1 Veteriner Hekimliği Fakültesi, Veteriner Klinik Bilimleri Bölümü, Iowa Eyalet Üniversitesi, Ames, IA, Amerika Birleşik Devletleri, |
| Editleyen: Mujeeb Ur Rehman, Hayvancılık ve Süt Ürünleri Geliştirme Departmanı, Pakistanİnceleyen: Naoki Miura, Kagoshima Üniversitesi, Japonya Jenna Hart Burton, Colorado Eyalet Üniversitesi, Amerika Birleşik Devletleri *İletişim: Uzmanlık Dalı: Sunum: 29 Kasım 2020 Atıfta bulunmak için: Coto GM, Musser ML, Tropf MA, Ward JL, Seo Y-J, Mochel JP and |
Aortic body tümörleri, özellikle kemodektomalar, köpek kardiyak tümörlerinin en yaygın ikinci türüdür; bununla birlikte, tedavisi hakkında bilgi eksikliği söz konusudur. Bu çalışma toceranib fosfat ile tedavi edilen aortic body kemodektoma ön tanısı veya kesin tanısı olan köpekleri içermektedir. Vakalar, Amerikan Veteriner İç Hastalıkları Fakültesi Kardiyoloji, İç Hastalıkları ve Onkoloji listservs’lerinden (ticari e-posta yönetim sistemi) elektronik bir anket aracılığıyla talep edilmiştir. Sağkalım süresini potansiyel olarak etkileyen faktörlerin Cox Regresyon Analizi yapılmıştır. Yirmi yedi (27) vaka analize dahil edilmiştir. Klinik fayda oranı (tam remisyon, kısmi remisyon veya >10 hafta stabil hastalık) %89’dur. Tek başına toceranib alanlar (n = 14) için 478 günlük ortalama sağkalım süresi tespit edilmiştir ve bu süre ek yöntemlerle tedavi edilenlerden (521 gün) istatistiksel olarak farklı çıkmamıştır. Değerlendirilen hiçbir faktör sonucu istatistiksel anlamda etkilememiştir. Köpek aortic body kemodektomalarının tedavisinde toceranib kullanımını değerlendirmek için ileriye dönük çalışmalar yapılması gerekmektedir. Anahtar Kelimeler: Palladia, kalp tabanı tümörü, köpek, kemoterapi, radyasyon, perikardiyektomi |
GİRİŞAortic body tümörleri, histopatolojik olarak teşhis edilen tüm köpek kardiyak tümörlerinin %8’ini oluşturmaktadır (1, 2). Aortic body tümörünün en yaygın tipi, çıkan aortanın (kalpten çıkan bölüm) kemoreseptör hücrelerinden kaynaklanan kemodektomadır (3). Kemodektomalar genellikle kalbin tabanında tek bir kitle olarak ortaya çıkar ve en sık aorta ile pulmoner arter, aorta ile sağ atriyum veya pulmoner arter ile sol atriyum arasında görülür (4, 5). Fonksiyonel olmayan ve genellikle lokal invaziv tümörlerdir ve %22’ye varan düşük metastatik eğilimleri vardır (2). Metastatik hastalığın en sık görüldüğü yerler bölgesel lenf nodları, miyokard, akciğerler, karaciğer, adrenal bezler ve beyindir (3, 6). Kemodektomalar genellikle yaşlı brakisefalik ırklarda görülür (1, 2, 6–9). Tümör patogenezinde kronik hipoksinin, genetiğin ve diğer faktörlerin rol oynadığı düşünülmektedir (2, 6, 9). Kemodektomalar genellikle görüntüleme veya nekropside tesadüfen rastlanan bir bulgudur, ancak çoğunlukla perikardiyal efüzyon ve ardından tamponad veya komşu kardiyak yapılara fiziksel basıya bağlı olarak çeşitli klinik belirtilerle ortaya çıkabilir (2). Kemodektomanın varsayımsal tanısı sıklıkla öykü, fizik muayene, toraks radyografileri ve ekokardiyogram bulgularına dayanarak konur. Anatomik olarak mümkün olduğunda kesin tanı için sitoloji için ince iğne aspiratları veya histopatoloji için doku biyopsisi alınabilir (10). |
Aortic body kemodektomalar için mevcut tedavi seçeneklerinin etkinliği hakkında yeterli veri bulunmamaktadır. Seçilmiş vakalarda değişik sonuçlar alınarak cerrahi rezeksiyon uygulanmıştır, ancak henüz kapsamlı bir şekilde incelenmemiştir (4, 11). Alternatif olarak, perikardiyal efüzyonun varlığına veya yokluğuna bakılmaksızın, kalp tabanı tümörü olan köpeklerde perikardiyektominin sağkalım sürelerini önemli ölçüde uzattığı ortaya konmuştur (7, 11). Aortic body tümörlerinin tedavisinde radyoterapinin faydası az sayıda vakada değerlendirilmiş, konformal veya stereotaktik radyoterapi klinik fayda sağlamış, ancak potansiyel olarak önemli yan etkiler konusunda endişe duyulmuştur (12, 13). Sitotoksik kemoterapinin faydasının sınırlı olduğu düşünülmekle birlikte, henüz tam olarak aydınlatılamamıştır (3). Toceranib fosfat (Palladia◎; Zoetis, Parsippany, New Jersey), varsayılan veya doğrulanmış aortic body tümörleri vakalarını tedavi etmek için anekdot olarak kullanılmıştır. Toceranib, 2009 yılında köpek mast hücre tümörlerinin tedavisi için FDA onayı almış bir reseptör tirozin kinaz inhibitörüdür (14). Çeşitli tirozin kinaz reseptörlerinin inhibisyonu, köpeklerdeki bir dizi solid tümörde hem antianjiyojenik etki hem de doğrudan antitümör etki ile sonuçlanmaktadır (15). Toceranib çeşitli tümör tiplerinde değerlendirilmiş olsa da, köpek aortic body tümörlerinde kullanımını destekleyen sadece yakın zamanda yayınlanmış retrospektif bir çalışma (16) ve bir vaka raporu bulunmaktadır (17). Bu çok kurumlu retrospektif çalışmanın birincil amacı, bu tümör tipi için kullanımını daha fazla desteklemek amacıyla, daha önce yayınlanmış literatürle karşılaştırıldığında, aortic body kemodektomaları olduğu varsayılan veya doğrulanmış köpek popülasyonunda toceranib’in klinik faydasını değerlendirmektir. İkincil amaç, ek tedavi yöntemlerinin (kemoterapi, radyoterapi, non-steroid anti-inflamatuar ilaçlar veya cerrahi gibi) tek ajan toceranibin klinik fayda oranı üzerindeki etkisini değerlendirmektir. |
MATERYALLER VE METOTVeri ToplamaÇok kurumlu retrospektif bir çalışma gerçekleştirilmiştir. Toceranib ile tedavi edilen şüpheli aortic body kemodektom vakaları, elektronik anket (REDCap, Vanderbilt Üniversitesi, Nashville, TN, ABD) kullanılarak Amerikan Veteriner İç Hastalıkları Akademisi (ACVIM) Kardiyoloji, İç Hastalıkları ve Onkoloji listservs aracılığıyla talep edilmiştir. Toceranib ile tedavi edilen ve yeterince takibi yapılan aortic body kemodektoma ön tanısı (daha önce açıklandığı gibi klinik ve görüntüleme bulgularının kombinasyonuna dayalı (13)) veya kesin tanısı (histopatoloji ve/veya sitoloji) olan köpekler çalışmaya dahil edilmeye uygun bulunmuştur. Toplanan veriler arasında hastanın özellikleri (yaş, cinsiyet, ırk), klinik bulgular, tanı yöntemi, metastatik hastalık olup olmadığı, tümörün yeri, en uzun çapta tümörün boyutu, tümör tarafından kompresyona maruz kaldığı belirtilen kardiyak yapılar, aritmi olup olmadığı ve türü, kaviter efüzyon(lar) olup olmadığı, toceranib dozu (mg/kg), tedavi programı ve süresi, alınan en iyi yanıt ve yan etkiler bulunmaktadır. Mevcut olduğunda, rapor edilen yan etkiler Veteriner Kooperatif Onkoloji Grubu Yan Etkiler için Ortak Terminoloji Kriterleri v1.1 kullanılarak derecelendirilmiştir (18). Toceranib ile tedaviden önce, katılımcı kurumun şartları uyarınca her hasta için bilgilendirilmiş müşteri onamı alınmıştır. Bu retrospektif çalışma için hayvan kullanımı denetimi veya başka herhangi bir etik onay gerekmemiştir. Retrospektif tasarım nedeniyle, evreleme ve takip aralıkları değişkenlik göstermiş ve ilgili klinisyenin takdirine bağlı olmuştur. Tedaviye en iyi yanıt Solid Tümörler için Yanıt Değerlendirme Kriterleri v1.1 kullanılarak bildirilmiş ve tam yanıt, kısmi yanıt, stabil hastalık veya progresif hastalık olarak kategorize edilmiştir (19). Toceranib’e klinik fayda tam yanıt, kısmi yanıt veya >10 hafta süreli stabil hastalık şeklinde tanımlanmıştır (15). Klinik fayda elde eden hastalar için genel progresyonsuz aralık, toceranib başlama tarihi ile progresif hastalığın belgelendiği tarih arasındaki süre hesaplanarak belirlenmiştir. Toceranib spesifik sağkalım, ilk toceranib dozundan ölüme veya son temas tarihine kadar Kaplan-Meier Hayatta Kalma Analizi kullanılarak hesaplanmıştır. Klinik bulguların veya efüzyonların iyileşmesi veya rezolüsyonu tedaviye yanıt değerlendirmesinin bir parçası değildi, çünkü klinik değerlendirme tedaviye yanıt için yanlış bir belirleyicidir (19). |
İstatiksel AnalizKaplan-Meier yöntemleri ve log-rank testleri dahil olmak üzere tek değişkenli analizler kullanılarak sağkalımla potansiyel olarak ilişkili olduğu düşünülen on ortak değişken değerlendirilmiştir. Modele dahil edilen değişkenler şunlardır: yaş, cinsiyet, ırk, kardiyak kompresyon olup olmadığı, aritmiler, perikardiyal efüzyon, plevral efüzyon, asit, metastatik hastalık ve tedavi. Çeşitli risk faktörleri ile toceranib’e özgü sağkalım süresi arasındaki ilişkiyi değerlendirmek için, en iyi alt kümeler değişken seçimi yöntemi kullanılarak Cox orantılı tehlikeler regresyon modeli oluşturulmuştur. Akaike ve Bayesian/Schwartz bilgi kriterleri (AIC, BIC veya SBC) daha sonra uygun bir model seçmek için kullanılmıştır. İstatistiksel analizler ticari yazılım olan SAS 9.4 (SAS Institute, Cary, NC, ABD) kullanılarak gerçekleştirilmiş ve sonuçlar p < 0.05 olduğunda istatistiksel olarak anlamlı kabul edilmiştir. |
SONUÇLARÇalışma GrubuYirmi sekiz (28) vaka ACVIM listervs aracılığıyla 12 kurumdan 5 yıl boyunca (2013-2018) toplanmıştır. Bir vaka, takip bilgilerinin eksik olması nedeniyle değerlendirme dışı bırakılmıştır. Dolikosefalik ırklar yaygındı; bunların arasında melez ırklar, Pitbull kırmaları ve Retrieverlar (her birinden n = 3 adet), Huskyler ve Yorkshire Terrierler (her birinden n = 2 adet) ve Bichon Frise, Coonhound, Jack Russell ve Schnauzer ırklarından birer adet vardı. Boston Terrier (n = 6), Boxer (n = 2) ve Fransız Bulldog (n = 2) olmak üzere on hasta brakisefal olarak değerlendirilmiştir. Bir kısırlaştırılmamış erkek, 13 kısırlaştırılmış erkek ve 13 kısırlaştırılmış dişi değerlendirilmiştir. Tanı konulduğunda ortalama yaş 10 idi (aralık: 4-12 yıl). Dokuz köpek (%33) letarji, kilo kaybı ve gastrointestinal belirtiler gibi spesifik olmayan belirtilerle başvurmuştur. Dört köpek (%15) yeni gelişen öksürük, üç köpek egzersiz intoleransı (%11), iki köpek senkop (%7), iki köpek yeni gelişen kalp üfürümü veya aritmi (%7), bir köpek kraniyal vena kava sendromu, bir köpek büyük bir servikal kitle, bir köpek solunum hızı ve eforunda artış ve bir köpek de yutma güçlüğü nedeniyle getirilmiştir. Üç köpek (%11) muayene sırasında klinik bulgulara sahip değildi. Yirmi bir köpekte (%78) ırka yatkınlık ve görüntülemeye (ekokardiyogram veya BT) dayalı olarak aortic body kemodektoma ön tanısı vardı. Altı köpekte (%22) histoloji ve/veya sitoloji yoluyla kemodektomanın kesin antemortem tanısı konmuştur. 27 köpeğin 11’inde (%41) tanı sırasında perikardiyal efüzyon mevcuttu. Vakaların 4/11’inde (%36) kardiyak tamponad mevcuttu. Perikardiyal efüzyonu olan 11 köpekten beşinde aynı zamanda plevral efüzyon ve asit, birinde ise sadece plevral efüzyon vardı. Beş köpekte (%18) perikardiyal efüzyon olmaksızın plevral efüzyon bulunurken 11 hastada (%41) efüzyon yoktu. Beş köpekte (%18) ventriküler ektopi (n = 3), supraventriküler ektopi (n = 1) ve sınıflandırılmamış bir aritmi dahil olmak üzere elektrokardiyografi ile belgelenmiş bir aritmi vardı. Aortik vücut kütlesi ölçümleri ve konumu on üç köpekte (%52) yalnızca ekokardiyogram, iki köpekte (%7) torasik bilgisayarlı tomografi (BT) veya bir köpekte göğüs radyografileri ile değerlendirilmiştir. Geri kalan 11 köpekte tanısal görüntüleme yöntemlerinin bir kombinasyonu uygulandı. Aortic body tümör boyutu 24 hastada kaydedilmiştir. Tüm ölçüm yöntemleri kullanılarak tüm hasta grubu için ortalama en uzun çap 5,4 cm (aralık: 1,8-12 cm) idi. İki hastada tümör boyutu hem ekokardiyogram hem de BT ile ölçüldü (sırasıyla 5,5 ve 4 cm ve 6,4 ve 5,2 cm). Kitle en sık aort ve pulmoner arter arasında (10/27, %37) yer almaktaydı, ancak sol atriyum ve aort arasında da (4/27, %15), her iki lokasyonda da (4/27, %15), diğer çeşitli lokasyonlarda (8/27, %30) kitleler rapor edildi ve bir vakada tümör lokasyonu bildirilmedi. Yirmi dört köpekte kardiyak yapı kompresyonunun değerlendirilmesine olanak tanıyan ekokardiyogram yapılmıştır. Bu köpeklerin on dördünde (%58) kardiyak bası olduğu kaydedilmiştir. En yaygın bası bölgeleri pulmoner arter (n = 5), sol atriyum (n = 3) ve sağ atriyum (n = 1) idi. Yirmi dört köpekten ikisinde diğer veya belirtilmemiş kardiyak yapıların sıkıştığı, üçünde ise kardiyak yapıların bir arada sıkıştığı görülmüştür. Yirmi altı köpek tanı sırasında veya tedavi sırasında tek bir görüntüleme yöntemi veya torasik radyografiler (n = 22), abdominal ultrason (n = 10) ve BT (n = 12) kombinasyonu ile metastatik hastalık açısından değerlendirilmiştir. Bu köpeklerin onunda (%38) metastatik hastalık kanıtı mevcut olup en yaygın bölgeler akciğerler (n = 6) ve bölgesel lenf düğümleridir (n = 4). Diğer metastatik bölgeler arasında dalak, karaciğer, böbrek ve pankreas yer almaktadır. |
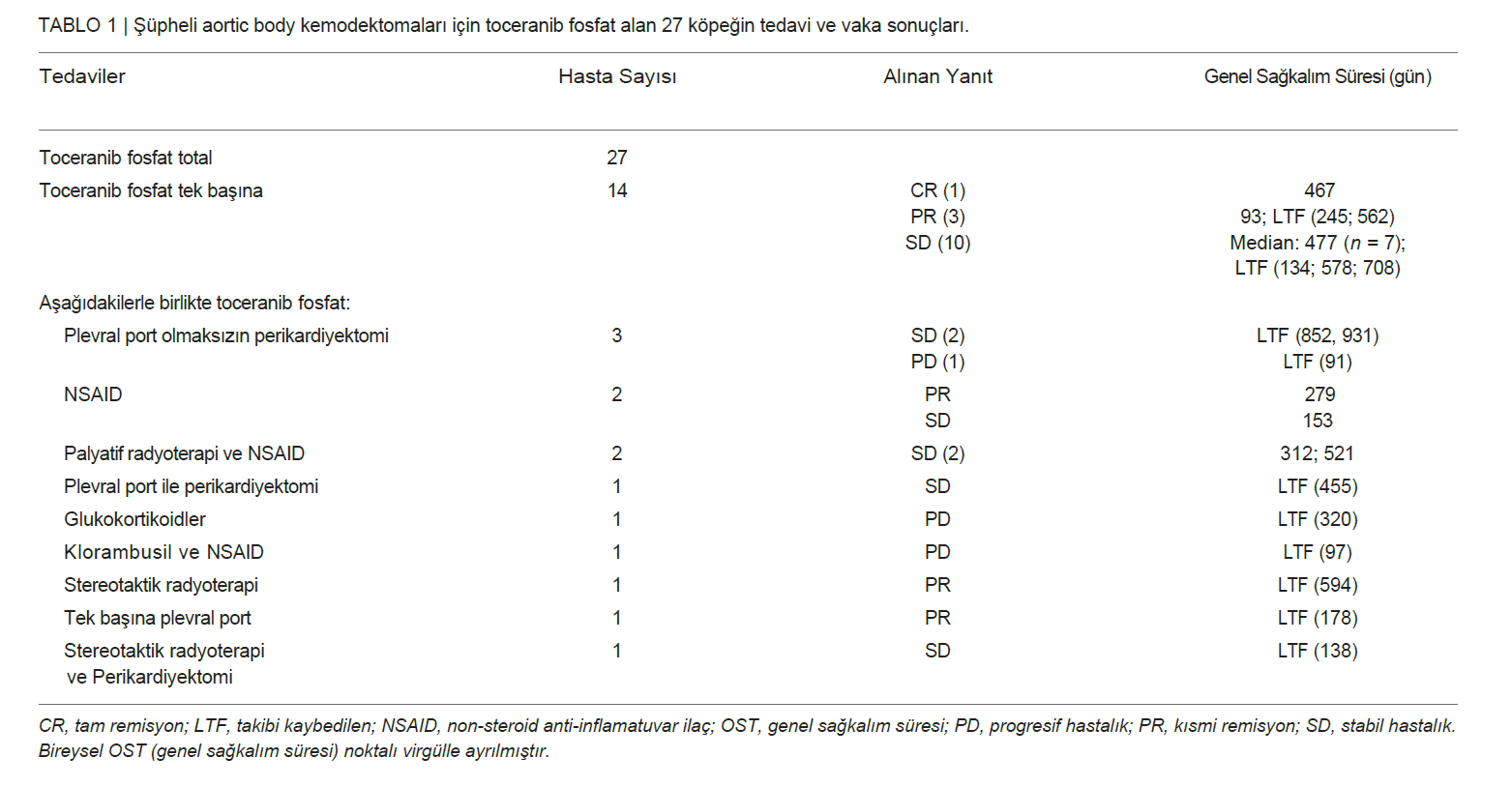
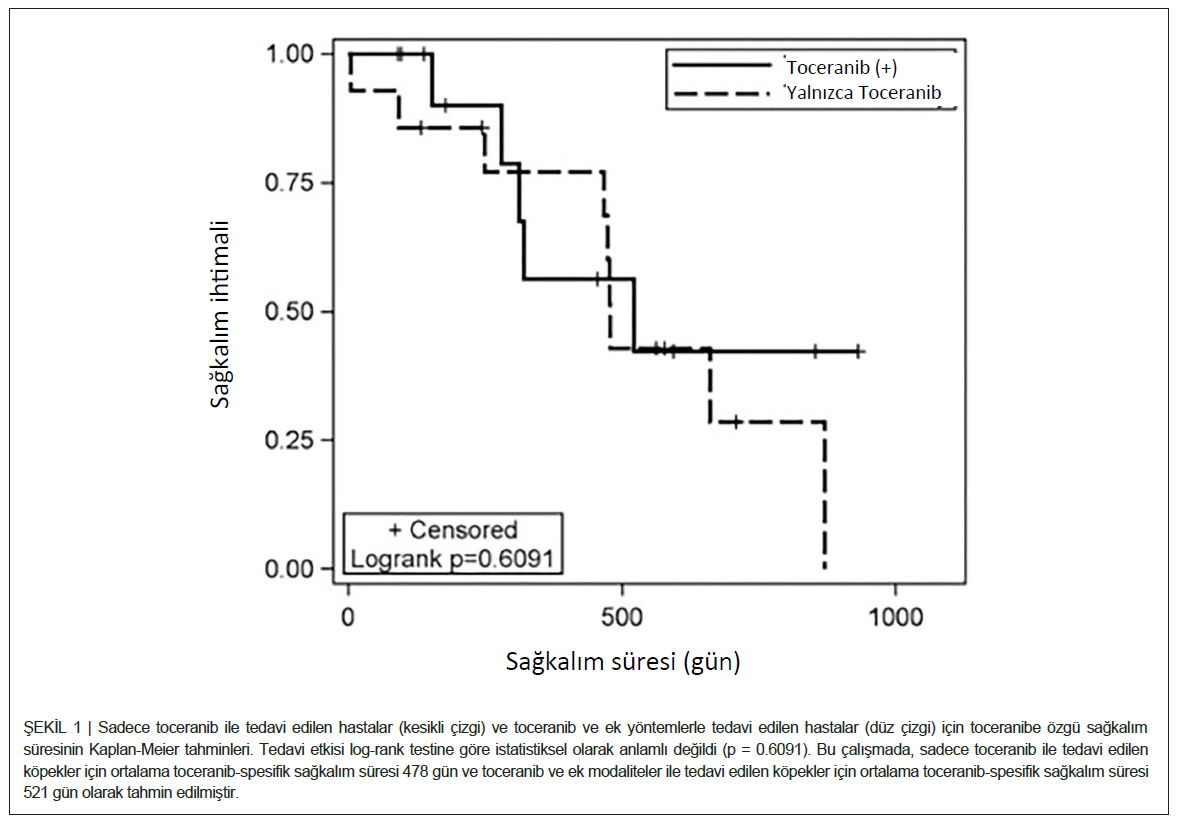
Toceranib Fosfat TedavisiToceranib oral yoldan ortalama 2,55 mg/kg (aralık: 2,30-3,17 mg/kg) dozunda uygulanmıştır. Toceranib doz sıklığı bildirilen köpeklerden (26/27) 15’i haftada üç kez toceranib alırken, diğer 11 köpek her gün (her 48 saatte bir) toceranib almıştır. Tanı ile toceranib tedavisinin başlaması arasında geçen süre değişiklik göstermiştir (ortalama 16, aralık: 0-608 gün). 27 hastanın tamamı rezeke edilemeyen gross hastalık için tedavi edilmiştir. On dört köpek (%52) tek bir ajan olarak toceranib alırken (efüzyonlu 11 köpek dahil), kalan 13 köpek Tablo 1′de belirtildiği gibi ek tedavi almıştır. Toceranib alan tüm köpekler yanıt açısından değerlendirilmiştir. Bu köpeklerden dokuzu belirgin metastatik hastalıkla başvurmuş, birinde tedaviye başladıktan sonra metastatik hastalık gelişmiştir. Yirmi dört (%89) tam yanıt (n = 1), kısmi yanıt (n = 6) ve stabil hastalık (n = 17) dahil olmak üzere klinik fayda elde edilmiştir. Kalan üç köpekte ilerleyici hastalık vardı. Toceranib alan ve klinik fayda gören köpeklerden 14’ü (bir tam yanıt, üç kısmi yanıt, 10 stabil hastalık) tek başına toceranib almıştır. Kalan 10 köpek Tablo 1‘de özetlendiği gibi bir dizi tedavi kombinasyonu almıştır. Toceranib tedavisi ile klinik fayda elde eden 24 köpekten 15’inin tıbbi kayıtları progresyonsuz aralığın değerlendirilmesine izin verecek şekilde eksiksizdi. Bu köpeklerin ortalama progresyonsuz aralığı 240 gündü (aralık: 93-584). Yalnızca toceranib alanlar (n = 14) için ortalama toceranib-spesifik sağkalım süresi 478 gündü (aralık: 5-870 gün). Toceranib ve herhangi bir ek tedavi alanlar (n = 13) için ortalama toceranib-spesifik genel sağkalım süresi 521 gündü (aralık: 91-931 gün). Bu süre istatistiksel olarak farklı bulunmamıştır (Şekil 1). Toceranib alan ve tam yanıt elde eden bir köpek veri toplama sırasında ölmüştür ve toceranibe özgü genel sağkalım süresi 468 gündü (Tablo 1). Kesin tanı konulan altı köpeğin sağkalım süresi 402-662 gün arasında değişirken, bir köpek 455 günde takipten çıkmıştır. Cox regresyon analizi, değerlendirilen 10 karıştırıcı faktörden hiçbirinin ölüm riskini etkilemediğini ortaya koymuştur. Bir köpekte nekropsi yapılmış ve kemodektoma ön tanısı doğrulanmıştır. |
Toceranib Yan EtkileriToceranib alan 27 köpeğin 17’sinde (%63) 33 yan etki bildirilmiştir. Bildirilen yan etkiler, köpeklerde toceranib kullanımına ilişkin önceki çalışmalardan elde edilen raporlarla tutarlıydı ve en yaygın olanı ishaldi (n = 8 hasta) (14, 20, 21). Diğer yaygın yan etkiler iştah azalması (n = 6 hasta), kilo kaybı (n = 3 hasta) ve letarji (n = 3 hasta) olmuştur. Bir tek grade iki hipertansiyon vakası vardı ve bu vaka enalapril ile tedaviye başladıktan sonra düzeldi. Toksisitelerin büyük çoğunluğu düşük grade’li olmasına rağmen, üç adet grade üç yan etki bildirilmiştir (bir bulantı ve iki ishal). Ayrıca, yan etki görülen 17 köpekten dokuzunda (%53) doz ayarlaması yapılması gerekmiştir (uygulanan miligramın azaltılması; her gün uygulanan dozun Pazartesi, Çarşamba, Cuma günlerine değiştirilmesi veya her ikisinin birden yapılması, ilgili klinisyenin takdirine bağlı olarak). Doz ayarlamasını tetikleyen yan etkiler arasında genel gastrointestinal belirtiler (iştahsızlık, ishal), kilo kaybı, grade I nötropeni, grade I azotemi ve grade II karaciğer enzimlerinde (alkalin fosfataz ve alanin aminotransferaz) yükselmeler yer almıştır. |
TARTIŞMAKöpek aortic body kemodektomalarının teşhis edilmesi zordur ve bilinen etkili tedavi seçenekleri sınırlıdır. Toceranib, split kinaz ailesindeki bir dizi tirozin kinaz reseptörünü rekabetçi bir şekilde inhibe eden küçük moleküler ağırlıklı bir tirozin kinaz inhibitörüdür (15, 22, 23). İnhibisyon, köpeklerdeki bir dizi solid tümörde hem antianjiyojenik etki (vasküler endotelyal büyüme faktörü reseptörü [VEGFR] ve platelet kaynaklı büyüme faktörü reseptörü [PDGFR] gibi reseptörlerin inhibisyonu yoluyla) hem de doğrudan antitümör etki (c-Kit ve transfeksiyon sırasında yeniden düzenlenmiş kinaz [RET] gibi reseptörlerin inhibisyonu yoluyla) ile sonuçlanır (15, 22, 23). Yakın zamanda, toceranib ile tedavi edilen aortic body kemodektomalı 28 köpekten oluşan retrospektif bir vaka serisi yayınlanmıştır (16). Genel sağkalım süresi 823 gün (aralık: 68-1190) olarak bildirilmiştir. Bu rakam, mevcut çalışmada sadece toceranib ile tedavi edilen köpekler için bulunan 478 günlük genel sağkalım süresine kıyasla sayısal olarak daha uzundur. Bu fark birkaç faktörle ilişkili olabilir. Genel olarak, kalp tabanı kitleleri yavaş büyür (16), bu nedenle, mevcut hasta popülasyonu hastalığın doğal seyrinde daha geç teşhis edilirse, sağkalım süreleri, erken teşhisten sağlanan zaman yanlılığı nedeniyle hatalı bir şekilde kısalacaktır. Ne yazık ki, her bir tümörün tam olarak ne zaman gelişmeye başladığını belirlemek mümkün değildir. Mevcut popülasyondaki ortalama aortic body tümör boyutu 5,4 cm’dir ve bu da ilerlemiş hastalığa işaret edebilecek önemli bir boyuttur. Önceki çalışmada ortalama tümör boyutu bildirilmediğinden karşılaştırma yapmak mümkün değildir. Metastatik hastalığın varlığı da daha ilerlemiş hastalığın göstergesidir. Mevcut popülasyonda, dokuz köpekte (%32) tanı sırasında metastatik hastalık mevcuttu ve bir köpekte daha tedavi sırasında metastatik hastalık gelişti. Tarihsel olarak, metastatik oranın düşük olduğu düşünülmektedir (≤%22). Önceki çalışmada başvuru sırasındaki metastatik oran %29 idi. Toceranib başlandıktan sonra metastatik hastalık gelişimine ilişkin veri mevcut değildir (16). Bu nedenle, tümör boyutu ve metastatik hastalığa dayalı olarak, mevcut köpek popülasyonunun tedavi başladığında daha ilerlemiş hastalığa sahip olması ve bunun da daha kısa bir genel sağkalım süresine yol açması muhtemeldir. Ayrıca, ortalama sağkalım süreleri farklı hesaplanmış gibi göründüğünden, iki çalışma popülasyonu arasında ortalama sağkalım süresi açısından doğrudan karşılaştırma yapmak zordur. Mevcut çalışmada, ortalama sağkalım süresi toceranib tedavisinin başlangıcından ölüme veya takip kaybedilene kadar geçen süre için hesaplanmıştır. Önceki çalışmada, bu hesaplama için kullanılan yöntemlerin farklı olduğu ve tanı anında başlamış olabileceği görülmektedir (16). Bu çalışmaya benzer şekilde, bir önceki çalışmada da metastazın toceranibe yanıtı olumsuz etkilemediği bulunmuştur (16). Ayrıca, metastazdan bağımsız olarak, her iki çalışmada da toceranib ile tedavi edilen hastaların %80-90’ı için klinik fayda bulunmuştur. Doğrulanmış aortic body kemodektoması olan bir köpekte toceranib kullanımını tanımlayan ek bir vaka raporu yayınlanmıştır (17). Hasta 9 ay boyunca toceranib almış ve bu süre boyunca hem klinik hem de radyografik iyileşme göstermiştir. Hasta 10 aylık bir progresyonsuz aralık yaşamış, tedavinin kesilmesinden 1 ay sonra belgelenmiş hastalık progresyonu nedeniyle tekrarlayan sağ taraflı konjestif kalp yetmezliği belirtileri ile başvurmuştur (17). Bu çalışma önceki raporlarla tutarlıdır ve toceranibin ilerlemiş hastalıkta bile klinik fayda sağlayabileceğini ortaya koymaktadır. Köpeklerdeki kemodektomalara biyolojik olarak benzeyen insanlardaki karotis cisim paragangliomalarının (5, 6) sıklıkla VEGFR1, VEGFR2, PDGFRα ve PDGFRβ’yı aşırı eksprese ettiği ve sunitinib gibi tirozin kinaz reseptör inhibitörleriyle tedavi için potansiyel hedefler haline geldiği gösterilmiştir (24). Paragangliomalı hastalarda sunitinib kullanımını değerlendiren klinik çalışmalar en az %47 oranında klinik yanıt bildirmiştir (25). Ayrıca, malign paragangliomalı insan hastaların yaklaşık %50’sinin süksinat dehidrojenaz alt ünite B geninde kalıtsal bir germ hattı mutasyonu taşıdığı tespit edilmiştir, bu da bu hastaları sunitinib ile tedaviye özellikle duyarlı hale getirmektedir (26). Aortic body kemodektomalı köpeklerin bu reseptörleri aşırı eksprese edip etmediği veya bu mutasyonları barındırıp barındırmadığı bilinmemekle birlikte, bir çalışmada paragangliomalı bir köpekte süksinat dehidrojenaz alt ünite D gen mutasyonu bulunmuştur (27), bu da toceranib veya benzer küçük molekül inhibitörlerinin köpek kemodektomaları için etkili bir tedavi sağlayabileceğini düşündürmektedir. Çalışmanın kısıtlamaları arasında heterojen klinik hasta popülasyonu, küçük örneklem büyüklüğü, takip protokolü standardizasyonunun olmaması, çoğu vakada kesin tanı olmaması, patolojik olarak doğrulanmış metastatik hastalık olmaması ve çoğu vakada tam nekropsi yapılmaması nedeniyle ölüm nedeninin varsayılması retrospektif bir çalışmanın doğasında olan kısıtlamalar yer almaktadır. Bu çalışmada kemodektomanın varsayımsal tanısı, daha önce tanımlandığı gibi hastanın özellikleri (brakisefalik ırk) ve/veya kitlenin ekokardiyografik konumunun (kalp tabanı bölgesinde) birlikte değerlendirilmesine dayanmaktadır (13). Kardiyak kitle lezyonlarını tespit etmek için ekokardiyografinin duyarlılığı genellikle iyidir (%82’ye kadar) (28–30). Yakın zamanda yapılan retrospektif bir çalışmada, kalp tabanı tümörü olan hastalarda, kemodektoma, ektopik tiroid karsinomu veya lenfoma varsayımsal ekokardiyografik tanısının %78 oranında doğru olduğu ve vakaların diğer %22’sinin sonuçta farklılaşmamış karsinom olarak teşhis edildiği görülmüştür (31). Bu nedenle, mevcut popülasyondaki bazı hastalara hatalı tanı konmuş olması, çalışma sonuçlarını etkilemesi ve tedaviye başlamadan önce sitoloji veya histopatoloji yoluyla kesin tanı almanın önemini ön plana çıkartmıştır. Kesin kemodektoma teşhisi konulan köpekler ile varsayımsal olarak teşhis konulan köpekler arasında sağkalım karşılaştırması ideal olsa da, vaka sayısının az olması istatistiksel değerlendirme yapılmasını engellemiştir. Toceranib, tiroid karsinomu ve hemanjiosarkom dahil olmak üzere diğer kalp tabanı tümörlerinin tedavisi için değerlendirildiğinden, bu konu potansiyel olarak önemlidir. Toceranib’in köpek tiroid karsinomu için klinik fayda sağladığı ve bu çalışmadakine benzer bir sağkalım süresi (563 gün) sağladığı görülmüştür (15, 32). Bununla birlikte, toceranib köpek dalak hemanjiosarkomu için klinik fayda sağlamamıştır (22, 33); kardiyak hemanjiosarkomun da benzer olacağı tahmin edilmektedir. Kardiyak hemanjiosarkomlu köpeklerin genel sağkalım süresi, mevcut çalışmada bildirilen sağkalım süresine kıyasla önemli ölçüde daha kısadır (tedavisiz 7,1 gün, sadece cerrahi ile 42 gün) (3). Dolayısıyla, toceranib’e yanıt veren bir yanlış tanının burada açıklanan bulgular üzerindeki etkisi muhtemelen küçük olacaktır, ancak kabul edilmelidir. Bu kısıtlamalara rağmen bu çalışma, varsayımsal olarak tanı konmuş kemodektomalar için toceranibin bir tedavi seçeneği olarak kullanılabileceğini desteklemektedir. Toceranib iyi tolere edilmiş ve hastaların %89’una klinik fayda sağlamıştır. Kemodektomalı olduğu varsayılan köpeklerde toceranibin iki retrospektif değerlendirmesinin benzer bulgular bildirmesi, kontrollü prospektif çalışmalarda daha fazla değerlendirme yapılmasına yönelik argümanı güçlendirmektedir ve kemodektoması doğrulanmış köpeklerde toceranibin klinik faydasını tam olarak değerlendirmek için gereklidir. |
VERİ ERİŞİM BEYANIBu makalenin sonuçlarını destekleyen ham veriler, yazarlar tarafından herhangi bir çekince olmaksızın sunulacaktır. ETİK BEYANRetrospektif bir çalışma olduğu için hayvan çalışması için etik inceleme ve onay gerekmemiştir. Toceranib ile tedaviden önce, katılımcı kurumun şartları uyarınca her hasta için bilgilendirilmiş müşteri onamı alınmıştır. KATKIDA BULUNAN YAZARLARGC ve MM, doğru veri toplanması için MT, JW ve CJ’nin katkılarıyla dijital anketi hazırlamıştır. Veriler GC, MM, MT, JW, Y-JS, JM ve CJ tarafından gözden geçirilmiş ve tanımlayıcı istatistikler hazırlanmıştır. Tam istatistiksel analiz Y-JS ve JM tarafından tamamlanmıştır. Makale hazırlığı GC ve MM tarafından tamamlanmış ve tüm yazarlar tarafından gözden geçirilmiştir. TEŞEKKÜRLERYazarlar, bu makalenin hazırlanmasında kullanılan vakalara katkıda bulunmak için zaman ve çaba harcayan tüm iç hastalıkları, onkoloji ve kardiyoloji uzmanlarına en içten teşekkürlerini sunmaktadır. Bu kişiler aşağıdaki kurumlardan katılmışlardır: Auburn Üniversitesi; Azabu Üniversitesi; Beacon Veteriner Uzmanları, Fremont, CA; BluePearl Evcil Hayvan Hastanesi, Rockville, MD; BluePearl Evcil Hayvan Hastanesi, Queens, NY; Kuzey Carolina Eyalet Üniversitesi; Oregon Eyalet Üniversitesi; Ottawa Evcil Hayvan Acil Yardım ve Uzmanlık Hastanesi; Evcil Hayvan Acil Yardım ve Uzmanlık Merkezi, La Mesa, CA; Minnesota Üniversitesi; Wisconsin Üniversitesi; VCA İhtisas Grubu, San Diego, CA; VCA Veteriner Sevk ve Acil Yardım Merkezi, Norwalk, CT; Veteriner Kanser Merkezi, Norwalk, CT. |
| KAYNAKÇA 1. Ware WA, Hopper DL. Cardiac tumors in dogs: 1982-1995. J Vet Intern Med. (1999) 13:95–103. doi: 10.1111/j.1939-1676.1999.tb01136.x 2. Withrow SJ, Vail DM, Page RL. Withrow & MacEwen’s Small Animal Clinical Oncology. 5th ed. St. Louis, Missouri: Elsevier (2013). p. 750. 3. Treggiari E, Pedro B, Dukes-McEwan J, Gelzer AR, Blackwood L. A descriptive review of cardiac tumours in dogs and cats. Vet Comp Oncol. (2017) 15:273–88. doi: 10.1111/vco.12167 4. Fossum TW. Surgery of the cardiovascular system. In: Small Animal Surgery. 4th ed. St. Louis, Mo.: Elsevier Mosby (2013). p. 896–8. 5. Galac S, Korpershoek E. Pheochromocytomas and paragangliomas in humans and dogs. Vet Comp Oncol. (2017) 15:1158–70. doi: 10.1111/vco.12291 6. Patnaik AK, Liu SK, Hurvitz AI, McClelland AJ. Canine chemodectoma (extra-adrenal paragangliomas)–a comparative study. J Small Anim Pract. (1975) 16:785–801. doi: 10.1111/j.1748-5827.1975.tb05813.x 7. Vicari ED, Brown DC, Holt DE, Brockman DJ. Survival times of and prognostic indicators for dogs with heart base masses: 25 cases (1986-1999). J Am Vet Med Assoc. (2001) 219:485–7. doi: 10.2460/javma.2001.219.485 8. Noszczyk-Nowak A, Nowak M, Paslawska U, Atamaniuk W, Nicpon J. Cases with manifestation of chemodectoma diagnosed in dogs in Department of Internal Diseases with Horses, Dogs and Cats Clinic, Veterinary Medicine Faculty, University of Environmental and Life Sciences, Wroclaw, Poland. Acta Vet Scand. (2010) 52:35. doi: 10.1186/1751-0147-52-35 9. Hayes HM. An hypothesis for the aetiology of canine chemoreceptor system neoplasms, based upon an epidemiological study of 73 cases among hospital patients. J Small Anim Pract. (1975) 16:337–43. doi: 10.1111/j.1748-5827.1975.tb05751.x 10. Pedro B, Linney C, Navarro-Cubas X, Stephenson H, Dukes-McEwan J, Gelzer AR, et al. Cytological diagnosis of cardiac masses with ultrasound guided fine needle aspirates. J Vet Cardiol. (2016) 18:47–56. doi: 10.1016/j.jvc.2015.0 9.002 11. Ehrhart N, Ehrhart EJ, Willis J, Sisson D, Constable P, Greenfield C, et al. Analysis of factors affecting survival in dogs with aortic body tumors. Vet Surg. (2002) 31:44–8. doi: 10.1053/jvet.2002.29989 12. Rancilio NJ, Higuchi T, Gagnon J, McNiel EA. Use of three-dimensional conformal radiation therapy for treatment of a heart base chemodectoma in a dog. J Am Vet Med Assoc. (2012) 241:472–6. doi: 10.2460/javma.241.4.472 13. Magestro LM, Gieger TL, Nolan MW. Stereotactic body radiation therapy for heart-base tumors in six dogs. J Vet Cardiol. (2018) 20:186–97. doi: 10.1016/j.jvc.2018.04.001 14. London CA, Malpas PB, Wood-Follis SL, Boucher JF, Rusk AW, Rosenberg MP, et al. Multi-center, placebo-controlled, double-blind, randomized study of oral toceranib phosphate (SU11654), a receptor tyrosine kinase inhibitor, for the treatment of dogs with recurrent (either local or distant) mast cell tumor following surgical excision. Clin Cancer Res. (2009) 15:3856–65. doi: 10.1158/1078-0432.CCR-08-1860 15. London C, Mathie T, Stingle N, Clifford C, Haney S, Klein MK, et al. Preliminary evidence for biologic activity of toceranib phosphate (Palladia⃝R ) in solid tumours. Vet Comp Oncol. (2012) 10:194–205. doi: 10.1111/j.1476-5829.2011.00275.x 16. Lew FH, McQuown B, Borrego J, Cunningham S, Burgess KE. Retrospective evaluation of canine heart base tumors treated with toceranib phosphate (Palladia⃝R ): 2011–2018. Vet Comp Oncol. (2019) 17:465–71. doi: 10.1111/vco.12491 17. Shin HR, Kim JS, Kim SM, Song KH, Seo KW. Metronomic chemotherapy with toceranib phosphate for treatment of a chemodectoma in a dog. J Vet Clin. (2017) 34:43–6. doi: 10.17555/jvc.2017.02.34.1.43 18. Veterinary Cooperative Oncology Group – common terminology criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Vet Comp Oncol. (2016) 14:417–46. doi: 10.1111/vco.283 19. Nguyen SM, Thamm DH, Vail DM, London CA. Response evaluation criteria for solid tumours in dogs (v1.0): a Veterinary Cooperative Oncology Group (VCOG) consensus document. Vet Comp Oncol. (2015) 13:176–83. doi: 10.1111/vco.12032 20. Berger EP, Johannes CM, Jergens AE, Allenspach K, Powers BE, Du Y, et al. Retrospective evaluation of toceranib phosphate (Palladia⃝R ) use in the treatment of gastrointestinal stromal tumors of dogs. J Vet Intern Med. (2018) 32:2045–53. doi: 10.1111/jvim.15335 21. Bernabe LF, Portela R, Nguyen S, Kisseberth WC, Pennell M, Yancey MF, et al. Evaluation of the adverse event profile and pharmacodynamics of toceranib phosphate administered to dogs with solid tumors at doses below the maximum tolerated dose. BMC Vet Res. (2013) 9:190. doi: 10.1186/1746-6148-9-190 22. London CA, Hannah AL, Zadovoskaya R, Chien MB, Kollias-Baker C, Rosenberg M, et al. Phase I dose-escalating study of SU11654, a small molecule receptor tyrosine kinase inhibitor, in dogs with spontaneous malignancies. Clin Cancer Res. (2003) 9:2755–68. 23. Zoetis. Palladia (package insert). Kalamazoo, MI: Zoetis Inc. (2015). 24. Cassol CA, Winer D, Liu W, Guo M, Ezzat S, Asa SL. Tyrosine kinase receptors as molecular targets in pheochromocytomas and paragangliomas. Mod Pathol. (2014) 27:1050–62. doi: 10.1038/modpathol. 2013.233 25. Ayala-Ramirez M, Chougnet CN, Habra MA, Palmer JL, Leboulleux S, Cabanillas ME, et al. Treatment with sunitinib for patients with progressive metastatic pheochromocytomas and sympathetic paragangliomas. J Clin Endocrinol Metab. (2012) 97:4040–50. doi: 10.1210/jc.2012-2356 26. Jimenez C, Rohren E, Habra MA, Rich T, Jimenez P, Ayala- Ramirez M, et al. Current and future treatments for malignant pheochromocytoma and sympathetic paraganglioma. Curr Oncol Rep. (2013) 15:356–71. doi: 10.1007/s11912-013-0320-x 27. Holt DE, Henthorn P, Howell VM, Robinson BG, Benn DE. Succinate dehydrogenase subunit D and succinate dehydrogenase subunit B mutation analysis in canine phaeochromocytoma and paraganglioma. J Comp Pathol. (2014) 151:25–34. doi: 10.1016/j.jcpa.2014.03.007 28. MacDonald KA, Cagney O, Magne ML. Echocardiographic and clinicopathologic characterization of pericardial effusion in dogs: 107 cases (1985–2006). J Am Vet Med Assoc. (2009) 235:1456–61. doi: 10.2460/javma.235.12.1456 29. Fruchter AM, Miller CW, O’Grady MR. Echocardiographic results and clinical considerations in dogs with right atrial/auricular masses. Can Vet J. (1992) 33:171–4. 30. Berg RJ WW. Pericardial effusion in the dog: a review of 42 cases. J Am Anim Hosp Assoc. (1984) 20:721–30. 31. Rajagopalan V, Jesty SA, Craig LE, Gompf R. Comparison of presumptive echocardiographic and definitive diagnoses of cardiac tumors in dogs. J Vet Intern Med. (2013) 27:1092–6. doi: 10.1111/jvim.1 2134 32. Sheppard-Olivares S, Bello NM, Wood E, Szivek A, Biller B, Hocker S, et al. Toceranib phosphate in the treatment of canine thyroid carcinoma: 42 cases (2009-2018). Vet Comp Oncol. (2020) 18:519–527. doi: 10.1111/vco.12571 33. Gardner HL, London CA, Portela RA, Nguyen S, Rosenberg MP, Klein MK, et al. Maintenance therapy with toceranib following doxorubicin-based chemotherapy for canine splenic hemangiosarcoma. BMC Vet Res. (2015) 11:131. doi: 10.1186/s12917-015-0446-1 |
| Çıkar çatışması beyanı: CJ, Pfizer Animal Health’in eski bir çalışanıdır. Diğer yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişki olmaksızın yürütüldüğünü beyan etmiştir. Telif Hakkı © 2021 Coto, Musser, Tropf, Ward, Seo, Mochel ve Johannes. Bu makale Creative Commons Attribution License (CC BY) koşulları altında dağıtılan açık erişimli bir makaledir. Orijinal yazar(lar)a ve telif hakkı sahip(ler)ine atıfta bulunulması ve bu dergideki orijinal yayına atıfta bulunulması koşuluyla, kabul edilmiş akademik uygulamalara göre, diğer forumlarda kullanılmasına, dağıtılmasına veya çoğaltılmasına izin verilir. Bu şartlara uymayan hiçbir kullanım, dağıtım veya çoğaltmaya izin verilmez. |