Kedi Tıbbı ve Cerrahisi Dergisi 1–8 © Yazar(lar) 2020
Makalenin yeniden
kullanımına ilişkin kurallar: sagepub.com/journals-permissions DOI: 10.1177/1098612X20964416 journals.sagepub.com/home/jfm
Bu makale Kedi Tıbbı ve Cerrahisi Dergisi’nde yayınlanmak üzere Avrupa Yazı İşleri Bürosu (Uluslararası Kedi Tıbbı Derneği) tarafından incelenmiş ve işleme tabi tutulmuştur.
Özet
Amaç Kedi Meme Karsinomaları (KMK) oldukça metastatiktir. Buna rağmen, ileri evredeki tümörlerle ilgili literatür ve tedavi seçenekleri nispeten azdır. Bu çalışmanın amacı, adjuvan tedavi uygulanarak ya da uygulanmadan, metastatik KMK’nin klinik sonucunu araştırmaktır.
Amaç Kedi Meme Karsinomaları (KMK) oldukça metastatiktir. Buna rağmen, ileri evredeki tümörlerle ilgili literatür ve tedavi seçenekleri nispeten azdır. Bu çalışmanın amacı, adjuvan tedavi uygulanarak ya da uygulanmadan, metastatik KMK’nin klinik sonucunu araştırmaktır.
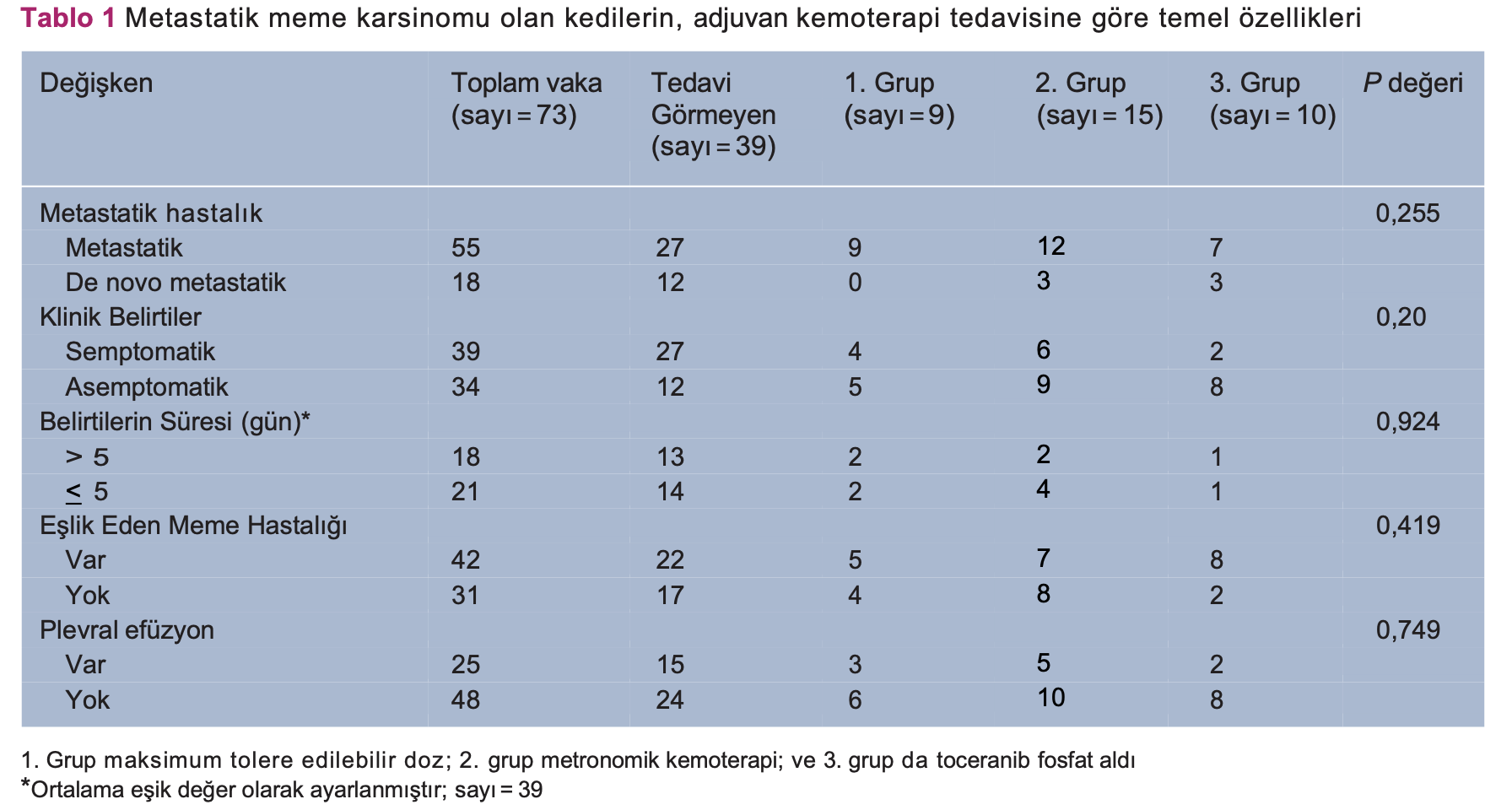
Yöntem Metastatik KMK (4. evre) teşhisli 73 kedinin tıbbi kayıtları incelenerek bu çalışmaya dahil edilmiştir. Metastatik hastalığın teşhisinde çeşitli görüntüleme teknikleri (röntgen, ultrason ve BT) kullanıldı ve bu teşhis sitoloji ve/veya histopatoloji yardımıyla da doğrulandı. Adjuvan kemoterapi tedavisi gören kediler (sayı = 34 kedi) üç gruba bölündü: 1. grup (sayı = 9 kedi) maksimum tolere edilebilir doz alan kediler; 2. grup (sayı = 15) metronomik kemoterapi alan kediler ve 3. Grup da (sayı = 10) toceranib fosfat tedavisi gören kedilerden oluşmaktaydı. Çalışmanın sonlanım noktaları; progresyona kadar geçen süre (PKGS) ve tümöre özgü sağkalım (TÖS) süreleriydi. Tedaviye bağlı toksisite, Kooperatif Veteriner Onkoloji Grubu’na ait Advers Olaylar için Ortak Terminoloji Kriterleri sürüm 1.1’e (KVOG-AOOTK) göre değerlendirildi.
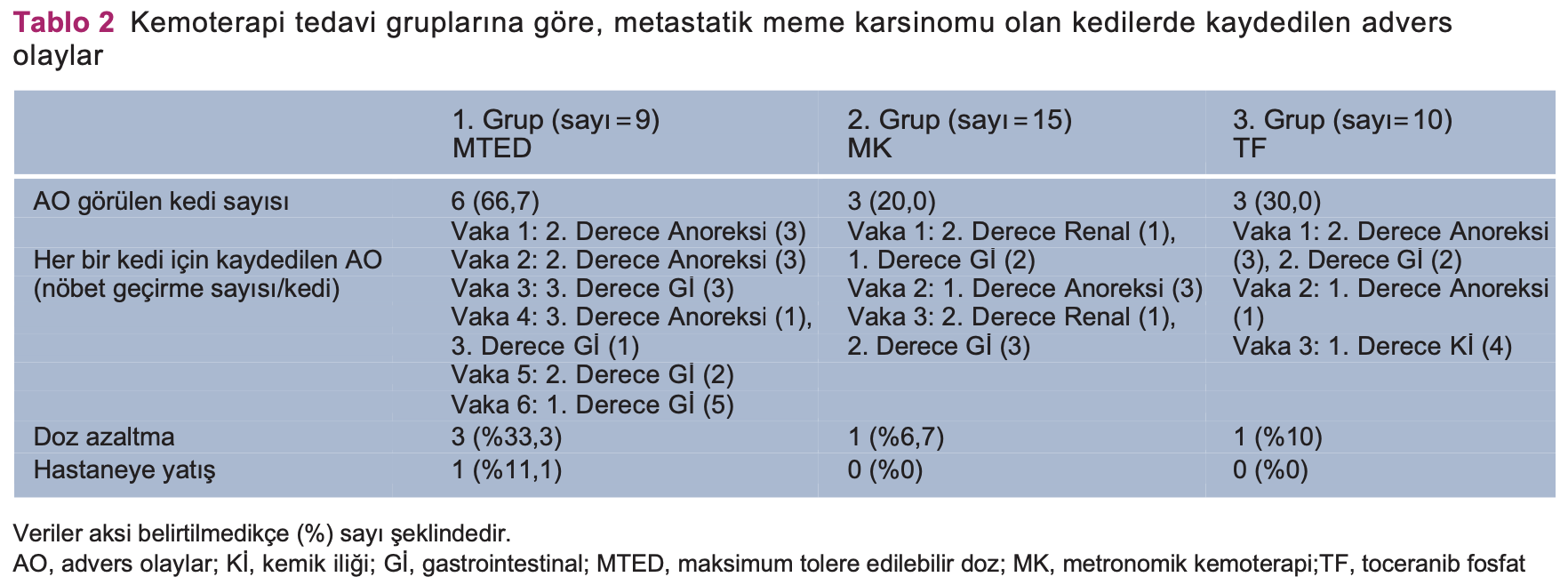
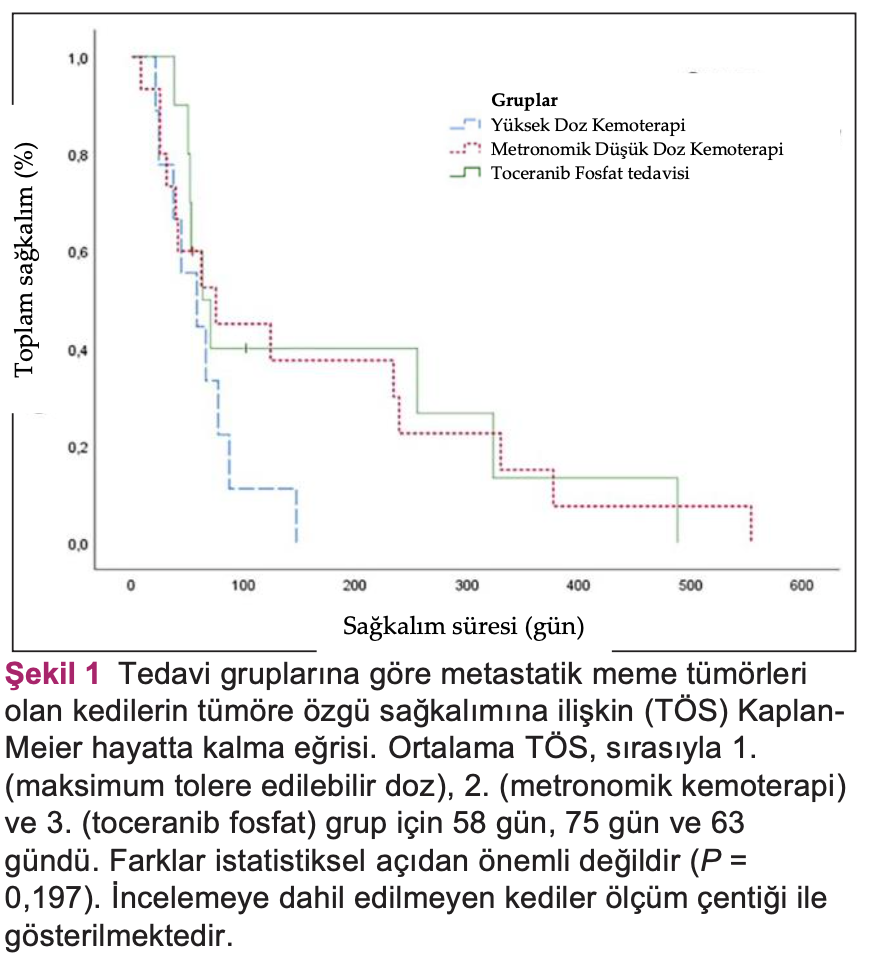
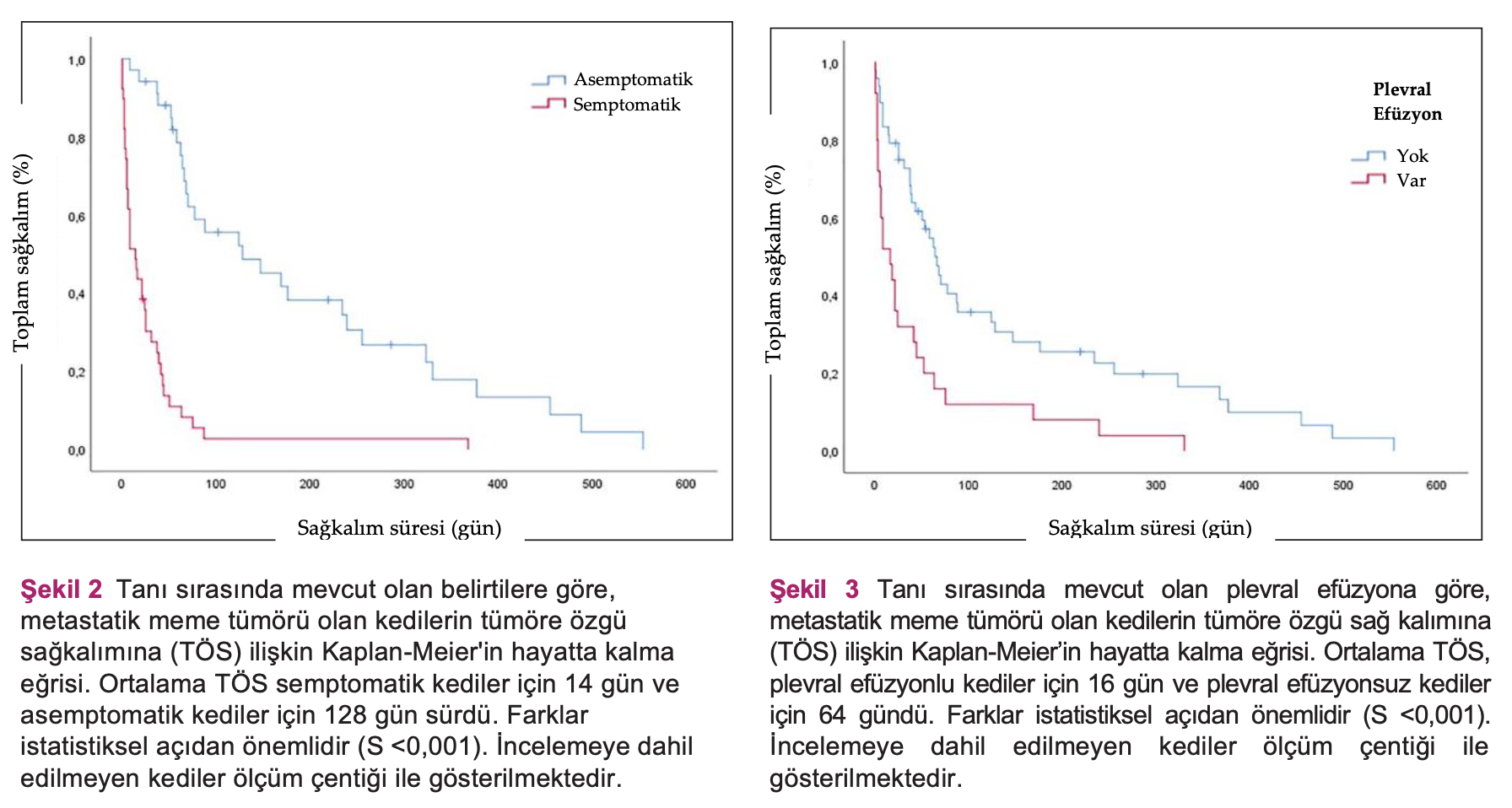
Bulgular PKGS ve TÖS’nin genel ortalaması, sırasıyla, 23 ve 44 gündü. Tanı sırasında klinik belirti gösteren kedilerin TÖS’leri (14 gün) asemptomatik kedilerden (120 gün; P <0,001) daha düşüktü. Plevral efüzyon tanısı olan kediler, olmayan kedilere göre (P <0,001) daha düşük TÖS’ye sahipti (16 gün). Ortalama TÖS; 1., 2. ve 3. gruplar için sırasıyla 58, 75 ve 63’tü (S = 0,197). Toksisite, 1, 2 ve 3. gruplardaki kedilerin, sırasıyla, %66,7, %20 ve %30’unda görüldü.
Tartışma ve sonuç Bildiğimiz kadarıyla, sayı olarak en fazla metastatik KMK teşhisli kedi bu çalışmada yer almaktadır. Prognoz genel olarak kötü olsa da bazı kediler 6 aydan daha fazla hayatta kalabildi. Bu durum da metastatik hastalıkların iyileştirilmesinde adjuvan tedavinin alternatif olabileceğini gösterdi. IV. Evre’deki hastaların tedavi sürecinin daha iyi anlaşılması ve yönetilmesi için daha fazla çalışma yapılması gerekmektedir.
Anahtar kelimeler: Metastatik meme tümörü; meloksikam; metronomik kemoterapi; toceranib fosfat; de novo (yeni tanı almış) metastatik
Kabul edilme tarihi: 15 Eylül 2020
1Porto Onevet Hayvan Hastanesi, Porto, Portekiz
2Bern Onevet Hayvan Hastanesi, Lizbon, Portekiz
3Hayvan Hastanesi Merkezi, Porto, Portekiz
4Üniversite Hayvan Hastanesi– Veteriner Fakültesi, Lizbon Üniversitesi, Lizbon, Portekiz
5Hayvan ve Veteriner Araştırma Merkezi (CECAV), Trás-os-Montes ve Alto Douro Üniversitesi, Vila Real, Portekiz 6Veteriner Fakültesi, Lusófona Beşeri Bilimler ve Teknoloji Üniversitesi, Lisbon, Portekiz
7Hayvan Bilimleri Araştırma Merkezi, CECA-ICETA, Porto Üniversitesi, Portekiz
8Moleküler Onkoloji ve Viral Patoloji Grubu, IPO-Porto Araştırma Merkezi (CI-IPOP), Portekiz Onkoloji Enstitüsü Porto (IPO-Porto), Porto, Portekiz 9 Tarımsal-Çevresel ve Biyolojik Bilimler Araştırma ve Teknoloji Merkezi (CITAB), Trás-os-Montes ve Alto Douro Üniversitesi, Vila Real, Portekiz
İlgili yazarlar:
Felisbina Queiroga DVM, MSc, PhD, Tarımsal-Çevresel ve Biyolojik Bilimler Araştırma ve Teknoloji Merkezi (CITAB),Trás-os-Montes ve Alto Douro Üniversitesi, Quinta dos Prados, Vila Real 5000-801, Portekiz
Eposta: fqueirog@utad.pt
Giriş
Kedi Meme Karsinomaları (KMK) kedilerde görülen en yaygın üçüncü tümör türüdür.1–3 Bu tip tümörler, klinik ve histolojik agresiflikleri ve buna bağlı sistemik ilerlemeleri ile karakterizedir.4,5 Rapor edilen metastatik oranlar %50 ile %90 arasında değişiklik göstermektedir ve en çok etkilenen bölgeler akciğerler, lenf nodları, karaciğer ve plevradır (akciğer zarı). 6
Uzak metastazı olan kediler Dünya Sağlık Örgütü’nün (DSÖ) değiştirilen kanser evreleme sistemine göre IV. evre olarak sınıflandırılır ve metastatik hastalık bu hayvanlarda başlıca ölüm nedeni olduğundan kötü prognozla ilişkilendirilir. 1,7 Torasik metastazlı hastaların klinik seyrinde ortaya çıkan solunum güçlüğü ve/veya öksürük, iştahsızlık ve kilo kaybı gibi belirtiler solunum bozukluklarının ilerlemesiyle meydana gelir.3,8 Bazı vakalarda, metastatik hastalık da plevral efüzyona neden olabilir. 3 Hastalığı IV. evrede olan kedilerin ortalama hayatta kalma süresi yaklaşık 1 ay olarak rapor edilmiştir. 9
KMK’ler, insanlardaki meme kanseri ile karşılaştırılması açısından kullanışlı bir modeldir, çünkü her iki hastalığın da kanserojen ve klinik seyir bakımından bir takım benzerlikleri bulunmaktadır. 10,11 İnsanlardaki meme kanserinde, halihazırda metastatik hastalığı mevcut olan fakat henüz yeni tanı almış hastalar vardır. Bu durum, “de novo” metastatik meme kanseri olarak tanımlanmaktadır.12 İnsanlardaki metastatik meme kanserinin tedavisi çeşitli faktörlere bağlıdır. Bunlar; biyolojik belirleyiciler (hormon reseptörleri ve insan epidermal büyüme faktörü tip 2 [HER2] ekspresyonu), metastaz sayısı ve alanı ile önceki tedavilerdir. Ayrıca, hastalığın ve klinik bulguların da acilen kontrol edilmesine ihtiyaç vardır. 13
Yukarıda bahsedilen nedenlerden ötürü, tek başına ya da yüksek dozda kombine olarak kullanılacak ilaçlarla kemoterapi, tirozin kinaz inhibitörleri ve/veya metronomik kemoterapi (MK) önerilmektedir. 13,14
Metastatik meme hastalığı olan bir kedinin tedavisini yaparken çeşitli güçlükler söz konusudur. Bazı yazarlar, hem klinik muayenede fark edilebilecek boyuta ulaşan hastalıkta hem de ileri metastatik KMK’de doksorubisin ve siklofosfamid kullanımından bahsetmişlerdir, fakat bu çalışmalar farklı DSÖ evrelerindeki hastalar üzerinedir ve klinik anlamda sağladığı yararlar net değildir. 15,16 KMK’ye bağlı plevral efüzyonu olan kediler için, dosetaksel ile ya da doksorubisin olmadan uygulanacak sistemik kemoterapi, intraplevral siklofosfamidden daha iyi yanıt verebilir.8 Bildiğimiz kadarıyla, bunlar metastatik KMK tedavisini inceleyen tek çalışmalardır.
Konu ile ilgili yayınların bir hayli az olması sebebiyle, bu retrospektif çalışmanın amacı, adjuvan kemoterapi tedavisi uygulanarak veya uygulanmadan, IV. evredeki kedilerin iyileştirilmesine yönelik sonuçları, tedaviye bağlı toksisiteyi ve klinik açıdan prognostik faktörleri araştırmaktır.
Materyal ve Yöntem
Vaka Seçimi
Veteriner hizmeti veren dört kurumda (Onevet Hospital Veterinário do Porto, Onevet Hospital
Veterinário Berna, Centro Hospitalar Veterinário ve Hospital Escolar Veterinário) çok merkezli retrospektif bir çalışma yapılmıştır. DSÖ’nün değiştirilen kanser evreleme sistemine göre IV. evre meme karsinomu olan kedileri tespit etmek için Ocak 2012 ile Aralık 2019 tarihleri arasındaki kayıtlar incelendi. 17
Çalışmaya yalnızca tıbbi kaydı tam olan kediler dahil edildi. Bunun için, daha önce meme tümörü geçmişine sahip kedilere histopatolojik olarak meme karsinomu tanısı konmuş olmalıydı. De novo metastatik hastalığı olan kedilerde meme nodüllerinin, sitoloji veya histopatoloji ile kötü huylu tümörler olduğu teyit edildi. Meme karsinomu dışında başka türden kanser tanısı alan kediler çalışmaya dahil edilmedi. IV. evre (ölçülebilir metastaz), kedilerin klinik muayenesinde, üç-poz toraks röntgenlerinde ve/veya abdominal ultrasonunda ve/veya tam vücut BT’sinde tespit edildi. Metastatik hastalığın mevcut olduğu, sitoloji ve/veya histopatoloji ile doğrulanmıştır. Akciğer nodülü olan bazı kedilerin yalnızca görüntüleme tetkikleri ile akciğer metastazı olduğu varsayılmıştır.
Metastatik hastalığın tespitinden sonra, adjuvan kemoterapi tedavisi gören kediler, üç tedavi grubuna ayrıldı: 1. grup, maksimum tolere edilebilir doz (MTED) kemoterapi ile tedavi edilen kedilerden oluşuyordu; 2. grupta MK ile tedavi edilen kediler vardı; 3. grupta da toceranib fosfat (TF) ile tedavi edilen kediler bulunmaktaydı (Palladia; Zoetis). MTED kemoterapi, kemoterapi ajanlarının yüksek dozda, belli dönemlerde ilacın kesilerek uygulanmasıdır. MK, tedavi sürecinde herhangi bir kesinti olmadan, kemoterapi ajanlarının düşük dozda, sürekli olarak ağız yolu ile alınmasıdır.18 Adjuvan kemoterapi tedavisi alan kedilerde, ilgili advers olaylar (AO), Kooperatif Veteriner Onkoloji Grubu’na ait Advers Olaylar için Ortak Terminoloji Kriterleri sürüm 1.1’e (KVOG-AOOTK) göre bulundu ve kaydedildi.19 Klinik yanıt ve değerlendirme, kontrol muayenelerinde incelenmiş, Katı Tümörlerde Yanıt Değerlendirme Kriterleri’ne (KTYDK, sürüm 1.0) göre kaydedilmiş ve tanımlanmıştır. 20
Tüm kediler (tedavi edilmeyen kediler de dahil olmak üzere) en az bir kez kontrol muayenesinden geçirildi. Bu kontrol muayenesi, fiziksel tam değerlendirme ve toraks röntgeni ve/veya abdominal ultrasondan oluşmaktaydı. Çalışmanın retrospektif yapısı nedeniyle, kontrol muayeneleri klinisyenlerin değerlendirmelerine göre gerçekleştirilmiştir ancak IV. evre teşhisinden sonraki ilk 12 hafta içerisinde asgari olarak 3 haftada bir yapılmıştır. Klinik takibi yapılmayan veya kaydı eksik olan kediler hariç tutulmuştur.
Toplanan ve çalışmaya dahil edilen ek bilgiler; hayvanın dıştan bakıldığındaki görünümü, daha önce verilen kontraseptiflere dair bilgiler, önceki meme tümörleri ve geçmiş tedavi prosedürleri, klinik belirtiler, evreleme görüntüleme prosedürü, metastaz alanı, efüzyonun varlığı/yokluğu, eşlik eden meme hastalığı, palyatif meme eksizyonu, kontrol muayenelerinin evreleme sonuçları, progresyona kadar geçen süre (PKGS) ve tümöre özgü sağkalım (TÖS) üzerineydi. PKGS, IV. evrenin teşhis edilmesi ile progresyonun ilk kez kayda alınarak belgelendirilmesi arasında geçen süre şeklinde tanımlanmıştır.
Progresif hastalık (PH) ve stabil hastalık (SH), KTYDK’ye (sürüm 1.0) göre tanımlanmıştır. 20 TÖS, IV. evrenin teşhis edilmesi ile tümöre bağlı ölüm arasında geçen zaman şeklinde tanımlanmıştır.
İstatiksel Analiz
Klinik değişkenlerin ve histopatolojik verilerin analizinde betimleyici istatistikler kullanılmıştır. Kesintisiz verilerin normallik deneyi Shapiro-Wilk testi ile yapılmıştır. Farkları ve gruplar arasındaki özellik dağılımını değerlendirmek için 2 testi uygulandı. Progresyon, sağkalım ve 6 aylık hayatta kalma oranlarını tespit etmek için Kaplan-Meier yöntemi kullanıldı ve farklar da log- rank testi ile değerlendirildi. Sonuçlar, %95 güven aralığı (GA) ile medyan gün olarak gösterilir. 0,05’ten küçük olan P değerleri önemli kabul edildi. Takip edilmesi mümkün olmayan, araştırmanın sonunda hayatta olan veya çalışmanın sonunda progresif hastalığı belgelenmeyen kediler çalışmaya dahil edilmemiştir.
Bulgular
Kedi ve tümör özellikleri
Çalışmaya seksen dört kedinin dahil edilmesi planlandı. Fakat beş kedi, meme sitolojisi veya histopatolojik doğrulaması eksik olduğu için çalışmadan çıkarıldı. Üçkedi de eksik veri nedeniyle çıkarıldı. İki kedi, histolojik ya da sitolojik doğrulama yapılmadan, tahmini olarak hepatik metastaz geçirdikleri için çıkarıldı ve bir kedi de başka bir tümör (sarkoma) geçmişine sahip olduğu ve metastatik hastalığı sitoloji ya da histopatoloji ile doğrulanmadığı için çıkarıldı.
Katılım kriterlerini karşılayan yetmiş üç kedi çalışmaya dahil edildi. Araştırmada yer alan kedilerin ortalama yaşı 12,28 ± 2,86 yıldı (6-20 yaş aralığında) ve
baskın olan ırk tekirdi (sayı = 62 [%84,9]), onun ardından İran kedisi (sayı = 6 [%8,2]) ve diğer ırklar (Habeş Kedisi, Siyam ve Norveç Orman Kedisi) (sayı = 5 [%6,8]) gelmekteydi. Elli beş kedi kısırlaştırılmış ve dişiydi (%75,3). 18 kedi de (%24,7) yine dişi fakat sunum sırasında henüz kısırlaştırılmamış haldeydi. Yirmi dört (%32,9) kediye daha önce ağız yoluyla kontrasif verilmiş (10 kediye dair bir bilgi yok). Elli beş kedi daha önce meme ameliyatına alınmış (15 kedi [%27,3] kısmi mastektomi, 37 kedi [%67,3] tek taraflı mastektomi ve üç [%5,5] kedi de çift taraflı mastektomi olmuş) ve metastatik hastalığa yakalanmış. 18 kedi de (%24,7) ilk defa meme karsinomu ve uzak metastaz (de novo metastatik KMK) tanısı almış.
IV. evre teşhisinden önce, daha önce ameliyata alınan 55 kediden 19’u kemoterapi tedavisi gördü. 11 kedi MK (siklofosfamid 15 mg/m2, Ağız Yoluyla, 24 saatte bir, 6 ay boyunca meloksikamla veya hastalık ilerleyene kadar) ve sekiz ay doksorubisin ile tedavi edildi (dört döngü için her 3 haftada bir 1 mg/kg).
Çalışmadaki tüm kedilere baktığımızda (sayı = 73), metastatik hastalığın teşhisi esnasında, semptomatik olan 39 (%53,4) kedi vardı. Rapor edilen klinik belirtilerşunlardır: solunum güçlüğü/ öksürük (sayı = 17 [%43,6]), anoreksi (sayı = 12 [%30,8]), kilo kaybı (sayı = 5 [%12,8]) ve bu bulguların kombinasyonu (sayı = 5 [12,8%]). Çalışmaya dahil olan kedilerin bazı klinik özellikleri Tablo 1’de özetlenmiştir.
Metastatik hastalığın teşhisi için, 64 kedinin (%87,7) toraks röntgeni ile abdominal ultrasonografisine ve dokuz kedinin (%12,3) de tam vücut tomografisinebakıldı. On dokuz kediye (26%) biyopsi yapıldı ve 28 kedinin metastatik hastalığını doğrulamak için şüpheli olduğu düşünülen lezyonların sitolojisi incelendi (%38.4).
Yirmi altı (%35,6) kedinin yalnızca röntgen veya BT taramasına bakılarak akciğer metastazı olduğu varsayılmıştır. Altmış üç (%86,3) kedinin pulmoner metastazı, dördünün (%5,5) hepatik metastazı, dördünün de (%5,5) birden fazla bölgede metastazı (bir hepatik ve renal, iki hepatik ve dalak ve bir pulmoner, deri ve kaburga) ve ikisinin (%2,7) deri metastazı vardı. Dokuz (%12,3) kediye lokal meme tümörünün sitoredüksiyonu için palyatif cerrahi operasyon yapıldı.
Adjuvan tedavi grupları
1. Grupta (MTED) dokuz kedi (%12,3); 2. grupta (MK) 15 kedi (%20,5) ve 3. grupta da (TF) 10 (%13,7) kedi vardı. Otuz dokuz (%53,4) kedi adjuvan kemoterapi tedavisi görmedi. Tüm gruplar iyi bir şekilde dengelenmişti ve klinik değişkenler arasında belirgin bir fark yoktu, ancak tanı sırasında mevcut olan belirtiler hariç tutulmuştur. (P = 0,020; tedavi görmeyen vakalarda daha fazla semptomatik hayvan) (Tablo 1). Yalnızca tedavi grupları (gruplar 1, 2 ve 3) göz önünde alındığında istatistiksel açıdan herhangi bir farklılık görülmemiştir. (P >0,05).
1. Grup (MTED) kedilerinden, yedi (%77,8) kedi, tek bir ilaç olarak doksorubisin ile (3 haftada bir 1 mg/kg) ve iki kedi (%22,2) de karboplatin (3 haftada bir 250 mg/m2) ile tedavi edildi. Ortalama tedavi sayısı iki (1-4 aralığında) idi. 2. gruptaki (MK) kediler arasında 11 (%73,3) kedi siklofosfamid (%15 mg/m2, Ağız yoluyla, 24 saatte bir) ve dört kedi (%26,7) klorambusil almıştır (%0,4-0,6 mg/kg aralığında, iki günde bir) [İGB]. MK tedavisinin ortalama süresi 60 gündü (8-400 gün aralığında). 3. Grup (TF) kedilerden 10 tanesi (%100) TF aldı (2,4-3,3 mg/kg İGB). Ortalama tedavi süresi 55 gündü (35-300 gün aralığında). Çalışmada yer alan tüm kediler (tedavi gören ve tedavi görmeyen), klinik değerlendirmeye göre, destekleyici analjezik tedavi
görmüşlerdir gabapentin). (meloksikam, buprenorfin ve/veya gabapentin.)
Toksisite
Her bir tedavi grubuna ait advers olaylar Tablo 2’de verilmiştir. 1. grupta, bir kedinin hastaneye yatırılması (şiddetli anoreksi ve gastrointestinal belirtiler nedeniyle)
gerekmiş ve tedavisi durmuş, orta dereceli anoreksi ve gastrointestinal belirtiler gösteren diğer üç kedinin de aldığı doz %25 oranında azaltılmıştır. Orta şiddetligastrointestinal belirtilerden dolayı 2. Grupta yer alan bir kediye verilen doz azaltılmıştır (siklofosfamid 10 mg/m2 İGB) ve 3. grupta bir kedinin hafif şiddetli gastrointestinal belirtiler göstermesi neticesinde tedavisi 1 hafta süreyle durdu ancak daha sonra tedaviye devam edildi.
Bulgular ve Teşhis
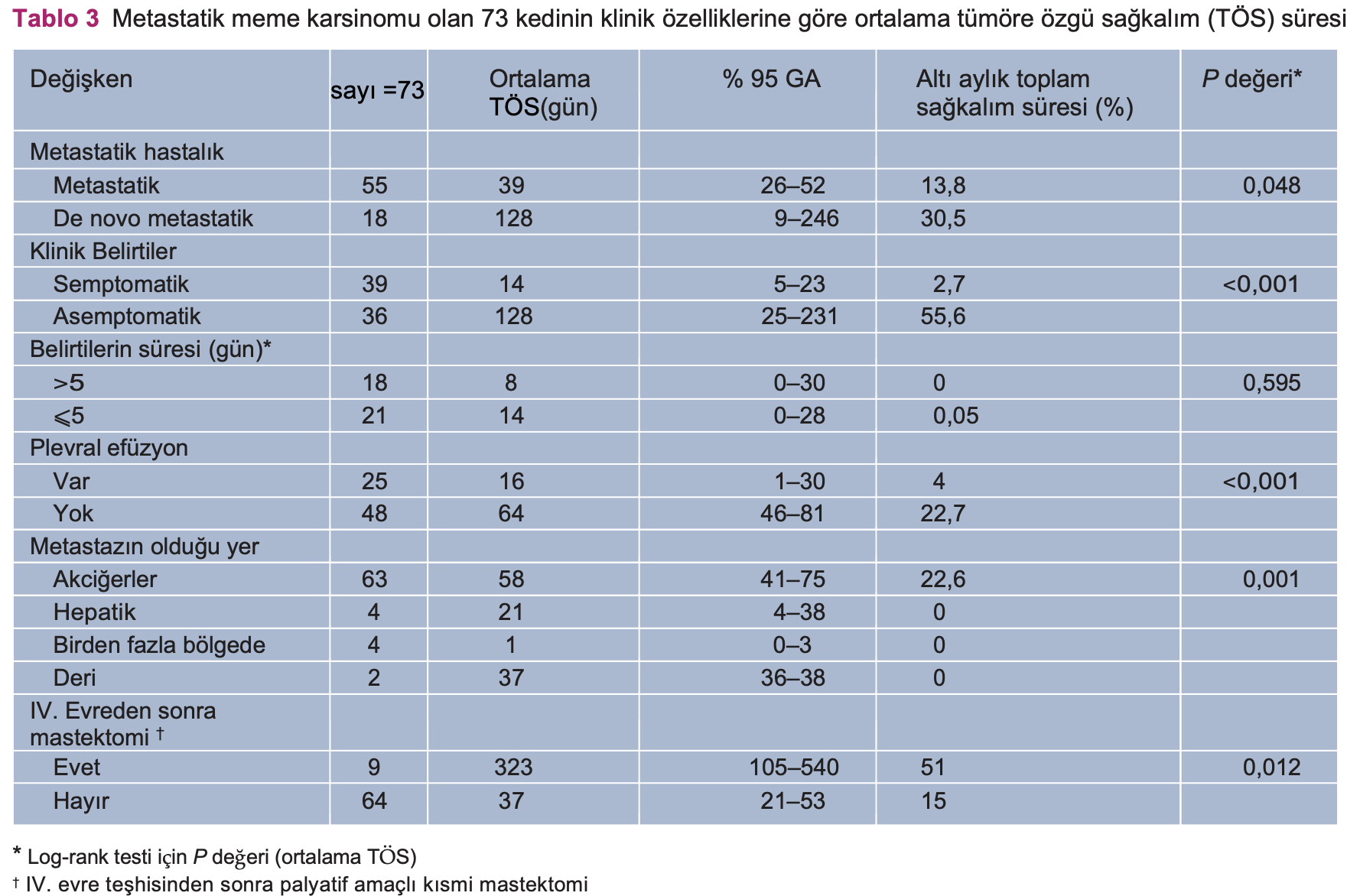
Genel olarak, ortalama PKGS 23 gündü (0-342 gün arası; %95 GA 7-39) ve ortalama TÖS 44 gündü (0-554 gün arası; 95% GA 28-60). 6 ayda toplam hayatta kalma oranı %19,4’tü. Tedavi gruplarına göre PKGS ve TÖS Şekil 1’de gösterilmiştir. Adjuvan tedavi gören kediler için, PKGS 50 gün (%95 GA 27-73) ve TÖS 63 gündü (%95 GA 46-79). TÖS için prognostik faktörler Tablo 3’te verilmiştir. Mevcut belirtilere ve plevral efüzyona ilişkin Kaplan-Meier eğrileri, sırasıyla, Şekil 2 ve 3’te verilmiştir.
Genel olarak, 19 kedide (%26) SH, 54’ünde (%74) PH vardı. IV. evre teşhisinden sonra, dokuz (%12,3) kedinin meme bezinde yeni tümörler oluştu. Çalışmanın sonunda, 66 kedi (%90,4) kansere bağlı nedenlerle hayatını kaybetti, altı kedi (%8,2) sağ kaldı ve bir kedinin de (%1,4) klinik takibi yapılamadı.
Tartışma
Meme karsinomları orta yaşlı ve yaşlı kedilerde kansere bağlı ölümlerin önde gelen nedenlerinden biridir.7,21 Özellikle metastatik oranın yüksek olmasından dolayı, bu hastalığın prognozu kötü olarak bilinmektedir. Bu da çoğu KMK’nin tedavi edilemez olduğu gerçeğini ortaya koyar.1,3 Bu bakımdan, bir noktada, metastatik hastalığı olan hayvanların tedavi edilmesinde en önemli hedefler; hastaları idare etmek, hastalığı kontrol altına almak ve yaşam kalitesini artırmak olacaktır. Geçtiğimiz yıllarda, kedi meme tümörleri hakkında pek çok rapor yayınlanmasına rağmen, bunların yalnızca birkaçı metastatik hastalığı olan hastalar hakkındaydı.
Mevcut çalışmada elde edilen sonuçlara göre, ortalama hayatta kalma süresi 44 gün olduğundan metastatik KMK’nın prognozu kötüdür. Bu sonuçlar önceki çalışmalarla da benzerlik taşımaktadır. Hayatta kalma sürelerinin 1 ile 3 ay arasında değişkenlik gösterdiği rapor edilmiştir.9,16 Itoh ve ark.9 çalışmalarında yer alanmetastazlı ve tedavi görmeyen 29 kedinin tanı konduktan sonra 5 ay içinde öldüğünü bildirmiştir. Yine de, elde ettiğimiz sonuçlara göre, hayatta kalma oranı 0 ile 554 gün arasında değişmektedir. Bu durum, metastazik KMK’nin heterojenliğini destekler niteliktedir. Aynı zamanda, hayatta kalmanın çeşitli faktörlere göre değişebileceğini de göstermektedir.
Tedavi seçeneklerini göz önünde bulundurduğumuzda, tedavi grupları arasında hastalığın ilerlemesi ve hayatta kalma açısından önemli bir fark bulunmadı. Ancak, mevcut çalışmada nispeten daha az sayıda hayvan olduğunu ve aldığımız sonuçları doğrulamak için daha fazla vaka içeren ek çalışmalara ihtiyaç duyulacağını bilmemiz gerekiyor. Mevcut literatür doksorubisin ile uygulanan protokollerin palyatif tedavi için terapötik bir seçenek olduğunu belirtiyor.8,15,16 Ancak, daha önce de belirtildiği gibi, bu yayımlanan çalışmaların çoğunda DSÖ’nun farklı evrelerindeki kediler yer almıştır, bu da uygulanan tedavinin metastatik hastalık üzerindeki gerçek etkisini doğrulamayı güçleştirmiştir. Yayınlanan raporların aksine, diğer tedavilerle karşılaştırıldığında, MTED hayatta kalma süresini arttırmadı ve sıklıkla da dozu azaltımı ve destekleyici tedavi gerektiren çok sayıda advers olay meydana getirdi.
Bununla birlikte, köpeklerde agresif seyirli çeşitli kanserlerin tedavisi için MK önerilmiştir.22,23 Metastatik meme kanseri olan kadınlarda MK, geleneksel yöntemlere göre planlanmış MTED tedavisinin yerine bir alternatiftir ve agresif meme kanserlerinde iyi sonuçlar almak için ilgi çekici bir yaklaşımdır.14,24
Meme kanserlerinde kedi ve insanlar arasındaki ortak benzerlikler nedeniyle, bu tedavinin aynı faydayı sağlayacağına dair hipotez oluşturduk ancak bukanıtlanmamıştır. MK’nin mevcut çalışmada hayatta kalma oranını artırmamış olması, diğer yazarların da belirttiği gibi, tümörün hızlı bir şekilde ilerleyerek bize tedavinin verimliliğini kanıtlamak için yeterli süreyi vermemesiyle alakalı olabilir. 26
Aynı şekilde, TF, tirozin kinaz inhibitörü olduğu için, daha önce de, kedilerdeki bazı tümörlerde, antianjiyojenik ve antitümoral etkili olası bir tedavi seçeneği olarak tanımlanmıştır.27–30 İnsanlarda, küçük molekül inhibitörleri ileri meme kanserinde birinci
basamak tedavi olarak veya geleneksel tedavi yöntemleri başarısız olduğunda kullanılır. 13,31 Tümör anjiyogenezi, çeşitli kanserlerde tümör büyümesi ve metastaz gibi konularda önemli rol oynadığından, vasküler endotelyal büyüme faktörü reseptörünün inhibisyonu KMK tedavisinde de klinik açıdan yararlı olabilir.32,33
Toksisite değerlendirmesine bakıldığında, sonuçlar MTED ile MK’yi karşılaştıran önceki çalışmalarla paraleldi.26 Bu terapileri değerlendiren diğer çalışmalarda da görüldüğü üzere, bu kedilerde MK ya da TF’ye bağlı toksisite düşüktü. 27,34
İnsanlarda, metastatik meme kanserine müdahale etmenin amacı semptomları azaltmak, ömrü uzatmak ve yaşam kalitesini, olumsuz etkileri en aza indirerek, yeterli seviyede sağlamaktır.35 Metastatik KMK, MK veya TF’ye de aynı ilkeleri uygulamak, seçenek olarak MTED’den daha makul görünmektedir.
Ayrıca, mevcut çalışmaya göre, klinik belirtilerin bazıları, olumsuz sayılan prognostik faktörler açısından faydalı kabul edilebilir. Tanı esnasındaki belirtiler veplevral efüzyon, olumsuz sayılan prognostik faktörler arasında daha ciddi ve önemli olanlardır. Bunlar aynı zamanda primer akciğer kanseri olan kediler için de belirtilmiştir.36 Ancak, primer akciğer karsinomu olan asemptomatik kedilerin genel olarak hayatta kalma süreleri daha uzundur. Aynı bölgede olmasına rağmen,primer akciğer karsinomu ve metastatik KMK’nin prognozu ve evrimi aynı görünmemektedir. Plevral efüzyon, primer veya sekonder akciğer neoplazisi olankedilerde de önemli bir sorundur ve prognozu kötüdür. Mevcut çalışmada elde edilen sonuçların aksine, Yakunina ve Treshalina8, dosetaksel ile birlikte doksorubisin kullanımını önermektedir ve KMK’ye sekonder plevral efüzyonu olan kediler için ortalama hayatta kalma süresini 2.8 ay olarak tanımlamaktadır.
Bu prognostik faktörler sonucu tahmin etmeye ve karar almaya yardımcı olabilir. Bu çalışmada, de novo metastatik IV. evre dokuz kediye palyatif meme ameliyatı yapıldı ve ortalama hayatta kalma süresi 322 gündü. Primer tümörün rezeksiyonu prognozu etkilemiş ve metastatik meme kanserinde sonucu iyileştirmiştir. Bu olumlu etkiyi açıklamak için primer tümörün kendi kendine yayılmasının sekteye uğratılması, kanser kök hücre eliminasyonu ve tümör yükünün genel olarak azaltılması gibi çeşitli oluşbiçimleri ileri sürülmüştür. 37–40 Tümörün manipüle edilmesi tümör hücresinin yıkımına ve tümörle bağlantılı antijenlerin dolaşıma girmesine, radyasyon almış dokunun radyasyon almamış dokuyu etkilemesi ile bağışıklık tepkisinin artmasına yol açabilir.41 Kedilerin %57,5’inde tanı anında lokal meme hastalığı olduğu ve kedilerin %12’sinde tanı sonrasında yeni meme tümörü ve/veya lokal metastatik hastalık geliştiğinden, özellikle ülserli ve agresif lokal hastalıklarda yaşam kalitesini yükseltmek amacıyla lokal rezeksiyon önerilebilir ve gerekli olabilir. Ancak olumsuz prognostik faktörlerin olasılığı ve hastanın anestezi riski ile yaşam kalitesi gibi klinik skoru da dikkate alınmalıdır.
Bu çalışmanın temel olarak retrospektif yapıda olması nedeniyle bazı kısıtlamalar söz konusudur. Yalnızca tıbbi kayıtlar mevcut olduğundan, tedavi esnasındaki yaşam kalitesi tam olarak yakalanmamış olabilir, bu nedenle yalnızca advers olaylar rapor edilmiştir.
Metastatik hastalığın saptanması için görüntüleme tetkikleri kullanmak standart bir uygulama değildi ve BT taramaları metastatik yükün, yani pulmoner nodüllerin saptanmasında daha duyarlı olduğu için sağkalımı etkileyebiliyordu.42 Buna ek olarak, adjuvan tedavi kararı sahiplere bırakıldığından, adjuvan tedavi almayan semptomatik kedilerin sayısında, seçim yanlılığı söz konusu olabilir. Metastatik hastalığı olan kedilerde adjuvan tedavinin rolünü netleştirmek için prospektif randomize klinik araştırmalar gerekmektedir.
Yine de, bildiğimiz kadarıyla, bu çalışma metastatik KMK üzerine yapılmış en kapsamlı çalışmadır. Geçtiğimiz on yılda, tarama programlarının kullanılması ve tedavilerdeki ilerlemeler, insan meme kanseri mortalitesini %25-38 oranında azaltmıştır.12 Birkaç yıl içinde, KMK’ye bağlı mortalitede aynı azalmayı sağlamayı umuyoruz. KMK tedavisini farklı evrelerde ele alan yeni çalışmalar, umarız ki hastalarımızı daha iyi tedavi etmemizi sağlayacaktır.
Sonuç
Metastatik KMK’nin prognozu kötüdür ve adjuvan tedavinin rolü henüz doğrulanmamıştır. Asemptomatik kedilerin hayatta kalma sürelerinin daha iyi olduğu görülmektedir. Yaşam kalitesini artırmak için palyatif lokal cerrahi yapılabilir. Prognozu iyileştirmek için daha fazla çalışma gerekmektedir.
Çıkar çatışması Yazarlar, bu makalenin araştırılması, yazarlığı ve/veya yayınlanmasıyla ilgili herhangi bir potansiyel çıkar çatışması beyan etmemiştir.
Fon Bu çalışma, UIDB/04033/2020 ve UIDB/00211/2020 projeleri kapsamında FCT – Portekiz Bilim ve Teknoloji Vakfı tarafından ulusal fonlarla desteklenmiştir.
Etik onay Bu çalışmada deney hayvanı kullanılmamıştır (sahipli veya sahipsiz hayvanlar ve ileriye dönük veya geriye dönük çalışmalardan elde edilen veriler dahil). Bireysel veteriner klinik hasta bakımına ilişkin uluslararası kabul görmüş yüksek standartlara (“en iyi uygulama”) uyulmuştur.
Kaynakça
1 GiménezF,HechtS,CraigLE,etal.Earlydetection,aggres- sive therapy: optimizing the management of feline mam- mary masses. J Feline Med Surg 2010; 12: 214–224.
2 Castagnaro M, Casalone C, Bozzetta E, et al. Tumour grad- ing and the one-year post-surgical prognosis in feline mammary carcinomas. J Comp Pathol 1998; 119: 263–275.
3 Morris J. Mammary tumours in the cat: size matters, so early intervention saves lives. J Feline Med Surg 2013; 15: 391–400.
4 SeixasF,PalmeiraC,PiresMA,etal.Gradeisanindependent prognostic factor for feline mammary carcinomas: a clinico- pathological and survival analysis. Vet J 2011; 187: 65–71.
5 Castagnaro M, De Maria R, Bozzetta E, et al. Ki-67 index as indicator of the post-surgical prognosis in feline mam- mary carcinomas. Res Vet Sci 1998; 65: 223–226.
6 Zappulli V, Rasotto R, Caliari D, et al. Prognostic evalua- tion of feline mammary carcinomas: a review of the litera- ture. Vet Pathol 2015; 52: 46–60.
7 Hassan BB, Elshafae SM, Supsavhad W, et al. Feline mam- mary cancer: novel nude mouse model and molecular characterization of invasion and metastasis genes. Vet Pathol 2017; 54: 32–43.
8 Yakunina MN and Treshalina EM. Systemic taxotere che- motherapy for metastatic tumor pleurisy in cats with spontaneous breast cancer. Bull Exp Biol Med 2011; 150: 642. DOI: 10.1007/s10517-011-1211-5.
9 Itoh T, Kadosawa T, Mochizuki M, et al. Prognosis of malignant mammary tumor in 53 cats. J Vet Med Sci Jpn Soc Vet Sci 1996; 58: 723–726.
10 Caliari D, Zappulli V, Rasotto R, et al. Triple-negative vimentin-positive heterogeneous feline mammary carci- nomas as a potential comparative model for breast cancer. BMC Vet Res; 10: 185. DOI: 10.1186/s12917-014-0185-8.
11 Cannon CM. Cats, cancer and comparative oncology. Vet Sci 2015; 2: 111–126.
12 Seltzer S, Corrigan M and O’Reilly S. The clinicomolecu- lar landscape of de novo versus relapsed stage IV meta- static breast cancer. Exp Mol Pathol 2020; 114: 104404. DOI: 10.1016/j.yexmp.2020.104404.
13 Cardoso F, Senkus E, Costa A, et al. 4th ESO-ESMO inter- national consensus guidelines for advanced breast cancer (ABC 4). Ann Oncol 2018; 29: 1634–1657.
14 Banys-Paluchowski M, Schütz F, Ruckhäberle E, et al.
Metronomic chemotherapy for metastatic breast cancer – a systematic review of the literature. Geburtshilfe Frauen- heilkd 2016; 76: 525–534.
15 Stolwijk JA, Minke JM, Rutteman GR, et al. Feline mam- mary carcinomas as a model for human breast cancer. II. Comparison of in vivo and in vitro adriamycin sensitiv- ity. Anticancer Res 1989; 9: 1045–1048.
16 MauldinGN,MatusRE,PatnaikAK,etal.Efficacyandtox- icity of doxorubicin and cyclophosphamide used in the treatment of selected malignant tumors in 23 cats. J Vet Intern Med 1988; 2: 60–65.
17 Misdorp W, Else RW, Hellmén E and Lipscomb TP. Histo- logical classification of mammary tumors of the dog and the cat. Washington, DC: Armed Forces Institute of Pathol- ogy in cooperation with the American Registry of Pathology and the World Health Organization Collaborating Center for Worldwide Reference on Comparative Oncology, 1999.
Bu nedenle bir komiteden etik onay gerekmemektedir.
alınması
Bilgilendirilmiş onam Yapılan prosedürler (prospektif veya retrospektif çalışmalar) için bu çalışmada açıklanan tüm hayvanların (deney veya deney hayvanları olmayan) sahibinden veya yasal koruyucusundan bilgilendirilmiş onam (sözlü veya yazılı) alınmıştır. Bu yayında hiçbir hayvan veya insan tanınır değildir ve bu nedenle yayın için ek bilgilendirilmiş onam gerekmemektedir.
ORCID Numarası
Gonçalo Petrucci Joaquim Henriques
Felisbina Queiroga
https://orcid.org/0000-0003-1751-2419 https://orcid.org/0000-0002-2293-2277
https://orcid.org/0000-0001-6130-8381
- 18 Gaspar TB, Henriques J, Marconato L, et al. The use of low- dose metronomic chemotherapy in dogs—insight into a modern cancer field. Vet Comp Oncol 2018; 16: 2–11.
- 19 VCOG. Veterinary Cooperative Oncology Group – common terminology criteria for adverse events (VCOG- CTCAE) following chemotherapy or biological antineo- plastic therapy in dogs and cats v1.1. Vet Comp Oncol 2016; 14: 417–446.
- 20 Nguyen SM, Thamm DH, Vail DM, et al. Response evalua- tion criteria for solid tumours in dogs (v1.0): a Veterinary Cooperative Oncology Group (VCOG) consensus docu- ment. Vet Comp Oncol 2015; 13: 176–183.
- 21 Zappulli V, De Zan G, Cardazzo B, et al. Feline mammary tumours in comparative oncology. J Dairy Res 2005; 72: 98–106.
- 22 Lana S, U’ren L, Plaza S, et al. Continuous low-dose oral chemotherapy for adjuvant therapy of splenic hemangio- sarcoma in dogs. J Vet Intern Med 2007; 21: 764–769.
- 23 Polton G, Finotello R, Sabattini S, et al. Survival analysis of dogs with advanced primary lung carcinoma treated by metronomic cyclophosphamide, piroxicam and thalido- mide. Vet Comp Oncol 2018; 16: 399–408.
- 24 Rabanal C, Ruiz R, Neciosup S, et al. Metronomic chemo- therapy for non-metastatic triple negative breast cancer: selection is the key. World J Clin Oncol 2017; 8: 437–446.
- 25 Adega F, Borges A and Chaves R. Cat mammary tumors: genetic models for the human counterpart. Vet Sci 2016; 3: 17. DOI: 10.3390/vetsci3030017.
- 26 Marconato L, Chalfon C, Finotello R, et al. Adjuvant anthracycline-based vs metronomic chemotherapy vs no medical treatment for dogs with metastatic splenic hem- angiosarcoma: a multi-institutional retrospective study of the Italian Society of Veterinary Oncology. Vet Comp Oncol 2019; 17: 537–544.
- 27 Merrick CH, Pierro J, Schleis SE, et al. Retrospective evalu- ation of toceranib phosphate (Palladia®) toxicity in cats. Vet Comp Oncol 2017; 15: 710–717.
- 28 Wiles V, Hohenhaus A, Lamb K, et al. Retrospective evalu- ation of toceranib phosphate (Palladia) in cats with oral squamous cell carcinoma. J Feline Med Surg 2017; 19: 185–193.
- 29 Berger EP, Johannes CM, Post GS, et al. Retrospective eval- uation of toceranib phosphate (Palladia) use in cats with mast cell neoplasia. J Feline Med Surg 2018; 20: 95–102.
30 London C, Mathie T, Stingle N, et al. Preliminary evidence for biologic activity of toceranib phosphate (Palladia(®)) in solid tumours. Vet Comp Oncol 2012; 10: 194–205.
31 Mohan A and Ponnusankar S. Newer therapies for the treatment of metastatic breast cancer: a clinical update. Indian J Pharm Sci 2013; 75: 251–261.
32 Carvalho MI, Pires I, Prada J, et al. High COX-2 expression is associated with increased angiogenesis, proliferation and tumoural inflammatory infiltrate in canine malig- nant mammary tumours: a multivariate survival study. Vet Comp Oncol 2017; 15: 619–631.
33 Michishita M, Ohtsuka A, Nakahira R, et al. Anti-tumor effect of bevacizumab on a xenograft model of feline mammary carcinoma. J Vet Med Sci 2016; 78: 685–689.
34 Leo C, Stell A, Borrego J, et al. Evaluation of low-dose met- ronomic (LDM) cyclophosphamide toxicity in cats with malignant neoplasia. J Feline Med Surg 2014; 16: 671–678.
35 Stebbing J and Ngan S. Breast cancer (metastatic). BMJ Clin Evid 2010; 2010: 0811.
36 Maritato KC, Schertel ER, Kennedy SC, et al. Outcome and prognostic indicators in 20 cats with surgically treated primary lung tumors. J Feline Med Surg 2014; 16: 979–984.
37 Gera R, Chehade HELH, Wazir U, et al. Locoregional ther- apy of the primary tumour in de novo stage IV breast can- cer in 216 066 patients: a meta-analysis. Sci Rep 2020; 10: 2952. DOI: 10.1038/s41598-020-59908-1.
38 Norton L and Massagué J. Is cancer a disease of self- seeding? Nat Med 2006; 12: 875–878.
39 Karnoub AE, Dash AB, Vo AP, et al. Mesenchymal stem cells within tumour stroma promote breast cancer metas- tasis. Nature 2007; 449: 557–563.
40 Rashid OM, Nagahashi M, Ramachandran S, et al. Resec- tion of the primary tumor improves survival in metastatic breast cancer by reducing overall tumor burden. Surgery 2013; 153: 771–778.
41 Walker R, Poleszczuk J, Pilon-Thomas S, et al. Immune interconnectivity of anatomically distant tumors as a potential mediator of systemic responses to local therapy. Sci Rep 2018; 8: 1–11. DOI: 10.1038/s41598-018-27718-1.
42 Alexander K, Joly H, Blond L, et al. A comparison of com- puted tomography, computed radiography, and film- screen radiography for the detection of canine pulmonary nodules. Vet Radiol Ultrasound 2012; 53: 258–265.