| 1Karşılaştırmalı Tıp, Üniversitelerarası Messerli Araştırma Enstitüsü, Viyana Veteriner Hekimliği Üniversitesi, Viyana Tıp Üniversitesi ve Viyana Üniversitesi, Viyana 1210; 2Patofizyoloji ve Alerji Araştırma Enstitüsü, Patofizyoloji, Enfeksiyon ve İmmünoloji Merkezi, Viyana Tıp Üniversitesi, Viyana 1090, Avusturya Sunum Tarihi: 28 Eylül 2015; |
| İletişim için: Professor Profesör Erika Jensen-Jarolim, Karşılaştırmalı Tıp, Üniversitelerarası Messerli Araştırma Enstitüsü, Viyana Veteriner Hekimliği Üniversitesi, Viyana Tıp Üniversitesi ve Viyana Üniversitesi, c/o 18-20 Währinger Gürtel, Viyana 1090, Avusturya E-posta: erika.jensen-jarolim@meduniwien.ac.at Kısaltmalar: AAV, adeno-ilişkili virüs; AAVLP, AAV benzeri partikül; DER-2, köpek epidermal büyüme faktörü reseptörü-2; EGFR, epidermal büyüme faktörü reseptörü; HER-2, insan epidermal büyüme faktörü reseptörü-2 Anahtar Kelimeler: HER-2, köpek, translasyonel, kanser aşısı, onkoloji, mimotop |
| Özet. İnsan epidermal büyüme faktörü reseptörü-2 (HER-2), insanlarda antikanser tedavisinde hassas tıp için kullanılan başarılı bir hedeftir. Köpek meme tümörlerinde, burada ‘köpek epidermal büyüme faktörü reseptörü-2 (DER-2)’ olarak adlandırılan ve insan meme kanserindekine benzer biyolojik etkileri olan %92 amino asit özdeşliğine sahip HER-2 homoloğu açıklanmıştır. Her iki antijen de temel olarak trastuzumab gibi anti-HER-2 antikorları tarafından immünolojik olarak hedeflenebilir; ancak, hümanize antikorların diğer türlere in vivo uygulanması spesifik aşırı duyarlılık reaksiyonlarına yol açacaktır. Bu nedenle, otolog trastuzumab benzeri immünoglobulinleri aktif olarak indükleyen HER-2 mimotop aşıları, türe özgü sınırlamaların üstesinden gelmek için yeni ve ekonomik bir tedavi seçeneği sunmaktadır. Bu nedenle, bu derleme, güvenlik ve etkinliklerini değerlendirmek için spontan DER-2 pozitif meme bezi karsinomlu köpek kanser modeli hastalarında HER-2 aşılarıyla klinik çalışmaların yürütülmesini sunmaktadır. Bu yaklaşım sadece veteriner onkoloji alanında çığır açmakla kalmayacak, aynı zamanda insan deneyleri için de sağlam veriler üretecek ve yeni kombinatoryal tedavilerin test edilmesini kolaylaştıracaktır. |
İçindekiler
|
1. İnsan ve köpek kanserinde HER-2 hedefli tedavilerin karşılaştırılmasıİnsan epidermal büyüme faktörü reseptörü-2 (HER-2), gen amplifikasyonu nedeniyle insan meme kanserlerinin %25-30’unda aşırı eksprese edilir ve böylece ‘HER-2-pozitif hastalığı’ temsil eder (1-3). İnsan meme kanserinde HER-2-aşırı ekspresyonu artmış metastatik potansiyel (4), hastalıksız geçen süre ve genel sağkalımın kötü olması ve in vitro ve in vivo kemoterapiye yanıtın kötü olması ile ilişkilendirilmiştir (5,6). Cerrahi, radyoterapi ve normal kemoterapi protokollerinin yanı sıra, HER-2-aşırı eksprese eden kanserlerde en başarılı şekilde kullanılan tedaviler, HER-2’yi malign olarak dönüşmüş hücrelerde hedef olarak ele alan tedavilerdir (7,8). ‘Hedefe yönelik tedaviler’ olarak adlandırılan bu tedaviler insan HER-2-pozitif meme kanserinde iyi bir şekilde uygulanmaktadır ve son yıllarda bu endikasyon için çeşitli ajanların kullanımı onaylanmıştır (9,10). Hastalık sonuçlarını önemli ölçüde iyileştiren bu tür hedefe yönelik tedavilere örnek olarak, farklı kemoterapi protokolleriyle birlikte pasif immünoterapi için kullanılan iki monoklonal antikor olan trastuzumab (Herceptin®; Hoffmann-La Roche AG, Basel, İsviçre) ve pertuzumab (Perjeta®; Hoffmann-La Roche AG) (11) verilebilir (12), ancak lapatinib (Tyverb®; GlaxoSmithKline plc., Londra, İngiltere) gibi tirozin kinaz inhibitörlerinin de etkili olduğu kanıtlanmıştır (13). Bu hedefe yönelik tedavilerin neredeyse hiçbiri köpek hastalarda kullanılmak üzere uyarlanmamış veya veteriner hekimliği klinik çalışmalarında henüz üzerinde çalışılmamıştır. Bugüne kadar sadece her biri c-Kit’i hedef alan tirozin kinaz inhibitörleri masitinib (Masivet®; AB Science S.A., Paris, Fransa) ve toceranib (Palladia®; Pfizer Inc., New York, NY, ABD) klinik çalışmalarda başarıyla test edilmiş ve köpek mast hücreli tümör hastalarında kullanımı onaylanmıştır (14,15) . Toceranib örneğinde, insan muadili sunitinib maddesinin (Sutent®; Pfizer Inc.) etkinliği, köpekler için benzer bir ilacın bağımsız olarak geliştirilmesine öncülük etmiştir (15,16). Yakın zamanda yapılan bir çalışmada, köpek meme bezi tümörlerinde insan hastalığındaki muadiliyle karşılaştırıldığında benzer ErbB-2 aşırı ekspresyon oranına ek olarak (17-20), köpek epidermal büyüme faktörü reseptörü-2 (DER-2) ile insan HER-2 arasında %92’lik bir amino asit özdeşliği ve %95’lik homoloji olduğu ortaya konmuştur (21). Ayrıca, DER-2’nin trastuzumab ile hedeflenmesinin köpek tümör hücrelerinin büyümesini engellediği görülmüştür (21), bu da köpek meme karsinomlarında insan hastalardaki HER-2 sistemi ile benzer bir biyolojiye işaret etmektedir (19). Köpeklerdeki meme tümörlerinin DER-2 durumu veteriner hekimlikte henüz değerlendirilmemiştir, ancak ekspresyonu karsinogenez ve hastalık şiddeti açısından ve yeni hedefe yönelik ilaçların geliştirilmesinde önemli olabilir (20,22). |
2. HER-2 mimotop aşıları – yeni bir tedavi yöntemiTrastuzumab, daha önce de belirtildiği gibi, insan HER-2-pozitif meme kanserinde pasif immünoterapi için kullanılan hümanize mono-klonal bir antikordur (12). Hümanize formunda, aşırı duyarlılığa neden olabilen ksenojenik ve oldukça immünojenik proteini temsil ettiğinden, karşılaştırmalı tıp çalışmalarında, örneğin köpek modellerinde uygulanamaz (23-25). Sabit bölge alanları söz konusu türe adapte edilirse bu risk en aza indirilebilir (24,26). Bugüne kadar bu türden sadece iki kimerik köpek antikoru rapor edilmiştir. Bunlardan biri fare-insan kimerik anti-epidermal büyüme faktörü reseptörü (EGFR) antikoru olan cetuximab (Erbitux®; Merck KGaA, Darmstadt, Almanya) (26), ikincisi ise B-hücresi farklılaşma antijen kümesini (CD)20 hedefleyen rituximab benzeri (MabThera®; Hoffman-La Roche AG, Basel, İsviçre) bir antikordur (27). Bununla birlikte, bu yöntemler yüksek maliyetlidir ve bu da karşılaştırmalı tıbbi çalışmalarda ve veteriner onkolojisinde kullanım alanlarını sınırlandırabilir. Maliyet faktörünün yanı sıra otolog antikorların indüklenmesi, sadece translasyonel veya karşılaştırmalı çalışmalar için değil, aynı zamanda insan hastalar için de pasif immünoterapi yerine aşı gibi aktif immünoterapilerin tercih edilmesine neden olacaktır (28,29). Tümör aşısı, tümöre özgü antijene karşı poliklonal antikorları indüklemek için bağışıklık sistemini harekete geçiren aktif bir immünoterapi görevi görür. Şu anda insan meme kanserinde, müsin-1, telomeraz ters transkriptaz veya karsinoembriyonik antijen gibi farklı tümörle ilişkili proteinlere karşı antikorların indüklenmesini amaçlayan birkaç tümör aşısı klinik geliştirme aşamasındadır (30). Buna paralel olarak, CD8(+) T-hücresi uyarıcı bir aşı olan NeuVaxTM (31) ve şu anda bir faz I çalışmasında test edilmekte olan AdHER2/neu dendritik hücre aşısı (32) dahil olmak üzere çeşitli anti-HER-2 aşıları da klinik çalışmalarda incelenmektedir. Mimotoplar, yani protein, karbonhidrat veya lipid epitoplarını taklit eden peptitler, kanser aşıları için bir başka yeni ve uygulanabilir seçenektir (33,34). Önceki çalışmalarda, EGFR (35) ve HER-2 (36) dahil olmak üzere önemli tümör hedeflerine karşı bir dizi mimotop aşısı geliştirilmiştir. HER-2’ye özgü mimotoplar, trastuzumab ile faj görüntüleme kütüphanelerinin biyopanlanması yoluyla üretildi ve çıkarılan peptitler, aşılama için anahtar deliği limpet hemosiyanini gibi immünojenik taşıyıcılara bağlandı (37) veya adeno-ilişkili virüsler (AAV) veya AAV benzeri partiküller (AAVLP’ler) gibi taşıyıcılarla füzyon proteinleri olarak eksprese edildi ve tahmin edildiği gibi yüksek güvenlik sağlandı (38). HER-2 mimotop aşılarının antijenisitesi, immünojenisitesi ve tümörisidik etkileri önceki çalışmalarda in vitro ve in vivo olarak kanıtlanmıştır (37). Aşı ile indüklenen HER-2 reaktif trastuzumab benzeri antikorlar, büyüme sinyali inhibisyonu ve internalizasyon yoluyla büyüme reseptörü downregülasyonu nedeniyle HER-2-aşırı eksprese eden insan SK-BR-3 hücre hatları üzerinde önemli tümör inhibitör etkileri de göstermiştir. Daha yakın zamanda, AAV-HER-2 aşısı, HER-2 transgenini ifade eden D2F2E2 tümör hücreleri ile aşılanmış BALB/c fare modelinde tümör büyümesini belirgin şekilde yavaşlatmıştır (39). Özellikle, farelerin hiçbirinde lokal veya sistemik reaksiyonlar veya iyi tanımlanmış trastuzumab ile ilişkili kardiyotoksisite dahil olmak üzere aşı ile ilişkili yan etki belirtileri görülmemiştir (40). |
3. Köpek meme karsinomunun insan hastalığına benzerliğiMeme bezi kompleksinin neoplazmları köpeklerde en sık görülen tümörler olup, özellikle kısırlaştırılmamış dişi hayvanlarda ortaya çıkmakta ve ortalama ilk görülme yaşı yaklaşık dokuzdur (41,42). Herhangi bir ırktan dişi köpeklerde görülme sıklığı %50 olarak tahmin edilmektedir ve bunların %40 ila 50’si malign teşhisi almaktadır (43). Bu kötü huylu tümörlerin tümü, lenfojen olarak bölgesel lenf düğümlerine ve akciğere ya da hematojen olarak doğrudan akciğere ve diğer uzak organlara metastaz yapma potansiyeline sahiptir (44). Metastaz yapan tümörler ve >3 cm tümör boyutu, sağkalım açısından kötü prognozla sonuçlanır (44). Diğer prognostik faktörler histolojik derece, tümörün farklılaşması ve östrojen ve/veya progesteron reseptörlerinin olup olmamasıdır (45,46). İnsan meme kanserine benzer şekilde, steroid-hormon reseptör ekspresyonu köpek meme bezi tümörlerinde sıktır ve bu reseptörler tümör gelişiminde önemli rol oynamaktadır (44,47-49). Ayrıca, p53 aşırı ekspresyonu ve mutasyonları, HER-2 aşırı ekspresyonu veya tümörün immünolojik mikroçevresi gibi diğer faktörler de belirgin şekilde benzerdir ve insan hastalığında olduğu gibi köpeklerde de benzer klinik korelasyonlar göstermektedir (17-21,44,50-53). Köpek ve insan meme bezi karsinomu arasındaki tartışılan patofizyolojik benzerliklere dayanarak, köpek kanser hastaları hastalık biyolojisinin incelenmesi ve özellikle yeni immünoterapilerin geliştirilmesi için potansiyel model hastalar olarak değerlendirilebilir. Halihazırdaki olağan tedavi seçenekleri öncelikle cerrahi, radyoterapi veya kemoterapidir (42,45). Ancak bunlar ideal tedavi yöntemleri olmaktan uzaktır ve sıklıkla ciddi yan etkilere yol açmaktadır (54-56). Bu nedenle köpek meme karsinomlarının tedavisi oldukça sınırlı kalırken hastalığın nüksetmesi de sık görülmektedir (44,57,58). Özetle, bu endikasyon için bugüne kadar ideal bir tedavi mevcut değildir ve pasif immünoterapi gibi insan klinik onkolojisinde yaygın olarak kullanılan tedavi seçenekleri henüz standart veteriner tedavisinde kullanılmamıştır. Yüksek moleküler homoloji nedeniyle, insan hastalar için geliştirilen yukarıda bahsedilen AAV HER-2 mimotop aşısı gibi HER-2’yi hedef alan bir aşının, köpeklerde köpek DER-2 ile çapraz reaktif olan ve tümörisidik etkilere neden olan fonksiyonel anti-HER-2 antikorlarını indükleyebileceğini tahmin ediyoruz. Dolayısıyla, böyle aktif bir immünoterapi, yüksek antikor özgüllüğüne sahip poliklonal immün yanıtı indükleyerek ve ek olarak immünolojik hafızayı indükleyerek yeni ve alternatif bir yöntem geliştirebilir (33). Köpek modeli hastalarda, kombine tedavi stratejileri olumlu bir şekilde test edilebilir. Spontan HER-2-pozitif meme bezi karsinomlu köpek kanser hastalarında yapılacak aşı çalışmasının, insan hastalar için indüklenmiş veya aşılanmış tümörlerle yapılan hayvan deneylerinden daha sağlam sonuçlar vermesi kuvvetle muhtemeldir. |
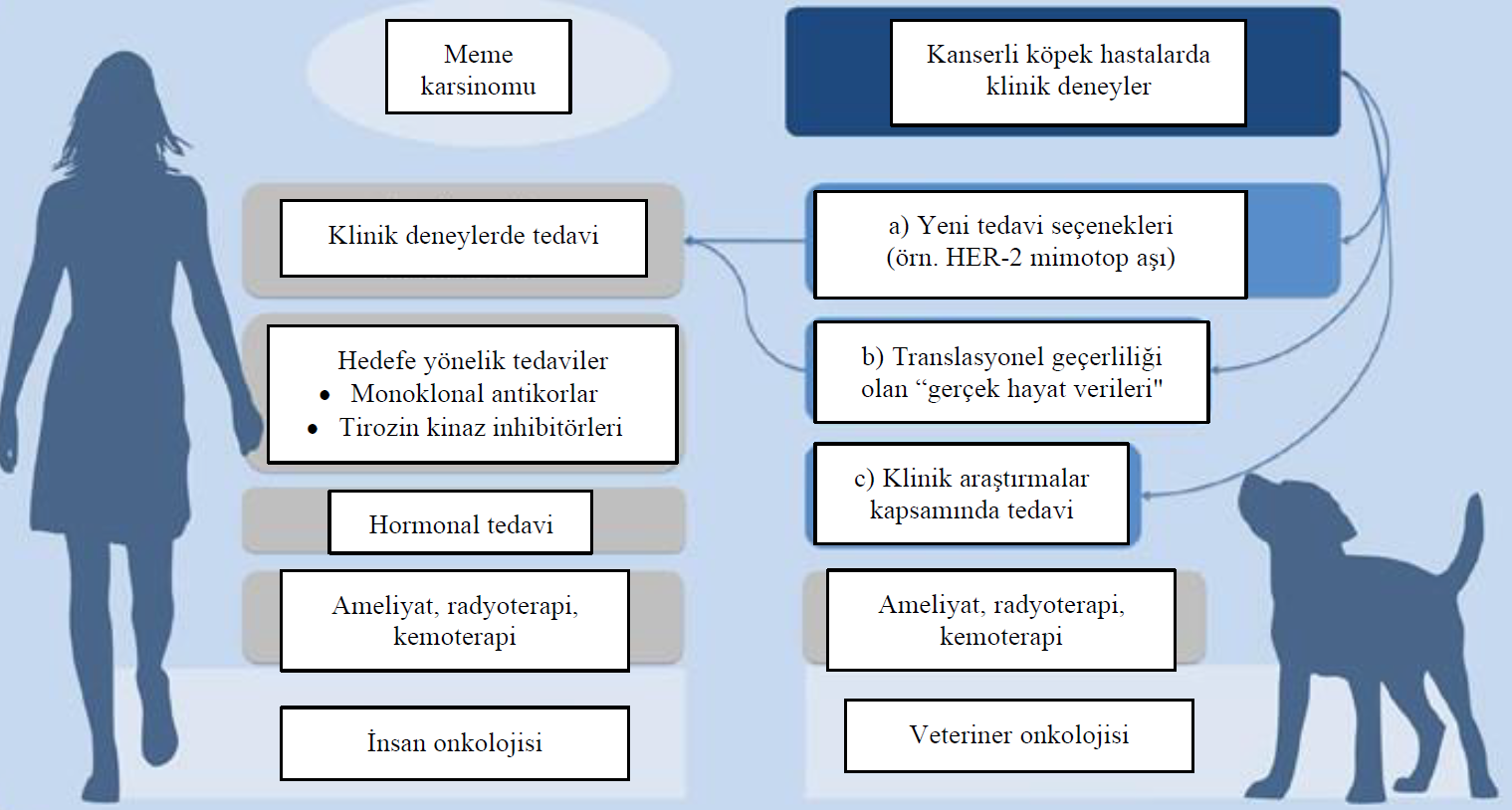
4. Translasyonel uygunlukDoğal nedenlerle kanser olan köpeklerin klinik bir araştırmaya katılarak sadece bireysel fayda sağlamakla kalmayacağı, aynı zamanda insan hastalığı için hayvan modeli hastalar olarak da rol oynayabileceği aşikardır (16,46). Şu anda, yeni anti-kanser ilaçlarının geliştirilmesi oldukça verimsiz bir prosedürdür; klinik faz I denemelerine giren yeni ajanların yalnızca %10,4’ü Gıda ve İlaç İdaresi tarafından onay almıştır (59). Yeni kanser ilaçları için durum daha da kötüdür; çoğunlukla antikanser biyolojiklerin düşük başarı oranı nedeniyle bu oran sadece %6,7’ye düşmektedir (59). Bir başka engel de bir bileşiğin geliştirilmesinin 15 yıla kadar sürebilmesidir (60). İlaç geliştirmenin olağan prosedürü, bilgisayarda yeni bir bileşik tasarlamak (bilgisayar destekli ilaç tasarımı) (61) ve bunu in vitro olarak test etmekle başlar. Hayvan deneylerinin mümkün olduğunca alternatif, ‘hayvansız’ yöntemlerle değiştirilmesi yasal bir zorunluluk olsa da (62), her ilacın en az iki hayvan türünde toksisite açısından test edilmesi gerekmektedir (61). Bu tür hayvan modelleri, insanlarda klinik çalışmalarda kullanılmadan önce farmakokinetik ve etkinlik hakkında önemli bilgiler elde etmek için de kullanılır (63). Bir ilaç tüm preklinik testleri geçerse, klinik geliştirme sağlıklı gönüllülerde (veya onkolojik faz I denemelerindeki hastalarda) faz 0/I çalışmalarıyla başlar, ardından insan hastalarda daha ileri klinik faz II-IV denemeleri yapılır (64,65). Ancak, insanlarla benzer spontan hastalıklara sahip hayvan hastalar, insan hastalıkları için ‘gerçek yaşam’ modelleri olarak hizmet edebilecek olmalarına ve hayvan deneylerinin laboratuvar ortamı ile ‘gerçek yaşam’ koşulları arasında eksik bir halka olmalarına rağmen, ilaç geliştirme sürecinde genellikle dışarıda bırakılmaktadır (66). Evcil hayvanlar, özellikle de köpekler, yalnızca benzer hastalık patofizyolojisine sahip olmakla kalmayıp, aynı zamanda insan sahiplerinin çevresel ortamını ve yaşam tarzını paylaşmakta ve dolayısıyla kanser de dahil olmak üzere insanlarla benzer hastalıklar geliştirmeye yatkın olmaktadır (67-69). İlaç etkinliği ve güvenliği doğal nedenlerle kanser olan hastalarda ele alınmalıdır, zira bu soruların sadece kemirgen modellerinde veya insan klinik çalışmalarında yanıtlanması zordur. Bu nedenle hayvan hastalarda yapılan araştırmalar sadece insan tıbbında veri üretimini tamamlamaya değil, aynı zamanda veteriner tıbbında kullanılmak üzere yeni ilaçlar oluşturmaya da yardımcı olabilir (70). Paoloni ve Khanna (16) tarafından açıklandığı üzere, SU11654 bileşiğinin köpeklerde ve sunitinibin (Sutent®; Pfizer Inc.) insan kanser hastalarında paralel olarak geliştirilmesi, insan ve veteriner onkolojisinde ajanların translasyonel gelişimi açısından iki disiplinin nasıl işbirliği yapabileceğine bir örnek teşkil edebilir. Köpek kanser hastasını insan hastalığı için hayvan modeli olarak kullanmanın bir diğer avantajı da yaşam süresinin nispeten daha kısa olması ve dolayısıyla hastalık gelişimi ve tedaviye yanıt süresinin daha kısa olmasıdır. Veteriner klinik deneylerinin sonuçlanmasına kadar geçen süre kemirgen modellerinde yapılan deneylerden daha uzun olsa da bu durum geçerliliğini korumaktadır (16,70). Bu zaman faktörü, evcil hayvan hastalarındaki klinik çalışmaların insan tıbbındaki normal faz I-III çalışma planlarıyla kısıtlanmaması ve yeni ilaçların hayvan hastalara başka herhangi bir geleneksel tedavi sağlanmadan önce sunulabilmesi ile daha da desteklenecektir (16). İnsan klinik deneylerinde elde edilmesi yıllar sürecek sonuçlar, köpek hastalarla nispeten kısa bir zaman diliminde keşfedilebilir ve ardından insanlara uyarlanabilir. Bununla birlikte, veteriner onkolojisinde yeni tedavi stratejilerinin ve özellikle hedefe yönelik tedavilerin klinik çalışmalarda test edilmesi, insan onkolojisinde olduğu kadar yaygın değildir. Finansal destek alma fırsatı oldukça nadirdir ve hayvan deneylerinden farkı da yasal olarak nadiren kabul edilmektedir (71). Genel olarak, bir ilacın insan vücudunda klinik olarak geliştirilmesi maliyet ve zaman açısından zahmetlidir. HER-2-pozitif meme kanseri ile ilgili olarak, DER-2-pozitif meme karsinomunun yüksek homolojisi ve spesifik hedeflemeye yanıt verebilirliği (21), köpek kanser hastalarının insan kanser hastaları için bir ‘gerçek yaşam modeli’ olarak hareket edebileceğini göstermektedir. Ayrıca, köklü terapötik stratejilerin insan onkolojisinden veteriner onkolojisine aktarılması, mevcut terapötik seçenekleri geliştirecektir (Şekil 1). |
5. Sonuç: Durum değerlendirmesiİnsanlar için mevcut olan tedaviler ile hayvanlar için mevcut olan tedaviler arasındaki farklar, özellikle onkoloji alanında çok belirgindir. Evcil hayvanlar için mevcut kanser tedavileri genellikle insan tıbbının bir adım gerisindedir. Bu nedenle, cerrahi, kemoterapi ve varsa radyoterapi, evcil hayvanlar için en yaygın uygulanan tedavi seçenekleridir. Bu arada, hedefe yönelik tedaviler, ya ruhsatlı tedaviler olarak ya da klinik geliştirme aşamasındaki ilaçlar olarak insan onkolojisinde vazgeçilmez tedavi seçenekleri haline gelmiştir. Özellikle kadınlarda HER-2-pozitif meme kanseri teşhisinin sonuçları açısından önemli bir değişiklik meydana gelmiştir. HER-2-pozitifliği eskiden kötü prognoz göstergesi olarak kabul edilirdi (3), ancak bu değerlendirme son 17 yılda tedavi sonuçlarını önemli ölçüde iyileştiren kişiselleştirilmiş anti-HER-2 tedavilerinin bulunması sayesinde tamamen değişmiştir (1,8,12). Karşılaştırmalı tıp, özellikle köpeklerdeki HER-2-pozitif meme tümörleri örneğinde olduğu gibi, insanlar ve evcil hayvanlar arasındaki karşılaştırmalarda, bir dizi hastalığın patofizyolojisinde giderek daha fazla benzerliği sistematik şekilde ortaya koymaktadır (17-21). Bu bilgi, yeni ilaçların eşzamanlı ve dolayısıyla daha hızlı geliştirilmesi yoluyla her alanda fayda sağlamak için kullanılabilir (72,73). Veteriner hekimlikte de kanser insidans oranları arttığından (74), hedefe yönelik tedavilerin geliştirilmesine büyük ihtiyaç duyulmaktadır. Bununla birlikte, insan monoklonal antikorlarının veteriner tıbbına basitçe uyarlanması bir seçenek değildir; immünojenisite ve advers reaksiyonları önlemek için her türe özel olarak uyarlanmaları gerekir. Şimdiye kadar sadece iki antikor köpek kanser hastalarında kullanılmak üzere ‘kaninize’ edilmiştir (26,27). Bu nedenle, trastuzumab benzeri immünoglobulinleri indükleyen AAVLP HER-2 mimotop aşısı geliştirme fikri, uygun maliyetli ve türden bağımsız bir alternatif olacaktır ve insan onkolojisi için de büyük ilgi görecektir. Hayvan hastalar için böyle yeni bir tedavi seçeneğinin klinik olarak geliştirilmesi, insan tıbbına da aktarılması için daha yüksek öngörü değerine sahip sağlam klinik ‘gerçek hayat’ verileri elde edilmesini sağlayacaktır. Sonuç olarak, karşılaştırmalı onkoloji ortamlarındaki klinik deneyler gelecekte artan bir öneme sahip olabilir, ancak bu sadece hayvanlar için geçerli değildir. Denemeler, insanlardaki uygulamalar için translasyonel kanıtlar sağlayabilir ve yeni kombinatoryal tedavilerin hızlı ve etkili bir şekilde doğrulanmasına olanak tanıyabilir. AAVLP-HER-2 mimotop yaklaşımı gibi antikanser aşıları özellikle etkili olabilir; HER-2 ve DER-2 örneğinde olduğu gibi hedef antijenin homolojisi yüksek olduğu sürece türlerden bağımsız olarak uygulanabilirler. |
Teşekkürler BölümüBu çalışma Avusturya Bilim Fonu projeleri P 23398-B11, W1205-B09 (Sağlık ve Hastalıkta Hücre İletişimi doktora programı) ve Biomedical International R+D GmbH (Viyana, Avusturya) tarafından desteklenmiştir. Yazarlar, orijinal makalenin redaksiyonu için Sayın Amelia Wein’e ( Üniversitelerarası Messerli Araştırma Enstitüsü, Viyana, Avusturya) teşekkürlerini sunmaktadır. |
Kaynakça
|