C. Agnoli*, S. Sabattini *, A. Ubiali *, E. Battisti*, F. Rossi†, A. Diana*, M. T. Camerino‡, S. Perfetti*, L. Ciammaichella*, D. Stefanello §, M. Papa¶, R. Zaccone * and L. Marconato *,1
*Veteriner Tıp Bilimleri Bölümü, Alma Mater Studiorum Bolonya Üniversitesi, Bolonya, İtalya
†Clinica Veterinaria dell’Orologio, Sasso Marconi (BO), İtalya
‡Veteriner Bilimleri Bölümü, Torino Üniversitesi, Torino, İtalya
§Milano Üniversitesi, Veterinerlik ve Hayvan Bilimleri Bölümü, Milano, İtalya
¶Clinica Veterinaria Gran Sasso, Milano, İtalya
1 İlgili yazarın e-posta adresi: laura.marconato@unibo.it
Amaçlar: Solid kanserli kemik metastazlı köpeklerde klinik özellikleri, tedaviyi, sonuçları ve prognostik faktörleri incelemek.
Materyal ve Metod: Histolojik olarak kanıtlanmış solid kanserli ve kemik metastazlı köpeklerin kayıtları incelendi. Klinikopatolojik değişkenler, kemik metastazlarının özellikleri ve iskeletle ilgili olaylar kaydedildi. Sonlanım noktası kemik metastazına kadar geçen süre ve sağkalımdı.
Sonuçlar: Çalışmaya 20’si senkron ve 30’u metakron kemik metastazı olan 50 köpek dahil edildi. İkinci grupta, kemik metastazlarının teşhisine kadar geçen ortalama süre 210 gündü (aralık, 30 ila 1835). En sık görülen primer kanser lokalizasyonları meme bezi (n=6), dalak (n=5) ve tonsil (n=5) idi. En yaygın histotipler karsinom (n=32) ve hemanjiosarkom (n=10) idi. On dokuz köpekte birden fazla kemik tutulumu vardı, humerus ve vertebra daha yaygın şekilde etkilenmişti. Yirmi dört köpek antitümöral tedavi almış, beşi semptomatik tedavi görmüş ve 21’i tedavi edilmemiştir. Kemik metastazı tanısından sonra genel ortalama sağkalım 30 gündü (aralık, 11 ila 49); köpeklerin %83’ü iskeletle ilgili sorunlar nedeniyle öldü. Antitümöral tedavi eksikliği daha kısa sağkalım (tehlike oranı: 2,7; %95 güven aralığı: 1,3 ila 5,6) ve iskeletle ilişkili ölüm riskinde artış (tehlike oranı: 3,3; %95 güven aralığı: 1,4 ila 7,4) ile istatistiksel olarak anlamlı şekilde bağlantılıydı. Endokrin/nöroendokrin tümörlü (tahmini risk oranı: 8,8; %95 güven aralığı: 1,2 ila 63,9), apendiküler metastazı olmayan (tahmini risk oranı: 5,1; %95 güven aralığı: 1,0 ila 25,8), iskelet dışı metastazı olmayan (tahmini risk oranı: 5,2; %95 güven aralığı: 1,1 ila 24,5) ve anti-tümöral tedavi alan (tahmini risk oranı: 14,8; %95 güven aralığı: 1,7 ila 131,4) hastaların hayatta kalma şansı 100 günden daha fazla olmuştur.
Çalışmanın klinik önemi: Solid kanserli köpeklerde kemik metastazları kötü prognoz ve iskeletle ilgili yüksek risk taşıyan olaylarla ilişkilidir. Tedavinin sağkalım üzerinde de etkisi olduğu görülmektedir.
GİRİŞ
İnsanlarda kemikler, solid maligniteler için en yaygın metastatik bölgelerden biridir (Norgaard ve ark. 2010, Li ve ark. 2012). Kemik metastazları (BM) son derece agresiftir ve ciddi morbiditeye neden olarak şiddetli kemik ağrısı, patolojik kırık, omurilik veya sinir kökü basısı, cerrahi veya radyoterapi zorunluluğu ve malign hiperkalsemi gibi iskeletle ilgili tipik olaylara (SRE’ler) yol açmaktadır (Sathiakumar et al. 2011, Yong et al. 2011, Sathiakumar et al. 2012, Sathiakumar et al. 2013). Ayrıca, BM gelişimi genel sağkalımda (OS) kısalmaya neden olmaktadır. Hedefe yönelik tedaviler ve zoledronik asit dahil olmak üzere özellikle BM’yi tedavi etmeyi amaçlayan ilaçlar insan tıbbında kullanılabilir hale gelmiştir ve hastalara klinik fayda sağlayabilir (Lipton ve ark. 2000, Rosen ve ark. 2004, Schultz ve ark. 2007, Lipton & Balakuma- ran 2012). Köpeklerde BM’nin palyatif tedavisi için bifosfonatlar üzerine sadece bir çalışma yayınlanmıştır (Fan ve ark. 2005), bununla birlikte birkaçı primer kemik tümörü (örn. osteosarkom) olan köpek hastalarda etkinliklerini kanıtlamıştır (Spugnini ve ark. 2009, Suva ve ark. 2021).
Antikanser tedavisinin kanserli köpeklerin yaşam süresini iyileştirmesiyle birlikte, kişisel klinik izlenimimiz BM’nin de veteriner hekimlikte yeni ortaya çıkan bir sorun haline geldiğidir.
Köpeklerde BM en sık meme karsinomu (Trost ve ark. 2014, Charney ve ark. 2016), pulmoner karsinom (Trost ve ark. 2014), ürotelyal karsinom (Cooley ve Waters 1998, Charney ve ark. 2016, Melilli 2020) ve prostatik adenokarsinom (Michalak ve ark. 2021) olarak rapor edilmiştir. Literatüre göre, en çok humerus ve vertebra etkilenmektedir (Trost ve ark. 2014, Charney ve ark. 2016).
Şu anda, ilerlemiş solid tümörleri olan köpeklerde BM’ye odaklanan klinik çalışmalar henüz mevcut değildir. Benzer şekilde, tıbbi tedavi, radyoterapi ve cerrahi gibi terapötik müdahalelerin BM’li köpeklerin klinik seyrini ve SRE’lerin gelişimini nasıl etkileyebileceği bilinmemektedir. Prognozun tarihsel olarak kötü olduğu düşünülse de, eski verilere dayanarak yayınlanan tahminler, son tedavi gelişmeleri ışığında sağkalım eğilimlerini doğru yansıtmıyor olabilir. Uzun takip sürelerine dayanan sağkalım verileri de literatürde nadiren rapor edilmektedir.
Bu amaçla, solid kanser taşıyan BM’li köpeklerde klinik özellikleri, tedavi yöntemlerini ve potansiyel olarak etkili olan ve prognostik faktörleri gözden geçirmek için retrospektif çok merkezli bir çalışma gerçekleştirdik.
MATERYAL VE METOD
İtalya merkezli beş veteriner hastanesi veya kliniğinin elektronik tıbbi kayıtları, solid kanser ve BM tanısı konan köpekleri bulmak için retrospektif olarak incelenmiştir. Ocak 2012 ve Mayıs 2022 tarihleri arasında rapor edilen tüm ardışık BM vakaları, her hastaneden bir yazar tarafından alındı. Arama terimleri arasında “metastaz”, “metastatik”, “kemik” ve “iskelet” vardı. BM tanısı çeşitli görüntüleme yöntemlerine göre konmuş ve sitoloji veya histoloji ile doğrulanmıştı.
Şu klinikopatolojik değişkenler analiz edilmiştir: karakteristik özellikler (ırk, yaş, cinsiyet, ağırlık), primer kanser bölgesi, histotipi ve evresi, primer kanser tedavisi. BM’nin kaydedilen özellikleri arasında primer kanser tanısından BM’nin tanımlanmasına kadar geçen süre, metakron BM’li köpeklerde hastalığın boyutu (sadece uzak metastaz veya uzak metastaz ve lokorejyonel hastalık), ekstraosseöz metastaz varlığı, BM sayısı, BM bölgeleri, radyografi veya BT’deki paternler, BM’nin ortaya çıkışındaki semptomlar, BM’nin geliştiği sıradaki SRE’ler ve BM tedavisi (hiç tedavi görmemiş vs semptomatik veya antitümöral) yer almıştır.
İnsan tıbbında metakron metastazların takip süresi boyunca herhangi bir zamanda (histotipe ve çalışma tasarımına bağlı olarak birincil kanser teşhisi konulduktan sonra 1 aydan 6 aya kadar) ortaya çıkan metastaz şeklinde tanımlanması göz önünde bulundurulduğunda, bu çalışmada metakron metastaz ihtiyari olarak primer kanser teşhisi konulduktan sonra >30 gün veya daha uzun bir süre içinde tespit edilen BM şeklinde tanımlanmıştır. İlk solid tümör teşhisinden önceki veya sonraki 30 gün içinde BM teşhisi konulan köpekler senkron metastaz olarak kabul edilmiştir.
Radyografi veya BT görüntülerindeki morfolojik paternler osteolitik, mikst ve osteoproliferatif/osteosklerotik tipler olarak sınıflandırılmıştır.
SRE’ler patolojik kırıklar, omurilik komplikasyonu, malign hiperkalsemi (BM’li köpeklerde nadiren görülür) veya semptomatik BM sebebiyle radyoterapi veya cerrahi operasyon zorunluluğu şeklinde tanımlanmıştır (Coleman 1997).
BM teşhisi sırasında kaydedilmişse değerlendirilen ek değişkenler arasında laktat dehidrojenaz (LDH), alkalin fosfataz (ALP), kalsiyum ve kolesterol serum seviyeleri yer almıştır. Zaman aralığı laboratuvarlar genelinde biraz farklılık gösterdiğinden, laboratuvar test sonuçları her bir kurum tarafından sağlanan referans sınırlarının altında, üstünde veya normal şeklinde tanımlanmıştır.
Hematolojik tümörleri (multipl miyelom, plazmasitom ve lenfoma dahil) veya osteosarkomu olan köpekler çalışmaya dahil edilmemiştir. Ayrıca, BM tanısından sonraki 30 gün içinde kaydedilmiş birden fazla senkron primer (yani iki veya daha fazla farklı tümör tipi) varsa köpekler çalışmaya dahil edilmemiştir.
Sağkalım verileri tıbbi kayıtlardan ve gerektiğinde köpek sahipleri ya da sevk eden veteriner hekimlerle yapılan telefon görüşmelerinden elde edilmiştir.
İstatiksel analiz
Kategorik değişkenler sıklık (yüzde) olarak özetlenirken, sayısal değişkenler ortalama (aralık) olarak özetlenmiştir. Sayısal verilerin normal olup olmadığı Shapiro-Wilk testi kullanılarak değerlendirilmiştir.
BM’ye kadar geçen süre (TTBM) primer tümör ile BM tanısı arasındaki süre olarak tanımlanmıştır.
Sağkalım süresi, BM tanısı tarihinden herhangi bir nedenden ölüm tarihine veya veri toplama işleminin sonuna kadar olacak şekilde tanımlanmıştır. OS için, herhangi bir nedenden ölen köpekler vaka olarak kabul edilmiştir; kemik metastazlarıyla ilişkili sağkalım (BMRS) için, sadece BM ile ilişkili nedenlerden ölen köpekler vaka olarak kabul edilmiştir. Sağkalım tahminleri ortalamalar ve %95 güven aralıkları (CI) olarak hesaplanmıştır.
Cinsiyet, yaş, kilo, primer kanser lokalizasyonu, histotip, iskelet dışı metastaz varlığı, hematolojik anormallikler, semptom varlığı, patolojik kırıklar, BM sayısı, BM bölgeleri, BM incelemesinde kullanılan görüntüleme türü ve görüntülemedeki osteoproliferatif patern gibi potansiyel prognostik değişkenlerin TTBM üzerindeki etkisini değerlendirmek için tek değişkenli ve çok değişkenli Cox orantılı tehlikeler regresyon analizi yapılmıştır. Yukarıda belirtilen değişkenlerin yanı sıra senkronize BM varlığı, BM için antitümöral tedavi uygulanması ve bifosfonat uygulanmasının etkisi, OS ve BMRS için tek değişkenli ve çok değişkenli analizlerde değerlendirilmiştir. Sürekli değişkenler olan yaş ve vücut ağırlığı, sonlanım noktası olarak ortalama değer kullanılarak dikotom değişkenlere dönüştürülmüştür. Tek değişkenli testlerde istatistiksel olarak anlamlı P-değerine sahip değişkenler çok değişkenli (düzeltilmiş) regresyon modeline dahil edilmiştir.
Ayrıca, listelenen değişkenlerin senkron metastaz geliştirme ve BM tanısından itibaren 100 gün içinde ölme riski üzerindeki etkisini değerlendirmek için tek değişkenli ikili lojistik regresyon uygulanmıştır. Değişkenlerin etki büyüklüğü %95 CI’larla birlikte tahmini risk oranları (OR’ler) ile ifade edilmiştir.
Sağkalım eğrileri Kaplan-Meier çarpım sınırı yöntemi ile oluşturulmuş ve antitümöral BM tedavisi alan ve almayan köpekler arasında log-rank testi ile karşılaştırılmıştır.
Veriler SPSS v.26 (SPSS, Inc., IBM, Chicago, IL, ABD) ile analiz edilmiştir. P-değerleri ≤0.05 ise anlamlı kabul edilmiştir.
SONUÇLAR
Veri tabanı araştırması sonucunda BM olduğu varsayılan 76 köpek tespit edilmiş ve bunların tamamı uygunluk açısından değerlendirilmiştir. Yirmi altı köpek eksik klinik kayıtlar (13), sitolojik/histolojik doğrulama eksikliği (12) veya birden fazla primer tümör kanıtı (bir) nedeniyle çalışma dışı bırakılmıştır.
Toplamda 50 kemik metastatik köpek çalışmaya dahil edilme kriterlerini karşılamıştır. Bu köpeklerin 15’i (%30) melez, 35’i (%70) saf ırktı. En çok saf ırk olarak Rottweiler (n=4; %11,8), Labrador retriever (n=4; %11,8) ve boxer (n=3; %8,8) bulunurken, 20 diğer ırk bir veya iki kez görülmüştür.
Yirmi beş (%50,0) köpek erkek (kısırlaştırılmamış, n=17; kısırlaştırılmış, n=8) ve 25 (%50,0) köpek dişiydi (kısırlaştırılmamış, n=4; kısırlaştırılmış, n=21). Ortalama yaş 10 yıl (dağılım, 6 ila 15) ve ortalama ağırlık 30,0 kg (dağılım, 3,3 ila 51) idi.
BM tanısı konduğunda, 41 (%82,0) köpek semptomatikken, kalan 9 (%18,0) köpekte BM tesadüfi bir bulguydu. Başlıca semptomlar topallık (n=31), ağrı (n=8), felç veya parezi (n=3), depresyon veya asteni (n=3) ve rektal tenesmus (n=1) idi.
Primer kanser bölgeleri arasında meme bezi (n=6; %12,0), dalak (n=5; %10,0), tonsil (n=5; %10,0), karaciğer (n=4; %8,0), prostat (n=4; %8,0), üretra (n=3; 6,0%), kalp (n=3; 6,0%), deri (n=2; 4,0%), anal kese (n=2; 4,0%), tükürük bezi (n=2; 4,0%), böbrek üstü bezi (n=2; 4,0%), akciğerler (n=2;
4,0%) ve birer (%2,0) tiroid bezi, böbrek, idrar kesesi, kas, bağırsak, ağız boşluğu, retroperiton, vajina, karotis glomu ve primeri bilinmeyen kanser (MCUP) yer almaktaydı. En yaygın histotipler karsinom (n=32; %64,0) ve hemanjiosarkom (n=10; %20,0) olup, bunları leiomyosarkom (n=2; %4,0), melanom (n=2; %4,0), kemodektom (n=2; %4,0), histiyositik sarkom (n=1; %2,0) ve feokromositom (n=1; %2,0) takip etmiştir.
BM tanısı konduğunda, 36 (%72) köpekte daha önce veya eş zamanlı iskelet dışı metastazlar vardı. Bunların 13’ünde nodal metastaz, 12’sinde visseral metastaz ve 11’inde her ikisi birden vardı. 13 (%26,0) köpekte iskeletin tek metastatik bölge olduğu görülmüştür. Bunlar arasında karsinom (n=7), hemanjiosarkom (n=3), kemodektoma (n=2) ve dalak leiomyosarkomu (n=1) yer aldı. 1 (%2) vakada iskelet dışı tutulum değerlendirilememiştir.
BM teşhisi sırasında, 31 (%62,0) köpekte soliter BM ve 19’unda (%38,0) çoklu kemik metastatik hastalığı vardı ve görüntüleme çalışmalarında metastaz bölgesi olarak toplam 105 kemik tespit edildi. Etkilenen tüm kemikler dikkate alındığında, en yaygın bölge humerus (n=26; %24,8) olurken, bunu vertebra (n=25; %23,8), kaburga (n=14; %13,3), pelvis (n=10; 9,6), femur (n=9; %8,6), skapula (n=4; %3,8), radius (n=4, %3,8), ulna (n=4, %3,8), tibia (n=4, %3,8), sternum (n=4, %3,8) ve mandibula (n=1, %1,0) takip etmiştir.
Overall, lesions involved the axial skeleton alone in 11 (22.0%) dogs, the appendicular skeleton alone in 28 (56.0%) and both in 11 (22.0%) dogs.
Azalan sırayla, 47 apendiküler bölge arasında BM humerusta (n=26; %55,3; n=23 proksimal metafiz, n=3 diyafiz), femurda (n=9; %19,2; n=5 proksimal metafiz, n=3 diyafiz, n=1 distal metafiz), radiusta (n=4; 8,5; n=2 distal metafiz, n=1 diyafiz, n=1 proksimal metafiz), ulnada (n=4; %8,5; n=2 metafiz, n=1 proksimal metafiz, n=1 distal metafiz), tibiada (n=4; %8,5; n=2 distal metafiz, n=1 diyafiz, n=1 proksimal metafiz) tespit edilmiştir.
BM’nin değerlendirilmesi için kullanılan görüntüleme teknolojisi 29 (%58,0) köpekte genel anestezi altında çekilen tüm vücut BT (TBCT) ve geri kalan 20 (%40,0) köpekte düz radyografileri içerirken, bir (%2) vakada görüntüleme tekniği kaydedilmemiştir. BM 34 köpekte (%68,0) osteolitik, 15 köpekte (%30,0) mikst ve bir köpekte (%2,0) osteoproliferatifti. BM’nin doğrulanması 31 (%62,0) vakada sitoloji ve kalan 19 (%38,0) köpekte histopatoloji yoluyla elde edilmiştir.
BM teşhisi sırasında 39 (%78,0) köpeğin serum ALP konsantrasyonu mevcuttu. Bunların arasında 13’ünde (%33,3) seviye yüksekti.
35 köpeğin (%70,0) serum kolesterol konsantrasyonu mevcuttu. Bunlar arasında sadece bir tanesinde (%2,9) seviye yüksekti.
32 köpeğin (%64,0) serum LDH konsantrasyonu mevcuttu. Bunların arasında altı tanesinde (%18,8) seviye yüksekti.
30 köpeğin (%60,0) iyonize kalsiyum seviyesi mevcuttu. Bunlar arasında sadece bir tanesinde (%3,3) seviye artışı tespit edilmiştir.
Genel olarak, 22 (%44,0) köpek patolojik kırık (n=8), RT zorunluluğu (n=5), cerrahi müdahale gerekliliği (n=4), omurilik sıkışması (n=4) ve malign hiperkalsemi (n=1) dahil olmak üzere SRE’ler yaşamıştır.
BM tedavisi ile ilgili olarak, 24 (%48,0) köpek kemoterapi (5-fluorurasil içeren veya içermeyen platin bileşiği) ve/veya toceranib (Palladia; Zoetis) (n=15; 5’i ayrıca bifosfonat almıştır), radyoterapi (n=5; 3’ü ayrıca metronomik tedavi almıştır) ve cerrahi (n=4; 2’si ayrıca metronomik tedavi almıştır) dahil olmak üzere antitümöral tedavi almıştır.
Karboplatin (Carboplatin-Teva; Teva S.r.l.) 3 haftada bir 300 mg/m2 dozunda IV olarak uygulanırken, sisplatin (Cisplatin-Teva; Teva S.r.l.) haftada bir 150 mg/m2 dozunda IV olarak uygulanan 5-florourasil (Fluorouracil-Teva; Teva S.r.l.) ile birlikte 3 haftada bir 70 mg/m2 dozunda IV olarak uygulanmıştır.
Toceranib, etkili olduğu düşünülen süre boyunca Pazartesi-Çarşamba-Cuma programında 2,2 ila 2,5 mg/kg dozunda oral olarak uygulanmıştır.
Metronomik tedavi siklofosfamid (günde 10 mg/m2), talidomid (günde 4 mg/kg) ve piroksikamdan (günde 0,3 mg/kg) oluşmuştur.
Harici ışın radyasyon tedavisi 6 MV lineer hızlandırıcı ile fotonlar (üç boyutlu konformal radyasyon tedavisi, n=2) veya elektronlar (n=3) kullanılarak verilmiştir. Köpekler 3 hafta boyunca haftada bir, iki veya üç kez uygulanan palyatif amaçlı hipofraksiyone radyasyon protokolü ile tedavi edilmiştir. Toplam dozlar 20.0 ila 30.4 Gy arasında değişmiştir. Fraksiyon sayıları 3 ila 8 arasında ve fraksiyon boyutları 3,8 ila 8,0 Gy arasında değişmiştir.
Beş köpek (%10,0) anti-enflamatuar ilaçlar (firocoxib, Previcox – Boehringer; piroxicam, Feldene – Pfizer S.r.l.; carprofen, Canidryl – Chanelle Medical; prednisone, Prednicortone – Dechra S.r.l. dahil), tramadol (Tralieve; Dechra), gabapentin (Gabapentin Teva Pharma; Teva S.r.l.) ve/veya amantadinden (Mantadan; Hikma S.p.A.) oluşan semptomatik tedavi almıştır.
Yirmi bir (%42,0) köpeğe herhangi bir tedavi uygulanmamıştır.
Sonuç verileri ve prognostik faktörlerin analizi
Veri analizi tamamlandığında, BM gelişimini takiben 25 günlük (aralık, 10 ila 97) ve primer kanser tanısından itibaren 389 günlük (aralık, 20 ila 1932) ortalama takip süresinin ardından 46 (%92,0) köpek ölmüş ve 4 (%8,0) köpek hala hayattaydı.
BM tanısından sonra ortalama OS 30 gündü (%95 CI, 12 ila 48); 46 köpekten 38’i (%82,6) geçmeyen ağrı (n=28) ve/veya patolojik kırık (n=6) ve/veya sinir kökü/omurilik sıkışması (n=4) dahil olmak üzere SRE’ler nedeniyle ötenazi edildi.
Dokuz köpek (%19,6) BM geliştikten sonra 100 günden daha uzun süre hayatta kalmıştır. BM gelişiminden itibaren bir yıllık sağkalım oranı %2’dir.
Antitümöral veya semptomatik tedavi gören 29 köpekten 15’i (%51,7), sahipleri tarafından bildirildiği üzere yaşam kalitesinde iyileşme şeklinde tanımlanan klinik fayda gördüğü bildirilmiştir.
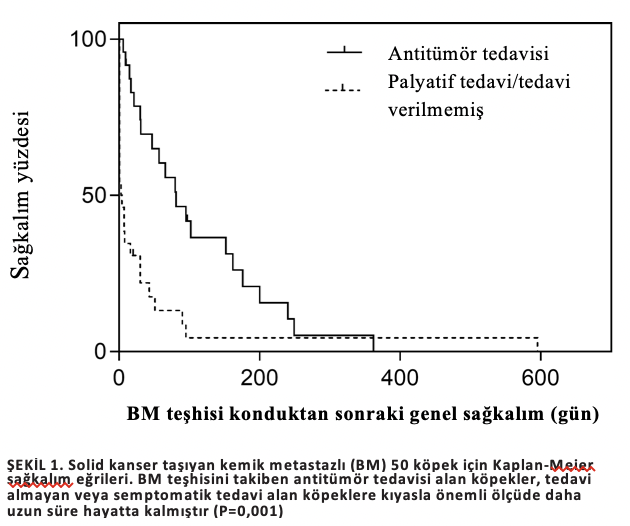
Antitümör tedavisi alan köpekler için ortalama OS (81 gün; %95 GA, 38 ila 124), semptomatik tedavi alanlara (43 gün; %95 GA, 15 ila 71) ve tedavi edilmeyen köpeklere (5 gün; %95 GA, 1 ila 24; P=0,001; Şekil 1) kıyasla önemli ölçüde daha uzundu.On univariable analysis, none of theinvestigated variables was significantly associated with TTBM.
Yaşı ≤10 olan [tehlike oranı (HR): 2.0; %95 GA: 1.1 ila 3.7; P=0.028], endokrin/nöroendokrin olmayan primer tümörlü (HR: 3.4; %95 GA: 1.0 ila 11.6; P=0.046), senkron metastazlı (HR: 1.9; %95 GA: 1.0 ila 3.5; P=0.047), ilaveten iskelet dışı metastazlı (HR: 2. 4; %95 GA: 1.1 ila 4.9; P=0.021), proksimal humerus tutulumu olan (HR: 2.0; %95 GA: 1.1 ila 3.7; P=0.031) ve BM için antitümöral tedavi almayan (HR: 2.6; %95 GA: 1.4 ila 4.8; P=0.003) köpeklere BM tanısı konulduktan sonra daha kısa OS ile istatistiksel olarak anlamlı şekilde ilişkilendirilmiştir. Çok değişkenli analizde yalnızca antitümöral tedavinin olmaması prognostik önemini korumuştur (HR: 2.7; %95 GA: 1.3 ila 5.6; P=0.009).
İskeletle ilişkili ölüm riskinde artışla istatistiksel olarak anlamlı şekilde bağlantılı değişkenler arasında ≤10 olmak üzere yaş (HR: 2.3; %95 GA: 1.2 ila 4.5; P=0.013), endokrin olmayan/nöroendokrin primer tümörler (HR: 4.3; %95 GA: 1.0 ila 18.7; P=0. 049), proksimal humerus tutulumu (HR: 2.1; %95 GA: 1.1 ila 4.2; P=0.024), iskelet dışı metastaz (HR: 2.2; %95 GA: 1.1 ila 4.8; P=0.049) ve antitümöral tedavi uygulanmaması (HR: 2.8; %95 GA: 1.4 ila 5.5; P=0.003) vardı. Çok değişkenli analizde yalnızca antitümöral tedavi eksikliği prognostik önemini korumuştur (HR: 3.3; %95 GA: 1.4 ila 7.4; P=0.005).
Endokrin/nöroendokrin primer tümörlü [tahmini risk oranı (OR): 8.8; %95 GA: 1.2 ila 63.9; P=0.032], apendiküler metastazı olmayan (OR: 5.1; %95 GA: 1.0 ila 25.8; P=0.048), iskelet dışı metastazı olmayan (OR: 5. 2; %95 GA: 1.1 ila 24.5; P=0.043) ve antitümöral tedavi alanların (OR: 14.8; %95 GA: 1.7 ila 131.4; P=0.016) BM sonrası hayatta kalma şansı 100 günden fazla artmıştır.
Senkronize BM’li köpeklerin TBCT ile değerlendirilme olasılığı (OR: 4,9; %95 GA: 1,3 ila 18,4; P=0,018) ve proksimal humerus (OR: 3,7; %95 GA: 1,1 ila 12,2; P=0,031) dahil olmak üzere birden fazla kemik tutulumuna (OR: 4,1; %95 GA: 1,1 ila 15,1; P=0,034) sahip olma olasılığı daha yüksekti.
TARTIŞMA
Bu klinik çalışma, İtalya’daki 5 onkoloji muayenehanesinden alınan elektronik tıbbi kayıt verilerini kullanarak solid tümörlü köpekler arasında BM’nin klinikopatolojik özelliklerini ve tedavi stratejilerini tanımlamayı amaçlamıştır. Bugüne kadar, BM’li köpekler için standart bir tedavi bulunmamaktadır. Bu nedenle, daha iyi prognoza sahip köpeklerin belirlenmesi, tedavi seçeneklerinin seçilmesine yardımcı olabilir.
Yüksek kan akışı nedeniyle kemik, dolaşımdaki kanser hücrelerinin yerleşmesine, hayatta kalmasına ve çoğalmasına olanak tanıyan ve nihayetinde klinik olarak ilgili metastazın gelişmesine yol açan çekici bir ortam sağlıyor gibi görünmektedir. Mevcut seride, meme bezi köpeklerin %12’sinde görülen en yaygın primer tümör bölgesidir. Bu, hem köpeklerde (Trost ve ark. 2014) hem de meme ve prostat karsinomunun BM’nin çoğunluğunu oluşturduğu insanlarda (Hage ve ark. 2000, Jiang ve ark. 2020) önceki verilerle uyumludur.
Ayrıca, bu çalışmada meme tümörü olan köpeklerin >%80’i için BM ilk ve tek uzak metastatik bölgeyi temsil etmiştir. Bu köpeklerin >%80’inde BM metakroniktir ve daha sık olarak apendiküler iskeleti tutan osteolitik lezyonlar şeklinde ortaya çıkmıştır. Bu sonuç, bu hastaların yeniden evrelendirilmesinde gelişmiş tanısal görüntülemeye duyulan ihtiyacı yansıtmaktadır. Meme bezinin yanı sıra dalak, tonsiller, karaciğer ve prostat da mevcut seride %36’ya varan oranlarda BM’nin çoğundan sorumludur.
Serimizdeki meme ve diğer karsinomların daha sık görülmesi, Paget (1889) tarafından önerilen tohum ve toprak teorisini desteklemektedir; buna göre spesifik kanserler belirli bölgeleri kolonize etme eğilimindedir (Nguyen ve ark. 2009). Gerçekten de, malign hücrelerin (tohum) moleküler özellikleri ve kemik mikroçevresi (toprak) ile karşılıklı etkileşimleri tümörlerin metastatik yayılımını sağlamada büyük önem taşımaktadır. Bu özellikler hem hücre kökenine (histotip) hem de bireysel neoplastik klonların içsel özelliklerine göre değişebilir. Hemanjiyosarkomlar en sık görülen ikinci tümör tipidir. Bu grupta, eş zamanlı uzak iskelet dışı metastazlar yaygın olarak gözlenmiş ve daha kısa BM gecikme süreleri ile birlikte, oldukça agresif doğasını ve hematojen olarak birçok organa ulaşma yeteneğini doğrulamıştır.
Yayınlanan literatürle uyumlu olarak, humerus ve vertebra en sık etkilenen kemikler olmuştur (Trost ve ark. 2014, Charney ve ark. 2016). Mevcut çalışmada, uzun kemik metastazı (%57,2) aksiyal iskelet metastazından (%20,4) daha yüksek oranda görülmüştür. Köpeklerin %22,4’ünde hem uzun kemik hem de aksiyal iskelet metastazı vardı. Bu bulgu dikkatle yorumlanmalıdır. Aksiyel iskelet metastazı asemptomatik olabilir ve düz radyografiler teşhis amaçlı tarama olarak kullanıldığında tespit edilemeyebilir, dolayısıyla prevalansları düşük tahmin edilebilir.
Apendiküler iskeletteki metastatik lezyonların, muhtemelen bir nutrient foramene yakınlığı nedeniyle sıklıkla diyafizi etkilediği yaygın bir görüştür (Ehrhart ve ark. 2020).
Ancak bu veriler yayınlanmış çalışmalarla desteklenmemekte, sadece ders kitaplarında bildirilmektedir. Mevcut seride, BM’nin dağılım paterni, apendiküler lezyonların %66’sının proksimal metafizde, %21’inin diyafizde ve %13’ünün distal metafizde yer aldığını göstermiştir.
Çeşitli anatomik ve biyolojik nedenler, kemik ekstremitelerinin metastatik tutulumunun yüksek prevalansını açıklayabilir. Metafiz bölgesini besleyen küçük ve sinüzoidal damarlardaki yavaş kan akışı, metastatik kanser hücrelerinin sıkışmasını teşvik edebilir (Welch ve ark. 2003, Glinsky 2006). Ayrıca, metafizer bölge, kemiğin trabeküler yapısı, büyüme faktörleri, sitokinler ve kemokinlerin zenginliği nedeniyle kanser hücrelerinin tohumlanması için ideal bir mikro çevre oluşturur (Phadke ve ark. 2006, Shupp ve ark. 2018).
Olguların %20’sinde aksiyel metastaz meydana gelmiştir. Aksiyel iskelet, sinüzoidal vasküler boşluklar ve penetrasyon için nispeten daha hafif bariyer nedeniyle metastatik kanser hücreleri için cazip bir bölge olan aktif kırmızı ilik barındırır (Nakamoto ve ark. 2003).
BM tanısı için en yaygın görüntüleme yöntemi TBCT idi. Kanserlerin çoğu osteolitik BM ile sonuçlanmış olup, bu köpeklerde osteoblastik aktivitenin bir belirteci olan ALP aktivitesinin artmamasının da gösterdiği gibi, söz konusu tablodaki dengenin birikimden çok kemik yıkımına kaydığını göstermektedir (Pagani ve ark. 2005). Osteolizin, kanserin kendisinin doğrudan bir etkisinden ziyade osteoklastik aktiviteden kaynaklandığına inanılmaktadır (Roodman 2004, Rove & Crawford 2009). Osteoliz, köpekleri patolojik kırıklar ve diğer müteakip SRE’ler açısından risk altına sokar.
Sekiz köpek BM bakımından asemptomatiktir ve BM tanısı primer kanserin evreleme çalışması sırasında tesadüfen konulmuştur. BM derin yerleşimli lezyonlardır ve metastatik yayılımın erken evresinde belirgin semptomlar olmayabilir. Zira, bu sekiz köpekten altısına TBCT uygulanmıştır: özellikle aksiyel iskelet için, evreleme sadece radyoloji ve ultrason ile yapıldıysa, BM insidansının daha önce tahmin edildiği gibi düşük tahmin edilmiş olması muhtemeldir. Gelişmiş görüntüleme yöntemleri yaygın olarak kullanılabilir hale geldikçe, BM insidansı muhtemelen artacak ve zamanında tanı konulması halinde bu hastaların klinik tedavisi için daha fazla alan açılacaktır.
BM gelişimi kötü prognozla ilişkilendirilmiştir, çünkü ortaya çıktıktan sonra hayatta kalma süresi kısadır ( ortalama 30 gün) ve köpeklerin yalnızca %18’i >100 gün hayatta kalabilmiştir. SRE’ler, BM gelişimini takiben artan ölüm riskinde önemli bir rol oynayabilir.
Çok değişkenli sağkalım analizi yaş, kilo ve antitümör tedavi eksikliğinin prognozu önemli ölçüde etkilediğini göstermiştir.
BM’li köpeklerin prognozunda yaşın rolü daha önce değerlendirilmemiştir. Mevcut bulgulara göre, ≤10 yaşındaki köpeklerde tümöre bağlı ve SRE’ye bağlı ölüm riski önemli ölçüde artmıştır, bu da ilerleyen yaşta BM tümörünün agresif doğasını kaybedebileceğini düşündürmektedir. Aynı eğilim insan tıbbında meme kanseri ve akciğer kanseri için de gösterilmiştir (Riihimäki ve ark. 2014, Frank ve ark. 2020).
Daha yavaş hücre çoğalması (Holbrook & Ikeyama 2002), tümörle ilişkili anjiyogenezin azalması (Reed ve ark. 2007) ve immün sistemin değişmesi (Purushotham ve ark. 2014) dahil olmak üzere, yaşlı hastalarda agresifliğin azalmasıyla ilgili çeşitli mekanizmalar öne sürülmüştür. Bunun aksine, bağışıklığı güçlü genç bireylerde primer tümör daha agresif bir başlangıç gösterebilir ve bağışıklık sisteminden kaçma potansiyeli daha yüksek olabilir, bu da daha erken metastatik yayılmaya yol açabilir (Frank ve ark. 2020).
Daha yüksek ağırlığın apendiküler osteosarkom için predispozan bir faktör olduğu (Ru ve ark. 1998) ve yassı ve düzensiz kemiklerin osteosarkomu olan köpeklerde olumsuz bir prognostik faktör olduğu savunulmuştur (Hammer ve ark. 1995, Makielski ve ark. 2019). Osteosarkoma katkıda bulunduğu düşünülen ağırlık taşıyan kemikler üzerindeki aynı mekanik ve fonksiyonel streslerin, doğrulayıcı çalışmalar olmamasına rağmen, BM gelişimini de etkileyebileceği varsayılabilir. Ayrıca, artan ağırlık, daha kırılgan olan bir kemik üzerindeki ağır yükün sonucu olarak patolojik kırıklar da dahil olmak üzere, BM’li hastalarda daha yüksek SRE görülme riskinden de sorumlu olabilir. Son olarak, komorbid durumların daha yüksek prevalansı ve BM gelişimini takiben hastanın daha zor tedavi edilmesi, yüksek kilolu hastalarda mortalite riskinin artmasında önemli bir rol oynayabilir.
Genel olarak, bazı antitümöral tedavi biçimleri uygulanan köpekler, semptomatik tedavi uygulanan (ortalama 43 gün) veya hiç tedavi uygulanmayan (ortalama 5 gün) köpeklere göre önemli ölçüde daha uzun süre (ortalama 81 gün) hayatta kalmıştır. Ayrıca, tedavi edilen köpeklerin yaklaşık %50’sinin klinik fayda gördüğü, diğer yarısının ise analjezik tedavi kullanılmasına rağmen hala ağrı çektiği vurgulanmalıdır.
Mevcut çalışmada, BM teşhisi sonrası prognoz da primer kanser türüne bağlıydı. Endokrin/nöroendokrin kanserli köpeklerin BM gelişiminden itibaren 100 günden fazla hayatta kalma şansı daha yüksekti. Mevcut çalışmada, endokrin/nöroendokrin kanserli beş köpek vardı ve bunların 3’ü (%60) antitümöral tedavi aldı, biri semptomatik tedavi aldı ve biri tedavi edilmedi. İyileşen sonucun spesifik histotipten ziyade antitümöral tedavi uygulanmasıyla bağlantılı olması mümkündür.
Bu çalışmanın en büyük dezavantajı, retrospektif yapısının doğasında var olan sapmalardır. Veri toplama kapsamlı olmayabilir, birden fazla onkolog ve radyolog çalışmaya dahil olmuş ve farklı görüntüleme teknikleri kullanılmıştır, örneklem büyüklüğü sınırlıdır ve tedavide belirgin bir heterojenlik vardır, bu da güç eksikliği nedeniyle daha kapsamlı istatistiksel analiz yapmamıza imkan vermemiştir. Benzer şekilde, birçok köpek için ilk evreleme yöntemleri ve primer kanserin alt tipi ve derecesi de dahil olmak üzere ayrıntılı histopatolojik değişkenlerle ilgili tam veri elde etmek mümkün olmamıştır.
Bir diğer kısıtlama ise BM’nin histolojik doğrulamasının sadece 19 vakada yapılmış olması, diğerlerinin ise sitolojik tanı almış olmasıdır. Ancak, kötü durumda olan ve sadece semptomatik tedavi için uygun olan köpeklerde tüm vakaların histopatolojik olarak doğrulanması pratik ve hatta etik değildir. Nekropsi verileri de faydalı olabilirdi.
Ayrıca, bir köpekte tespit edilen hiperkalsemi, BM ile ilgisi olmayan nedenlere bağlı olabilir.
Sonuç olarak, BM yaşam kalitesini önemli ölçüde bozmanın ötesinde kısa vadeli prognoza işaret etmektedir.
Bildiğimiz kadarıyla bu çalışma, solid kanserli BM’li köpeklerde daha uzun sağkalımı öngören potansiyel değişkenleri değerlendiren ilk klinik çalışmadır. BM’li köpekler düşük oranda yaşama şansına sahipken, >10 yaş, <30 kg ağırlık ve antitümör tedavi uygulanması sağkalım süresini önemli ölçüde iyileştirmiştir. BM’li köpeklerde spesifik tedavilerin etkin rolünü anlamak için daha fazla çalışmaya ihtiyaç vardır.
Katkıda bulunan yazarlar
Chiara Agnoli: Veri derleme (eşit); danışmanlık (eşit); yazarlık – orijinal taslak (eşit). Silvia Sabattini: Veri derleme (eşit); resmi analiz (lider); yazma – orijinal taslak (eşit). Alessandra Ubiali: Veri düzenleme (eşit); görselleştirme (eşit). Emiliano Battisti: Veri düzenleme (eşit). Federica Rossi: Veri düzenleme (eşit); yazma – inceleme ve redaksiyon (eşit). Alessia Diana: Veri düzenleme (eşit); yazma – inceleme ve redaksiyon (eşit). Maria Teresa Camerino: Veri düzenleme (eşit); yazma – gözden geçirme ve redaksiyon (eşit). Simone Perfetti: Veri derleme (eşit); yazım – inceleme ve redaksiyon (eşit). Luca Ciammaichella: Veri düzenleme (eşit); yazma – gözden geçirme ve redaksiyon (eşit). Damiano Stefanello: Veri düzenleme (eşit); yazma – gözden geçirme ve redaksiyon (eşit). Melissa Papa: Yazma – gözden geçirme ve redaksiyon (eşit). Riccardo Zaccone: Yazma – gözden geçirme ve redaksiyon (eşit). Laura Marconato: Kavramsallaştırma (lider); veri küratörlüğü (lider); araştırma (lider); metodoloji (lider); danışmanlık (lider); yazım – orijinal taslak (lider).
Çıkar çatışması beyanı
Bu makalenin yazarlarından hiçbirinin, makalenin içeriğini uygunsuz bir şekilde etkileyebilecek veya taraflı hale getirebilecek başka kişi veya kuruluşlarla maddi veya kişisel herhangi bir çıkar ilişkisi bulunmamaktadır..
Kaynakça
Charney, V. A., Miller, M. A., Heng, H. G., et al. (2016) Skeletal metastasis of canine urothelial carcinoma: pathologic and computed tomographic features. Veterinary Pathology 54, 380-386
Coleman, R. E. (1997) Skeletal complications of malignancy. Cancer 80, 1588- 1594
Cooley, D. M. & Waters, D. J. (1998) Skeletal metastasis as the initial clinical manifestation of metastatic carcinoma in 19 dogs. Journal of Veterinary Internal Medicine 12, 288-293
Ehrhart, N. P., Christensen, N. I. & Fan, T. M. (2020) Tumors of the skeletal system. In: Withrow & MacEwen’s Small Animal Clinical Oncology. 6th edn. Eds D. M. Vail, D. H. Thamm and J. M.Liptak. Elsevier, St. Louis, MO, USA. pp 524-564
Fan, T. M., de Lorimier, L. P., Charney, S. C., et al. (2005) Evaluation of intravenous pamidronate administration in 33 cancer-bearing dogs with primary or second- ary bone involvement.Journal of Veterinary Internal Medicine 19, 74-80
Frank, S., Carton, M., Dubot, C., et al. (2020) Impact of age at diagnosis of meta- static breast cancer on overall survival in the real-life ESME metastatic breast cancer cohort. Breast 52, 50-57
Glinsky, V. V. (2006) Intravascular cell-to-cell adhesive interactions and bone metastasis. Cancer and Metastasis Reviews 25, 531-540
Hage, W. D., Aboulafia, A. J., Aboulafia, D. M., et al. (2000) Incidence, location, and diagnostic evaluation of metastatic bone disease. The Orthopedic Clinics of North America 31, 515-528
Hammer, A., Weeren, F., Weisbrode, S., et al. (1995) Prognostic factors in dogs with osteosarcomas of the flat or irregular bones. Journal of the American Ani- mal Hospital Association 31,321-326
Holbrook, N. J. & Ikeyama, S. (2002) Age-related decline in cellular response to oxidative stress: links to growth factor signaling pathways with common defects. Biochemical Pharmacology 64, 999-1005
Jiang, W., Rixiati, Y., Zhao, B., et al. (2020) Incidence, prevalence, and outcomes of systemic malignancy with bone metastases. Journal of Orthopaedic Surgery 28, 2 Li, S., Peng, Y., Weinhandl,E. D., et al. (2012) Estimated number of prevalent cases of metastatic bone disease in the US adult population. Clinical Epide-
miology 4, 87-93
Lipton, A. & Balakumaran, A. (2012) Denosumab for the treatment of cancer therapy-induced bone loss and prevention of skeletal-related events in patients with solid tumors. Expert Reviewof Clinical Pharmacology 5, 359-371
Lipton, A., Theriault, R. L., Hortobagyi, G. N., et al. (2000) Pamidronate prevents skeletal complications and is effective palliative treatment in women with breast carcinoma and osteolytic bone metastases: long term follow-up of two randomized, placebo-controlled trials. Cancer 88, 1082-1090
Makielski, K. M., Mills, L. J., Sarver, A. L., et al. (2019) Risk factors for develop- ment of canine and human osteosarcoma: a comparative review. Veterinary Sciences 6, 48-67
Melilli, A. (2020) Uncommon skeletal metastasis secondary to transitional cell carcinoma. Open Veterinary Journal 9, 313-316
Michalak, S. R., Woerde, D. J., Wilson, S. S., et al. (2021) Mandibular metastasis of a prostatic carcinoma in a dog. Veterinary Medicine and Science 7, 1488- 1492
Nakamoto, Y., Osman, M. & Wahl, R. L. (2003) Prevalence and patterns of bone metastases detected with positron emission tomography using F-18 FDG. Clini- cal Nuclear Medicine 28, 302-307
Nguyen, D. X., Bos, P. D. & Massagué, J. (2009) Metastasis: from dissemination to organ-specific colonization. Nature Reviews Cancer 9, 274-284
Norgaard, M., Jensen, A. O., Jacobsen, J. B., et al. (2010) Skeletal related events, bone metastasis and survival of prostate cancer: a population based cohort study in Denmark (1999 to 2007). Journal of Urology 184, 162-167
Pagani, F., Francucci, C. M. & Moro, L. (2005) Markers of bone turnover: biochemi- cal and clinical perspectives. Journal of Endocrinological Investigation 28, 8-13 Paget, S. (1889) The distribution of secondary growths in cancer of the breast.
The Lancet 133, 571-573
Phadke, P. A., Mercer, R. R., Harms, J. F., et al. (2006) Kinetics of metastatic breast cancer cell trafficking in bone. Clinical Cancer Research 12, 1431-1440
Purushotham, A., Shamil, E., Cariati, M., et al. (2014) Age at diagnosis and distant metastasis in breast cancer – a surprising inverse relationship. European Jour- nal of Cancer 50, 1697-1705
Reed, M. J., Karres, N., Eyman, D., et al. (2007) The effects of aging on tumor growth and angiogenesis are tumor-cell dependent. International Journal of Can- cer 120, 753-760
Riihimäki, M., Hemminki, A., Fallah, M., et al. (2014) Metastatic sites and survival in lung cancer. Lung Cancer 86, 78-84
Roodman, G. D. (2004) Mechanisms of bone metastasis. New England Journal of Medicine 350, 1655-1664
Rosen, L. S., Gordon, D., Tchekmedyian, N. S., et al. (2004) Long-term effi- cacy and safety of zoledronic acid in the treatment of skeletal metastases in
patients with non-small cell lung carcinoma and other solid tumors. Cancer
100, 2613-2621
Rove, K. O. & Crawford, E. D. (2009) Metastatic cancer in solid tumors and clinical outcome: skeletal-related events. Oncology 23, 21-27
Ru, G., Terracini, B. & Glickman, L. T. (1998) Host related risk factors for canine osteosarcoma. The Veterinary Journal 156, 31-39
Sathiakumar, N., Delzell, E., Morrisey, M. A., et al. (2011) Mortality following bone metastasis and skeletal-related events among men with prostate cancer: a population-based analysis of USMedicare beneficiaries, 1999–2006. Prostate Cancer and Prostatic Diseases 14, 177-183
Sathiakumar, N., Delzell, E., Morrisey, M. A., et al. (2012) Mortality following bone metastasis and skeletal-related events among women with breast cancer: a population based analysis of U.S. Medicare beneficiaries, 1999-2006. Breast Cancer Research and Treatment 131, 231-238
Sathiakumar, N., Delzell, E., Morrisey, M., et al. (2013) Mortality following bone metastasis and skeletal-related events among patients 65 years and above with lung cancer: a population-based analysis of U.S. Medicare beneficiaries, 1999-2006. Lung India 30, 20-26
Schultz, R. M., Puchalski, S. M., Kent, M., et al. (2007) Skeletal lesions of histio- cytic sarcoma in nineteen dogs. Veterinary Radiology & Ultrasound 48, 539-543 Shupp, A. B., Kolb, A. D., Mukhopadhyay, D., et al. (2018) Cancer metastases to bone: concepts, mechanisms, and interactions with bone osteoblasts. Cancers
10, 182-219
Spugnini, E. P., Vincenzi, B., Caruso, Q., et al. (2009) Zoledronic acid for the treat- ment of appendicular osteosarcoma in a dog. Journal of Small Animal Practice 50, 44-46
Suva, L. J., Cooper, A., Watts, A. E., et al. (2021) Bisphosphonates in veterinary medicine: the new horizon for use. Bone 142, 115711
Trost, M. E., Inkelmann, M. A., Galiza, G. J. N., et al. (2014) Occurrence of tumours metastatic to bones and multicentric tumours with skeletal involvement in dogs. Journal of Comparative Pathology 150, 8-17
Welch, D. R., Harms, J. F., Mastro, A. M., et al. (2003) Breast cancer metastasis to bone: evolving models and research challenges. Journal of Musculoskeletal & Neuronal Interactions 3, 30-38
Yong, M., Jensen, A. Ø., Jacobsen, J. B., et al. (2011) Survival in breast cancer patients with bone metastases and skeletal-related events: a population-based cohort study in Denmark (1999–2007). Breast Cancer Research and Treatment 129, 495-503