1İç Hastalıkları Anabilim Dalı I, Hematoloji ve Hemostazoloji Bilim Dalı, Viyana Tıp Üniversitesi, Viyana, Avusturya
2Ludwig Boltzmann Hematoloji ve Onkoloji Enstitüsü, Viyana Tıp Üniversitesi, Viyana, Avusturya
3Evcil Hayvanlar ve Atlar Bölümü/Hastanesi, Küçük Hayvanlar Üniversite Kliniği, İç Hastalıkları Küçük Hayvanlar, Veteriner Hekimliği Üniversitesi, Viyana, Avusturya
İletişim:
Emir Hadzijusufovic, Ludwig Boltzmann Hematoloji ve Onkoloji Enstitüsü, Viyana Tıp Üniversitesi, Waehringer Guertel 18-20, Viyana 1090, Avusturya.
E-posta: hadzijusufovic@meduniwien.ac.at
Fon desteği
Avusturya Bilim Fonu, Hibe/Ödül Numaraları: DK W1248-B30, SFB F4701-B20, SFB F4704-B20
| BarbaraPeter1,2
| Michael Willmann2,3 |
Bruton tirozin kinaz (BTK) inhibitörü ibrutinib, insan kronik lenfositik lösemi ve mantle hücreli lenfoma tedavisinde etkilidir. Elde edilen son veriler, ibrutinibin insan bazofillerinde (BA’lar) ve mast hücrelerinde (MC’ler) IgE’ye bağlı aktivasyonu ve histamin salınımını da engellediğini göstermiştir. Bu çalışmanın amacı, BTK’nın köpek mast hücre tümörlerinde (MCT’ler) yeni tedavi yöntemi olarak kullanılıp kullanılamayacağını araştırmaktır. İbrutinibin C2 ve NI-1 olmak üzere iki köpek MC hattı ve köpek MCT’lerinden elde edilen primer MC’ler (n = 3) üzerindeki etkilerini değerlendirdik. Akış sitometrisi kullanarak, ibrutinibin her iki MC hattında BTK ve downstream STAT5 fosforilasyonunu baskıladığını bulduk. Buna ek olarak, ibrutinib neoplastik MC’lerin proliferasyonunu azaltmış, IC50 değerleri primer MCT hücrelerinde 0,1 ile 1 μM arasında, C2 ve NI-1 hücrelerinde ise 1 ile 3 μM arasında değişmiştir. C2 hücrelerinde, “ibrutinib + midostaurin” kombinasyonu sinerjik büyüme inhibe edici etkiler üretmiştir. Daha yüksek konsantrasyonlarda, ibrutinib her iki MC hattında daapoptozu indüklemiştir. Son olarak, ibrutinibin primer MCT hücrelerinde IgE’ye bağlı histamin salınımını baskıladığı, IC50 değerlerinin NI-1 hücrelerinde 0,05 ila 0,1 μM ve primer MCT hücrelerinde 0,05 ila 1 μM arasında değiştiği bulunmuştur. Özetle, ibrutinib köpek neoplastik MC’lerinde anti-proliferatif etkiler göstermektedir ve bu hücrelerde IgE’ye bağlı histamin salınımını engellemektedir. Elde ettiğimiz verilere dayanarak, ibrutinib köpek MCT’sinin tedavisi için yeni tedavi edici bir ajan olarak değerlendirilebilir.
ANAHTAR KELİMELER
BTK, köpek neoplastik mast hücreleri, histamin salınımı, ibrutinib, IgE
1 | GİRİŞ
Mast Mast hücre tümörleri (MCT’ler) köpeklerde en sık teşhis edilen deri neoplazmlarından biridir.1-4 Bu tümörler heterojen yapıda neoplazmlardır.2-4 Klinik belirtiler, düşük dereceli, iyi huylu tümörlerden, kötü prognoza yol açan neoplastik MC’lerin hızla
çoğaldığı yüksek dereceli, agresif hastalık varyantlarına kadar değişmektedir.4-6 Kaşıntı veya ödem gibi ek klinik semptomlar, histamin gibi MC türevi mediatörler nedeniyle tetiklenebilir. 4,7 Bu mediyatör kaynaklı etkiler genellikle histamin reseptör (HR)1 ve HR2 antagonistleri ile kontrol altına alınabilir. 3,8,9 Şu anda tek tedavi edici yaklaşım geniş marjinli cerrahidir. 5
Tam rezeksiyon mümkün değilse veya tümör tekrarlarsa, genellikle radyo- ve/veya kemoterapi önerilir.5,10-14 Son zamanlarda, proto- onkogen, reseptör tirozin kinaza (KIT) yönelik iki hedefli ilaç olan masitinib ve toceranib, rezeke edilemeyen veya metastaz yapmış yüksek dereceli MCT tedavisinde kullanılmak üzere onaylanmıştır.15,16 Bu ilaçların çeşitli MCT hastalarında etkili olduğu görülmüştür.15-17 Bu nedenle, mevcut araştırmalar köpek MCT hücrelerinin büyümesini ve aktivasyonunu engelleyebilecek yeni hedefe yönelik ilaçların tespit edilmesi ve preklinik olarak geliştirilmesine yoğunlaşmaktadır.
İnsanlarda, Bruton tirozin kinaz (BTK) inhibitörü ibrutinib, kronik lenfositik lösemi ve mantle hücreli lenfoma tedavisi için yakın zamanda Gıda ve İlaç İdaresi onayı almış gelecek vaat eden bir ilaçtır.18-20 Ayrıca, BTK’nın nöroblastom hücreleri ve neoplastik insan MC’leri de dahil olmak üzere çeşitli tümör hücrelerinin büyümesine ve hayatta kalmasına aracılık eden kritik bir sinyal molekülü olduğu belirtilmiştir.21,22 Ayrıca, BTK’nın IgE reseptörüne çapraz bağlı insan bazofillerinin (BA’lar) ve MC’lerin downstream yolağında hedef rol oynadığı tespit edilmiştir.23-26 Yakın zamanda, bizim ve diğer grupların yayınladığı çalışmalar ibrutinib’i insan BA’larında IgE’ye bağlı aktivasyonun ve histamin salınımının potent blokörü olarak tanımlamıştır.26,27 Ancak, ibrutinib’in köpeklerdeki in vitro ve in vivo etkileri hakkında sadece birkaç rapor mevcuttur. Yakın zamanda, ibrutinibin köpek hastalarda doğal olarak ortaya çıkan B hücreli non-Hodgkin-lenfomada anti-tümör etkiler gösterdiği açıklanmıştır.28 Bu verilere dayanarak, ibrutinib karşılaştırmalı onkoloji bağlamlarında test edilmesi ilgi çekici bir ajan olabilir. İbrutinibin köpek neoplastik MC’leri üzerindeki etkisini incelemeye karar verdik. Çalışmamızın spesifik amaçları, ibrutinibin köpek MCT tedavisinde yeni ve umut verici bir ilaç olup olamayacağını ve ibrutinibin neoplastik MC’lerde histamin salınımını baskılayıp baskılayamayacağını incelemekti.
2 |MATERYAL VE METOD
2.1 | İlaçlar ve reaktif maddeler
İbrutinib Selleck Chemicals’tan (Houston, Texas), toceranib Sigma- Aldrich’ten (St. Louis, Missouri), masitinib ve midostaurin LC laboratuvarlarından (Woburn, Massachusetts) temin edilmiştir. Tüm ilaçlar için stok çözeltiler Sigma-Aldrich’ten satın alınan dimetil sülfoksit (DMSO) içinde çözülerek hazırlanmıştır. RPMI 1640 besiyeri, Iscove’s modifiye Dulbecco’s besiyeri (IMDM) ve antibiyotikler (penisilin, streptomisin) Lonza’dan (Basel, İsviçre), amfoterisin B PAN- Biotech’ten (Aidenbach, Almanya), Gibco Life Technologies’den (Carlsbad, California) fetal buzağı serumu (FCS), PerkinElmer’den (Waltham, Massachusetts) 3H-timidin, Worthington’dan (Lakewood, New Jersey) kolajenaz tip 2 ve Sigma-Aldrich’ten tripan mavisi ve 40,6-diamidino-2-fenilindol (DAPI) satın alınmıştır. DMSO tüm deneylerde (en yüksek ilaç konsantrasyonlarına karşılık gelen) ilaç kontrol aracı olarak kullanılmış ve köpek MC’lerinin büyümesi ve aktivasyonu üzerinde hiçbir etki göstermemiştir (gösterilmemiştir).
2.2 | Hücre hatları ve kültür özellikleri
İki köpek mastositoma hücre dizisi kullanılmıştır: C2 ve NI-1. C2 hücreleri Dr. Warren Gold (Kardiyovasküler Araştırma Enstitüsü,
Kaliforniya Üniversitesi, San Francisco, Kaliforniya) tarafından sağlanmıştır.29 NI-1 hücreleri daha önce tarif edildiği gibi laboratuvarımızda oluşturulmuştur.30 Her iki hücre hattı da %10 FCS, antibiyotik ve amfoterisin B içeren RPMI 1640 ortamında kültüre edilmiştir. İnsan MC hattı HMC-1 Dr. Joseph H. Butterfield (Mayo Clinic, Rochester, Minnesota) tarafından sağlanmış ve IMDM artı %10 FCS, alfa-tiyogliserol, antibiyotik ve amfoterisin B ortamında kültüre edilmiştir.31 Hücre hatları kültürde %5 CO2 ve 37○C’de 6 ila 8 hafta boyunca tutulmuştur. Daha sonra hücreler atılmış ve orijinal stoktan yeni hücreler çözülmüştür.
2.3 | Mastositoma örneklerinden primer köpek neoplastik MC’lerinin izolasyonu
Taze MCT örnekleri Viyana Veterinerlik Üniversitesi’nde (Viyana, Avusturya) ameliyat edilen üç köpekten elde edilmiştir. Mastositoma hastalarının ayrıntılı özellikleri Tablo 1’de listelenmiştir. Primer neoplastik MC’ler daha önce yayınlandığı gibi kolajenaz kullanılarak izole edilmiştir.32 Kısaca, doku örnekleri küçük parçalar halinde kesilmiş, Tyrode tamponunda iyice yıkanmış ve ardından 50 mL %0,9 NaCl içinde çözülmüş 75 mg kolajenaz tip 2 içinde 180 dakika boyunca 37○C’de inkübe edilmiştir. İzole edilen MC’ler hücre süzgecinden (70 μM gözenek boyutu) süzülerek geri kazanıldı ve FBS içeren tüplerde toplandı. Yıkamadan sonra hücreler canlılık (tripan mavisi dışlama) ve MC sayıları (Wright Giemsa boyama) açısından incelenmiştir.
2.4 | MC hatlarında BTK ve STAT5 ifadesinin Western blot analizi
Western blot deneyleri esasen bildirildiği gibi C2 ve NI-1 hücreleri kullanılarak gerçekleştirilmiştir.33 Tekniğin ayrıntılı bir açıklaması Ek’in Yöntem Bölümünde verilmiştir.
2.5 | BTK- ve STAT5 fosforilasyonunun akış sitometrisi ile analizi
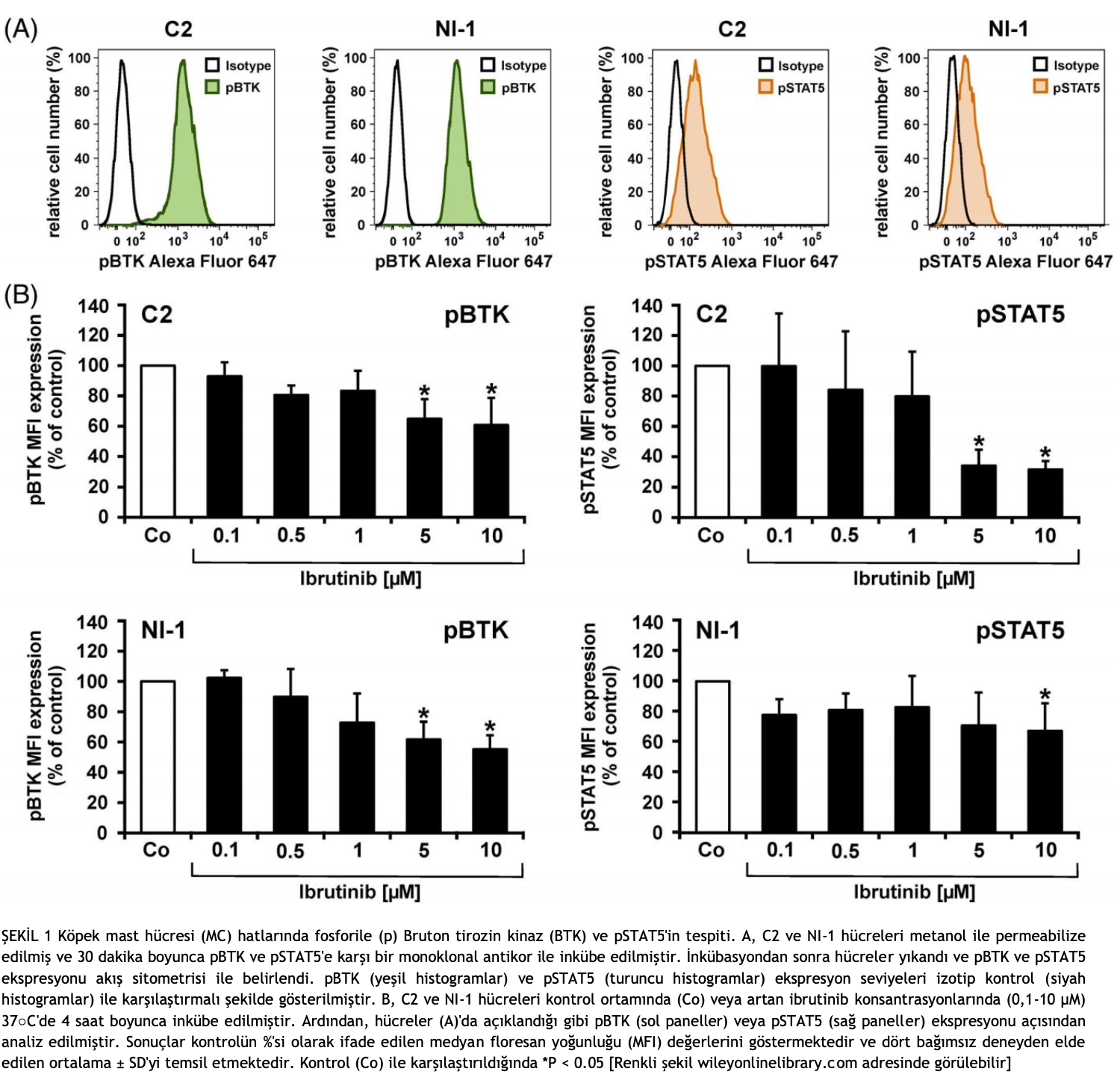
Fosforile (p) BTK ve pSTAT5’in boyanması için, C2 hücreleri ve NI-1 hücreleri kontrol ortamında veya artan konsantrasyonlarda ibrutinib (0,1-10 μM) içeren ortamda 37○C’de 4 saat boyunca inkübe edilmiştir. Ardından, hücreler metanol (-20○C, 15 dakika) ile permeabilize edilmiş ve pBTK’ya (fosforilasyon bölgesi: Y223) karşı Alexa Fluor 647 işaretli fare monoklonal antikoru (mAb) N35- 86 veya pSTAT5’e (fosforilasyon bölgesi: Y694) karşı Alexa Fluor 647 işaretli fare mAb 47 (BD Biosciences, San José, California) ile 30 dakika boyunca inkübe edilmiştir. İzotip kontrol olarak IgG1’e (BD Biosciences) karşı bir fare mAb MOPC-21 kullanılmıştır. pBTK ve pSTAT5 ekspresyonu FACSCanto (BD Biosciences) üzerinde çok renkli akış sitometrisi ile ölçülmüştür.
2.6 | Köpek neoplastik MC’lerinin proliferasyonunun ölçümü
MC hatları ve primer mastositoma hücreleri düz tabanlı 96 kuyulu mikrotitre plakalarına (5 × 103 hücre/kuyu) ekilmiş ve 48 saat boyunca 37○C’de kontrol ortamında, araç kontrolünde veya çeşitli
ibrutinib konsantrasyonlarında (0,01-5 μM) inkübe edilmiştir. Potansiyel kooperatif ilaç etkilerini değerlendirmek için hücreler ibrutinib, midostaurin, toceranib, masitinib (tek ajan olarak) veya “ibrutinib + midostaurin”, “ibrutinib + toceranib” ve “ibrutinib + masitinib” ilaç kombinasyonlarına sabit ilaç konsantrasyon oranında maruz bırakılmıştır. İnkübasyondan sonra 0,5 μCi 3H- timidin eklenmiştir (37○C, 16 saat). Daha sonra hücreler filtre membranları (Packard Bioscience, Meriden, Connecticut) üzerinde Filtermate 196 toplayıcıda (Packard Bioscience) toplandı. Filtreler havada kurutulmuş ve bağlı radyoaktivite bir β-sayıcıda (TopCount NXT, Packard Bioscience) ölçülmüştür. Tüm deneyler üç kopya halinde gerçekleştirilmiştir.
2.7 | İlaca maruz kalan hücrelerde apoptozun değerlendirilmesi
C2 ve NI-1 hücreleri kontrol ortamında, ilaç kontrolünde veya çeşitli ibrutinib konsantrasyonlarında (1-25 μM) 37○C’de 24 veya 48 saat boyunca inkübe edilmiştir. İnkübasyondan sonra, canlı, apoptotik ve nekrotik hücrelerin yüzdeleri diferansiyel Hızlı Boyama Kiti (Modifiye Wright Giemsa, Sigma- Aldrich) ile boyanmış slaytlar üzerinde mikroskopi ile ölçülmüştür. Ayrıca, apoptoz Annexin V (eBioscience, San Diego, California) ve DAPI boyaması ile akış sitometrisinde tarif edildiği şekilde değerlendirilmiştir.31 Kısaca, hücreler kontrol ortamında veya çeşitli konsantrasyonlarda ibrutinib (1-25 μM) içeren ortamda 37○C’de 24 ve 48 saat boyunca inkübe edilmiştir. Daha sonra, hücreler toplandı ve bağlayıcı tampon içinde Annexin V ile inkübe edildi. Ardından, DAPI (1 μg/mL) eklenmiş ve hücreler FACSCanto (BD Biosciences) üzerinde akış sitometrisi ile analiz edilmiştir. Tüm apoptotik hücrelerin toplam fraksiyonu, Annexin V-tekli pozitif (erken apoptotik) hücrelerin yüzdesi artı Annexin V artı DAPI pozitif (geç apoptotik) hücrelerin yüzdesi örnek tüpünde yakalanan tüm hücrelere göre belirlenerek ölçülmüştür .
2.8 | Histamin salınımı deneyleri
NI-1 hücreleri ve primer mastositoma hücreleri 37○C’de 2 saat boyunca 5 μg/mL saflaştırılmış köpek IgE (Bethyl, Montgomery, Alabama) ile ön yükleme yapılarak hassaslaştırılmıştır. IgE ön yüklemesi yapılmayan hücreler negatif kontrol olarak kullanılmıştır. Daha sonra, hücreler farklı ibrutinib konsantrasyonlarıyla (0,001-1 μM) 37○C’de 60 dakika boyunca inkübe edilmiştir. İnkübasyondan sonra hücreler fosfat tamponlu salin (PBS, Gibco Life Technologies) içinde yıkanmış, histamin salım tamponu (HRB, Immunotech, Marseille, Fransa) içinde yeniden süspanse edilmiş ve ardından 5 μg/mL keçi anti-dog-IgE antikoru (Bethyl Laboratories) ile 37○C’de 30 dakika inkübe edilmiştir.
İnkübasyondan sonra, hücreler 4○C’de santrifüjlenmiş ve hücresiz süpernatantlar ve hücre peletleri geri kazanılmış ve radyoimmünoassay (RIA, Immunotech) ile histamin içeriği açısından analiz edilmiştir. Toplam histamin, hassaslaştırılmamış hücrelerin lizatlarında ölçülmüş ve hassaslaştırılmış ve ilaca maruz bırakılmış hücrelerin salınan histamin yüzdesini hesaplamak için referans olarak kullanılmıştır. Tüm deneyler üç kopya olarak gerçekleştirilmiştir.
2.9 | İstatistiksel analiz
Veriler en az üç bağımsız deneyden elde edilen ortalama değerler ve standart sapma (SD) şeklinde sunulmuştur. İlaca maruz kalan ve kalmayan hücreler arasında görülen farklılıkların istatistiksel olarak anlamlı olup olmadığını belirlemek için bağımsız örneklemler üzerinde Student t testi uygulanmıştır. P <0,05 olduğunda sonuçlar istatistiksel olarak anlamlı kabul edilmiştir. İlaç kombinasyonlarının etkileri Calcusyn yazılımı (Biosoft, Ferguson, Missouri) kullanılarak belirlenmiş ve kombinasyon indeksi (CI) değerleri olarak ifade edilmiştir. CI <1 olduğunda ilaç etkilerinin sinerjik olduğu kabul edilmiştir.
3
| SONUÇ
| İbrutinibin köpek neoplastik MC’lerinde pBTK ve
3.1
pSTAT5 ekspresyonu üzerindeki etkileri
İbrutinibin BTK aktivasyonu ve downstream STAT5 aktivasyonu üzerindeki etkilerini test etmek için, ilaca maruz kalan hücrelerde akış sitometrisi kullanarak BTK ve STAT5’in fosforilasyon durumunu inceledik. C2 hücrelerinin ve NI-1 hücrelerinin yapısal olarak pBTK ve pSTAT5 eksprese ettiğini tespit ettik (Şekil 1A). C2 hücrelerinin ve NI-1 hücrelerinin çeşitli ibrutinib konsantrasyonlarına maruz bırakılması, pBTK ve pSTAT5 ekspresyonunda konsantrasyona bağlı azalmaya yol açmıştır (Şekil 1B). Zaman seyri deneylerinde, ibrutinibin pBTK ve pST A T5 ekspresyonu üzerindeki inhibitör etkisi incelenen tüm zaman noktalarında (0,25-4 saat) görülmüştür (Şekil S1). Western blotlama ile değerlendirildiği üzere, her iki köpek MC hattı da (C2 ve NI-1) BTK ve STAT5 proteinini ifade etmiştir (Şekil S2). İnsan MC hattı HMC-1.2 bu deneylerde pozitif kontrol olarak kullanıldı (Şekil S2).
3.2 | İbrutinibin köpek neoplastik MC’lerinin proliferasyonu üzerindeki etkileri
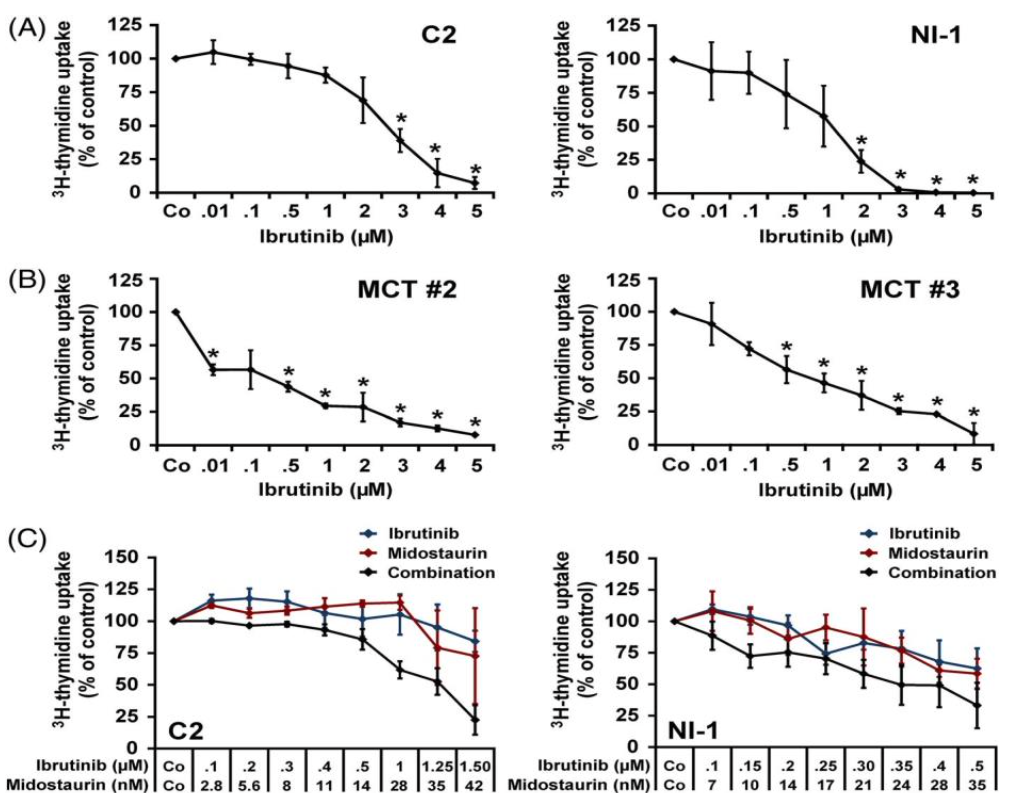
3H-timidin alımıyla belirlendiği üzere, ibrutinibin C2 hücrelerinin ve NI-1 hücrelerinin proliferasyonunu 1 ila 3 μM arasında değişen IC50 değerleriyle azalttığı bulunmuştur (Şekil 2A, Tablo 2).
İbrutinib ayrıca primer MCT hücrelerinde 0,1 ile 1 μM arasında değişen IC50 değerleri ile proliferasyonu baskılamıştır (Şekil 2B, Tablo 2). Proliferasyon üzerinde ibrutinib ve midostaurin arasındaki sinerjistik etkiler C2 hücrelerinde görülmüş, ancak NI-1 hücrelerinde görülmemiştir (Şekil 2C). “İbrutinib + masitinib” ve “ibrutinib + toceranib” ilaç kombinasyonları C2 ve NI-1 hücrelerinde bazı kooperatif büyüme engelleyici etkilere neden olmuş, ancak sinerjik etkileşimler görülmemiştir (Şekil S3).
3.3 | İbrutinibin C2 hücreleri ve NI-1 hücrelerinin sağkalımı üzerindeki etkileri
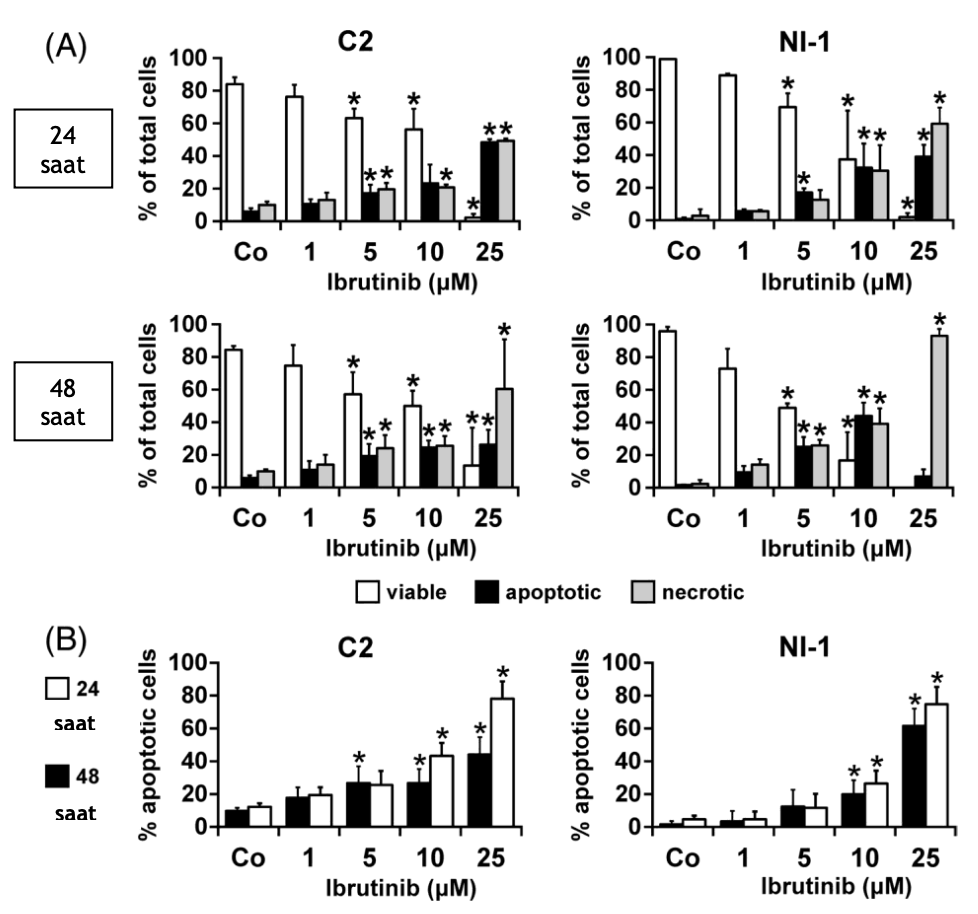
Bir sonraki adımda, ibrutinibin köpek MC hatlarında apoptozu indükleyip indüklemediğini inceledik. Mikroskopi ile değerlendirildiği üzere, ibrutinib her iki MC hattında da 48 saat
sonra C2 hücreleri için 10 ila 25 μM ve NI-1 hücreleri için 5 ila 10 μM arasında değişen EC50 değerleri ile apoptoz ve ardışık nekrozu indüklemiştir (Şekil 3A). Apoptoz indüksiyonu, ibrutinibin 48 saat sonra 10 ila 25 μM arasında değişen EC50 değerleri ile sağkalımı azalttığı Annexin V/DAPI boyama deneylerinde doğrulanmıştır (Şekil 3B).
3.4 | İbrutinibin NI-1 hücrelerinde ve primer mastositoma hücrelerinde IgE’ye bağlı histamin salınımı üzerindeki etkileri
İbrutinibin yakın zamanda insan BA’larının IgE’ye bağlı aktivasyonuna karşı koyduğu görülmüştür.26,27 İbrutinibin köpek neoplastik MC’lerinde IgE’ye bağlı histamin salınımı üzerinde inhibitör etkileri olup olmadığını incelemek için, fonksiyonel IgE reseptörü30,34 ifade ettiği bilinen NI-1 hücreleri ve primer
ŞEKİL 2 İbrutinib veya “ibrutinib + midostaurin “in köpek neoplastik mast hücrelerinde (MCs) proliferasyon üzerindeki etkileri. C2 ve NI-1 hücreleri (A) veya mastositoma hastaları #2 ve #3’ten (B) izole edilen primer hücreler 48 saat boyunca 37○C’de kontrol ortamında (Co) veya çeşitli ibrutinib konsantrasyonlarında (0,01-5 μM) inkübe edilmiştir . C, İlaç kombinasyon etkilerini değerlendirmek için, C2 ve NI-1 hücreleri 48 saat boyunca 37○C’de Co, ibrutinib (mavi çizgi), midostaurin (kırmızı çizgi) veya her iki ilacın kombinasyonunda (siyah çizgi) sabit ilaç konsantrasyonları oranında (belirtildiği gibi) inkübe edilmiştir . İnkübasyondan sonra 3H-timidin ölçülmüştür. Sonuçlar kontrol yüzdesi olarak 3H-timidin alımını göstermektedir (=%100, Co) ve dört bağımsız deneyin (C2, NI-1) ortalama ± SD’sini veya üç kopyanın (birincil MC’ler) ortalama ± SD’sini temsil etmektedir . Kontrol (Co) ile karşılaştırıldığında *P < 0.05 [Renkli şekil wileyonlinelibrary.com adresinde görülebilir]
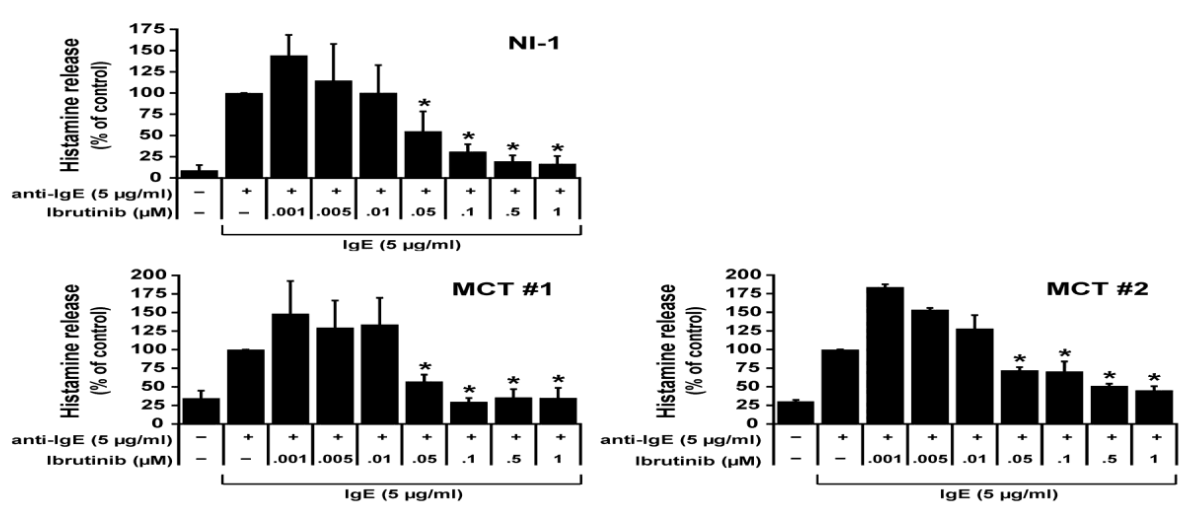
mastositoma hücreleri kullanılarak deneyler gerçekleştirdik. Her iki hücre tipinde de, ibrutinibin IgE’ye bağlı histamin salınımını konsantrasyona bağlı bir şekilde inhibe ettiği ve IC50 değerlerinin NI-1 hücrelerinde 0,05 ile 0,1 μM arasında ve primer MCT hücrelerinde 0,05 ile 1,0 μM arasında değiştiği bulunmuştur (Şekil 4).
4 | TARTIŞMA
Agresif köpek MCT’si henüz tedavi ihtiyacı karşılanmamış bir hastalıktır.2-5 İnsan ve köpek MC neoplazmlarında mutasyona uğramış KIT, büyüme faktöründen bağımsız aktivasyona ve neoplastik MC’lerin kontrolsüz proliferasyonuna neden olabilir.2,6,35-38 Tirozin kinaz inhibitörleri (TKI’ler) masitinib ve toceranib köpeklerde ilerlemiş MC neo-plazmlarını tedavi etmek için halihazırda kullanılmaktadır.15,16
Bununla birlikte, bu ilaçlar köpek MCT hastalarının bir alt kümesinde klinik etkinlik gösterse de, nüksler sıklıkla görülmektedir.17,39 Bu nedenle, yeni moleküler hedeflerin belirlenmesi ve yeni ilaçların geliştirilmesi büyük önem taşımaktadır. Burada BTK hedefli ilaç ibrutinibin köpek neoplastik MC’lerinin büyümesinde güçlü bir inhibitör olduğunu belirtmekteyiz. Ayrıca, ibrutinibin neoplastik köpek MC’lerinde IgE’ye bağlı histamin salınımını baskıladığını ortaya koyuyoruz. Bu gözlemler klinik açıdan önemli olabilir ve MCT’den muzdarip köpeklerde yeni tedavi stratejilerinin geliştirilmesine yardımcı olabilir.
BTK ibrutinibin ana hedefi olduğundan,28,40 ilk olarak her iki MC hattında BTK proteininin ekspresyonunu göstermekle ilgilendik. Buna ek olarak, her iki hücre hattının da fosforile BTK ve downstream efektör molekülü STAT5 sergilediğini gösterebildik. Bu gözlem, köpek MC hatlarında STAT5/pSTAT5 ekspresyonuna ilişkin önceki raporları doğrulamaktadır.41 Ayrıca, ibrutinibin bu hücrelerde konsantrasyona bağlı bir şekilde her iki sinyal molekülünün fosforilasyonunu hızla baskıladığını tespit ettik. İbrutinib tarafından pBTK’nın aşağı regülasyonu, kronik lenfositik lösemi gibi B-hücreli neo-plazmalarda gösterilen verilerle tutarlıdır.19,42
BTK ayrıca MC büyümesi, proliferasyonu ve sağkalımı için kritik olduğu bilinen KIT-sinyal yolağında downstream molekül şeklinde tanımlanmıştır.43 İbrutinibin C2 ve NI-1 hücrelerinin proliferasyonunu 1 ila 3 μM arasında IC50 değerleriyle ve primer MCT hücrelerinin proliferasyonunu 0,1 ila 1 μM arasında IC50değerleriyle inhibe ettiğini göstermeyi başardık. Primer MCT hücreleri ile elde edilen IC50 değerleri MC hatları ile karşılaştırıldığında daha düşüktür. Bu fenomenin açıklaması, her iki
ŞEKİL 3 İbrutinibin köpek mast hücresi (MC) hatlarının hayatta kalması üzerindeki etkileri. A, C2 hücreleri (sol paneller) ve NI-1 hücreleri (sağ paneller) kontrol ortamında (Co) veya çeşitli ibrutinib konsantrasyonlarında (1-25 μM) 37○C’de 24 veya 48 saat boyunca (belirtildiği gibi) inkübe edilmiştir.İnkübasyondan sonra, canlı (açık sütunlar), apoptotik (siyah sütunlar) ve nekrotik (gri sütunlar) hücrelerin yüzdeleri Giemsa boyalı slaytlar üzerinde ışık mikroskobu ile ölçülmüş ve toplam hücrelerin yüzdesi hesaplanmıştır. B, C2 hücreleri (sol panel) ve NI-1 hücreleri (sağ panel) (A)’da açıklandığı gibi inkübe edilmiştir. İnkübasyondan sonra hücreler Annexin V- ve DAPI boyama (akış sitometrisi) ile incelenmiştir. Sonuçlar, Annexin V (erken apoptoz) için sadece pozitif boyanan hücrelerin yüzdesi artı Annexin V ve DAPI (geç apoptoz) için “çift pozitif” hücrelerin yüzdesi eklenerek belirlenen tüm apoptotik hücrelerin yüzdesini göstermektedir. Sonuçlar her bir hücre hattında yapılan üç bağımsız deneyin ortalama ± SD değerini temsil etmektedir. Kontrol (Co) ilekarşılaştırıldığında *P < 0.05
MC hattının da agresif bir hastalık türünü temsil etmesi olabilir. Her iki MC hattı da sürekli in vitro kültürleme yoluyla yüksek ikiye katlanma süreleri nedeniyle seçilen hücrelerden gelmektedir ve bu nedenle orijinal tümörün en hızlı büyüyen alt klonundan türemişlerdir. Buna ek olarak, C2 hücreleri bir fare modelinden seri pasajlama yoluyla üretilmiş ve NI-1 hücreleri MC lösemili bir köpekten elde edilmiştir.29,30 Primer MCT hücrelerinin yüksek hassasiyetine katkıda bulunan ek faktör, C2 ve NI-1 hücreleri içinde kaybolan mikro çevreye olan bağımlılıkları olabilir.44 Tolere edilebilir ibrutinib dozları için literatürü taradık ve kronik lenfositik lösemiden muzdarip insan hastaların, 2,16 μM (953 ng/mL) stabil durum plazma seviyesine karşılık gelen günlük 560 mg ibrutinib uygulamasını tolere edebildiğini bulduk.45 Bu bilgilere dayanarak, ortalama erkek insanda (vücut ağırlığı: 80 kg) hesaplanan tolere edilebilir ibrutinib dozu günde 7 mg/kg olacaktır. Honigberg ve arkadaşları, köpeklerin günde 20 mg/kg gibi daha yüksek dozları 35 güne kadar ilgili yan etkiler olmaksızın tolere edebildiğini bildirmiştir.28 Bununla birlikte, köpeklerde günde 20 mg/kg ibrutinib uygulamasından sonra ulaşılabilecek plazma seviyeleri bildirilmemiştir.
TKI’lerin neoplastik hücreler üzerindeki büyüme inhibe edici etkileri genellikle bozulmuş tirozin kinaz aktivitesi ve ardışık apoptoz ile ilişkili olduğundan ve BTK’nın mantle lenfoma hücrelerinin hayatta kalması için önemli olduğu gösterildiğinden,46 ibrutinibin C2 ve NI-1 hücrelerinin canlılığı üzerindeki etkileriniaraştırdık. İbrutinibin yalnızca büyüme inhibisyonu
deneylerimizdekinden daha yüksek konsantrasyonlarda uygulandığında apoptozu indüklediği görülmüştür.
İbrutinib ile elde edilen EC50 değerleri her iki MC hattı için 10 ila 25 μM arasında değişmektedir; bu da EC50 değerlerinin sırasıyla 1,0 ila 10 μM ve 10 ila 25 μM arasında değiştiği mantle lenfoma hücre hatları Mino ve JeKo-1’deki bulgularla tutarlılık göstermektedir.46 Ayrıca, son veriler ibrutinibin lenfoid malignitelerde farmakolojik olarak ulaşılabilir konsantrasyonlarda apoptozu indüklemediğini göstermiştir.47-49
Neoplastic KIT mutasyonlarını barındıran neoplastik MC’ler TKI’lere karşı direnç kazanabilir; bu nedenle, köpek ve insan MC neoplazilerindeki mevcut araştırmalar bu sorunun üstesinden gelmek için ilaç kombinasyonlarına odaklanmaktadır.33,50 Mevcut çalışmada, ibrutinib ve KIT hedefleyici ilaçlar arasındaki kooperatif etkileri incelemek istedik. Midostaurin, insan KIT D816V+ MC’lerinin in vitro ve in vivo büyümesini baskıladığı iyi bilinen bir KIT hedefleyici ilaçtır.50-52 “İbrutinib + midostaurin” ilaç kombinasyonunun C2 hücrelerinde (CI < 1) sinerjik büyüme önleyici etkiler gösterdiğini, ancak NI-1 hücrelerinde göstermediğini tespit ettik. NI-1 hücrelerinde “ibrutinib + midostaurin” ilaç kombinasyonunun daha zayıf etkisinin muhtemel açıklaması, KIT’de birkaç farklı mutasyonun varlığı olabilir. Özellikle, C2 hücreleri yalnızca bir KIT mutasyonu içerirken, NI-1 hücrelerinin altı farklı KIT mutasyonu gösterdiği bilinmektedir; bu da NI-1 hücrelerinin daha hızlı çoğalmasına ve muhtemelen daha dirençli bir fenotipe neden olabilir.30 C2 ve NI-1 hücrelerinde diğer ilaç kombinasyonlarının etkilerini de test ettik.
ŞEKİL 4 İbrutinibin köpek mast hücresi (MC) hatlarının hayatta kalması üzerindeki etkileri. A, C2 hücreleri (sol paneller) ve NI-1 hücreleri (sağ paneller) kontrol ortamında (Co) veya çeşitli ibrutinib konsantrasyonlarında (1-25 μM) 37○C’de 24 veya 48 saat boyunca (belirtildiği gibi) inkübe edilmiştir. İnkübasyondan sonra, canlı (açık sütunlar), apoptotik (siyah sütunlar) ve nekrotik (gri sütunlar) hücrelerin yüzdeleri Giemsa boyalı slaytlar üzerinde ışık mikroskobu ile ölçülmüş ve toplam hücrelerin yüzdesi hesaplanmıştır. B, C2 hücreleri (sol panel) ve NI-1 hücreleri (sağ panel) (A)’da açıklandığı gibi inkübe edilmiştir. İnkübasyondan sonra hücreler Annexin V- ve DAPI boyama (akış sitometrisi) ile incelenmiştir. Sonuçlar, Annexin V (erken apoptoz) için sadece pozitif boyanan hücrelerin yüzdesi artı Annexin V ve DAPI (geç apoptoz) için “çift pozitif” hücrelerin yüzdesi eklenerek belirlenen tüm apoptotik hücrelerin yüzdesini göstermektedir. Sonuçlar her bir hücre hattında yapılan üç bağımsız deneyin ortalama ± SD değerini temsil etmektedir. Kontrol (Co) ile karşılaştırıldığında *P < 0.05
Toceranib ve masitinib, günlük pratikte köpek MCT hastalarını tedavi etmek için kullanılan iki KIT hedefleyici ilaçtır. “İbrutinib + toceranib” ve “ibrutinib + masitinib” ilaç kombinasyonlarının her iki MC hattında da ortak büyüme inhibitör etkileri olduğunu tespit ettik. Ancak, sinerjik büyüme inhibe edici etkiler görülmemiştir.
MC neoplazmlarından muzdarip hastalarda, klinik semptomlar MC kaynaklı aracıların etkilerinden de kaynaklanabilir.4,7 Bu çalışmada, ibrutinibin IgE’ye bağlı histamin salınımı üzerindeki etkilerini NI-1 hücrelerinde ve birincil MCT hücrelerinde test ettik. C2 hücreleri fonksiyonel olarak aktif bir IgE reseptörü eksprese etmedikleri için bu deneylerde kullanılamamıştır.53 NI-1 hücrelerinde ve primer mastositoma hücrelerinde ibrutinib ile elde edilen IC50 değerleri “farmakolojik” aralıkta (0,05-1 μM) bulunmuştur. Histamin salınımını engellemek için gereken konsantrasyonlar, proliferasyon ve sağkalımı engellemekten önemli ölçüde daha düşük olduğundan, ibrutinibin köpeklerde atopik dermatit veya gıda alerjileri gibi IgE’ye bağlı diğer hastalıklar için de klinik etkileri olabilir.54-57 Bulgularımız, BTK’nın insan BA’larında ve MC’lerinde ifade edildiğini ve ibrutinib ile BTK inhibisyonunun bu hücrelerde IgE’ye bağlı mediatör salınımının azalmasıyla ilişkili olduğunu gösteren önceki verilerle güçlendirilmiştir.3-27
Özet olarak, elde ettiğimiz veriler ibrutinibin köpek neoplastik MC’lerinde anti-proliferatif ve sağkalımı azaltıcı etkiler gösterdiğini kanıtlamaktadır. Ayrıca, ibrutinib ile BTK inhibisyonunun NI-1 hücrelerinde ve primer MCT hücrelerinde IgE’ye bağlı histamin salınımının konsantrasyona bağlı olarak baskılanmasıyla sonuçlandığını bulduk.
Bu gözlemler, BTK’nın hedeflenmesinin köpek MCT’sinde potansiyel tedavi yöntemi olabileceğini düşündürmektedir. Bu konseptin klinik etkisi halen aydınlatılmamıştır.
TEŞEKKÜRLER
Yazarlar, teknik deneylerdeki yardımları için D.B.’ye teşekkürü borç bilir. Bu çalışma Avusturya Bilim Fonu (FWF) tarafından desteklenmiştir: DK W1248-B30, SFB F4701-B20 ve SFB F4704-B20.
ÇIKAR ÇATIŞMASI BEYANI
Yazarlar herhangi bir çıkar çatışması beyan etmemiştir.
KATKIDA BULUNAN YAZARLAR
Çalışmayı S.G., P.V. ve E.H. tasarlamıştır. S.G. deneylerin çoğunu gerçekleştirmiş, verileri analiz etmiş ve şekil ve tabloları oluşturmuştur.
G.S. histamin salınımı ve 3H-timidin alım deneylerini ölçmüştür. B.P. Western blot deneylerini gerçekleştirmiştir. D.S. ve K.B. köpek tümör örneklerinden primer neoplastik MC’lerin izole edilmesine yardımcı olmuştur. D.S., M.W., P.V. ve E.H. verilerin yorumlanmasına yardımcı olmuştur. S.G., M.W., P.V. ve E.H.makalenin yazımına ve son düzenlemesine katılmıştır. Tüm yazarlar nihai makaleyi okumuş ve onaylamıştır.
VERİ ERİŞİM BEYANI
Tüm veri erişim talepleriniz için lütfen ilgili yazarlarla iletişime geçiniz.
ORCID
Susanne Gamperl https://orcid.org/0000-0002-6509-2810 Gabriele Stefanzl
https://orcid.org/0000-0002-6759-4662 Barbara Peter https://orcid.org/0000-0001-5701-5412 Dubravka Smiljkovic
https://orcid.org/0000-0002-4016-4259 Karin Bauer
https://orcid.org/0000-0001-9927-042XMichael Willmann
https://orcid.org/0000-0002-4260-1491 Peter Valent
https://orcid.org/0000-0003-0456-5095
Emir Hadzijusufovic https://orcid.org/0000-0001-7409-4204 KA YNAKÇA
- Dobson JM, Samuel S, Milstein H, Rogers K, Wood JL. Canine neopla- sia in the UK: estimates of incidence rates from a population of insured dogs. J Small Anim Pract. 2002;43:240-246.
- London CA, Seguin B. Mast cell tumors in the dog. Vet Clin North Am Small Anim Pract. 2003;33:473-489.
- Welle MM, Bley CR, Howard J, Rufenacht S. Canine mast cell tumours: a review of the pathogenesis, clinical features, pathology and treatment. Vet Dermatol. 2008;19:321-339.
- Misdorp W. Mast cells and canine mast cell tumours. A review. Vet Q. 2004;26:156-169.
- Sledge DG, Webster J, Kiupel M. Canine cutaneous mast cell tumors: a combined clinical and pathologic approach to diagnosis, prognosis, and treatment selection. Vet J. 2016;215:43-54.
- Kiupel M, Webster JD, Kaneene JB, Miller R, Yuzbasiyan-Gurkan V. The use of KIT and tryptase expression patterns as prognostic tools for canine cutaneous mast cell tumors. Vet Pathol. 2004;41:371-377.
- Blackwood L, Murphy S, Buracco P, et al. European consensus docu- ment on mast cell tumours in dogs and cats. Vet Comp Oncol. 2012; 10:e1-e29.
- Eichenseer M, Johansen C, Mueller RS. Efficacy of dimetinden and hydroxyzine/chlorpheniramine in atopic dogs: a randomised, con- trolled, double-blinded trial. Vet Rec. 2013;173:423.
- PetersLJ,KovacicJP.Histamine:metabolism,physiology,andpatho- physiology with applications in veterinary medicine. J Vet Emerg Crit Care (San Antonio). 2009;19:311-328.
- Lejeune A, Skorupski K, Frazier S, et al. Aggressive local therapy com- bined with systemic chemotherapy provides long-term control in grade II stage 2 canine mast cell tumour: 21 cases (1999-2012). Vet Comp Oncol. 2015;13:267-280.
- Thamm DH, Turek MM, Vail DM. Outcome and prognostic factors following adjuvant prednisone/vinblastine chemotherapy for high-risk canine mast cell tumour: 61 cases. J Vet Med Sci. 2006;68:581-587.
- Hahn KA, King GK, Carreras JK. Efficacy of radiation therapy for incompletely resected grade-III mast cell tumors in dogs: 31 cases (1987-1998). J Am Vet Med Assoc. 2004;224:79-82.
- Thamm DH, Mauldin EA, Vail DM. Prednisone and vinblastine chemo- therapy for canine mast cell tumor—41 cases (1992-1997). J Vet Intern Med. 1999;13:491-497.
14. Willmann M, Hadzijusufovic E, Hermine O, et al. Comparative oncol- ogy: the paradigmatic example of canine and human mast cell neo- plasms. Vet Comp Oncol.2019;17(1):1-10.
15. Hahn KA, Ogilvie G, Rusk T, et al. Masitinib is safe and effectivefor the treatment of canine mast cell tumors. J Vet Intern Med. 2008;22: 1301-1309.
16. London CA, Malpas PB, Wood-Follis SL, et al. Multi-center, placebo- controlled, double-blind, randomized study of oral toceranib phosphate (SU11654), a receptor tyrosine kinase inhibitor, for the treatment of dogs with recurrent (either local or distant) mast cell tumor following surgical excision. Clin Cancer Res. 2009;15:3856-3865.
17. London CA. Tyrosine kinase inhibitors in veterinary medicine. Top Companion Anim Med. 2009;24:106-112.
18. Niemann CU, Wiestner A. B-cell receptor signaling as a driver of lym- phoma development and evolution. Semin Cancer Biol. 2013;23:410-421.
19. Hendriks RW, Yuvaraj S, Kil LP. Targeting Bruton’s tyrosine kinase in B cell malignancies. Nat Rev Cancer. 2014;14:219-232.
20. Maddocks K, Blum KA. Ibrutinib in B-cell lymphomas. Curr Treat Options Oncol. 2014;15:226-237.
21. Gleixner KV, Mayerhofer M, Cerny-Reiterer S, et al. KIT-D816V- independent oncogenic signaling in neoplastic cells in systemic mas- tocytosis: role of Lyn and Btk activation and disruption bydasatinib and bosutinib. Blood. 2011;118:1885-1898.
22. Li T , Deng Y , Shi Y , et al. Bruton’s tyrosine kinase potentiates ALK sig- naling and serves as a potential therapeutic target of neuroblastoma. Oncogene. 2018;37:6180-6194.
23. Yao L, Kawakami Y, Kawakami T. The pleckstrin homology domain of Bruton tyrosine kinase interacts with protein kinase C. Proc Natl Acad Sci U S A.1994;91:9175-9179.
24. Kuehn HS, Swindle EJ, Kim MS, Beaven MA, Metcalfe DD, Gilfillan AM. The phosphoinositide3-kinase-dependent activation of Btk is required for optimal eicosanoid production and generation of reactive oxygen species in antigen-stimulated mast cells. J Immunol. 2008;181:7706-7712.
25. Ishmael S and MacGlashan D, Jr. Early signal protein expression pro- files in basophils: a population study. J Leukoc Biol 2009;86:313–325.
26. MacGlashan D Jr, Honigberg LA, Smith A, Buggy J, Schroeder JT. Inhi- bition of IgE-mediated secretion from human basophils with a highly selective Bruton’s tyrosine kinase, Btk, inhibitor . Int Immunopharmacol. 2011;11:475-479.
27. Smiljkovic D, Blatt K, Stefanzl G, et al. BTK inhibition is a potent approach to block IgE-mediated histamine release in human baso- phils. Allergy. 2017;72:1666-1676.
28. Honigberg LA, Smith AM, Sirisawad M, et al. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy. Proc Natl Acad Sci U S A.2010;107:13075-13080.
29. DeVinney R, Gold WM. Establishment of two dog mastocytoma cell lines in continuous culture. Am J Respir Cell Mol Biol. 1990;3:413-420. 30. Hadzijusufovic E, Peter B, Herrmann H, et al. NI-1: a novel canine mastocytoma model for studying drug resistance and IgER-dependent
mast cell activation. Allergy. 2012;67:858-868.
31. Butterfield JH, Weiler D, Dewald G, Gleich GJ. Establishment of an
immature mast cell line from a patient with mast cell leukemia. Leuk
Res. 1988;12:345-355.
32. Peter B, Gleixner KV, Cerny-Reiterer S, et al. Polo-like kinase-1 as a
novel target in neoplastic mast cells: demonstration of growth- inhibitory effects of small interfering RNA and the polo-like kinase-1 targeting drug BI 2536. Haematologica. 2011;96:672-680.
33. Gleixner KV, Rebuzzi L, Mayerhofer M, et al. Synergistic antip- roliferative effects of KIT tyrosine kinase inhibitors on neoplastic canine mast cells. Exp Hematol. 2007;35:1510-1521.
34. Bauer K, Hadzijusufovic E, Cerny-Reiterer S, et al. IL-4 downregulates expression of the target receptor CD30 in neoplastic canine mast cells. Vet Comp Oncol.2017;15:1240-1256.
- London CA, Galli SJ, Yuuki T, Hu ZQ, Helfand SC, Geissler EN. Spon- taneous canine mast cell tumors express tandem duplications in the proto-oncogene c-kit. Exp Hematol. 1999;27:689-697.
- Metcalfe DD. Classification and diagnosis of mastocytosis: current status. J Invest Dermatol. 1991;96:2S-4S; discussion 4S, 60S-65S.
- Valent P , Horny HP , Escribano L, et al. Diagnostic criteria and classifi-
cation of mastocytosis: a consensus proposal. Leuk Res. 2001;25:
603-625.
- Escribano L, Akin C, Castells M, Orfao A, Metcalfe DD. Mastocytosis:
current concepts in diagnosis and treatment. Ann Hematol. 2002;81:
677-690.
- Halsey CH, Gustafson DL, Rose BJ, et al. Development of an in vitro
model of acquired resistance to toceranib phosphate (palladia[R]) in
canine mast cell tumor. BMC Vet Res. 2014;10:105.
- Buggy JJ, Elias L. Bruton tyrosine kinase (BTK) and its role in B-cell
malignancy. Int Rev Immunol. 2012;31:119-132.
- Keller A, Wingelhofer B, Peter B, et al. The JAK2/STAT5 signaling
pathway as a potential therapeutic target in canine mastocytoma. Vet
Comp Oncol. 2018;16:55-68.
- PatelV,BalakrishnanK,BibikovaE,etal.Comparisonofacalabrutinib,
a selective Bruton tyrosine kinase inhibitor, with ibrutinib in chronic
lymphocytic leukemia cells. Clin Cancer Res. 2017;23:3734-3743.
- Gilfillan AM, Rivera J. The tyrosine kinase network regulating mast
cell activation. Immunol Rev. 2009;228:149-169.
- Gillet JP , Varma S, Gottesman MM. The clinical relevance of cancer
cell lines. J Natl Cancer Inst. 2013;105:452-458.
- European Medicines Agency . https://www .ema.europa.eu/
documents/product-information/imbruvica-epar-product-information_
en.pdf. Accessed March 4,2019.
- Cinar M, Hamedani F, Mo Z, Cinar B, Amin HM, Alkan S. Bruton tyrosine
kinase is commonly overexpressed in mantle cell lymphoma and its atten-
uation by ibrutinib induces apoptosis. Leuk Res. 2013;37:1271-1277.
- Cheng S, Ma J, Guo A, et al. BTK inhibition targets in vivo CLL prolif- erationthroughitseffectsonB-cellreceptorsignalingactivity.Leuke-
50. Gleixner KV, Peter B, Blatt K, et al. Synergistic growth-inhibitory effects of ponatinib and midostaurin (PKC412) on neoplastic mast cells carrying KIT D816V. Haematologica. 2013;98:1450-1457.
51. Valent P, Akin C, Hartmann K, et al. Midostaurin: a magic bullet that blocks mast cell expansion and activation. Ann Oncol. 2017;28:2367- 2376.
52. Gotlib J, Kluin-Nelemans HC, George TI, et al. Efficacy and safety of midostaurin in advanced systemic mastocytosis. N Engl J Med. 2016; 374:2530-2541.
53. Brazis P, Torres R, Queralt M, de Mora F, Ferrer L, Puigdemont A. Evaluation of cell-surface IgE receptors on the canine mastocytoma cell line C2 maintained in continuous culture. Am J Vet Res 2002;63: 763–766.
54. de Mora F, Puigdemont A, Torres R. The role of mast cells inatopy: what can we learn from canine models? A thorough review of the biology of mast cells in canine and human systems. Br J Dermatol. 2006;155:1109-1123.
55. Hill PB, Hillier A, Olivry T. The ACVD task force on canine atopic der- matitis (VI): IgE-induced immediate and late-phase reactions, two inflammatory sequences at sites of intradermal allergen injections. Vet Immunol Immunopathol. 2001;81:199-204.
56. Kennis RA. Food allergies: update of pathogenesis, diagnoses, and management. Vet Clin North Am Small Anim Pract. 2006;36:175-184. vii-viii.
57. Hill PB, Olivry T. The ACVD task force on canine atopic dermatitis (V): biology and role of inflammatory cells in cutaneous allergic reac- tions. Vet Immunol Immunopathol. 2001;81:187-198.
58. Patnaik AK, Ehler WJ, MacEwen EG. Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 dogs. Vet Pathol. 1984;21:469-474.
EK BİLGİLER
Ek bilgileri bu makalenin sonundaki “Ek Bilgiler” bölümünde
mia. 2014;28:649-657. bulabilirsiniz.
- Guo A, Lu P , Galanina N, et al. Heightened BTK-dependent cell prolif-
eration in unmutated chronic lymphocytic leukemia confers increased
sensitivity to ibrutinib. Oncotarget. 2016;7:4598-4610.
- Guo A, Lu P, Coffey G, Conley P, Pandey A, Wang YL. DualSYK/JAK inhibition overcomes ibrutinib resistance in chronic lymphocytic leu- kemia: cerdulatinib, but not ibrutinib, induces apoptosis of tumor cells protected by the microenvironment. Oncotarget. 2017;8:12953-
12967.
Bu makaleye atıfta bulunmak için: Gamperl S, Stefanzl G, Peter B, et al. Effects of ibrutinib on proliferation and histamine release in canine neoplastic mast cells. Vet Comp Oncol. 2019;17: 553–561. https://doi.org/10.1111/vco.12520