| Veteriner Klinik Patobiyoloji Bölümü, Tarım ve Yaşam Bilimleri Enstitüsü, Tokyo Üniversitesi, Tokyo, Japonya J. Vet. Med. Sci. Teslim Edildi: 9 Mayıs 2023 *Yazışmalar için: Maeda S: amaeda@g.ecc.u-tokyo.ac.jp, Veteriner Klinik Patobiyoloji Bölümü, Tarım ve Yaşam Bilimleri Enstitüsü, Tokyo Üniversitesi, 1-1-1 Yayoi, Bunkyo-ku, Tokyo 113-8657, Japonya ©2023 Japon Veteriner Bilimleri Derneği |
| ÖZET Yeni nesil dizileme kullanılarak moleküler biyoloji ve biyoinformatiğin geliştirilmesi, çeşitli hastalıklarda rol oynayan moleküllerin tanımlanmasını ve patogenezlerinin aydınlatılmasını önemli ölçüde ilerletmiştir. Sonuç olarak, tıp alanında birçok moleküler hedefli tedavi geliştirilmiştir. Veterinerlik alanında, hayvanlar için dünyanın ilk moleküler hedefli ilacı olan masitinib 2008 yılında onaylanmış, bunu 2009 yılında multikinaz inhibitörü toceranib izlemiştir. Toceranib başlangıçta köpeklerdeki mast hücresi tümörleri için onaylanmıştır ancak anjiyogenezde rol oynayan molekülleri inhibe etme kabiliyeti nedeniyle diğer tümörlerde de etkili olduğu gösterilmiştir. Böylece, toceranib köpekler için moleküler hedefli bir kanser tedavisi olarak büyük başarı elde etmiştir. Toceranib’in başarısından bu yana kanser tedavisi için yeni moleküler hedefli ilaçların geliştirilmesi ve ticarileştirilmesinde ilerleme kaydedilmemiş olsa da, son zamanlarda birkaç klinik çalışma, tümörlü köpeklere araştırma aşamasında yeni ajanların kullanıldığını bildirmiştir. Bu derleme, köpek tümörleri, özellikle de transizyonel hücreli karsinomlar için moleküler hedefli ilaçlara genel bir bakış sağlamakta ve son verilerimizden bazılarını sunmaktadır. ANAHTAR KELİMELER: köpek, klinik çalışma, moleküler hedefli ilaç, translasyonel araştırma |
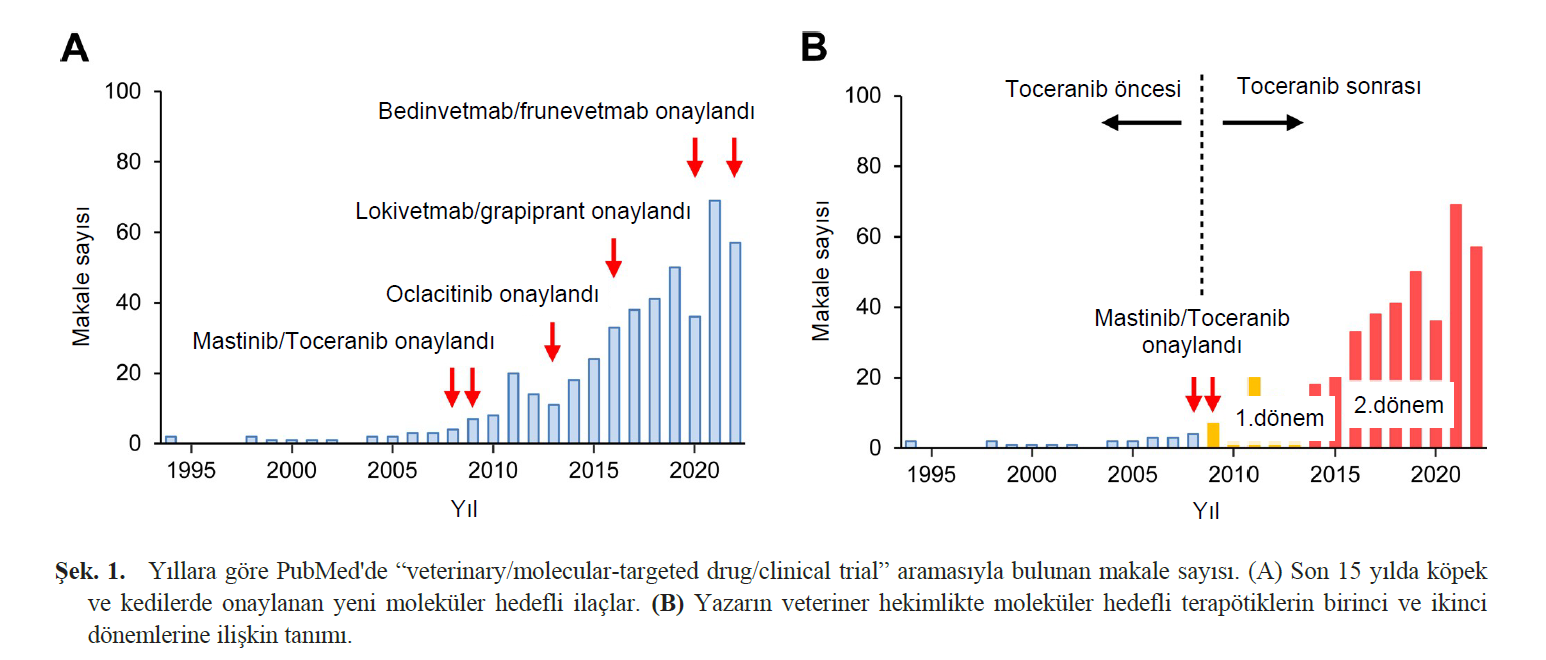
| 1890’larda Paul Ehrlich ilk olarak hedefe yönelik tedavinin bilimsel konseptini “ sihirli ilaç/tedavi” olarak önermiş ve vücut üzerinde toksik etki yaratmadan belirli hedefleri öldürmenin mümkün olabileceğini varsaymıştır [45]. Bu teori başlangıçta kanserin moleküler biyolojisi hakkındaki yetersiz bilgi nedeniyle kanser tedavisine değil enfeksiyon hastalıklarına uygulanmış olsa da, kavram o zamandan beri moleküler hedefli kanser tedavisine kadar genişletilmiştir. Beşeri tıpta, kanser tedavisi için onaylanan ilk moleküler hedefli ilaçlar, 1998 yılında HER2-pozitif meme kanseri tedavisi için onaylanan bir anti-insan epidermal büyüme faktörü reseptörü 2 (HER2) monoklonal antikoru olan trastuzumab ve 2001 yılında Philadelphia kromozomu pozitif kronik miyelojenöz lösemi için onaylanan breakpoint cluster region- Abelson’u (BCR-ABL) hedefleyen küçük moleküllü bir tirozin kinaz inhibitörü olan imatinib olmuştur [1]. Bu ajanların klinik başarısı, kanser tedavisinde moleküler hedefli ilaçların yaygın kullanımı için bir paradigma sağlamıştır ve o zamandan beri bir dizi moleküler hedefli antikanser tedavisi kanser hastalarında klinik kullanım için onaylanmıştır. Moleküler hedefli ilaçlar, belirli proteinleri (molekülleri) hedef alan ve işlevlerini engelleyen ilaçlar olarak tanımlanmaktadır [2]. Genel olarak, “moleküler hedefli ilaç” terimi hem küçük moleküllü bileşikleri hem de antikor ilaçları içerir. Küçük moleküllü ilaçlar hücre yüzeyindeki, sitoplazmadaki ve çekirdekteki tüm proteinleri hedef alırken, antikor ilaçlar hücre yüzeyinde ifade edilen proteinleri hedef alır (antikorlar makromoleküllerdir ve hücre zarından geçemezler). Küçük moleküllü ilaçların çoğu ağızdan alınır ve günlük olarak uygulanabilirken, protein bazlı antikor ilaçları sindirilir ve ağızdan alınamaz; bu nedenle intravenöz enjeksiyon yoluyla uygulanırlar. Antikor ilaçların hedef moleküllerine özgüllüğü çok yüksektir ve hedef dışındaki moleküllerle nadiren çapraz reaksiyona girerler. Bununla birlikte, küçük moleküllü ilaçların özgüllüğü genellikle düşüktür ve genellikle hedefe yapısal olarak benzeyen diğer moleküllerle çapraz reaksiyona girerler. Örneğin, KIT için bir moleküler hedefleme ajanı olan imatinib, başlangıçta BCR-ABL adı verilen anormal bir proteine bağlanan bir ilaç olarak geliştirilmiştir. Toceranib gibi multikinaz inhibitörleri, hedef molekül için düşük özgüllüklerinden yararlanarak tümör ilerlemesinde rol oynayan birden fazla molekülü hedeflemek üzere tasarlanmıştır. Küçük moleküllü ilaçlar kimyasal sentez yoluyla ucuza üretilebilir ve bu nedenle düşük üretim maliyetlerine sahipken, protein preparatları olan antikor ilaçların üretim maliyetleri yüksektir. Küçük moleküllü bileşiklerin çoğu kinaz adı verilen proteinleri hedef almak üzere tasarlanmıştır [19]. Kinazlar, ATP’nin fosfat grubunu substrat proteine aktaran enzimler için kullanılan genel bir terimdir. Küçük moleküllü bileşikler, kinazlar üzerindeki inhibitör etkilerini, kinazın “ATP cebi” olarak adlandırılan ATP bağlama bölgesine rekabetçi bir şekilde bağlanarak gösterirler, ancak yukarıda belirtildiği gibi özgüllükleri yüksek değildir. Bu nedenle, birçok küçük moleküllü bileşik birden fazla kinaza karşı inhibitör etki gösterir. Hedeflenen kinazlar, fosforilasyona uğrayan substratın amino asit kalıntısı tipine göre tirozin kinazlar, serin/treonin kinazlar, histidin kinazlar ve aspartat/glutamat kinazlar olarak sınıflandırılır. Küçük moleküllü bileşiklerin çoğu, özellikle reseptör tirozin kinazları (RTK’lar) hedefleyen tirozin kinaz inhibitörleridir. Temsili RTK’lar arasında KIT, vasküler endotelyal büyüme faktörü reseptörü (VEGFR), trombosit kaynaklı büyüme faktörü reseptörü (PDGFR), epidermal büyüme faktörü reseptörü (EGFR) ve HER2 bulunur. RTK’lar ligand bağlandıktan sonra dimerler oluşturur ve reseptör üzerindeki tirozin kalıntılarının fosforilasyonu ile aktive olurlar. Aktive olan RTK’lar fosforilasyon yoluyla hücre içi sinyal moleküllerini (reseptör tipi olmayan kinazlar) aktive eder. Aktive edilmiş hücre içi reseptör tipi olmayan kinazlar daha sonra sırayla bir sonraki sinyal molekülleri setini fosforile eder ve son olarak fosforile edilmiş sinyal molekülleri gen transkripsiyonunun indüklendiği ve işlevlerini yerine getirmek için proteinlerin üretildiği çekirdeğe göç eder. MAP kinaz yolunun bir bileşeni olan V-raf murin sarkom viral onkogen homolog B1 (BRAF), veteriner onkolojisinde iyi bilinen ve reseptör olmayan bir kinazdır ve aşağıdaki “BRAF inhibitörü” bölümünde daha ayrıntılı olarak ele alınmıştır. VETERİNERLİKTE MOLEKÜLER HEDEFLİ İLAÇLARIN İKİNCİ DÖNEMİ Şekil 1A, PubMed’de “veterinerlik/moleküler hedefli ilaç/klinik deneme” aramasıyla bulunan makalelerin yıllara göre sayısını göstermektedir. Hücre dizileri veya kanser taşıyan fare modelleri yerine köpek ve kedilerde moleküler hedefli ilaçların klinik denemeleri hakkındaki makalelerin sayısı ilginç bir eğilim göstermektedir: 1990’larda ve 2000’lerin başında sıfır ila birkaç makale vardı ve makale sayısı 2009 civarında kademeli olarak arttı. Bu durum, dünyanın ilk moleküler hedefli veteriner ilacı olan masitinibin 2008 yılında ve toceranibin 2009 yılında Avrupa ve Amerika Birleşik Devletleri’nde onaylanmasıyla ilgili olabilir. Daha sonra şunlar da onaylanmıştır: Janus kinaz (JAK) inhibitörü oclacitinib 2013 yılında köpek atopik dermatitinin tedavisi için onaylanmıştır, 2016 yılında köpek atopik dermatitinin tedavisi için anti-kanin interlökin-31 (IL-31) antikoru lokivetmab, 2016’da osteoartrit için prostaglandin E2 reseptör 4 (EP4) inhibitörü grapiprant ve sırasıyla 2020 ve 2022’de osteoartrit için anti-kanin sinir büyüme faktörü (NGF) antikoru bedinvetmab ve anti-kedi NGF antikoru frunevetmab (Şek. 1A). Kuşkusuz, moleküler hedefli terapötikler çağı, tıpkı beşeri tıp alanında olduğu gibi veteriner hekimlik alanında da kendini göstermiştir. Ne yazık ki, toceranib’in onaylanmasından bu yana onkolojik hastalıklar için yeni moleküler hedefli ilaçların onaylanması ve klinik uygulaması sağlanamamıştır. Yazarın görüşüne göre, toceranib’in veteriner hekimlikte kanser tedavisi üzerindeki etkisi o kadar önemli olmuştur ki, belirli bir gerekliliği tatmin edici bir şekilde yerine getirdiği için, toceranib’i takip eden bir ilacın geliştirilmesini geciktirmiş olabilir. Yazar, toceranibin tanıtıldığı 2008’den önceki dönemi “toceranib öncesi” ve 2009’dan sonraki dönemi “toceranib sonrası (moleküler hedefli tedaviler dönemi)” olarak tanımlamaktadır (Şekil 1B). 2009 sonrası moleküler hedefli terapötikler döneminde, 2011 ve 2021’de iki zirve kaydedilmiştir. Toceranib’in piyasaya sürülmesinden sonraki ilk beş yıl boyunca (2009-2013), mast hücreli tümörler ve diğer tümörlerde toceranib klinik çalışmaları yürütülmüştür; ancak 2015 yılı civarında, tamamen yeni molekülleri hedefleyen yeni ajanların birkaç klinik çalışması başlamıştır. Klinik çalışmaların çoğu hala pilot çalışmalar olmasına rağmen, yeni nesil kanser tedavisinde rol oynayacak yeni moleküler hedefli ilaçlar için büyük bir potansiyel bulunmaktadır. |
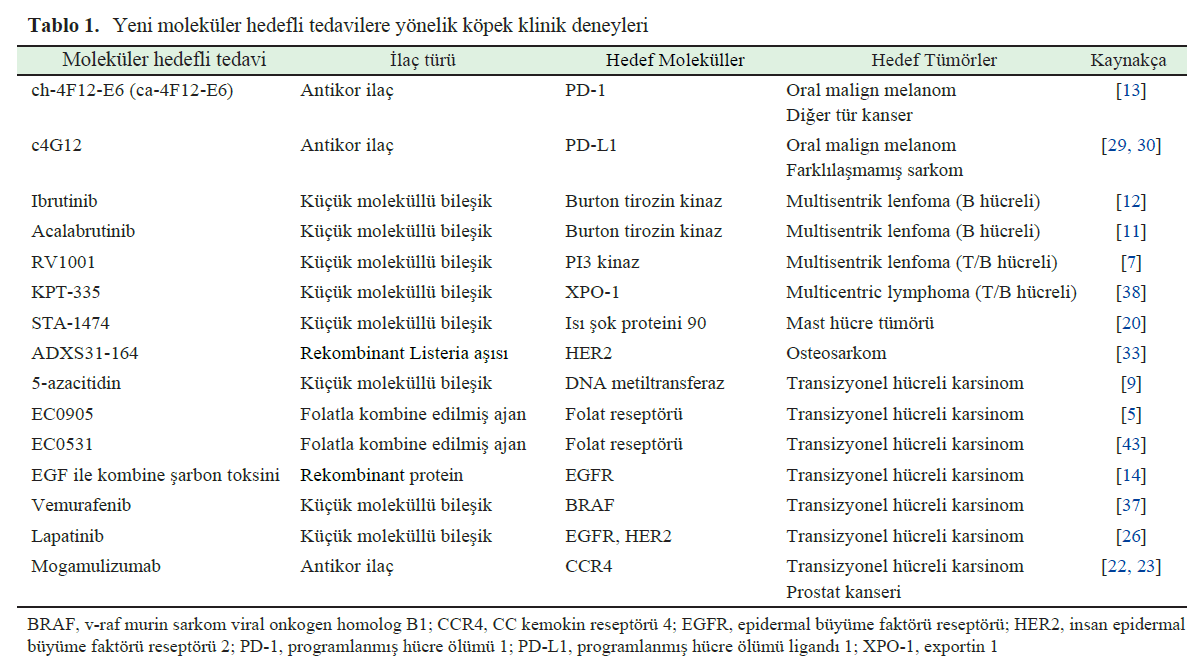
| KÖPEK TÜMÖRLERİNDE YENİ MOLEKÜLER HEDEFLİ İLAÇLAR KONUSUNDA ÖNEMLİ BİLGİLER Önceki bölümde de belirtildiği gibi, yazar veteriner hekimlikte ikinci nesil moleküler hedefli terapötikler çağının geldiğine inanmaktadır. Malign tümörlü köpeklere uygulanan yeni nesil moleküler hedefli ilaçların klinik çalışma sonuçları son on yılda rapor edilmiştir. Tablo 1, köpek tümörleri için yeni moleküler hedefli ilaçlarla ilgili ön çalışmalar da dahil olmak üzere araştırma makalelerini özetlemektedir [5, 7, 9, 11–14, 20, 22, 23, 26, 29, 30, 33, 37, 38, 43]. Bunlardan en dikkate değer olanları, programlanmış hücre ölümü 1 (PD-1), programlanmış hücre ölümü ligand 1 (PD-L1) ve sitotoksik T lenfosit ilişkili antijen 4 (CTLA-4) gibi kendine ve aşırı inflamasyona karşı bağışıklık tepkilerini baskılayan bir grup molekül olan bağışıklık kontrol noktası moleküllerini [13, 29, 30] hedef alan antikor ilaçlardır [46]. Bu moleküller, kendi antijenlerine ve yakınsak bağışıklık tepkilerine yanıt veren T hücrelerini baskılayarak veya ortadan kaldırarak homeostazın korunmasında önemli bir rol oynar; ancak tümör hücreleri tarafından bağışıklık saldırısından kaçmak için de kullanılırlar. İmmün kontrol noktası moleküllerinin bağlanmasını engelleyen antikor ilaçlar, çeşitli insan tümörlerine karşı yenilikçi terapötik ajanlardır. Veteriner tıpta immün kontrol noktası inhibitörlerinin dünyadaki ilk köpek klinik denemesi, Dr. Konnai’nin Hokkaido Üniversitesi’ndeki araştırma ekibi tarafından yürütülen ve 2017 ve 2021’de yayınlanan makalelerle anti-PD-L1 antikor denemeleriydi [29, 30]. Bu klinik çalışmalarda, anti-PD-L1 antikorları öncelikle oral malign melanomlu köpeklere uygulanmış ve yanıt oranı düşük olmasına rağmen (%7,7-14,3), bazı vakalarda akciğer metastazlarının kaybolması da dahil olmak üzere çarpıcı sonuçlar gözlemlenmiştir. Anti-PD-L1 antikoru ile tedavi edilen köpeklerde, tarihsel kontrol grubuna kıyasla genel anlamda sağkalım açısından da bir fayda ( ortalama 143 gün) gözlenmiştir. 2020 yılında, Dr. Mizuno’nun Yamaguchi Üniversitesi’ndeki araştırma ekibi, esas olarak oral malign melanomlu köpeklere uygulanan anti-PD-1 antikor ilaçlarının klinik bir çalışmasını rapor etmiştir [13]. Bu klinik çalışmadaki yanıt oranı %16,7 ile nispeten düşük olsa da, IV. evre hastalığı olan bazı köpeklerde akciğer metastazlarında küçülme ve tarihsel kontrol grubuna kıyasla genel olarak sağkalım faydası ( ortalama 166 gün) görülmüştür. Genel olarak, bağışıklık kontrol noktası molekülleri PD-1 ve PD-L1’i hedefleyen antikor ilaçları için yanıt oranı düşüktür (yaklaşık %10), ancak yanıt verenler geç evre hastalıkta bile tümör küçülmesi gösterebildiğinden çok umut vericidir. Gelecekteki zorluklardan biri, hangi vakaların immün kontrol noktası inhibitörlerinden fayda göreceğini öngörebilecek biyobelirteçler geliştirmektir. Yakın zamanda yapılan bir çalışmada, bir diğer önemli immün kontrol noktası molekülü olan CTLA-4’e karşı köpek antikor ilacı rapor edilmiştir; ancak köpeklerde anti-CTLA-4 antikorunun klinik çalışmaları henüz rapor edilmemiştir [32]. Yazar daha sonra Burton tirozin kinaz (BTK) inhibitörleriyle ilgilenmiştir (Tablo 1). BTK, B-hücresi reseptörünün (BCR) aşağı akışında (downstream) yer alan reseptör olmayan tirozin kinazdır ve B-lenfosit farklılaşması, büyümesi ve aktivasyonu için önemli bir sinyal molekülüdür. İbrutinib, 2007 yılında geliştirilmesinden sadece 6 yıl sonra, 2013 yılında insan mantle hücreli lenfomasında kullanım için onaylanan seçici bir BTK inhibitörüdür; çok merkezli B hücreli lenfomalı köpeklerde 2010 yılında yapılan bir klinik çalışma bu erken onayı hızlandırmıştır [12]. Bu çalışma, insanlar için klinik öncesi denemelerde köpek klinik vakalarının yararlılığını göstermesi açısından bir dönüm noktasıydı ve küresel ekonomi dergisi Forbes bu çalışmanın çabalarını takdir etti. Daha sonra, çok merkezli B-hücreli lenfomalı köpeklerde BTK için daha yüksek seçicilik ve afiniteye sahip acalabrutinib klinik çalışması da yürütülmüştür [11]. |
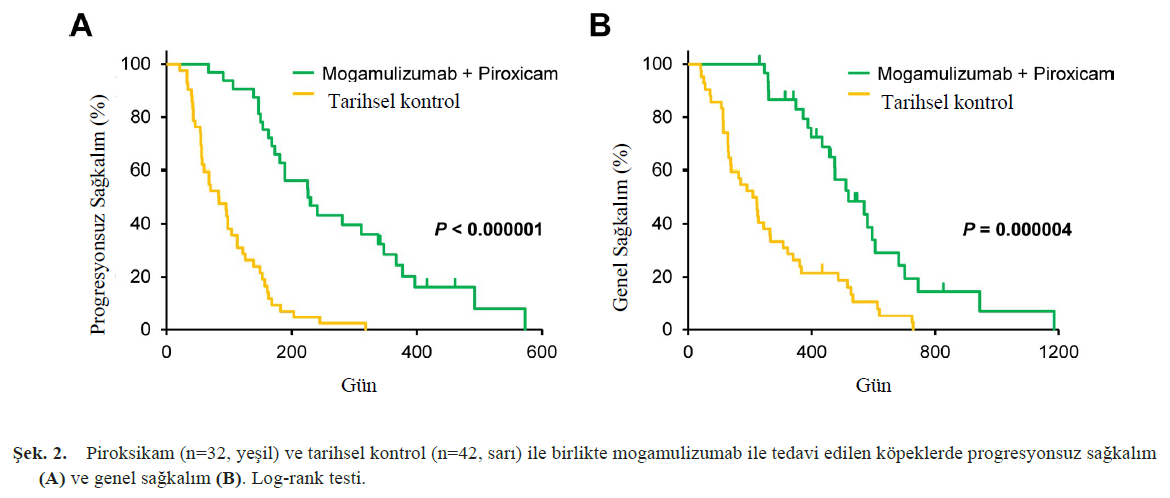
| Yazarlar için bir başka ilgi çekici nokta da yeni ajanların uygulandığı hedef hastalıktı. Tablo 1’de gösterildiği üzere, klinik çalışmalarda en sık görülen tümör tipi transizyonel hücreli karsinom olup, bunu multisentrik lenfoma takip etmektedir. Lenfoma tüm köpek tümörlerinin %10-20’sini oluşturduğu için çok merkezli lenfomalara yönelik klinik çalışmaların sayısı yüksektir; ayrıca köpek vakalarının klinik çalışmalara dahil edilmesi insan vakalarına kıyasla nispeten daha kolaydır. Buna karşılık, transizyonel hücreli karsinom tüm köpek tümörlerinin yaklaşık %2’sini oluşturmaktadır ve bu da onu nispeten nadir bir vaka haline getirmektedir. Transizyonel hücreli karsinom, etkili bir tedavisi olmadığı için yeni moleküler hedefli ilaçlar için klinik çalışmaların en yaygın hedefidir. Cerrahi genellikle solid tümörler için ilk basamak tedavi olsa da, tümör hücreleri kolayca istila etme ve yayılma eğiliminde olduğundan ve total sistektomi üriner inkontinans ve piyelonefrit gibi önemli komplikasyonlarla ilişkili olduğundan, transizyonel hücreli karsinom için genellikle endike değildir. Bu nedenle, bu yeni ilaçları klinik çalışmalara dahil etmek kolaydır. Bir başka neden de Perdue Üniversitesi’nden Profesör Knapp’ın köpek transizyonel hücreli karsinomları üzerinde aktif olarak klinik çalışmalar yürütüyor olmasıdır. Dr. Knapp, köpek klinik vakalarını insan tümörleri için uygun bir hayvan modeli olarak kullanan ve köpek geçiş hücreli karsinomu ile insan mesane kanseri arasındaki benzerliklere odaklanan translasyonel araştırmalarda bir öncüdür. Dr. Knapp’ın araştırma ekibi, transizyonel hücreli karsinomlu köpeklerde veteriner hekim tarafından başlatılan birkaç klinik çalışma yürütmüş ve insan tıbbından önce geliştirilmekte olan yeni ajanların kullanımına öncülük etmiştir; bu da transizyonel hücreli karsinomun köpeklerde yeni ilaçların en fazla klinik çalışmasının yapıldığı tümör türü olmasında önemli bir faktör olabilir. Bir sonraki bölümde, köpek transizyonel hücreli karsinomu için mevcut trend konuyu ve yeni moleküler hedefli ilaçları tartışacağız. KÖPEK TRANSİYONEL HÜCRE KARSİNOMU İÇİN YENİ MOLEKÜLER HEDEFLİ İLAÇLAR Multi-kinaz inhibitörü: toceranib Toceranib, PDGFR, VEGFR ve KIT’i inhibe eden moleküler hedefli bir ilaçtır ve aynı zamanda FLT3, CSFR-1 ve RET gibi diğer moleküller üzerinde inhibitör etkiler gösteren bir multi-kinaz inhibitörüdür. Toceranib’in köpek mast hücreli tümörlerindeki etkinliği çok merkezli, randomize, çift kör bir faz III klinik çalışmada gösterilmiş ve 2009 yılında tekrarlayan mast hücreli tümörlerin tedavisi için onaylanmıştır [21]. Toceranibin mast hücreli tümörlerdeki terapötik etkisi, yanıt oranı c-KIT mutasyonları ile ilişkili olduğundan, esas olarak KIT inhibisyonuna bağlı olabilir. Toceranib ayrıca PDGFR ve VEGFR gibi anjiyogenezde rol oynayan molekülleri de inhibe eder ve bu nedenle mast hücreli tümörler dışındaki köpek malignitelerinde de kullanılır. Toceranibin apokrin bez anal kese adenokarsinomu, tiroid kanseri ve gastrointestinal stromal tümörde etkinliği doğrulanmıştır [3, 18]. Köpek transizyonel hücreli karsinomunda tümör hücreleri yüksek düzeyde PDGFR ve VEGFR eksprese ettiğinden, toceranibin etkinliği beklenmekteydi [47]. Yakın zamanda, retrospektif bir çalışma, köpek transizyonel hücreli karsinomunun tedavisi için toceranibin etkinliğini bildirmiştir. Ne yazık ki, sonuçlar konvansiyonel tedaviden önemli ölçüde daha etkili değildi: %7 kısmi remisyon (PR), %80 stabil hastalık (SD) ve %13 progresif hastalık (PD), medyan progresyonsuz sağkalım (PFS) 96 gün ve medyan genel sağkalım (OS) 149 gün [8]. Bununla birlikte, bu çalışmadaki transizyonel hücreli karsinom vakalarının %90’ından fazlası steroid olmayan anti-enflamatuar ilaçlar (NSAID’ler) veya antikanser ajanlarla tedavi edilmişti. Birkaç köpek kısmi remisyon elde etse de, klinik fayda oranı %87’dir ve bu da toceranibin birçok vakada tümör ilerlemesini engellediğini göstermektedir. İlk basamak tedavi olarak veya NSAID’ler veya antikanser ajanlarla kombinasyon halinde toceranibin etkinliğini değerlendirmek için daha fazla klinik çalışmaya ihtiyaç vardır. DNA metiltransferaz inhibitörü: 5-azasitidin Tümör baskılayıcı genlerin ekspresyonunun azalması ve bozulması çeşitli tümörlerde belirgindir ve tümörigenez ile ilişkilidir. Geleneksel olarak, mutasyonlar nedeniyle tümör baskılayıcı gen işlevinin kaybı tümörün başlamasına ve ilerlemesine neden olur. Bununla birlikte, DNA metilasyonu ve histon asetilasyonu gibi epigenetik anormallikler de tümör baskılayıcı genlerin ekspresyonunun azalmasına neden olan faktörlerdir. DNA metilasyonunu destekleyen bir enzim olan DNA metiltransferaz 1’in (DNMT1) artmış gen ekspresyonu ve bir tümör baskılayıcı gen olan CDKN2A’nın hipermetilasyonu, köpek transisyonel hücre karsinomunda bildirilmiştir ve bu da anormal DNA metilasyonunun köpeklerde gelişim ve ilerleme ile ilişkili olduğunu düşündürmektedir [4, 9]. İnsanlarda miyelodisplastik sendromu tedavi etmek için kullanılan 5-azasitidin, DNA metiltransferaz aktivitesini baskılayarak DNA metilasyonunu inhibe eder [15]. 2012 yılında, köpek transizyonel hücreli karsinomu için 5-azasitidin faz I çalışması rapor edilmiştir [9]. Bu bir pilot çalışma olduğu için sağkalım değerlendirilmemiştir; bununla birlikte, %22 PR, %50 SD ve %28 PD ile bazı terapötik etkinlik gözlenmiştir. Bununla birlikte, köpeklerin yaklaşık %30’unda 5-azasitidinin bir advers olayı olarak şiddetli nötropeni (VCOG-CTECAE derece 3 veya 4) bildirilmiştir, bu nedenle ayarlanmış dozaj ve dozlama aralıkları ile daha ileri çalışmalar gereklidir. Folat-kombine antikanser ajanlar Tümör hücreleri folat reseptörlerini normal hücrelerden daha yüksek seviyelerde ifade eder ve folatı (B9 vitamini) aktif olarak alır. Folat, amino asitlerin ve DNA’nın sentezi için önemlidir ve bu nedenle tümör hücrelerinde aktif hücre bölünmesi için gerekli bir besindir. Folat reseptörleri, köpek transizyonel hücreli karsinom vakalarının %75’inden fazlasında yüksek oranda eksprese edilmektedir [5, 43]. Yüksek düzeyde folat reseptörü eksprese eden tümör hücreleri tarafından ilacın seçici olarak alınmasını sağlamak için folatı bir antikanser ilacı ile birleştiren bir ilaç iletim sistemi geliştirilmiştir ve köpek transizyonel hücreli karsinomu için iki klinik çalışma yürütülmüştür [5, 43]. 2013 yılında yapılan bir klinik çalışmada, folat ile vinblastini birleştiren EC0905 adlı bir ilaç, folat reseptörü pozitif transizyonel hücreli karsinomu olan köpeklere uygulanmış ve %56 PR, %44 SD gibi iyi bir yanıt oranı elde edilmiş ve PD görülmemiştir. Ne yazık ki, çalışma PFS veya OS gibi prognostik bilgiler sağlamamıştır [5]. 2018 yılında, aynı grup folat reseptörü pozitif transizyonel hücreli karsinomlu köpeklerde folatı tubulizin ile birleştiren EC0531 adlı bir ilaç kullanarak %11 PR, %61 SD, %28 PD ve 103 günlük ortalama PFS ile bir klinik çalışma yürütmüştür [43]. Hem EC0905 hem de EC0531 için advers olay olarak hafif-orta gastrointestinal semptomlar (kusma, diyare, anoreksi ve kilo kaybı), aktivite azalması ve nötropeni gözlenmiştir. Sonuçlar geleneksel tedavilerden önemli ölçüde daha etkili olmasa da, folat reseptörü aracılı ilaç dağıtım sistemi umut vericidir ve gelecekte folatı diğer antikanser ajanlarla birleştiren yeni ilaçların araştırılması beklenmektedir. EGF-kombine şarbon toksini Epidermal büyüme faktörü (EGF), çeşitli tümörlerde yüksek oranda eksprese edilen ve aşırı büyüme sinyali yoluyla tümör gelişimi ve ilerlemesi ile ilişkili olan reseptörü EGFR’ye bağlanarak hücre büyümesini ve proliferasyonunu destekleyen bir moleküldür. Köpek transizyonel hücreli karsinom vakalarının %72’sinde EGFR aşırı ekspresyonu bildirilmiştir [10]. Şarbon toksini ile EGF’yi birleştiren moleküler hedefli bir ilaç geliştirilmiştir [14]. Şarbon toksinleri üç tip proteinden oluşur: koruyucu antijenler, ödem faktörleri ve öldürücü faktörler. Hücre yüzeyine bağlandıktan sonra, koruyucu antijenler plazma membranında bir araya gelerek endositoz yoluyla içselleştirilen bir heptamer oluşturur. Septamerik koruyucu antijenler ödem faktörlerine veya ölümcül faktörlere bağlanabildiğinden, bu faktörler aynı anda koruyucu antijenler olarak içselleştirilir. Hücre içine alınan ödem faktörleri, döngüsel AMP’de artış yoluyla su ve elektrolitlerin hücre içi salgılanmasını indükleyerek doku ödemine neden olur. Ölümcül faktör, hücre sinyalizasyonunda önemli olan MAP kinaz kinazı (MAPKK) parçalayan proteolitik bir enzimdir. MAPKK parçalandığında, sinyalizasyon normal şekilde gerçekleşmez ve öldürücü faktörü alan hücre ölür. Bu nedenle, öldürücü faktörlerin koruyucu antijenler tarafından alınması şarbon toksinlerinin toksik etkileri için kritik öneme sahiptir. EGF-bağlayıcı şarbon toksini, koruyucu antijenin hücre zarına bağlanan bölgesini EGF ile değiştirerek EGFR-aşırı eksprese eden tümör hücrelerini spesifik olarak hedeflemek üzere tasarlanmıştır. EGF-bağlayıcı şarbon toksininin geçiş hücreli karsinomu olan altı köpeğin mesanelerine enjekte edildiği bir pilot çalışma 2020 yılında rapor edilmiş ve PR gözlenmemesine rağmen tüm vakalarda kitle azalmasına yönelik bir eğilim gözlenmiştir [14]. Özellikle, EGF-bağlayıcı şarbon toksininin intravezikal uygulamasını alan altı köpekten birinde hafif sistit semptomları (hematüri ve 2 gün boyunca sık idrara çıkma) gözlenmiş, ancak diğer vakalarda belirgin bir yan etki bildirilmemiştir. Gelecekte, bu ilacın etkinliği ve güvenliği büyük ölçekli klinik çalışmalarla doğrulanmalı ve yeni bir moleküler hedefli ilaç olarak piyasaya sürülmelidir. BRAF inhibitörü: vemurafenib BRAF, MAP kinaz yolu olarak bilinen bir sinyal yolunu oluşturan bir kinazdır. İnsanlarda, aralarında BRAFV600E mutasyonunun en yaygın olduğu malign melanom, kolorektal kanser, akciğer kanseri ve tiroid kanseri de dahil olmak üzere çeşitli tümörlerde çeşitli BRAF mutasyonları bildirilmiştir. Mutant BRAF, yukarı akış RAS aktivasyonu olmadan sürekli aktivasyona neden olarak, tümör hücresi büyümesini ve sağkalımını indükleyerek ve anjiyogenezi teşvik ederek tümör gelişimi ve ilerlemesinde rol oynar. BRAF gen mutasyonlarına sahip malign melanom tedavisi için vemurafenib, dabrafenib ve encorafenib gibi BRAF inhibitörleri onaylanmıştır. 2015 yılında, BRAFV595E mutasyonunun köpek transizyonel hücreli karsinomlarının %70-80’inde bulunduğu bildirilmiştir [34, 35]. Bu mutasyon insan BRAFV600E mutasyonu ile homolog olduğundan, BRAF inhibitörlerinin transizyonel hücreli karsinomlu köpekler için yeni bir moleküler hedefli tedavi olarak etkili olması beklenmektedir. 2021 yılında yapılan bir klinik çalışmada, BRAF mutasyonu pozitif transizyonel hücreli karsinomu olan 24 köpeğe vemurafenib uygulandığı ve bunun sonucunda %38 PR, %54 SD ve %8 PD elde edildiği, ortalama PFS’nin 181 gün ve ortalama OS’nin 354 gün olduğu bildirilmiştir [37]. Bu sonuçlar, tıbbi tedaviler için bugüne kadar bildirilen en iyi yanıt oranlarından ve sağkalım sonuçlarından birini temsil etmektedir. Bu klinik çalışmada vemurafenib tek bir ajan olarak kullanıldığından, NSAID’lerle kombinasyonu sonuçları daha da iyileştirebilir. BRAF inhibitörleri, köpek transizyonel hücreli karsinomu için moleküler hedefli tedaviler olarak umut vaat etmektedir; ancak, advers olaylarla ilgili zorlukları da beraberinde getirmektedir. Vemurafenib ile tedavi edilen 24 köpekten altısında (%18) tedavi sonrası histolojik olarak skuamöz hücreli papillom veya skuamöz hücreli karsinom olduğu doğrulanan deri kitleleri görülmüştür [37]. Deri tümörleri insanlarda BRAF inhibitörleri ile ilişkili bir advers olay olarak da bildirilmiştir. Bir advers sonuç olarak tümör gelişiminin önemli riski nedeniyle, hasta sahiplerine eksiksiz bilgi verilmesi zorunludur. KÖPEK TRANSİYONEL HÜCRE KARSİNOMU İÇİN YENİ TEDAVİ STRATEJİSİNİN GELİŞTİRİLMESİ Bir önceki bölümde, köpek transizyonel hücreli karsinomu için yurtdışında (çoğunlukla Dr. Knapp’ın araştırma ekibi tarafından) yayınlanan yeni moleküler hedefli tedavilerin raporları sunulmuştur. Yazarın araştırma ekibi ayrıca köpek transizyonel hücreli karsinomu için yeni moleküler hedefli tedavilerin veteriner hekim tarafından başlatılan klinik denemelerini aktif olarak yürütmekte ve bu denemelerin sonuçlarını yayınlamaktadır. Bu bölüm yazarların araştırma ekibinin çabalarını özetlemektedir. HER2 inhibitörü: lapatinib HER2, hücre proliferasyonu, sağkalım, farklılaşma, migrasyon ve anjiyogenez dahil olmak üzere tümör progresyonunda rol oynayan EGFR ailesine ait bir reseptör tipi tirozin kinazdır. Veteriner hekimlikte, köpek meme karsinomu ve osteosarkomunda HER2 aşırı ekspresyonu bildirilmiş ve HER2 hedefli immünoterapinin osteosarkoma karşı etkinliği gösterilmiştir [33]. Araştırma grubumuz, köpek transizyonel hücreli karsinomu için yeni terapötik hedefler keşfetmek amacıyla tümör dokularındaki gen ekspresyonunu kapsamlı bir şekilde analiz etmiştir. HER2 sinyal yolağının transizyonel hücreli karsinomda önemli ölçüde aktive olduğunu bulduk [27]. Daha sonra sırasıyla immünohistokimya ve dijital PCR kullanarak HER2 protein ekspresyonunu ve HER2 gen amplifikasyonunu değerlendirdik ve bazı vakalarda köpek transizyonel hücreli karsinomunda HER2 protein aşırı ekspresyonu ve HER2 gen amplifikasyonunun gözlendiğini bulduk [40, 44]. Ayrıca, EGFR ve HER2’nin ikili inhibitörü olan lapatinibin köpek transizyonel hücreli karsinomuna karşı etkinliği hücre hatları ve tümör aşılanmış fare modeli kullanılarak doğrulanmıştır [39]. Bu sonuçlara dayanarak, transizyonel hücreli karsinomlu köpeklerde veteriner hekim tarafından başlatılan bir lapatinib klinik çalışması yürütülmüştür [26]. Sonuçlar olumlu olmuştur: 3 tam remisyon (CR), %52 PR, %34 SD ve %11 PD, ortalama PFS 193 gün ve ortalama OS 435 gün. Advers olaylar nispeten hafifti ve nadiren ciddi advers olaylar görüldü, ancak zaman zaman karaciğer enzimlerinde yükselme, gastrointestinal semptomlar (kusma, diyare ve anoreksi) ve cilt pigmentasyonu gözlendi. Özellikle, karaciğerde metabolize olan lapatinibin nefrotoksisitesinin düşük olması, idrar yollarında gelişen transizyonel hücreli karsinoma karşı kullanımını kolaylaştırmaktadır. Bu nedenle, lapatinib köpek transizyonel hücreli karsinomu için umut verici yeni bir moleküler hedefli tedavidir. Bu çalışmada ayrıca lapatinib etkinliğinin öngörücü biyobelirteçleri de değerlendirilmiştir [26]. Tümör hücreleri HER2 aşırı ekspresyonu veya HER2 gen amplifikasyonu gösteren transizyonel hücreli karsinomlu köpekler lapatinibin daha fazla etkinliğini göstermiştir. KIT gen mutasyonlarının varlığı, köpek mast hücre tümörlerinde imatinibin terapötik etkinliği ile ilişkilidir, ancak moleküler hedefli ilaçların etkinliğini tahmin etmek için yararlı bir biyobelirteç bulunamamıştır. Yazarlar, lapatinibin etkinliğini tahmin etmek için HER2 testinin keşfinin köpek kanseri tedavisinde bir atılım olabileceğine inanmaktadır. Anti-CCR4 antikoru: mogamulizumab CCR4, lenfosit göçü ve infiltrasyonunda rol oynayan bir molekül olan kemokin CCL17 için bir reseptördür. Alerji bağlamında, CCL17 ve CCR4 köpek atopik dermatitinin patogenezinde önemlidir. Th2 hücreleri, alerji patogenezinde önemli olan ve CCR4 eksprese eden T-lenfositlerdir. Köpek atopik dermatitinde, CCR4-pozitif Th2 hücreleri keratinositler tarafından üretilen CCL17 aracılığıyla lezyonlu deriye göç eder. Periferik kandaki CCR4-pozitif yardımcı T hücrelerinin (Th2 hücreleri) yüzdesi, sağlıklı köpeklere kıyasla köpek atopik dermatit vakalarında artmaktadır [25]. Yazarın araştırma grubu, CCR4’ün sadece Th2 hücrelerinde değil, aynı zamanda düzenleyici T hücreleri (Treg’ler) olarak adlandırılan immünosupresif T-lenfositlerinde de yüksek oranda eksprese edildiğini ve Treg’lerin tümör dokularına infiltrasyonunda önemli bir rol oynadığını göstermiştir [22–24]. Treg’ler, enflamasyon ve immün toleransın sonlandırılmasında rol oynayan önemli T lenfositleridir, ancak anti-tümör bağışıklığını baskılayarak tümör ilerlemesinde teşvik edici bir rol oynarlar. Köpek tümör dokularında Treg infiltrasyonunu immünohistokimya kullanarak inceledik ve transizyonel hücreli karsinom, prostat kanseri, meme karsinomu, akciğer adenokarsinomu, skuamöz hücreli karsinom ve malign melanomda çok sayıda Treg’in infiltre olduğunu ve sayılarının sağkalım süresiyle ilişkili olduğunu bulduk [22, 23, 41]. Ayrıca, Treg infiltrasyonunda rol oynayan moleküllerin kapsamlı bir analizi, tümör infiltre eden Treg’lerin yüksek oranda CCR4 eksprese ettiğini ve CCR4 için bir ligand olan kemokin CCL17’nin tümör hücreleri tarafından büyük miktarlarda üretildiğini ortaya koymuştur. Daha sonra, köpek CCR4 ile çapraz reaksiyona giren ve anti-insan CCR4 antikoru olan mogamulizumab ilacının veteriner hekim tarafından başlatılan klinik denemesini, transisyonel hücreli karsinomu olan köpeklerde gerçekleştirdik [23]. CCR4 inhibisyonunun tümör dokularına Treg infiltrasyonunu baskıladığını ve anti-tümör bağışıklığını aktive ederek terapötik bir etki yarattığını bulduk. Mogamulizumabın transizyonel hücreli karsinomlu köpeklerdeki etkinliği %71 PR, %29 SD idi ve PD yoktu; ortalama PFS 189 gün ve ortalama OS 474 gündü [23]. Ancak, bu klinik çalışmada sadece 14 transizyonel hücreli karsinomlu köpeğe mogamulizumab uygulanmıştır. Bu nedenle vaka sayısını artırmaya devam ettik. Transizyonel hücreli karsinomlu köpeklerde mogamulizumab tedavisinin yararı, daha önce yayınlanan 14 vakanın sonuçları [23] ve 2019-2022 yılları arasında Tokyo Üniversitesi Veteriner Tıp Merkezi’nde 18 ek köpeğin sonuçları da dahil olmak üzere 32 vakada yakın zamanda doğrulanmıştır. Piroksikam ile birlikte mogamulizumab ile tedavi edilen 32 köpek, altı erkek (tümü kısırlaştırılmış) ve 26 dişi (ikisi kısırlaştırılmamış ve 24’ü kısırlaştırılmış) içeriyordu ve ortalama yaşları 12,8 yıldı (aralık 7,1-17,8 yıl). Köpek mesane kanseri için DSÖ TNM sınıflandırmasına göre [6, 36], 32 köpeğin 23’ü (%72) T2N0M0, ikisi (%6) T2N0M1, biri (%3) T2N1M1, dördü (%13) T3N0M0 ve ikisi (%6) T3N1M0 olarak sınıflandırılmıştır. Üçer (%9) vakada lenf nodu ve uzak (akciğere) metastaz gözlenmiştir. Mogamulizumab/piroksikam ile tedavi edilen 32 köpeğin 17’sinde (%53) PR, 13’ünde (%41) SD ve ikisinde (%6) PD görüldü. Son noktada (1 Mayıs 2023), mogamulizumab ile tedavi edilen dokuz köpek (%28) hayatta kalmıştır. Mogamulizumab/piroksikam alan köpeklerde ortalama PFS ve OS sırasıyla 228 gün (aralık 67-573 gün) ve 468 gün (aralık 231-1185 gün) olmuştur. Mogamulizumab tedavisinin köpek transizyonel hücreli karsinomunda sağkalımı uzatıp uzatmadığını doğrulamak için, mogamulizumab/piroksikam ile tedavi edilen vakaların PFS ve OS’lerini önceki çalışmamızdaki tarihsel kontrol grubunun (sadece piroksikam ile tedavi edilen vakalar; n=42) PFS ve OS’leriyle karşılaştırdık [26]. Tek başına piroksikam ile tedavi edilen köpeklerde ortalama PFS ve OS sırasıyla 90 (aralık, 21-318) gün ve 216 (aralık, 41-725) gündü [26]. PFS ve OS, mogamulizumab/piroksikam ile tedavi edilen köpeklerde tek başına piroksikam ile tedavi edilenlere göre daha uzundu (Şekil 2). Köpek transizyonel hücreli karsinomuna ek olarak, 2022 yılında köpek prostat kanseri için mogamulizumabın klinik bir çalışmasını bildirdik [22]. Prostat kanserli köpeklerde mogamulizumab/piroksikamın etkinliği %30 PR, %61 SD ve %9 PD idi ve medyan PFS 204 gün ve ortalama OS 312 gündü [22]. Köpek transizyonel hücreli karsinom ve prostat kanserinde mogamulizumab/piroksikam için bu sonuçlar, geleneksel tedavilerle olumlu bir şekilde karşılaştırılmıştır. |
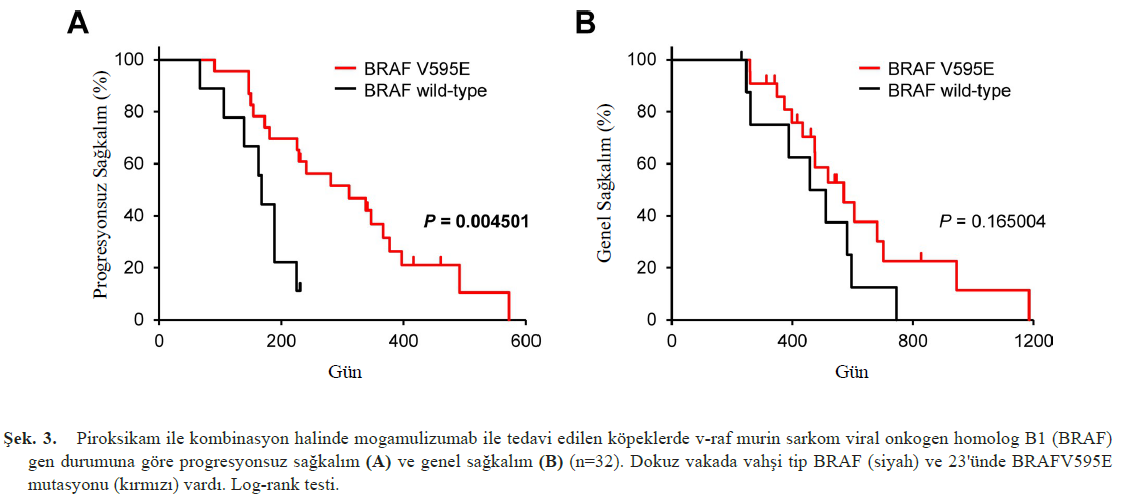
| Yakın zamanda BRAFV595E somatik mutasyonunun CCL17 üretimini indüklediğini ve transizyonel hücreli karsinom ve prostat kanseri olan köpeklerde Treg infiltrasyonuna katkıda bulunduğunu gösterdik [22, 28]. Bu nedenle, ileri analizler BRAFV595E mutasyonunun mogamulizumab tedavisine klinik yanıtı etkileyip etkilemediğini araştırmıştır. Bu çalışmada mogamulizumab/piroksikam ile tedavi edilen 32 transizyonel hücreli karsinom vakasının 23’ünde (%72) BRAFV595E mutasyonu tespit edilmiştir. Bu köpeklerde, BRAFV595E mutasyonuna sahip olgularda PFS, ancak OS değil, vahşi tip BRAF’a sahip olanlara göre daha uzundu (Şekil 3). Transizyonel hücreli karsinom vakalarına benzer şekilde, prostat kanserli köpeklerde BRAFV595E somatik mutasyonunun belirlenmesiyle mogamulizumab tedavisine yanıt olasılığı (tümör yükünün azaltılması ve sağkalım) artırılabilir [22], bu da BRAFV595E mutasyonunun mogamulizumab tedavisinin klinik yanıtını ve sonucunu tahmin etmek için yararlı bir biyobelirteç olduğunu düşündürmektedir. Köpeklerde mogamulizumab tedavisi, derece 1 veya 2 tedaviye bağlı advers olaylarla iyi tolere edilir [22, 23]. Kusma ve anoreksi, yalnızca sistemik antiemetik tedavi ile yönetilebilirdi. Pankreatit, ürtiker, döküntü ve infüzyon reaksiyonları gibi bağışıklıkla ilgili advers olaylar gözlenmiş ancak hafif düzeyde kalmıştır. Nefrotoksisite olmaması da dahil olmak üzere bu güvenlik verileri, böbrek yetmezliğine daha yatkın olan transizyonel hücreli karsinomlu veya prostat kanserli yaşlı köpeklerin mogamulizumab tedavisini kemoterapiden daha iyi tolere edebileceğini düşündürmektedir. SPONTANE KANSER HAYVAN MODELİ OLARAK KÖPEKLER Kanser araştırmalarında, kanserojen modeller, genetik olarak tasarlanmış fare modelleri, xenograft modelleri ve allograft modelleri gibi fare modelleri, hayvan modelleri olarak yaygın bir şekilde kullanılmaktadır. Fare modellerinin kanser araştırmalarının gelişimindeki önemi açık olsa da, son zamanlarda fare modellerinin birçok dezavantajı olduğuna dikkat çekilmektedir. Örneğin, homojen genetik ve çevresel arka planlar nedeniyle farelerde çeşitlilik eksikliği, kanser fenotipleri ve terapötik etkinliği değerlendirme yöntemleri insanlardakinden büyük ölçüde farklıdır ve immün yetmezliği olan farelerde immünoterapinin değerlendirilmesi zordur. Kanser ilacı keşfinde fare modellerinden insan klinik çalışmalarına ekstrapolasyonun başarı oranı %10’dan azdır [31] ve temel araştırma ile klinik çalışmalar arasında “ölüm vadisi” adı verilen bir boşluk bulunmaktadır. Bu ölüm vadisinin üstesinden gelmek için, spontan köpek kanser modellerinin kullanıldığı translasyonel araştırmalar son yayınlarda destek bulmuştur [2, 16, 17, 42]. Köpekler kendiliğinden çeşitli kanserler geliştirir ve semptomları, metastatik paternleri, patolojileri ve bağışıklık sistemleri insanlarınkine benzer. Ayrıca, köpekler zaman içinde kan testleri ve tanısal görüntüleme gibi insanlarla aynı test yöntemleri kullanılarak değerlendirilebilir. Buna ek olarak, prostat kanseri, mesane kanseri, lenfoma, melanoma ve osteosarkom gibi bazı kanser türleri, köpeklerde ve insanlarda benzer gen ekspresyon modellerine sahiptir [2, 17, 22]. Bu derlemede belirtildiği gibi, köpek onkolojisi vakalarında insan hastalar için onaylanmamış yeni ajanlar kullanılarak veteriner hekim tarafından başlatılan birkaç klinik çalışma ve başarılı sonuçlar bildirilmiştir, bu da köpek tümör vakalarının “spontan kanser hayvan modelleri” olarak çok yararlı olduğunu düşündürmektedir. SONUÇ Bu derleme, köpek tümörlerine yönelik moleküler hedefli ilaçlarla ilgili olarak 2008’deki masitinib raporundan günümüze kadar geçen 15 yıllık sürede yayınlanan makaleleri özetlemekte ve veteriner hekimlikte “ikinci moleküler hedefli ilaç çağının” başladığını öne sürmektedir. Yazar, veteriner hekimlikte yeni moleküler hedefli ilaçların kullanılmaya başlanmasının yakın olduğu görüşündedir. Buna ek olarak, köpeklerde yeni moleküler hedefli ilaçların kullanıldığı translasyonel klinik çalışmalar, insanlarda kanser tedavisi için önemli bilgiler sağlayabilir. Veterinerlik ve insan tıbbındaki “türler ötesi” karşılaştırmalı onkoloji çabaları, kanser araştırmaları ve ilaç geliştirmede önemli ve giderek büyüyen bir rol oynamaktadır. |
| ÇIKAR ÇATIŞMASI BEYANI. Yazarların çıkar çatışmasına ilişkin herhangi bir beyanı yoktur. TEŞEKKÜRLER. Yazarlar, bu makalede özetlenen çalışmadaki yardımları için Tokyo Üniversitesi Veteriner Tıp Merkezi’ndeki köpek hastalara, sahiplerine ve klinik bakım ekibine minnetle teşekkür eder. Bu çalışma JSPS KAKENHI (hibe numarası, JP19H00968) ve Anicom Capital Research Grant (EVOLVE) tarafından desteklenmiştir. |
| KAYNAKÇA 1. Attwood MM, Fabbro D, Sokolov AV, Knapp S, Schiöth HB. 2021. Trends in kinase drug discovery: targets, indications and inhibitor design. Nat Rev Drug Discov 20: 839–861. [Medline] [CrossRef] 2. Beltrán Hernández I, Kromhout JZ, Teske E, Hennink WE, van Nimwegen SA, Oliveira S. 2021. Molecular targets for anticancer therapies in companion animals and humans: what can we learn from each other? Theranostics 11: 3882–3897. [Medline] [CrossRef] 3. Berger EP, Johannes CM, Jergens AE, Allenspach K, Powers BE, Du Y, Mochel JP, Fox LE, Musser ML. 2018. Retrospective evaluation of toceranib phosphate (Palladia®) use in the treatment of gastrointestinal stromal tumors of dogs. J Vet Intern Med 32: 2045–2053. [Medline] [CrossRef] 4. Dhawan D, Ramos-Vara JA, Hahn NM, Waddell J, Olbricht GR, Zheng R, Stewart JC, Knapp DW. 2013. DNMT1: an emerging target in the treatment of invasive urinary bladder cancer. Urol Oncol 31: 1761–1769. [Medline] [CrossRef] 5. Dhawan D, Ramos-Vara JA, Naughton JF, Cheng L, Low PS, Rothenbuhler R, Leamon CP, Parker N, Klein PJ, Vlahov IR, Reddy JA, Koch M, Murphy L, Fourez LM, Stewart JC, Knapp DW. 2013. Targeting folate receptors to treat invasive urinary bladder cancer. Cancer Res 73: 875–884. [Medline] [CrossRef] 6. Fulkerson CM, Knapp DW. 2015. Management of transitional cell carcinoma of the urinary bladder in dogs: a review. Vet J 205: 217–225. [Medline] [CrossRef] 7. Gardner HL, Rippy SB, Bear MD, Cronin KL, Heeb H, Burr H, Cannon CM, Penmetsa KV, Viswanadha S, Vakkalanka S, London CA. 2018. Phase I/II evaluation of RV1001, a novel PI3Kδ inhibitor, in spontaneous canine lymphoma. PLoS One 13: e0195357. [Medline] [CrossRef] 8. Gustafson TL, Biller B. 2019. Use of toceranib phosphate in the treatment of canine bladder tumors: 37 cases. J Am Anim Hosp Assoc 55: 243–248. [Medline] [CrossRef] 9. Hahn NM, Bonney PL, Dhawan D, Jones DR, Balch C, Guo Z, Hartman-Frey C, Fang F, Parker HG, Kwon EM, Ostrander EA, Nephew KP, Knapp DW. 2012. Subcutaneous 5-azacitidine treatment of naturally occurring canine urothelial carcinoma: a novel epigenetic approach to human urothelial carcinoma drug development. J Urol 187: 302–309. [Medline] [CrossRef] 10. Hanazono K, Fukumoto S, Kawamura Y, Endo Y, Kadosawa T, Iwano H, Uchide T. 2015. Epidermal growth factor receptor expression in canine transitional cell carcinoma. J Vet Med Sci 77: 1–6. [Medline] [CrossRef] 11. Harrington BK, Gardner HL, Izumi R, Hamdy A, Rothbaum W, Coombes KR, Covey T, Kaptein A, Gulrajani M, Van Lith B, Krejsa C, Coss CC, Russell DS, Zhang X, Urie BK, London CA, Byrd JC, Johnson AJ, Kisseberth WC. 2016. Preclinical evaluation of the novel BTK inhibitor acalabrutinib in canine models of B-cell non-hodgkin lymphoma. PLoS One 11: e0159607. [Medline] [CrossRef] 12. Honigberg LA, Smith AM, Sirisawad M, Verner E, Loury D, Chang B, Li S, Pan Z, Thamm DH, Miller RA, Buggy JJ. 2010. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy. Proc Natl Acad Sci USA 107: 13075–13080. [Medline] [CrossRef] 13. Igase M, Nemoto Y, Itamoto K, Tani K, Nakaichi M, Sakurai M, Sakai Y, Noguchi S, Kato M, Tsukui T, Mizuno T. 2020. A pilot clinical study of the therapeutic antibody against canine PD-1 for advanced spontaneous cancers in dogs. Sci Rep 10: 18311. [Medline] [CrossRef] 14. Jack S, Madhivanan K, Ramadesikan S, Subramanian S, Edwards DF 2nd, Elzey BD, Dhawan D, McCluskey A, Kischuk EM, Loftis AR, Truex N, Santos M, Lu M, Rabideau A, Pentelute B, Collier J, Kaimakliotis H, Koch M, Ratliff TL, Knapp DW, Aguilar RC. 2020. A novel, safe, fast and efficient treatment for Her2-positive and negative bladder cancer utilizing an EGF-anthrax toxin chimera. Int J Cancer 146: 449–460. [Medline] [CrossRef] 15. Keating GM. 2009. Azacitidine: a review of its use in higher-risk myelodysplastic syndromes/acute myeloid leukaemia. Drugs 69: 2501–2518. [Medline] [CrossRef] 16. Kol A, Arzi B, Athanasiou KA, Farmer DL, Nolta JA, Rebhun RB, Chen X, Griffiths LG, Verstraete FJ, Murphy CJ, Borjesson DL. 2015. Companion animals: translational scientist’s new best friends. Sci Transl Med 7: 308ps21. [Medline] [CrossRef] 17. LeBlanc AK, Mazcko CN. 2020. Improving human cancer therapy through the evaluation of pet dogs. Nat Rev Cancer 20: 727–742. [Medline] [CrossRef] 18. London C, Mathie T, Stingle N, Clifford C, Haney S, Klein MK, Beaver L, Vickery K, Vail DM, Hershey B, Ettinger S, Vaughan A, Alvarez F, Hillman L, Kiselow M, Thamm D, Higginbotham ML, Gauthier M, Krick E, Phillips B, Ladue T, Jones P, Bryan J, Gill V, Novasad A, Fulton L, Carreras J, McNeill C, Henry C, Gillings S. 2012. Preliminary evidence for biologic activity of toceranib phosphate (Palladia®) in solid tumours. Vet Comp Oncol 10: 194–205. [Medline] [CrossRef] 19. London CA. 2009. Tyrosine kinase inhibitors in veterinary medicine. Top Companion Anim Med 24: 106–112. [Medline] [CrossRef] 20. London CA, Acquaviva J, Smith DL, Sequeira M, Ogawa LS, Gardner HL, Bernabe LF, Bear MD, Bechtel SA, Proia DA. 2018. Consecutive day HSP90 inhibitor administration improves efficacy in murine models of KIT-driven malignancies and canine mast cell tumors. Clin Cancer Res 24: 6396–6407. [Medline] [CrossRef] 21. London CA, Malpas PB, Wood-Follis SL, Boucher JF, Rusk AW, Rosenberg MP, Henry CJ, Mitchener KL, Klein MK, Hintermeister JG, Bergman PJ, Couto GC, Mauldin GN, Michels GM. 2009. Multi-center, placebo-controlled, double-blind, randomized study of oral toceranib phosphate (SU11654), a receptor tyrosine kinase inhibitor, for the treatment of dogs with recurrent (either local or distant) mast cell tumor following surgical excision. Clin Cancer Res 15: 3856–3865. [Medline] [CrossRef] 22. Maeda S, Motegi T, Iio A, Kaji K, Goto-Koshino Y, Eto S, Ikeda N, Nakagawa T, Nishimura R, Yonezawa T, Momoi Y. 2022. Anti-CCR4 treatment depletes regulatory T cells and leads to clinical activity in a canine model of advanced prostate cancer. J Immunother Cancer 10: 10. [Medline] [CrossRef] 23. Maeda S, Murakami K, Inoue A, Yonezawa T, Matsuki N. 2019. CCR4 blockade depletes regulatory T cells and prolongs survival in a canine model of bladder cancer. Cancer Immunol Res 7: 1175–1187. [Medline] [CrossRef] 24. Maeda S, Nakazawa M, Uchida M, Yoshitake R, Nakagawa T, Nishimura R, Miyamoto R, Bonkobara M, Yonezawa T, Momoi Y. 2020. Foxp3+ regulatory T cells associated with CCL17/CCR4 expression in carcinomas of dogs. Vet Pathol 57: 497–506. [Medline] [CrossRef] 25. Maeda S, Ohmori K, Yasuda N, Kurata K, Sakaguchi M, Masuda K, Ohno K, Tsujimoto H. 2004. Increase of CC chemokine receptor 4-positive cells in the peripheral CD4 cells in dogs with atopic dermatitis or experimentally sensitized to Japanese cedar pollen. Clin Exp Allergy 34: 1467–1473. [Medline] [CrossRef] 26. Maeda S, Sakai K, Kaji K, Iio A, Nakazawa M, Motegi T, Yonezawa T, Momoi Y. 2022. Lapatinib as first-line treatment for muscle-invasive urothelial carcinoma in dogs. Sci Rep 12: 4. [Medline] [CrossRef] 27. Maeda S, Tomiyasu H, Tsuboi M, Inoue A, Ishihara G, Uchikai T, Chambers JK, Uchida K, Yonezawa T, Matsuki N. 2018. Comprehensive gene expression analysis of canine invasive urothelial bladder carcinoma by RNA-Seq. BMC Cancer 18: 472. [Medline] [CrossRef] 28. Maeda S, Yoshitake R, Chambers JK, Uchida K, Eto S, Ikeda N, Nakagawa T, Nishimura R, Goto-Koshino Y, Yonezawa T, Momoi Y. 2020. BRAFV595E mutation associates CCL17 expression and regulatory T cell recruitment in urothelial carcinoma of dogs. Vet Pathol 58: 971–980. [Medline] 29. Maekawa N, Konnai S, Nishimura M, Kagawa Y, Takagi S, Hosoya K, Ohta H, Kim S, Okagawa T, Izumi Y, Deguchi T, Kato Y, Yamamoto S, Yamamoto K, Toda M, Nakajima C, Suzuki Y, Murata S, Ohashi K. 2021. PD-L1 immunohistochemistry for canine cancers and clinical benefit of anti-PD-L1 antibody in dogs with pulmonary metastatic oral malignant melanoma. NPJ Precis Oncol 5: 10. [Medline] [CrossRef] 30. Maekawa N, Konnai S, Takagi S, Kagawa Y, Okagawa T, Nishimori A, Ikebuchi R, Izumi Y, Deguchi T, Nakajima C, Kato Y, Yamamoto K, Uemura H, Suzuki Y, Murata S, Ohashi K. 2017. A canine chimeric monoclonal antibody targeting PD-L1 and its clinical efficacy in canine oral malignant melanoma or undifferentiated sarcoma. Sci Rep 7: 8951. [Medline] [CrossRef] 31. Mak IW, Evaniew N, Ghert M. 2014. Lost in translation: animal models and clinical trials in cancer treatment. Am J Transl Res 6: 114–118. [Medline] 32. Mason NJ, Chester N, Xiong A, Rotolo A, Wu Y, Yoshimoto S, Glassman P, Gulendran G, Siegel DL. 2021. Development of a fully canine anti-canine CTLA4 monoclonal antibody for comparative translational research in dogs with spontaneous tumors. MAbs 13: 2004638. [Medline] [CrossRef] 33. Mason NJ, Gnanandarajah JS, Engiles JB, Gray F, Laughlin D, Gaurnier-Hausser A, Wallecha A, Huebner M, Paterson Y. 2016. Immunotherapy with a HER2-targeting listeria induces HER2-specific immunity and demonstrates potential therapeutic effects in a phase I trial in canine osteosarcoma. Clin Cancer Res 22: 4380–4390. [Medline] [CrossRef] 34. Mochizuki H, Kennedy K, Shapiro SG, Breen M. 2015. BRAF mutations in canine cancers. PLoS One 10: e0129534. [Medline] [CrossRef] 35. Mochizuki H, Shapiro SG, Breen M. 2015. Detection of BRAF mutation in urine DNA as a molecular diagnostic for canine urothelial and prostatic carcinoma. PLoS One 10: e0144170. [Medline] [CrossRef] 36. Owen LN. 1980. TNM Classification of Tumours in Domestic Animals, World Health Organization (WHO), Geneva. 37. Rossman P, Zabka TS, Ruple A, Tuerck D, Ramos-Vara JA, Liu L, Mohallem R, Merchant M, Franco J, Fulkerson CM, Bhide KP, Breen M, Aryal UK, Murray E, Dybdal N, Utturkar SM, Fourez LM, Enstrom AW, Dhawan D, Knapp DW. 2021. Phase I/II trial of vemurafenib in dogs with naturally occurring, BRAF-mutated urothelial carcinoma. Mol Cancer Ther 20: 2177–2188. [Medline] [CrossRef] 38. Sadowski AR, Gardner HL, Borgatti A, Wilson H, Vail DM, Lachowicz J, Manley C, Turner A, Klein MK, Waite A, Sahora A, London CA. 2018. Phase II study of the oral selective inhibitor of nuclear export (SINE) KPT-335 (verdinexor) in dogs with lymphoma. BMC Vet Res 14: 250. [Medline] [CrossRef] 39. Sakai K, Maeda S, Saeki K, Nakagawa T, Murakami M, Endo Y, Yonezawa T, Kadosawa T, Mori T, Nishimura R, Matsuki N. 2018. Anti-tumour effect of lapatinib in canine transitional cell carcinoma cell lines. Vet Comp Oncol 16: 642–649. [Medline] [CrossRef] 40. Sakai K, Maeda S, Saeki K, Yoshitake R, Goto-Koshino Y, Nakagawa T, Nishimura R, Yonezawa T, Matsuki N. 2020. ErbB2 copy number aberration in canine urothelial carcinoma detected by a digital polymerase chain reaction assay. Vet Pathol 57: 56–65. [Medline] [CrossRef] 41. Sakai K, Maeda S, Yamada Y, Chambers JK, Uchida K, Nakayama H, Yonezawa T, Matsuki N. 2018. Association of tumour-infiltrating regulatory T cells with adverse outcomes in dogs with malignant tumours. Vet Comp Oncol 16: 330–336. [Medline] [CrossRef] 42. Schiffman JD, Breen M. 2015. Comparative oncology: what dogs and other species can teach us about humans with cancer. Philos Trans R Soc Lond B Biol Sci 370: 370. [Medline] [CrossRef] 43. Szigetvari NM, Dhawan D, Ramos-Vara JA, Leamon CP, Klein PJ, Ruple AA, Heng HG, Pugh MR, Rao S, Vlahov IR, Deshuillers PL, Low PS, Fourez LM, Cournoyer AM, Knapp DW. 2018. Phase I/II clinical trial of the targeted chemotherapeutic drug, folate-tubulysin, in dogs with naturally- occurring invasive urothelial carcinoma. Oncotarget 9: 37042–37053. [Medline] [CrossRef] 44. Tsuboi M, Sakai K, Maeda S, Chambers JK, Yonezawa T, Matsuki N, Uchida K, Nakayama H. 2019. Assessment of HER2 expression in canine urothelial carcinoma of the urinary bladder. Vet Pathol 56: 369–376. [Medline] [CrossRef] 45. Valent P, Groner B, Schumacher U, Superti-Furga G, Busslinger M, Kralovics R, Zielinski C, Penninger JM, Kerjaschki D, Stingl G, Smolen JS, Valenta R, Lassmann H, Kovar H, Jäger U, Kornek G, Müller M, Sörgel F. 2016. Paul ehrlich (1854–1915) and his contributions to the foundation and birth of translational medicine. J Innate Immun 8: 111–120. [Medline] [CrossRef] 46. Waldman AD, Fritz JM, Lenardo MJ. 2020. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nat Rev Immunol 20: 651–668. [Medline] [CrossRef] 47. Walters L, Martin O, Price J, Sula MM. 2018. Expression of receptor tyrosine kinase targets PDGFR-β, VEGFR2 and KIT in canine transitional cell carcinoma. Vet Comp Oncol 16: E117–E122. [Medline] [CrossRef] |