Özet
Artemisia annua L.’den elde edilen artemisinin ve türevleri iyi bilinen antimalaryal ilaçlardır. Ayrıca, in vitro çalışmalar, in vivo çalışmalar ve klinik deneyler, bu ilaçların kanserli insan hastalarda antikanser etki gösterdiğini ortaya koymuştur. Bu nedenle, bu çalışmanın amacı fitoterapötik bir A. annua preparatının küçük evcil hayvanların tümörlerinde antikanser etki gösterip göstermediğini araştırmaktır. Spontan kanserli köpek ve kediler (n=20) standart tedavi ile birlikte ticari ürün olan A. annua preparatı (Luparte®) ile tedavi edilmiş ve sadece standart tedavi ile tedavi edilen kontrol grubu (n=11) ile karşılaştırılmıştır. Tümörlerin A. annua’ya verdiği tedavi yanıtını değerlendirmek için olası biyobelirteçler olarak transferrin reseptörü (TfR) ve proliferasyon belirteci Ki-67 ekspresyonunu analiz etmek için formalinle sabitlenmiş parafine gömülü tümör biyopsileri ile immünohistokimyasal analizler yapılmıştır. Son olarak, TfR ve Ki-67 ekspresyon seviyeleri, iki köpek tümör hücresi hattında (DH82 ve DGBM) ve 54 insan tümör hücresi hattından oluşan test panelinde artemisinin IC50 değerleri ile karşılaştırılmıştır. Retrospektif olarak, bu çalışmada A. annua ile veya A. annua olmadan standart tedaviyle tedavi edilen küçük hayvanların hayatta kalma süreleri değerlendirilmiştir. A. annua tedavisi neticesinde, A. annua tedavisi uygulanmayan hayvanlara kıyasla bu tedaviyi alan hayvanlar 18 aydan fazla hayatta kalmış ve istatiksel açıdan anlamlı bulunmuştur (P=0.0331).
Transferrin ve Ki-67 ekspresyonunun artemisinin hücresel yanıtı ile ilişkisini daha fazla değerlendirmek için, bu çalışmada in vitro Ulusal Kanser Enstitüsü tümör hücre hatlarında bu iki biyobelirteç ekspresyonu ve artemisinin IC50 değerleri karşılaştırılmıştır. Her iki belirteç de artemisinin yanıtı ile ters ilişkiliydi (P<0.05) ve TfR ve Ki-67 ekspresyon seviyeleri önemli ölçüde korelasyon gösterdi (P=0.008). Sonuç olarak, mevcut retrospektif çalışmanın umut verici sonuçları, gelecekte yapılacak prospektif çalışmalarla da teyit edilmelidir.
Giriş
Laboratuvar hayvanları biyomedikal araştırmalar için vazgeçilmezdir. İnsan hastalıklarının patogenezini daha iyi anlamak için hastalık modelleri geliştirmek ve yeni tedavi seçenekleri geliştirmek için kullanılırlar. Kanser araştırmalarında, farelerde veya sıçanlarda nakledilen sinjenik, ksenogreft ve ortotopik tümör modelleri veya kimyasal olarak indüklenen tümörler onlarca yıldır kullanılmaktadır (1). Yaygın olarak kullanılan bu deneysel hayvan modellerine rağmen, insan onkolojisinde hayvanların insan hastalarla karşılaştırılabilir nitelikte spontan olarak ortaya çıkan tümörlerden muzdarip olabileceği göz ardı edilmiştir. Bu spontan hayvan tümörleri, deneysel tümör modellerine kıyasla insanlardaki tabloya çok daha yakındır, çünkü spontan olarak ortaya çıkarlar ve ne transplantasyonla korunurlar ne de kimyasal karsinojenler tarafından indüklenirler (2). Bu nedenle, spontan hayvan tümörleri, kanserli insan hastalarda tıbbi olarak uygulanmadan önce yeni tedavi stratejilerini incelemek için, her ne kadar göz ardı edilse de, oldukça önemli bir fırsattır. Hayvanlardaki spontan tümörlerin tedavisi veteriner hekimlikte de önemli olduğundan, hayvan tümörleri üzerine yapılan çalışmalar veteriner onkoloji için de büyük önem taşımaktadır. Küçük hayvanlarda malign tümörlerin sağkalım prognozu tatmin edici olmaktan uzaktır ve cerrahi, radyoterapi veya kemoterapötik müdahalelerin uygulanmasından sonra bile çoğunluk hastalığa yenik düşmektedir (3,4). Klinik prognoz ve evcil hayvanların sağkalımını etkileyen klinik, patolojik ve biyokimyasal faktörler köpekler (5-9), kediler (10-12), köpekgiller (13) ve diğer türler (14,15) için rapor edilmiştir. Hem veteriner hem de insan tümörlerinin tedavisinde önemli ilerlemeler kaydedilmesine rağmen, durum hala kötüdür ve çok sayıda hasta hastalığına yenik düşmektedir. Bu nedenle, yeni tedavi seçeneklerine acilen ihtiyaç duyulmaktadır.
Klinik olarak kullanılan ilaçların çoğu doğal ürünlerden elde edilmektedir (16). Bu nedenle, doğal kaynaklar kullanıldığında yeni tedavi arayışları mümkün görünmektedir.
İlgili yazar: Profesör Thomas Efferth, Farmasötik Biyoloji Bölümü, Eczacılık ve Biyokimya Enstitüsü, Johannes Gutenberg Üniversitesi, Staudinger Weg 5, Mainz, D-55128 Rhineland- Palatinate, Almanya
E-posta: efferth@uni-mainz.de *Eşit şekilde katkıda bulunmuştur
Kısaltmalar: NMR, nükleer manyetik rezonans; TfR, transferrin reseptörü; TIL, tümör infiltre eden lenfosit
Anahtar kelimeler: artemisinin, Asteraceae, kemoterapi, doğal ürünler, fitoterapi, prognostik faktörler
Bu görüşün doğruluğuna dair güncel bir örnek artemisinin’dir. Artemisinin, geleneksel Çin tıbbında yaklaşık iki bin yıldır kullanılan şifalı bir bitki olan Artemisia annua L.’den izole edilen biyoaktif bir terpenoiddir (17). Artemisinin A. annua’dan izole edilmesi, sıtma için son derece değerli yeni bir tedavi seçeneğinin ortaya çıkmasını sağlamıştır. Artemisinin ve türevleri milyonlarca sıtma hastasının hayatta kalmasını sağlamıştır (18,19). Bu başarı 2015 yılında Nobel Tıp veya Fizyoloji Ödülü’nün Çinli bilim insanı Youyou Tu’ya verilmesiyle takdir edilmiştir (20). Artemeter ve artesunat gibi artemisinin türevleri sıtma karşıtı ilaçlar olarak iyi bilinirken, A. annua’nın bitkisel preparatları da sıtmalı hastalarda Plasmodia enfeksiyonlarını engellemektedir (21). Özellikle, artemisinin biyoaktivitesi sıtma ile sınırlı değildir ve şistozomiyazis ve tripanozomiyazis (22-24), çeşitli viral enfeksiyonlar (25) ve obezite, diyabet ve ateroskleroz gibi metabolik sendromlarla ilgili hastalıklar (26-28) gibi diğer hastalıklar da artemisinin ve A. annua tedavisine duyarlıdır.
Artemisinin türevleri ayrıca in vitro ve in vivo olarak insan tümör hücresi büyümesini de inhibe eder (29-31). Bu sadece kanser tedavisi için değil, aynı zamanda kanserin önlenmesi için de önemlidir (32,33). Artemisinin türevleri, klinik olarak yerleşmiş çok çeşitli ilaçlarla kombinasyon halinde katkı maddesi veya sinerjik etkileşimler gösterir (34-36). Bu durum in vitro veteriner tümör hücre hatlarında ve veteriner klinik çalışmalarında da gösterilmiştir (37-39). Deneysel tümör modellerindeki antikanser aktiviteye dayanarak, insan kanser hastalarında insani nedenlerle kullanım şeklinde antikanser aktivitenin araştırılması (40,41) ve hatta insan kanser hastalarında klinik faz I/II denemelerinin yapılması mümkün olmuştur (42-44). Daha önceki bir başka klinik faz I/II çalışması, tümörlü bir dizi köpekte antikanser aktivitesini göstermiştir (39). Üç köpek ve bir kedide elde edilen ön sonuçlar, bitkisel bir A. annua preparatının (Luparte®) tümörlü hayvanların hayatta kalma süresini uzatabileceğini göstermiştir (45). A. annua’nın insani nedenlerle kullanımından elde edilen bu ön sonuçları doğrulamak için, bu çalışma A. annua ile tedavi edilen 25 evcil hayvanın hayatta kalma sürelerini A. annua tedavisi uygulanmayan 11 hayvanla karşılaştırarak retrospektif bir analiz gerçekleştirmiştir. A. annua gıda takviyesinden
bağımsız olarak, tüm hayvanlar standart tedavi protokollerine tabi tutulmuştur. Ayrıca, tümör biyopsilerinin immünohistokimya analizi ile iki biyobelirteç olan transferrin reseptörü (TfR) ve proliferasyon belirteci Ki-67’nin ekspresyonu belirlenmiştir.
Materyal ve Metod
A. annua’da artemisinin tayini. Nükleer manyetik rezonans (NMR) spektrumları Bruker 300 NMR spektrometresinde (Bruker Corporation) kaydedilmiştir. Ters faz yüksek performanslı sıvı kromatografisi (HPLC)-kütle spektrometresi (MS) analizi, daha önce tarif edildiği gibi aynı ayırma koşulları kullanılarak bir Quattro Ultima üçlü kuadrupol MS (Waters Corporation) ile birleştirilmiş Waters Alliance 2695 LC (Waters Corporation) üzerinde gerçekleştirilmiştir (46). Ayırma koşulları aşağıdaki gibidir: Kromatogram kolonu, XBridge™ kolon (4,6×150 mm, 5 µm); kolon sıcaklığı, 20˚C; ve enjeksiyon hacmi, 1 µl. Elüsyon, mobil faz olarak su (A) ve asetonitril (B) karışımı
kullanılarak 1 ml/dak akış hızında gerçekleştirilmiştir. Örnekler aşağıdaki gradyan kullanılarak elüe edildi: 0 dakika, %98,0 A; 0-8 dakika, %100 B’ye doğrusal artış; %100 A 2 dakika tutuldu, 11-12 dakika, %98,0 A’ya dönüş. ESI kaynağı çalışma parametrelerinin son optimizasyonu 11 l/dak azot gazı akışı, 30 psi nebülizör, ±2,4 kV kapiler voltaj ve 250˚C kurutma gazı sıcaklığı (N2) idi. Quattro Ultima üçlü kuadrupol MS, 0,7 m/z çözünürlük ile çoklu reaksiyon izleme modunda çalışmıştır. Elektrosprey iyonizasyonu (pozitif mod) ve 254 nm’de fotodiyot dizi tespiti gerçekleştirildi.
Farklı A. annua (Luparte®) partileri Johannes Gutenberg Üniversitesi (Mainz, Almanya) Farmasötik Biyoloji Bölümü tarafından incelenmiştir. Bu kör yaklaşım, Luparte®’de artemisinin varlığını bağımsız olarak garanti etmek için bir kalite ölçütü olarak kullanılmıştır. Her bir A. annua tozu partisi (2×10 g) iki farklı polaritede çözücü olan metilen klorür ve metanol ile 24 saat boyunca oda sıcaklığında ekstrakte edilmiştir. Ekstrakt vakumda konsantre edilerek metilen klorür ve metanol için sırasıyla 0,8 ve 1,2 g kalıntı elde edilmiştir. Her bir ekstrakt küçük bir şişeye aktarıldı ve oda sıcaklığında kuru tutuldu. Küçük kristaller oluşmuş, bunlar toplanmış ve ekstrakt kalıntılarını gidermek için n-hekzan ve metilen klorür ile yıkanmıştır. Daha sonra 1H ve 13C NMR analizleri gerçekleştirilmiştir.
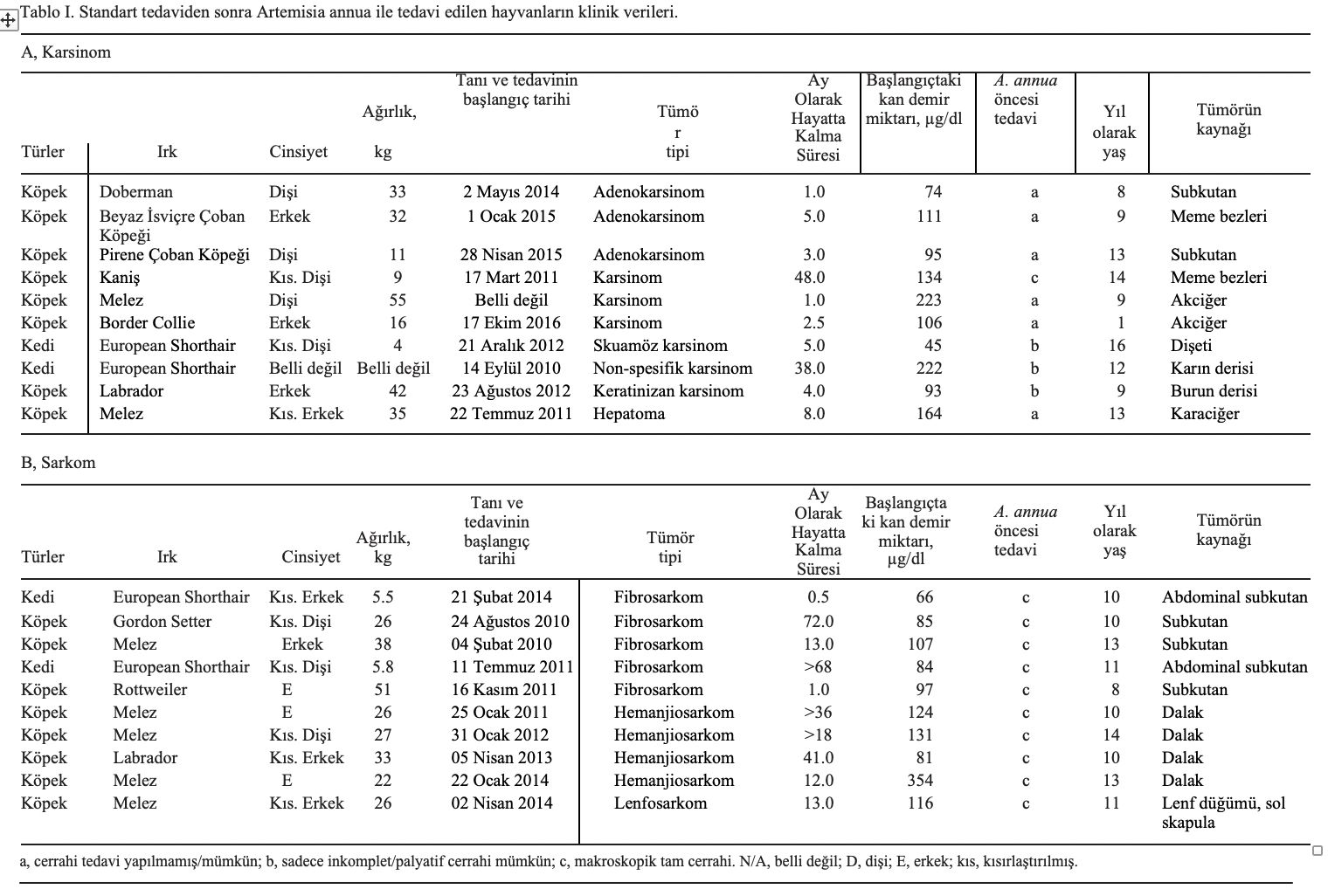
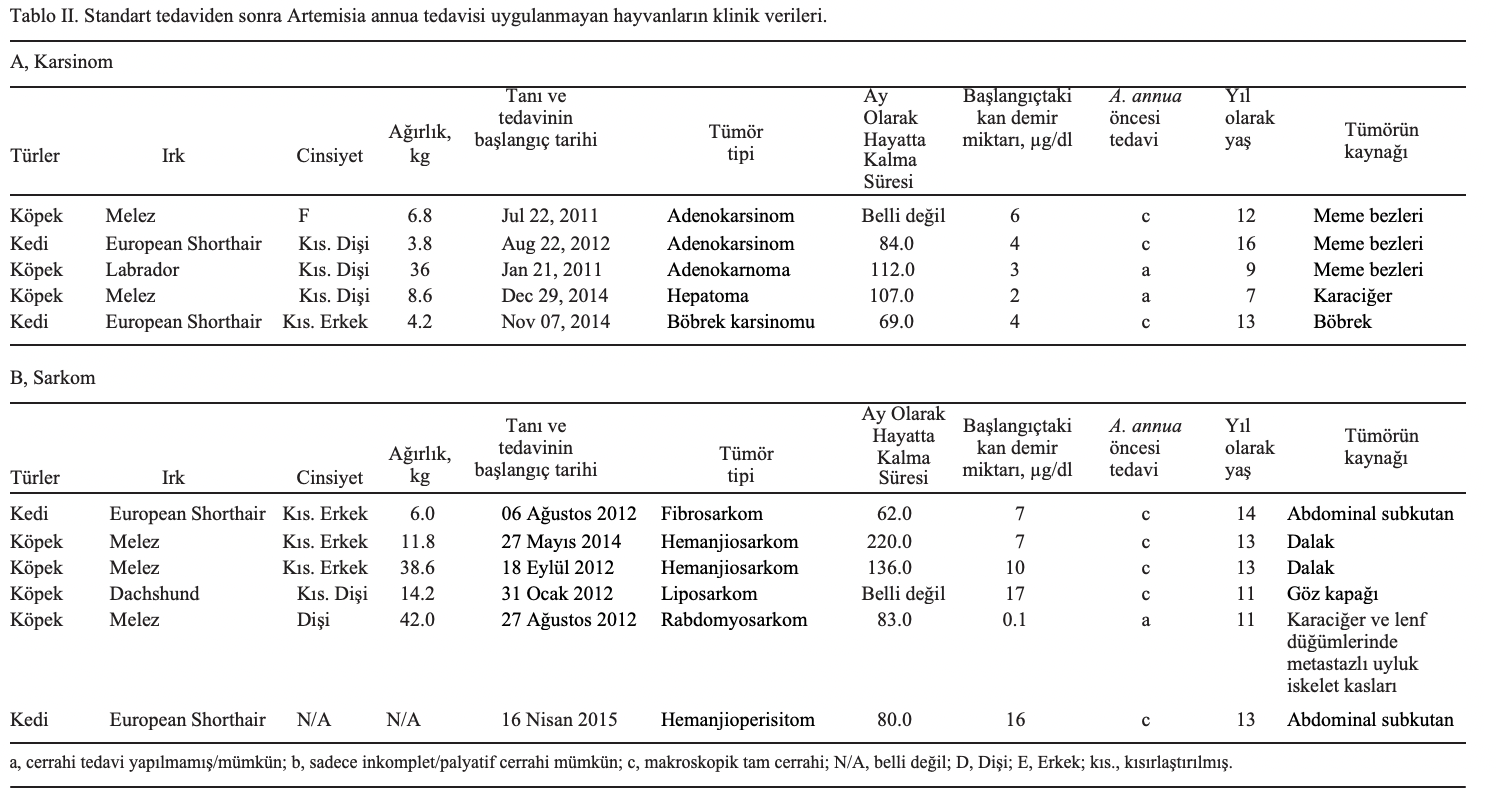
Tümörler. Hayvanlar 2010 ve 2017 yılları arasında tedavi edilmiştir. Kısaca, 16 köpek (10 erkek ve 6 dişi) ve 4 kedi (2 dişi, 1 erkek ve 1 cinsiyeti belirsiz) A. annua ile tedavi edilmiştir. Köpeklerin ortalama yaşı 10,31 ve kedilerin ortalama yaşı 12,25 idi. Köpeklerin ortalama ağırlığı 30.125 kg ve kedilerin ortalama ağırlığı 5.10 kg idi. Tüm hayvanlardan doku örnekleri alınmış ve başlangıçta oda sıcaklığında (~22˚C) %4’lük formaldehit solüsyonunda 48 saat süreyle fikse edilmiştir. Fiksasyonun ardından organlar kesilmiş, işlenmiş ve yaklaşık 60˚C’de parafin mumuna gömülmüştür. Kesitler 4 µm kalınlığında kesilmiş ve oda sıcaklığında rutin olarak hematoksilen ve eozin ile boyanmıştır. Hematoksilen ve eozin ile boyanan kesitlerin histopatolojik incelemesi Zeiss Axioskop ile immersiyon yağında ışık mikroskobu altında yapılmıştır. Rutin patolojik tanıdan sonra, parafin bloklar sonraki immünohistokimyasal çalışmalar için fazla materyal olarak kullanılmıştır. Ayrıca, histolojik hematoksilen ve eozin boyalı tümör kesitleri tümör infiltre eden lenfositlerin (TIL) varlığı açısından değerlendirilmiştir. Klinik veriler Tablo I ve II’de sunulmuştur. Hayvan sahipleri bu retrospektif çalışma için yazılı onam formu imzalamıştır. İmzalı yazılı onam formları Johannes Gutenberg Üniversitesi (Mainz, Almanya) Farmasötik Biyoloji Bölümü’nde saklanmaktadır ve talep edilmesi halinde incelenebilir.
Tedavi protokolü. Serum demir içeriği kan örneklerinin alınmasını takiben belirlenmiştir; normal aralık 140 ila 170 µg/dl’dir (47). Ferrozin renk testi (48) kullanılarak yapılan ilk demir içeriği tespitinden sonra, tümörler gözle muayene edildikten sonra ve gerektiğinde akciğer radyografisi çekildikten sonra standart bir protokolle güvenlik marjlarıyla cerrahi olarak çıkarılmıştır. Kan alımı ve klinik tanı laboratuvarından serum demir sonuçlarının belirlenmesi arasında, demir oral yoldan [Ferrosanol® kapsülleri (100 mg/kapsül veya 40 mg/kapsül)] uygulanmıştır.
Dozaj, fitan, oksalatlar ve/veya fosfatlar gibi demir bağlayıcı bitki moleküllerinden kaçınmak için günde iki kez 100 mg/30 kg BW olacak şekilde bitkisel açıdan zayıf gıdalara karıştırılmıştır. Alternatif olarak, klinik laboratuvardan serum demir sonuçları gelene kadar günde 100 mg/10 kg BW dozunda subkutan demir enjekte edilmiştir (Myofer®/Ursoferran®; 100 mg/ml). Demir ikamesine, kan serumunda 250±30 µg/dl (~43±5 µmol/l) demir içeriğine istikrarlı bir şekilde ulaşılana kadar bireysel olarak devam edilmiştir. İlk demir ikamesinin dördüncü gününden itibaren, hayvanlar günde üç fraksiyona bölünerek 1.400 mg/m2 vücut yüzeyi dozunda Luparte® kapsülleri ile oral olarak tedavi edilmiştir (Tablo III). Kapsüller bir sonraki öğünden 1-2 saat önce uygulandı. Serum demir içeriği düzenli olarak izlenmiş ve gerektiğinde 250±30 µg/dl’ye ayarlanmıştır.
Tedavi detayları ve sağkalım süreleri de dahil olmak üzere takip bilgileri klinik dokümantasyon dosyalarına kaydedilmiştir. Klinik ve deneysel verilerin değerlendirilmesinden önce tüm etik konular Regierungspräsidium (Hükümet Başkanlığı) Freiburg (Almanya) ile görüşülmüştür. Bu retrospektif çalışmanın tasarımına göre, Regierungspräsidium (Hükümet Başkanlığı) Freiburg (Almanya) bu çalışma için yazılı izin vermiştir (Az. 35-9185.81/1, 4 Şubat 2019 itibariyle).
Hücre Hatları. D-GBM hücre hattı Dr. George Stoica (Veteriner Patobiyoloji Bölümü, Texas A&M Üniversitesi, College Station, TX, ABD) tarafından 8 yaşındaki erkek Boxer cinsi bir köpeğin beyin tümöründen üretilmiştir (49). Bu çalışmada kullanılan D-GBM hücreleri Dr. Pablo Steinberg (Gıda Toksikolojisi ve Analitik Kimya Enstitüsü, Hannover Veterinerlik Üniversitesi, Hannover, Almanya) tarafından Dr. G. Stoica’dan temin edilmiştir.
Histiyositik DH82 hücre hattı Dr. M.L. Wellman (Veteriner Patobiyoloji Bölümü, Veteriner Fakültesi, Ohio Eyalet Üniversitesi, CO, ABD) tarafından üretilmiştir (50). Bu çalışmada kullanılan DH82 hücre hattı da Dr. Pablo Steinberg tarafından Avrupa Doku Hücre ve Doku Bankası’ndan (katalog no. 94062922) satın alınmıştır.
Ulusal Kanser Enstitüsü Gelişimsel Tedavi Programı’nın (DTP) 54 insan tümör hücre dizisinden oluşan paneli lösemi, melanom, küçük hücreli dışı akciğer kanseri, kolon kanseri, böbrek kanseri, yumurtalık kanseri, meme kanseri ve prostat karsinomunun yanı sıra merkezi sinir sistemi tümörlerinden türetilen hücre dizilerinden oluşmaktadır (51). Daha önce, 48 saat boyunca artemisinin ile muamele edilen hücrelerin sitotoksisitesi bir sulforhodamine B tahlili kullanılarak değerlendirilmiştir (52). Artemisinin için log10 IC50 değerleri ve Ki-67 ve TfR için mRNA ifadeleri DTP veritabanında halka açık olarak mevcuttur (https://dtp.cancer.gov/default.htm).
Sitotoksisite deneyi. Artemisinin, artesunatın ve dihidroartemisinin köpek tümör hücre hatları DH82 ve DGBM’ye karşı sitotoksisitesini değerlendirmek için daha önce tarif edildiği gibi (53) resazurin indirgeme deneyi (Promega Corporation) gerçekleştirilmiştir. Testin konsepti, floresan olmayan boyanın canlı hücreler tarafından güçlü floresan boya resorufine metabolik olarak indirgenmesine dayanmaktadır (54). IC50 değerleri, GraphPad Prism 7 yazılımında (GraphPad Prism, Inc.)
Her bir deney, her biri altı tekrarlı olacak şekilde bağımsız olarak üç kez gerçekleştirilmiştir.
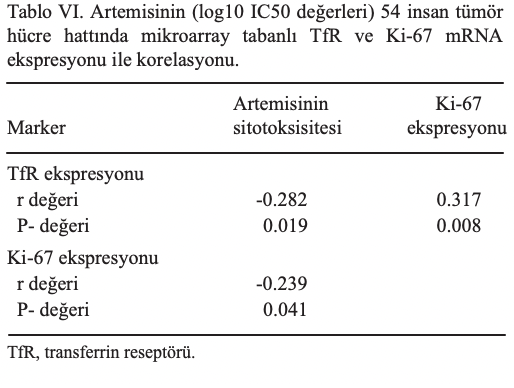
İmmünohistokimya. Hayvan tümörlerinde Ki-67 ve TfR ekspresyonunu değerlendirmek için evcil hayvanlarda farklı tümör tiplerini temsil eden toplam 17 tümör dokusu toplanmıştır (Tablo V). Kısaca, tümör dokuları 15 köpek (7 erkek ve 8 dişi) ve 2 kediden (her ikisi de dişi) elde edilmiştir. Köpeklerin ortalama yaşı 9,33 ve kedilerin ortalama yaşı 4 idi. Köpeklerin ortalama ağırlığı 27.266 kg ve kedilerin ortalama ağırlığı 4.00 kg’dır. Seçilen tüm hayvanlar pet hayvanı barınma koşullarında tutulmuştur. Tümör dokularının immüno histokimyasal boyaması daha önce tarif edildiği gibi yapıldı (55). Parafini uzaklaştırmak için lamlar iki kez ksilen (oda sıcaklığında her biri 5 dakika süreyle %98,5 ksilen) ile yıkandı. Ardından, örnek dokular su içinde izopropanol ile kademeli yıkamalarla rehidrate edildi. Isı kaynaklı epitop alımı, ısıtma cihazı olarak düdüklü tencere kullanılarak gerçekleştirilmiştir. Ultra-vision protein bloğu ve UltraVision Hidrojen Peroksit Bloğu (katalog no. TA-060-UB ve TA-060-H2O2Q; Thermo Fisher Scientific, Inc.), spesifik olmayan arka plan boyamasını önlemek amacıyla sırasıyla endojen proteinleri ve endojen peroksidaz aktivitesini bloke etmek için eklenmiştir. Monoklonal primer antikorların eklenmesinin ardından 4˚C’de bir gecelik inkübasyon gerçekleştirilmiştir. Ki-67’nin tespiti için SP6 klonu (katalog no. ab16667; Abcam) 1:200 dilüsyonda kullanılmıştır. TfR ekspresyonunun belirlenmesi için H68.4 klonu (katalog no. 136800; Thermo Fisher Scientific, Inc.) 1:100 dilüsyonda uygulanmıştır. Ardından, hem fare hem de tavşan primer antikorlarına özgü sekonder antikorlarla konjuge horseradish (yabanturpu) peroksidaz işaretli polimerler (katalog no. TL-060-QPH ve TL-060-QPB; Thermo Fisher Scientific, Inc.) üreticinin protokolüne göre 1 saat boyunca oda sıcaklığında eklenmiştir. Son boyama reaksiyonu diaminobenzidin ile gerçekleştirilmiş ve lamlar oda sıcaklığında 3 dakika boyunca hematoksilen ile karşı boyanmıştır.
DH82 ve DGBM hücre hatlarının immün boyaması rehidrasyon veya epitop alma adımları olmaksızın gerçekleştirilmiştir. Kısaca, 6 kuyucuklu bir plakaya altı kapak fişi yerleştirilmiş, ardından 5×105 hücre/kuyucuk kapak fişlerinin üzerine ekilmiş ve hücrelerin lamellere yapışması için nemlendirilmiş %5 CO2 atmosferinde 37˚C’de gece boyunca inkübe edilmiştir. Ardından, hücreler %4 paraformaldehit içinde 15 dakika oda sıcaklığında sabitlenmiş ve bloklama ve boyama adımları doku kesiti için tarif edildiği gibi gerçekleştirilmiştir. Ancak, Ki-67 ve TfR antikorları sırasıyla 1:500 ve 1:1.000 oranında seyreltilmiştir. İmmün boyalı slaytlar Pannoramic Desk (3DHISTECH Ltd.) kullanılarak taranmış ve Ki-67 veya TfR eksprese eden hücrelerin miktarı Pannoramic Viewer yazılımı sürüm 1.15 (3DHISTECH Ltd.) ile ölçülmüştür.
İstatiksel analiz. Anlamlılık değerleri ve korelasyon katsayıları WinSTAT yazılım programı sürüm 2012.1 (www.winstat.com/) ile Pearson korelasyon katsayısı ve Fisher’in kesin testi kullanılarak hesaplanmıştır. Artemisinin log10 IC50 değerleri ile Ki-67 ve TfR mRNA ifadeleri için Excel 2016 (Microsoft Corporation) kullanılarak doğrusal regresyon gerçekleştirilmiştir. P<0.05 istatistiksel olarak anlamlı bir fark olduğunu göstermek için kabul edilmiştir.
Sonuçlar
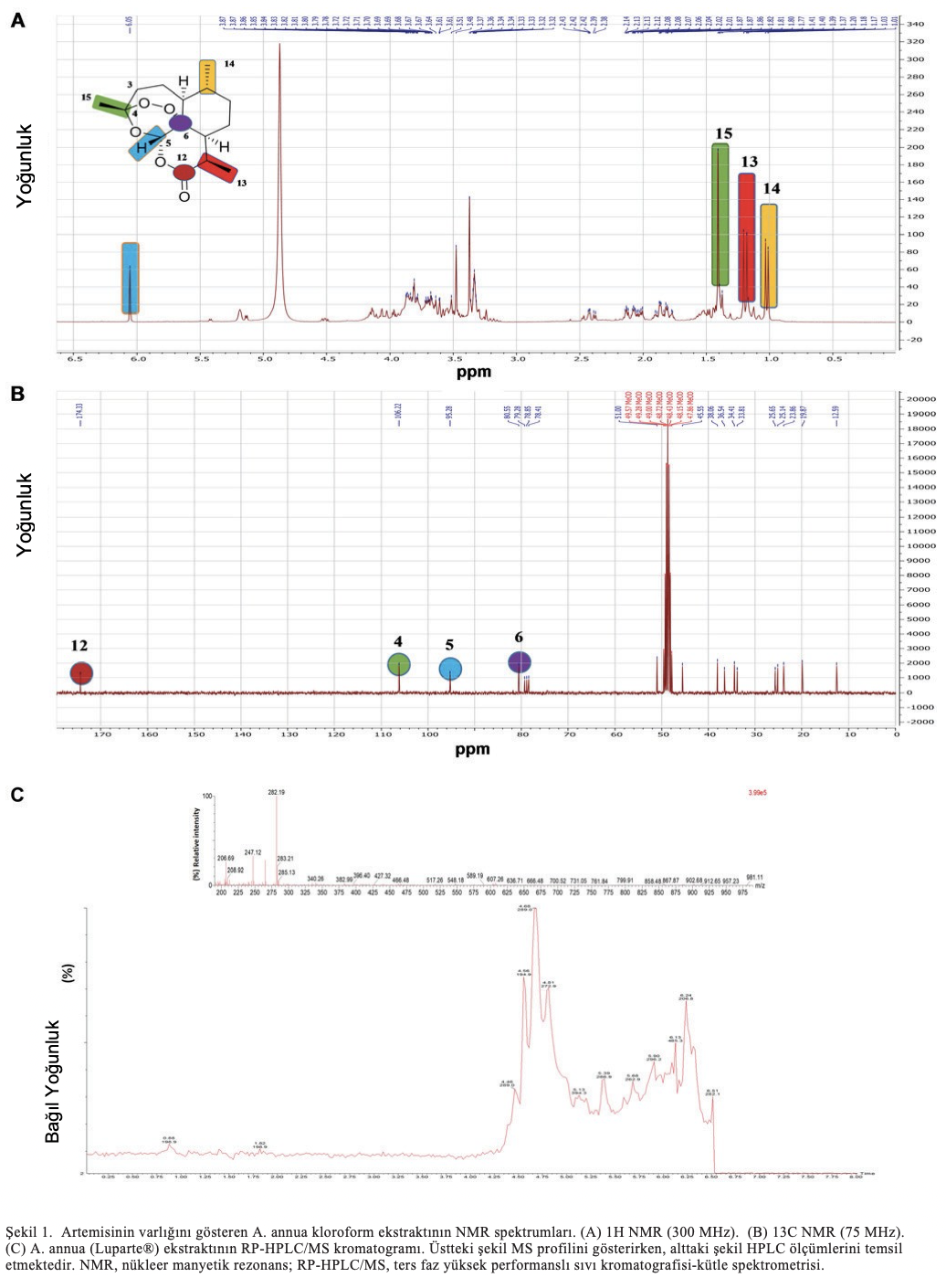
Artemisinin tespit edilmesi. Şekil 1A’da gösterildiği gibi, renksiz bir kristalin 1H NMR spektrumu artemisinin tipik sinyallerini içeriyordu. Spektrum üç metil grubu için sinyaller göstermiştir: δH 1.00 (d, J=6.5, H-14), 1.17 (d, J=7.2, H-13)’de iki sekonder ve δH 1.40 (s, H-15)’de bir tersiyer metil sinyali. Ek olarak, H-3a ve H-3b için sırasıyla δH 2.12 (brddd, J=14.9,4.2,2.6) ve 2.40 (ddd, J=14.9, 13.1,4.1) değerlerinde iki alifatik metilen sinyali gözlenmiştir. δH 6.01’deki karakteristik aşağı alan singlet sinyali H-5 için oksijenlenmiş protonun varlığını göstermiştir. Şekil 1B’de sunulduğu gibi, 13C NMR spektrumu, aşağıdaki gibi artemisinin varlığını doğrulayan önemli karbon sinyalleri de dahil olmak üzere 15 ana karbon sinyali göstermiştir: δC 173.3 (s, C-12), 105.2 (s, C-4), 94.3 (d, C-5) ve 79.5 (s, C-6) (56).
Artemisinin varlığını kantitatif olarak analiz etmek için ters faz HPLC-MS kullanılmıştır. Şekil 1C, 2 mg/ml MeOH ekstraktının çözülmesinden sonra elde edilen ve artemisinin A. annua (Luparte®) ekstraktının %3,46’sını temsil ettiğini gösteren kromatogramı göstermektedir.
Klinik tedavi. Bu çalışmaya toplam 23 köpek ve 8 kedi dahil edilmiştir. Bunlardan 20’si standart tedavilerine ek olarak A. annua ile tedavi edilmiş (Tablo I) ve 11’ine sadece standart tedavi uygulanmıştır (Tablo II). A. annua ile tedavi edilen grup 10 karsinom (8 köpek, 2 kedi) ve 10 sarkomdan (8 köpek, 2 kedi) oluşuyordu. Tüm hayvanlar 2010 ve 2017 yılları arasında tedavi edilmiştir (Tablo I). A. annua tedavisi uygulanmayan hayvan grubunda 5 hayvanda karsinom (3 köpek, 2 kedi) ve 6 hayvanda sarkom (4 köpek, 2 kedi) görülmüştür (Tablo II). Tüm hayvanların kan demir içeriği ve hayatta kalma süreleri kaydedilmiştir.
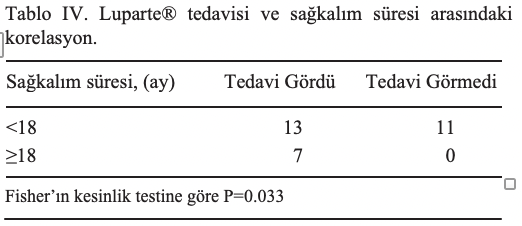
- annua tedavisinin genel sağkalım süresi üzerindeki etkisi değerlendirilmiştir. Toplamda, A. annua ile tedavi edilen 13 hayvan ve tedavi edilmeyen 11 hayvan tedaviyi takiben <18 ay hayatta kalma süresi göstermiştir. A. annua ile tedavi edilen gruptaki 7 hayvan A. annua tedavisinden sonra >18 ay hayatta kalırken, tedavi edilmeyen gruptaki hiçbir hayvan >18 ay hayatta kalmamıştır.
Gruplar arasındaki sağkalım sürelerindeki bu fark istatistiksel olarak anlamlıydı (P=0,033; iki kuyruklu Fisher’in kesinlik testi; Tablo IV).
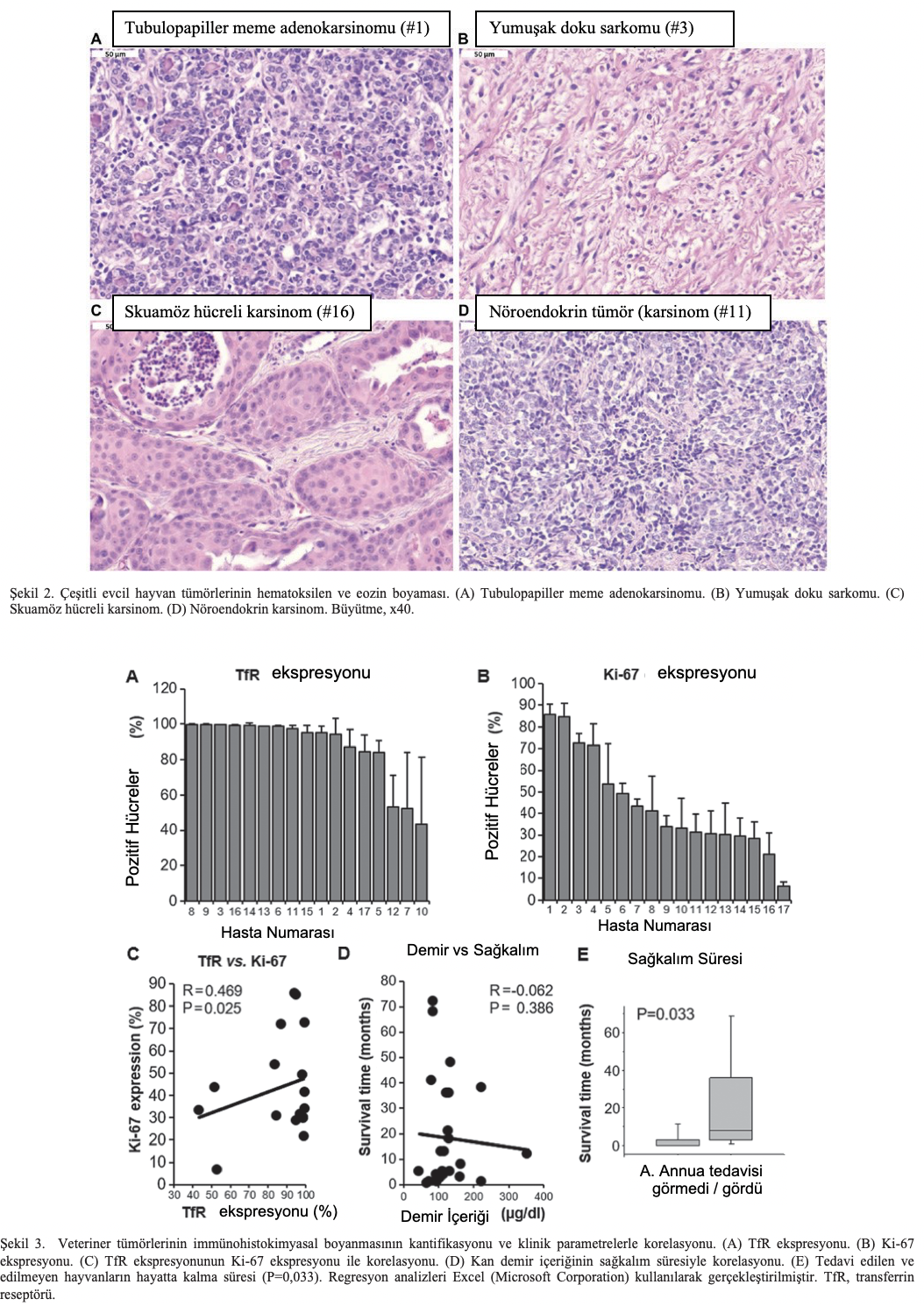
Histoloji ve immünohistokimya. İkinci kez 17 tümörden oluşan bir koleksiyon kullanılarak, tümörlerin histolojisi formalinle fikse edilmiş ve parafine gömülmüş tümör kesitlerinin hematoksilen ve eozinle boyanmasıyla belirlenmiştir. Tübülopapiller meme adenokarsinomu, yumuşak doku sarkomu, skuamöz hücreli karsinom ve nöroendokrin karsinom dahil olmak üzere farklı tümör histolojilerinin temsili fotoğrafları Şekil 2’de sunulmuştur.
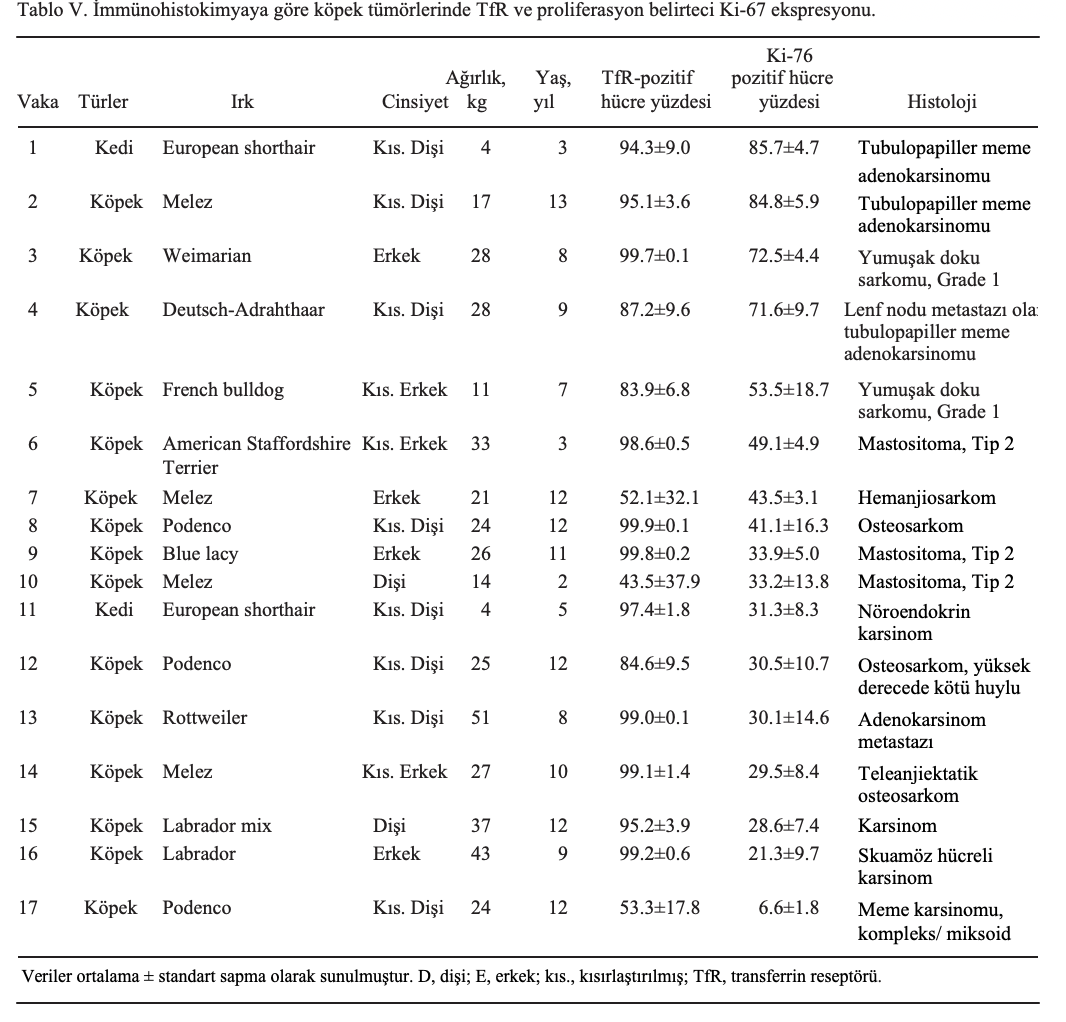
Ayrıca, immünohistokimyasal analizler gerçekleştirilmiştir. TfR’nin (CD71) membrana bağlı ekspresyonu ve proliferasyon belirteci Ki-67’nin nükleer ekspresyonu belirlenmiştir. Boyanan hücrelerin yüzdesi bilgisayar tabanlı ölçüm sistemi kullanılarak belirlenmiştir. Temsili ekspresyon değerleri sağlamak için her tümör kesitinden altı farklı alan seçilmiştir. TfR eksprese eden hücrelerin yüzdesi 43,5 (±%37,9) ile %99,2 (±%0,2) arasında değişirken, Ki-67-pozitif hücrelerin yüzdesi 6,6 (±%1,8) ile %85,7 (±%4,7) arasındaydı (Şekil 3A ve B). Tümör heterojenitesi antikanser tedaviye yanıtta önemli bir rol oynadığından, bu çalışmada farklı tümör biyopsileri arasındaki heterojen ve homojen boyanma paternlerine de odaklanılmıştır. Bazı tümörler immünohistokimyasal boyamada çok heterojen iken, diğerleri tek tip boyanma göstermiştir. Bu durum, TfR için 0,1 (3, 8 ve 13 numaralı vakalar) ile %37,9 (10 numaralı vaka) arasında ve Ki-67 için 1,8 (17 numaralı vaka) ile %16,3 (8 numaralı vaka) arasında değişen standart sapmalarda görülebilir (Tablo V). Daha sonra, TfR ve Ki-67 ekspresyonu ile tümör biyopsileri seti arasındaki korelasyon araştırılmış ve istatistiksel olarak anlamlı bir korelasyon ortaya çıkmıştır (P=0,025; r=0,469; Şekil 3C). Kan demir içeriği ile hayvanların hayatta kalma süresi arasında anlamlı bir korelasyon tespit edilmemiştir (P=0.386; r=-0.062; Şekil 3D). Hayatta kalma süresi ile A. annua tedavisi arasındaki ilişkinin anlamlı olması dikkat çekicidir. Standart tedavi artı A. annua ile tedavi edilen hayvanlar, sadece standart tedavi ile tedavi edilenlere kıyasla önemli ölçüde daha uzun hayatta kalma sürelerine sahipti (P=0,033; Şekil 3E).
Bu tümör örneklerinde TfR ve Ki-67 ekspresyonu ile artemisinin sitotoksisitesi arasındaki doğrudan ilişki değerlendirilemediğinden, 54 insan tümör hücre hattındaki TfR ve Ki-67 mikroarray tabanlı mRNA ekspresyonu, sülforhodamin testi ile belirlenen log10 IC50 değerleri ile karşılaştırılarak analiz edilmiştir. Hem TfR hem de Ki-67 ekspresyonu, bu hücre hatlarında artemisinin sitotoksisitesi ile önemli ölçüde negatif korelasyon göstermiştir (P<0.05; r<-0.20); bu da bu iki markörün daha yüksek ekspresyonunun hücre hatlarının artemisine karşı daha yüksek bir hassasiyetle ilişkili olduğunu göstermektedir (Tablo VI). TfR ve Ki-67 ifade düzeyleri pozitif korelasyon göstermiştir (P=0.008; r=0.317).
54 insan tümör dizisinden oluşan bu panel sekiz tümör tipinden (lösemi, melanom ve beyin tümörü ile kolon, meme, yumurtalık, böbrek ve prostat karsinomu) türetilen hücre dizilerinden oluşmuştur. Her bir tümör tipine ait hücre dizisi sayısı (n=1-9), aşağıdaki üç sonuç dışında, anlamlı korelasyonları ortaya çıkarmak için çok düşüktü. Akciğer kanseri hücre hatlarında, artemisinin log10 IC50 değerleri Ki-67 ekspresyonu ile ters korelasyon göstermiştir (P=0,009; r=-0,759). Melanom hücre hatlarında, Ki-67 ve TfR ekspresyon seviyeleri önemli ölçüde korelasyon gösterdi (P=0.010; r=0.787). Böbrek kanseri hücre hatlarında, Ki-67 ve TfR ekspresyon seviyeleri de önemli ölçüde korelasyon göstermiştir (P=0.019; r=0.781) (veriler gösterilmemiştir). Artemisinin yanıtı ile Ki-67 ve TfR ekspresyonu arasındaki diğer tüm ilişkiler istatistiksel olarak anlamlı olmadığından, Ki-67 ve TfR’nin rolüne ilişkin güvenilir sonuçlar tümör tipine özgü alt kümelerden değil, bir bütün olarak hücre hattı panelinden çıkarılabilir.
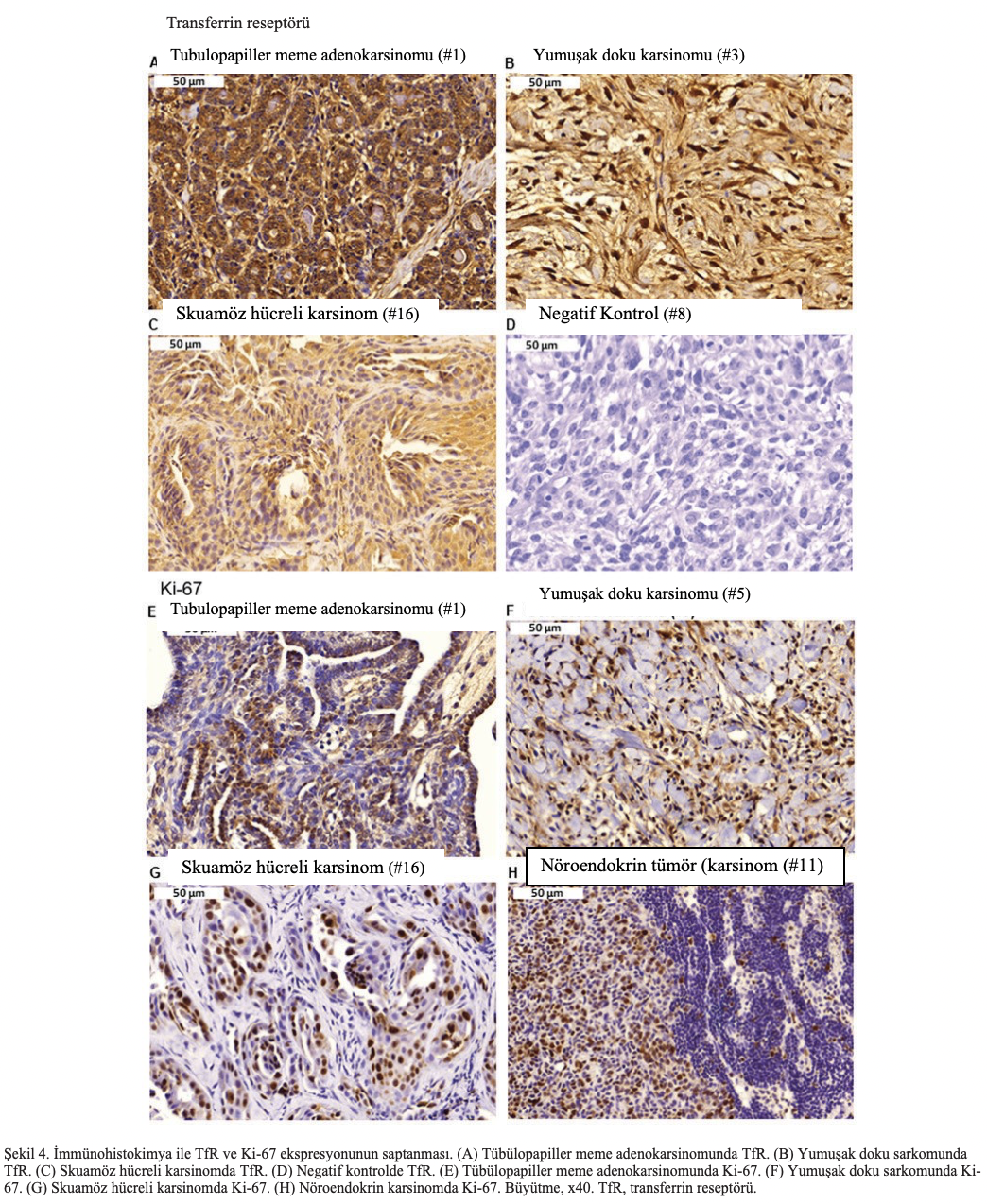
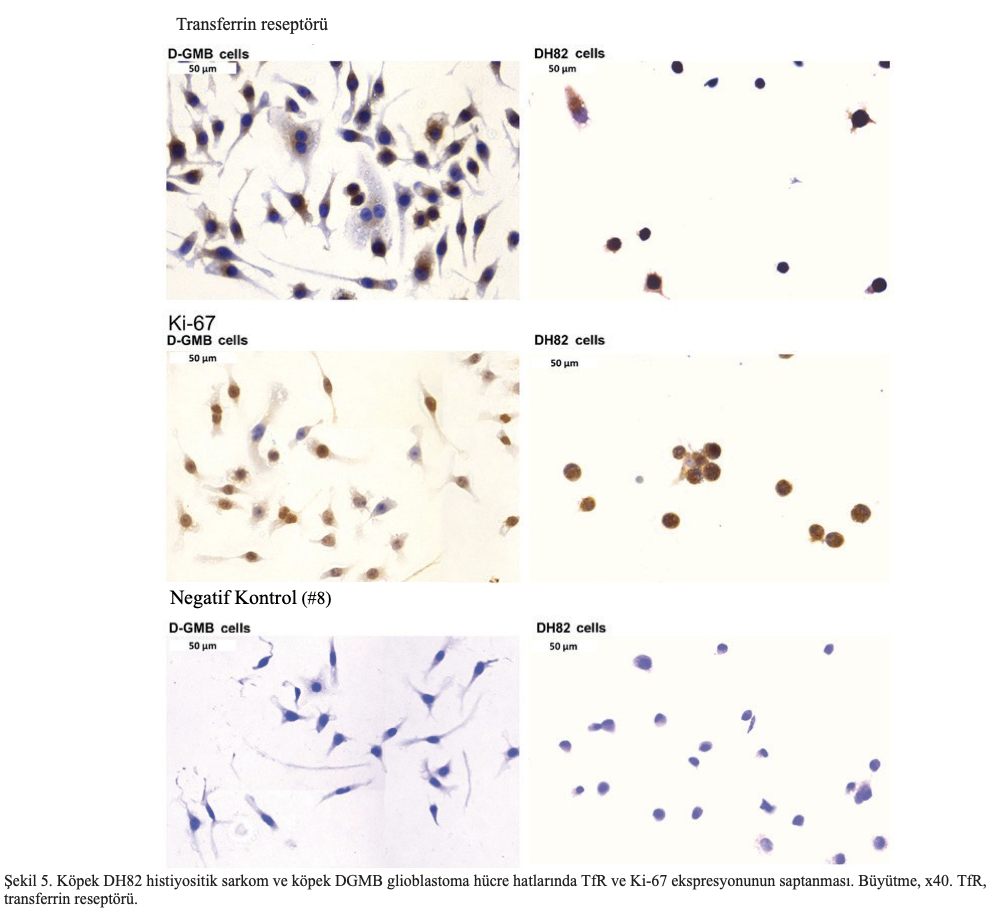
TfR ekspresyonu için immün boyamanın temsili görüntüleri Şekil 4A-D’de sunulmuştur. Tubulopapiller meme adenokarsinomu, yumuşak doku sarkomu ve skuamöz hücreli karsinom biyopsilerinde güçlü TfR ekspresyonu tespit edilmiştir. Buna karşılık, negatif kontrol herhangi bir reaktivite göstermemiştir, bu da immün boyama prosedürünün özgüllüğünü göstermektedir.
Ayrıca, tübülopapiller meme adenokarsinomu, yumuşak doku sarkomu, skuamöz hücreli karsinom ve nöroendokrin karsinomda Ki-67 ekspresyonu örnekleri Şekil 4E-H’de gösterilmiştir. Ayrıca, hematoksilen ve eozin boyalı tümör dokularında TIL varlığının değerlendirilmesi, tüm tümör slaytlarında TIL bulunmadığını ortaya koymuştur.
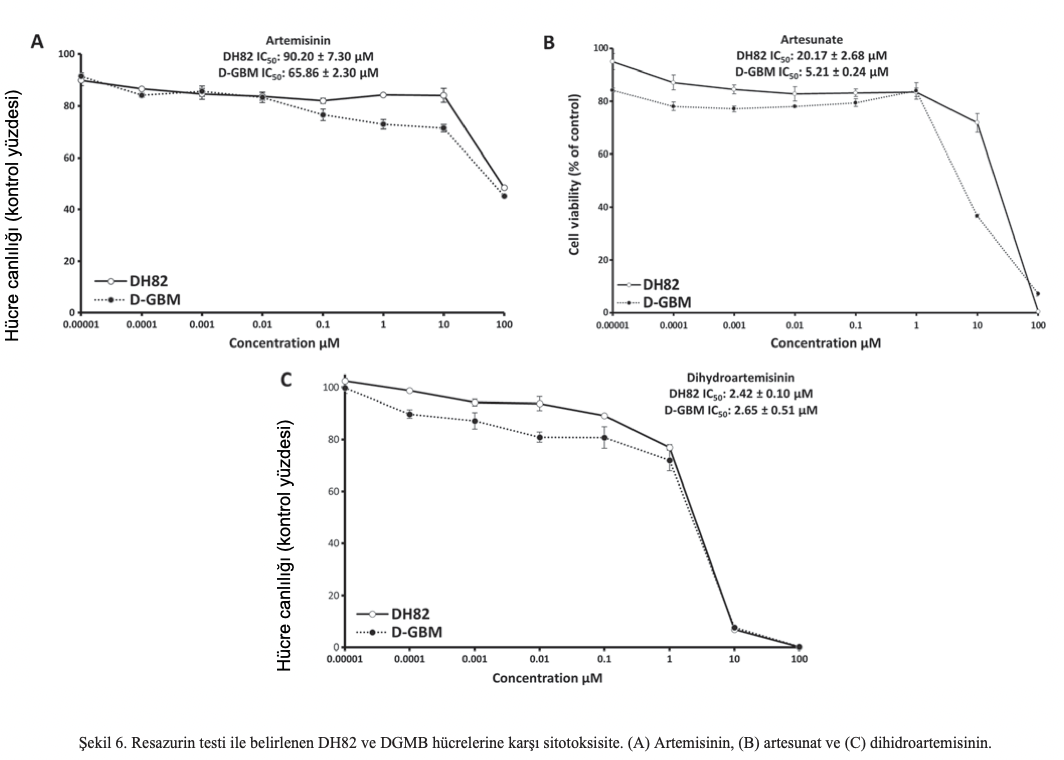
Karşılaştırma için, Ki-67 ve TfR ekspresyonu iki köpek hücre hattında analiz edilmiştir. DH82 histiyositik sarkom ve DGMB glioblastom hücreleri her iki belirteç için immün boyandı. Nitekim, Şekil 5’te gösterildiği gibi, Ki-67 ve TfR her iki hücre dizisinde de aşırı eksprese edilmiştir. Ayrıca, bu çalışmada artemisinin, artesunat ve dihidroartemisinin köpek hücre hatlarına karşı sitotoksisitesi araştırılmıştır. Beklendiği gibi, artemisinin ve türevleri bu tümör hücre hatlarında da aktifti. DH82 hücreleri ve DGBM hücrelerine karşı artemisinin, artesunat ve dihidroartemisinin IC50 değerleri Şekil 6’da sunulmuştur.
Tartışma
Artemisinin aktivitesi için demir takviyesinin faydalı olup olmadığı veteriner hekimler ve alternatif uygulayıcılar arasında tartışma konusu olmuştur. Artemisinin ve türevlerinin antimalaryal aktivitesi için demirin rolü tartışılmıştır (57,58). Kanser bağlamında, daha önce Ferrosanol® ve holotransferrinin lösemi ve astrositoma hücrelerinde artesunat kaynaklı sitotoksisite ve apoptozu 10 kata kadar artırdığını bildirmiştik.
Bu etkiler, TfR’ye bağlanmak için transferrin ile rekabet eden anti-Tf R monoklonal antikoru RVS10 ile tersine çevrilmiştir. Tümör hücre hatlarında TfR ekspresyonu %48 ila 95 arasında değişirken, normal periferik mononükleer kan lökositleri ≤%1,3 TfR pozitifliği göstermiştir, bu da artesunatın tümör hücrelerindeki tercihli TfR ekspresyonu nedeniyle en azından bir dereceye kadar tümöre özgü etkiler gösterebileceğini göstermektedir (59).
Başka bir çalışmada, farklı tümör tiplerinden toplam 36 hücre hattını tek başına artesunat veya Ferrosanol® ile kombinasyon halinde tedaviye verdikleri yanıt açısından araştırdık (60). Bu, artesunat artı Ferrosanol®’ün hücre hatlarının çoğunda tek başına artesunat ile karşılaştırıldığında sitotoksisiteyi artırdığını ortaya koymuştur; ancak, 11 hücre hattı artmış apoptoz göstermemiş ve dokuz hat, tek başına artesunat tedavisine kıyasla kombine ilaç tedavisini takiben apoptozda bir azalma sergilemiştir. Demirin proliferasyonla ilgili enzimler için ko-faktör görevi gördüğü anlaşılmaktadır (61). Bu nedenle, Ferrosanol® bu dokuz hücre hattının proliferasyonunu baskılamak yerine indükleyebilir.
Bu in vitro verilere dayanarak, veteriner veya insan kanser tedavisinde demirin artemisinin tipi tedaviye ek olarak eklenmesi güvenilir değildir. Bu çalışmanın sonuçları, kan demir içeriğinin A. annua tedavisinden sonra hayatta kalma süreleriyle ilişkili olmadığını, tümör içindeki TfR içeriğinin ise ilişkili olduğunu ortaya koymuştur. Pratik nedenlerden dolayı, vücudun normal demir içeriğinin artesunatın aktivitesi için yeterli olması gerektiği varsayılabilir. Sadece demir eksikliği olan hastalarda demir takviyesi düşünülebilir. Ancak bu durumda, ilaç kombinasyonunun etkisini arttırmak için demir ve artesunatın tümöre aynı anda ulaşması önemli olabilir. Aksi takdirde, Ferrosanol® daha kötü etkiler gösterebilir ve proliferatif tümör aktivitesinin baskılanmasından ziyade artmasına yol açabilir.
Demirin etkisi daha önceki başka çalışmalarda da gösterilmiştir. Transferrin ilavesinin çoklu ilaca dirençli H69VP küçük hücreli akciğer kanseri hücrelerinin artemisinin çapraz direncini engelleyebildiği bildirilmiştir (62). Ayrıca, yüksek TfR ekspresyonuna sahip retinoblastoma hücreleri, normal retina hücrelerine kıyasla artesunata daha duyarlıdır. Bu aktivite spesifiktir, çünkü RNA interferans aracılı TfR-knockdown retinoblastoma hücrelerinin artesunata duyarlılığını artırmıştır (63). Bu bulgulara uygun olarak, holotransferrin takviyesi T-hücreli lenfoma hücrelerinde dihidroartemisinin sitotoksisitesini artırmaktadır (64).
TfR’nin tümör hücrelerinde normal hücrelere kıyasla daha yüksek oranda eksprese edildiği açıkça kanıtlanmıştır (61,65-68).
Bu nedenle, örneğin TfR’nin antikor aracılı hedeflenmesi veya TfR’ye yönelik immünotoksinlerin üretilmesi yoluyla, tümöre özgü öldürmeyi iyileştirmek ve aynı zamanda normal dokulara toksik yan etkileri önlemek için TfR’yi tedavi yöntemi olarak ele alan deneysel tedavi stratejileri önerilmiştir (69-71). Transferrin-artemisinin konjugatlarının üretilmesiyle, tümör hücrelerine karşı, bağlanmamış artemisinin ile karşılaştırıldığında gelişmiş sitotoksisite ortaya çıkmıştır (72-74).
Daha önce, kanserli 23 köpekte artesunat ile bir klinik faz I/II çalışması gerçekleştirdik ve artesunat tedavisini takiben 1 tam remisyon ve 7 stabil hastalık vakası ortaya çıkardık (39). A. annua ile yapılan bu retrospektif çalışmanın sonuçları daha iyi görünmektedir. Mevcut çalışmada 25 köpeğin 9’unda (%36) 18 aylık eşik değerin üzerinde sağkalım süresinde artış tespit edilmiştir. Bu eğilimin gelecekteki çalışmalarda doğrulanması gerekse de, tüm bitki özütünün antikanser etkisinin izole artemisinin veya yarı sentetik türevi artesunattan daha iyi olduğu tahmin edilebilir. Gerçekten de, bitki ekstresi artemisinin yanı sıra arteanuin B, artemisitene, scopoletin ve 1,8-cineole dahil olmak üzere çok daha fazla sitotoksik bileşik içerir (75-78). Bu nedenle, A. annua preparatları tek başına kombinasyon tedavisi olarak kullanılabilir. Birkaç sitotoksik bileşik tümöre karşı aynı anda etki edebilir ve bu da tümör inhibisyonunun artmasına yardımcı olur.
Hızlı çoğalan tümörlerin yavaş büyüyen tümörlere kıyasla standart kemoterapiye daha iyi yanıt verdiği iyi bilinmektedir (79,80). Bu nedenle, bu çalışmada immünohistokimyasal analize proliferasyon belirteci olarak Ki-67 de dahil edilmiştir. Ki-67 hücre döngüsü ile yakından ilişkilidir. Kemoterapinin başarısı için prediktif bir faktör ve kanser hastalarının sağkalımı için prognostik bir faktör olarak rolü tartışılmıştır (81,82). Bu nedenle, sekiz farklı tümör tipinden 54 insan hücre dizisinden oluşan panelde Ki-67 ekspresyonu ile artemisinin sitotoksisitesi arasındaki anlamlı bağlantı, Ki-67 ekspresyonunun artemisine tümör yanıtı için prognostik bir belirteç olabileceğini göstermiştir.
Bu çalışma, veteriner tümörlerinde ve insan tümör hücre hatlarında TfR ve Ki-67 ekspresyonu arasında anlamlı bir korelasyon olduğunu ortaya koymuştur; bu da TfR ekspresyonunun yüksek proliferatif oranlarla ilişkili olduğunu ve artemisinin hızlı büyüyen tümörlerde yavaş büyüyenlere göre daha aktif olduğunu göstermektedir. Bu sonuç, insan tümörlerinden elde edilen önceki verileri desteklemekte ve aynı zamanda veteriner ve insan tümörlerinin bu açıdan karşılaştırılabilirliğini ifade etmektedir. TfR ve Ki-67 ekspresyonu arasındaki anlamlı korelasyon, lösemi, melanom, meme karsinomu, beyin tümörleri, baş ve boyun kanseri ve özofagus kanseri dahil olmak üzere çeşitli tümör tiplerinin biyopsilerinde bildirilmiştir (83-88). TfR ve Ki-67 arasında 54 tümör hücre dizisinden oluşan panelin tamamında anlamlı bir ilişki tespit edilmesine rağmen, bu ilişki farklı tümör tiplerine sahip alt kümelerin çoğunda görülmemiştir. Bu durum, tümör varlığı başına hücre dizisi sayısının sınırlı olmasıyla açıklanabilir. TfR ve Ki-67 ekspresyonu arasındaki anlamlı korelasyona ilişkin daha önce yayınlanan veriler, tümör biyopsilerinin daha büyük kolektiflerinde elde edilmiştir (83,89).
İnsan tümör patolojisinde, hematoksilen ve eozin boyama tümör infiltre eden lenfositlerin (TIL) saptanması için de yararlıdır (90-92). Bu nedenle, bu çalışmada evcil hayvan tümörlerinin hematoksilen ve eozin boyalı preparatlarını TIL’lerin varlığı açısından da taradık, ancak tümör dokularında TIL’ler tespit edilemedi. Tümörler genellikle büyük olduğundan ve tanı konulduğunda zaten ilerlemiş olduğundan, hayvanların bağışıklık sisteminin zayıfladığı ve tümöre karşı TIL aracılı bağışıklık savunmasının büyük ölçüde yok olduğu varsayılmıştır.
Ayrıca, mevcut çalışmada A. annua ile tedavi edilen 25 köpek ve kedi arasında kayda değer herhangi bir ciddi yan etki gözlemlenmediğini belirtmekte fayda vardır. İnsan kanser hastalarında yarı sentetik ilaç artesunat ile yapılan tümör tedavisi ile karşılaştırıldığında, A. annua’nın daha da güvenli olduğu görülmüştür. Artesunat ile tedavi edilen 23 kanserli köpekten 16’sında ateş ve geçici hematolojik ve gastrointestinal toksisite gözlenmiş ve 1 köpek pnömoniden ölmüştür (39). İnsan kanser hastalarında, prostat karsinomu olan 1 hastada A. annua’nın insani nedenlerle kullanımı başka bir çalışmada gayet iyi tolere edilmiştir (41). Artesunat ile tedavinin kolon, serviks ve meme karsinomunda hematolojik toksisite, gastrointestinal toksisite, asteni ve tromboz dahil olmak üzere zaman zaman ve geçici yan etkilere yol açtığı bildirilmiştir (42-44). Artesunat ile nadir hepatotoksisite vakaları bildirilmiştir (93,94). A. annua ile fitoterapötik yaklaşımların artesunat ile tedaviden daha güvenli olup olmadığı daha fazla araştırma gerektirmektedir.
Özellikle, evcil hayvan sahiplerinin çoğunluğu, hayvanların A. annua tedavisinden sonra daha iyi hissettiklerini bildirmiştir; bazıları daha aktifken, diğerleri daha rahatlamıştır. Elbette, bu gözlemler öznel ve ölçülebilir değildir ve bu raporların evcil hayvanlarının tedavisinin başarılı olmasından sonra evcil hayvan sahiplerinin psikolojik durumunu yansıtıp yansıtmadığı belirsizdir. Bununla birlikte, A. annua tedavisinin beklenmedik ve kasıtsız gelişen olumlu yan etkileri olabileceği ihtimali göz ardı edilemeyeceğinden, bu tespit dikkate alınmalıdır. Nitekim, bu gözlemleri destekleyen bazı geçmiş çalışmalar bulunmaktadır. Artesunat ile tedavi edilen tavşanların beyinlerindeki serotonin serum seviyelerinin, tedavi edilmeyen kontrol hayvanlarına kıyasla önemli ölçüde daha yüksek olduğu bildirilmiştir (95). Zhu ve arkadaşları (96) dihidroartemisinin, artesunat veya artemether ile nosiseptif, anksiyete ve depresif davranışlarda önemli gerilemeler bildirmiştir. Amos ve arkadaşları (97), artemisinin beyindeki postsinaptik dopamin D2 reseptörleri üzerindeki etkisinin aracılık ettiği artemisinin sedatif özelliklerini öne sürmüştür. Artemisinin bu yeni özelliği gelecekte daha detaylı şekilde araştırılmayı hak etmektedir.
Mevcut araştırma ayrıca hayvan tümörlerinde elde edilen verilerin insan tümörlerindeki klinik durumla karşılaştırılabilirliği ve dolayısıyla veteriner tümörlerinin insan kanser biyolojisi ve tedavisine model olarak uygunluğu hakkındaki temel soruyu da gündeme getirmektedir. Bu çalışma, TfR ve Ki-67’nin rolünün veteriner tümörleri ve insan tümör hücre hatları arasında karşılaştırılabilir olduğunu ortaya koymuştur. TfR ve Ki-67 ayrıca insan hastaların tümörlerinde artemisinin ve artesunata verilen yanıtla da ilişkilendirilmiştir (41-43). İnsan tümörlerindeki bu veriler henüz başlangıç aşamasında olsa da, veteriner tümörlerinin artemisinin tedavisi bağlamında klinik insan tümörleri için uygun bir modeli temsil edebileceğini göstermektedir.
Bu durumdan bağımsız olarak, veteriner tümörlerinin insan kanser biyolojisinin araştırılması için uygunluğunu destekleyen daha fazla argüman vardır. Veteriner tümörleri kendiliğinden gelişmektedir, bu da onları fare ve sıçanlardaki diğer tümörlere kıyasla daha iyi modeller olarak nitelendirebilir. Sıklıkla tümörler, sinjeneik tümörlerin kemirgenlere veya insan ksenograft tümörlerinin immünosüpresif çıplak farelere nakledilmesiyle korunur. Bir başka olasılık da kimyasal karsinojenlerle fare veya sıçanlarda tümör gelişimini indüklemektir. Bu tümör modelleri preklinik onkolojide vazgeçilmez ve yüksek değere sahip olsalar da, bir dereceye kadar yapaydırlar. Burada, köpek ve kedilerdeki tümörler avantajlı olabilir, çünkü spontane gelişimleri insan tümörlerinin durumuna daha yakındır. Veteriner tümörleri henüz yukarıda bahsedilen kemirgen tümör modelleri kadar ilgi görmemiştir. İnsan tümör tedavisine yönelik stratejiler geliştirmek için cazip in vivo modeller olarak veteriner tümörlerinin tam potansiyelini araştırmak için daha fazla çalışma yapılması gerekmektedir.
Sonuç olarak, standart tedavi artı A. annua ile tedavi edilen 20 köpek ve kedi ile sadece standart tedavi ile tedavi edilen 11 köpeği içeren mevcut retrospektif çalışma, veteriner kanser hastalarına ek A. annua gıda takviyesinin daha iyi bir sağkalım prognozu ile sonuçlandığını açıkça göstermiştir. Tümörlerdeki TfR ekspresyonu, insan tümör hücre hatlarından oluşan bir kontrol panelinde sağkalım süresi ve artemisinin sitotoksisitesi ile önemli ölçüde ilişkili olduğundan, A. annua’nın aktivitesi kandaki değil tümördeki demir içeriğine bağlı olabilir.
Aynı durum Ki-67 ifadesi için de geçerliydi. Yüksek proliferatif aktiviteye işaret eden yüksek Ki-67 ekspresyonuna sahip tümörler, insan hücre hattı panelinde artemisinin etkisine daha duyarlıydı. Bu çalışmada sunulan veriler, A. annua’nın veteriner tümörlerine karşı aktivitesi için yol gösterici niteliktedir. Bu hipotez için ikna edici kanıtlar sunmak üzere ileriye dönük çalışmalar yapılması gerekmektedir.
Teşekkürler
Yazarlar Sayın Doris Rohr’a (Farmasötik Biyoloji Bölümü, Eczacılık ve Biyokimya Enstitüsü, Johannes Gutenberg Üniversitesi, Mainz, Almanya) immünohistokimyasal boyama konusundaki teknik yardımları için teşekkür borçludur.
Finansman
Bu çalışma Johannes Gutenberg Üniversitesi (Mainz, Almanya) tarafından sağlanan kurumsal fon ile desteklenmiştir.
Veri ve materyallere erişim
Mevcut çalışma sırasında üretilen ve/veya analiz edilen veri setleri, bu verilerin erişilebilirliğine ilişkin kısıtlamalar nedeniyle kamuya açık değildir, ancak talep edilmesi halinde ilgili yazardan temin edilebilir.
Katkıda bulunan yazarlar
TE ve EB çalışmayı tasarlamıştır. EB hayvanları tedavi etmiş, materyalleri sağlamış ve klinik verileri toplamıştır. MEMS immün boyama işlemini gerçekleştirmiştir. MEFH NMR ve HPLC-MS gerçekleştirdi. TE istatistiksel analizi gerçekleştirmiş, çalışmayı denetlemiş ve çalışma için gerekli olanakları sağlamıştır. TE ve MEMS makaleyi yazmıştır. Tüm yazarlar makaleyi okumuş ve son halini onaylamıştır.
Kurul onayı ve katılım izni
Bu retrospektif çalışma için yazılı izin Regierungspräsidium’dan (Hükümet Başkanlığı) Freiburg, Almanya (Az. 35-9185.81/1, 4 Şubat 2019 tarihli) alınmıştır. Tüm evcil hayvan sahiplerinden deneysel çalışma için yazılı onam belgesi alınmıştır.
Yayın için hasta onayı
Geçerli değil.
Çıkar çatışması beyanı
EB, Luparte® ürününü ticari olarak satmaktadır. Farmakolojik Biyoloji Bölümü’ndeki (Johannes Gutenberg Üniversitesi, Mainz, Almanya) deneysel çalışmaların hiçbir kısmı EB tarafından finanse edilmemiştir. Diğer tüm yazarlar çıkar çatışması olmadığını beyan etmişlerdir.
Kaynakça
- Talmadge JE, Singh RK, Fidler IJ and Raz A: Murine models to evaluate novel and conventional therapeutic strategies for Am J Pathol 170: 793-804,2007.
- Jantscheff P, Beshay J, Lemarchand T, Obodozie C, Schächtele C and Weber H: Mouse-derived isograft (MDI) in vivo tumor models Spontaneous sMDI models: Characterization and cancer therapeutic approaches. Cancers (Basel) 11: 11, 2019.
- Choi JW, Yoon HY and Jeong SW: Clinical outcomes of surgically managed spontaneous tumors in 114 client-owned Immune Netw 16: 116-125,2016.
- Hellmén E, Bergström R, Holmberg L, Spångberg IB, Hansson K and Lindgren A: Prognostic factors in canine mammary tumors: A multivariate study of 202 consecutive Vet Pathol 30: 20-27, 1993.
- Marconato L: The staging and treatment of multicentric high-grade lymphoma in dogs: A review of recent developments and future prospects. Vet J 188: 34-38,
- Tuohy JL, Selmic LE, Worley DR, Ehrhart NP and Withrow SJ: Outcome following curative-intent surgery for oral melanoma in dogs: 70 cases (1998-2011).J Am Vet Med Assoc 245: 1266-1273,
- Miller RL, Van Lelyveld S, Warland J, Dobson JM and Foale RD: A retrospective review of treatment and response of high-risk mast cell tumours in dogs. Vet Comp Oncol 14: 361-370,
- Romano FR, Heinze CR, Barber LG, Mason JB and Freeman LM: Association between body condition score and cancer prognosis in dogs with lymphoma and osteosarcoma. J Vet Intern Med 30: 1179-1186,
- Sarowitz BN, Davis GJ and Kim S: Outcome and prognostic factors following curative-intent surgery for oral tumours in dogs: 234 cases (2004 to 2014). J Small Anim Pract 58: 146-153,
- Ettinger SN: Principles of treatment for feline lymphoma. Clin Tech Small Anim Pract 18: 98-102,
- Morris J: Mammary tumours in the cat: Size matters, so early intervention saves lives. J Feline Med Surg 15: 391-400,
- Zabielska‑Koczywąs K, Wojtalewicz A and Lechowski R: Current knowledge on feline injection-site sarcoma treatment. Acta Vet Scand 59: 47,
- Martano M, Iussich S, Morello E and Buracco P: Canine oral fibrosarcoma: Changes in prognosis over the last 30 years? Vet J 241: 1-7,
- Zhang D, Hedlund EM, Lim S, Chen F, Zhang Y, Sun B and Cao Y: Antiangiogenic agents significantly improve survival in tumor-bearing mice by increasing tolerance to chemo- therapy-induced Proc Natl Acad Sci USA 108: 4117-4122, 2011.
- Tiwari A, Hadley JA, Hendricks GL III, Elkin RG, Cooper T and Ramachandran R: Characterization of ascites-derived ovarian tumor cells from spontaneously occurring ovarian tumors of the chicken: Evidence for E-cadherin PLoS One 8: e57582, 2013.
- Newman DJ and Cragg GM: Natural products as sources of new drugs from 1981 to J Nat Prod 79: 629-661, 2016.
- Tu Y: The discovery of artemisinin (qinghaosu) and gifts from Chinese medicine. Nat Med 17: 1217-1220,
- Bridgford JL, Xie SC, Cobbold SA, Pasaje CFA, Herrmann S, Yang T, Gillett DL, Dick LR, Ralph SA, Dogovski C, et al: Artemisinin kills malaria parasites by damaging proteins and inhibiting the proteasome. Nat Commun 9: 3801,
- Su XZ and Miller LH: The discovery of artemisinin and the Nobel Prize in Physiology or Medicine. Sci China Life Sci 58: 1175-1179,
- Tu Y: Artemisinin-a gift from traditional chinese medicine to the world (Nobel Lecture). Angew Chem Int Ed Engl 55: 10210-10226,
- Daddy NB, Kalisya LM, Bagire PG, Watt RL, Towler MJ and Weathers PJ: Artemisia annua dried leaf tablets treated malaria resistant to ACT and v.artesunate: Case reports. Phytomedicine 32: 37-40, 2017.
- Saeed ME, Krishna S, Greten HJ, Kremsner PG and Efferth T: Antischistosomal activity of artemisinin derivatives in vivo and in patients. Pharmacol Res 110: 216-226,
- Pérez del Villar L, Burguillo FJ, López-Abán J and Muro A: Systematic review and meta-analysis of artemisinin based therapies for the treatment and prevention of PLoS One 7: e45867, 2012.
- Naß J and Efferth T: The activity of Artemisia and their constituents against Trypanosomiasis. Phytomedicine 47: 184-191, 2018.
- Efferth T: Beyond malaria: The inhibition of viruses by arte- misinin-type compounds. Biotechnol Adv 36: 1730-1737,
- Jiang W, Cen Y, Song Y, Li P, Qin R, Liu C, Zhao Y, Zheng J and Zhou H: Artesunate attenuated progression of atherosclerosis lesion formation alone or combined with rosuvastatin through inhibition of pro‑inflammatory cytokines and pro‑inflammatory Phytomedicine 23: 1259-1266, 2016.
- Li J, Casteels T, Frogne T, Ingvorsen C, Honore C, Courtney M, Huber KV, Schmitner N, Kimmel RA, Romanov RA, et al: Artemisinins target GABAA receptor signaling and impair alpha cell Identity. Cell 168: 86-100.e15,
- Guo Y, Fu W, Xin Y, Bai J, Peng H, Fu L, Liu J, Li L, Ma Y and Jiang H: Antidiabetic and antiobesity effects of artemether in db/db mice. BioMed Res Int 2018: 8639523,
- Efferth T, Dunstan H, Sauerbrey A, Miyachi H and Chitambar CR: The anti-malarial artesunate is also active against cancer. Int J Oncol 18: 767-773,
- Efferth T, Sauerbrey A, Olbrich A, Gebhart E, Rauch P, Weber HO, Hengstler JG, Halatsch ME, Volm M, Tew KD, et al: Molecular modes of action of artesunate in tumor cell lines. Mol Pharmacol 64: 382-394,
- Dell’Eva R, Pfeffer U, Vené R, Anfosso L, Forlani A, Albini A and Efferth T: Inhibition of angiogenesis in vivo and growth of Kaposi’s sarcoma xenograft tumors by the anti-malarial arte- Biochem Pharmacol 68: 2359-2366, 2004.
- Efferth T: From ancient herb to modern drug: Artemisia annua and artemisinin for cancer Semin Cancer Biol 46: 65-83, 2017.
- Abba ML, Patil N, Leupold JH, Saeed ME, Efferth T and Allgayer H: Prevention of carcinogenesis and metastasis by Artemisinin-type drugs. Cancer Lett 429: 11-18,
- Krusche B, Arend J and Efferth T: Synergistic inhibition of angiogenesis by artesunate and captopril in vitro and in Evid Based Complement Alternat Med 2013: 454783, 2013.
- Efferth T: Cancer combination therapy of the sesquiterpenoid artesunate and the selective EGFR-tyrosine kinase inhibitor Phytomedicine 37: 58-61, 2017.
- Efferth T: Cancer combination therapies with artemisinin-type Biochem Pharmacol 139: 56-70, 2017.
- Hosoya K, Murahari S, Laio A, London CA, Couto CG and Kisseberth WC: Biological activity of dihydroartemisinin in canine osteosarcoma cell lines. Am J Vet Res 69: 519-526,
- Hosoya K, Couto CG, London CA, Kisseberth WC, Phelps MA and Dalton JT: Comparison of high-dose intermittent and low-dose continuous oral artemisinin in dogs with naturally occurring tumors. J Am Anim Hosp Assoc 50: 390-395,
- Rutteman GR, Erich SA, Mol JA, Spee B, Grinwis GC, Fleckenstein L, London CA and Efferth T: Safety and efficacy field study of artesunate for dogswith non‑resectable tumours. Anticancer Res 33: 1819-1827,
- Berger TG, Dieckmann D, Efferth T, Schultz ES, Funk JO, Baur A and Schuler G: Artesunate in the treatment of metastatic uveal melanoma ‑ firstexperiences. Oncol Rep 14: 1599‑1603,
- Michaelsen FW, Saeed ME, Schwarzkopf J and Efferth T: Activity of Artemisia annua and artemisinin derivatives, in prostate carcinoma. Phytomedicine 22: 1223-1231,
- Jansen FH, Adoubi I, JC KC, DE Cnodder T, Jansen N, Tschulakow A and Efferth T: First study of oral Artenimol-R in advanced cervical cancer: Clinical benefit, tolerability and tumor markers. Anticancer Res 31: 4417-4422,
- Krishna S, Ganapathi S, Ster IC, Saeed ME, Cowan M, Finlayson C, Kovacsevics H, Jansen H, Kremsner PG, Efferth T, et al: A randomised, double blind, placebo-controlled pilot study of oral artesunate therapy for colorectal EBioMedicine 2: 82-90, 2014.
- von Hagens C, Walter-Sack I, Goeckenjan M, Osburg J, Storch-Hagenlocher B, Sertel S, Elsässer M, Remppis BA, Edler L, Munzinger J, et al: Prospective open uncontrolled phase I study to define a well‑tolerated dose of oral artesunate as add‑on therapy in patients with metastatic breast cancer(ARTIC M33/2). Breast Cancer Res Treat 164: 359-369,
- Breuer E and Efferth T: Treatment of iron-loaded veterinary sarcoma by Artemisia annua. Nat Prod Bioprospect 4: 113-118,
- Hegazy MF, Abdelfatah S, Hamed AR, Mohamed TA, Elshamy AA, Saleh IA, Reda EH, Abdel-Azim NS, Shams KA, Sakr M, et al: Cytotoxicity of 40Egyptian plant extracts targeting mechanisms of drug-resistant cancer Phytomedicine 59: 152771, 2019.
- Chikazawa S, Hori Y, Kanai K, Ito N, Hoshi F, Orino K, Watanabe K and Higuchi S: Factors influencing measurement of serum iron concentration in dogs: Diurnal variation and hyper- ferritinemia. J Vet Med Sci 75: 1615-1618,
- Carpenter CE and Ward RE: Iron determination by Ferrozine In: Food Analysis Laboratory Manual. Springer, Luxembourg, pp157-159, 2017.
- Stoica G, Lungu G, Martini-Stoica H, Waghela S, Levine J and Smith R III: Identification of cancer stem cells in dog glio- Vet Pathol 46: 391-406, 2009.
- Wellman ML, Krakowka S, Jacobs RM and Kociba GJ: A macrophage-monocyte cell line from a dog with malignant In Vitro Cell Dev Biol 24: 223-229, 1988.
- Alley MC, Scudiero DA, Monks A, Hursey ML, Czerwinski MJ, Fine DL, Abbott BJ, Mayo JG, Shoemaker RH and Boyd MR: Feasibility of drug screening with panels of human tumor cell lines using a microculture tetrazolium Cancer Res 48: 589-601, 1988.
- Rubinstein LV, Shoemaker RH, Paull KD, Simon RM, Tosini S, Skehan P, Scudiero DA, Monks A and Boyd MR: Comparison of in vitro anticancer-drug-screening data generated with a tetra- zolium assay versus a protein assay against a diverse panel of human tumor cell lines. J Natl Cancer Inst 82: 1113-1118,
- Kuete V, Mbaveng AT, Sandjo LP, Zeino Mand EfferthT: Cytotoxicity and mode of action of a naturally occurring naphthoquinone, 2-acetyl-7-methoxynaphtho[2,3-b]furan-4,9-quinone towards multi-factorial drug-resistant cancer Phytomedicine 33: 62-68, 2017.
- O’Brien J, Wilson I, Orton T and Pognan F: Investigation of the Alamar Blue (resazurin) fluorescent dye for the assessment of mammalian cell Eur J Biochem 267: 5421-5426, 2000.
- Saeed ME, Mertens R, Handgretinger R and Efferth T: Identification of fatal outcome in a childhood nasopharyngeal carcinoma patient by protein expressionprofiling. Int J Oncol 53: 1721‑1731, 2018.
- Blaskó G, Cordell GA and Lankin DC: Definitive 1H-and 13C-NMR assignments of artemisinin (Qinghaosu). J Nat Prod 51: 1273-1276,
- Haynes RK, Cheu KW, N’Da D, Coghi P and Monti D: Considerations on the mechanism of action of artemisinin anti- malarials: Part 1 – the ‘carbon radical’ and ‘heme’ hypotheses. Infect Disord Drug Targets 13: 217-277,
- Klonis N, Creek DJ and Tilley L: Iron and heme metabolism in Plasmodium falciparum and the mechanism of action of arte- Curr Opin Microbiol 16: 722-727, 2013.
- Efferth T, Benakis A, Romero MR, Tomicic M, Rauh R, Steinbach D, Häfer R, Stamminger T, Oesch F, Kaina B, et al: Enhancement of cytotoxicity of artemisinins toward cancer cells by ferrous iron. Free Radic Biol Med 37: 998-1009,
- Kelter G, Steinbach D, Konkimalla VB, Tahara T, Taketani S, Fiebig HH and Efferth T: Role of transferrin receptor and the ABC transporters ABCB6 and ABCB7 for resistance and differ- entiation of tumor cells towards artesunate. PLoS One 2: e798,
- Aulbert E, Disselhoff W, Sörje H, Schulz E and Gericke D: Lysosomal accumulation of 67Ga – transferrin in malignant tumors in relation to their growth Eur J Cancer 16: 1217-1232, 1980.
- Sadava D, Phillips T, Lin C and Kane SE: Transferrin overcomes drug resistance to artemisinin in human small-cell lung carcinoma cells. Cancer Lett 179: 151-156,
- Zhao F, Wang H, Kunda P, Chen X, Liu QL and Liu T: Artesunate exerts specific cytotoxicity in retinoblastoma cells via Oncol Rep 30: 1473-1482,2013.
- Wang Q, Wu S, Zhao X, Zhao C, Zhao H and Huo L: Mechanisms of dihydroartemisinin and dihydroartemisinin/holotransferrin cytotoxicity in t-cell lymphoma cells. PLoS One 10: e0137331, 2015.
- Judd W, Poodry CA and Strominger JL: Novel surface antigen expressed on dividing cells but absent from nondividing cells. J Exp Med 152: 1430-1435,
- Sutherland R, Delia D, Schneider C, Newman R, Kemshead J and Greaves M: Ubiquitous cell-surface glycoprotein on tumor cells is proliferation-associated receptor for Proc Natl Acad Sci USA 78: 4515-4519, 1981.
- Trowbridge IS and Omary MB: Human cell surface glycoprotein related to cell proliferation is the receptor for Proc Natl Acad Sci USA 78: 3039-3043, 1981.
- Gatter KC, Brown G, Trowbridge IS, Woolston RE and Mason DY: Transferrin receptors in human tissues: Their distri- bution and possible clinical relevance. J Clin Pathol 36: 539-545,
- Tortorella S and Karagiannis TC: Transferrin receptor-mediated endocytosis: A useful target for cancer J Membr Biol 247: 291-307, 2014.
- Luria-Pérez R, Helguera G and Rodríguez JA: Antibody-mediated targeting of the transferrin receptor in cancer Bol Méd Hosp Infant México 73: 372-379, 2016.
- Akbari B, Farajnia S, Ahdi Khosroshahi S, Safari F, Yousefi M, Dariushnejad H and Rahbarnia L: Immunotoxins in cancer therapy: Review and update. Int Rev Immunol 36: 207-219,
- Lai H, Sasaki T, Singh NP and Messay A: Effects of arte- misinin-tagged holotransferrin on cancer Life Sci 76: 1267-1279, 2005.
- Nakase I, Gallis B, Takatani-Nakase T, Oh S, Lacoste E, Singh NP, Goodlett DR, Tanaka S, Futaki S, Lai H, et al: Transferrin receptor-dependent cytotoxicity of artemisinin-transferrin conjugates on prostate cancer cells and induction of apoptosis. Cancer Lett 274: 290-298,
- Gong Y, Gallis BM, Goodlett DR, Yang Y, Lu H, Lacoste E, Lai H and Sasaki T: Effects of transferrin conjugates of artemisinin and artemisinin dimer on breast cancer cell lines. Anticancer Res 33: 123-132,
- Zhong YR: Chemical constituents of volatile oils of Artemisia annua. Zhong Yao Tong Bao 8: 31-32, 1983 (In Chinese).
- Liao HW, Wang DY and Li XM: Studies on the chemical constituents of essential oil of Hunan Artemisia annua. Zhong Yao Cai 29: 562-564, 2006 (InChinese).
- Efferth T, Herrmann F, Tahrani A and Wink M: Cytotoxic activity of secondary metabolites derived from Artemisia annua towards cancer cells in comparison to its designated active constituent artemisinin. Phytomedicine 18: 959-969, 2011.
- Zhang X, Zhao Y, Guo L, Qiu Z, Huang L and Qu X: Differences in chemical constituents of Artemisia annua from different geographical regions in China. PLoS One 12: e0183047, 2017.
- Efferth T, Konkimalla VB, Wang YF, Sauerbrey A, Meinhardt S, Zintl F, Mattern J and Volm M: Prediction of broad spectrum resistance of tumors towards anticancer drugs. Clin Cancer Res 14: 2405-2412,
- Volm M and Efferth T: Prediction of cancer drug resistance and implications for personalized Front Oncol 5: 282, 2015.
- Duffy MJ, Harbeck N, Nap M, Molina R, Nicolini A, Senkus E and Cardoso F: Clinical use of biomarkers in breast cancer: Updated guidelines from the European Group on Tumor Markers (EGTM). Eur J Cancer 75: 284-298,
- Sun X and Kaufman PD: Ki-67: More than a proliferation Chromosoma 127: 175-186, 2018.
- Scott CS, Ramsden W, Limbert HJ, Master PS and Roberts BE: Membrane transferrin receptor (Tf R) and nuclear prolif- eration-associated Ki-67expression in hemopoietic Leukemia 2: 438-442, 1988.
- Soyer HP, Smolle J, Smolle-Juettner FM and Kerl H: Proliferation antigens in cutaneous melanocytic tumors – an immunohisto- chemical study comparing the transferrin receptor and the Ki-67 antigen. Dermatologica 179: 3-9,
- Wrba F, Chott A, Reiner A, Reiner G, Markis-Ritzinger E and Holzner JH: Ki-67 immunoreactivity in breast carcinomas in relation to transferrin receptor expression, estrogen receptor status and morphological An immunohistochemical study. Oncology 46: 255-259, 1989.
- Prior R, Reifenberger G and Wechsler W: Transferrin receptor expression in tumours of the human nervous system: Relation to tumour type, grading and tumour growth fraction. Virchows Arch A Pathol Anat Histopathol 416: 491-496,
- Kearsley JH, Furlong KL, Cooke RA and Waters MJ: An immuno- histochemical assessment of cellular proliferation markers in head and neck squamous cell Br J Cancer 61: 821-827, 1990.
- Chan KT, Choi MY, Lai KK, Tan W, Tung LN, Lam HY, Tong DK, Lee NP and Law S: Overexpression of transferrin receptor CD71 and its tumorigenic properties in esophageal squamous cell carcinoma. Oncol Rep 31: 1296-1304,
- Motamedi M, Xu L and Elahi S: Correlation of transferrin receptor (CD71) with Ki67 expression on stimulated human and mouse T cells: The kinetics of expression of T cell activation J Immunol Methods 437: 43-52, 2016.
- Darb-Esfahani S, Kolaschinski I, Trillsch F, Mahner S, Concin N, Vergote I, Van Nieuwenhuysen E, Achimas-Cadariu P, Glajzer J, Woopen H, et al:Morphology and tumour‑infiltrating lymphocytes in high-stage, high-grade serous ovarian carcinoma correlated with long-term survival. Histopathology 73: 1002-1012,
- Lee JS, Won HS, Sun S, Hong JH and Ko YH: Prognostic role of tumor‑infiltrating lymphocytes in gastric cancer: A systematic review and meta-analysis.Medicine (Baltimore) 97: e11769,
- Shen M, Wang J and Ren X: New insights into tumor‑infiltrating B lymphocytes in breast cancer: Clinical impacts and regulatory mechanisms. Front Immunol 9: 470,
- Uhl M, Schwab S and Efferth T: Fatal liver and bone marrow toxicity by combination treatment of dichloroacetate and arte- sunate in a glioblastoma multiforme patient: Case report and review of the literature. Front Oncol 6: 204,
- Efferth T, Schöttler U, Krishna S, Schmiedek P, Wenz F and Giordano FA: Answer to the comment of Hai Lu et al. regarding ‘Hepatotoxicity by combination treatment of temozolomide, artesunate and Chinese herbs in a glioblastoma multiforme patient: Case report and review of the literature. Arch Toxicol (2016)’. Arch Toxicol 91: 2491-2492,
- Eigbibhalu UG, Albert Taiwo EO, Douglass IA and Abimbola EA: Effect of selected anti-malarial drugs on the blood chemistry and brain serotonin levels in male rabbits. Pak J Pharm Sci 26: 125-129,
- Zhu CY, Xu QH, Mao ZY and Lin N: Application of three arte- misinin derivatives in neuropathic pain: Evaluating co-curation of nociceptive and emotionalsyndromes in spinal cord ligation Zhongguo Zhong Yao Za Zhi 43: 3058-3063, 2018 (In Chinese).
- Amos S, Chindo BA, Abbah J, Vongtau HO, Edmond I, Binda L, Akah PA, Wambebe C and Gamaniel KS: Postsynaptic dopamine (D(2))-mediated behavioural effects of high acute doses of arte- misinin in rodents. Brain Res Bull 62: 255-260, Bu çalışma Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0) Lisansı ile lisanslanmıştır.