OPEN ACCESS
Bu makaleye atıfta bulunmak için: Machado MC, da Costa-Neto JM, Portela RD, D’Assis MJMH, Martins-Filho OA, Barrouin- Melo SM, et al. (2018) The effect ofnaltrexone as a carboplatin chemotherapy-associated drug on the immune response, quality of life and survival of dogs with mammary carcinoma. PLoS ONE 13 (10): e0204830. https://doi.org/10.1371/journal. pone.0204830
Editör: Douglas H. Thamm, Colorado Eyalet Üniversitesi, ABD
Sunum Tarihi: 9 Mayıs 2018
Kabul Tarihi: 14 Eylül 2018
Yayın Tarihi: 4 Ekim 2018
Telif hakkı: © 2018 Machado et al. Bu makale, orijinal yazar ve kaynağa atıfta bulunulması koşuluyla, herhangi bir ortamda kısıtlama olmaksızın kullanım, dağıtım ve çoğaltmaya izin veren Creative Commons Attribution License koşulları altında dağıtılan açık erişimli bir makaledir.
Veri Erişim Beyanı: İlgili tüm veriler makalede ve Ek Bilgi dosyalarında yer almaktadır.
Finansman:
|
Mar´ılia Carneiro Machado, Yükseköğretim Personel Teşvik Koordinasyonu’nun (CAPES) yüksek lisans bursiyeridir. Alessandra Estrela-Lima ve Olindo Assis Martins-Filho, Ulusal Bilimsel ve Teknolojik Gelişim Konseyi’nden (CNPq) araştırma bursiyerleridir. Fon sağlayıcıların çalışma tasarımı, veri toplama ve analizi, yayınlama kararı veya makalenin hazırlanmasında hiçbir rolü olmamıştır.
Özet
Bu çalışmanın amacı, mastektomi sonrası benign mikst tümörlü meme karsinomlu (MC-BMT) dişi köpeklerde karboplatin kemoterapisi ile ilişkili ilaç olarak düşük doz naltreksonun (LDN) etkisini değerlendirmek ve yaşam kalitesi ve sağkalım oranları ile bağlantısını incelemektir. Bu çalışmaya histopatolojik olarak MC-BMT tanısı konulan 60 dişi köpek dahil edilmiş ve üç gruba ayrılmıştır: Bunlar; bölgesel metastaz olsun ya da olmasın sadece mastektomi uygulanan hayvanlardan oluşan G1 (kontrol), metastaz görülmeyen tedavi edilmiş hayvanlardan oluşan G2 ve metastaz görülen tedavi edilmiş köpeklerden oluşan G3’tür. G2 ve G3 ayrıca uygulanan tedaviye göre alt gruplara ayrılmıştır: tek başına kemoterapi (MC-BMT(-) C/MC-BMT(+) C) veya LDN ve kemoterapi (MC-BMT(-) C+LDN/MC-BMT(+) C+LDN). Tüm hayvanlar klinik değerlendirme, mastektomi, periferik kan lenfosit immünofenotipleme, beta-endorfin ve metenkefalin ölçümü ve sağkalım oranları ile yaşam kalitesi skorlarının değerlendirilmesine tabi tutulmuştur. Elde edilen sonuçlara göre, LDN ile tedavi edilen gruplarda, LDN ile tedavi edilmeyen gruplara kıyasla daha yüksek serum beta-endorfin ve met-enkefalin konsantrasyonları, kemoterapiye bağlı daha az yan etki ve daha iyi yaşam kalitesi ve sağkalım oranları görülmüştür (P < 0.05). Klinik ve patolojik parametrelerin değerlendirilmesiyle LDN kullanımı ile hem sağkalım süresinin uzaması hem de yaşam kalitesinin artması arasında istatistiksel olarak anlamlı bir bağlantı tespit edilmiştir. Bu sonuçlar, LDN’nin MC-BMT’li dişi köpeklerde kemoterapi ile birlikte uygulanabilir bir tedavi olduğunu, yaşam kalitesini koruduğunu ve sağkalım oranını uzattığını göstermektedir.
Giriş
Köpek meme tümörleri küçük hayvan kliniklerinde sıklıkla rastlanan bir vakadır, ancak birçok vaka veteriner değerlendirmesi için getirilmediğinden malign neoplazilerin kesin insidansını belirlemek zordur [1]. Bununla birlikte, Meksika’da 1.917 meme biyopsisi ile yapılan bir çalışmada, vakaların %47,5’inin malign tümör olduğu doğrulanmıştır [2]. Bu yüksek insidans ve dişi köpekler ile kadınlar arasındaki klinik özelliklerin benzerliği nedeniyle, iki tür arasında karşılaştırmalı çalışma yapılması büyük ilgi görmektedir.
Dişi köpeklerdeki malign meme tümörleri arasında, bu türde teşhis edilen 51 meme karsinomu arasında MC-BMT’nin %60 oranında bulunduğu bir çalışmada [4] görüldüğü gibi, benign mikst tümörde meme karsinomu (MC-BMT) en yaygın olanıdır [3]. Bu tümör epitelyal bileşenin malign transformasyonundan meydana gelir, miyoepitelyal ve bazal tabaka devamlılığının kaybı ile görüldüğü gibi in situ büyüme veya infiltratif özelliklerle de karşımıza çıkabilir ve kanser hücreleri tarafından stromanın invazyonu veya önceden var olan benign lezyonun tamamen yer değiştirmesi ile ilişkilendirilir [5, 6].
Bu kanserin yüksek insidansı, yüksek derecede potansiyel malignite ve literatürdeki spesifik veri eksikliği nedeniyle, çalışmalar yeni adjuvan tedavilerin araştırılmasına yoğunlaşmıştır. Öncelikle veteriner klinisyenler, hastaları için daha yüksek iyileşme oranları, uzun ömür ve daha iyi yaşam kalitesi sağlayabilecek yeni tedavi protokolleri aramaktadır.
Naltrekson, mu, kappa ve delta opioid reseptörlerine bağlanarak endojen opioidlerin etkilerini bloke eden ve opioid antagonisti olarak kullanılan sentetik bir oksimorfin analoğudur. Saf bir antagonisttir, yani agonist etkisi yoktur [7]. İnsan tıbbında, kemoterapi adjuvanı olarak düşük doz naltrekson (LDN) kullanımı, meme karsinomu da dahil olmak üzere bazı kanser türlerini [8] tedavi etmek için kullanıldığında sağkalımı artırmaktadır. LDN, kemoterapinin yan etkilerini azaltma ve bağışıklık sistemini uyarma kapasitesine sahiptir ve cerrahi ve kemoterapi ile tek veya kombine tedavi şeklinde kullanılabilir [9].
Kadınlarda ve dişi köpeklerde meme tümörü özellikleri arasındaki benzerlikler ve ikinci türde MC-BMT’nin önemi göz önüne alındığında, bu kanser türü için yeni kombine tedaviler önermek ve test etmek son derece önemlidir. Bu bağlamda, bu çalışmanın amacı LDN’nin adjuvan tedavi olarak kullanımını ve MC-BMT’li köpeklerin sağkalım ve yaşam kalitesi üzerindeki etkilerini değerlendirmektir.
Materyal ve metot
Araştırma protokolleri, Bahia Federal Üniversitesi Veterinerlik Fakültesi Etik Kurulu tarafından onaylanmıştır (protokol n˚ 10/ 2013). Bu çalışmada listelenen tüm prosedürler Brezilya Deney Hayvanları Etik Kurulu (COBEA) tarafından belirlenen kurallara göre yürütülmüştür. Tüm hayvan sahipleri bilgilendirilmiş onam vermiş ve çalışmanın amacı hakkında bilgi almıştır.
Klinik değerlendirme ve mastektomi
Bu çalışmaya katılan hayvanlar, Bahia Federal Üniversitesi (UFBA) Veteriner Hastanesini ziyaret eden köpekler arasından seçilmiştir. Dahil edilme kriterleri arasında histopatolojik MC-BMT tanısı, üç santimetreden büyük bir tümörün varlığı ve değerlendirme sırasında eşlik eden başka bir hastalığın olmaması bulunmaktaydı. Meme neoplazisi olan 150 hayvandan, yaşları beş ila 18 arasında değişen farklı ırklardan 60 dişi köpek bu çalışmaya dahil edilmiştir. MC-BMT’li dişi köpekler prospektif bir şekilde değerlendirildi ve rastgele üç gruba ayrıldı: Sadece mastektomi uygulanan hayvanlardan oluşan G1: (kontrol), metastaz olmaması (MC-BMT(-)) ve bölgesel metastaz olması (MC-BMT(+)) temelinde prospektif olarak sınıflandırılmıştır; metastaz olmayan tedavi edilmiş hayvanlar G2; ve bölgesel
metastaz olan tedavi edilmiş hayvanlar G3. G2 ve G3 uygulanan tedaviye göre alt gruplara ayrılmıştır: sadece karboplatin kemoterapisi (MC-BMT(-) C/MC-BMT(+) C) veya hem karboplatin kemoterapisi hem de LDN (MC-BMT(-) C + LDN/MC-BMT(+) C + LDN). Hayvan sahipleri ve hayvanları değerlendiren veteriner hekimler hangi hayvanların LDN ile tedavi edildiğinin farkında değildi.
Meme neoplazisi olan tüm dişi köpekler tam kapsamlı klinik muayeneye tabi tutulmuş ve klinik veriler Ferreira ve arkadaşları [10] tarafından önerilen protokole göre spesifik bir kanser anketi şeklinde düzenlenmiştir. Preoperatif klinik değerlendirme, hemogram ve serum biyokimyasal profil analizi için periferik kan örneklemesini, torasik radyolojik incelemeyi (sağ laterolateral (LLD), sol laterolateral (LLE) ve ventral-dorsal (VD)) ve metastazı değerlendirmek için tam batın ultrason muayenesini kapsıyordu. Klinik evre sınıflandırması TNM sistemine göre tümör boyutu (T), bölgesel lenf nodlarının tutulumu (N) ve uzak metastazların varlığı veya yokluğuna (M) göre yapılmıştır [11]. Tüm hayvanlara inguinal lenf nodlarının çıkarılmasıyla birlikte tek taraflı total mastektomi uygulanmış ve tümör örnekleri histopatolojik tanıya göre Cassali ve arkadaşları tarafından önerilen kriterlerle birlikte Dünya Sağlık Örgütü (DSÖ) kriterlerine göre sınıflandırılmıştır [6]. Metastazı olmayan MC-BMT Grade I tümörler hariç tutulmuştur. Ameliyattan yirmi gün sonra G2 ve G3 hastaları kemoterapiye başlamıştır. Bu çalışmada kullanılan değerlendirme süresi iki yıl olmuştur.
Naltrekson tedavisi ve kemoterapi
Ameliyattan yirmi gün sonra, naltrekson (LDN) tedavisine 24 hafta boyunca 24 saatte bir oral 0,1 mg/kg dozunda başlanmıştır. Hayvanların sahipleri bu ilacın amacı konusunda bilgilendirilmedi. Her yedi günde bir, dişi köpekler uyuşukluk ve gastrointestinal bozukluklar (kusma ve ishal) gibi ilacın potansiyel yan etkilerini değerlendirmek için klinik olarak değerlendirilmiştir [12]. Yan etkiler, Veteriner Onkoloji Grubu’nun yan etkiler için ortak terminoloji kriterleri (VCOG-CTCAE) ile daha önce tanımlandığı gibi Grade 1 ila 5 olarak sınıflandırılmıştır [13]. Bu çalışmada kullanılan tedavi protokolü, aynı günlük sıklık, doz ve kemoterapi uygulama süresi ile daha önce fareler için uygulanan deneysel protokole dayanmaktadır [9].
Aynı zaman diliminde, kemoterapi seansları intravenöz karboplatinin (300 mg/m2) beş dakikalık infüzyon süresiyle 21 günlük aralıklarla altı seans boyunca uygulanmasıyla başlamıştır. Her kemoterapi seansından yaklaşık 24 saat önce hemogram ve serum biyokimya analizleri yapılmıştır. Metoklopramid (0.5 mg/kg), ranitidin (2 mg/kg) ve prometazin (0.1 mg/kg) subkutan olarak verildi. Ranitidin (her 12 saatte bir 2 mg/kg) ve metoklopramid (her sekiz saatte bir 0,5 mg/kg) kemoterapiden sonraki üç gün boyunca ağızdan uygulandı. Naltrekson dışında uygulanan tüm tedavi prosedürleri Brezilya Hayvan Deneyleri Kurulu (COBEA) tarafından açıklanan yönergelere uygun olarak gerçekleştirilmiştir.
Periferik kan lökositlerinin immünofenotiplendirilmesi
Çalışmaya katılan hayvanlarda hücresel immün yanıtı değerlendirmek için mastektomiden elli dakika önce ve kemoterapi tedavisinin bitiminden sonra (ameliyattan altı ay sonra) 4 mL kan alınmıştır. Kan, juguler ven ponksiyonu yoluyla 5 mL’lik steril tek kullanımlık şırıngalara alınmış ve ardından EDTA içeren steril tüplere aktarılmıştır. Hematolojik parametreler otomatik kan hücresi analizörü (ADVIA 60, Bayer HealthCare, Tarrytown, NY, ABD) kullanılarak elde edilmiştir.
Köpek periferik kanının immünofenotipleme analizleri, önerilen tedavilerden önce ve sonra çalışmaya katılan hayvanların periferik kanındaki CD3+, CD4+ ve CD8+ T-hücresi
sayılarını analiz etmek için Araujo ve arkadaşları [14] ve Estrela-Lima ve arkadaşları [15] tarafından tarif edildiği gibi akış sitometrisi ile gerçekleştirilmiştir. Akış sitometrisi ölçümleri FACSCalibur cihazı (Becton Dickinson, San Jose, CA, ABD) ile yapılmıştır. Hem veri toplama hem de analiz için Cell-Quest yazılım paketi kullanılmıştır. Her analiz iki kopya şeklinde gerçekleştirilmiştir..
Serum beta-endorfin ve met-enkefalin miktarının belirlenmesi
Serum örnekleri mastektomiden 50 dakika önce ve altı ay sonra alınan kandan elde edilmiş ve köpeklere özgü tıbbi ELISA kitleri (MyBioSource, San Diego, CA, ABD) kullanılarak beta-endorfin ve met-enkefalin ölçümü için kullanılmıştır. Tüm prosedürler üreticinin talimatları doğrultusunda gerçekleştirilmiştir.
Yaşam kalitesinin değerlendirilmesi ve sağkalım takibi
Kemoterapi tedavisi ve takip muayeneleri sırasında tüm dişi köpeklerde yaşam kalitesi ölçümü yapılmıştır. Hasta sahipleri kemoterapi tedavisi ve takip süresi boyunca her 15 günde bir anket doldurmuştur. Anket Yazbek ve Fantoni [16] tarafından önerildiği şekilde geliştirilmiş olup, her bir sorunun sıfır ile üç puan arasında değiştiği ve toplam 36 puana ulaşan dört olası yanıt seçeneği bulunan 12 sorudan oluşmuştur. Sıfır puan en kötü, 36 puan ise en iyi yaşam kalitesi olarak kabul edilmiştir. Sorular davranışsal bilgilere, sahibiyle etkileşime ve ağrı, iştah, uyku bozukluklarının yanı sıra kusma, ishal, idrar inkontinansı veya tokluk durumunun değerlendirilmesine odaklanmıştır..
Bu çalışmaya dahil edilen tüm hayvanlar, klinik ve laboratuvar testleri ve torasik radyolojik muayeneler yapıldığında onkoloji konusunda deneyimli bir veteriner hekim ekibi tarafından aylık olarak kontrol edilmiştir. Hayvan sahiplerine, hayvanlarda herhangi bir yan etki görülmesi halinde projeden sorumlu veteriner hekimle irtibata geçmeleri talimatı verilmiştir. Veteriner hekimler, herhangi bir ağrı, acı veya şiddetli semptom durumunda bu hayvanların hızlı bir şekilde değerlendirilmesi ve tedavisini gerçekleştirmeye ve hatta hayvanın daha spesifik bir tedaviye tabi tutulup tutulmayacağını veya ötenazi yapılıp yapılmayacağını (sahibinin rızasıyla) değerlendirmeye hazırdı; bu noktada hayvanlar çalışmadan çıkarılmıştır.
Genel sağkalım süresi, her bir hayvan için primer tümörün cerrahi eksizyonu ile ölüm tarihi arasında geçen süre olarak tanımlanmıştır. Takip süresi içinde ölen hastaların ölüm nedenini belirlemek ve olası metastazı değerlendirmek için Veteriner Patoloji Laboratuvarında nekropsileri yapılmıştır.
İstatistiksel analiz
Veriler aşağıdaki şekilde sınıflandırılmıştır: tümör boyutu (3,1-5 cm veya > 5 cm), lenf düğümlerinde metastaz (var veya yok), klinik evre (II, III, IV veya V), histolojik grade (II veya III), karboplatin ile kemoterapi kullanımı (var veya yok), vücut kondisyon skoru (obez, normal, zayıf), LDN ile adjuvan tedavi (evet veya hayır), CD4+ ve CD8+ lenfosit yüzdesi (düşük veya yüksek), CD4+/CD8+ oranı (düşük veya yüksek) [15] ve yaşam kalitesi skoru (düşük veya yüksek) [16].
Veri dağılımının normalliğini değerlendirmek için sonuçlar öncelikle Kolmogorov-Smirnov testine tabi tutulmuştur. Parametrik ve parametrik olmayan veriler için sırasıyla Student’in t testi/Mann-Whitney U testi ve tek yönlü varyans analizi (ANOVA)/Kruskal-Wallis kullanılmıştır. Benzer şekilde, korelasyonlar Spearman testleri ile incelenmiştir. Sağkalım eğrileri Kaplan-Meier yöntemi ve log-rank testi (Mantel-Cox) kullanılarak hesaplanmış ve karşılaştırılmıştır.
Tüm prognostik faktörler hiyerarşik küme analizi, hiyerarşik olmayan küme analizi ve temel bileşen analizi yoluyla çok değişkenli testlerle analiz edilmiştir. Tüm durumlarda, istatistiksel karşılaştırmalar ve testler p < 0.05 olduğunda anlamlı kabul edilmiştir.
Analizler Prism 5.0 yazılımı (GraphPad, San Diego, CA, ABD) veya SPSS 17 yazılımı (SPSS Inc., Chicago, IL, ABD) kullanılarak gerçekleştirilmiştir.
Sonuçlar
Klinik ve patolojik özellikler
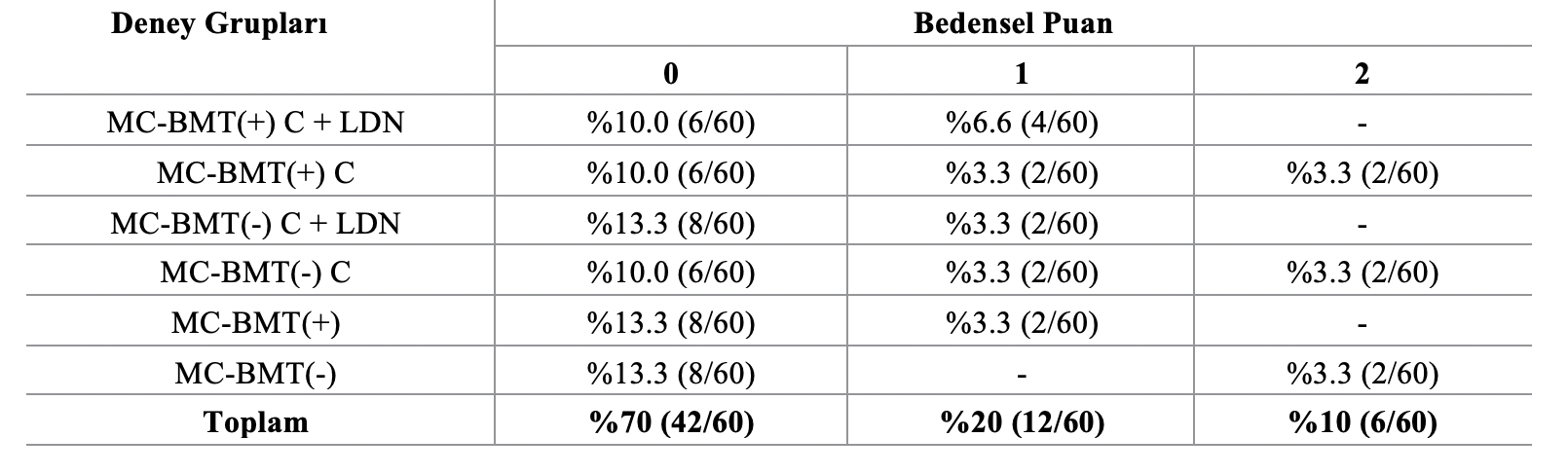
Çalışmaya katılan dişi köpeklerin yaşları beş ila 18 arasında değişmekte olup (ortalama = 11, medyan = 11,5), 10 ila 14 yaş arasındaki hayvanların oranı daha yüksekti (%60). En çok etkilenen ırk kaniş (%50, 15/30) olup, bunu melez ırk köpekler (%20, 12/60) izlemiştir. Farklı gruplardaki hayvanların bedensel skorlarına göre dağılımı Tablo 1’de gösterilmiştir. Köpeklerin sadece %10’u (6/60) yaş ve ırklarına göre olması gerekenden daha düşük vücut ağırlığına sahipken, %70’i (42/60) normal ağırlık parametreleri göstermiş ve %20’si (12/60) obez olarak değerlendirilmiştir.
Çalışmaya katılan hayvanların üreme geçmişine göre, bu çalışmanın başlangıcından önce hayvanların %20’sinde (12/60) en sık görülen anormallik yalancı gebelikti. Dişi köpeklerin %30’u (18/60) tümör tanısından önce östrusu baskılamak için progestin ile tedavi edilmişti. Ameliyat sonrası biyopsilerin grade, boyut, etkilenen lenf düğümleri ve evre ile ilgili analizi Tablo 2’de sunulmuştur.
Kemoterapi bakımından, dişi köpeklerin %90’ı (36/40) planlanan döngüyü tamamlayarak altı kemoterapi seansı almıştır. Hayvanların %10’u (4/40) dördüncü kemoterapi seansından sonra ölmüştür ve tüm bu dişi köpeklerde kemoterapi tedavisinin muhtemel sonuçlarından biri olan belirgin miyelosupresyon görülmüştür. Kemoterapinin olası yan etkileri arasında, dişi köpeklerin %10’unda (4/40) her kemoterapi seansından sonra kusma görülmüş ve %5’inde (2/40) ishal gelişmiştir. LDN tedavisi almayan hayvanlar arasında, yan etkiler için VCOG-CTCAE derecelerinin dağılımı aşağıdaki gibiydi: %80, Grade 1, %15 Grade 2 ve %5 Grade 3. Yan etki görülen hayvanların hiçbirine LDN adjuvan tedavisi uygulanmamıştır.
Hematolojik parametrelere göre, anemi ve lökopeni hem kontrol grubunda hem de LDN uygulanmayan kemoterapi grubunda gözlenen en yaygın bulgular olmuştur (S1 Tablosu). Buna karşılık, LDN ile tedavi edilen iki alt grupta, hayvanların kırmızı ve beyaz kan hücresi ve trombosit sayıları kendi türleri için tanımlanan normal aralıklarda kalmıştır [17]. Hastaların biyokimyasal profilleri kontrol grubunda daha yüksek kreatinin değerleri ortaya koymuştur (S2 Tablosu).
Çalışmadaki 60 dişi köpek arasında, kontrol (12/20), MC-BMT(+) C (8/10) ve MC-BMT(-) C (4/10) gruplarında, öncelikle neoplastik sürecin evrimi (metastazlar ve paraneoplastik
Tablo 1. Sıklığın bedensel puana göre gruplara dağılımı.
“0” puanı normal kilolu hayvanlara, “1” puanı aşırı kilolu hayvanlara, “2” puanı ise yaşına ve ırkına göre normal kilonun altında olan hayvanlara karşılık gelmektedir.
https://doi.org/10.1371/journal.pone.0204830.t001
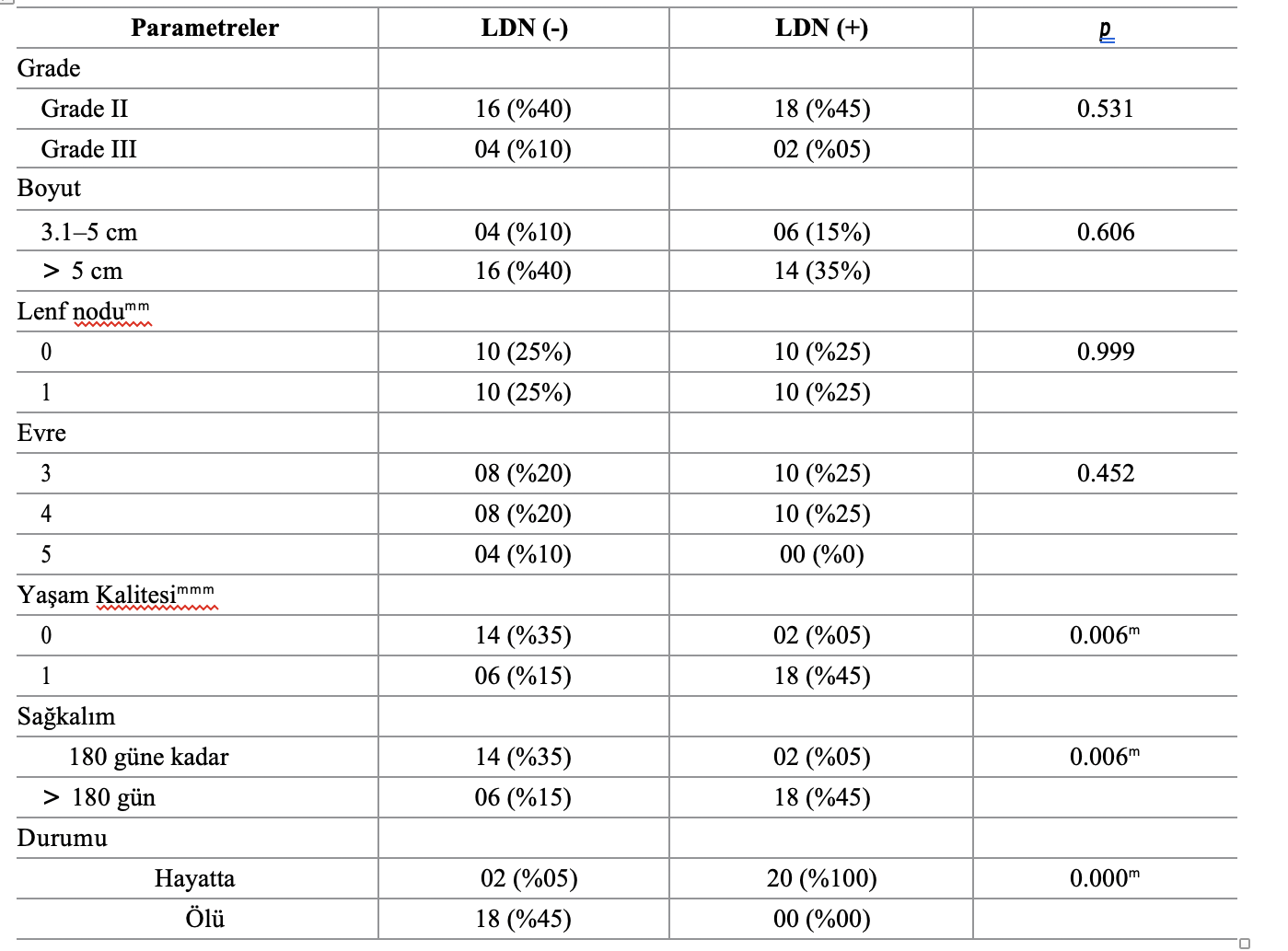
Tablo 2. MC-BMT uygulanan dişi köpeklerin klinik ve patolojik parametreleri ve LDN tedavisinin varlığı (+) veya yokluğu (-) ile korelasyonu.
m Spearman istatistiksel testi kullanılarak p < 0.05 düzeyinde anlamlı farklılıklar
mm0 –metastaz yok; 1- metastaz var
mmm0–0 ila 20 puan [16] tarafından önerilen ölçekte; 1-21 ila 36 puan aynı ölçekte.
https://doi.org/10.1371/journal.pone.0204830.t002
sendromlar) (18/24) ve hipovolemik şok (6/24) nedeniyle ölüm görülmüştür. Tıbbi ekibin endikasyonuna rağmen, hayvan sahipleri bu prosedürü uygulamayı tercih etmediği için hayvanlara ötanazi uygulanmamıştır. Hayvanlar ağrı tedavisi altında ve ölüm anına kadar sağlık ekibinin sürekli gözetiminde tutulmuştur. LDN ile tedavi edilen alt gruplarda ölüm olmamıştır.
Ölen 24 dişi köpeğin nekropsisinde metastaz belirtisi olan lezyonlar tespit edilmiş ve daha sonra bu metastazların mikroskobik analizle primer tümörle örtüştüğü doğrulanmıştır. Bazı hayvanlarda birden fazla metastatik bölge görülmüştür. İkincil bölgeler arasında akciğer (18/24), deri (10/24), karaciğer (6/24) ve böbrek (4/24) yer almıştır. Bu çalışmada, MC-BMT(-) grubunda 16 Grade II ve 4 Grade III tümör, MC-BMT(+) grubunda ise 18 Grade II ve 2 Grade III tümör tespit edilmiştir.
LDN ile tedavi edilen ve edilmeyen dişi köpeklerde klinik ve patolojik bulguların, yaşam kalitesinin ve sağkalımın karşılaştırmalı analizi Tablo 2’de sunulmuştur. Bu veriler, LDN ile adjuvan tedavinin istatistiksel olarak sağkalımda artış ve yaşam kalitesinde iyileşme sağladığını göstermektedir.
Periferik kan lenfositlerinin immünofenotiplendirilmesi
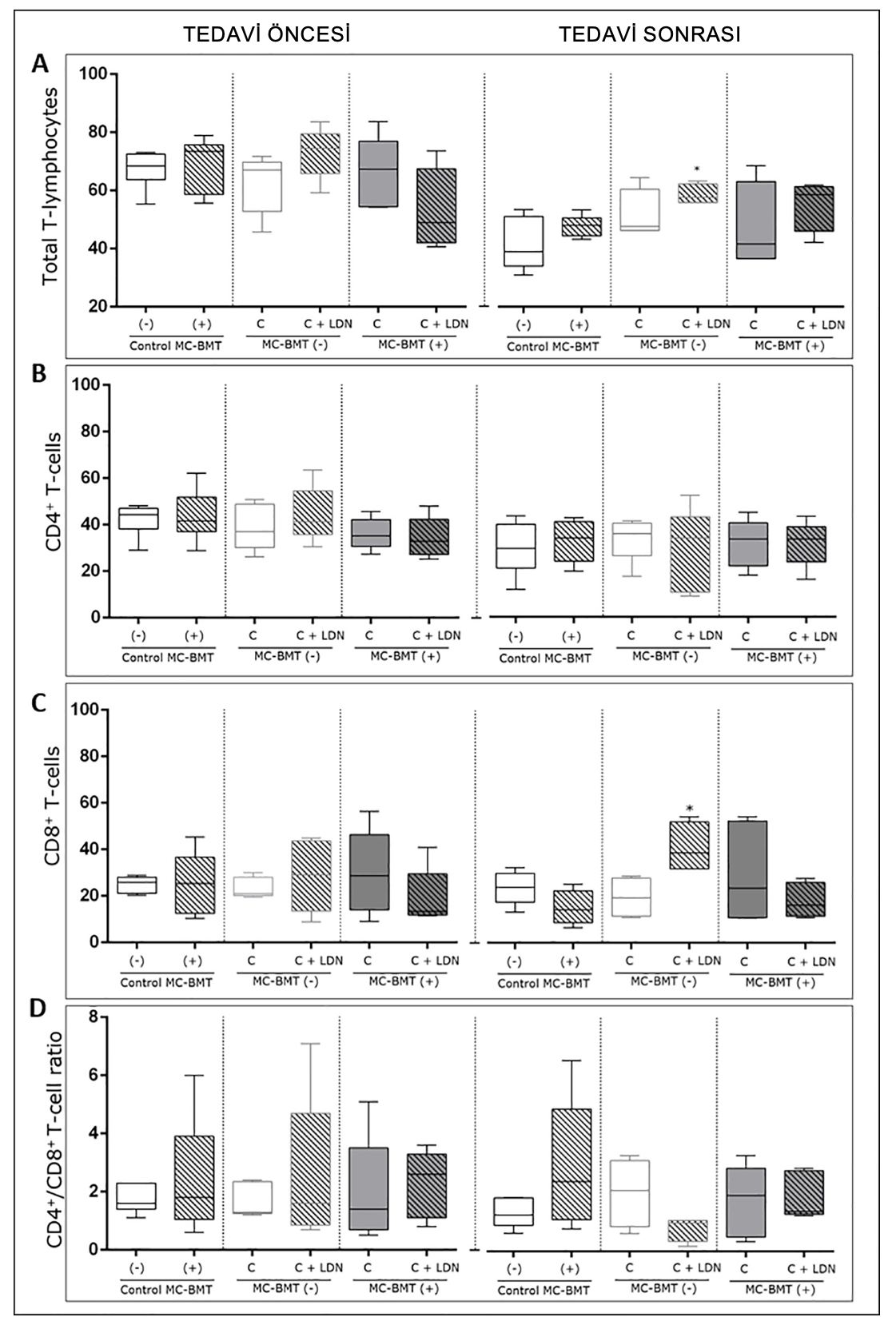
Tedavi sonrası yapılan analize göre, LDN ile tedavi edilen gruptaki toplam T-hücrelerinin yüzdesinde, sadece kemoterapi ve MC-BMT kontrolleriyle tedavi edilen gruplara kıyasla belirgin bir artış görülmüştür (Şekil 1A). Sonuçlara göre MC-BMT(+) C+ LDN grubunda lenfosit sayısı da daha yüksek bulunmuştur (p = 0,0994). Veri analizi, tedavi öncesinde veya sonrasında gruplar arasında CD4+ T-hücrelerinin yüzdesinde önemli bir fark olmadığını göstermiştir (Şekil 1B).
Tedavi öncesi başlangıç döneminde gruplar arasında CD8+ T-hücrelerinin yüzdesi açısından anlamlı bir fark bulunmamıştır. Ancak, CD4+ T-hücreleri için gözlenen sonuçların aksine, deneysel değerlendirme sonrasında, CD8+ T-hücrelerinin yüzdesi MC-BMT(-) C + LDN grubunda (p < 0,05) yalnızca kemoterapi ile tedavi edilen gruba (MC-BMT(-) C) kıyasla belirgin şekilde daha yüksekti (Şekil 1C). CD4+/CD8+ T-hücresi oranı MC-BMT(-) C + LDN grubunda sayısal olarak daha düşük olsa da istatistiksel açıdan anlam kazanamamıştır (Şekil 1D).
Endojen opioid peptid ölçümü
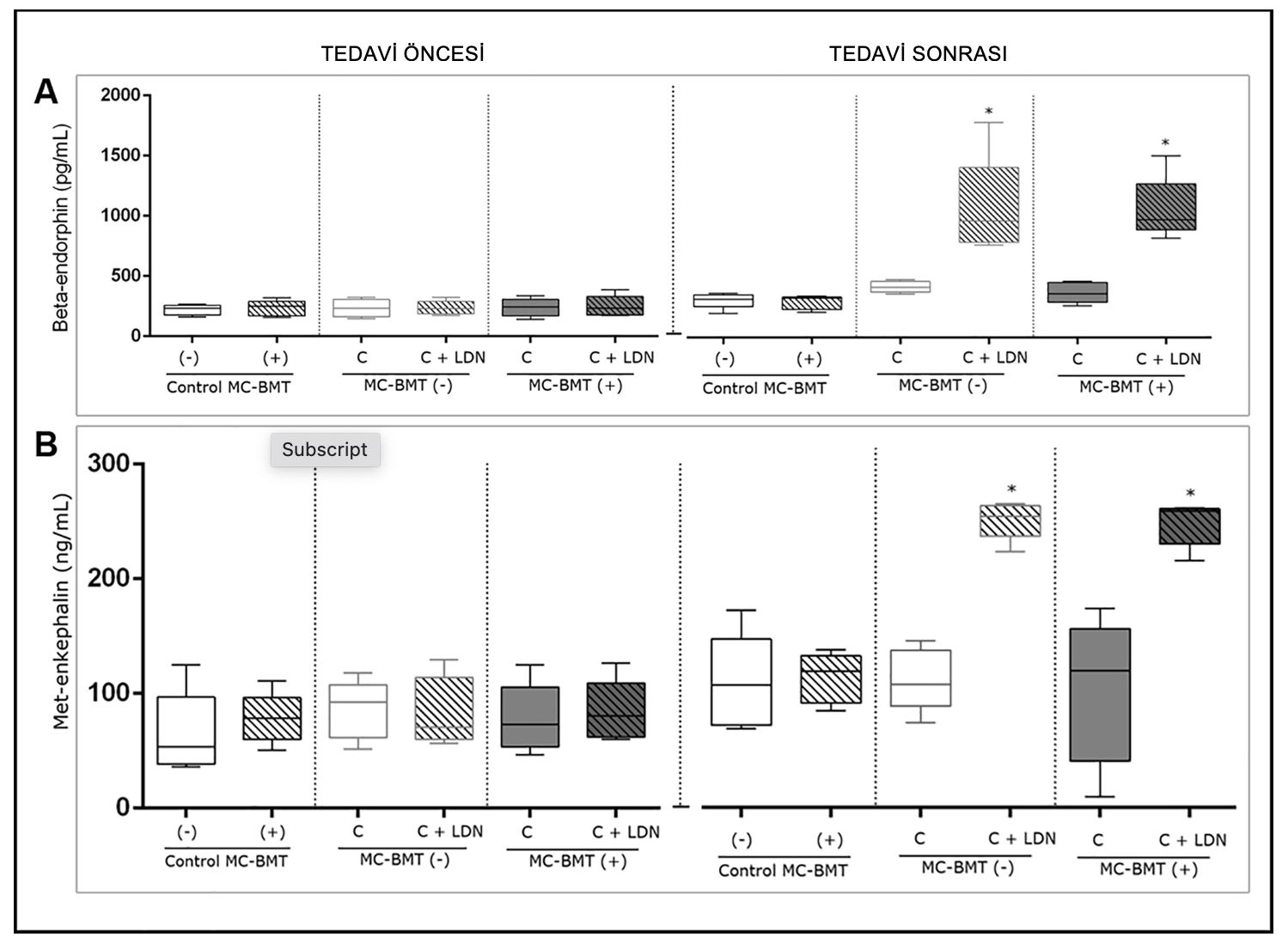
Tüm beta-endorfin serum konsantrasyonları başlangıç döneminde deney grupları arasında istatistiksel olarak anlamlı bir farklılık göstermemiştir. Bununla birlikte, son değerlendirmede (mastektomi sonrası son kemoterapi seansından sonra), MC-BMT(-) C + LDN ve MC-BMT(+) C + LDN gruplarında (p < 0,05) sadece kemoterapi ile tedavi edilen MC-BMT(-) C ve MC-BMT(+) C gruplarına göre anlamlı derecede daha yüksek beta-endorfin konsantrasyonu gözlenmiştir (Şekil 2A).
Met-enkefalin serum analizi dikkate alındığında, başlangıç döneminde gruplar arasında anlamlı bir farklılık gözlenmemiştir. Ancak, tedavinin sonunda, sadece kemoterapi uygulanan gruplarla karşılaştırıldığında, LDN’nin adjuvan tedavi olarak kullanıldığı gruplarda belirgin şekilde daha yüksek met-enkefalin konsantrasyonları görülmüştür (p < 0.05) (Şekil 2B).
Yaşam kalitesi
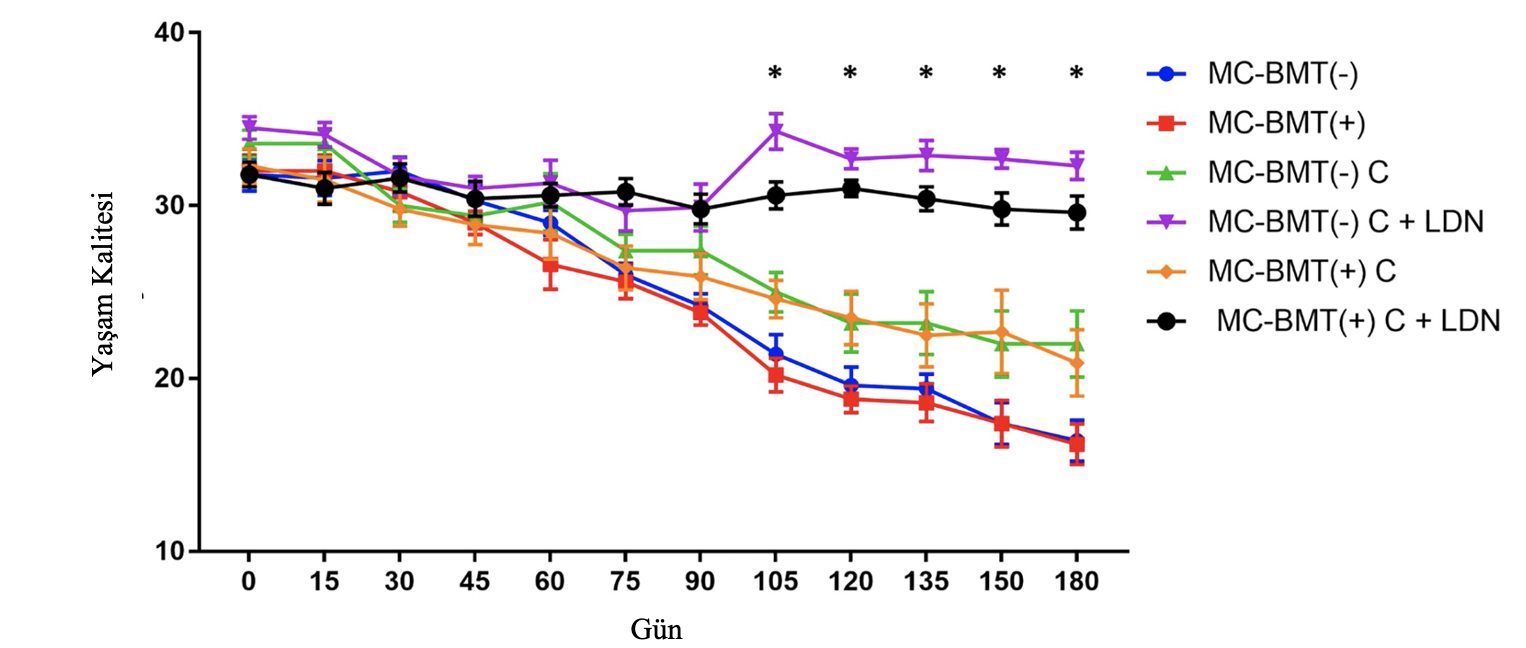
Yaşam kalitesi verilerinin değerlendirilmesi, kemoterapinin başlangıcında tüm alt grup skorlarının 31 ila 36 puan arasında değişecek şekilde benzer yaşam kalitesi skorları sergilemiştir (Şekil 3). Bununla birlikte, kemoterapinin sonunda, metastazın varlığına veya yokluğuna bakılmaksızın LDN ile tedavi edilen gruplar başlangıçtaki yaşam kalitesi skorlarını korurken, sadece karboplatin ile tedavi edilen gruplar 20 ila 23 puan arasında değişen skorlarla yaşam kalitesinde önemli bir düşüş sergilemiştir. Kontrol grubundaki dişi köpekler başlangıçta kemoterapi uygulanan gruba benzer yaşam kalitesi skorları göstermiş, sadece tedavinin sonunda skorlar 11 ila 21 puan arasında değişmiştir. Yaşam kalitesi puanlarının zaman bakımından analizi, LDN ile tedavi edilen grupların deneyin başlangıcından 105 gün sonra LDN ile tedavi edilmeyen gruplardan istatistiksel olarak daha yüksek puanlar verdiğini ve bu farkın gözlem süresinin sonuna kadar korunduğunu ortaya koymuştur (Şekil 4).
Örnekleme zamanına göre gruplar karşılaştırıldığında, sadece karboplatin ile tedavi edilen gruplarda istatistiksel olarak anlamlı düşüşler gözlenmiştir. Karşılaştırma sadece tedavi sonrasında yapıldığında, MC-BMT(-) C ve MC-BMT(+) C grupları arasında belirgin bir fark vardı (Tablo 3).
Sağkalım eğrisi karşılaştırmaları ve istatistiksel analiz
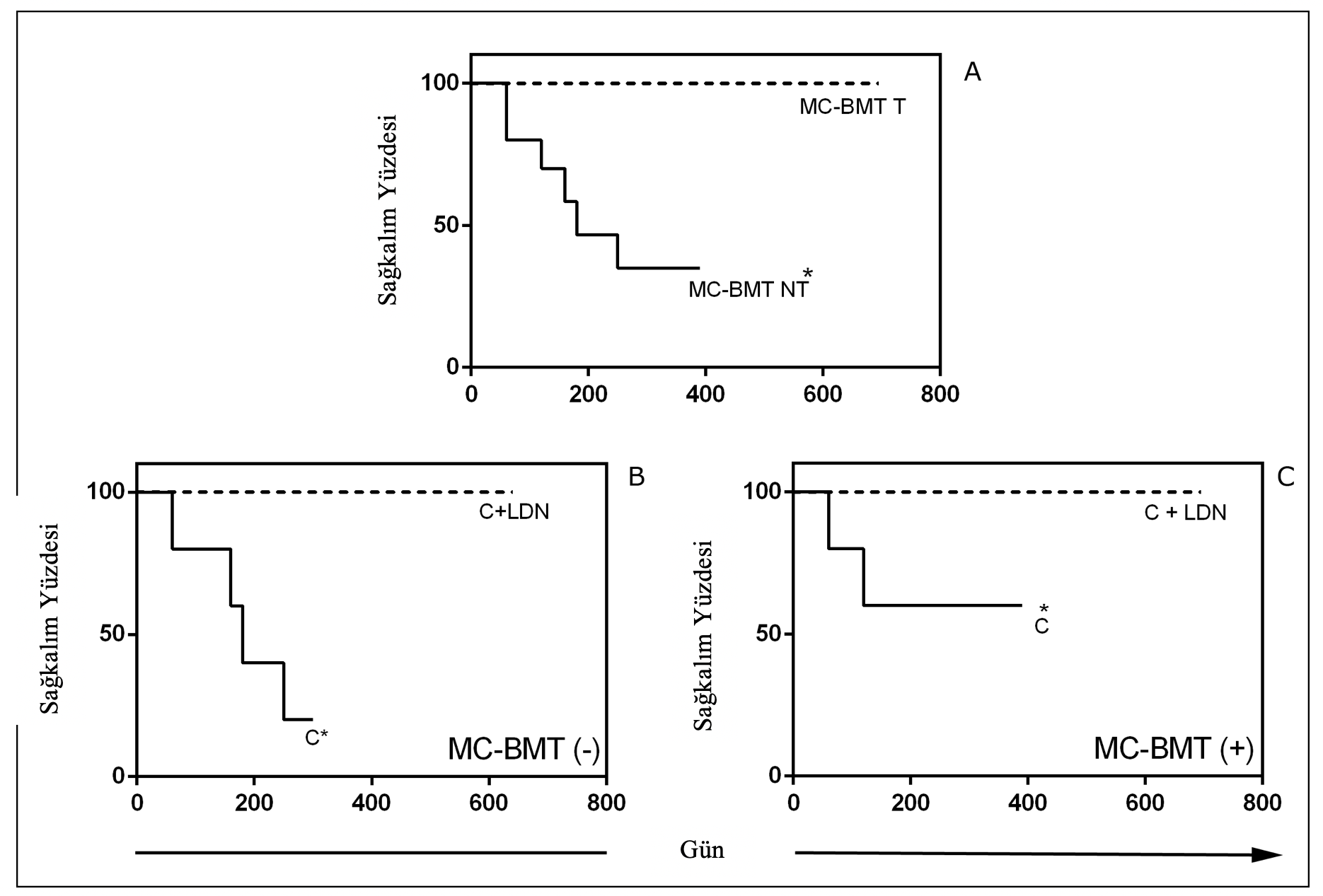
Akciğer metastazı nedeniyle ölen kontrol grubundaki hayvanlarda görüldüğü gibi, minimum sağkalım süresi mastektomiden sonra 60 gün iken, mastektomi ve LDN ile ilişkili kemoterapi uygulanan grupta maksimum 695 gün olarak gözlenmiştir. Metastazın varlığına veya yokluğuna bakılmaksızın, LDN ile tedavi edilen ve edilmeyen gruplar arasında önemli farklılıklar (p < 0.05) gözlenmiştir (Şekil 5). Ortalama gözlem süresi kemoterapi ve LDN, sadece kemoterapi ve sadece mastektomi ile tedavi edilen gruplarda sırasıyla 525,5, 200,2 ve 123,1 gündü. Ameliyat sonrası kemoterapi ve sadece mastektomi uygulanan gruplarda medyan sağkalım sırasıyla 180 ve 150 gündü.
Şekil 1. MC-BMT uygulanan dişi köpeklerin periferik kanında total T-lenfositleri, CD4+ ve CD8+ T-lenfositleri ve CD4+/CD8+ T-hücre oranının akış sitometrisi ile immünofenotiplendirilmesi. Analiz, metastaz olmaması (-) veya olmasına (+) göre alt kategorilere ayrılarak önerilen tedaviden önce ve sonra şeklinde ayrılmıştır. İmmünofenotipik analizler, Metot kısmında açıklandığı gibi çift renkli akış sitometrisi kullanılarak gerçekleştirilmiştir. Total lenfositler önce boyutlarına (lazer ileri saçılım-FSC) ve karmaşıklıklarına (lazer yan saçılım-SSC) göre seçilmiş ve alt kümeler FL1/FITC’ye karşı FL2/R-PE nokta grafikleri üzerinde kadran istatistikleriyle analiz edilmiştir. Sonuçlar, toplam T-lenfositlerinin minimum, medyan ve maksimum değerlerini gösteren bir kutu grafiği formatında gösterilmiştir. (A) CD4+ (B) ve CD8+ T-lenfositleri (C) (kapılı lenfositlerin yüzdesi olarak ifade edilir) ve CD4+/CD8+ T-hücresi oranı (D) (oran olarak ifade edilir). mKruskal-Wallis testine göre p < 0,05 düzeyinde anlamlı farklılıklar.
https://doi.org/10.1371/journal.pone.0204830.g001
Şekil 2. İyi huylu mikst tümör olarak kanserli dişi köpeklerin kanındaki beta-endorfin ve met-enkefalin konsantrasyonları. Sonuçlar önerilen tedaviden önce ve sonra şeklinde ayrılmış ve metastaz olmaması (-) veya olmasına (+) göre alt kategorilere ayrılmıştır. Her numune için beta-endorfin konsantrasyonları (pg/mL cinsinden) ELISA ile belirlenmiştir (A). Her bir numune için met-enkefalin konsantrasyonları ELISA ile belirlenmiş ve ng/mL cinsinden hesaplanmıştır (B). mKruskal-Wallis istatistik testine göre p < 0,05 düzeyinde anlamlı farklılıklar.
https://doi.org/10.1371/journal.pone.0204830.g002
Kemoterapi ve LDN grubunda ölüm olmadığı için medyan sağkalımı gözlemlemek mümkün olmamıştır. Sadece postoperatif kemoterapi ve mastektomi uygulanan gruplarda mortalite yüzdesi %60 olmuştur. Veteriner hekim tarafından değerlendirildiği üzere, herhangi bir ötenazi uygulamasına gerek duyulmamıştır.
Adjuvan tedavi olarak LDN ile sağkalım (hem tek değişkenli hem de çok değişkenli analizde p < 0.0001) ve tedavi sonrası yaşam kalitesi (tek değişkenli analizde p = 0.004 ve çok değişkenli analizde p = 0.003) arasında istatistiksel olarak anlamlı bir bağlantı bulunmuştur.
Tartışma
Benign mikst tümörlerdeki meme karsinomları dişi köpeklerde en sık görülen malignitelerdir [3] ve yüksek insidansı ve değişken malign potansiyeli nedeniyle biyolojik davranışları ve tedavilerine yönelik yapılan çalışmalara artan bir ilgi vardır. MC-BMT teşhisi konulan hayvanların insidansı 10 ila 14 yaş aralığında daha yüksektir.
Şekil 3. Karboplatin tedavisinden önce ve sonra ve LDN adjuvan tedavisinin uygulanmadığı durumlarda MC-BMT uygulanan dişi köpeklerin yaşam kalitesi skorlarının gösterimi. mKruskal-Wallis istatistik testine göre p < 0,05 düzeyinde anlamlı farklılıklar.
https://doi.org/10.1371/journal.pone.0204830.g003
Bu sonuç, dokuz ila on üç yaş arasındaki dişi köpeklerde meme tümörlerinin sıklığının arttığını gösteren ve daha önce rapor edilen bulguları destekler niteliktedir [4, 18]. Bununla birlikte, veteriner hekimlik alanındaki çalışmaların hiçbiri yaşa göre prognozda tutarlı farklılıklar kaydetmemiştir [19].
Misdorp’a [1] göre, kaniş ırkı meme tümörlerine karşı belirgin bir genetik yatkınlığa sahiptir. Ancak Salas ve arkadaşları [20], meme tümörlerinin bazı ırklarda daha sık teşhis edilmesine rağmen, bu hastalığın gelişiminde herhangi bir ırksal yatkınlığı destekleyecek yeterli veri bulunmadığını bildirmiştir. Bu çalışmada, Estrela-Lima [4] tarafından rapor edilene benzer şekilde, MC-BMT’li kaniş ırkı köpeklerde daha yüksek insidans gözlenmiştir.
Şekil 4. MC-BMT uygulanan dişi köpeklerin zaman içindeki yaşam kalitesi skorlarına ilişkin dönemsel analiz. Veriler her grup için yaşam kalitesi skorlarının ortalaması şeklinde ifade edilmiştir. mLDN uygulanan ve uygulanmayan gruplar arasında p < 0,05 düzeyinde anlamlı farklılıklar. İstatistiksel analiz post-hoc Tukey testi ile iki yönlü ANOVA kullanılarak gerçekleştirilmiştir.
https://doi.org/10.1371/journal.pone.0204830.g004
Tablo 3. Önerilen tedaviden önce ve sonra deney grupları arasında yaşam kalitesinin karşılaştırılması.
Büyük harflerle yazılan üst simgeler, aynı grubu tedavi öncesi ve sonrası karşılaştırırken parametrik olmayan Wilcoxon istatistiksel testi kullanılarak p < 0,05 değerini göstermektedir.
Küçük harflerle yazılan üst simgeler, her bir zaman noktasında farklı grupları karşılaştırırken parametrik olmayan Mann-Whitney istatistiksel testi kullanılarak p < 0,05 değerini göstermektedir.
mp < 0,05 düzeyinde anlamlı farklılıklar.
https://doi.org/10.1371/journal.pone.0204830.t003
Ancak bu durum, çalışma kapsamında ele alınan bölgede bu ırka ait çok sayıda hayvan bulunması veya çeşitli ırkların ve melezlerin varlığı ile ilişkilendirilebilir [21].
Şekil 5. MC-BMT uygulanan hayvanların sağkalım oranları. (A) Lenf nodu metastazının olmamasına (-) veya olmasına (+) göre sınıflandırılan LDN alt gruplarıyla birlikte tedavi edilen (T) veya edilmeyen (NT) grupların altı aylık sağkalım eğrileri (B ve C). mKaplan-Meier analizine göre p< 0,05 düzeyinde anlamlı farklılıklar..
https://doi.org/10.1371/journal.pone.0204830.g005
Hastaların beslenme özellikleri ve bedensel durumlarıyla ilgili ilginç ve tartışmalı sonuçlar gözlemlenmiştir, çünkü çalışma hayvanlarının büyük çoğunluğunun (%70) diyetinde ev yapımı yiyecekler bulunmasına rağmen, bedensel durum çoğu vakada (%70) normaldi. Bu çalışmada hayvanların çoğunun deneyin başında bedensel durumlarının normal olduğu yönündeki bulgular, başlangıçta bu değişkenin tümör gelişiminde belirgin bir etkisi olmadığını düşündürmektedir; ancak obez dişi köpeklerin çoğunda (8/12) beş santimetreden büyük tümörlerin yanı sıra ileri evrede bölgesel metastaz görülmesi dikkat çekicidir. Dolayısıyla, belki de köpeğin bedensel durumu neoplastik progresyon için önemli bir faktördür, başlangıcı için değil. Çalışmalar, obez kadınların yağ dokusundan androstenedionun östrona ve ardından meme karsinogenezinde rol oynadığı iyi bilinen estrojen hormonuna dönüşmesi nedeniyle daha yüksek östrojen konsantrasyonlarına sahip olduğunu göstermektedir [22].
LDN ile tedavi edilmeyen iki alt gruptaki dişi köpeklerde gözlenen ortalama eritrosit, trombosit ve lökosit sayıları, bu ilaçla tedavi edilen gruplara kıyasla daha düşüktü. Karboplatinin başlıca yan etkisi, öncelikle lökopeni, anemi ve trombositopeni ile kendini gösteren hematolojik profil üzerindeki etkisidir [23]. Moretti ve arkadaşları [24] 46 köpekte karsinom tedavisinde kemoterapötik olarak kullanıldığında karboplatinin hematolojik parametrelerde önemli bir düşüşe neden olmadığını rapor etmiştir; ancak bu çalışmada kan örneği alma işlemi tedaviden hemen sonra yapılmıştır. Bu nedenle, bu çalışmada gözlenen lökosit sayısındaki azalma, kemoterapi süresinin daha uzun olmasına ve hayvanların daha uzun süre gözlem altında tutulmasına bağlanabilir.
Tümörlerin makroskopik analizi, meme zincirinin bilateral tutulumu ile multisentrik tümörlerin baskınlığını ve en çok abdominal ve inguinal meme bezlerinin etkilendiğini göstermektedir; bu tümörler genellikle beş santimetreden daha büyüktür. Bu sonuçlar, tümörlerin %57’sinin çok merkezli olduğunu rapor eden Sorenmo [25] tarafından elde edilen sonuçları desteklemektedir. Lana ve arkadaşları [26] meme karsinomu görülme sıklığının inguinal ve abdominal meme bezlerinde belirgin şekilde daha yüksek olduğunu belirtmiş ancak bu öngörü hakkında herhangi bir açıklama yapmamıştır. Misdorp’a [1] göre bu bezler, hormonlara yanıt olarak daha fazla proliferatif değişim sergileyebilen meme bezi parankiminin artması nedeniyle en çok etkilenen bezlerdir.
Bu çalışmada, dişi köpeklerin büyük çoğunluğu kemoterapi tedavisini tamamlamıştır; ancak, dişi köpeklerin %40’ında her kemoterapi seansından sonra kusma ve %10’unda ishal görülmüştür. Karboplatin kullanımından sonraki bu yan etkiler literatürde zaten mevcuttur [27]. Yan etki görülen hayvanların büyük çoğunluğunun (%90) LDN adjuvan tedavisi almamış olması dikkat çekicidir.
Naltreksonun hayvanlara ağız yoluyla uygulanabilmesi ve maliyetinin düşük olması kullanımını kolaylaştırmaktadır. Kemoterapi ile tedavi edilen insanlarda, düşük doz naltrekson tedavisi kemoterapinin neden olduğu yan etkilerin azalmasını sağlamaktadır [9, 28]. Metze ve arkadaşlarına göre [12], insanlarda LDN yan etkileri arasında uyuşukluk, baş dönmesi, kusma ve ishal yer almaktadır, ancak bu etkiler çok sık görülmemektedir ve tedavinin başlangıcıyla sınırlı kalmıştır. Bu çalışmada, LDN’yi adjuvan tedavi olarak alan hastalar yukarıda açıklanan yan etkilerin hiçbirini göstermemiştir. Bu veriler, Brown ve Panksepp [28] tarafından yapılan ve LDN kullanımının insanlarda yaşam kalitesi ve sağlıkla ilişkilendiren çalışmadan elde edilen verilerle tutarlılık göstermektedir. Kemoterapinin yan etkilerini azaltarak ve yaşam kalitesini koruyarak, LDN köpeklerde meme tümörlerinin adjuvan tedavisi için önemli bir yöntem olabilir.
CD8+ T-lenfositlerinin yüzdesi ile beta-endorfin ve enkefalin serum konsantrasyonları, LDN ile tedavi edilen gruplarda, LDN ile tedavi edilmeyen ve kontrol gruplarına kıyasla önemli ölçüde daha yüksekti; ancak CD8+ T-hücrelerindeki bu artış metastaz olmayan grupla sınırlıydı. Dolayısıyla, LDN tedavisinin CD8+ T-lenfositleri aracılığıyla hücresel olarak immün yanıt stimülüsü sağladığı ve metastazın olmamasının bu faydayı desteklediği düşünülmektedir. LDN ile tedavi edilen hayvanlarda, beta-endorfin ve enkefalin
konsantrasyonları ile daha yüksek CD8+ T-lenfosit sayısı arasında doğrudan bir korelasyon vardı. Bu sonuç, lenfositlerin endojen opioid peptidler için reseptörler eksprese etmesi ile açıklanabilir [29]. Düşük dozlarda kullanıldığında, naltrekson kısa bir süre için endojen opioid reseptörlerine geri dönüşümlü olarak bağlanır. Üç ila dört saat sonra naltrekson bu reseptörleri kapatarak beta-endorfin ve enkefalin konsantrasyonlarını artırır. Lenfositlerdeki bu opioid peptid reseptörlerinin aktivasyonu, efektör hücreler ile tümör hücreleri arasındaki temasın artmasına neden olur [30]. Ek olarak, bu temas yoluyla, adenilat siklaz enzimi ile reaksiyona giren ATP salınımı olur ve sonuç olarak lenfositlerde cAMP artar [31]. Buna karşılık, cAMP sitokinlerin (IL-2 ve IFN-γ) seçici aktivasyonunu teşvik eder [32]. IFN-γ makrofajları interlökin-2 (IL-2) salgılamaları için uyarır, bu da T-hücrelerini çoğalmaları ve daha fazla IFN-γ üretmeleri için uyarır [29].
Aktive olmuş makrofajlar, malign hücrelerin apoptozunu destekleyen TNF-α üretir [33].
Bu çalışmada, beta-endorfin ve enkefalin serum konsantrasyonları LDN ile tedavi edilen gruplarda, LDN ile tedavi edilmeyen gruplara ve kontrollere kıyasla önemli ölçüde daha yüksekti. Bu gruplar, kontrol ve LDN tedavisi görmeyen gruplara kıyasla daha yüksek yaşam kalitesi sağlamış ve daha fazla sağkalım sergilemiştir. Bu veriler, naltrekson metabolizmasında yer alan endojen opioid peptidlerin, yaşam kalitesinde ve hasta sağkalımında iyileşme sağlamanın yanı sıra bağışıklık sisteminin uyarılması yoluyla faydalı etkiler sağlayarak yaşam kalitesine katkıda bulunduğunu göstermektedir [28].
The Bu çalışmanın sonuçları, LDN’nin faydalı etkileri ile yaşam kalitesi arasında doğrudan bir bağlantı olduğunu, tedavinin evrimi ve bunun sonucunda sağkalım bakımından önemli olduğunu göstermektedir. Bu veriler, sırasıyla pankreas ve yumurtalık tümörü olan insanlarda naltrekson kullanımını inceleyen Berkson ve diğerleri [34] ve Donahue ve diğerleri [9] tarafından tespit edilen verilerle tutarlılık göstermektedir. Bu çalışmalarda, naltreksonun adjuvan tedavi olarak kullanılması insan hastalar için yaşam kalitesinde iyileşme sağlamıştır.
Sağkalım eğrilerinin karşılaştırılması, metastazın varlığına veya yokluğuna bakılmaksızın, LDN ile tedavi edilen gruplarda, LDN ile tedavi edilmeyen gruplara kıyasla daha iyi sonuçlar elde edildiğini göstermektedir. Bu sonuçlar, LDN tedavisinin insanlarda sağkalımı artırdığını ve yaşam kalitesini koruduğunu tespit eden Brown ve Panksepp’in [28] gözlemleriyle tutarlılık göstermektedir. Naltrekson adjuvan tedavisinin etkileri bir insan hastada kemoterapinin yan etkilerini azaltmış [34] ve mevcut çalışmada görüldüğü gibi sıçanların bağışıklık sisteminde önemli bir etki göstermiştir [9]..
Sonuç
Bu çalışma, meme karsinomlu dişi köpeklerde kemo-terapi-adjuvan tedavi olarak veteriner hekimlikte naltrekson kullanımının ilk kez incelenmesini temsil etmektedir. Bu çalışmanın sonuçları naltreksonun karboplatin kemoterapisine bağlı yan etkileri azalttığını göstermektedir. Naltrekson tedavisi beta-endorfin ve met-enkefalin serum konsantrasyonlarını artırmış, hayvanların sağlık durumlarını iyileştirmiş, yaşam kalitelerini korumuş ve kemoterapi gören köpeklerde sağkalım oranının artmasına katkıda bulunmuştur, böylece LDN adjuvan tedavisi dişi köpeklerde meme tümörlerinin klinik yönetiminde önemli bir yöntem haline gelmiştir.
Ek bilgiler
S1 Tablo. Benign mikst tümör ile karsinomlu dişi köpeklerde önerilen tedaviden önce ve sonra şeklinde sınıflandırılmış hematolojik parametreler. https://figshare.com/articles/Hematologic_parameters_in_female_dogs_with_carcinoma_in_benign_mixed_tumor_stratified_as_before_and_after_the_proposed_treatment/6977744.(PDF)
S2 Tablo. Benign mikst tümörlü karsinomlu dişi köpeklerde önerilen tedavi öncesi ve sonrası şeklinde sınıflandırılmış serum biyokimya parametreleri. https://figshare.com/articles/Serum_biochemical_parameters_in_female_dogs_with_carcinoma_in_benign_mixed_tumor_stratified_as_before_and_after_the_proposed_treatment/6977747.
(PDF)
Teşekkür Bölümü
Bu çalışma Bahia Eyaleti Araştırma Destek Vakfı (FAPESB- 3538/2013 sayılı hibe) tarafından desteklenmiştir. Yazarlar Tropikal Hayvan Bilimi Lisansüstü Çalışmalar Programı’na (PPgCAT) sonsuz teşekkürlerini sunmaktadır. Mar´ılia Carneiro Machado, Yükseköğretim Personel Teşvik Koordinasyonu’nun (CAPES) yüksek lisans bursiyeridir. Alessandra Estrela- Lima ve Olindo Assis Martins-Filho Ulusal Bilimsel ve Teknolojik Gelişim Konseyi (CNPq) araştırma bursiyerleridir.
Katkıda Bulunan Yazarlar
Tasarım: Alessandra Estrela-Lima.
Veri Düzenleme: Mar´ılia Carneiro Machado, Ricardo Dias Portela, Ma´rio Jorge Melhor Heine D’Assis,Olindo Assis Martins-Filho, Natalie Ferreira Borges, Fabiana Lessa Silva, Alessan- dra Estrela-Lima.
Biçimsel Analiz: Mar´ılia Carneiro Machado, Ricardo Dias Portela, Olindo Assis Martins- Filho,Natalie Ferreira Borges, Fabiana Lessa Silva, Alessandra Estrela-Lima.
Fon Sağlama: Alessandra Estrela-Lima.
Araştırma: Mar´ılia Carneiro Machado, Alessandra Estrela-Lima.
Metodoloji: Mar´ılia Carneiro Machado, João Moreira da Costa-Neto, Ricardo Dias Portela, Ma´rio JorgeMelhor Heine D’Assis, Olindo Assis Martins-Filho, Stella Maria Barrouin- Melo, Natalie Ferreira Borges, Fabiana Lessa Silva.
Kaynaklar: Alessandra Estrela-Lima.
Danışman: João Moreira da Costa-Neto, Alessandra Estrela-Lima.
Onay: Mar´ılia Carneiro Machado, Ricardo Dias Portela.
Yazım – orijinal taslak: Mar´ılia Carneiro Machado.
Yazım – inceleme ve düzenleme: Ricardo Dias Portela, Stella Maria Barrouin-Melo, Fabiana Lessa Silva, Alessandra Estrela-Lima.
Kaynakça
- Misdorp Tumors of the mammary gland. In: Meuten DJ. Tumors in Domestic Animals. 4th ed. Iowa State: Blackwell Publishing; 2002. p. 575–606
- Salas Y, Ma´rquez A, Diaz D, Romero L. Epidemiological Study of Mammary Tumors in Female Dogs Diagnosed during the Period 2002–2012: A Growing Animal Health PLoS One. 2015; 18: 10– 15.https://doi.org/10.1371/journal.pone.0127381 PMID: 25992997.
- Cassali G Comparative mammary oncology: canine model. BMC Proceed. 2013; 7: 1–2. https://doi.org/10.1186/1753-6561-7-S2-K6 PMID: 24764485
- Estrela-Lima A, Arau´jo MS, Costa-Neto JM, Teixeira-Carvalho A, Barrouin-Melo SM, Cardoso SV, et Immunophenotypic features of tumor infiltrating lymphocytes from mammary carcinomas in female dogs associated with prognostic factors and survival rates. BMC Cancer. 2010; 10: 1–14. https://doi.org/10.1186/1471-2407-10-1 PMID: 20047689.
- Damasceno KA, Bertagnolli AC, Estrela-Lima A, Ribeiro LGR, Rabelo BS, Campos CB, et Versicanexpression in canine carcinomas in benign mixed tumours: is there an association with clinical patholog- ical factors, invasion and overall survival? BMC Vet Res. 2012; 8: 195–205. https://doi.org/10.1186/ 1746-6148-8-195 PMID: 23082892.
- Cassali GD, Lavalle GE, Ferreira E, Estrela-Lima A, De Nardi AB, Ghever C, et Consensus for the Diagnosis, Prognosis and Treatment of Canine Mammary Tumors– 2013. Braz J Vet Pathol. 2014; 7: 38–69.
- Lee MW, Fujioka Naltrexone for the treatment of obesity: review and update. Expert Opin Pharmac- other. 2009; 11: 1841–1845.
- Zagon IS, McLaughlin Opioids and differentiation in human cancer cells. Neuropep. 2005; 39: 495– 505. https://doi.org/10.1016/j.npep.2005.07.001 PMID: 16169076.
- Donahue RN, McLaughlin PJ, Zagon Low-dose naltrexone suppresses ovarian cancer and exhibits enhanced inhibition in combination with cisplatin. Exp Biol Med. 2003; 236: 883–895. https://doi.org/10.1258/ebm.2011.011096 PMID: 21685240.
- Ferreira E, Bregunci GC, Schmitt FC, Cassali Protocol for the anatomopathological examination of canine mammary tumors. Arq Bras Med Vet Zootec. 2003; 55: 105–109. https://doi.org/10.1590/ S0102-09352003000100017.
- Owen TNM Classification of tumors in Domestic Animals. 1th ed. Geneva: World Health Organiza- tion; 1980. p. 53.
- Metze D, Reimann S, Beissert S, Luger Efficacy and safety of naltrexone, an oral opiate receptor antagonist, in the treatment of pruritus in internal and dermatological diseases. J Am Acad Dermatol. 1999;41: 533–539. https://doi.org/10.1016/S0190-9622(99)80048-6. PMID: 10495371.
- Veterinary Cooperative Oncology Common terminology criteria for adverse events (VCOG- CTCAE), following chemotherapy or biological antineoplastic therapy in dogs and cats. Vet. Comp. Oncol. 2011; 14:417–446. https://doi.org/10.1111/vco.283 PMID: 28530307.
- Araujo MSS, Andrade RA, Vianna LR, Mayrink W, Reis AB, Sathler-Avelar R, et Despite Leishvac- cineand Leishmune (R) trigger distinct immune profiles, their ability to activate phagocytes and CD8(+) T-cellssupport their high-quality immunogenic potential against canine visceral leishmaniasis. Vaccine. 2008; 26:2211–2224. https://doi.org/10.1016/j.vaccine.2008.02.044 PMID: 18395948.
- Estrela-Lima A, Arau´jo MS, Costa-Neto JM, Ribeiro LG, Damasceno KA, D’Assis MJ, et al. Understand- ing of the immunological heterogeneity of canine mammary carcinomas to provide immunophenotypicfeatures of circulating leukocytes as clinically relevant prognostic Br Can Res Treat. 2012; 131:751–763. https://doi.org/10.1007/s10549-011-1452-z PMID: 21448671.
- Yazbek KV, Fantoni Validity of a health-related quality-of-life scale for dogs with signs of pain sec-ondary to cancer. J Am Vet Med Assoc. 2005; 226: 1354–1358. https://doi.org/10.2460/javma.2005.226.1354. PMID: 15844428.
- Coles EH. Veterinary Clinical Pathology. 4th ed. Philadelphia: Saunders; 1986. 516.
- Shafiee R, Javanbakht J, Atyabi N, Kheradmand P, Kheradmand D, Bahrami A, et Diagnosis, classi- fication and grading of canine mammary tumours as a model to study human breast cancer: an clinico-cytohistopathological study with environmental factors influencing public health and medicine. Cancer Cell Int.2013; 13: 1–11. https://doi.org/10.1186/1475-2867-13-1 PMID: 23305405.
- Philibert JC, Snyder PW, Glickman N, Glickman LT, Knapp DWE, Waters Influence of host factors onsurvival in dogs with malignant mammary gland tumors. J Vet Int Med. 2003; 17: 102–106. https://doi.org/10.1111/j.1939-1676.2003.tb01330.x. PMID: 12564734.
- Salas Y, Ma´rquez A, Diaz D, Romero L. Epidemiological Study of Mammary Tumors in Female Dogs Diagnosed during the Period 2002–2012: A Growing Animal Health PLoS One. 2015; 10: 1– 15.https://doi.org/10.1371/journal.pone.0127381 PMID: 25992997.
- Sontas BH, Yu¨ zbaşıoğlu O¨ ztu¨ rk G, Toydemir TF, Arun SS, Ekicim H. Fine-needle aspiration biopsy of canine mammary gland tumours: a comparison between cytology and Reprod. Domest. Anim.2012; 47: 125–130. https://doi.org/10.1111/j.1439-0531.2011.01810.x PMID: 21615802.
- Yoo K, Tajima K, Park S, Kang D, Kim S, Hirose K, et Postmenopausal obesity as a breast cancer riskfactor according to estrogen and progesterone receptor status. Cancer Lett. 2001; 167: 57–63. PMID:11323099.
- Oun R, Moussa YE, Wheate The side effects of platinum-based chemotherapy drugs: a review for chemists. Dalton Trans. 2018; 47: 6645–6653. https://doi.org/10.1039/c8dt00838h PMID: 29632935.
- Moretti P, Giordano A, Stefanello D, Ferrari R, Castellano S, Paltrinieri S. Nucleated erythrocytes in blood smears of dogs undergoing Vet Comp Oncol. 2017; 15: 215–225. https://doi.org/10.1111/vco.12156 PMID: 26109175.
- Sorenmo Canine mammary gland tumors. Vet. Clin. North. Am. Small Anim. Pract. 2003; 33: 573–596. https://doi.org/10.1016/S0195-5616(03)00020-2. PMID: 12852237.
- Lana SE, Rutteman GR, Withrow Tumors of the mammary gland. In: Withrow SJ, Vail DM, Page RL. Withrow & MacEwen’s Small Animal Clinical Oncology. 5th ed. St. Louis: Elsevier Saunders; 2013. p.619–636.
- Lavalle GE, De Campos CB, Bertagnolli AC, Cassali Canine malignant mammary gland neoplasms with advanced clinical staging treated with carboplatin and cyclooxygenase inhibitors. In Vivo 2012; 26: 375–379. PMID: 22523289.
- Brown N, Panksepp Low-dose naltrexone for disease prevention and quality of life. Med. Hypotheses 2009; 72: 333–337. https://doi.org/10.1016/j.mehy.2008.06.048 PMID: 19041189.
- Hazum E, Chang KJ, Cuatrecasas Specific nonopiate receptors for beta-endorphin. Science 1979; 205: 1033–1035. https://doi.org/10.1126/science.224457. PMID: 224457.
- Bidlack Detection and Function of Opioid Receptors on Cells from the Immune System. Clin. Diagn. Lab. Immunol. 2000; 7: 719–723. https://doi.org/10.1128/CDLI.7.5.719-723.2000. PMID: 10973443.
- Sojka DK, Huang YH, Fowell Mechanisms of regulatory T-cell suppression—a diverse arsenal for a moving target. Immunology 2008; 124: 13–22. https://doi.org/10.1111/j.1365-2567.2008.02813.x PMID:18346152.
- Tang Q, Bluestone The Foxp3+ regulatory T cell: a jack of all trades, master of regulation. Nat. Immunol. 2008; 9: 239–244. https://doi.org/10.1038/ni1572 PMID: 18285775.
- Stein C, Schafer M, Machelska Attacking pain at its source: new perspectives on opioids. Nat. Med. 2003; 9: 1003–1008. https://doi.org/10.1038/nm908 PMID: 12894165.
- Berkson BM, Rubin DM, Berkson AJ. The long-term survival of a patient with pancreatic cancer with metastases to the liver after treatment with the intravenous alpha-lipoic acid/low-dose naltrexone proto- col. Integr. Cancer Ther. 2006; 5: 83–89. https://doi.org/10.1177/1534735405285901 PMID: 16484716.