Yomogi Sato a, Mohamed Elbadawy a, b,*, Kazuhiko Suzuki c, Ryouichi Tsunedomi d,
Hiroaki Naganod, Yusuke Ishiharaa, Haru Yamamotoa, Daigo Azakamie, Tsuyoshi Uchidef,
Rina Nabeta f, Ryuji Fukushima g, Amira Abugomaa a, h, Masahiro Kaneda i, Hideyuki Yamawakij, Yuta Shinoharak, Tatsuya Usuia,**, Kazuaki Sasakia
a Veteriner Farmakoloji Laboratuvarı, Veteriner Hekimliği Bölümü, Ziraat Fakültesi, Tokyo Tarım ve Teknoloji Üniversitesi, 3-5-8 Saiwai-cho, Fuchu, Tokyo 183-8509, Japonya b Farmakoloji Anabilim Dalı, Veteriner Fakültesi, Benha Üniversitesi, 13736, Moshtohor, Toukh, Elqaliobiya, Mısır
c Veteriner Toksikoloji Laboratuvarı, Veteriner Hekimliği Bölümü, Ziraat Fakültesi, Tokyo Tarım ve Teknoloji Üniversitesi, 3-5-8 Saiwai-cho, Fuchu, Tokyo 183-8509, Japonya d Gastroenteroloji, Meme ve Endokrin Cerrahisi Bölümü, Yamaguchi Üniversitesi Tıp Fakültesi, 1-1-1 Minami-Kogushi, Ube, Yamaguchi 755- 8505, Japonya
e Veteriner Klinik Onkoloji Laboratuvarı, Ziraat Fakültesi, Tokyo Tarım ve Teknoloji Üniversitesi, 3-5-8 Saiwai-cho, Fuchu, Tokyo 183-8509, Japonya
f Veteriner Moleküler Patoloji ve Terapötikler Laboratuvarı, Ziraat Fakültesi, Tokyo Tarım ve Teknoloji Üniversitesi, 3-5-8 Saiwai-cho, Fuchu, Tokyo 183-8509, Japonya
g Hayvan Tıbbi Acil Durum Merkezi, Ziraat Fakültesi, Tokyo Tarım ve Teknoloji Üniversitesi, 2-24-16 Nakamachi, Koganei, Tokyo 184-8588, Japonya
h Veteriner Fakültesi, Mansoura Üniversitesi, 35516 Mansoura, Mısır
i Veteriner Anatomi Laboratuvarı, Veteriner Hekimliği Bölümü, Ziraat Fakültesi, Tokyo Tarım ve Teknoloji Üniversitesi, 3-5-8 Saiwai-cho, Fuchu, Tokyo 183-8509, Japonya
MAKALEYE DAİR BİLGİLER
Anahtar Kelimeler: Plevral mezotelyoma Köpekler
Organoidler RNA-seq Hücre adezyonu EMT
ÖZET
Köpek malign mezotelyoması (cMM) nadir görülen ve ilaca dirençli malign bir tümördür. Az sayıda hasta ve deneysel model bulunması nedeniyle, hastalığın patogenezini ve cMM için yeni ve etkili tedaviyi ortaya koyacak yeterli çalışma yapılmamıştır. Histopatolojik özellikler bakımından insan MM’sine (hMM) benzediğinden, hMM için de umut verici bir araştırma modeli olarak kabul edilmektedir. Geleneksel 2 boyutlu (2D) kültür yöntemleriyle karşılaştırıldığında, 3 boyutlu (3D) organoid kültürü orijinal tümör dokularının özelliklerini yeniden canlandırabilir. Bununla birlikte, kMM organoidleri hiç geliştirilmemiştir. Bu çalışmada, plevral efüzyon örnekleri kullanılarak ilk kez cMM organoidleri üretilmiştir. Her bir MM köpeğinden organoidler başarıyla üretildi. MM’nin özelliklerini sergilediler ve WT-1 ve mezotelin gibi mezotelyal hücre belirteçlerini eksprese ettiler. Anti-kanser ilaçlarına karşı duyarlılık her bir cMM organoid türünde farklıydı. RNA sıralama analizi, hücre adezyon molekülü yolaklarının, karşılık gelen 2D kültür hücrelerine kıyasla cMM organoidlerinde spesifik olarak yukarı regüle edildiğini göstermiştir. Bu genler arasında, E-cadherin’in ekspresyon seviyesi organoidlerde 2D hücrelerdekinden önemli ölçüde daha yüksekti. Sonuç olarak, oluşturduğumuz cMM organoidleri, köpek ve insan MM tedavisine yeni bakış açıları sağlamak için yeni birdeneysel araç haline gelebilir.
1. Giriş
Mezotelyum, vücut boşluklarını ve organların yüzeyini kaplayan, hem epitelyal hem de mezenkimal hücre özelliklerine sahip ve mezotelyal hücrelerden oluşan seröz epiteldir.
* Sorumlu yazar: Veteriner Farmakoloji Laboratuvarı, Veteriner Hekimliği Bölümü, Ziraat Fakültesi, Tokyo Tarım ve Teknoloji Üniversitesi, 3-5-8 Saiwai-cho, Fuchu, Tokyo 183-8509, Japonya.
** Sorumlu yazar.
E-posta adresleri: Mohamed.elbadawy@fvtm.bu.edu.eg (M. Elbadawy), fu7085@go.tuat.ac.jp (T. Usui).
https://doi.org/10.1016/j.biopha.2023.114651
Sunulduğu tarih: 28 Aralık 2022; Gözden geçirilmiş haliyle sunulduğu tarih: 21 Mart 2023; Kabul edildiği tarih: 31 Mart 2023 Çevrimiçi olarak 6 Nisan 2023’te yayınlanmıştır
0753-3322/© 2023 Yazarlar. Elsevier Masson SAS tarafından yayınlanmıştır. Bu makale CC BY-NC-ND lisansı altında açık erişimli bir makaledir (http://creativecommons.org/licenses/by-nc-nd/4.0/).
Normalde tek bir tabaka halinde bulunan mezotel hücreleri, inflamasyon veya tümörijenez ile proliferasyon aktive olduğunda vücut boşluğu efüzyonlarında çok katmanlı ve serbest hale gelir [2]. Malign mezotelyomaların (MM) insan, köpek, kedi, inek ve fare gibi çeşitli memeli türlerinde çeşitli seröz boşluklarda meydana geldiği bilinmektedir. İnsanlarda plevral mezotelyoma en yaygın olanıdır ve özellikle asbest maruziyetiyle ilişkilendirilmiştir [3]. Bununla birlikte, köpeklerde hastalığın kesin nedeni bilinmemektedir. WHO sınıflandırmasına göre [4,5], MM histolojik olarak üç ana alt tipe ayrılabilir (epiteloid, sarkomatoid ve bifazik). Köpekler, insanlar gibi spontan hastalıklar gösterdikleri için yeni ilaçlar ve terapötik yöntemler için iyi bir model olarak kabul edilmektedir [6-10].
Köpek MM (cMM) nadir görülür ve daha agresif olup prognozu kötüdür [11]. Esas olarak plevra, periton ve perikardın mezotelyal astarından veya nadiren tunika vajinalis ve testisten kaynaklanır [11]. Orta yaşlı ve yaşlı köpekleri etkilemesine rağmen, daha genç başlangıçlı vakalar da bildirilmiştir [12-14]. Başlıca klinik semptomlar taşipne ve plevral efüzyon ve asite bağlı dispnedir [11].
Şu anda kMM için optimal bir tedavi bulunmamaktadır. Kötü yanıt veya tedavi direnci nedeniyle inatçı bir tümör olarak kabul edilir [11]. Tedaviler, tek başına veya mitoksantron ile birlikte intrakaviter veya intravenöz platin bazlı kemoterapi, 5-FU ve karboplatini içerir [11,16- 18]. Tedaviler efüzyon hacmini azaltmış ve ortalama sağkalım süresini bir dereceye kadar uzatmıştır [11]. KMM’nin tedavi stratejisini iyileştirmek için yeni preklinik modellerin geliştirilmesi gereklidir. İnsanlarda MM araştırmaları için fare modelleri [19,20], hücre hatları [21,22], sferoidler [23-25] ve organoidler [26,27] kullanılmıştır. Öte yandan, vaka sayısının az olması ve hastalığın nispeten hızlı ilerlemesi nedeniyle, kMM ile ilgili çalışmaların ve raporların çoğu klinik çalışmalara dayanmaktadır [11,15,28] ve köpeklerde az sayıda MM hücre hattı oluşturulmuştur [17,18,28-30]. Bu nedenle, yeni terapötik ajanlar ve kMM’nin tümör dinamikleri üzerine araştırmaları ilerletmek için yeni bir deneysel 3D modelin oluşturulması gerekmektedir.
Son zamanlarda organoid kültür yöntemi rejeneratif tıp [31], hassas tıp [32], hastalıkların modellenmesi [33,34], toksikolojik patoloji [35], translasyonel araştırma [36] ve tümör araştırması [37-39] alanlarında uygulanmaktadır. Organoidler, kendini yenileme yeteneği açısından
zengin olan 3 boyutlu (3D) kültür hücreleridir. Canlı bir vücudunkine daha benzer bir durumda muhafaza edilirler [40,41]. Bu nedenle, kMM biyolojisini incelemek ve tedavi stratejilerini geliştirmek için değerli bir model olarak kabul edilir. Bildiğimiz kadarıyla, kMM için organoid kültür yöntemleri oluşturulmamıştır. Bu nedenle, bu çalışmada, hasta kaynaklı kMM organoidlerinin kültüre edilmesi için bir yöntem oluşturmayı ve 2D hücrelerle karşılaştırıldığında moleküler özelliklerdeki farklılıkları araştırmayı amaçladık.
2. Materyal ve metod
2.1. Materyal
KMM organoidleri oluşturmak için, plevral efüzyon hücreleri Matrigel (BD Bioscience, San Jose, CA, ABD) içine gömülmüş ve daha önce tarif edildiği gibi modifiye edilmiş kök hücre geliştirme ortamı ile kültürlenmiştir [8,33,41]. Kültür ortamı gelişmiş Dulbecco’s Modified Eagle’s Medium (Ad. DMEM, Thermo Fisher Scientific, Waltham, MA, ABD) idi. Köklülük takviyeleri ve büyüme faktörleri aşağıdaki gibiydi: 50 Wnt (W)-, Noggin (N)- ve R-Spondin (R)-koşullandırılmış ortam;GlutaMax; 100 μg/ml Primocin (Thermo Fisher Scientific, Waltham, MA, ABD); 1 mM N-Asetil-L-sistein; 10 mM nikotinamid (Sigma-Aldrich, St. Louis, MO, ABD); ve 500 nM A83-01 (Adooq Bioscience, Irvine, CA, ABD), 50 ng/ml epidermal büyüme faktörü (EGF) (Pepro Tech, Cranbury, NL, ABD); 5 ng/ml fibroblast büyüme faktörü (FGF) – 2 (FGF2) (R&D Systems, Inc. Minneapolis, MN, ABD); 5 ng/ml FGF7; 25 ng/ml FGF10 (Pepro Tech); ve 100 ng/ml insülin benzeri büyüme faktörü (IGF) (Novus Biologicals, Centennial, CO, ABD). Diğer detaylar Tablo 1’de gösterilmiştir. Anti-kanser ilaçları şu şekildeydi: karboplatin (FUJIFILM WAKO Pure Chemical Corporation, Osaka, Japonya), doksorubisin, sisplatin ve gemsitabin (Cayman, Ann Arbor, MI, ABD). Antikor kaynakları şu şekildeydi: anti-AE1/AE3 (Novus Biologicals); anti-mezotelin (Abcam, Cambridge, MA, ABD); anti-Wilms tümörü-1 (WT-1, Dako-Agilent, Technologies Inc., Santa Clara, CA, ABD); anti- vimentin (Santa Cruz Biotechnology, Dallas, TX, ABD); ve anti-E- cadherin (BD Bioscience). İkincil antikor EnVision+Dual Link System- HRP (Dako-Agilent) idi.
2.2. cMM örneği bilgileri
Plevral efüzyon örnekleri, perikardiyektomi ile histopatolojik olarak perikardiyal mezotelyoma tanısı konulan üç köpekten toplanmıştır. Tüm örnekler (2019-2021) Tokyo Tarım ve Teknoloji Üniversitesi, Fuchu, Tokyo, Japonya’daki Hayvan Tıp Merkezi’nden toplanmış ve bir nakliye aracıyla derhal laboratuvarımıza transfer edilmiştir (Tablo 2). Bu çalışmadaki köpekler ve örnekleriyle ilgili bilgiler Tablo 3’te listelenmiştir. Bu çalışma için tüm köpek sahiplerinden yazılı bilgilendirilmiş onamlar alınmış ve deneyler Tokyo Tarım ve Teknoloji Üniversitesi Hayvan Bakım ve Kullanım Komitesi’nin onayıyla gerçekleştirilmiştir (Onay numarası: 0016012).
2.3. cMM organoidlerinin oluşturulması
cMM tanısı konulan köpeklerden alınan plevral sıvı örnekleri 600 g’de 3 dakika santrifüj edilmiş ve soğuk fosfat tamponlu salin (PBS) ile üç kez yıkandıktan sonra peletler toplanmıştır. Hücre peletleri Matrigel (40 μl/kuyu) ile buz üzerinde karıştırılmış ve 24 gözlü plakalara ekilmiştir. Jel 37 °C’de 30 dakika boyunca katılaştırıldıktan sonra kültür besiyeri (Tablo 1) eklenmiş ve haftada üç kez değiştirilmiştir. Konfluent büyümeden sonra, cMM organoidleri daha önce tarif edildiği gibi 1:3-4 oranında yeni yuvalara pasajlandı [6].
2.4. cMM 2D hücrelerinin oluşturulması
Plevral efüzyon örneklerinden cMM hücre peletleri toplanmış, 1x RBC lizis tamponu (pluriSelect, Leipzig, Almanya) ile oda sıcaklığında (RT) 3 dakika inkübe edilmiş, 200 g’de 3 dakika santrifüj edilmiş ve PBS ile üç kez yıkanmıştır. Hücreler daha sonra %10 fetal sığır serumu (FBS, Sigma Aldrich) ve %1 penisilin- streptomisin (WAKO), %1 L-glutamin, 50 ng/ml EGF, %0,1 hidro-kortizon (WAKO) ve %0,2 heparin (Sigma Aldrich) ile desteklenmiş Roswell Park MemorialInstitute (RPMI)-1640 (Sigma-Aldrich) ile karıştırılmış ve 6 cm’lik bir tabakta kültüre edilmiştir. Ortam haftada üç kez değiştirilmiş ve %80 konfluent durumda pasajlanmıştır. Kültürlenen hücreler sonraki analizler için kullanılmıştır.
2.5. cMM organoidleri için uygun ortam bileşeni deneyi
CMM organoidleri yeterince büyüdükten sonra, buz üzerinde 90 dakika boyunca 5 mM EDTA/PBS ile muamele edildi ve TrypLE (Thermo Fisher Scientific Inc.) kullanılarak 37 ◦C’de 5 dakika boyunca tripsinize edildi.
Daha sonra organoidler kuvvetli bir şekilde pipetlenmiş ve 70 μm hücre süzgecinden (Falcon, Cary, NC, ABD) geçirilmiştir. Elde edilen hücre çözeltisi FBS ile nötralize edildi ve 600 g’de 3 dakika santrifüj edildi. Hücre peletleri daha sonra toplanmış, buz üzerinde Matrigel ile karıştırılmış ve 96 gözlü kültür plakalarına ekilmiştir. Jel 20 dakika boyunca CO2 inkübatöründe katılaştıktan sonra farklı bileşimlerdeki kültür ortamları eklenmiştir. Kullanılan kültür ortamları şu şekildedir: (1) Kontrol ortamı Gelişmiş DMEM; GlutaMax; 100 μg/ml Primocin; 1 mM N-Asetil-L-sistein; 10 mM niko- tinamid; ve 500 nM A83-01 içeriyordu. (2) WNR ortamı %50 Wnt (W), Noggin (N) ve R-Spondin (R) şartlandırılmış ortam ihtiva eden kontrol ortamından oluşmuştur. (3) ila (7) arasındaki ortamlar sırasıyla 50 ng/ml EGF, 5 ng/ml FGF2, 5 ng/ml FGF7, 25 ng/ml FGF10 ve 100 ng/ml IGF içeren kontrol ortamını içeriyordu. Ortam üç gün sonra değiştirilmiş ve hücre proliferasyon oranları 7 gün sonra PrestoBlue test kiti (Thermo Fisher Scientific) ve 585 nm emisyon dalga boyunda bir mikroplaka okuyucu (TECAN, Seestrasse, İsviçre) kullanılarak belirlenmiştir. Veriler SigmaPlot yazılımı (V 14.5, Systat Software, Inc. San Jose, CA. ABD) kullanılarak analiz edilmiş ve grafiklendirilmiştir.
2.6. cMM organoidlerinin hematoksilen ve eozin (H&E) ile boyanması
Organoidlerin H&E boyaması daha önce tarif edildiği şekilde gerçekleştirilmiştir [6,8]. Gece boyunca 4 Co’da %4 paraformaldehit (PFA) ile sabitlendikten sonra, her organoid örneği etanol ve ksilen ile dehidrate edildi ve ardından mikrotom dilimleme için parafine gömülerek 4 μm kalınlığında kesitler halinde MS kaplı cam lamlara monte edildi. Daha sonra, kesitler deparafinize edilmiş ve ardından standart prosedürlere göre H&E ile boyanmıştır. Görüntüler bir ışık mikroskobu (BX-52; Olympus, Tokyo, Japonya) ile çekilmiştir.
2.7. cMM organoidlerinin immünohistokimyasal (IHC) boyanması
The cMM organoidlerinin IHC boyaması daha önce tarif edildiği şekilde gerçekleştirilmiştir [6,8]. cMM organoid kesitlerinin ksilen ve etanol ile deparafinizasyonundan sonra, antijen 10 mM sitrat tamponunda 121 Co’de 5 dakika ısıtılarak geri alındı, ardından kesitler 30 dakika boyunca %1 peroksidaz ile muamele edilerek endojen peroksidaz aktivitesi inaktive edildi. Ardından, %10 normal keçi serumu (NGS) / Tris tamponlu salin (TBS) ile 30 dakika bloke edildikten sonra, örnekler primer antikorlarla (anti-sitokeratin AE1/AE3; 1:100, anti- mezotelin; 1:100, anti-WT1; kullanıma hazır, anti-vimentin; 1:200 ve anti-E-cadherin; 1:200) 4 Co’de gece boyunca inkübe edilmiştir. Kesitler daha sonra PBS ile üç kez yıkandı ve ikincil antikor (EnVision+ Dual Link System-HRP) ile inkübe edildi ve DAB solüsyonu (Nacalai Tesque, Tokyo, Japonya) kullanılarak görselleştirildi.
Çekirdekler Mayer hematoksilen ile karşı boyanmıştır. Tüm görüntüler ışık mikroskobu (BX-43; Olympus, Tokyo, Japonya) kullanılarak elde edilmiştir.
2.8. cMM 2D hücrelerinin immünositokimyası (ICC)
cMM 2D hücrelerinin ICC boyaması daha önce tarif edildiği şekilde
gerçekleştirilmiştir [42]. Kültürlenmiş cMM 2D hücreleri PBS ile yıkandı ve 20 dakika boyunca %1 peroksidaz ile muamele edilerek endojen peroksidaz aktivitesinin inaktive edilmesinden önce 5 dakika boyunca -20 °C’de soğutulmuş metanol ile sabitlendi. Daha sonra, örnekler 30 dakika boyunca %10 NGS/TBS ile bloke edilmiş ve ardından primer antikorlarla (anti-sitokeratin AE1/AE3; 1:100, anti-mezotelin; 1:100, anti-WT; kullanıma hazır, anti-vimentin; 1:200 ve anti-E-cadherin; 1:200) inkübe edilmiştir. Daha sonra, 2D hücre örnekleri ikincil antikor (EnVision+ Dual Link System-HRP, DAKO) ile inkübe edilmiş ve DAB solüsyonu (Nacalai Tesque) kullanılarak görselleştirilmiştir. Çekirdekler Mayer’s hematoksilen ile karşı boyandı. Tüm görüntüler ışık mikroskobu (BX-43) kullanılarak elde edilmiştir.
2.9. cMM organoidlerinin transmisyon elektron mikrografı (TEM)
TEM prosedürü daha önce belirtildiği gibi gerçekleştirilmiştir [34]. Kısaca, cMM organoidleri 15 ml’lik tüplere toplanmış ve gece boyunca %2,5 glutaraldehit (pH 7,4) ile sabitlenmiştir. Organoidler daha sonra 0,1 M kakodilat (pH 7,4) ile bir kez yıkandı ve 0,1 M sodyum kakodilat (pH 7,4) içinde %2 osmiyum tetroksit ve %1,5 K4Fe(CN)6 çözeltisi içinde 4 °C’de 2 saat inkübe edildi. Daha sonra organoidler PBS ile yıkanmış, kademeli etanol solüsyonlarında (%50, %70, %80, %90, %95 ve %99,5 ila %100) dehidrate edilmiş ve Epon içine gömülmüştür. Ultra ince kesitler (70-110 nm) Leica UC7 ultramikrotom kullanılarak elmas bıçakla dilimlenmiş ve form çubuğu ve karbon film ile kaplanmış 50 gözlü bakır ızgaralara yüklenmiştir. Kesitler RT’de 15 dakika uranil asetat ve kurşun sitrat ile boyandı. TEM görüntüleri, TEM dijital kameralı (NanoSprint500, Hitachi) bir TEM (H-7500, Hitachi, Tokyo, Japonya) kullanılarak hazırlanmıştır.
2.10. İlaçtedavisivehücrecanlılığıdeneyi
cMM organoidlerinin ve 2D hücrelerin hücre canlılığı daha önce tarif edildiği gibi gerçekleştirilmiştir [6,39]. Karboplatin, doksorubisin, sisplatin ve gemsitabin için uygun konsantrasyonlar, klinik ve farmakokinetik verilerdeki kan terapötik seviyelerine göre belirlenmiştir [11, 43-45]. Hem cMM organoidleri hem de 2D hücreler PBS ile yıkandı ve 5 mM EDTA/PBS ile muamele edildi ve ardından TrypLE kullanılarak tripsinize edildi. Organoidler için, tripsinize edildikten sonra, organoid hücreler bir hücre süzgecinden (70 μm) geçirilmiştir. Ardından, hem organoidler hem de 2D hücreler FBS ile nötralize edildi ve sayıldı. Yaklaşık 2 × 103 organoid hücresi 10 μl Matrigel veya 2D hücrelere kültür ortamıyla birlikte 96 gözlü kültür plakalarına gömülmüş ve 24 saat boyunca inkübe edilmiştir. Daha sonra hücreler DMSO veya her bir ilaçla şu şekilde muamele edilmiştir: 72 saat boyunca karboplatin (0.1, 1, 10 ve 100 μg/ml), doksorubisin (0.1, 1, 10 ve 100 μM), sisplatin (0.1, 1, 10 ve 100 μM) veya gemsitabin (0.1, 1, 10 ve 100 μM). Hücre canlılığı PrestoBlue kiti (Thermo Fisher Scientific Inc.) kullanılarak 585 nm emisyon dalga boyunda bir mikroplaka okuyucu (TECAN) ile analiz edilmiştir. Parlak alan görüntüleri ışık mikroskobu (BX-52) kullanılarak çekilmiş ve mikroplaka okuyucunun okumaları SigmaPlot yazılımı kullanılarak analiz edilmiş ve grafiklendirilmiştir.
2.11. RNA dizi analizi
RNA dizileme (RNA-Seq) analizi daha önce açıklandığı gibi gerçekleştirilmiştir [46]. Total RNA, üreticinin talimatları izlenerek NucleoSpin kiti (TaKaRa Bio Inc.) kullanılarak cMM organoidlerinden ve 2D hücrelerden ekstrakte edilmiştir. Her numune için ekstrakte edilen toplam RNA (10 ng), dizileme için veri kütüphaneleri oluşturmak üzere kullanılmıştır. Kütüphaneyi donatmak için bir Ribo-Zero Human Kit (Illu- mina, San Diego, CA, ABD) ve bir TruSeq Stranded Total RNA
2.12. Kantitatif gerçek zamanlı polimeraz zincir reaksiyonu
Total RNA, üreticinin talimatlarına göre NucleoSpin kiti (Takara Bio Inc, Japonya) kullanılarak cMM organoid örneklerinden ve cMM 2D hücre örneklerinden ekstrakte edilmiştir. Birinci iplik cDNA, QuantiTect Ters Transkripsiyon Kiti (Qiagen Hilden, Almanya) kullanılarak sentezlenmiştir. Kantitatif gerçek zamanlı PCR, bir QuantiTect SYBR I Kiti (Qiagen) ve bir StepOnePlus Gerçek Zamanlı PCR Sistemi (Applied Bio-systems, Waltham, MA, ABD) kullanılarak gerçekleştirilmiştir. Kantifikasyonda elde edilen 2-ΔΔCq yöntemi ve döngü eşiği (Ct) değerleri, mRNA bolluğundaki kat değişikliklerini hesaplamak için kullanılmıştır. Spesifik primer tasarımları Tablo 4’te gösterilmiştir.
2.13. İstatistikselanaliz
Veriler ortalama + SEM olarak gösterilmiştir. İstatistiksel değerlendirme SigmaPlot yazılımı ile tek yönlü varyans analizi (ANOVA) ve ardından Bonferroni testi kullanılarak yapılmıştır. P değerleri (iki kuyruklu) < 0.05 olduğunda, veriler istatistiksel olarak anlamlı kabul edilmiştir.
3. Sonuçlar
3.1. cMM hastası köpeklerin plevral efüzyon örneklerinden cMM organoidlerinin oluşturulması
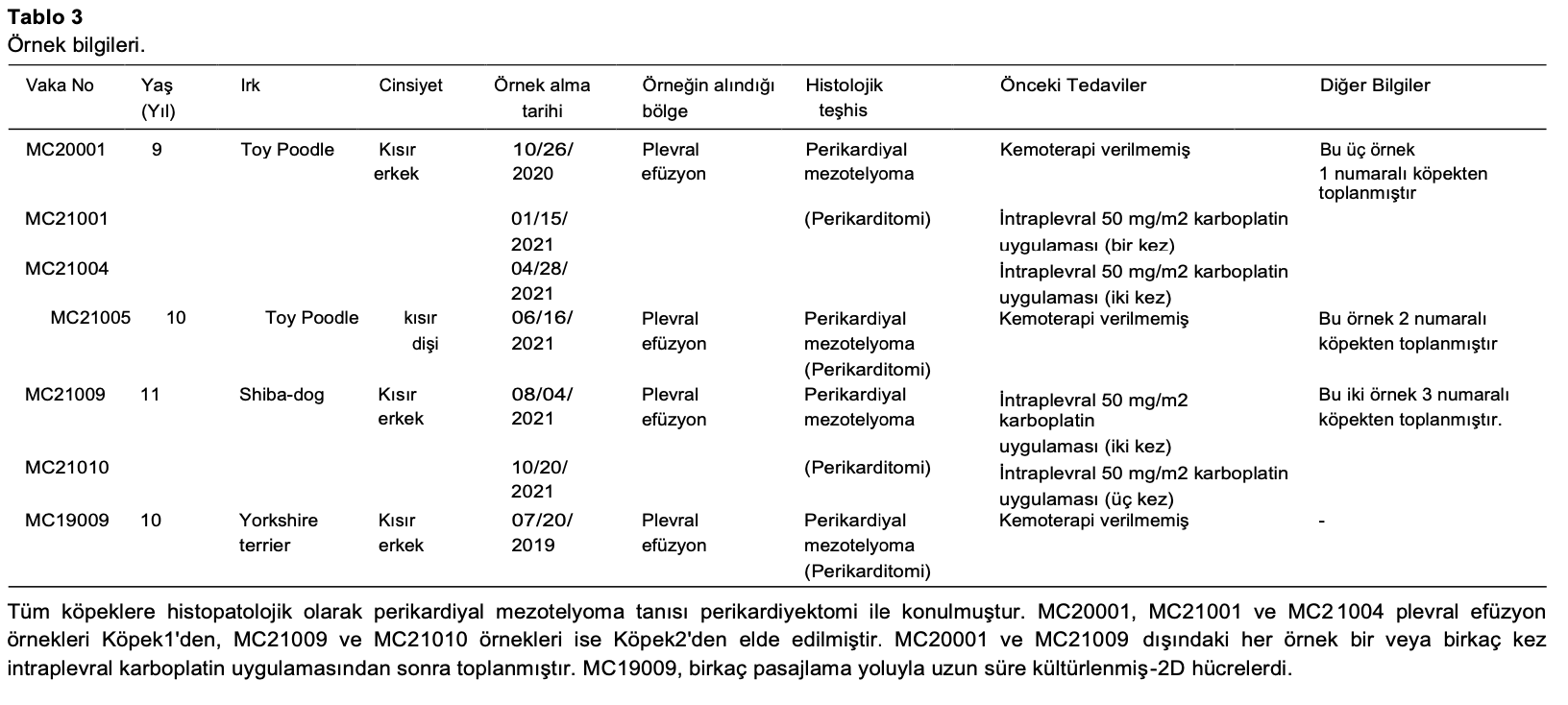
Mezotelyal hücreler, bilgileri Tablo 3’te gösterilen cMM’li köpeklerin plevral efüzyonundan toplanmıştır. Toplanan hücreler 2D kültür olarak 6 cm’lik tabaklara ve 3D kültür olarak Matrigel içeren 24 gözlü plakalara ekilmiştir (Şekil 1A). Plevral efüzyondan alınan tüm örnekler 3-7 gün kültürlendikten sonra başarılı bir şekilde küresel organoidler oluşturdu (Şekil 1B) ve birkaç pasajdan sonra büyümeye devam etti. cMM organoidleri sadece küresel değil lümen benzeri oluşumlar da göstermiştir (Şekil 1B, C).
Şeki 1. Köpek malign mezotelyoma (cMM) organoidlerinin oluşturulması. cMM organoidleri ve 2D kültür hücrelerinin üretimi ve karşılaştırmalı analizi prosedürünün şematik deneysel tasarımı (A). Mezotelyoma hücreleri malign mezotelyomalı köpeklerin plevral efüzyonundan toplanmıştır. Hücreler 2 boyutlu (2B) kültür olarak 6 cm’lik tabaklara ve 3 boyutlu (3B) kültür olarak Matrigel içeren 24 gözlü plakalara ekilmiştir. Birkaç kez pasajlamadan sonra hücreler hücre canlılığı, gen ifadesi ve histoloji açısından incelenmiştir. Parlak alan mikroskopisi (B) ve cMM organoidlerinin hematoksilen ve eozin (H&E) boyaması (C) için temsili görüntüler. Ölçek çubuğu: 100 μm (B) ve 25 μm (C). cMM organoidlerinin transmisyon elektron mikrografı (TEM) (D). Bir bütün organoid görüntüsü (a) ve büyütülmüş kısımları (b, c, d, e) gösterilmiştir. Kırmızı oklar mikrovillusları göstermektedir (c). Sarı oklar içme eylem hücrelerini göstermektedir (d). Yıldız işaretleri glikojen granüllerini göstermektedir (d). Beyaz daire mikrofilamentleri göstermektedir (e). Ölçek çubuğu: 10 μm (a), 2 μm (b) ve 600 nm (c, d, e).
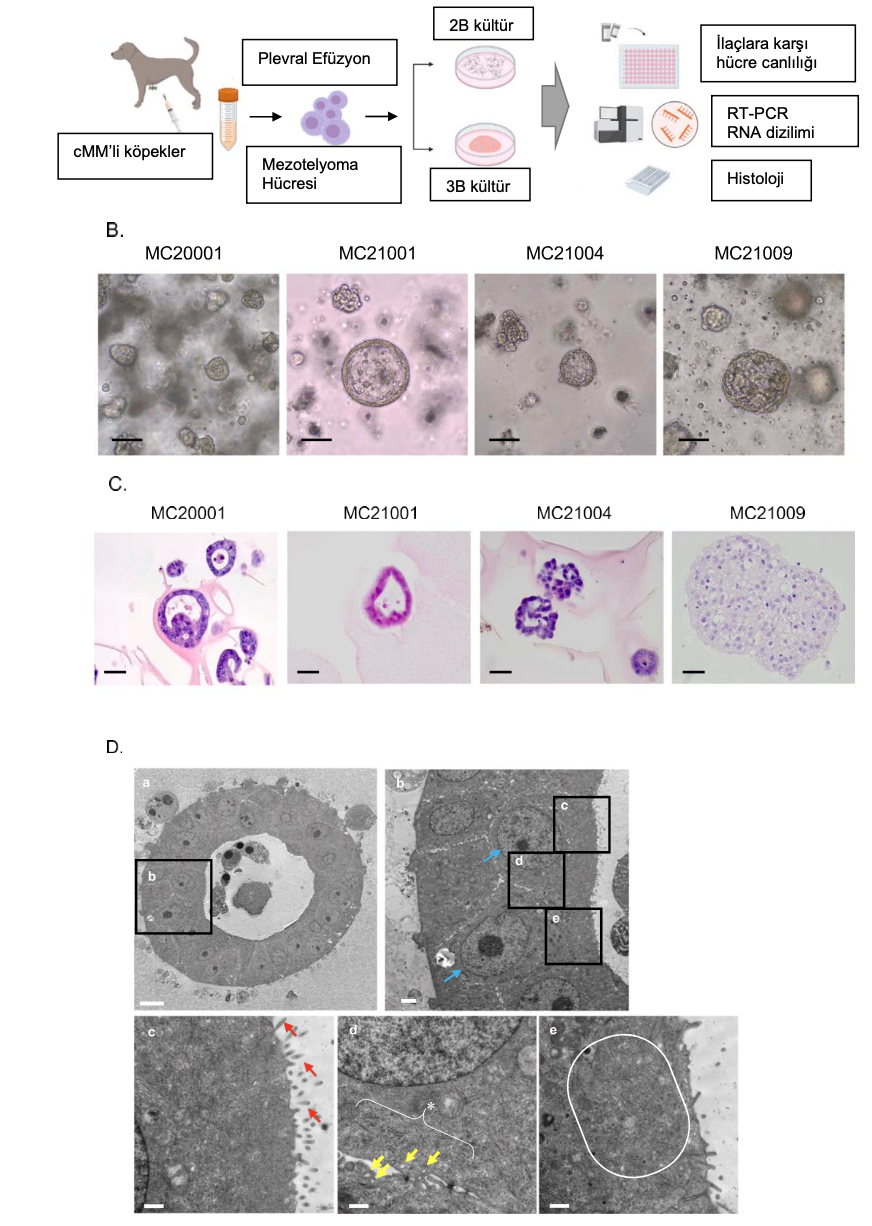
Şekil 2. CMM organoidleri için uygun ortam bileşenlerinin değerlendirilmesi. CMM organoidleri için uygun ortam bileşenlerinin değerlendirilmesine ilişkin deneysel şema (A). Aynı sayıda hücre ekildikten sonra yalnızca temel ortamda (Cont) veya farklı kültür takviyeleriyle kültürlenen cMM organoidlerinin (MC20001) büyümesinin faz kontrast görüntüleri. WNR, Wnt 3a, Noggin ve R-spondini göstermektedir. Ölçek çubuğu: 100 μm (B). Her kültür ortamındaki organoidlerin hücre çoğalma oranı (C, n = 3). Sonuçlar kontrole göre misli artış olarak gösterilmiş ve ortalama ± S.E.M. olarak ifade edilmiştir. *Kontrole kıyasla P < 0.05.
Çoğu cMM organoidi büyüme hızını kademeli olarak azaltmış olsa da, büyüme nihayet beş ila altı pasajdan sonra durmuştur. cMM organoidlerinin (MC20001) TEM görüntüleri belirgin nükleol ve ökromatin dağılımı (Şekil 1D. a, b), iyi gelişmiş mikrovilluslar (Şekil 1D. c), çok sayıda içme eylem hücresi ve glikojen granülleri (Şekil 1D. d), rastgele düzenlenmiş mikrofilamentler (Şekil 1D. e) göstermiştir. Bu gözlemler MM’nin özelliklerine karşılık geldiğinden, kurulan cMM organoidlerimizin malign mezotelyoma özelliklerini yansıttığı sonucuna varılmıştır.
Öte yandan, cMM 2D kültür hücreleri de plevral efüzyon örneklerinden üretilmiş ve MC21001 hariç çoğu örnek mezenkimal
benzeri morfoloji göstermiştir (Ek Şekil 1A). MC21001 2D hücreleri başlangıçta mezenkimal benzeri morfoloji sergilemiş, pasajlama yoluyla epitel benzeri hücrelere dönüşmüştür (Ek Şekil 1A). cMM organoidlerinin aksine, cMM 2D hücreleri 10 kereden fazla pasajlamadan sonra büyümeye devam etmiştir.
3.2. cMM organoidleri için uygun ortam bileşenlerinin değerlendirilmesi
HMM hücrelerinin 2D kültürü için RPMI ve DMEM ortamlarının kullanıldığı rapor edilmesine rağmen [45,48], MM organoidlerinin kültürü için uygun ortam koşulları rapor edilmemiştir.
Bu nedenle, cMM organoidleri için uygun ortam bileşenlerini araştırdık. Yaklaşık 2×103 cMM organoid hücresi 96 gözlü bir plakaya ekilmiş ve 7 gün boyunca kültürlendikten sonra çoğalma oranları bir mikroplaka okuyucu kullanılarak değerlendirilmiştir (n=3) (Şekil 2A). 7. günde, WNR, EGF veya FGF2 içeren temel ortam (Cont) kullanıldığında proliferasyon oranı önemli ölçüde daha yüksekti (Şekil 2B, C). FGF7, FGF10 ve IGF’nin kontrole kıyasla önemli bir etkisi yoktu. Bu verilere dayanarak, WNR, EGF ve FGF2’yi cMM organoid kültürü için en iyi bileşenler olarak seçtik (Şekil 2C, Tablo 1).
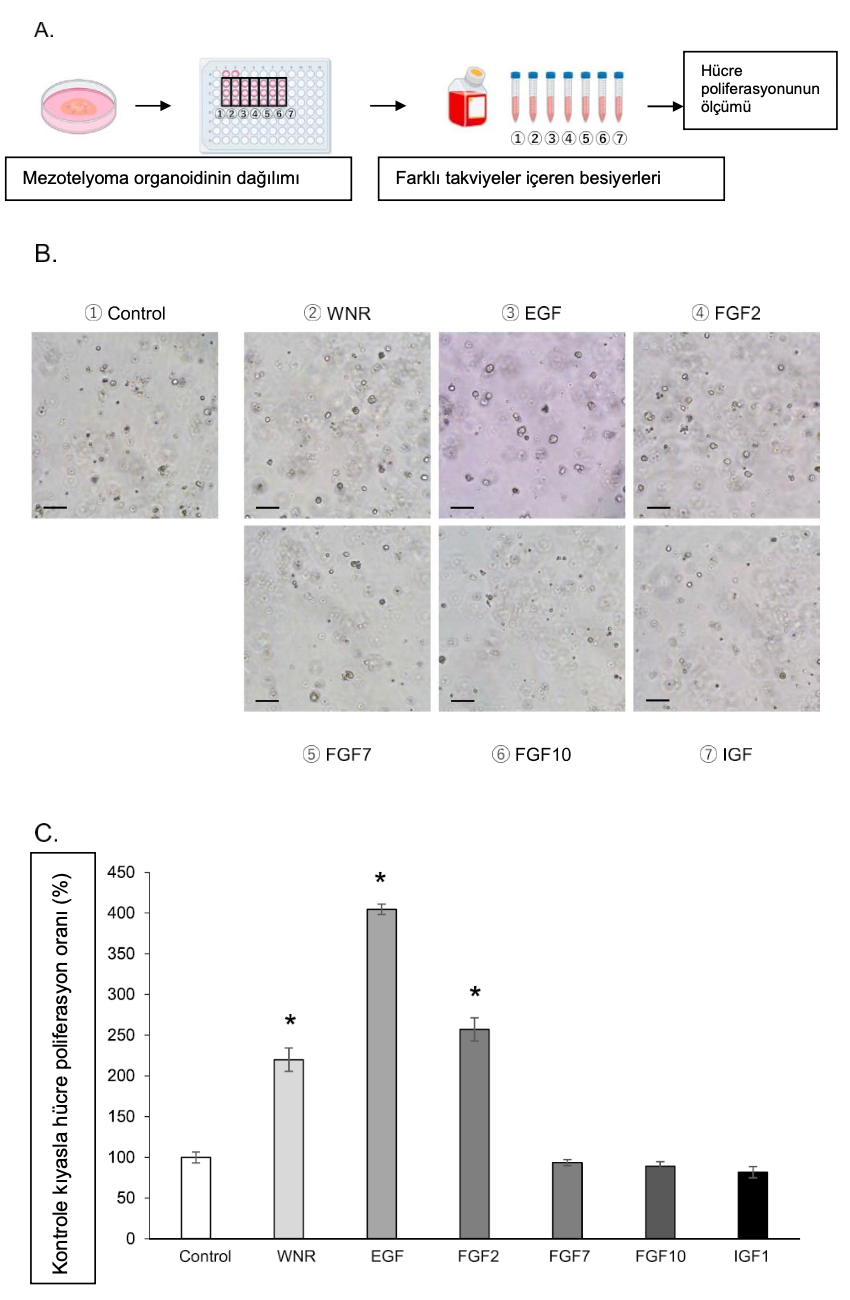
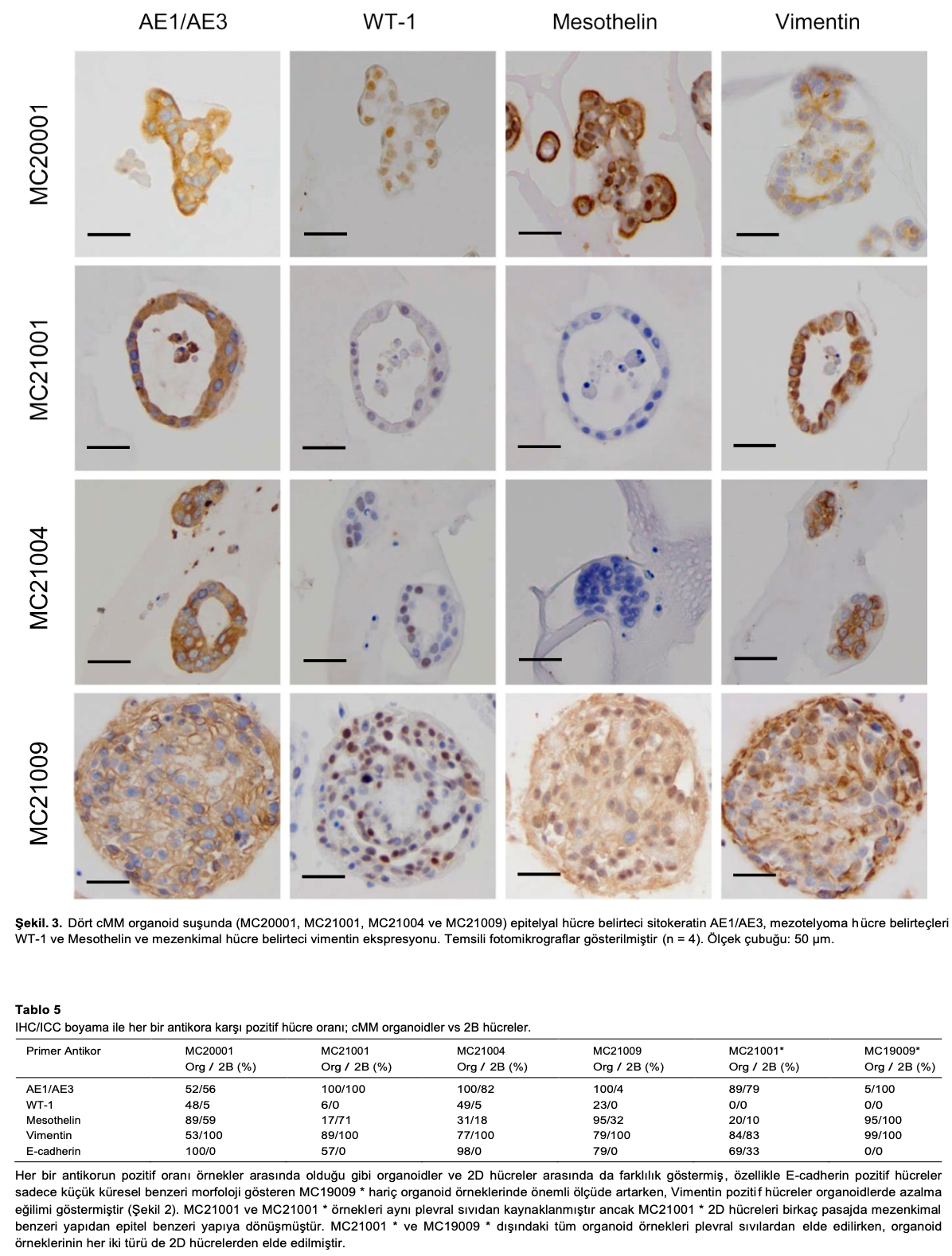
3.3. cMMorganoidlerindemezotelyomahücrebelirteçlerininekspresyonu
IHC boyama deneyinde, her bir cMM organoid suşunda bir epitel hücre belirteci olan sitokeratin AE1/AE3, mezotelyoma hücre belirteçleri olan WT-1 ve Mesothelin ve bir mezenkimal hücre belirteci olan vimentin ekspresyonu gözlenmiştir (Şekil 3). Sitokeratin AE1/AE3 ve vimentin için pozitif hücreler diğer iki antikora göre daha yüksekti. Ayrıca, pozitif hücrelerin oranı her organoid örneği arasında ve ayrıca organoid ve 2D hücreler arasında farklılık göstermiştir (Tablo 5). cMM 2D hücreleri de aynı antikorlar için ICC boyamasıyla değerlendirilmiştir (Ek Şekil 1B). Sitokeratin AE1/AE3 ve vimentin ekspresyonu 2D hücrelerin her bir türünde de gözlenmiş olsa da (Ek Şekil 1B), WT-1 ve Mesothelin ekspresyonu bazı türlerde nadiren gözlenmiştir.
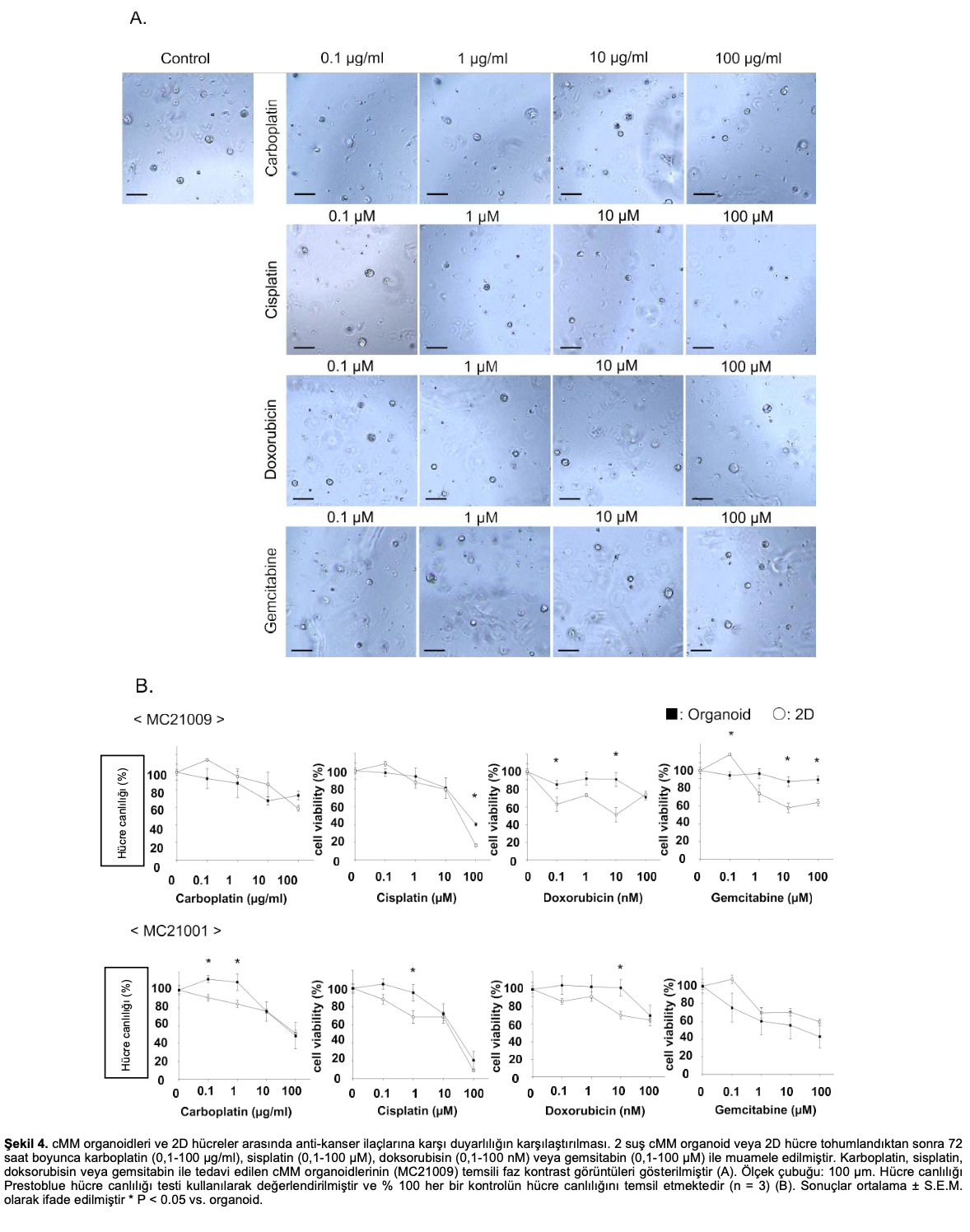
3.4. cMMorganoidlerive2Dhücrelerarasındaanti-kanser ilaçlarına karşı duyarlılığın karşılaştırılması
Anti-kanser ilaçlarına duyarlılığı kontrol etmek için preklinik bir model olarak cMM organoidlerinin faydasını kanıtlamak amacıyla, daha önce açıklandığı gibi (n=3) organoidleri 2D hücrelerle dört ilaca (karboplatin, sisplatin, doksorubisin ve gemsitabin) karşı karşılaştırarak cMM’nin ilaç duyarlılığını inceledik [6,49,50]. Farklı ilaç koşulları altında MC21009 organoidlerinin temsili görüntülerinde gösterildiği gibi, yüksek konsantrasyonda sisplatin ile tedavi MC21009 organoidlerinin hücre canlılığını büyük ölçüde azaltırken, karboplatin, doksorubisin veya gemsitabin ile tedavi kısmen azaltmıştır (Şekil 4A, B). MC21009 organoidlerinde, düşük konsantrasyonlarda doksorubisin veya yüksek konsantrasyonlarda gemsitabin ile tedavi, 2D hücrelere kıyasla hücre canlılığını daha az azaltmıştır. Karboplatin veya sisplatin ile tedavi hücre canlılığında benzer inhibisyon göstermiştir (Şekil 4B). MC21001 organoidlerinde, düşük konsantrasyonlarda karboplatin, sisplatinveya doksorubisin ile tedavi 2D hücrelere kıyasla hücre canlılığını daha az azaltmıştır. Öte yandan, en yüksek karboplatin, sisplatin veya doksorubisin konsantrasyonuyla muamele, hücre canlılığında benzer inhibisyon göstermiştir (Şekil 4B). Organoid ve 2D hücrelerdeki her bir anti-kanser ilacı için IC50 değerleri Tablo 6’da gösterilmiştir.
3.5. ComparisonofgeneexpressionprofilebetweencMMorganoidsand 2D cells
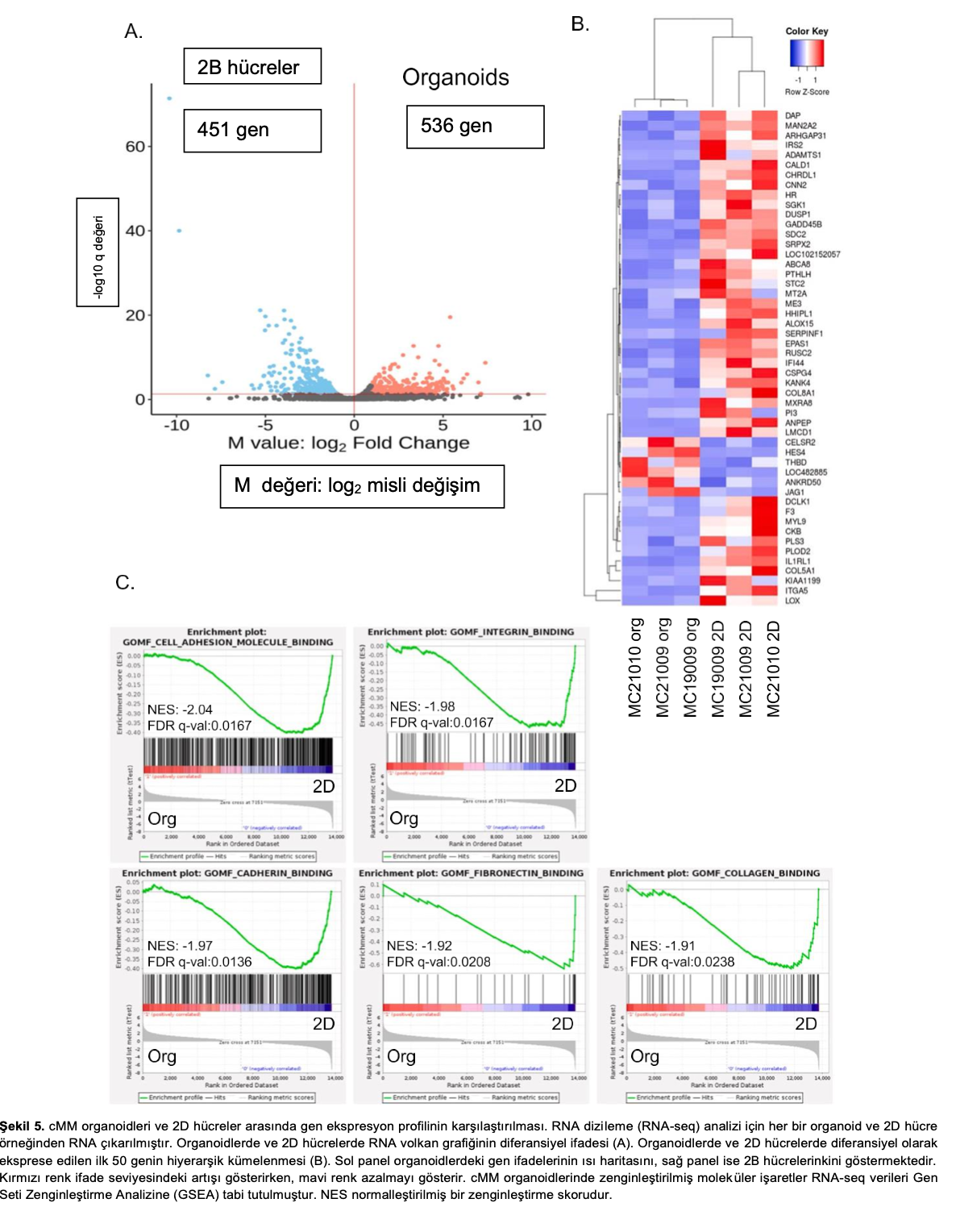
CMM organoidleri ve 2D hücreler arasındaki gen ekspresyonu farklılıklarını araştırmak için, RNA-seq ile üç suş cMM organoidi ve 2D hücrenin gen ekspresyon seviyesini analiz ettik. 987 genin ifade düzeyi organoidler ve 2D hücreler arasında önemli ölçüde farklıydı. Bunlar arasında 536 gen organoidlerde yukarı regüle edildi (Şekil 5 A).
Organoidlerde veya 2D hücrelerde önemli ölçüde yukarı regüle edilen ilk 50 gen bir ısı haritası olarak gösterilmiştir (Şekil 5B). Gen Seti Zenginleştirme Analizi (GSEA), cMM organoidlerinin 2D hücrelere kıyasla hücre yapışma molekülü bağlanması, integrin bağlanması ve cadherin bağlanma yolları gibi hücre bağlanmasıyla ilgili sinyallerle önemli ölçüde zenginleştirildiğini göstermiştir (Şekil 5 C). İlginç bir şekilde, mezotelin mRNA ekspresyonu 3D organoidlerde daha yüksek olma eğilimindeyken, WT-1 mRNA ekspresyonu suşlar arasında farklılık göstermiştir (Ek Şekil 2).
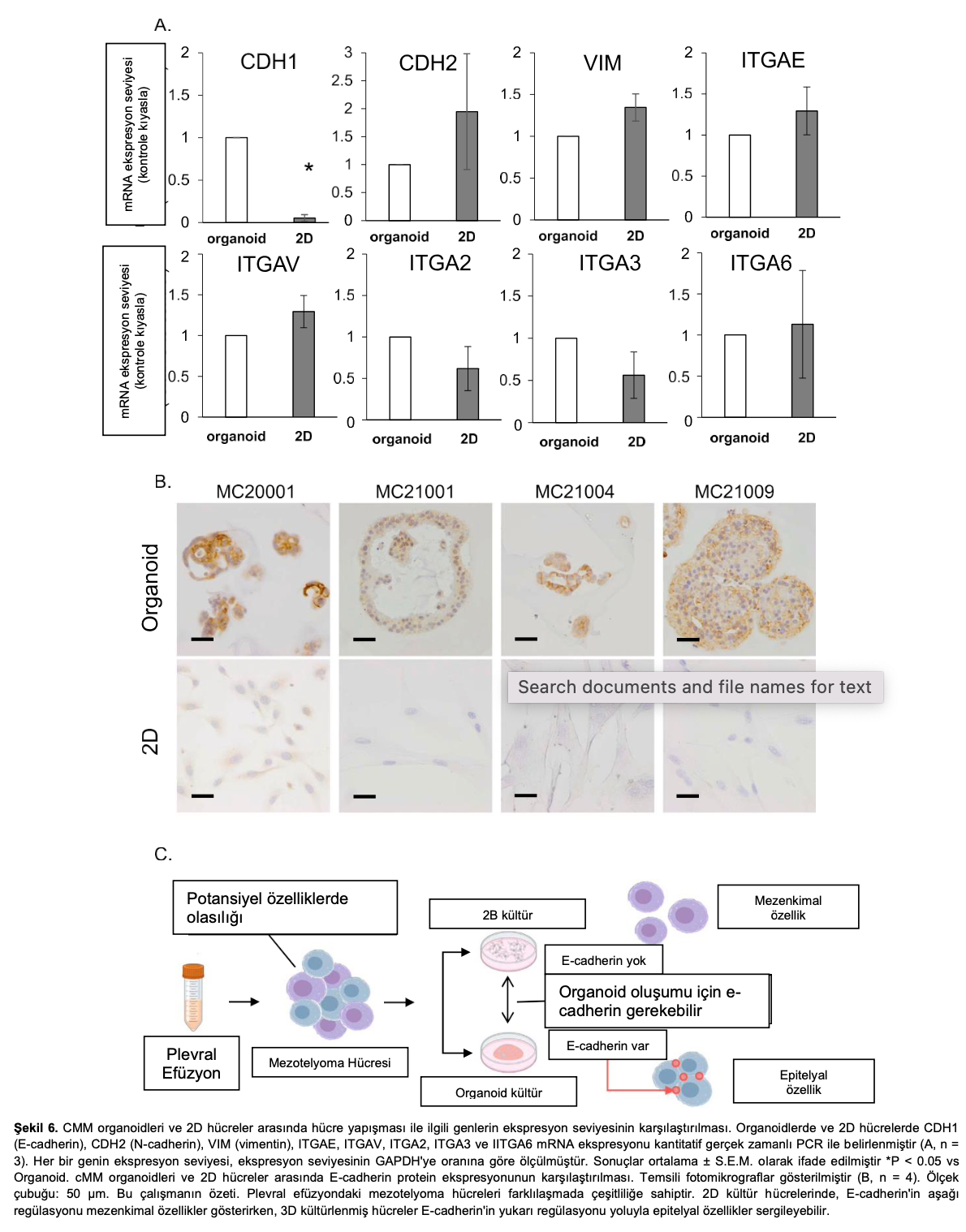
3.6. cMMorganoidlerindeve2Dhücrelerdehücrebağlanmasıyla ilgili molekül ekspresyonları
RNA-seq ve GSEA sonuçlarından, hücre bağlarıyla ilişkili bazı moleküllerin ekspresyonunu kantitatif gerçek zamanlı PCR ile değerlendirdik (n=4). CDH1 (E-cadherin) hücre zarında ve bağlayıcı hücrede eksprese edilen bir epitelyal marker olarak bilinirken, CDH2 ( N-cadherin) ve Vimentin’in (VIM) mezenkimal hücrelerde arttığı veya epitelyal-mezenkimal geçiş (EMT) ile ilişkili olduğu bilinmektedir. İntegrin alt birimi alfa (ITGA), ITGAE, ITGAV ve ITGA2, 3, 6 gibi geniş bir alt tip ailesine sahiptir ve bunlar hücre-hücre adezyonu ve kanser invazyonu ile ilişkilidir (Şekil 6A). CDH2 ve VIM organoidlerde 2D hücrelere kıyasla azalma eğilimi gösterirken, CDH1 organoidlerde önemli ölçüde artmıştır (Şekil 6A). E-cadherin’in protein ifadesini doğrulamak için IHC veya ICC boyama deneyi yapıldı. Kantitatif gerçek zamanlı PCR sonuçlarında olduğu gibi, E-cadherin ekspresyonu her bir cMM organoid türünde yüksek oranda tespit edilmiş ancak 2D hücrelerde tespit edilmemiştir (Şekil 6B).
4. Tartışma
Bu çalışmada, cMM organoidleri plevral efüzyondan başarılı bir şekilde üretilmiş ve özellikle hücre yapışması ile ilgili özelliklerdeki farklılıklar cMM 2D hücreleri ile karşılaştırılarak ortaya konmuştur. Mevcut çalışmanın ana bulguları aşağıdaki gibidir: 1) Plevral efüzyondan türetilen cMM organoidleri küresel veya lüminal bir morfoloji göstermiş ve mezotelyoma belirteçlerini, mezotelyal hücre özelliklerini ve malign özellikleri ifade etmiştir (Şekil 1 ve 3), 2) EGF, FGF2 ve WNR, cMM organoidlerinin optimum büyümesi için gereklidir (Şekil 2 ve 3). CMM organoidleri her bir anti-kanser ilacının düşük konsantrasyonlarına karşı 2D hücrelerden daha fazla direnç gösterirken, yüksek anti-kanser ilaç konsantrasyonları altında organoidler ve 2D hücreler arasında çok az fark bulunmuştur (Şekil 4), 4) CMM 2D hücreleriyle karşılaştırıldığında, plevral efüzyondan elde edilen cMM organoidleri E-cadherin gibi hücre yapışma moleküllerinde farklı özelliklere sahiptir (Şekil 5 ve 6). T oplu olarak, elde ettiğimiz veriler cMM organoidlerinin 2D hücrelerinden farklı özellikler ortaya koyduğunu ve MM tedavisi için yeni bilgiler sağlamak üzere MM için yeni bir deneysel model olarak kullanılabileceğini göstermektedir.
MM’nin histolojik sınıflandırması memeliler arasında yaygındır ve genellikle DSÖ sınıflandırmasına göre insan MM’sine (hMM) benzer şekilde epiteloid (esas olarak epitel şeklindeki hücrelerden oluşur), sarkomatoid (esas olarak iğ şeklindeki hücrelerden oluşur) veya bifazik (her iki hücre tipinden oluşur) olarak ayrılır [51-56]. hMM’nin histolojik analizi orijinal doku örnekleri ve in situ hibridizasyon kullanılarak rapor edilmiştir [55]. Mezotelyoma hastalarından alınan plevral sıvı ve doku örnekleri kullanılarak çeşitli MM hücre hatları oluşturulmuştur [19,45,57-60] ve yeni terapötik alternatifler aramak için genetik analize tabi tutulmuştur.
Ayrıca, asbest maruziyeti [61-63] veya vektör virüsler kullanılarak genetik mühendisliği [61, 64-67] ile indüklenen MM’nin murin modelleri de geliştirilmiştir. Ancak bu modeller, hayvan türlerindeki farklılıklar ve bağışıklık eksikliği nedeniyle orijinal tümörün davranışını tam olarak yansıtamamıştır [69,6168]. Bu modeller MM hakkında çeşitli veriler sunsa da, hala yetersizdir ve bu modellerin hassas tıp için uygulanmasında sınırlamalar vardır. Bu nedenle, hastadan türetilen yeni modellerin geliştirilmesi daha uygun ve büyük ilgi görecektir.
Hasta kaynaklı tümör organoid modelleri, yetişkin kök hücrelerden yetiştirilebilen ve 3D hücresel yapılara kendi kendine organize olabilen 3D kültür modelleridir ve orijinal dokunun özelliklerini [70,71] ve bireyler arasındaki tümör içi ve tümörler arası heterojenliği [72,73] yansıtır. Sferoidler [23,25,74] ve organoidler [26,27,61] olarak MM 3D kültürleri hakkında raporlar bulunmaktadır. Çeşitli tümör ve hastalıklarda köpekler ve insanlar arasındaki benzerliklere atıfta bulunulmuş ve köpek tümörü araştırması insanlar için preklinik bir model olarak önerilmiştir [75]. Bu çalışmada, ilk kez cMM’li farklı köpeklerden alınan plevral efüzyonu kullanarak cMM organoidleri oluşturduk (Şekil 1) ve TEM görüntüleri bu organoidlerin MM hücrelerinin ince yapısını yansıtabildiğini gösterdi (Şekil 1D). Ayrıca, IHC boyamasıyla, cMM organoidleri sitokeratin, vimentin ve mezotelyoma belirteçlerini (WT-1 ve mezotelin) eksprese etmiştir (Şekil 3) ve bunlar çeşitli insan çalışmalarında da rapor edilmiştir [54, 76]. Bu veriler, oluşturduğumuz cMM organoidlerinin cMM özelliklerini koruduğunu göstermiştir.
MM organoidleri için kültür ortamı göz önüne alındığında, hMM üzerine yapılan çalışmaların çoğunda MM 2D hücrelerinin [45,48,57] ve 3D kültürlerinin [26,27,57] kültürlenmesi için RPMI veya DMEM kullanıldığı rapor edilmiştir. Günümüzde MM organoidleri için uygun kültür ortamı içeriklerini inceleyen az sayıda makale bulunmaktadır. Kim ve arkadaşları mezotelyomaya özgü bir besiyeri olan LHC-MM’de (Lechner and LaVeck medium; Biosource International, Camarillo, CA)mezotelyoma sferoid oluşumunun gözlenmediğini bildirmiştir [23]. Tsugeno’nun grubu, EGFR’yi aşırı eksprese ettiği bilinen bir mezotelyoma hücre hattı olan MSTO’nun hücre proliferasyon oranının, DMEM besiyerine kıyasla STK1 ve STK2 (DS Pharma Biomedical Co., Ltd., Osaka, Japonya) gibi serumsuz besiyerlerinde kültürlendiğinde önemli ölçüde azaldığını tanımlamıştır [77]. Bu çalışmada, cMM organoidlerinin optimum büyümesi için gerekli olan uygun ortam ve takviyelerin gelişmiş DMEM/F12 ve %50 W, N, R, EGF ve FGF2 olduğunu ilk kez gösterdik (Şekil 2, Tablo 1). Bu durum, Wnt, EGFR ve FGFR sinyalizasyonunun muhtemelen kMM organoid büyümesinde önemli rolleri olduğunu ve dolayısıyla bunların hedeflenmesinin cMM tedavisinde yardımcı olabileceğini düşündürmektedir. EGFR’nin hMM hastalarının çoğunda sıklıkla aşırı eksprese edildiği görülmüştür [78- 80] ve tedavi amaçlı olarak hedeflenmiştir [81,82]. Ayrıca, bazı çalışmalar FGFR ekspresyonunun hMM ve ilaç direncinde rol oynadığını [83,84] ve FGFR1 ve FGF2’nin yüksek oranda birlikte eksprese edildiği hMM hücre hatları olduğunu öne sürmüştür [83,85].
Son yıllarda kanser tedavilerinde kaydedilen ilerlemelere rağmen, geleneksel kemoterapötik ajanlara ve yeni hedefe yönelik ilaçlara karşı direnç hala temel sorun olmaya devam etmektedir [87-89]. Bazı çalışmalar, 3B’de kültürlenen hMM hücrelerinin çok hücreli direnç olarak adlandırılan bir özellik kazanabileceğini, yani sferoidlerin veya organoidlerin apoptoza veya ilaçlara direnme eğiliminde olduğunu, bunun da in vivo olarak gözlemlenen kemorezistansı taklit ettiğini ve katı tümörlerin karmaşıklığının bir kısmını etkili bir şekilde yeniden taklit edebileceğini bildirmiştir [25,90,91]. Bu çalışmada, cMM organoidleri çoğu anti-kanser ilacına karşı 2D hücrelere göre direnç gösterirken, hem organoidler hem de 2D hücreler sisplatine nispeten duyarlıydı (Şekil 4B). Organoidlerin ilaç taramasına duyarlılığı hastaların ilaçlara verdiği yanıta benzer olduğundan, oluşturduğumuz cMM organoidleri cMM hastalığında hassas tıp amaçları için yararlı olabilir.
Tümör ilerlemesi ve metastaz potansiyellerinin, neoplastik hücrelerin epitelyal bütünlüğünü ve polaritesini kaybetmesine, damar
Biomedicine & Pharmacotherapy 162 (2023) 114651
12
içine girmesine ve kan dolaşımında hayatta kalmasına ve diğer organlarda kolonileşmesine izin veren yapışma özelliklerindeki değişikliklerle ilişkili olduğu gösterilmiştir [92]. Bazı raporlar, plevral sıvıların sitolojik analizinin genellikle malignite ile güçlü bir şekilde bağlantılı olan hMM hücrelerinin serbest sferoidal agregatlarının varlığını ortaya koyduğunu ve bunların plevral sıvıda hayatta kalma eğilimine sahip olduklarını göstermiştir [93, 94]. Serum ve plevral sıvı çözünür hücre adezyon molekülleri, E-cadherin ve hücreler arası adezyon molekülü-1 seviyelerinin hMM hastalarında sağlıklı kontrollerle karşılaştırıldığında önemli ölçüde yükseldiği [95,96] ve etkili adezyon ve hastalık ilerlemesi için gerekli olduğu gösterilmiştir [96,97]. Ayrıca hMM’de yüksek E-cadherin ekspresyonunun terapötik dirençle ilişkili olduğu belirtilmiştir [98]. Mevcut çalışmamızda, kMM hücreleri organoidlerde 2D hücrelere göre daha yüksek E-cadherin ekspreseetmiştir (Şekil 6A, B). Verilerimiz göz önüne alındığında, kMM organoidleri muhtemelen plevral sıvıdaki davranış ve özelliklerini korumakta ve malignitelerini 2D hücrelerden daha fazla muhafaza etmektedir (Şekil 6C).
5. Sonuç
Plevral efüzyon örneklerinden ilk kez cMM organoidleri ürettik. KMM organoidleri küresel veya lüminal bir morfoloji sergiledi, mezotelyoma belirteçlerini eksprese etti ve yüksek hücre adezyon özellikleri gösterdi. EGF, FGF2 ve WNR’nin cMM organoidlerinin optimum büyümesi için gerekli olduğu görülmüştür. cMM organoidleri, çeşitli anti-kanser ilaçlarına ve diferansiyel gen ekspresyon profillerine karşı karşılık gelen 2D hücrelerine göre daha fazla direnç göstermiştir. Bu veriler, oluşturduğumuz cMM organoidlerinin orijinal tümör histolojisini yansıtabileceğini ve insan ve köpek MM tedavisi için yeni bilgiler sağlamak üzere MM için yeni bir deneysel model olarak kullanılabileceğini göstermektedir. 3D cMM organoid modelimiz, mezotelyomaların iki veya üç boyutlu davranışlarındaki benzersiz farklılıkları karşılaştırmak veya adezyon moleküllerinin ekspresyonunu ve tümör dinamiklerini incelemek için uygulanabilecek yeni bir deneysel araç olarak potansiyele sahip olacaktır.
CRediT yazarlık katkısı beyanı
Tüm yazarlar makalenin gönderilmesini onaylamış ve herhangi bir çıkar çatışması olmadığını beyan etmişlerdir. Mohamed Elbadawy, Yomogi Sato, Haru Yamamoto, Yusuke Ishihara, Rina Nabeta ve Amira Abugomaa deneyleri gerçekleştirmiştir. Yomogi Sato Kazuhiko Suzuki ve Yusuke Ishihara patolojik deneyleri gerçekleştirmiştir. Ryouichi Tsunedomi ve Hiroaki Nagano RNA dizileme analizini gerçekleştirmiştir. Daigo Azakami, Tsuyoshi Uchide ve Ryuji Fukushima köpek sahiplerini bilgilendirmiş ve hastalıklı köpeklerden örnekler toplamıştır. Yuta Shinohara ve Masahiro Kaneda deneysel araç ve kaynak sağlamıştır. Hideyuki Yamawaki makaleyi revize etmiştir. Tatsuya Usui ve Kazuaki Sasaki çalışmayı tasarladı, verileri analiz etti ve yorumladı ve makaleyi yazmıştır.
Çıkar Çatışması Beyanı
Yazarlar herhangi bir maddi ve manevi çıkar beyan etmemişlerdir.
Veri Erişim Beyanı
Veriler talep edilmesi halinde temin edilecektir.
Ek A. Ek bilgiler
Bu makaleye ilişkin ek bilgiler doi:10.1016/j.biopha.2023.114651 adresindeki çevrimiçi versiyonda bulunabilir.
Kaynakça
[1] K. Kawanishi, Diverse properties of the mesothelial cells in health and disease, Pleura Perito 1 (2) (2016) 79–89.
- [2] E. Hiriart, R. Deepe, A. Wessels, Mesothelium and malignant mesothelioma, J. Dev. Biol. 7 (2) (2019).
- [3] R. Tranchant, F. Montagne, M.C. Jaurand, D. Jean, Molecular heterogeneity of malignant pleural mesotheliomas, Bull. du Cancer 105 (1) (2018) 35–45.
- [4] J.L. Sauter, S. Dacic, F. Galateau-Salle, R.L. Attanoos, K.J. Butnor, A. Churg, A. N. Husain, K. Kadota, A. Khoor, A.G. Nicholson, V. Roggli, F. Schmitt, M.-S. Tsao, W.D. Travis, The 2021 WHO classification of tumors of the pleura: advances since the 2015 classification, J. Thorac. Oncol. 17 (5) (2022) 608–622.
- [5] S. Dacic, Pleural mesothelioma classification—update and challenges, Mod. Pathol. 35 (1) (2022) 51–56.
- [6] M. Elbadawy, T. Usui, T. Mori, R. Tsunedomi, S. Hazama, R. Nabeta, T. Uchide, R. Fukushima, T. Yoshida, M. Shibutani, T. Tanaka, S. Masuda, R. Okada,
R. Ichikawa, T. Omatsu, T. Mizutani, Y. Katayama, S. Noguchi, S. Iwai,
T. Nakagawa, Y. Shinohara, M. Kaneda, H. Yamawaki, K. Sasaki, Establishment of a novel experimental model for muscle-invasive bladder cancer using a dog bladder cancer organoid culture, Cancer Sci. 110 (9) (2019) 2806–2821. - [7] A. Abugomaa, M. Elbadawy, H. Yamamoto, H. Ayame, Y. Ishihara, Y. Sato, H. Yamawaki, M. Kaneda, T. Usui, K. Sasaki, Establishment of a direct 2.5D organoid culture model using companion animal cancer tissues, Biomed. Pharmacother. 154 (2022), 113597.
- [8] M. Elbadawy, K. Fujisaka, H. Yamamoto, R. Tsunedomi, H. Nagano, H. Ayame,
Y. Ishihara, T. Mori, D. Azakami, T. Uchide, R. Fukushima, A. Abugomaa,
M. Kaneda, H. Yamawaki, Y. Shinohara, T. Omatsu, T. Mizutani, T. Usui, K. Sasaki, Establishment of an experimental model of normal dog bladder organoid using a three-dimensional culture method, Biomed. Pharmacother. 151 (2022), 113105. - [9] A. Abugomaa, M. Elbadawy, H. Yamawaki, T. Usui, K. Sasaki, Emerging roles of cancer stem cells in bladder cancer progression, tumorigenesis, and resistance to chemotherapy: a potential therapeutic target for bladder cancer, Cells 9 (1) (2020) 235.
- [10] H. Yamamoto, M. Elbadawy, K. Fujisaka, Y. Sato, T. Ohmori, Y. Shinohara,
Y. Hatano, D. Kobayashi, A. Gomyo, Y. Sudo, D. Azakami, T. Uchide, R. Fukushima, S.Morita,A.Abugomaa,H.Yamawaki,M.Kaneda,T.Usui,K.Sasaki,Evaluationof the safety and feasibility of apheresis in dogs: for application in metastatic cancer research, Animals 11 (10) (2021) 2770. - [11] H.L. Moberg, I. Gramer, I. Schofield, L. Blackwood, D. Killick, S.L. Priestnall,
A. Guill ́en, Clinical presentation, treatment and outcome of canine malignant mesothelioma: a retrospective study of 34 cases, Vet. Comp. Oncol. 20 (1) (2022) 304–312. - [12] E. Milne, Y. Martinez Pereira, C. Muir, T. Scase, D.J. Shaw, G. McGregor,
L. Oldroyd, E. Scurrell, M. Martin, C. Devine, H. Hodgkiss-Geere, Immunohistochemical differentiation of reactive from malignant mesothelium as a diagnostic aid in canine pericardial disease, J. Small Anim. Pract. 59 (5) (2018) 261–271. - [13] J.H. Kim, Y.K. Choi, H.Y. Yoon, O.K. Kweon, D.Y. Kim, Juvenile malignant mesothelioma in a dog, J. Vet. Med. Sci. 64 (3) (2002) 269–271.
- [14] S.A. Vural, Z. Ozyildiz, S.Y. Ozsoy, Pleural mesothelioma in a nine-month-old dog, Ir. Vet. J. 60 (1) (2007) 30–33.
- [15] A.L. Hudson, C. Weir, E. Moon, R. Harvie, S. Klebe, S.J. Clarke, N. Pavlakis, V. M. Howell, Establishing a panel of chemo-resistant mesothelioma models for investigating chemo-resistance and identifying new treatments for mesothelioma, Sci. Rep. 4 (2014) 6152.
- [16] A.S. Moore, C. Kirk, A. Cardona, Intracavitary cisplatin chemotherapy experience with six dogs, J. Vet. Intern. Med. 5 (4) (1991) 227–231.
- [17] E.P. Spugnini, S. Crispi, A. Scarabello, G. Caruso, G. Citro, A. Baldi, Piroxicam and intracavitary platinum-based chemotherapy for the treatment of advanced mesothelioma in pets: preliminary observations, J. Exp. Clin. Cancer Res.: CR 27 (1) (2008) 6.
- [18] K.W. Seo, U.S. Choi, Y.C. Jung, S.J. Hong, Y.E. Byeun, M.S. Kang, B. Pachrin, W. H. Kim, C.Y. Hwang, D.Y. Kim, H.Y. Youn, C.W. Lee, Palliative intravenous cisplatin treatment for concurrent peritoneal and pleural mesothelioma in a dog,
J. Vet. Med. Sci. 69 (2) (2007) 201–204. - [19] D.J.Colin,D.Cottet-Dumoulin,A.Faivre,S.Germain,F.Triponez,V.Serre-Beinier, Experimental model of human malignant mesothelioma in athymic mice, Int. J. Mol. Sci. 19 (7) (2018).
- [20] K.P. Seastedt, N. Pruett, C.D. Hoang, Mouse models for mesothelioma drug discovery and development, Expert Opin. Drug Discov. 16 (6) (2021) 697–708.
- [21] T. Chernova, X.M. Sun, I.R. Powley, S. Galavotti, S. Grosso, F.A. Murphy, G.
J. Miles, L. Cresswell, A.V. Antonov, J. Bennett, A. Nakas, D. Dinsdale, K. Cain, M. Bushell, A.E. Willis, M. MacFarlane, Molecular profiling reveals primary mesothelioma cell lines recapitulate human disease, Cell Death Differ. 23 (7) (2016) 1152–1164.
- [22] G.Cramer,M.Shin,S.Hagan,S.I.Katz,C.B.Simone2nd,T.M.Busch,K.A.Cengel, Modeling epidermal growth factor inhibitor-mediated enhancement of photodynamic therapy efficacy using 3D mesothelioma cell culture, Photochem. Photobiol. 95 (1) (2019) 397–405.
- [23] K.U. Kim, S.M. Wilson, K.S. Abayasiriwardana, R. Collins, L. Fjellbirkeland, Z. Xu, D.M. Jablons, S.L. Nishimura, V.C. Broaddus, A novel in vitro model of human mesothelioma for studying tumor biology and apoptotic resistance, Am. J. Respir. Cell Mol. Biol. 33 (6) (2005) 541–548.
- [24] X. Xiang, Y. Phung, M. Feng, K. Nagashima, J. Zhang, V.C. Broaddus, R. Hassan, D. Fitzgerald, M. Ho, The development and characterization of a human mesothelioma in vitro 3D model to investigate immunotoxin therapy, PloS One 6 (1) (2011), e14640.
- [25] D. Barbone, L. Van Dam, C. Follo, P.V. Jithesh, S.D. Zhang, W.G. Richards,
R. Bueno, D.A. Fennell, V.C. Broaddus, Analysis of gene expression in 3D spheroids
highlights a survival role for ASS1 in mesothelioma, PloS One 11 (3) (2016),
e0150044.
- [26] A.R. Mazzocchi, S.A.P. Rajan, K.I. Votanopoulos, A.R. Hall, A. Skardal, In vitro
patient-derived 3D mesothelioma tumor organoids facilitate patient-centric
therapeutic screening, Sci. Rep. 8 (1) (2018) 2886.
- [27] Y. Gao, M. Kruithof-de Julio, R.-W. Peng, P. Dorn, Organoids as a Model for
Precision Medicine in Malignant Pleural Mesothelioma: Where Are We Today?,
Cancers, 2022.
- [28] O. Zeira, E. Ghezzi, L. Pettinari, V. Re, D.M. Lupi, S.L. Benali, S. Borgonovo,
G. Alessandri, F. Petrella, R. Paroni, M. Dei Cas, C. Tremolada, V. Cocc`e, A. Pessina, Case report: microfragmented adipose tissue drug delivery in canine mesothelioma: a case report on safety, feasibility, and clinical findings, Front. Vet. Sci. 7 (2020), 585427.
- [29] J.M. Closa, A. Font, J. Mascort, Pericardial mesothelioma in a dog: long-term survival after pericardiectomy in combination with chemotherapy, J. Small Anim. Pract. 40 (8) (1999) 383–386.
- [30] S. Lapp, V.M. Pfankuche, W. Baumg ̈artner, C. Puff, Viral oncolysis – can insights from measles be transferred to canine distemper virus? Viruses 6 (6) (2014) 2340– 2375.
- [31] J. Wang, X. Li, H. Chen, Organoid models in lung regeneration and cancer, Cancer Lett. 475 (2020) 129–135.
- [32] A. Abugomaa, M. Elbadawy, Patient-derived organoid analysis of drug resistance in
precision medicine: is there a value? Expert Rev. Precision Med. Drug Dev. 5 (1)
(2020) 1–5.
- [33] M. Elbadawy, M. Yamanaka, Y. Goto, K. Hayashi, R. Tsunedomi, S. Hazama,
H. Nagano, T. Yoshida, M. Shibutani, R. Ichikawa, J. Nakahara, T. Omatsu,
T. Mizutani, Y. Katayama, Y. Shinohara, A. Abugomaa, M. Kaneda, H. Yamawaki, T. Usui, K. Sasaki, Efficacy of primary liver organoid culture from different stages of non-alcoholic steatohepatitis (NASH) mouse model, Biomaterials 237 (2020), 119823. - [34] M. Elbadawy, Y. Kato, N. Saito, K. Hayashi, A. Abugomaa, M. Kobayashi,
T. Yoshida, M. Shibutani, M. Kaneda, H. Yamawaki, T. Mizutani, C.-K. Lim,
M. Saijo, K. Sasaki, T. Usui, T. Omatsu, Establishment of intestinal organoid from rousettus leschenaultii and the susceptibility to bat-associated viruses, SARS-CoV-2 and Pteropine Orthoreovirus, Int. J. Mol. Sci. 22 (19) (2021) 10763. - [35] T. Yoshida, M. Kobayashi, S. Uomoto, K. Ohshima, E. Hara, Y. Katoh, N. Takahashi, T. Harada, T. Usui, M. Elbadawy, M. Shibutani, The potential of organoids in toxicologic pathology: role of toxicologic pathologists in in vitro chemical hepatotoxicity assessment, J. Toxicol. Pathol. 35 (3) (2022) 225–235.
- [36] M. Elbadawy, A. Abugomaa, H. Yamawaki, T. Usui, K. Sasaki, Development of prostate cancer organoid culture models in basic medicine and translational research, Cancers 12 (4) (2020) 777.
- [37] M. Elbadawy, T. Usui, H. Yamawaki, K. Sasaki, Development of an experimental model for analyzing drug resistance in colorectal cancer, Cancers 10 (6) (2018) 164.
- [38] T. Usui, M. Sakurai, K. Umata, M. Elbadawy, T. Ohama, H. Yamawaki, S. Hazama, H. Takenouchi, M. Nakajima, R. Tsunedomi, N. Suzuki, H. Nagano, K. Sato,
M. Kaneda, K. Sasaki, Hedgehog signals mediate anti-cancer drug resistance in three-dimensional primary colorectal cancer organoid culture, Int. J. Mol. Sci. 19(4) (2018) 1098.
- [39] A. Abugomaa, M. Elbadawy, M. Yamanaka, Y. Goto, K. Hayashi, T. Mori, T. Uchide,
D. Azakami, R. Fukushima, T. Yoshida, M. Shibutani, R. Yamashita, M. Kobayashi, H. Yamawaki, Y. Shinohara, M. Kaneda, T. Usui, K. Sasaki, Establishment of 2.5D organoid culture model using 3D bladder cancer organoid culture, Sci. Rep. 10 (1) (2020) 9393.
- [40] M. Elbadawy, Y. Sato, T. Mori, Y. Goto, K. Hayashi, M. Yamanaka, D. Azakami, T. Uchide, R. Fukushima, T. Yoshida, M. Shibutani, M. Kobayashi, Y. Shinohara,
A. Abugomaa, M. Kaneda, H. Yamawaki, T. Usui, K. Sasaki, Anti-tumor effect of trametinib in bladder cancer organoid and the underlying mechanism, Cancer Biol. Ther. 22 (5–6) (2021) 357–371.
- [41] M. Elbadawy, K. Hayashi, H. Ayame, Y. Ishihara, A. Abugomaa, M. Shibutani, S.- M. Hayashi, S. Hazama, H. Takenouchi, M. Nakajima, R. Tsunedomi, N. Suzuki,
H.Nagano,Y.Shinohara,M.Kaneda,H.Yamawaki,T.Usui,K.Sasaki,Anti-cancer activity of amorphous curcumin preparation in patient-derived colorectal cancer organoids, Biomed. Pharmacother. 142 (2021), 112043.
- [42] R.K. Pramod, A. Mitra, In vitro culture and characterization of spermatogonial stem cells on Sertoli cell feeder layer in goat (Capra hircus), J. Assist. Reprod. Genet. 31 (8) (2014) 993–1001.
- [43] A.N. Husain, T.V. Colby, N.G. Ordo ́n ̃ez, T.C. Allen, R.L. Attanoos, M.B. Beasley, K. J. Butnor, L.R. Chirieac, A.M. Churg, S. Dacic, F. Galateau-Sall ́e, A. Gibbs, A.
M. Gown, T. Krausz, L.A. Litzky, A. Marchevsky, A.G. Nicholson, V.L. Roggli, A.
K. Sharma, W.D. Travis, A.E. Walts, M.R. Wick, Guidelines for pathologic diagnosis of malignant mesothelioma 2017 update of the consensus statement from the international mesothelioma interest group, Arch. Pathol. Lab. Med. 142 (1) (2018) 89–108. - [44] A.J. Moore, R.J. Parker, J. Wiggins, Malignant mesothelioma, Orphanet J. Rare Dis. 3 (2008) 34.
- [45] V. Relan, L. Morrison, K. Parsonson, B.E. Clarke, E.E. Duhig, M.N. Windsor, K. S. Matar, R. Naidoo, L. Passmore, E. McCaul, D. Courtney, I.A. Yang, K.M. Fong, R. V. Bowman, Phenotypes and karyotypes of human malignant mesothelioma cell lines, PloS One 8 (3) (2013), e58132.
- [46] M. Nishiyama, R. Tsunedomi, K. Yoshimura, N. Hashimoto, S. Matsukuma,
H. Ogihara, S. Kanekiyo, M. Iida, K. Sakamoto, N. Suzuki, S. Takeda, S. Yamamoto, S. Yoshino, T. Ueno, Y. Hamamoto, S. Hazama, H. Nagano, Metastatic ability and the epithelial-mesenchymal transition in induced cancer stem-like hepatoma cells, Cancer Sci. 109 (4) (2018) 1101–1109. [47] A. Subramanian, P. Tamayo, V.K. Mootha, S. Mukherjee, B.L. Ebert, M.A. Gillette, A. Paulovich, S.L. Pomeroy, T.R. Golub, E.S. Lander, J.P. Mesirov, Gene set enrichment analysis: a knowledge-based approach for interpreting genome-wide
expression profiles, Proc. Natl. Acad. Sci. U. S. A. 102 (43) (2005) 15545–15550. [48] D. Horio, T. Minami, H. Kitai, H. Ishigaki, Y. Higashiguchi, N. Kondo, S. Hirota,
K. Kitajima, Y. Nakajima, Y. Koda, E. Fujimoto, Y. Negi, M. Niki, S. Kanemura, E. Shibata, K. Mikami, R. Takahashi, T. Yokoi, K. Kuribayashi, T. Kijima, Tumor- associated macrophage-derived inflammatory cytokine enhances malignant potential of malignant pleural mesothelioma, Cancer Sci. 111 (8) (2020) 2895–2906.
[49] T. Usui, M. Sakurai, S. Nishikawa, K. Umata, Y. Nemoto, T. Haraguchi, K. Itamoto, T. Mizuno, S. Noguchi, T. Mori, S. Iwai, T. Nakagawa, H. Yamawaki, T. Ohama,
K. Sato, Establishment of a dog primary prostate cancer organoid using the urine
cancer stem cells, Cancer Sci. 108 (12) (2017) 2383–2392.
- [50] T. Usui, M. Sakurai, S. Enjoji, H. Kawasaki, K. Umata, T. Ohama, N. Fujiwara,
R. Yabe, S. Tsuji, H. Yamawaki, S. Hazama, H. Takenouchi, M. Nakajima,
R. Tsunedomi, N. Suzuki, H. Nagano, K. Sato, Establishment of a novel model for anticancer drug resistance in three-dimensional primary culture of tumor microenvironment, Stem Cells Int. 2016 (2016) 7053872. - [51] W.D. Travis, E. Brambilla, A.G. Nicholson, Y. Yatabe, J.H.M. Austin, M.B. Beasley, L.R. Chirieac, S. Dacic, E. Duhig, D.B. Flieder, K. Geisinger, F.R. Hirsch,
Y. Ishikawa, K.M. Kerr, M. Noguchi, G. Pelosi, C.A. Powell, M.S. Tsao, I. Wistuba, The 2015 World Health Organization classification of lung tumors: impact of genetic, clinical and radiologic advances since the 2004 classification, J. Thorac. Oncol.: Off. Publ. Int. Assoc. Study Lung Cancer 10 (9) (2015) 1243–1260. - [52] M.G. Zauderer, A. Martin, J. Egger, H. Rizvi, M. Offin, A. Rimner, P.S. Adusumilli, V.W. Rusch, M.G. Kris, J.L. Sauter, M. Ladanyi, R. Shen, The use of a next- generation sequencing-derived machine-learning risk-prediction model (OncoCast- MPM) for malignant pleural mesothelioma: a retrospective study, Lancet Digit. Health 3 (9) (2021) e565–e576.
- [53] A.R. D’Angelo, G. Di Francesco, Sclerosing peritoneal mesothelioma in a dog: histopathological, histochemical and immunohistochemical investigations, Vet.
Ital. 50 (4) (2014) 301–305.
- [54] N.V. Son, J.K. Chambers, T. Shiga, T.E. Kishimoto, S. Kikuhara, K. Saeki,
R. Fujiwara, M. Tsuboi, R. Nishimura, K. Uchida, H. Nakayama, Sarcomatoid mesothelioma of tunica vaginalis testis in the right scrotum of a dog, J. Vet. Med. Sci. 80 (7) (2018) 1125–1128.
- [55] A. Fassina, R. Cappellesso, V. Guzzardo, L. Dalla Via, S. Piccolo, L. Ventura, M. Fassan, Epithelial-mesenchymal transition in malignant mesothelioma, Mod. Pathol. 25 (1) (2012) 86–99.
- [56] A. Schramm, I. Opitz, S. Thies, B. Seifert, H. Moch, W. Weder, A. Soltermann, Prognostic significance of epithelial-mesenchymal transition in malignant pleural mesothelioma, Eur. J. Cardio-Thorac. Surg. 37 (3) (2010) 566–572.
- [57] Y. Su, X. Zhang, S. Bidlingmaier, C.R. Behrens, N.K. Lee, B. Liu, ALPPL2 is a highly specific and targetable tumor cell surface antigen, Cancer Res. 80 (20) (2020) 4552–4564.
- [58] L.S. Manning, D. Whitaker, A.R. Murch, M.J. Garlepp, M.R. Davis, A.W. Musk, B. W. Robinson, Establishment and characterization of five human malignant mesothelioma cell lines derived from pleural effusions, Int. J. Cancer 47 (2) (1991) 285–290.
- [59] N. Usami, T. Fukui, M. Kondo, T. Taniguchi, T. Yokoyama, S. Mori, K. Yokoi,
Y. Horio, K. Shimokata, Y. Sekido, T. Hida, Establishment and characterization of four malignant pleural mesothelioma cell lines from Japanese patients, Cancer Sci. 97 (5) (2006) 387–394. - [60] M.M. Philippeaux, J.C. Pache, S. Dahoun, M. Barnet, J.H. Robert, J. Mau ̈el, A. Spiliopoulos, Establishment of permanent cell lines purified from human mesothelioma: morphological aspects, new marker expression and karyotypic analysis, Histochem. Cell Biol. 122 (3) (2004) 249–260.
- [61] M. Shamseddin, J. Obacz, M.J. Garnett, R.C. Rintoul, H.E. Francies, S.J. Marciniak, Use of preclinical models for malignant pleural mesothelioma, Thorax 76 (11) (2021) 1154–1162.
[62] T. Chernova, F.A. Murphy, S. Galavotti, X.M. Sun, I.R. Powley, S. Grosso,
A. Schinwald, J. Zacarias-Cabeza, K.M. Dudek, D. Dinsdale, J. Le Quesne,
J. Bennett, A. Nakas, P. Greaves, C.A. Poland, K. Donaldson, M. Bushell, A.E. Willis, M. MacFarlane, Long-fiber carbon nanotubes replicate asbestos-induced mesothelioma with disruption of the tumor suppressor gene Cdkn2a (Ink4a/Arf), Curr. Biol.: CB 27 (21) (2017) 3302–3314, e6.- [63] M. Suzui, M. Futakuchi, K. Fukamachi, T. Numano, M. Abdelgied, S. Takahashi, M. Ohnishi, T. Omori, S. Tsuruoka, A. Hirose, J. Kanno, Y. Sakamoto, D.
B. Alexander, W.T. Alexander, X. Jiegou, H. Tsuda, Multiwalled carbon nanotubes intratracheally instilled into the rat lung induce development of pleural malignant mesothelioma and lung tumors, Cancer Sci. 107 (7) (2016) 924–935. - [64] J. Jongsma, E. van Montfort, M. Vooijs, J. Zevenhoven, P. Krimpenfort, M. van der Valk, M. van de Vijver, A. Berns, A conditional mouse model for malignant mesothelioma, Cancer Cell 13 (3) (2008) 261–271.
- [65] A.M. Kukuyan, E. Sementino, Y. Kadariya, C.W. Menges, M. Cheung, Y. Tan, K. Q. Cai, M.J. Slifker, S. Peri, A.J. Klein-Szanto, F.J. Rauscher 3rd, J.R. Testa, Inactivation of Bap1 cooperates with losses of Nf2 and Cdkn2a to drive the development of pleural malignant mesothelioma in conditional mouse models, Cancer Res. 79 (16) (2019) 4113–4123.
- [66] J. Badhai, G.K. Pandey, J.Y. Song, O. Krijgsman, R. Bhaskaran, G. Chandrasekaran, M.C. Kwon, L. Bombardelli, K. Monkhorst, C. Grasso, J. Zevenhoven, J. van der Vliet, M. Cozijnsen, P. Krimpenfort, D. Peeper, M. van Lohuizen, A. Berns, Combined deletion of Bap1, Nf2, and Cdkn2ab causes rapid onset of malignant mesothelioma in mice, J. Exp. Med. 217 (6) (2020).
- [67] E. Sementino, C.W. Menges, Y. Kadariya, S. Peri, J. Xu, Z. Liu, R.G. Wilkes, K. Q. Cai, F.J. Rauscher 3rd, A.J. Klein-Szanto, J.R. Testa, Inactivation of Tp53 and Pten drives rapid development of pleural and peritoneal malignant mesotheliomas, J. Cell. Physiol. 233 (11) (2018) 8952–8961.
- [68] L. Wu, G. Allo, T. John, M. Li, T. Tagawa, I. Opitz, M. Anraku, Z. Yun, M. Pintilie, B. Pitcher, G. Liu, R. Feld, M.R. Johnston, M. de Perrot, M.S. Tsao, Patient-Derived Xenograft establishment from human malignant pleural mesothelioma, Clin.
Cancer Res. 23 (4) (2017) 1060–1067. - [69] N. Kalra, J. Zhang, A. Thomas, L. Xi, M. Cheung, J. Talarchek, S. Burkett, M. G. Tsokos, Y. Chen, M. Raffeld, M. Miettinen, I. Pastan, J.R. Testa, R. Hassan, Mesothelioma patient derived tumor xenografts with defined BAP1 mutations that mimic the molecular characteristics of human malignant mesothelioma, BMC Cancer 15 (2015) 376.
- [70] M. Bleijs, M. van de Wetering, H. Clevers, J. Drost, Xenograft and organoid model systems in cancer research, EMBO J. 38 (15) (2019), e101654.
- [71] H. Clevers, Modeling development and disease with organoids, Cell 165 (7) (2016) 1586–1597.
[72] L.Huang,A.Holtzinger,I.Jagan,M.BeGora,I.Lohse,N.Ngai,C.Nostro,R.Wang, L.B. Muthuswamy, H.C. Crawford, C. Arrowsmith, S.E. Kalloger, D.J. Renouf, A. A. Connor, S. Cleary, D.F. Schaeffer, M. Roehrl, M.S. Tsao, S. Gallinger, G. Keller, S.
K. Muthuswamy, Ductal pancreatic cancer modeling and drug screening using human pluripotent stem cell- and patient-derived tumor organoids, Nat. Med. 21 (11) (2015) 1364–1371.
- [73] M. van de Wetering, H.E. Francies, J.M. Francis, G. Bounova, F. Iorio, A. Pronk, W. van Houdt, J. van Gorp, A. Taylor-Weiner, L. Kester, A. McLaren-Douglas,
J. Blokker, S. Jaksani, S. Bartfeld, R. Volckman, P. van Sluis, V.S. Li, S. Seepo, C. Sekhar Pedamallu, K. Cibulskis, S.L. Carter, A. McKenna, M.S. Lawrence,L. Lichtenstein, C. Stewart, J. Koster, R. Versteeg, A. van Oudenaarden, J. Saez- Rodriguez, R.G. Vries, G. Getz, L. Wessels, M.R. Stratton, U. McDermott,
M. Meyerson, M.J. Garnett, H. Clevers, Prospective derivation of a living organoid biobank of colorectal cancer patients, Cell 161 (4) (2015) 933–945. - [74] H. Kim, Y. Phung, M. Ho, Changes in global gene expression associated with 3D structure of tumors: an ex vivo matrix-free mesothelioma spheroid model, PloS One 7 (6) (2012), e39556.
- [75] G. Ranieri, C.D. Gadaleta, R. Patruno, N. Zizzo, M.G. Daidone, M.G. Hansson,
A. Paradiso, D. Ribatti, A model of study for human cancer: Spontaneous occurring tumors in dogs. Biological features and translation for new anticancer therapies, Crit. Rev. Oncol. /Hematol. 88 (1) (2013) 187–197. - [76] S. Dahiya, M. Singh, S. Jain, B. Khuraijam, N. Suroya, S. Mandal, Cytological diagnosis of malignant mesothelioma: a case series, J. Cytol. 39 (3) (2022) 105– 109.
- [77] Y. Tsugeno, F. Sato, Y. Muragaki, Y. Kato, Cell culture of human gingival fibroblasts, oral cancer cells and mesothelioma cells with serum-free media, STK1 and STK2, Biomed. Rep. 2 (5) (2014) 644–648.
- [78] A. Destro, G.L. Ceresoli, M. Falleni, P.A. Zucali, E. Morenghi, P. Bianchi,
C. Pellegrini, N. Cordani, V. Vaira, M. Alloisio, A. Rizzi, S. Bosari, M. Roncalli, EGFR overexpression in malignant pleural mesothelioma, Immunohistochem. Mol. Study Clin. – Pathol. Correl., Lung Cancer (Amst., Neth.) 51 (2) (2006) 207–215. - [79] K. Okuda, H. Sasaki, O. Kawano, H. Yukiue, T. Yokoyama, M. Yano, Y. Fujii, Epidermal growth factor receptor gene mutation, amplification and protein expression in malignant pleural mesothelioma, J. Cancer Res. Clin. Oncol. 134 (10) (2008) 1105–1111.
- [80] O. Rena, L.R. Boldorini, E. Gaudino, C. Casadio, Epidermal growth factor receptor overexpression in malignant pleural mesothelioma: prognostic correlations,
J. Surg. Oncol. 104 (6) (2011) 701–705. - [81] S. Dubey, P.A. Ja ̈nne, L. Krug, H. Pang, X. Wang, R. Heinze, C. Watt, J. Crawford, R. Kratzke, E. Vokes, et al., A phase II study of sorafenib in malignant mesothelioma: results of Cancer and Leukemia Group B 30307, J. Thorac. Oncol. 5 (10) (2010) 1655–1661.
- [82] P.L. Chia, S. Parakh, M.S. Tsao, N.A. Pham, H.K. Gan, D. Cao, I.J.G. Burvenich, A. Rigopoulos, E.B. Reilly, T. John, A.M. Scott, Targeting and efficacy of Novel mAb806-antibody-drug conjugates in malignant mesothelioma, Pharmaceuticals (Basel, Switzerland) 13 (10) (2020).
- [83] C. Blackwell, C. Sherk, M. Fricko, G. Ganji, M. Barnette, B. Hoang, J. Tunstead, T. Skedzielewski, H. Alsaid, B.M. Jucker, E. Minthorn, R. Kumar, M.P. DeYoung, Inhibition of FGF/FGFR autocrine signaling in mesothelioma with the FGF ligand trap, FP-1039/GSK3052230, Oncotarget 7 (26) (2016) 39861–39871.
- [85] L.A. Marek, T.K. Hinz, A. von Massenhausen, K.A. Olszewski, E.K. Kleczko,
D. Boehm, M.C. Weiser-Evans, R.A. Nemenoff, H. Hoffmann, A. Warth, J.M. Gozgit, S. Perner, L.E. Heasley, Nonamplified FGFR1 is a growth driver in malignant
pleural mesothelioma, Mol. Cancer Res.: MCR 12 (10) (2014) 1460–1469. - [86] K. Schelch, M.B. Kirschner, M. Williams, Y.Y. Cheng, N. van Zandwijk, M. Grusch, G. Reid, A link between the fibroblast growth factor axis and the miR-16 family reveals potential new treatment combinations in mesothelioma, Mol. Oncol. 12 (1) (2018) 58–73.
- [87] A. Elfadadny, H.M. El-Husseiny, A. Abugomaa, R.F. Ragab, E.A. Mady,
M. Aboubakr, H. Samir, A.S. Mandour, A. El-Mleeh, A.H. El-Far, A.H. Abd El-Aziz, M. Elbadawy, Role of multidrug resistance-associated proteins in cancer therapeutics: past, present, and future perspectives, Environ. Sci. Pollut. Res. 28 (36) (2021) 49447–49466.
14 [84] G. Vlacic, M.A. Hoda, T. Klikovits, K. Sinn, E. Gschwandtner, K. Mohorcic, ̈ ̈
K. Schelch, C. Pirker, B. Peter-Vorosmarty, J. Brankovic, B. Dome, V. Laszlo,
T. Cufer, A. Rozman, W. Klepetko, B. Grasl-Kraupp, B. Hegedus, W. Berger, I. Kern, M. Grusch, Expression of FGFR1-4 in malignant pleural mesothelioma tissue and corresponding cell lines and its relationship to patient survival and FGFR inhibitor sensitivity, Cells 8 (9) (2019)- [88] M. Elbadawy, T. Usui, H. Yamawaki, K. Sasaki, Emerging roles of C-Myc in cancer stem cell-related signaling and resistance to cancer chemotherapy: a potential therapeutic target against colorectal cancer, Int. J. Mol. Sci. 20 (9) (2019) 2340.
- [89] M. Elbadawy, T. Usui, H. Yamawaki, K. Sasaki, Novel functions of death-associated protein kinases through mitogen-activated protein kinase-related signals, Int. J. Mol. Sci. 19 (10) (2018) 3031.
- [90] D. Barbone, T.M. Yang, J.R. Morgan, G. Gaudino, V.C. Broaddus, Mammalian target of rapamycin contributes to the acquired apoptotic resistance of human mesothelioma multicellular spheroids, J. Biol. Chem. 283 (19) (2008) 13021–13030.
- [91] D. Barbone, J.A. Ryan, N. Kolhatkar, A.D. Chacko, D.M. Jablons, D.J. Sugarbaker, R. Bueno, A.G. Letai, L.M. Coussens, D.A. Fennell, V.C. Broaddus, The Bcl-2 repertoire of mesothelioma spheroids underlies acquired apoptotic multicellular resistance, Cell Death Dis. 2 (6) (2011), e174.
- [92] N. Makrilia, A. Kollias, L. Manolopoulos, K. Syrigos, Cell adhesion molecules: role and clinical significance in cancer, Cancer Investig. 27 (10) (2009) 1023–1037.
- [93] J. Daubriac, J. Fleury-Feith, L. Kheuang, J. Galipon, A. Saint-Albin, A. Renier, M. Giovannini, F. Galateau-Sall ́e, M.C. Jaurand, Malignant pleural mesothelioma cells resist anoikis as quiescent pluricellular aggregates, Cell Death Differ. 16 (8) (2009) 1146–1155.
Biomedicine & Pharmacotherapy 162 (2023) 114651
B. Davidson, Biological characteristics of cancers involving the serosal cavities,
Crit. Rev. Oncog. 13 (3) (2007) 189–227.
[95] M. Piazzi, S. Kojic, C. Capanni, N. Stamenkovic, A. Bavelloni, O. Marin, G. Lattanzi,W. Blalock, V. Cenni, Ectopic expression of Ankrd2 affects proliferation, motility and clonogenic potential of human osteosarcoma cells, Cancers (Basel) 13 (2) (2021).
[96] A. Ito, M. Hagiyama, T. Mimura, M. Matsumoto, T. Wakayama, S. Iseki,
H. Yokozaki, M. Okada, Expression of cell adhesion molecule 1 in malignant pleural mesothelioma as a cause of efficient adhesion and growth on mesothelium, Lab. Investig. 88 (5) (2008) 504–514.- [97] S. Tsagkouli, I.G. Kyriakoulis, K.G. Kyriakoulis, E. Fyta, A. Syrigos, P. Bakakos, A. Charpidou, E. Kotteas, Serum and pleural soluble cell adhesion molecules in mesothelioma patients: a retrospective cohort study, Cancers (Basel) 14 (12) (2022).
- [98] M.L. Yuen, L. Zhuang, E.M. Rath, T. Yu, B. Johnson, K.H. Sarun, Y. Wang, S. Kao, A. Linton, C.J. Clarke, B.C. McCaughan, K. Takahashi, K. Lee, Y.Y. Cheng, The role of E-Cadherin and microRNA on FAK inhibitor response in malignant pleural mesothelioma (MPM), Int. J. Mol. Sci. 22 (19) (2021).
- [50] T. Usui, M. Sakurai, S. Enjoji, H. Kawasaki, K. Umata, T. Ohama, N. Fujiwara,