*İlgili yazar:
Kyoung Won Seo
Veteriner İç Hastalıkları Anabilim Dalı, Veteriner Fakültesi, Chungnam Ulusal Üniversitesi, 99 Daehak-ro, Yuseong- gu, Daejeon 34134, Kore
Tel: +82-42-821-6756
Faks: +82-42-821-8903
E-mail: kwseo@cnu.ac.kr
Şu anki görev yeri: Veteriner İç Hastalıkları Bölümü, Veteriner Fakültesi, Seul Ulusal Üniversitesi, 1 Gwanak-ro, Gwanak-gu, Seul 08826, Kore
Tel: +82-2-880-1180 E-mail: kwseo@snu.ac.kr
ORCID: https://orcid.org/0000-0002-1561-3278
Çıkar çatışması beyanı:
Yazarlar herhangi bir çıkar çatışması beyan etmemiştir.
Sunum: 15 Ocak 2021 Revize: 09 Şubat 2021 Kabul: 25 Şubat 2021
Bu retrospektif çalışmanın amacı, kedi orta ve yüksek grade alimenter lenfoma vakalarını semptom, klinik prezentasyon, laboratuvar bulguları, tedaviye yanıt (modifiye 25 haftalık Wisconsin-Madison Üniversitesi [UW-25] vs. COP [siklofosfamid, vinkristin, prednizon]), toksisite ve sonuçları bakımından değerlendirmek ve prognostik faktörleri belirlemektir. On altı kedi kemoterapi protokolleri ile tedavi edilmiştir. Yanıt oranları ve sağkalım iki protokol arasında istatistiksel olarak farklılık göstermemiştir. Tedaviye yanıt veren kedilerde progresyonsuz aralık (PFI) ve medyan sağkalım süresi (MST), yanıt vermeyenlere [NR] göre daha uzundu (tam remisyon [CR] vs. kısmi remisyon [PR] vs. NR; PFI, 124 vs. 49 vs. 12 gün, p < 0.001; MST, 361 vs. 118 vs. 16 gün, p < 0.001). Klinik evre, PFI ve MST bakımından bir diğer prognoz faktörüydü. I. evredeki kedilerde PFI veMST diğer evrelerdekilere göre daha uzundu (PFI, 107 güne karşı 30 gün; MST, 193 güne karşı 54 gün). Hematolojik ve gastrointestinal toksisite çoğunlukla düşük gradeli olmuştur. Modifiye UW-25 protokolü ile COP protokolü karşılaştırıldığında, nöro-tropenik atakların sayısı ve grade düzeyleri arasında çok fazla fark yoktu. Anahtar Kelimeler: lenfoma; gastrointestinal neoplazmlar; kediler; antineoplastik protokoller
Giriş
Alimenter lenfoma (AL) kedilerde en sık görülen intestinal neoplazmdır [1-9]. AL, gastrointestinal (GI) kanalda görülen, mezenterik lenf nodu ve hepatosplenik tutulumu olan bir grup hastalıktan oluşur [1,3]. Tümör soliter olabilmesine rağmen, bağırsak boyunca yaygın formlar daha yaygındır [3]. Tutarlı bir cinsiyet eğilimi yoktur [3,4,10,11]. Histopatoloji ve immünohistopatoloji sonuçlarına dayanarak, çoğu kedi AL’si aşağıdaki üç tipten biri olarak sınıflandırılabilir: 1) düşük gradeli alimenter lenfoma (LGAL), 2) orta veya yüksek gradeli alimenter lenfoma (I/HAL) ve 3) büyük granüler lenfoma. Lenfomanın bu farklı alt tipleri, genellikle hiporeksi, kilo kaybı, kusma ve ishal gibi GI bozukluklarıyla bağlantılı klinik belirtileri gösterir [1,12-14]. Her bir alt tip için klinik semptomlarda farklılık bildirilmemiştir; ancak I/ HAL daha akut ilerleme eğilimindedir [1,4,12,15-17].
Kedi AL’si için tedavi protokolleri değişkendir, ancak en yaygın rejimler COP tabanlı (siklofosfamid, vinkristin, prednizolon veya prednizon) veya CHOP tabanlıdır (siklofosfamid, doksorubisin, vinka alkaloid, prednizolon veya
prednizon). Bununla birlikte, altın standart niteliğinde herhangi bir kemoterapi protokolü mevcut değildir [4,6,15,18-26].
Medyan sağkalım süresi (MST) lenfomanın alt tipleri arasında farklılık göstermektedir. LGAL kedilerinin MST’si yaklaşık 1,5 yıl iken, multiaktif kemoterapi ile tedavi edilen I/HAL kedilerininki yaklaşık 4 ila 6 aydır ve prognozu kötüdür [4,7,10,15,22-24,27]. Buna ek olarak, kombinasyon protokolleri ile tedavi edilen I/HAL’li kedilerde yanıt oranları ve yanıtın süresi genellikle LGAL’li kedilerdeki kadar iyi değildir. LGAL hastaları %80’den fazla yanıt oranına sahipken, HGAL hastaları %50 ila %65 yanıt oranına sahiptir [10,11,16-18,20-21,23- 26,28-30]. Özellikle, yakın zamanda yapılan birkaç retrospektif çalışma, I/ HAL’li kedilerde COP ve modifiye 25 haftalık Wisconsin-Madison Üniversitesi (UW-25) protokollerine verilen yanıtı rapor etmiş ve tedaviye iyi yanıt verildiğini göstermiştir (modifiye UW-25 ve COP protokollerine yanıt: 62 ve %92,4; modifiye UW-25 ve COP’nin MST’si sırasıyla 97 ve 112 gün) [11,31].
Aşağıdaki prognostik faktörlerin AL ile ilişkili olduğu bildirilmiştir: kedi lösemi virüsü (FeLV) antijenemisi, grade, tedavi yanıtı, hipoalbüminemi ve vücut ağırlığı. Bununla birlikte, en tutarlı prognostik faktör tedaviye tam remisyon (CR) sağlanmasıdır [10,11,16,17,22,29,30,32].
I/HAL’i inceleyen çok az sayıda çalışma bulunmaktadır. Modifiye UW-25 protokolü yakın zamanda geliştirildiği için, bildiğimiz kadarıyla, modifiye UW-25 protokolünde toksikozu değerlendiren herhangi bir çalışma ve I/HAL’li kedilerde modifiye UW-25 ve COP protokollerini karşılaştırılarak tedavi yanıtını değerlendiren herhangi bir araştırma bulunmamaktadır. Bu retrospektif çalışmanın amacı, kedi I/HAL vakalarını semptom, klinik prezentasyon, laboratuvar bulguları, tedaviye yanıt (modifiye UW-25 ve COP), toksisite ve sonuçlar bakımından değerlendirmek ve prognostik faktörleri belirlemektir.
Materyal ve Metod
Vaka seçimi
On altı kedi çalışmaya dahil edilme kriterlerini karşılamıştır. Chungnam Ulusal Üniversitesi, Beaksan Feline Tıp Merkezi, Kore Hayvan Tıp Merkezi ve Sungsim Hayvan Tıp Merkezi olmak üzere dört kurumda 2017-2020 yılları arasında I/HAL nedeniyle muayene edilen kedilerin tıbbi kayıtları incelenmiştir. Histolojik ve sitolojik olarak doğrulanmış I/HAL tanısı olan kediler çalışmaya dahil edilmiştir. Tüm kaba hastalıkları cerrahi olarak çıkarılmış kedilerin çalışmaya dahil edilmesine izin verilmiştir.
Verilerin toplanması
Hastaya dair parametreler
Toplanan veriler şu şekildeydi: yaş, cinsiyet, tanı anındaki klinik bulgular, fizik muayene bulguları, hematolojik veriler, FeLV ve kedi immün yetmezlik virüsü (FIV) testi, toraks ve batın röntgeni, batın ultrasonu, tanı tarihi, tanı yöntemi, klinik evre, tedavi tarihi, tedaviye yanıt, progresyon tarihi, ölüm tarihi, ölüm nedeni ve tedavi sırasında görülen yan etkiler.
Tedavi ve sonuç
Kediler, modifiye UW-25 veya COP protokolü de dahil olmak üzere kemoterapi protokolleri ile tedavi edilmiştir. COP protokolü standart dozlara ve aralıklara göre hazırlanmıştır [33] ve kemoterapide küçük değişiklikler yapılan hastalar (örn. doz yoğunluğu) hariç tutulmamıştır. Modifiye UW-25 protokolü vinkristin, l-asparaginaz, siklo- fosfamid, doksorubisin ve prednizolon ile kombine kemoterapi tedavisini kapsıyordu ve Collette ve arkadaşları tarafından yayınlanan rapora dayanıyordu [11]. Ayrıca, protokolde meydana gelen küçük bir sapma (örneğin, l-aspar- aginazın atlanması) bu gruptan çıkarılma nedeni sayılmamıştır.
Her tedaviden önce tam kan sayımı (CBC) yapılmıştır. Kediler toksisite veya diğer klinik belirtilere bağlı semptomlar gösterdiğinde biyokimya profilleri yapılmıştır.
Kediler hiç tedavi almamış, ilk basamak olarak modifiye UW-25 veya COP protokolü dışında herhangi bir kemoterapi protokolü ile tedavi edilmiş, tıbbi kayıtları eksikse yanıt ve sağkalım değerlendirmesinden hariç tutulmuştur.
Yanıtların değerlendirilmesi
Kediler düzenli aralıklarla çekilen ultrasonlar ile tedaviye yanıt bakımından objektif olarak değerlendirilmiştir. Kediler tedavi yanıtına göre aşağıdaki şekilde sınıflandırılmıştır: CR, tüm ölçülebilir hastalık boyutunda %100 azalma; kısmi remisyon (PR), tüm ölçülebilir hastalık boyutunda >%50 ancak <%100 azalma; ve yanıt yok (NR), boyutta <%50 azalma veya genel ölçülebilir hastalık boyutunda artış.
Toksisite değerlendirmesi
Tedavi sırasında CBC toksisitesinin yanı sıra GI toksikozu sonuçları da kaydedilmiştir. Nötropenik epizodlar Veteriner Onkoloji Grubu-Yan Etkiler için Ortak Terminoloji Kriterleri (VCOG-CTCAE) v1.1’e göre derecelendirilmiştir [34]. Bu retrospektif çalışmanın doğası gereği,
GI toksisitesinin VCOG-CTCAE v1.1’e göre derecelendirilmesi yapılamamıştır. GI toksisitesine bağlı yan etkiler aşağıdaki kriterler kullanılarak değerlendirilmiştir: grade 0, yok; grade 1, geçici veya diyet tedavisine yanıt veren iştahsızlık, kusma ve diyare; grade 2, tıbbi tedavi gerektiren iştahsızlık, kusma ve diyare; grade 3, tıbbi tedavi ve kemoterapinin ertelenmesini gerektiren iştahsızlık, kusma ve diyare; ve grade 4, tıbbi tedavi, hastaneye yatış ve kemoterapinin ertelenmesini gerektiren iştahsızlık, kusma ve diyare. Uzman klinisyen bu olayları önceden yapılan bir çalışmada bildirildiği gibi sınıflandırmıştır [21,35].
İstatistiksel Analiz
Çalışma sonlanım noktaları tümör progresyonu ve hastanın ölmesiydi. Progresyonsuz aralık (PFI) tedavi ile hastalık progresyonu arasında geçen süre şeklinde tanımlanmıştır. Sağkalım süresi, tedavi ile lenfomaya bağlı ölüm arasında geçen süre olarak tanımlanmıştır. PFI ve MST, Kaplan-Meieranalizi kullanılarak belirlenmiştir. Son takip muayenesi sırasında hayatta olan veya lenfoma dışındaki nedenlerle ölen kediler sansürlenmiştir.
PFI ve MST üzerindeki bağımsız etkileri açısından aşağıdaki değişkenleri değerlendirmek için tek değişkenli Cox ileri regresyon analizi (ardından birden fazla etkili faktör tespit edilirse çok değişkenli Cox ileri regresyon analizi) kullandık: yaş, cinsiyet, vücut ağırlığı, klinik evre, FeLV/FIVdurumu, tanı sırasında nefes darlığı, kilo kaybı, uyuşukluk, kusma olup olmadığı, tanı sırasında anemi olup olmadığı ve tanı sırasında CBC ve kimya profilleri. Yukarıdaki faktörlerin her bir kedinin CR’ye ulaşıp ulaşmaması üzerindeki etkisini analiz etmek için tek değişkenli lojistik regresyon analizi ve uygun olduğunda çok değişkenli analiz kullandık. <0,05 p-değeri anlamlı kabul edilmiştir. Tüm istatistiksel analizler IBM SPSS Statistics for Windows,
16 kedinin on biri kısırlaştırılmış erkek, diğer beşi ise kısırlaştırılmış dişiydi. 16 kedinin 13’ünde hiporeksi, 11’inde kilo kaybı, 11’inde uyuşukluk, 10’unda kusma ve üçünde ishal klinik belirtileri görülmüştür. Altı kedinin FeLV ve FIV testleri rapor edilmiştir. Bir kedide FeLV pozitif çıkmıştır. Hiçbir hastada FIV pozitif çıkmamıştır.
Tanı konulduğu gün, 16 kedinin altısında anemi (hematokrit <%30) vardı. Tüm kedilerde medyan hematokrit %35 (aralık, %14,3 ila %44,9) idi. Sekiz kedi nötrofilik (aralık, 11,1 ila 26,9 K/μL) ve beş kedi trombositopenikti (42 ila 126 K/μL).
Kimya profillerinde dört kedide azotemi, bir kedide karaciğer gama-glutamil transferaz değerlerinde yükselme ve bir kedide hipoalbüminemi tespit edilmiştir (Tablo 1).
Tanı ve klinik evreleme
Dokuz kediye lenf nodu veya GI kitle biyopsisi ile I/HAL tanısı konmuş, diğer yedi kediye ise ince iğne aspirasyonu ile tanı konulmuştur.
Yedi kedide sindirim sistemi dışında başka organ tutulumu da vardı. Ancak, bazı vakalarda evreleme için ek testler tam olarak yapılmamıştır. Dokuz kedide GI kanalında lokalize tümörler vardı. Bu nedenle, tüm kediler şu iki kategoriden birine sınıflandırıldı: I. evre ve diğer.
Tedaviye alınan yanıt
Tedaviye alınan yanıtın değerlendirilmesi ve sağkalım analizi için on altı kedi mevcuttu. Sağkalım analizi sırasında üç kedi sansürlenmiştir. İki hasta hâlâ hayattaydı ve remisyondaydı. Bu kediler analiz sırasında CR’deydi. Bir kedi NR’deyken lenfoma ile ilgisi olmayan kalp yetmezliğinden ölmüştür. İki kedi tedavinin reddedilmesi ve bir kedi de eksik tıbbi kayıtlar nedeniyle analiz dışı bırakılmıştır. Kurtarma tedavisi 16 kedinin beşinde kullanılmıştır. Bu kedilerden üçü lomustin (CCNU), biri L-asparaginaz ve biri doksorubisin ile tedavi edilmiştir.
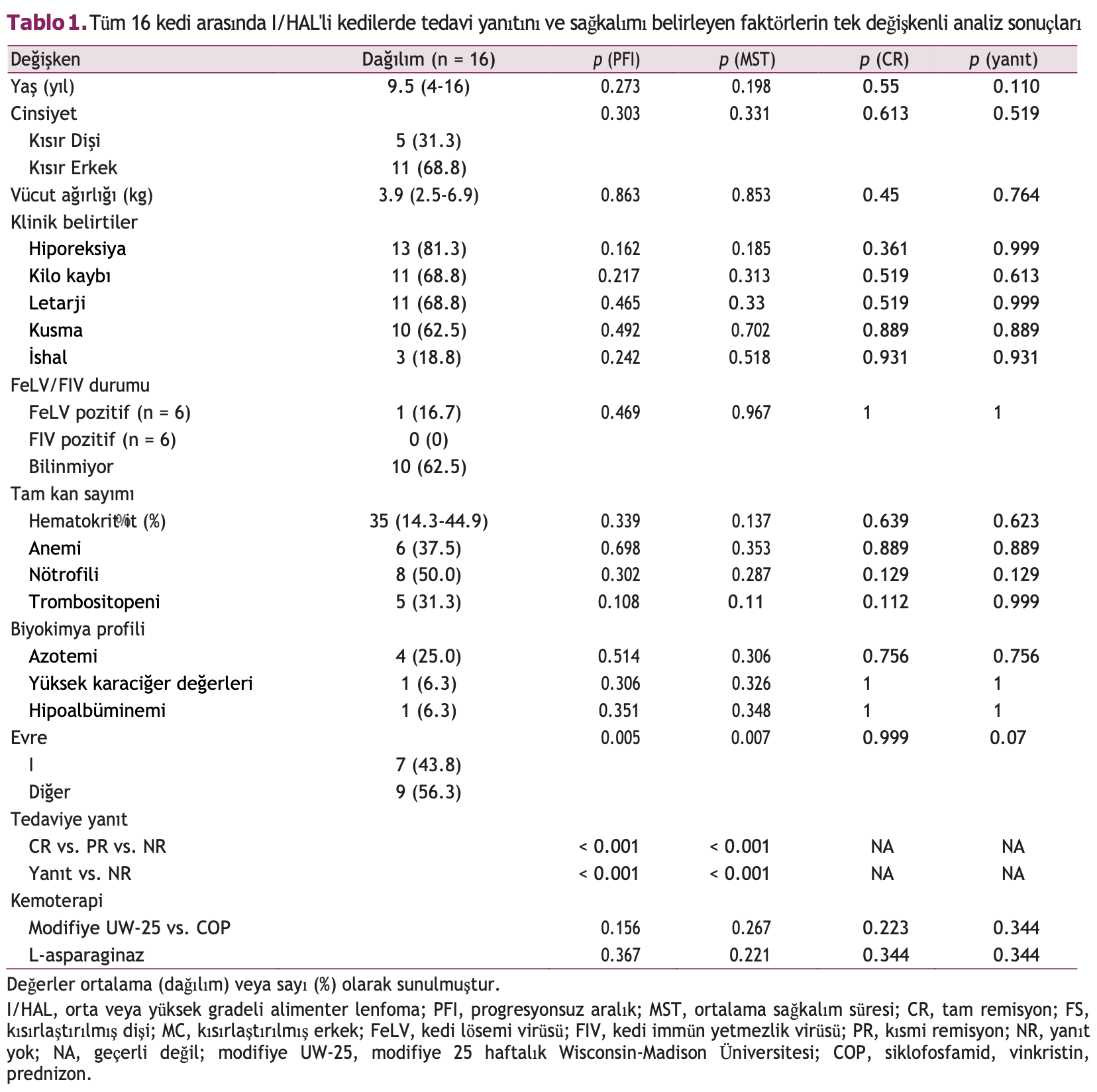
On kediye modifiye UW-25 protokolü ve altı kediye COP protokolü uygulanmıştır. Tüm 16 hastada yanıt dağılımı aşağıdaki gibi olmuştur: CR, beş (%31,3); PR, altı (%37,5); ve NR, beş (%31,3). Genel yanıt oranı (CR + PR) %68,8 idi. Ortalama PFI (MPFI) 49 gün (aralık, 9 ila 824 gün) ve MST 100 gündü (aralık, 9 ila 824 gün) (Şekil 1).
Modifiye UW-25 protokolü ile tedavi edilen kedilerden ikisi (%20,0) CR, dördü (%40,0) PR elde etmiş ve dördü (%40,0) tedaviye yanıt vermemiştir. Modifiye UW-25 protokolü için genel yanıt oranı (CR + PR) %60,0 olmuştur. Modifiye UW-25 protokolü alan kediler arasında MPFI ve MST sırasıyla 35 gün (aralık, 9 ila 824 gün) ve 65 gün (aralık, 9 ila 824 gün) olmuştur.
sürüm 25.0 (IBM gerçekleştirilmiştir.
Sonuçlar
Hasta grubu
Corp., ABD)
kullanılarak
On altı kedi bu retrospektif çalışmaya katılma şartlarını karşılamıştır. Tüm kediler sitolojik veya histopatolojik olarak I/HAL tanısı almış ve kemoterapi ile tedavi edilmiştir (10’u modifiye UW-25 protokolü ve 6’sı COP protokolü ile). Irklar arasında Russian Blue (6), Persian (4), Domestic Short Hair (2), Devon Rex (1), American Short Hair (1), Turkish Angora (1) ve melez (1) vardı. Ortalama yaş 9,5 (dağılım, 4 ila 16 yıl) ve ortalama vücut ağırlığı 3,9 kg (dağılım, 2,5 ila 6,9 kg) idi.
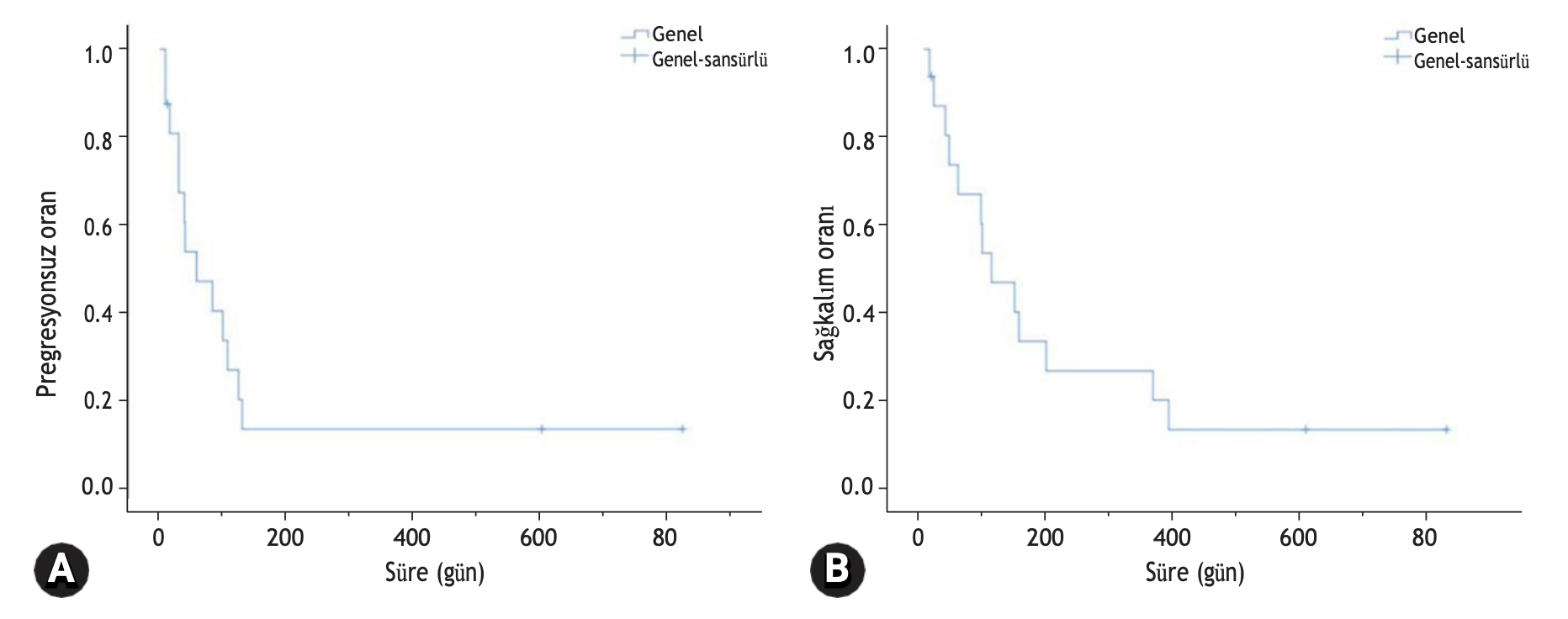
Bununla birlikte, COP protokolü ile tedavi edilen kedilerde yanıt oranı aşağıdaki gibi olmuştur: Üç CR (%50,0); iki PR (%33,3); ve bir NR (%16,7). COP protokolü için genel yanıt oranı (CR + PR) %83’tür. COP protokolü uygulanan kedilerde MPFI ve MST sırasıyla 116 gün (aralık, 30 ila 602 gün) ve 172 gün (aralık, 54 ila 602 gün) olmuştur (Tablo 2). İki protokol arasında yanıt oranı, PFI veya sağkalım süresi açısından istatistiksel olarak anlamlı bir fark yoktu (Şekil 2).
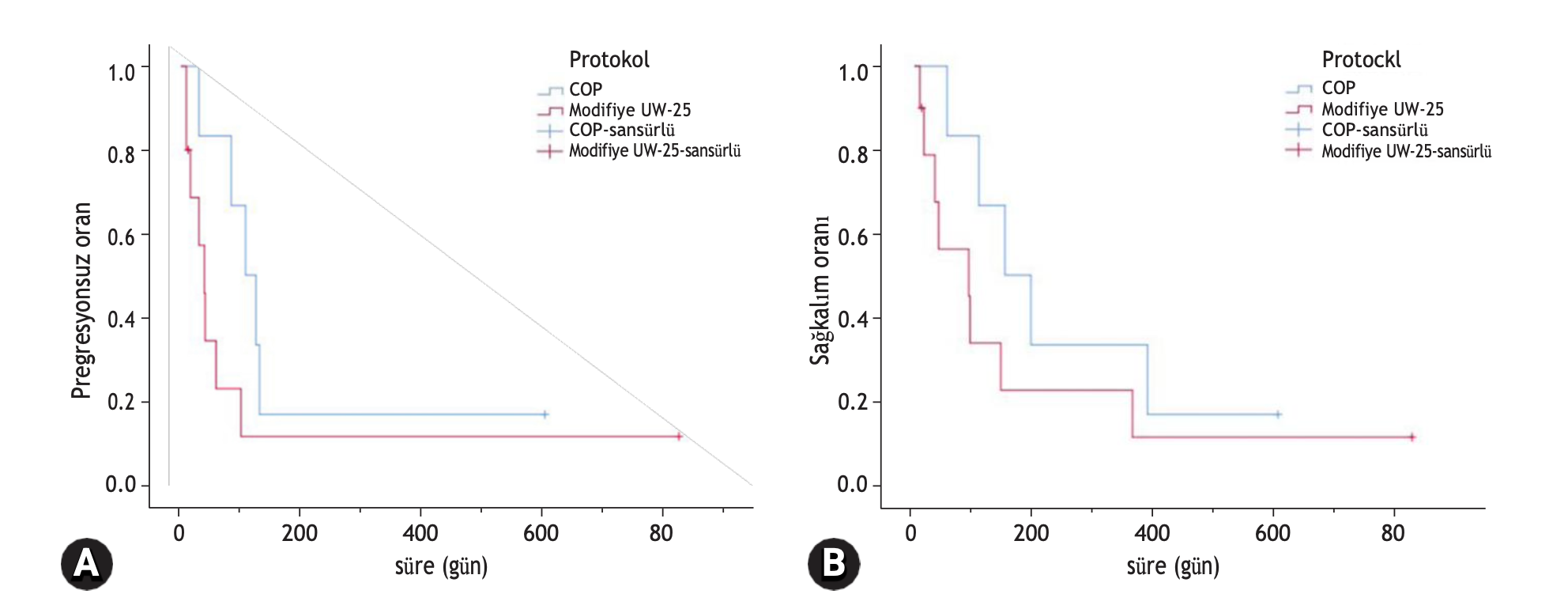
Hem PFI hem de MST, tedaviye yanıt veren kedilerde (CR veya PR), tedaviye yanıt vermeyenlere göre önemli ölçüde
daha uzundu (p < 0.001). CR’li kediler için MPFI 124 gün ( dağılım, 99 ila 824 gün) iken, PR için 49 gün (dağılım, 30 ila 130 gün) ve NR için sadece 12 gündü (dağılım, 9 ila 30 gün). CR elde eden kedilerin MST’si 361 gün ( dağılım, 107 ila 824 gün), PR’si 118 gün (dağılım, 40 ila 386 gün) ve NR’si 16 gün (dağılım, 9 ila 54 gün) olmuştur (Şekil 3).
Faktör analizi sonucunda PFI ve MST’yi etkileyen tek faktörün evreleme olduğu görülmüştür. I. evre grubu diğer evre gruplarına göre daha uzun PFI ve MST’ye sahipti (I. evreye karşı diğerleri; PFI, 107 güne karşı 30 gün; MST, 193 güne karşı 54 gün).
Şekil 1. Orta veya yüksek gradeli alimenter lenfomalı 16 kedinin Kaplan-Meier sağkalım eğrisi. (A) Progresyonsuz aralık ve (B) sağkalım süresi.
Diğer faktörler PFI veya MST için istatistiksel olarak anlamlı değildi. İncelenen diğer değişkenlerin hiçbiri CR veya tedavi yanıtı elde edilmesinde belirleyici olmamıştır (Tablo 1).
Toksisite
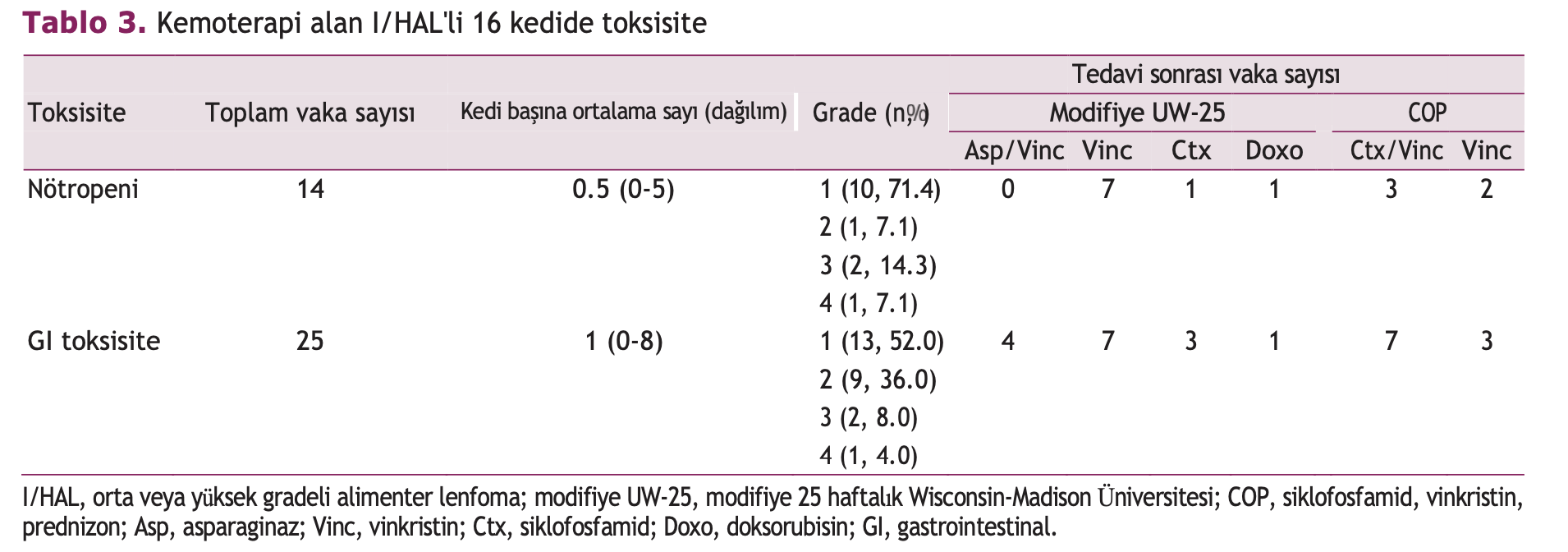
14 nötropenik epizod görülmüştür. Modifiye UW-25 protokolü uygulanan 10 hastada dokuz atak ve COP protokolü uygulanan altı hastada beş atak kaydedilmiştir. Kedi başına ortalama atak sayısı 0,5’tir (aralık, 0 ila 5). Sekiz kedide (modifiye UW-25 grubunda beş ve COP grubunda üç) hiç nötropenik epizod görülmemiştir. Nötropeni %71,4’ünde (n =
10) grade 1, %7,1’inde (n = 1) grade 2, %14,3’ünde (n = 2) grade 3 ve %7,1’inde (n = 1) grade 4 idi. Modifiye UW-25 protokolünü alan gruplarda nötropenik epizod sayısı grade 1’de altı, grade 2’de bir ve grade 3’te iki olmuştur. COP protokolünü alan gruplarda, grade 1’de dört ve grade 4’te bir nötropenik epizod vardı. Modifiye UW-25 protokolü ile tedavi edilen kedilerdeki nötropenik olayların dağılımı vinkristin ve L-asparaginaz ile tedaviden sonra hiç, vinkristin ile yedi, siklofosfamid ile bir ve doksorubisin ile bir şeklindeydi. COP protokolü ile tedavi edilen kedilerdeki nötropenik vakaların dağılımı, vinkristin ve siklofosfat mide ile tedaviden sonra üç,
vinkristin ile iki vaka şeklindeydi vinkristin ile iki vaka şeklindeydi(Tablo 3).
Şekil 2. Orta veya yüksek gradeli alimenter lenfomalı 16 kedinin Kaplan-Meier eğrisi. (A) Progresyonsuz aralık (PFI) ve (B) sağkalım süresi. Mavi çizgi siklofosfamid, vinkristin, prednizon (COP) protokolü alan kedileri; kırmızı çizgi ise modifiye edilmiş 25 haftalık Wisconsin-Madison Üniversitesi (UW-25) protokolü alan kedileri göstermektedir. İki protokol arasında PFI veya sağkalım süresi açısından anlamlı bir fark bulunmamıştır (PFI: p = 0,142; ortalama sağkalım süresi: p = 0,260).
Şekil 3. Kemoterapi ile tedavi edilen orta veya yüksek dereceli alimenter lenfomalı 16 kedinin Kaplan-Meier eğrisi. (A) Progresyonsuz aralık (PFI) ve (B) sağkalım süresi. Mavi çizgi tam remisyon (CR) elde eden kedileri, kırmızı çizgi kısmi remisyon (PR) elde eden kedileri ve yeşil çizgi tedaviye yanıt vermeyen kedileri göstermektedir. Yanıt grupları arasında PFI ve sağkalım süresi açısından anlamlı bir fark tespit edilmiştir (PFI: p < 0,001; ortalama sağkalım süresi: p < 0,001). NR, yanıt yok.
Tüm 16 kedi arasında belgelenen 25 GI toksisitesi yan etkisi vardı (modifiye UW-25 protokolü alan hastalarda 15 ve COP protokolünde 10). Kedi başına ortalama vaka sayısı 1’dir ( dağılım, 0 ila 8). Beş kedide (modifiye UW-25 grubunda üç ve COP grubunda iki) Gİ toksisite atağı görülmemiştir. Gİ toksisite yan etki sayısı %52,0 (n = 13) oranında grade 1, %36,0 (n = 9) oranında grade 2, %8,0 (n = 2) oranında grade 3 ve %4,0 (n = 1) oranında grade 4 idi. Modifiye UW-25 protokolü ile tedavi edilen 10 kedide, 6 / 10
vinkristin ve l- asparaginaz ile indüksiyon tedavisinden sonra dört, vinkristin ile yedi, siklofosfamid ile üç ve doksorubisin ile bir atak meydana gelmiştir. COP protokolü ile tedavi edilen gruplarda, siklofosfamid ve vinkristin ile tedaviden sonra yedi ve vinkristinden sonra üç atak meydana gelmiştir (Tablo 3).
Tedavi ve takip dönemindeki kilo değişimiyle ilgili olarak, sekiz kedi (%50,0) kilosunu korumuş, dört kedi (%25,0) temel
T artışma
I/HAL’li bu 16 kedinin klinik özellikleri diğer raporlarda tanımlananlarla karşılaştırılabilir nitelikteydi. I/HAL’li kedilerin ortalama yaşı 9,5 idi ve bu da yaş aralıklarında yakın zamanda kaydedilen değişimle tutarlıydı [17,36]. Hiporeksi (%81,3), kilo kaybı (%68,8), letarji (%68,8) ve kusma (%62,5) bu çalışmada bildirilen en yaygın klinik belirtilerdi. Bu durum, diyare (%19’a karşılık %70 ila %90) hariç, AL ile ilgili önceki raporlarla benzerlik göstermektedir [1,12-14]. Siyamlarda lenfoma gelişme riski daha yüksektir. Bununla birlikte, AL’nin düşük bir yüzdesini temsil etmektedirler. Bu çalışmaya hiçbir Siyam kedisi dahil edilmemiştir. Son çalışmalarda, Siyam kedileri de AL’de düşük bir yüzdeyi temsil etmektedir [1,2,7,37]. Bu durum, Siyam kedilerinde AL gelişme riskinin düşük olduğunu yansıtıyor olabilir [14,16,17,36]. Bir başka olasılık da, bu çalışmadaki örneklem büyüklüğünün küçük olması nedeniyle Siyam kedilerinin ırka dahil edilmemiş olabileceğidir. Diğer makalelerdeki vakaların çoğu Domestic Short Hair gibi görünse de, Russian Blue ırkı bu makaledeki kedilerin en büyük yüzdesini oluşturmaktadır [1,2,7,37].
Buna ek olarak, bu rapordaki I/HAL’li kediler çoğunlukla erkekti (11/16) ve eğer aynı oranda dişi ve erkek hastaneye gelseydi, sonuçlar erkeklerin daha fazla temsil edildiğini gösterebilirdi. Ancak, her bir kuruma getirilen erkek ve dişi kedilerin oranına ilişkin veriler mevcut değildir ve bu çalışmanın küçük örneklem büyüklüğü nedeniyle, bu sonuç tedbirli davranılarak yorumlanmalıdır.
Nötrofili (%50.0), anemi (%37.5) ve trombositopeni (%31.3) bu çalışmada sık görülen bulgulardı. Bu sonuçlar
diğer raporlarda da görülmüştür [1,4,14,15,38].
The Modifiye UW-25 ve COP kemoterapi protokollerine verilen genel birleşik yanıt oranı %69’dur ve hastaların %31’i CR elde etmiştir; bu bulgular diğer çalışmaların sonuçlarına benzerdir [10,11,16,17,22,30]. Modifiye UW-25 protokolü ile elde edilen CR oranı %20’dir ve bu oran başka bir çalışmadaki oranla (%25) karşılaştırılabilir [11]. COP protokolü uygulanan kedilerde gözlenen CR oranı (%50) daha önce bildirilenden (%32) daha yüksektir [4]. Tedavi edilen kedilerde genel PFI ve MST sırasıyla 49 ve 99 gündü. Modifiye UW-25 protokolü ile PFI ve MST sırasıyla 35 ve 65 gündü, bu da başka bir çalışma tarafından bildirilenden daha kısaydı (sırasıyla 50 ve 85 gün) [11]. COP protokolünü alan kedilerde gözlenen PFI ve MST (116 ve 172 gün) önceki bir çalışmadakinden daha uzundu (MST, 50 gün; PFI belirtilmedi) [4]. Bu veriler, orta ila yüksek dereceli lenfomalı kedilerin prognozunun kötü olduğunu göstermektedir. İki protokol arasında CR oranı, PFI veya MST açısından istatistiksel olarak anlamlı bir fark yoktu. Bu sonuç doksorubisinin faydalı olup olmadığı konusunda şüphe uyandırmaktadır. Ancak, vaka sayısının az olması iki protokol arasında bir fark tespit etme olasılığını azaltmış olabilir. Kedi I/HAL’de her iki protokolle ilişkilendirilen çok az bilgi vardı. Bu bulguları doğrulamak için daha geniş bir kedi grubunu
kapsayan yeni bir araştırmaya ihtiyaç vardır.
Bu çalışmada sadece birkaç prognostik faktörü inceledik.
Tedaviye verilen yanıt, kedi lenfoması çalışmalarındaki en tutarlı faktörlerden biridir [3,11,17]. Tedaviye yanıt veren kedilerde istatistiksel olarak anlamlı derecede daha uzun PFI ve MST görülmüştür. Bu nedenle, tedavi yanıtının değerlendirilmesi prognozun öngörülmesi açısından önemlidir. Klinik evrenin de PFI ve MST için prognostik bir faktör olduğu belirlenmiştir. I. evredeki kedilerin PFI ve MST süreleri diğer evrelerdekilere göre
daha uzundu (PFI, 107’ye karşı 30 gün;
MST, 193’e karşı 54 gün). Diğer çalışmalar I. evre hastalığın nispeten daha olumlu bir prognoza sahip olduğunu göstermiştir [6,16,23]. Bu sonuç, klinik evrenin değerlendirilmesinin önemine ağırlık kazandırmaktadır. Başka hiçbir prognostik faktör PFI veya MST’yi etkilememiştir. Bu çalışmanın kısıtlamalarından biri, kedi sayısının az olmasının diğer prognostik faktörlerin önemini tespit etmek için yeterli etki yaratmamış olabileceğidir.
Bu çalışmada, hematolojik ve GI toksikoz çoğunlukla düşük dereceli olup önceki çalışmalarda bildirilenlerle karşılaştırılabilir niteliktedir [21,29]. Her bir kedideki nötropenik ve GI yan etkilerin ortalama sayısı önceki raporlara benzer [21] ve başka bir rapordan [29] daha düşüktü. Farklı kemoterapi protokolleri de bu sonuca yol açabilir. Modifiye UW-25 protokolü ile COP protokolü karşılaştırıldığında, nötropenik epizodların sayısı ve derece düzeylerinde çok fazla fark görülmemiştir. Bu nedenle, bu iki terapötik rejimin kabul edilebilir tolerabiliteye sahip protokoller olduğu düşünülmüştür. Bu makalede, kemoterapiye başlamadan önce kilo kaybı veya tedavi sırasında kilo değişikliği ya da başlangıçtaki vücut ağırlığı sonucu etkilememiştir. Ancak, bir çalışmada tedavi öncesi kilo kaybı öyküsünün CR elde etme üzerinde olumsuz etkisi olduğu görülmüştür [25]. Buna ek olarak, çalışmalar başlangıçtaki vücut ağırlığının veya tedavi sırasındaki kilo değişikliğinin prognoz üzerinde etkisi olduğunu rapor etmiştir [28,39]. Bu farklı sonuçlar, mevcut çalışmadaki denek sayısının az olmasından kaynaklanıyor olabilir. Diğer bir olasılık ise, bu çalışmada yalnızca I/ HAL ele alınmış olmasına rağmen, önceki çalışmalarda çeşitli anatomik formlara veya farklı derecelere sahip lenfomaların dahil edilmiş olmasıdır. I/HAL’de kilonun sonuç üzerindeki etkisini belirlemek için geniş kapsamlı bir çalışma yapılması gerekmektedir.
Alimenter form kedi lenfomasında en yaygın olanıdır, ancak özellikle çok ajanlı kemoterapi ile I/HAL’de tek başına alimenter formu değerlendiren çok az makale vardır. Bu çalışma modifiye UW- 25 protokolünün toksisitesini değerlendiren ilk çalışmadır. Bununla birlikte, bu çalışmanın çeşitli sınırlamaları bulunmaktadır. Bu çalışmanın sınırlılıkları arasında çok kurumlu ve retrospektif olması yer almaktadır. Evreleme genellikle maliyet ve hastanın ileri tetkikleri reddetmesi ile sınırlı kalmıştır. Bir diğer önemli kısıtlama ise tedavi yanıtının değerlendirilmesinde standart bir zamanlamanın olmamasıdır. İzlemede tutarlılık eksikliği, tüm retrospektif çalışmaların doğasında olan bir özelliktir. Bir diğer kısıtlama ise kurtarma tedavisinde çeşitli protokollerin uygulanmış olmasıdır. Beş kedi (%31,3) kurtarma tedavisi almıştır. Bu standartlaştırılmamış kurtarma protokolü muhtemelen her hastanın sağkalım süresini farklı şekilde etkilemiştir.
Sonuç olarak, sitolojik veya histopatolojik olarak I/HAL tanısı konulan on altı kedi bu retrospektif çalışmaya dahil edilme şartlarını karşılamıştır. I/HAL, çoğunlukla Rus Mavisi
olmak üzere çeşitli ırklarda bulunmuştur. Kedilerde I/HAL 4 ila 16 yaş arasında dağılım göstermiş ve ileri yaşlarda yaygınlık göstermiştir. Çok ajanlı kemoterapi ile tedavi edilen I/HAL kötü prognoza sahipti (MPFI, 49 gün; MST, 100 gün). Modifiye UW-25 ve COP protokolü arasında tedaviye yanıt ve sağkalım açısından istatistiksel olarak anlamlı bir fark bulunmamıştır. Bu iki protokolle tedavi sırasında hematolojik ve GI toksisitesi çoğunlukla düşük grade’liydi. İki protokol arasında anlamlı bir fark bulunmamıştır. Bu çalışmada, klinik evre ve tedavi yanıtı I/HAL’li kedilerde prognostik faktörlerdir.
T eşekkürler
“Evcil Hayvan Araştırmaları Merkezi İş Birliği Araştırma Programı “na (Proje no. PJ01404502) teşekkür ederiz: Bölgesel Kalkınma İdaresi, Kore Cumhuriyeti. Tıbbi çizelgeleri paylaştığı için ” Kore Hayvan Tıp Merkezi”, Cheongju, Kore’ye teşekkür ederiz.
ORCID
Dong-Hyuk Kwak, https://orcid.org/0000-0002-1172-1044 Mun-Ju Cho, https://orcid.org/0000-0003-2350-0588 Hyung-Jin Park, https://orcid.org/0000-0002-4383-1037 Kun-Ho Song, https://orcid.org/0000-0001-8478-2035 Kyoung Won Seo, https://orcid.org/0000-0002-1561-3278
Kaynakça
1. Barrs VR, Beatty JA. Feline alimentary lymphoma: 1. Classifi- cation, risk factors, clinical signs and non-invasive diagnostics. J Feline Med Surg 2012;14:182-190.
2. Rissetto K, Villamil JA, Selting KA, Tyler J, Henry CJ. Recent trends in feline intestinal neoplasia: an epidemiologic study of 1,129 cases in the veterinary medical database from 1964 to 2004. J Am Anim Hosp Assoc 2011;47:28-36.
3. Vail DM, Thamm DH, Liptak JM. Withrow and MacEwen’s Small Animal Clinical Oncology. 6th ed. Elsevier, St. Louis, 2020.
4. Mahony OM, Moore AS, Cotter SM, Engler SJ, Brown D, Penninck DG. Alimentary lymphoma in cats: 28 cases (1988- 1993). J Am Vet Med Assoc 1995;207:1593-1598.
5. Gabor LJ, Malik R, Canfield PJ. Clinical and anatomical fea- tures of lymphosarcoma in 118 cats. Aust Vet J 1998;76:725- 732.
6. Vail DM, Moore AS, Ogilvie GK, Volk LM. Feline lymphoma (145 cases): proliferation indices, cluster of differentiation 3
immunoreactivity, and their association with prognosis in 90
cats. J Vet Intern Med 1998;12:349-354.
- Louwerens M, London CA, Pedersen NC, Lyons LA. Feline
lymphoma in the post-feline leukemia virus era. J Vet Intern
Med 2005;19:329-335.
- Stützer B, Simon K, Lutz H, Majzoub M, Hermanns W,
Hirschberger J, Sauter-Louis C, Hartmann K. Incidence of persistent viraemia and latent feline leukaemia virus infection in cats with lymphoma. J Feline Med Surg 2011;13:81-87.
- Vezzali E, Parodi AL, Marcato PS, Bettini G. Histopathologic classification of 171 cases of canine and feline non-Hodgkin lymphoma according to the WHO. Vet Comp Oncol 2010;8:38- 49.
- Rau SE, Burgess KE. A retrospective evaluation of lomustine (CeeNU) in 32 treatment naïve cats with intermediate to large cell gastrointestinal lymphoma (2006-2013). Vet Comp Oncol 2017;15:1019-1028.
- Collette SA, Allstadt SD, Chon EM, Vernau W, Smith AN, Garrett LD, Choy K, Rebhun RB, Rodriguez CO Jr, Skorupski KA. Treatment of feline intermediate- to high-grade lympho- ma with a modified university of Wisconsin-Madison proto- col: 119 cases (2004-2012). Vet Comp Oncol 2016;14(Suppl 1):136-146.
- Gieger T. Alimentary lymphoma in cats and dogs. Vet Clin North Am Small Anim Pract 2011;41:419-432.
- Kiselow MA, Rassnick KM, McDonough SP, Goldstein RE, Simpson KW, Weinkle TK, Erb HN. Outcome of cats with low-grade lymphocytic lymphoma: 41 cases (1995-2005). J Am Vet Med Assoc 2008;232:405-410.
- Lingard AE, Briscoe K, Beatty JA, Moore AS, Crowley AM, Krockenberger M, Churcher RK, Canfield PJ, Barrs VR. Low- grade alimentary lymphoma: clinicopathological findings and response to treatment in 17 cases. J Feline Med Surg 2009;11: 692-700.
15. Fondacaro JV, Richter KP, Carpenter JL, Hart JR, Hill SL, Fett- man MJ. Feline gastrointestinal lymphoma: 67 cases (1988– 1996). Eur J Comp Gastroenterol 1999;4:5-11.
- Gouldin ED, Mullin C, Morges M, Mehler SJ, de Lorimier LP, Oakley C, Risbon R, May L, Kahn SA, Clifford C. Feline dis- crete high-grade gastrointestinal lymphoma treated with surgi- cal resection and adjuvant CHOP-based chemotherapy: retro- spective study of 20 cases. Vet Comp Oncol 2017;15:328-335.
- Gustafson TL, Villamil A, Taylor BE, Flory A. A retrospective study of feline gastric lymphoma in 16 chemotherapy-treated cats. J Am Anim Hosp Assoc 2014;50:46-52.
18. Moore AS, Cotter SM, Frimberger AE, Wood CA, Rand WM, L’Heureux DA. A comparison of doxorubicin and COP for
19. 20.
21.
maintenance of remission in cats with lymphoma. J Vet Intern Med 1996;10:372-375.
Malik R, Gabor LJ, Foster SF, McCorkell BE, Canfield PJ. Therapy for Australian cats with lymphosarcoma. Aust Vet J 2001;79:808-817.
Teske E, van Straten G, van Noort R, Rutteman GR. Chemo- therapy with cyclophosphamide, vincristine, and predniso- lone (COP) in cats with malignant lymphoma: new results with an old protocol. J Vet Intern Med 2002;16:179-186. Simon D, Eberle N, Laacke-Singer L, Nolte I. Combination chemotherapy in feline lymphoma: treatment outcome, toler- ability, and duration in 23 cats. J Vet Intern Med 2008;22:394- 400.
22. Waite AH, Jackson K, Gregor TP, Krick EL. Lymphoma in cats treated with a weekly cyclophosphamide-, vincristine-, and prednisone-based protocol: 114 cases (1998-2008). J Am Vet Med Assoc 2013;242:1104-1109.
23. Mooney SC, Hayes AA, MacEwen EG, Matus RE, Geary A, Shurgot BA. Treatment and prognostic factors in lymphoma in cats: 103 cases (1977-1981). J Am Vet Med Assoc 1989;194: 696-702.
24. Milner RJ, Peyton J, Cooke K, Fox LE, Gallagher A, Gordon P, Hester J. Response rates and survival times for cats with lym- phoma treated with the University of Wisconsin-Madison chemotherapy protocol: 38 cases (1996-2003). J Am Vet Med Assoc 2005;227:1118-1122.
25. Hadden AG, Cotter SM, Rand W, Moore AS, Davis RM, Mor- rissey P. Efficacy and toxicosis of VELCAP-C treatment of lymphoma in cats. J Vet Intern Med 2008;22:153-157.
26. Kristal O, Lana SE, Ogilvie GK, Rand WM, Cotter SM, Moore AS. Single agent chemotherapy with doxorubicin for feline lymphoma: a retrospective study of 19 cases (1994-1997). J Vet Intern Med 2001;15:125-130.
27. Stein TJ, Pellin M, Steinberg H, Chun R. Treatment of feline gastrointestinal small-cell lymphoma with chlorambucil and glucocorticoids. J Am Anim Hosp Assoc 2010;46:413-417.
28. Krick EL, Cohen RB, Gregor TP, Salah PC, Sorenmo KU. Pro- spective clinical trial to compare vincristine and vinblastine in a COP-based protocol for lymphoma in cats. J Vet Intern Med 2013;27:134-140.
29. Limmer S, Eberle N, Nerschbach V, Nolte I, Betz D. Treatment of feline lymphoma using a 12-week, maintenance-free com- bination chemotherapy protocol in 26 cats. Vet Comp Oncol 2016;14 Suppl 1:21-31.
30. Barrs VR, Beatty JA. Feline alimentary lymphoma: 2. Further diagnostics, therapy and prognosis. J Feline Med Surg 2012; 14:191-201.
31. Taylor SS, Goodfellow MR, Browne WJ, Walding B, Murphy S, Tzannes S, Gerou-Ferriani M, Schwartz A, Dobson JM. Feline extranodal lymphoma: response to chemotherapy and surviv- al in 110 cats. J Small Anim Pract 2009;50:584-592.
32. Kiupel M, Smedley RC, Pfent C, Xie Y, Xue Y, Wise AG, DeVaul JM, Maes RK. Diagnostic algorithm to differentiate lymphoma from inflammation in feline small intestinal biop- sy samples. Vet Pathol 2011;48:212-222.
33. Cotter SM. Treatment of lymphoma and leukemia with cyclo- phosphamide, vincristine, and prednisone. I. Treatment of dogs. J Am Anim Hosp Assoc 1983;19:159-165.
34. Veterinary Cooperative Oncology Group-Common Termi- nology Criteria for Adverse Events (VCOG-CTCAE) follow- ing chemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Vet Comp Oncol 2016;14:417-446.
35. Simon D, Nolte I, Eberle N, Abbrederis N, Killich M, Hirsch- berger J. Treatment of dogs with lymphoma using a 12-week,
maintenance-free combination chemotherapy protocol. J Vet
Intern Med 2006;20:948-954.
36. Tidd KS, Durham AC, Brown DC, Velovolu S, Nagel J, Krick
EL. Outcomes in 40 cats with discrete intermediate- or large- cell gastrointestinal lymphoma masses treated with surgical mass resection (2005-2015). Vet Surg 2019;48:1218-1228.
37. Sabattini S, Bottero E, Turba ME, Vicchi F, Bo S, Bettini G. Differentiating feline inflammatory bowel disease from ali- mentary lymphoma in duodenal endoscopic biopsies. J Small Anim Pract 2016;57:396-401.
38. Sapierzyński R, Jankowska U, Jagielski D, Kliczkowska-Klaro- wicz K. Large granular lymphoma in six cats. Pol J Vet Sci 2015;18:163-169.
39. Krick EL, Moore RH, Cohen RB, Sorenmo KU. Prognostic significance of weight changes during treatment of feline lym- phoma. J Feline Med Surg 2011;13:976-983.