Journal of Feline Medicine and Surgery 2022, Cilt 24(12) 1187-1194
© Yazar(lar) 2021 Makale kullanım kuralları: sagepub.com/journals-permissions DOI: 10.1177/1098612X211067023 journals.sagepub.com/home/jfm
Bu makale JFMS’de yayınlanmak üzere Amerikan Editörlük Ofisi (AAFP) tarafından değerlendirilmiş ve yayına hazırlanmıştır.
Özet
Journal of Feline Medicine and Surgery 2022, Cilt 24(12) 1187-1194
© Yazar(lar) 2021 Makale kullanım kuralları: sagepub.com/journals-permissions DOI: 10.1177/1098612X211067023 journals.sagepub.com/home/jfm
Bu makale JFMS’de yayınlanmak üzere Amerikan Editörlük Ofisi (AAFP) tarafından değerlendirilmiş ve yayına hazırlanmıştır.
Amaç Non-steroidal anti-enflamatuar ilaçlar (NSAID’ler), böbrek yetmezliği endişesi nedeniyle kedilerde nadiren kullanılmaktadır; ancak yapılan son çalışmalar düşük doz meloksikamın tolere edilebilir olduğunu göstermektedir. Toceranib fosfat birçok kedi kanserinin tedavisinde kullanılmaktadır ve iyi tolere edilmektedir. Bu çalışmanın amacı, kanserli kedilerde toceranib ve düşük doz meloksikam kombinasyonunun tolere edilebilirliğini ve yan etkilerini belirlemektir. İkincil hedefler arasında antikanser etki ile yaşam kalitesi ve analjezi üzerindeki etkinin değerlendirilmesi yer almaktadır.
Metod Böbrek hariç olmak üzere başka türlü kanseri olan kediler çalışmaya dahil edilmiştir. Çalışmada geleneksel 3 + 3 doz eskalasyon tasarımı kullanılmıştır. Toceranib gün aşırı standart dozda uygulanmış ve meloksikam, önceki güvenlik çalışmalarına dayanarak, günde maksimum 0,02 mg/kg’a kadar, toceranib ile zıt günlerde 0,01 mg/kg’lık başlangıç dozunda, sonraki kohortlarda giderek artacak şekilde uygulanmıştır. Laboratuvar çalışmaları, kan basıncı, tümör ölçümleri, ağrı skoru ve hasta tarafından tamamlanan yaşam kalitesi anketleri 12 haftalık çalışma süresi boyunca her 2-4 haftada bir kayda alınmıştır. Bulgular Yirmi bir kedi çalışmaya dahil edilmiştir. Toceranib ile kombine edildiğinde, 0.02 mg/kg q24h meloksikam dozu güvenli ve iyi tolere edilmiş, ilaç kombinasyonundan kaynaklanan yan etkiler nedeniyle hiçbir kedi tedaviden çıkarılmamıştır. Kedilerin çoğunda tümör ölçümleri, yaşam kalitesi ve ağrı skorlarında stabil ila hafif iyileşme şeklinde klinik fayda görülmüştür.
Sonuç ve değerlendirme Düşük doz meloksikam ile toceranib kombinasyonu kanserli kedilerde güvenli ve iyi tolere edilmektedir. Tolere edilebilir maksimum meloksikam dozunu belirlemek için hasta kabulüne ve veri toplamaya devam edilmesi gerekmektedir. Çalışmamızın sonuçları daha sonraki faz II/III denemelerine rehberlik edecektir.
Anahtar Kelimeler: Kemoterapi; non-steroid anti-inflamatuvar ilaç; onkoloji; toceranib Kabul Tarihi: 27 Kasım 2021
Giriş
Non-steroid anti-enflamatuar ilaçlar (NSAİİ’ler), köpek ve insan neoplazmlarını hedef alan protokollerde, kansere bağlı ağrı ve enflamasyonu azaltmak için destekleyici ilaçlar olarak, doğrudan antineoplastik özellikler için veya ileri yaşta, kanserli hastalarda görülen diğer kronik enflamatuar rahatsızlıkları (dejeneratif eklem hastalığı [DJD] gibi) tedavi etmek için sıklıkla kullanılmaktadır.1 NSAİİ’ler, siklooksijenaz (COX) enzimleri tarafından araşidonik asitten prostaglandin üretimini inhibe eder. COX-2’nin upregülasyonu birçok insan ve köpek kanserinde tespit edilmiştir ve tümör hücrelerinin artan agresif potansiyeliyle ilişkilendirilmiştir.2,3
Onkoloji hastalarında NSAİİ kullanımının varsayılan faydalarına rağmen, farmakolojik metabolizmadaki
farklılıklar ve özellikle de yaşlı kedilerde kronik böbrek hastalığının yüksek insidansı göz önüne alındığında, böbrek yetmezliği endişesi nedeniyle kronik NSAİİ’ler kedi hastalarında nadiren kullanılmaktadır.4 2010 yılında Federal İlaç İdaresi, meloksikamın kedilerde tekrarlı kullanımına karşı bir ‘kara kutu uyarısı’ yayınladı; şu anda onaylanmış tek kullanım, postoperatif ağrı için tek seferlik enjeksiyon (0.3 mg/kg) kullanımıdır.5
Veteriner Fakültesi, Wisconsin-Madison Üniversitesi, Madison, WI, ABD
İlgili yazar:
MacKenzie A Pellin DVM, DACVIM (Onkoloji), DACVR, Veteriner Fakültesi, Wisconsin-Madison Üniversitesi, 2015 Linden Drive, Madison, WI, 53706, ABD
Kedilerin hepatik glukuronidasyon kapasitesinin düşük olması toksisitenin, özellikle de renal toksisitenin artış göstermesine neden olur.
Daha düşük dozlarda meloksikam bazı Avrupa ülkelerinde ve Avustralya’da kullanım ruhsatına sahiptir ve Uluslararası Kedi Tıbbı Derneği ve Amerikan Kedi Hekimleri Derneği kılavuzları kedilerde uzun süreli NSAİİ tedavisinin yararlarının risklerinden daha ağır bastığını öne sürmektedir.6 Düşük doz meloksikam – günlük 0,02 mg/kg veya 0,01-0,03 mg/kg aralığında – yakın zamanda DJD veya kronik böbrek hastalığı (KBH) olan kedi hastalarında değerlendirilmiş ve renal toksisite bulgusu olmaksızın iyi tolere edildiği görülmüştür.7-9
Toceranib fosfat (Palladia; Zoetis), mast hücre tümörleri, kedi oral skuamöz hücreli karsinomu (FOSCC) ve diğer epitelyal neoplazmlar dahil olmak üzere çeşitli köpek ve kedi neoplazmlarını tedavi etmek için kullanılan, oral yoldan uygulanan reseptör tirozin kinaz inhibitörüdür.10 -15 Yapılan çok sayıda çalışma, toceranibin kedilerde genellikle iyi tolere edildiğini ve toksisitenin tipik olarak hafif gastrointestinal, miyelosupresif ve hepatotoksik etkilerle sınırlı olduğunu göstermiştir.15-17 Renal toksisite sık görülmemektedir; çeşitli retrospektif çalışmalarda toceranib uygulamasına bağlı azotemi hastaların %0-14,5’inde bildirilmiş olup, çoğu vaka hafif şiddettedir ve herhangi bir müdahale gerektirmemektedir.15-17
Kedilerde toceranib ve meloksikam kombinasyonunu değerlendiren prospektif, doz kontrollü klinik çalışmalar henüz mevcut değildir. Bu çalışmanın birincil amacı, kanserli kedilerde standart dozda toceranib ile birlikte düşük doz meloksikamın (önceki çalışmalara dayanarak günde 0,02 mg/kg’a kadar) güvenli olup olmadığını ve yan etkilerini belirlemektir. Etkinlik, güvenlik çalışmalarının birincil son noktası olmasa da, ikincil hedef, kombinasyonun antikanser etkisinin yanı sıra yaşam kalitesi (QOL) ve analjezi üzerindeki etkisini araştırmaktı.
Materyal ve metod
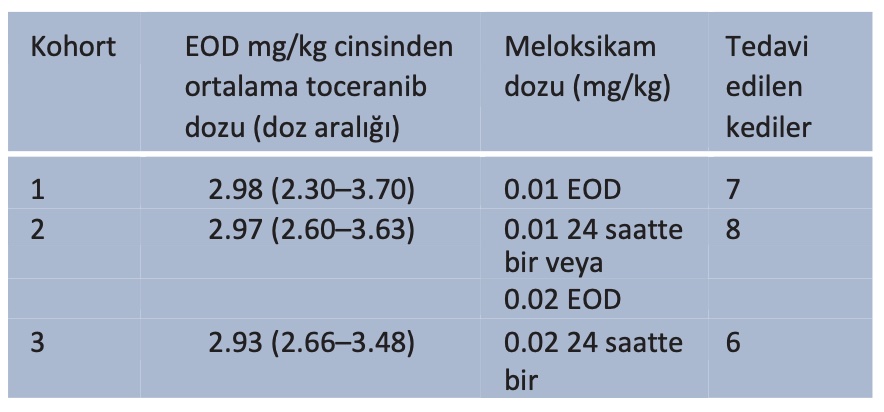
Bu prospektif doz eskalasyon klinik çalışmasında geleneksel 3 + 3 kohort tasarımı kullanılmıştır.18 Tüm kediler gün aşırı ağızdan (PO) toceranib almıştır; toceranib kapsül boyutu (10 veya 15 mg) ve kedi hastaların tipik boyutları göz önüne alındığında, kediler 2,5-3,75 mg/kg hedef doz almıştır. Meloksikam dozu, kohort 1’de gün aşırı 0,01 mg/kg PO başlangıç dozu ile arttırılmış ve toceranib ile zıt günlerde uygulanmıştır. Üç kediden oluşan bir kohortta doz sınırlayıcı toksisite (DLT) görülmezse, meloksikam dozu sonraki kohortlarda tolere edilebilir maksimum doz (MTD) belirlenene veya günlük 0,02 mg/kg doza ulaşılana kadar artırılmıştır. DLT, grade 4’ün doz sınırlayıcı olarak tanımlandığı hematopoetik olaylar (örn. nötropeni, trombositopeni) dışında klinik olarak ilgili olan herhangi bir grade 3 veya daha yüksek yan etki (Veteriner Onkoloji Grubu’nun yan etkiler için ortak terminoloji kriterlerine göre, VCOG-CTCAE v1.1)19 şeklinde tanımlanmıştır.
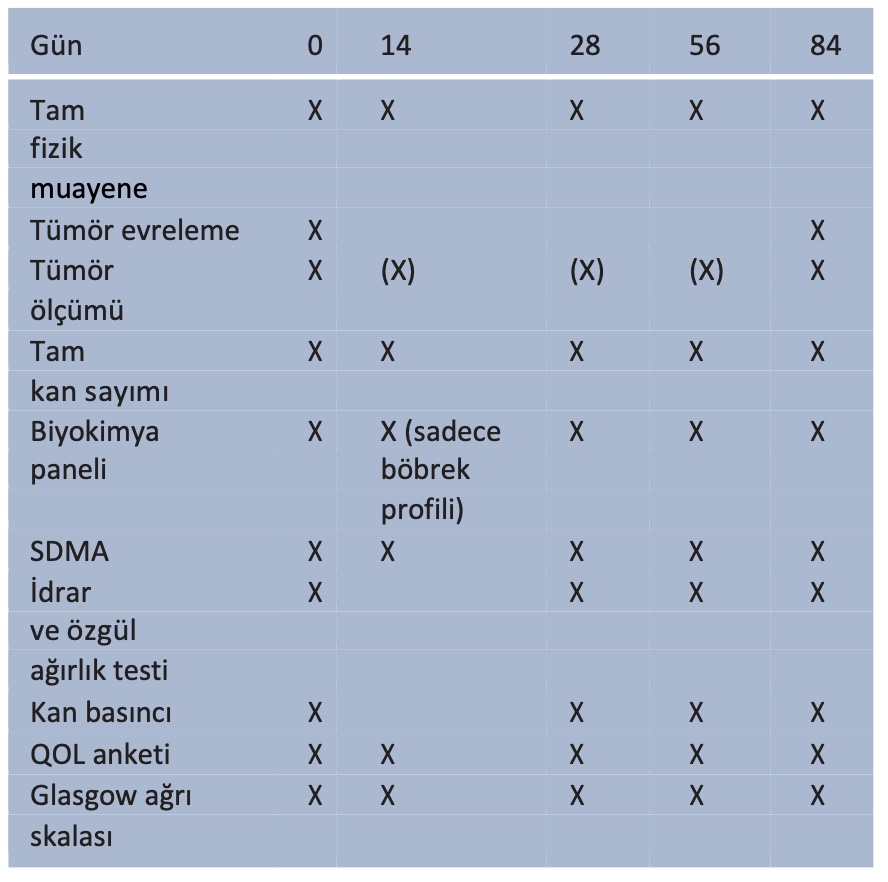
Başlangıçta dört kohort planlanmıştır (0.01 mg/kg gün aşırı, 0.01 mg/kg günlük, 0.02 mg/kg gün aşırı ve 0.02 mg/kg günlük). COVID-19 pandemisi ışığında hastane vaka yükünün ve çalışmaya katılımın azalması ve danışman farmakolog ile kohortların benzer farmakolojik özelliklere ve doz yoğunluğuna sahip olacağına dair yapılan görüşmeler nedeniyle, ortadaki iki kohort tek bir kohortta birleştirilmiştir. Böylece, 2. kohort günde 0,01 mg/kg veya gün aşırı 0,02 mg/kg meloksikam alan kedilerden oluşmuştur. Bir DLT kaydedilirse, kohort altı kediden oluşacak şekilde genişletilmiştir. MTD, en fazla altı kediden birinde DLT görülmeyen en yüksek doz seviyesidir. Kan ve idrar örnekleri ve kan basıncı ölçümleri 0, 14, 28, 56 ve 84. günlerde alınmıştır (Tablo 1). Kedileri sonraki kohortlara kaydetmeden önce gerekli laboratuvar ve güvenlik verilerini elde etmek için 56 günlük yeniden kontrolden önce herhangi bir kedinin ölmesi, ötenazi yapılması veya çalışmadan çıkarılması durumunda da kohortlar genişletilmiştir.
Yan etkiler (AE’ler) VCOG-CTCAE v1.1’e göre derecelendirilmiştir.19 Meloksikamın neden olduğu böbrek hasarı endişesi nedeniyle kreatinin değerleri yakından takip edilmiştir. Grade 3 veya daha ağır şiddette akut böbrek hasarı (kreatinin değerinde başlangıç değerine göre >3 kat artış veya >2 kat normalin üst sınırı şeklinde tanımlanmıştır) görülen ve ayrıca kültür ve görüntüleme ile idrar yolu enfeksiyonu ve ürolitiyazis ihtimali ekarte edilen kedilerde meloksikam tedavisi kesilmiş ve hasta çalışmadan çıkarılmıştır.
Tablo 1 Çalışma takvimi
Gün aşırı toceranib dozu 0. günde başlamıştır. Meloksikam dozu kohortlara bağlı olarak 0. günde veya 1. günde başladı
(X) = Fiziksel muayene ve kaliper ölçümleri yoluyla erişilebiliyorsa tümör ölçümleri yapılmıştır. Ölçümler yalnızca görüntüleme yoluyla elde edilebiliyorsa, ölçüm sıklığı asgari olarak başlangıçta ve 84. günde önerilmiştir
SDMA = simetrik dimetilarjinin; QOL = yaşam kalitesi
Hipertansiyon, Wisconsin Üniversitesi Veterinerlik Eğitim Hastanesi kardiyoloji servisi tarafından önerildiği şekilde amlodipin ile tedavi edilmiştir.
Müşterilerin kedileri, sitolojik veya histolojik olarak teyit edilmiş, böbrekleri doğrudan etkilemeyen herhangi bir histolojiye sahip naif veya daha önce tedavi edilmiş kötü huylu tümöre sahipse çalışmaya dahil edilmeye uygun bulunmuştur. Uygun kedilerin VCOG performans durumunun 0 (normal aktivite) veya 1 (başlangıç seviyesine göre hafif letarji) olması gerekiyordu. Önceki tedaviden sonra belirli bir süre (glukokortikoidlerden 1 hafta, önceki kemoterapi, cerrahi veya radyasyon tedavisinden 2 hafta) ara verilmesi gerekmiştir. Daha fazla uygunluk International Renal Interest Society (IRIS) Kronik Böbrek Hastalığı kılavuzlarına göre, Kronik Böbrek Hastalığı 1. veya 2. evre (klinik olarak stabil ve hidrate olduğunda kreatinin ⩽2.8 mg/dl olanlar) olan kediler çalışmaya katılmaya uygun bulunmuştur. Hidrasyon durumu mukoza zarı yapışkanlığı, deri turgoru ve kan değerleri (kan üre nitrojeni [BUN], total protein, hematokrit veya tam hücre hacmi) değerlendirilerek belirlenmiştir. Kayıt sırasında ağrı kesici ilaçların (buprenorfin, gabapentin) ve gastrointestinal sistemi destekleyici ilaçların (maropitant, ondansetron, metronidazol, famotidin, omeprazol, mirtazapin, kapromorelin) kullanılmasına veya çalışma süresi boyunca ilave edilmesine izin verilmiştir. Kayıttan önce herhangi bir zaman diliminde toceranib veya kronik NSAİİ almış olan kediler çalışma dışı bırakılmıştır. Güvenlik deneylerinin birincil sonlanım noktası olmasa da, eğer mevcutsa ilaç kombinasyonunun ön antitümör etkinliği ve ayrıca yaşam kalitesi ve analjezi üzerindeki etkisi de değerlendirilmiştir. Tümör yanıtı, gros hastalığı olan hastalar için VCOG solid tümörler için yanıt değerlendirme kriterleri (RECIST) kullanılarak değerlendirilmiştir.20 Ölçümler, en uzun tümör çapının kaliperle ölçülmesiyle veya varsa görüntüleme yöntemiyle yapılmıştır, ancak çalışma için görüntüleme gerekli görülmemiştir.
İlerleyici hastalık görülen kediler çalışmadan çıkarılmış ve hasta sahiplerine alternatif tedavi seçenekleri sunulmuştur. Progresyona kadar geçen süre, çalışmaya kayıt olduktan hastalığın ilerlemesine veya hastalıktan ölüme kadar geçen gün sayısı şeklinde tanımlanmıştır. Yaşam kalitesi üzerindeki etki, başlangıçta ve sonraki değerlendirmelerde hasta sahibi anketi aracılığıyla değerlendirilmiştir (bkz. ek belgeler). Yaşam kalitesi anketi, yiyecek ve su alımı, temizlik tutumu, kum kabı kullanımı ve sahibiyle etkileşim dahil olmak üzere evdeki davranışlara odaklanılmıştır. Analjezi üzerindeki etki, başlangıçta ve fizik muayene bulgularına dayalı olarak her ziyarette sorumlu klinisyen tarafından belirlenen Glasgow kompozit ağrı skalası kullanılarak değerlendirilmiştir (ek belgeye bakınız).
Klinik protokol Etik Kurul tarafından onaylanmış ve katılımcı müşterilerden yazılı bilgilendirilmiş onam alınmıştır. Hayvan sahiplerinin istedikleri zaman onamlarını geri çekmelerine müsaade edilmiştir.
Sonuçlar
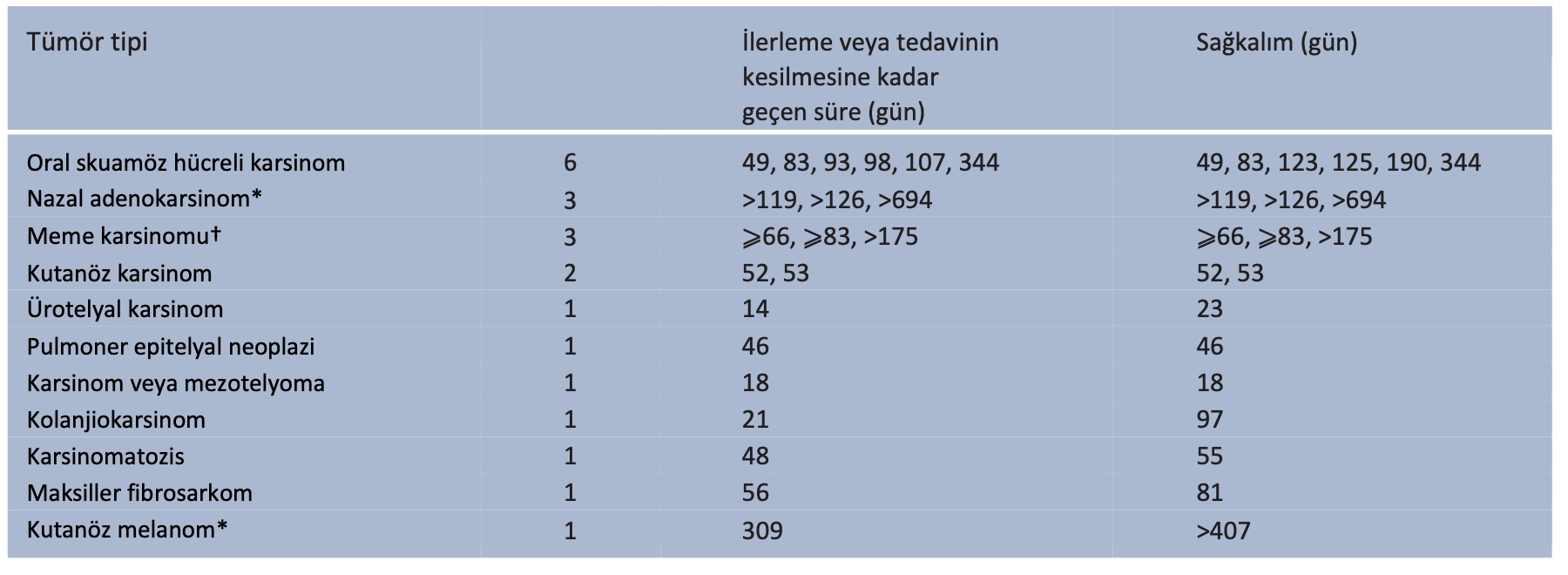
Toplamda 21 kedi çalışmaya dahil edilme kriterlerini karşılamış ve Ağustos 2019 ile Mart 2021 tarihleri arasında çalışmaya dahil edilmiştir. Bu kedilerin ortalama yaşı 11,7 ( yaş aralığı 5,7-17) ve ortalama ağırlığı 4,44 kg ( kilo aralığı 2,70-7,77) idi. Dokuz kısırlaştırılmış erkek, bir kısırlaştırılmamış erkek ve 11 kısırlaştırılmış dişi vardı. Kedilerin çoğunluğu (n = 15) domestic shorthair, geri kalanı ise domestic longhair (n = 2) ve birer adet domestic mediumhair, Maine Coon, Bengal ve Norveç Orman Kedisinden oluşmaktaydı. En yaygın kanser teşhisi altı kedide Kedi oral skuamöz hücreli karsinomu (FOSCC) idi, ancak diğer farklı kanser türleri de mevcuttu (Tablo 2).
İlk kohortta yedi, ikinci kohortta sekiz ve üçüncü ve son kohortta altı kedi çalışmaya dahil edilmiştir (Tablo 3). On bir kedi hastalığın ilerlemesi (n = 7), ilaçların uygulanmasındaki güçlük (n = 2), sahibinin gözlemlerine göre yaşam kalitesinde düşüş (n = 1) veya ani ölüm (nedeni bilinmiyor ve nekropsi reddedildi, ancak tedaviye bağlı olması muhtemel değildi, n = 1) nedeniyle erkenden çalışmadan çıkarılmıştır (Tablo 4).
Tablo 2 Tümör tipleri ve sonuçları
*Makaleler hazırlandığı sırada kediler hâlâ hayattaydı
†İki kedi kayıttan 66 ve 83 gün sonra takipten çıkarılmıştır; bir kedi makalenin hazırlandığı sırada hâlâ hayattaydı
Tablo 3 Tedavi kohortları
EOD = iki günde bir
Bu nedenle, kohort sayısı yedeklere duyulan ihtiyaç nedeniyle üçten fazla olmuştur. Günlük 0,02 mg/kg meloksikam dozuna ulaşılmış ve klinik olarak anlamlı herhangi bir DLT görülmemiştir.
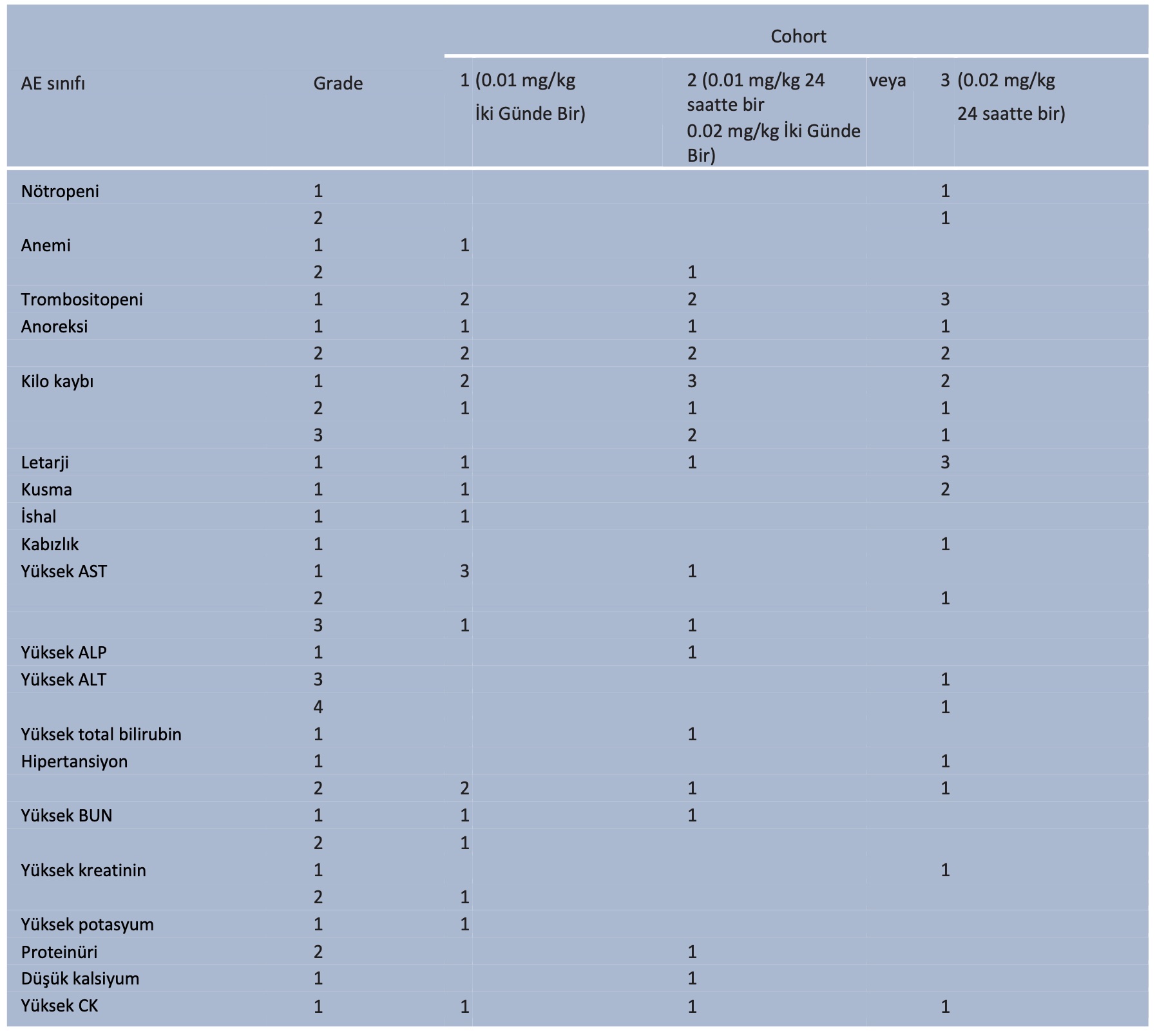
En sık görülen yan etkiler kilo kaybı (n = 13) ve anoreksi (n = 9) olmuştur (Tablo 5). Sekiz kedi hafif ( grade 1 veya 2) hematolojik yan etki yaşamıştır; en sık görüleni grade 1 trombositopenidir (n = 7), ancak dört kedide trombosit kümelenmesi bildirilen değerin yanlışlıkla düşmesine neden olmuş olabilir. On dört kedide biyokimyasal yan etkiler görülmüştür; bunların çoğu hafif derecede yükselmiş ( grade 1-2) karaciğer veya böbrek değerleri, potasyum veya kreatin kinaz (CK) ile ilişkilendirilmiştir. Kreatinin ve BUN yüksekliği sırasıyla 2/21 (%9,5) ve 3/21 (%14,3) kedide kaydedilmiştir. Grade 2 kreatinin yüksekliği olan kedide idrar kesesinde metastatik ürotelyal karsinom vardı ve bu da muhtemelen bu artışa katkıda bulundu. Grade 1 yüksek kreatininli kedi subkutan serumlarla tedavi edilmiş ve kreatinin daha sonra tekrar yapılan muayenede 2,8 mg/dl’den 2,4 mg/dl’ye düşmüştür; yüksek değer muhtemelen erken KBH’ye sekonderdir. Dört kedide yüksek glikoz seviyesi kaydedilmiştir ve hiperglisemi ne toceranib ne de meloksikamdan kaynaklanabilecek bir yan etki olmadığı için muhtemelen ilaç kombinasyonundan ziyade strese
bağlı sekonder bir yanıttır. Bu kedilerde idrar tahlilinde glukozüri görülmemiştir.
Hematolojik, biyokimyasal, gastrointestinal ve/veya konstitüsyonel yan etkiler 20/21 kedide (%95,2) gözlenmiştir. Yan etkiler genellikle hafifti (grade 1 veya 2). Hiçbir kedinin yan etkiler nedeniyle çalışmadan çıkarılması gerekmemiştir, ancak kohort 3’teki birer kedide sırasıyla hiporeksi (grade 2) ve kilo kaybı (grade 3) nedeniyle 2 haftalık toceranib molası ve toceranib dozunun Pazartesi-Çarşamba-Cuma şeklinde azaltılması önerilmiştir. Özellikle, üç kedi grade 3 kilo kaybı yaşamıştır, ancak bu kedilerden ikisinde daha önce kilo kaybı olduğu belgelenmiş ve diğer kediye çalışmaya kayıt olurken karsinomatozis teşhisi konmuştur, bu da kilo kaybının muhtemel nedenidir. Fizik muayene ve hasta sahibi anketi sonuçları göz önünde bulundurularak araştırmaya devam edilmesi kararlaştırılmıştır. Her üç kedide de kilo kaybının nedeni muhtemelen tedaviden ziyade kanserdi, ancak göğüs ve batın görüntüleme sahipleri tarafından reddedildi ve bu nedenle ilaca bağlı toksisite olasılığı hariç tutulamadı.
Diğer grade 3 ve üzeri yan etkiler nadirdi ve klinik olarak anlamlı değildi ve bu nedenle meloksikam dozu herhangi bir kohortta DLT sıklığını diğerine göre artırmadı. Grade 3 alanin aminotransferaz (ALT) yüksekliği olan kediye, muhtemelen anormalliğe sebep olan eş zamanlı hipertiroidizm teşhisi konulmuştur. ALT değeri metimazol tedavisi ile düzelmiştir. Başka bir kedideki grade 4 ALT yüksekliği geçiciydi ve tedavide herhangi bir değişiklik olmadan düzeldi, bu da ilaçla ilişkili bir toksisite ihtimalini daha düşük hale getirdi. Yedi kedide ikisi grade 3 olmak üzere aspartat aminotransferaz (AST) yüksekliği görülmüştür. AST yüksekliği başka bir kedi toceranib çalışmasında kaydedilmiştir13 ve bu çalışmada kaydedilen grade 3 AST yüksekliği, yeterli fizik muayene bulguları, QOL skorları, ağrı skorları ve diğer karaciğer enzimleri bakımından belirgin olmayan değerler göz önüne alındığında klinik olarak anlamlı değildir.
Tablo 4 Çalışmadan çıkarılan kediler
FOSCC = kedi ̇ oral skuamöz hücreli ̇ karsiṅ omu
Tablo 5 Derece ve kohortlara göre yan etkiler (YE)
AST = aspartat aminotransferaz; ALP = alanin aminotransferaz; BUN = kan üre azotu; CK = kreatin kinaz: EOD = iki günde bir
Kohort 3’teki bir kedide 8 hafta sonraki kontrolde geçici grade 1 hipertansiyon kaydedilmiştir. Dört kedide (kohort 1’de iki, kohort 2 ve 3’te birer) 4 hafta sonraki kontrolde grade 2 hipertansiyon görülmüş ve amlodipin tedavisi önerilmiştir; bu kedilerden birinde aynı zamanda grade 1 yüksek kreatinin ve bir diğerinde grade 2 proteinüri ile birlikte grade 1 yüksek BUN görülmüş, ancak hedef organ hasarına dair başka herhangi bir kanıt kaydedilmemiştir. Geri kalan idrar tahlili ve test verileri dikkate değer değildi.
Yaşam kalitesi başlangıçta ve her kontrol muayenesinde hasta sahiplerinin doldurduğu anketler ile değerlendirilmiştir. Sahipleri başlangıçtan sonra en az bir anket dolduran kediler arasında (n = 17), üçünün genel yaşam kalitesi artmış, sekizinin yaşam kalitesi sabit kalmış ve altısının yaşam kalitesi düşmüştür. Yaşam kalitesinde azalma olan altı kediden üçünün yaşam kalitesi puanlarının düştüğü sırada kayıt altına alınmış ilerleyici hastalığı vardı ve altı kediden biri ilaç tedavisine karşı dirençliydi, bu da muhtemelen daha düşük puan alınmasına katkıda bulundu..
Meme karsinomu ve nazal kaynaklı adenokarsinom şüphesi tanısı konan diğer iki kedinin fizik muayenesinde ölçülebilir hastalık stabildi ancak ek görüntüleme (abdominal ultrason, kafa BT taraması) yapılması reddedildi; bu nedenle, hastalığın ilerlemesi daha düşük puanlar alınmasına katkıda bulunmuş olabilir.
Glasgow kompozit ağrı skalası tedavi süresi boyunca altı kedide iyileşirken, 12 kedide sabit kalmış ve üç kedide kötüleşmiştir. Skalası kötüleşen üç kediden birinin hastalığı ilerlemiş, biri ilaçların uygulanmasındaki güçlükler nedeniyle tedavisi kesilmiş ve biri de muhtemelen son kontrol muayenesi sırasında hastane ortamında strese girmiş ve bu da skalanın yanlışlıkla yükselmesine neden olmuş olabilir.
Antikanser etkisinin değerlendirilmesi çalışmamızın birincil amacı olmamasına rağmen, Tablo 2 elde edilen sonuçları göstermektedir.
On dört kedi hastalıkları nedeniyle ölmüş veya ötenazi uygulanmış, beş kedi makalenin hazırlandığı sırada hayatta kalmış ve iki kedi takip dışı kalmıştır. Ölçülebilir hastalığı olan hastalarda, iki kedide (biri meme karsinomu, biri FOSCC) kısmi yanıt elde edilmiş ve bu yanıt çalışma süresi boyunca devam etmiştir. On kedide ilerleyici hastalık vardı (bunların yedisi 84 günlük çalışma süresi boyunca belgelendi) ve geri kalan kedilerde stabil hastalık vardı.
Tartışma
Standart dozda toceranib ile kombinasyon halinde günde 0.02 mg/kg dozunda meloksikam kanserli kedilerde iyi tolere edilmiştir. Bu ilaç kombinasyonunda meloksikamın MTD’sini belirlemek için ek çalışmalar yapılması gerekmektedir. Çalışmamız, kedi kanserli hastalarda NSAİİ tedavisinin rolüne işaret eden önceki bulguları desteklemektedir. COX-2 ekspresyonu, transizyonel hücreli karsinom (TCC) ve FOSCC dahil olmak üzere çeşitli kedi kanserlerinde rapor edilmiştir.21,22 COX inhibitörlerinin uzun vadeli güvenliği de incelenmiştir. Günde 0,01-0,03 mg/kg meloksikam alan DJD’li kediler, 1 aylık tedavi süresince kreatinin değerlerinin izlenmesiyle belirlenen böbrek fonksiyonlarında hiçbir olumsuz değişiklik göstermemiştir.7 DJD’li kedileri inceleyen başka bir çalışma, düşük doz meloksikam (günlük ortalama doz 0,02 mg/kg) ile tedavi edilen KBH’li hastalarda, tedavi edilmeyen kontrol grubuna kıyasla böbrek hastalığında daha az ilerleme görülmüştür.8 Ek çalışmalar, IRIS 2. evre (klinik olarak stabil ve hidrate olduğunda kreatinin 1,6 / 2,8 mg/dl) veya 3. evre (kreatinin 2,8-5,0 mg/dl) hastalık olarak sınıflandırılanlar dahil olmak üzere, en az 6 ay boyunca meloksikam (günlük ortalama doz 0,02 mg/kg) ile tedavi edilen ve daha önceden stabil KBH olan veya olmayan kedilerde böbrek boşaltım fonksiyonunda veya yaşam süresinde herhangi bir azalma meydana gelmediğini ortaya koymuştur.9,23
Kedilerde düşük doz meloksikamın değerlendirildiği daha önce yayınlanmış çalışmalar ve böbrek yetmezliği endişesi göz önüne alındığında, bu çalışmada günlük mg/kg’dan daha yüksek dozlar değerlendirilmemiştir. Bununla birlikte, kayda değer herhangi bir renal yan etki kaydedilmedi ve hiçbir kedi ilaçlara atfedilebilecek yan etkiler nedeniyle çalışmadan çıkarılmadı.
Kedilerin çoğu çalışma boyunca stabil veya iyileşmiş yaşam kalitesi skorlarına (11/17) ve ağrı skorlarına (18/21) sahipti; kötüleşen skorlar muhtemelen kanserin ilerlemesine, hem hasta hem de hasta sahibinin stresine yol açan ilaçların uygulanmasındaki zorluklara veya tümör bölgelerinde gelişen ikincil enfeksiyonlara bağlıydı.
Tablo 4’te belirtildiği üzere, on bir kedi çalışma tamamlanmadan (84. gün) çıkarılmıştır. Bu nedenle, DLT’lere dair net bir kanıt olmamasına rağmen kohort sayıları sık sık artırılmıştır. Kohort 1’den ani ölümün ardından çıkarılan kediye başlangıçta sol kulak kepçesinin kaudalinde kutanöz karsinom teşhisi konmuştur; çalışmaya katıldıktan 53 gün sonra kollaps ve ani ölümden önce grade 3 yüksek AST,
grade 2 hipertansiyon, grade 1 anoreksi ve grade 1 yüksek BUN görülmüştür. En son yapılan kan tahlillerinin geri kalanında herhangi bir bulguya rastlanmamış ve görüntüleme yapılmamıştır. Nekropsi reddedilmiştir, bu nedenle ani ölümün nedeni bilinmemektedir. Ürotelyal karsinomlu kedi, kayıttan 14 gün sonra progresif azotemi (kreatinin 2,2 mg/dl’den mg/dl’ye; BUN 46 mg/dl’den 99 mg/dl’ye yükselmesi) nedeniyle çıkarılmıştır; kanserin ilerlemesinden şüphelenilmiştir, ancak tekrar batın ultrasonu yapılmamıştır, bu nedenle ilaçlardan kaynaklanan toksisitenin yanı sıra enfeksiyon veya ürolitiyazis de göz ardı edilememiştir. Kohort 2 sekiz kediden oluşmaktaydı ve üç kedi 56 gün sonra yapılan tekrar kontrolde hayatta kalmıştır. Klinik olarak ilgili DLT’lerin olmaması nedeniyle, kohort 2’deki ilaç kombinasyonunun güvenli olduğu belirlenmiş ve böylece kohort 3 için çalışmaya dahil edilme süreci başlamıştır.
Bulgularımız, kanserli kedilerde NSAİİ’lerin ve/veya toceranib’in tolere edilebilirliğini ve etkinliğini bildiren önceki çalışmalara dayanmaktadır. Potansiyel klinik fayda daha önce NSAİİ alan FOSCC ve TCC’li kedilerle yapılan retrospektif çalışmalarda gösterilmiştir.21,22,24 FOSCC’li kedilerde toceranibin değerlendirildiği bir çalışmada, eş zamanlı NSAİİ kullanımı ile sağkalımda iyileşme arasında bağlantı olduğu ortaya konmuştur, ancak çalışmanın retrospektif niteliği göz önüne alındığında, kullanılan spesifik NSAİİ ve doz tutarlı değildir.10 FOSCC, mast hücre tümörü ve kedi enjeksiyon yeri sarkomu olan kedilerde toceranibin etkinliğini ve/veya güvenliğini belgeleyen birkaç ek rapor daha bulunmaktadır.13-16 Bu çalışmaların çoğu retrospektiftir ve takip süresi değişkenlik göstermektedir. Bu çalışma, bildiğimiz kadarıyla, meloksikamın toceranib ile kombinasyonunun güvenliğini ve tolere edilebilirliğini prospektif olarak inceleyen ilk çalışmadır.
Bu çalışmanın bazı kısıtlamaları mevcuttur. Kontrol muayenelerinde görüntüleme gerekmediğinden, internal tümör progresyonu veya pulmoner ya da abdominal metastaz gözden kaçmış olabilir. Bu nedenle, hastalığın ilerlemesi yan etkilerin veya kötüleşen yaşam kalitesi veya ağrı skorlarının nedeni olarak hariç tutulamaz. Çoğu rapor edilen ortalama sağkalım süresi 3 aydan az olan agresif bir kanser olan FOSCC (n = 6) vakalarının yüksekliği25,26 ve çalışma popülasyonumuzdaki diğer ilerlemiş kanserler, hızlı hastalık ilerlemesi nedeniyle sıklıkla çalışmadan erken dönemde çıkarılma ile sonuçlanmıştır. Ayrıca, hastaların ek destekleyici bakım ilaçları almalarına izin verilmiştir; bu da yaşam kalitesi ve ağrı skorlarını belirlemiş ve potansiyel olarak yan etkileri etkilemiş olabilir. Buna ek olarak, hasta yaşam kalitesi anketlerinin ve Glasgow kompozit ağrı skalası doğası gereği subjektif olması ve gözlemcilerin farklılık göstermesi bu skorlarda yanlılığa yol açmış olabilir. Nadiren, küçük mesane boyutu nedeniyle klinikte idrar örneği alınamamıştır; bu durumlarda azotemi kanıtı bulunmamış ve sonraki randevularda idrar örneği alınmıştır. Yine de, geçici anormallikler gözden kaçmış olabilir. Son olarak, kohort 2’deki meloksikam doz yoğunlukları aynı olmasına rağmen (günde bir kez 0,01 mg/kg ve gün aşırı 0,02 mg/kg), pik ilaç konsantrasyonları farklı olabilir.
Sonuç
Elde ettiğimiz veriler, kanserli kedilerin standart doz toceranib ile birlikte 0,02 mg/kg 24 saatte bir meloksikamı güvenli bir şekilde tolere edebildiğini göstermektedir. Daha yüksek meloksikam dozlarının güvenli olup olmadığını belirlemek için ek çalışmalara ihtiyaç vardır. Kedilerde meloksikam kaynaklı böbrek yetmezliği endişesi olsa da, bu düşük doz, diğer tedaviler reddedildiğinde veya bir bakım standardı mevcut olmadığında hasta sahiplerine makul bir seçenek sunabilir. İlaç kombinasyonunun antikanser etkisi, görüntüleme yapılmaması, kontrol popülasyonunun olmaması ve örneklem boyutunun küçük olması nedeniyle mevcut verilerle kesin olarak değerlendirilememektedir. Bu nedenle, benzer tümör tiplerine sahip daha büyük kedi gruplarıyla faz II/III klinik çalışmalar yapılmalıdır.
Teşekkürler
Dr. Lauren Trepanier DVM, PhD, DACVIM, DACVCP’ye çalışma tasarımı ve farmakoloji danışmanlığı konusundaki yardımları için teşekkür ederiz. Ayrıca tüm UW Veteriner Tıp Eğitim Hastanesi Tıbbi ve Radyasyon Onkolojisi ve destek servislerine hasta alımı ve hasta bakımı konusundaki yardımları için teşekkür ederiz.
Yazarın Notu Bu çalışmadan elde edilen ön bulgular, 2020 Amerikan Kedi Hekimleri Derneği yıllık konferansında bir posterde ve 2020 Veteriner Kanser Derneği yıllık konferansında sunum olarak paylaşılmıştır.
Ek Belgeler Aşağıdaki dosyalar çevrimiçi erişime açıktır: Kedi yaşam kalitesi anketi.
Glasgow kompozit ağrı skalası
Çıkar çatışması Beyanı Yazarlar, bu makalenin araştırması, yazımı ve/veya yayınlanması ile ilgili olarak herhangi bir çıkar çatışması beyan etmemiştir.
Finansman Yazarlar bu makalenin araştırması, yazımı ve/veya yayını için şu finansal desteği aldığını beyan etmiştir: bu çalışma Veteriner Kanser Derneği Araştırma Bursu tarafından desteklenmiştir.
Ethical approval Bu makalede açıklanan çalışma, deney hayvanı olmayan (sahipli veya sahipsiz) hayvanların kullanımını ve uluslararası kabul görmüş yüksek veteriner klinik bakım standartlarından (‘en iyi uygulama’) farklı prosedürleri içermektedir. Bu nedenle çalışma öncesinde, makalede de belirtildiği üzere, yetkili bir komiteden etik onay almıştır.
Bilgilendirilmiş onam Bu çalışmada belirtilen tüm hayvanların ( deney hayvanı ya da deney hayvanı olmayan, kadavralar dahil) sahibinden ya da yasal vasisinden yapılan tüm işlemler için bilgilendirilmiş onam (sözlü ya da yazılı) alınmıştır. Bu yayında hiçbir hayvan veya insan kimliği tespit edilememektedir ve bu nedenle yayın için ek bilgilendirilmiş onam gerekmemiştir.
ORCID iD MacKenzie A Pellin https://orcid.org/0000- 0002- 1094-8909
Kaynakça
1 Hayes A. Cancer, cyclo-oxygenase and non-steroidal anti- inflammatory drugs – can we combine all three? Vet Comp Oncol 2007; 5:1–13.
2 Gupta RA, Tejada LV, Tong BJ, et al. Cyclooxygenase-1
is overexpressed and promotes angiogenic growth fac- tor production in ovarian cancer. Cancer Res 2003; 63: 906–911.
3 Ristimaki A, Sivula A, Lundin J, et al. Prognostic signifi-
cance of elevated cyclooxygenase-2 expression in breast cancer. Cancer Res 2002; 62: 632–635.
4 Lascelles BD, Court MH, Hardie EM, et al. Nonsteroidal anti-inflammatory drugs in cats: a review. Vet Anaesth Analg 2007; 34: 228–250.
5 Plumb DC. Meloxicam. Plumb DC (ed). Plumb’s veterinary drug handbook. 8th ed. Stockholm, WI: John Wiley & Sons, 2015, pp 675–678.
6 Sparkes AH, Heiene R, Lascelles BD, et al. ISFM and AAFP consensus guidelines: long-term use of NSAIDs in cats. J Feline Med Surg 2010; 12: 521–538.
7 Gunew MN, Menrath VH and Marshall RD. Long-term safety, efficacy and palatability of oral meloxicam at 0.01–
0.02 mg/kg for treatment of osteoarthritic pain in cats.
J Feline Med Surg 2008; 10: 235–241.
8 Gowan RA, Lingard AE, Johnston L, et al. Retrospective case- control study of the effects of long-term dosing with meloxicam on renal function in aged cats with degenera- tive joint disease. J Feline Med Surg 2011; 13: 752–761.
9 Gowan RA, Baral RM, Lingard AE, et al. A retrospective analysis of the effects of meloxicam on the longevity of aged cats with and without overt chronic kidney disease. J Feline Med Surg 2012; 14: 876–881.
10 Wiles V, Hohenhaus A, Lamb K, et al. Retrospective eval- uation of toceranib phosphate (Palladia) in cats with oral squamous cell carcinoma. J Feline Med Surg 2017; 19: 185–193.
11 London CA, Hannah AL, Zadovoskaya R, et al. Phase I dose-escalating study of SU11654, a small molecule recep- tor tyrosine kinase inhibitor, in dogs with spontaneous malignancies. Clin Cancer Res 2003; 9: 2755–2768.
12 London C, Mathie T, Stingle N, et al. Preliminary evidence
for biologic activity of toceranib phosphate (Palladia) in solid tumours. Vet Comp Oncol 2012; 10: 194–205.
13 Olmsted GA, Farrelly J, Post GS, et al. Tolerability of tocer-
anib phosphate (Palladia) when used in conjunction with other therapies in 35 cats with feline oral squamous cell carcinoma: 2009–2013. J Feline Med Surg 2017; 19: 568–575.
14 Berger EP, Johannes CM, Post GS, et al. Retrospective eval- uation of toceranib phosphate (Palladia) use in cats with mast cell neoplasia. J Feline Med Surg 2018; 20: 95–102.
15 Harper A and Blackwood L. Toxicity and response in cats
with neoplasia treated with toceranib phosphate. J Feline Med Surg 2017; 19: 619–623.
16 Holtermann N, Kiupel M and Hirschberger J. The tyrosine kinase inhibitor toceranib in feline injection sarcoma: efficacy and side effects. Vet Comp Oncol 2017; 15: 632–640.
17 Merrick CH, Pierro J, Schleis SE, et al. Retrospective evalu- ation of toceranib phosphate (Palladia) toxicity in cats. Vet Comp Oncol 2017; 15: 710–717.
18 Vail DM. Cancer clinical trials: Development and implemen- tation. Vet Clin North Am Small Anim Pract 2007; 37: 1033–1057.
19 Veterinary Co-operative Oncology Group (VCOG). Vet- erinary Co-operative Oncology Group – common ter- minology criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Vet Comp Oncol 2016; 14: 417–446.
- 20 Nguyen SM, Thamm DH, Vail DM, et al. Response evalua-
tion criteria for solid tumours in dogs (v1.0): a Veterinary Cooperative Oncology Group (VCOG) consensus docu- ment. Vet Comp Oncol 2015; 13: 176–183. - 21 Beam SL, Rassnick KM, Moore AS, et al. An immunohisto- chemical study of cyclooxygenase-2 expression in various feline neoplasms. Vet Pathol 2003; 40: 496–500.
- 22 DiBernardi L, Doré M, Davis JA, et al. Study of feline oral squamous cell carcinoma: potential target for
cyclooxygenase inhibitor treatment. Prostaglandins Leu- kot
Essent Fatty Acids 2007; 76: 245–250.
23 KuKanich K, George C, Roush JK, et al. Effects of low-dose
meloxicam in cats with chronic kidney disease. J Feline Med
Surg 2021; 23: 138–148.
24 Bommer NX, Hayes AM, Scase TJ, et al. Clinical features,
survival times and COX-1 and COX-2 expression in cats with transitional cell carcinoma of the urinary bladder treated with meloxicam. J Feline Med Surg 2012; 14: 527–533.
25 Reeves NCP, Turrel JM and Withrow SJ: Oral squamous cell carcinoma in the cat. J Am Anim Hosp Assoc 1993; 29: 438–441.
26 Hayes AM, Adams VJ, Scase TJ, et al. Survival of 54 cats
with oral squamous cell carcinoma in United Kingdom general practice. J Small Anim Pract 2007; 48: 394–399.