| 1Universidade Vila Velha (UVV) Vila Velha, ES 2Universidade Federal de Minas Gerais (UFMG) Belo Horizonte, MG 3Cambridge Üniversitesi – Cambridge – Birleşik Krallık 12 Mayıs 2016’da sunuldu |
ÖZETMevcut birçok protokole rağmen, köpek mast hücreli tümörlerinin (MCT) tedavisinde kemoterapi kullanımı deneysel niteliktedir ve protokol seçimi ve tedaviden fayda görebilecek hastaların belirlenmesi için kriter eksikliği söz konusudur. Bu çalışmanın amacı, adjuvan kemoterapi sonrası MCT’li köpeklerin sonuçlarını literatürde önerilen nüks veya metastaz riskine göre değerlendirmektir. Bu prospektif çalışma, köpek MCT’sinin klinik, histolojik, immünohistokimyasal ve genetik özelliklerini içeren prognoz analiziyle takip edilen 89 köpeği kapsamaktadır. Hastalar nüks ve metastaz riskine göre gruplandırıldı ve yüksek riskli kabul edilenlere lomustin ve ardından klorambusil, orta riskli kabul edilenlere ise vinblastin ve ardından klorambusil tedavisi önerildi. Sonuç, Kaplan-Meier eğrisi ile tahmin edilen hastalıksız geçen süre (DFI) ve genel sağkalım (OS) ile tespit edilmiştir. Adjuvan lomustin, nüks veya metastaz riski yüksek köpek MCT’sinin kontrolü için faydalıydı, ancak bu sadece sıralı şekilde klorambusile bağlandığında gerçekleşti ve DFI 686 gündü ve OS’ye ulaşılamadı. Seçilen tedaviye rağmen orta riskli grupta sonuç açısından bir fark görülmemiştir. Orta-düşük riskli hastalar, serbest cerrahi sınırların yokluğunda bile adjuvan tedavilere ihtiyaç duymayabilir. Anahtar Kelimeler: köpek, neoplazm, mast hücreleri, Ki-67, c-kit |
GİRİŞVeteriner onkolojisindeki yüksek prevalansı nedeniyle köpek mast hücre tümörüne (MCT) giderek daha fazla odaklanılmaktadır. Her ne kadar çoğu düşük-orta grade MCT sadece cerrahi ile tedavi edilebilse de, uzun sağkalım süreleri ile sonuçlansa da, son derece agresif ve ölümcül bir formda kendini gösterebilen bu neoplazmaya yenik düşen hastaların olması alışılmadık bir durum değildir (Dobson ve Scase 2007). Patnaik derecelendirme şemasına göre grade 3 MCT olarak sınıflandırılan tümörlerin yanı sıra lenf nodu veya uzak metastaz ve/veya mitotik sayı veya Ki-67 immünoekspresyonu ile tahmin edilen yüksek büyüme fraksiyonu (Romansik ve ark 2007 Blackwood ve ark 2012 London ve Thamm, 2013 Miller ve ark 2014) ve mukoza veya mukokutanöz bağlantılarda bulunan MCT için (London ve Thamm, 2013) Patnaik orta grade için de yüksek rekürrens veya metastaz riski söz konusudur. Tümörün yeri (skrotum, prepusyum, perine veya vulva), cins (London ve Thamm, 2013) ve KITr paterni ekspresyonu (Kiupel ve ark., 2004) gibi diğer prognostik faktörler de hastalığın ilerlemesinde önemli rol oynayabilir. Spesifik fonksiyon kazanımı genetik mutasyonları da büyük ölçüde daha kötü prognozla ilişkilidir (Zemke vd., 2002; Webster vd., 2006; Webster vd., 2008; Avery, 2012). Radyoterapi, köpek MCT’si için oldukça benimsenmiş adjuvan bir tedavidir ve genel iyileşme oranı %90’dır, ancak bu sonuç çalışılan popülasyonla ilişkili olabilir (Frimberger ve ark., 1977, Al-Sarraf ve ark., 1996). Köpek MCT’si için adjuvan kemoterapi tarihsel olarak sınırlı bir kullanıma sahiptir, ancak bu neoplazmın biyolojik davranışının bol çeşitliliği göz önüne alındığında, medikal tedavi metastatik veya yüksek riskli MCT için adjuvan tedavi olarak endike olmuştur (Thamm ve ark., 2006, Cooper ve ark., 2009). Kemoterapi, cerrahi eksizyonu kolaylaştırmak için sitoredüksiyonu teşvik etmek amacıyla neoadjuvan ortamda da kullanılmaktadır (Rassnick ve ark., 1999; Thamm ve ark., 1999; Cooper ve ark., 2009; Warland ve ark., 2015) veya rezeke edilemeyen tümörler için tek tedavi olarak (Taylor ve ark., 2009), ancak bu hastalar için prognoz kötüdür (London ve Thamm, 2013). Son çalışmalar, ileri evre MCT’li veya yüksek metastatik hastalık riski taşıyan hastalar için adjuvan bir ortamda glukokortikoidler, vinblastin, lomustin, siklofosfamid ve klorambusil gibi çok sayıda kemoterapi protokolünü değerlendirmiştir, ancak çoğu çalışma kontrol gruplarının eksikliğinden muzdarip olduğundan, gerçek fayda değerlendirilememektedir (Thamm ve ark., 2006; Cooper ve ark., 2009). Çoğunlukla sistemik veya yüksek riskli hastalığı olan hastalarda kullanılmasına rağmen, bazı yerlerde serbest cerrahi sınır elde etmenin zorluğu, radyoterapiye sınırlı erişim ve gelişmekte olan veya gelişmemiş ülkelerde iyi kurulmuş veteriner radyoterapi hizmetlerinin bulunmaması göz önüne alındığında, köpek MCT’sinin lokal kontrolünün bir parçası olarak adjuvan kemoterapinin kullanılması alışılmadık bir durum değildir (Thamm ve ark., 1999; Davies ve ark., 2004). Bununla birlikte, mevcut birçok protokole rağmen, kemoterapi kullanımı, kontrollü çalışmaların eksikliği (Dobson ve Scase, 2007; London ve Thamm, 2013) ve protokol seçimi ve tedaviden fayda görebilecek hastaların tanımlanması için uygun kriterlerin olmaması nedeniyle deneysel olmaya devam etmektedir. Vinblastin ve prednizon ile tedavi edilen köpekler için olumlu sonuçlar bildirilmiştir, ancak nükseden veya metastatik hastalığı olan hastalarda düşük sağkalım oranları bildirilmiştir (Thamm ve ark., 1999) ve şu anda veteriner onkolojisinde büyük ilgi gören bir konu olarak yeni protokoller araştırılmaktadır. Bu çalışmanın amacı, MCT’li köpeklerde adjuvan kemoterapi sonrası klinik sonuçların literatürde belirtilen rekürrens veya metastaz riskine göre değerlendirilmesidir. |
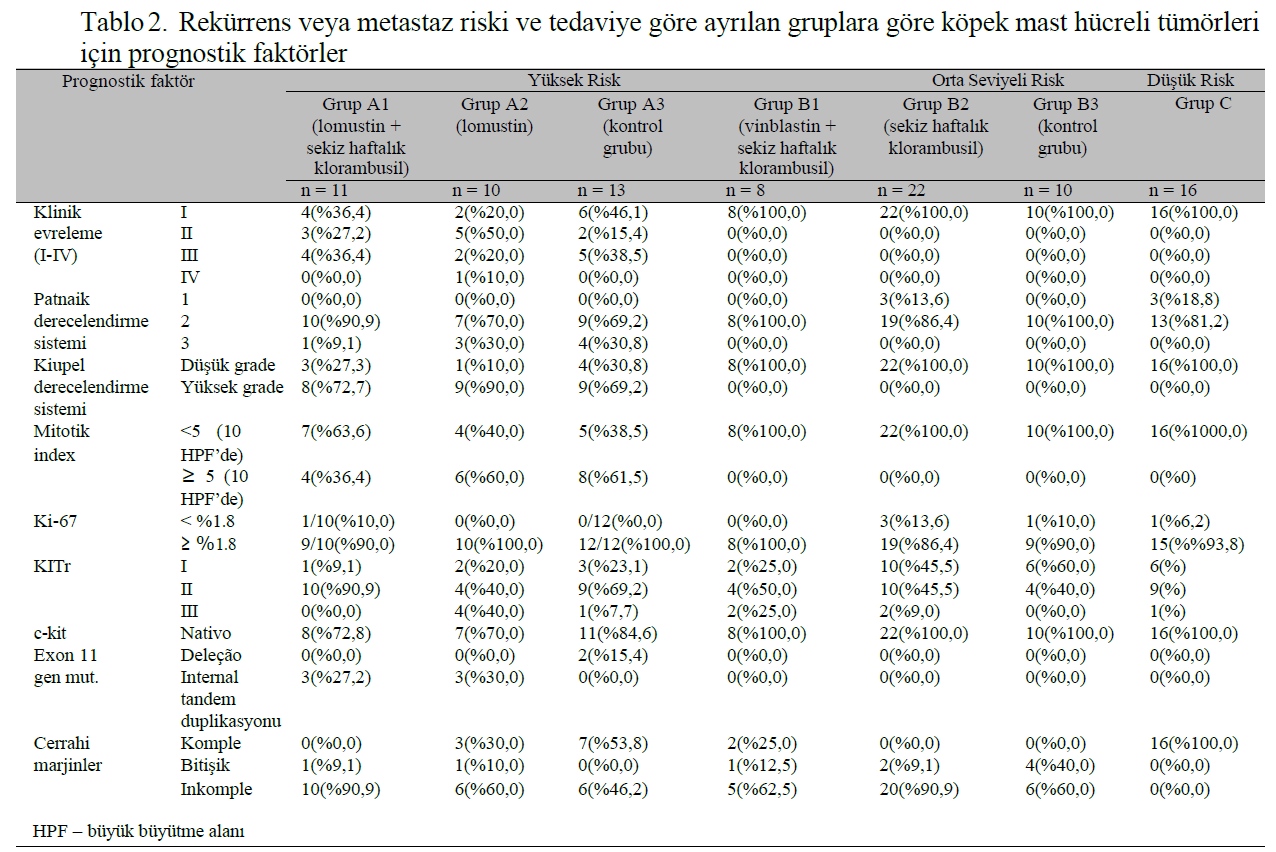
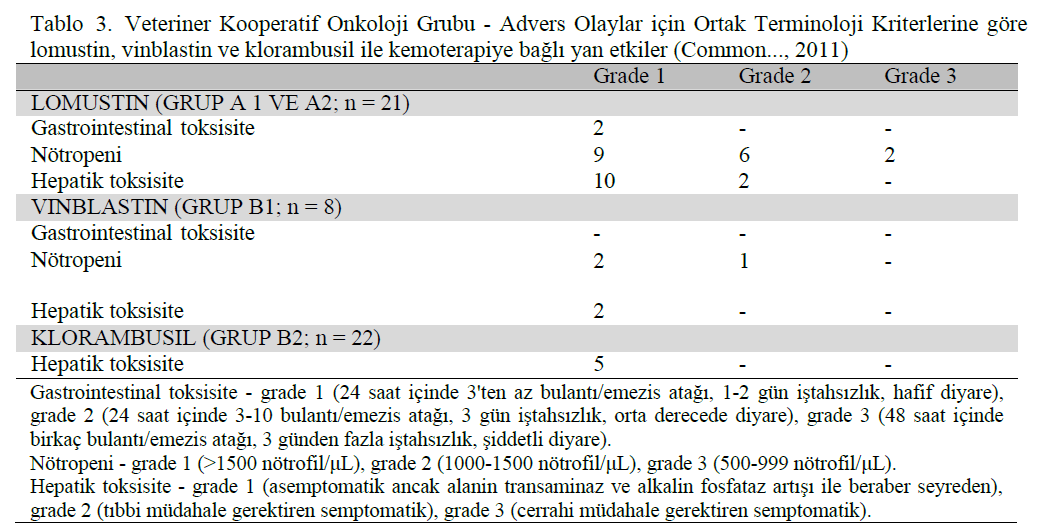
MATERYAL VE METOTBu prospektif çalışma Universidade Federal de Minas Gerais Hayvan Hakları Etik Kurulu tarafından onaylanmıştır (protokol n° 384/2013). Çalışmaya, cerrahi eksizyondan sonra herhangi bir gross hastalık belirtisi göstermeyen, histolojik olarak kutanöz veya subkutanöz MCT tanısı konmuş 89 köpek dahil edilmiştir. Tüm hastalar fizik muayene ve yara revizyonu, abdominal ultrason, ince iğne aspirasyonu ve bölgesel lenf nodlarının sitolojisi ile evrelendirilmiştir. Sitolojide metastaz şüphesi olan hastalarda ileri evreleme için lenf nodunun çıkarılması önerilmiştir. Önerilen kemoterapi rejimine uyulmaması, hastanın bu çalışmadan çıkarılmasına neden olmuştur. Primer tümörlerin cerrahi örnekleri parafin gömme hazırlığı için uzunlamasına kesitler halinde kesilmiş ve lamlar hematoksilen-eozin ve toluidin mavisi ile boyanmıştır. Histopatolojik incelemede Patnaik ve arkadaşları (1984) ve Kiupel ve arkadaşları (2011) tarafından önerilen sistemler kullanılarak derecelendirme yapılmıştır. Subkutan MCT için, tümör ekstansiyonu derecelendirmede dikkate alınmamıştır. Lenf nodları Weishaar ve arkadaşları (2014) tarafından önerildiği şekilde değerlendirilmiş, ancak yalnızca belirgin metastazlar II. evre hastalık olarak belirlenmiştir. Her vaka için temsili bir bloktan 4 μm’lik kesitler alınmış ve jelatin kaplı lamlar üzerinde toplanmıştır. Lamlar deparafinize edildi ve bir alkol serisinde rehidrate edildi. Antijen alımı, basınçlı ısı (20-25 mmHg, 125 °C/2 dakika) altında bir antijen alım solüsyonu (Target Retrieval Solution Citrate pH 6, Dako Cytomation) ile gerçekleştirildi. Endojen peroksidaz %3 hidrojen peroksit ve protein blokajına (Protein Block, Thermo Scientific Ultravision) daldırılarak bloke edildi. Birincil antikorlar CD117 (poliklonal, 1:800, Dako Cytomation) ve MIB-1 (monoklonal, 1:25, Dako Cytomation), KITr ve Ki-67 reaksiyonları için sırasıyla 16 saat (gece boyunca) 4°C’de inkübe edilmiştir. Sekonder antikor (Advance HRP Link, Dako Cytomation) nem odasında 30 dakika inkübe edildi ve reaksiyon polimer (Advance HRP Enzyme, Dako Cytomation) ile amplifiye edildi. Reaksiyon kromojen 3,3- diaminobenzidin tetrahidroklorür (Liquid DAB + Substrat Chromogen System, Dako Cytomation) ile ortaya çıkarıldı ve Harris hematoksilen ile boyandı. KITr için immün boyama paterni, 40x büyütmede 100 mast hücresinde membranar, fokal veya difüz sitoplazmik immün ekspresyon (sırasıyla KIT paternleri I, II veya III) sayılarak değerlendirilmiştir. Her bir MCT, Kiupel ve arkadaşları (2004) tarafından tarif edildiği gibi, neoplastik hücre popülasyonunun en az %10’unda bulunan veya tümör içinde büyük neoplastik hücre kümelerinde bulunan en yüksek boyanma paterni ile tayin edilmiştir. Ki-67 indeksi, 40x büyütmede 3-5 yüksek immünoreaktivite alanında (sıcak noktalar) en az 500 neoplastik hücredeki pozitif çekirdeklerin yüzdesi ile belirlenmiştir. İmmünoreaktivite kanıtı olan her çekirdek Ki-67 için pozitif kabul edilmiştir. Bu yöntem Abadie ve diğerleri (1999), Scase ve diğerleri (2006) ve Strefezzi ve diğerleri (2009) tarafından tanımlanmıştır. Bu metodun değerlendirmenin öznelliğini azalttığı düşünülmektedir. Daha önce test edilmiş köpek MCT örnekleri KITr ve Ki-67 için pozitif kontrol olarak kullanılmış ve birincil antikor normal serumla değiştirilerek negatif kontroller elde edilmiştir. DNA, parafine gömülü tümörlerden proteinaz K yöntemiyle ekstrakte edilmiştir. PCR yoluyla ilgili parçanın amplifikasyonu için kullanılan primerler BLAST yazılımı (Basic Local Alignment Search Tool®, NCBI) kullanılarak tasarlanmış ve Invitrogen tarafından c-kit F: 5′-ATCTGTCTCTCTTTCTCCCCC-3′ (sense) e c-kit R: 5′-TGGGGTTCCCTAAAGTCATTGT-3′ (antisense) olarak üretilmiştir. Bu primer çifti tarafından üretilen ürün, mutasyonların yokluğunda 225 baz çiftine (bp) sahipti (doğal c-kit). Reaksiyonlar GenPro thermocycler’da (BIOER Technology) hazırlanmış ve planlanmıştır; 95°C’de beş dakika tutulmuş, ardından DNA ipliklerinin denatürasyonu için 45 saniye 94°C, primerlerin eşleştirilmesi ve tavlanması için 45 saniye 63°C ve uzatma için bir dakika 72°C’de 30 döngü gerçekleştirilmiş, son olarak moleküler stabilizasyon için on dakika 72°C’de tutulmuştur. Amplifiye edilmiş materyal 100V’de serbest amperajlı elektroforez ile ayrılmıştır. Pozitif ve negatif kontroller olarak sırasıyla sağlıklı köpek derisi örnekleri ve mililitre su kullanılmıştır. Bu çalışma için, MCT tanısı konan hastalar, literatürde (Blackwood ve ark., 2012; London ve Thamm, 2013; Miller ve ark., 2014) değerlendirilen pronostik faktörlere dayalı olarak nüks veya metastaz riskine göre Tablo 1’de gösterildiği gibi üç ana gruba ayrılmıştır. Lomustin (Citostal, Bristol-Meyer Squibb) ile sistemik kemoterapi, her 21 günde bir 60-90 mg/m² dozunda, 3-4 seans, ardından her 48 saatte bir 4-6mg/m² klorambusil (Leukeran, GSK) ile sekiz haftalık protokol yüksek riskli hastalar için şiddetle tavsiye edilmiştir (grup A). Ancak bazı hasta sahipleri tüm tedaviyi kabul ederken (grup A1), bazıları yalnızca maksimum tolere edilebilir lomustin dozunu kabul etmiş (grup A2) ve bazıları da başka bir tedavi seçmemiştir (grup A3 veya yüksek riskli kontrol). |
Orta riskli hastalar (grup B) üç gruba ayrılmıştır: Dört seans boyunca her yedi günde bir 2 mg/m² dozunda adjuvan vinblastin (Velban, ABL) ile tedavi edilen ve ardından sekiz haftalık klorambusil protokolünü takiben dört seans boyunca her 14 günde bir tedavi edilen hastaların oluşturduğu B1; klorambusil kullanılarak sekiz haftalık protokolle tedavi edilen hastaların oluşturduğu B2; ve sahipleri ameliyat dışında herhangi bir tedaviyi reddeden hastaların oluşturduğu B3 (orta riskli kontrol grubu). Düşük riskli hastalar sadece takip edilmiş ve ayrı bir grup (grup C) olarak belirlenmiştir. Tüm kemoterapi protokolleri, ilk yedi gün boyunca günde 40 mg/m2 dozunda prednizon (Meticorten, Schering-Plough), ardından 30 gün boyunca günde 25 mg/m2 ve 60 gün boyunca her 48 saatte bir 25 mg/m2 eşzamanlı olarak uygulanmıştır. Kemoterapi gören tüm hastalara 10 günlük lomustin uygulamasından sonra, yedi günlük vinblastin uygulamasından sonra veya klorambusil tedavisi için her 30 günde bir tam kan sayımı yapılmıştır. Kemoterapi alan tüm hastalar için her 30 günde bir yapılan serum biyokimyasında üre, kreatinin, alkalin fosfataz (ALP), alanin transaminaz (ALT), aspartat transaminaz (AST), gama-glutamil transferaz (GGT) ve albümin değerleri ölçülmüştür. Hastalıksız geçen süre (DFI) ve genel sağkalım süresi (OS) ameliyat gününden itibaren hesaplanmıştır. DFI için lokal nüks, satellit (uydu) lezyonlar, lenf nodu veya viseral metastaz kabul edilmiştir. İlerleyen hastalık ve yeni lezyonların ortaya çıkması durumunda tanıyı doğrulamak için sitoloji kullanılmıştır. Uzak izole kutanöz veya subkutanöz MCT, “de novo” primer lezyonlar olarak kabul edilmiş ve bu nedenle bir vaka teşkil etmemiştir. OS vakaları yalnızca MCT ile ilişkili ölümler için hesaplanmıştır. Takibi kaybedilen veya ilişkili olmayan nedenlerle ölen hastalar analizden sansürlenmiştir. Kemoterapi kullanımına bağlı yan etkiler Veteriner Kooperatif Onkoloji Grubu – Advers Olaylar için Ortak Terminoloji Kriterleri’ne (Common…, 2011) göre kaydedilmiştir. İstatistiksel analiz GraphPad Prism (v.6.01) kullanılarak gerçekleştirilmiştir. Hastalıksız geçen süre ve genel sağkalım süresi Kaplan-Meier eğrisi ile hesaplanmıştır. Risk ve tedaviye göre karşılaştırmalar Cox-Mantel longrank testi kullanılarak yapıldı. Yüksek riskli hastalar için prognostik faktörler ve sonuç arasındaki korelasyon Spearmann testi kullanılarak yapıldı. Anlamlılık p < 0.05 olarak alınmıştır. |
ÇALIŞMAYA DAHİL EDİLEN KÖPEKLERBu çalışmaya 89 köpek dahil edilmiştir. Yaşları üç ila 16,6 arasında değişen (ortalama 10,3 ± 2,8) ve ortalama takip süresi 338 gün olan 55 dişi ve 34 erkek köpek vardı. Labrador (n = 18), Kaniş (n = 6) ve Pit-bull Terrier (n = 5) prevalansının daha yüksek olduğu kaydedilmiştir. Bununla birlikte, melez ırklar 22 köpekle fazlasıyla mevcuttu. Çalışmada yer alan diğer ırklar şunlardır: Cocker Spaniel (n = 4), American Cocker (n = 1), Golden Retriever (n = 3), Weimaraner (n = 1), Boxer (n = 2), Pug (n = 2), French Bulldog (n = 1), Dachshund (n = 2), Pinscher (n = 3), Schnauzer (n = 3), Brazilian Fila (n = 2), Brazilian Terrier (n = 2), Shih-tzu (n = 1), Lhasa- apso (n = 2), Yorkshire (n = 2), Staffordshire Bull Terrier (n = 1), Shiba Inu (n= 1), Maltese (n= 1), German Shepherd (n = 1), Bernese (n = 1), Argentine Mastiff (n = 1) ve Deutsche Dogge (n= 1). Çalışılan gruplarda yaş, cinsiyet ve ırk açısından istatistiksel bir fark bulunmamıştır. Tüm köpekler kutanöz veya subkutan MCT’nin cerrahi eksizyonundan sonra klinik evreleme, cerrahi sınırlar, Patnaik ve Kiupel derecelendirme sistemleri, mitotik sayı, Ki-67 indeksi, KITr paterni ve c-kit onkogeninin ekson 11’inin mutasyonel durumu dahil olmak üzere kapsamlı prognostik faktörlerin değerlendirilmesiyle tedavi edilmiş ve/veya takip edilmiştir (Tablo 2). Birden fazla lezyon varlığında, daha kötü prognozlu olanlar analiz için kabul edilmiştir. c-kit onkogeninin 11. ekzonundaki internal tandem duplikasyonların (ITD) genel prevalansı düşüktü (%6,7), ancak bunlar esas olarak yüksek risk grubunda mevcuttu, göreceli prevalansı %17,6 idi ve evre I hastalığı olan hastalarda mutasyon saptanmadı. |
Tüm yüksek riskli hastalara (n=34) lomustin ile adjuvan kemoterapi ve ardından klorambusil ile sekiz haftalık bir protokol önerilmiş, ancak sadece 11 köpek bu rejimle tedavi edilmiştir (grup A1). On hasta, sahibi daha ileri tedaviyi reddettiği için sadece lomustin ile tedavi edildi (grup A2) ve 13 köpek, yüksek nüks ve metastaz riskine rağmen hiçbir adjuvan tedavi almadı (grup A3). Orta riskli gruptaki sekiz hastaya (grup B1) vinblastin ve ardından sekiz haftalık klorambusil tedavisi uygulanırken, 22 köpek sekiz hafta boyunca yalnızca klorambusil tedavisi almış (grup B2) ve 10 köpek başka bir tedavi almamıştır (grup B3). Düşük riskli hastalara (grup C, n=16) adjuvan tedavi önerilmemiştir ve bu hastalar 6-8 haftada bir takip edilmiştir. Bu çalışmada, dar (n = 9) veya tam olmayan cerrahi sınırlara (n = 53) sahip hastalarda ve hatta cerrahi sınırların ve adjuvan tedavilerin olmadığı durumlarda bile (n = 16/62) lokal tümör nüksü gözlenmemiştir. Hastaların %23,6’sında (21/89), yüksek riskli grubun %58,9’unda (20/34) (adjuvan tedavi uygulanmayan dokuz hasta-A3) ve orta riskli grubun %2,5’inde (1/40) hastalık progresyonu görülmüştür. Bu çalışma sırasında hastaların %19,1’inde (17/89) MCT’ye bağlı ölümler meydana gelmiş olup, bunların tümü yüksek risk grubunda, A1, A2 ve A3 gruplarında sırasıyla iki, altı ve dokuz hastada görülmüştür. Progresif hastalığı olan 21 hastanın 10’unda masitinib (n = 5; ikisi A1, ikisi A2 ve biri A3 grubunda), toceranib (n = 1; A3 grubu), lomustin (n = 1; A3 grubu) veya cerrahi eksizyon ve ardından masitinib (n = 1; A3 grubu) veya lomustin ve ardından klorambusil (n = 3; A1, A3 ve B2 arasında eşit olarak bölünmüştür) ile kurtarma tedavileri denenmiştir, ancak sadece üç hastada (A1, A3 ve B2 grupları arasında eşit olarak bölünmüş) hastalık ilerlemesinden sonra 180 günden daha uzun sağkalım süreleri elde edilmiştir. Bu çalışmadaki her ilerleme bölgesel lenf düğümlerine metastaz ve/veya ciltte çoklu lezyonların oluşumu ile sonuçlanmış ve bunların %71,4’ü (15/21) ülserasyonla sonuçlanmıştır. Orta riskli üç hastada, cerrahi eksizyon ve histopatoloji analizinden sonra yeni bağımsız, ancak soliter lezyonlar olarak karakterize edilen ve yine düşük ila orta riskle ilişkilendirilen “de novo” MCT gelişmiştir ve bu nedenle bunlar, daha önce teşhis edilen MCT’den progresyon olarak değil, primer hastalık olarak tedavi edilmiştir. Nüks ve metastaz riskine göre, Şekil 1’de gösterildiği gibi, DFI ve OS sırasıyla 134 ve 258 gün ile yalnızca yüksek riskli grupta ortalama değere ulaşılmıştır (P <0.0001). |
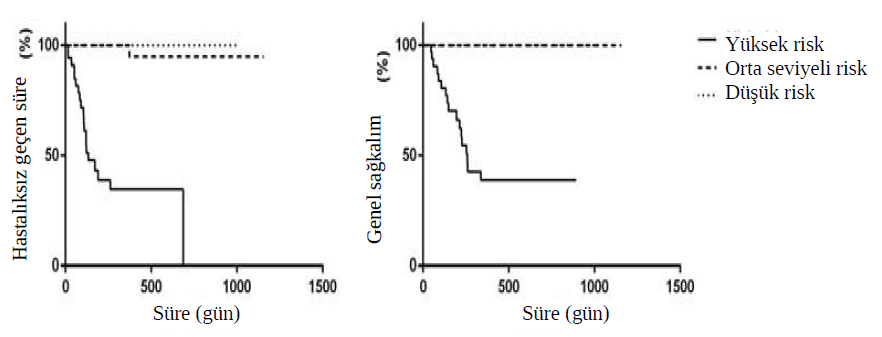
DFI ve OS’de sadece yüksek riskli grupta istatistiksel olarak anlamlı farklılıklar gözlenmiştir. A1, A2 ve A3 grupları için sırasıyla 686, 107 ve 109 günlük bir DFI belirlenirken (p = 0,04), A1 grubunda ortalama OS’ye ulaşılamamıştır ve A2 (OS = 148 gün, p = 0,003) ve A3 (OS = 213 gün, p = 0,0008) gruplarıyla karşılaştırıldığında istatistiksel olarak anlamlı derecede yüksektir. Şekil 2’de gösterildiği gibi, A2 ve A3 grupları arasında DFI ve OS açısından istatistiksel bir fark bulunmamıştır. Diğer gruplarda ortalama değere ulaşılamamış ve 56 hastadan yalnızca birinde (%1,8) 372. günde tümör nüksü geliştiği, ancak çalışmanın sonunda MCT’ye bağlı ölüm bildirilmediği için herhangi bir fark gözlenmemiştir. Advers yan etkiler çoğunlukla hafif ve kendi kendini sınırlayıcıdır ve tablo 3’te gösterilmiştir. |
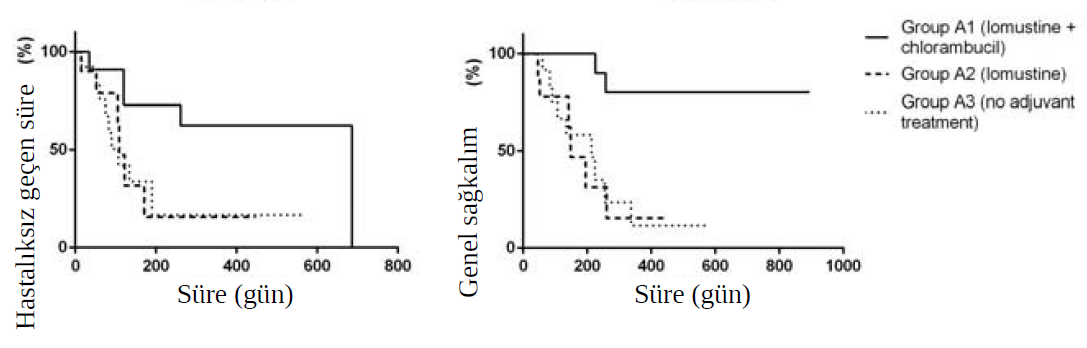
TARTIŞMAKöpek ve kedilerde MCT üzerine Avrupa Konsensüsüne göre, sistemik tedavi yüksek metastaz riski taşıyan hastalar için uygun bir tedavi olarak kabul edilmektedir (Blackwood ve ark., 2012). Bu çalışmada kullanılan köpek MCT’si için prognostik faktörler iyi dengelenmiştir, bu nedenle bu çalışmada doğrulama amacı güdülmemiştir. Çalışılan gruplar arasında sonuç açısından belirgin farklılıklar bulunmuş olup, yüksek riskli hastalarda hastalık kontrolü orta-düşük risk grubundaki hastalara kıyasla daha kötüydü. Bu çalışmada kullanılan orta seviye risk kriterlerinin literatürde hakkında daha az kanıt bulunan prognostik faktörleri de kapsadığı unutulmamalıdır (London ve Thamm, 2013). Genel olarak, inkomplet veya dar cerrahi sınırlarla seyreden histolojik bulgulara sahip köpek MCT’lerinde nüks riskinin daha yüksek olduğundan şüphelenilir. Ancak bu çalışmada bu bulguya rastlanmadığı gibi Miller ve arkadaşları (2014) tarafından yapılan çalışmada da bu bulguya rastlanmamıştır. Michels ve arkadaşları (2002) tarafından yapılan bir çalışmada, inkomplet cerrahi sınırları olan MCT’de nüks olasılığı, temiz sınırları olanlara göre daha yüksek çıkmamıştır. Bu durum, cerrahi sınırların değerlendirilmesindeki başarısızlığın bir sonucu olabileceği gibi, köpek MCT’sinin lokal kontrolünde cerrahinin kapsamının daha az önem taşımasından da kaynaklanıyor olabilir. Ancak tümör rekürrensi %86-100 mortalite oranı ile kötü bir sonuçla ilişkilendirildiğinde, bunu önlemek için her türlü çaba gösterilmelidir (Bostock, 1973; Patnaik ve ark., 1984). Bu nedenle, nüks riskini azaltmak, düşük risk grubuna indirmek ve sistemik tedavilerin yanlışlıkla kullanılmasını önlemek amacıyla, yüksek nüks riski veya metastaz ile ilişkili özelliklerin bulunmadığı, temiz sınırların elde edilebildiği tüm hastalara mümkün olduğunda revizyon cerrahisi uygulanmıştır. Tümör nüksüne ilişkin kötü prognoz, bazı vakalarda revizyon cerrahisinin zorluğu ve radyoterapinin mevcut olmaması göz önünde bulundurularak, bu çalışmada, revizyon cerrahisi yapılmamış (orta risk grubu), inkomplet veya dar cerrahi sınırlara sahip hastalar da sistemik kemoterapi ile tedavi edilmiş, ancak vinblastin ve / veya klorambusil tedavisine dayalı daha az immünosupresif bir protokol uygulanmıştır. Mitotik sayım iyi bilinen bir prognostik faktör olduğundan, orta-düşük risk gruplarında 10 büyük büyütme alanında beşten fazla mitotik sayıma sahip hiçbir hasta yoktur (Romansik ve ark., 2007). Bununla birlikte, tüm vakaların %94,3’ünde ve orta ila düşük riskli hastaların %91,1’inde %1,8’den yüksek Ki-67 indeksi olduğu doğrulanmıştır ve bu durum van Lelyveld ve arkadaşları (2015) tarafından tanımlandığı gibi mitotik sayıya kıyasla bu prognostik faktörün düşük özgüllüğüyle ilişkili olabilir. C-kit onkogenindeki (ekzon 11) internal tandem duplikasyonlar bu çalışmada yaygın olmamakla birlikte, Zemke ve arkadaşları (2002) ve Webster ve arkadaşları (2006) tarafından bildirildiği gibi, bunlar yalnızca nüks veya metastaz riski daha yüksek olan ve eşlik eden negatif prognostik faktörlere sahip hastalarda mevcuttur. Orta ve düşük riskli hiçbir hastada MCT’ye bağlı ölüm görülmemiştir; ancak yüksek risk grubunda, hastalık ilerlemesi belirtileri gösteren hastalarda (ciltte veya lenf düğümlerinde metastatik hastalık) ölüm olasılığı yüksek olmuştur. Bazı hastalar kısa bir süre takip edilmiş olsa da, nüks veya metastaz riskine göre klinik tablonun oluşturulmasına yardımcı olmuşlardır. MCT’li köpeklerde kemoterapi için önerilen birçok ilaca rağmen, bunların kullanımı deneysel düzeyde kalmaktadır (Dobson ve Scase, 2007; London ve Thamm, 2013) ve vinblastin ile prednizon kombinasyonu genellikle tercih edilen protokol haline gelmiş gibi görünmektedir (Dobson ve Scase, 2007; Webster ve ark., 2008). Thamm ve arkadaşları (2006) tarafından yürütülen çalışmada, 61 yüksek riskli hasta (mukokutanöz kavşaklarda bulunan veya bölgesel lenf nodu tutulumu olan orta ila yüksek grade MCT), prednizon ile birlikte her yedi veya 14 günde bir 2 mg/m2 dozunda intravenöz vinblastin ile adjuvan tedavi almış, bunun sonucunda grade 3 MCT için ortalama sağkalım 1374 gün olurken, grade 2 MCT’li tüm hastalar üç yıllık sağkalıma ulaşmıştır. Bununla birlikte, bu popülasyonun tekil özellikleri bu sonuçları etkilemiş olabilir ve kötü sonuçlar genellikle doğru metastatik hastalık teşhisi konulan, yani lenf düğümlerinde açık metastaz (Weishaar ve ark., 2014), ikincil cilt nodülleri (uydu metastaz) ve doğrulanmış viseral tutulum olan hastalarda görülmüştür. Diğer kemoterapötik ajanlar da köpek MCT’sinin tedavisi için değerlendirilmiştir. Taylor ve arkadaşları (2009) tarafından yürütülen bir çalışmada, rezeke edilemeyen MCT ile gelen köpekler prednizolon ve düşük doz klorambusil ile tedaviye tabi tutulmuş, %38’inde ölçülebilir klinik yanıt elde edilmiş ve toksisite bildirilmemiştir. Lomustin de neoadjuvan ortamda kullanılmış ve tedavi edilen 19 köpeğin sekizinde (%42) ölçülebilir yanıt ile etkili olduğu kanıtlanmıştır (Rassnick ve ark., 1999). Çok ajanlı protokoller umut verici sonuçlar göstermiştir ve vinblastin, silkofosfamid ve prednizon birlikteliği, kutanöz MCT’li 11 köpekten yedisinde ölçülebilir yanıtlarla sonuçlanmıştır (Camps-Palau ve ark., 2007). Adjuvan ortamda, Cooper ve arkadaşları (2009), 20 yüksek riskli hastayı prednizon ile birlikte vinblastin (2mg/m2, intravenöz) ve lomustin (27-90mg/m2, oral) ile iki haftada bir dönüşümlü olarak tedavi etmiş ve sırasıyla 35 ve 48 haftalık DFI ve OS elde etmiştir. Bununla birlikte, ölçülebilir hastalığın tedavisinde lomustin ve klorambusilin güvenilirliği ve dikkate değer şekilde etkili olmasına rağmen (Rassnick vd., 1999; Taylor vd., 2009), bu çalışma lomustin ve ardından klorambusil (A1), lomustin (A2), vimblastin ve ardından klorambusil (B1) ve klorambusil (B2) ile adjuvan olarak tedavi edilen hastaları ve benzer prognostik faktörlere sahip kontrol gruplarını kapsayan ilk çalışmadır. Bu çalışmada, adjuvan lomustin, nüks veya metastaz riski yüksek olan köpek MCT’sinin kontrolü için yararlıydı, ancak yalnızca klorambusil ile ardışık olarak kullanıldığında (grup A1), bu durum yalnızca lomustin ile tedavi edilen az sayıda vaka (grup A2) olmasıyla ilişkili olabilir. Lomustinin sekiz haftalık klorambusil protokolü ile kombinasyonu bu hastalarda DFI ve OS’yi önemli ölçüde iyileştirmiştir. Bu prokolün sekonder olarak veya diğer kemoterapötik ajanlarla eşzamanlı olarak etkinliğini kanıtlamak için daha fazla sayıda vaka içeren ileri çalışmalara ihtiyaç vardır. 40 orta riskli hastadan (38’i inkomplet veya dar cerrahi sınırlarla başvurmuştur) 30’u prednizon ile kombinasyon halinde vinblastin ve/veya klorambusil ile tedavi edilmiş, hastaların %97,5’inde hastalığın etkin kontrolü sağlanmış ve sadece birinde bölgesel lenf nodunda metastatik hastalık ve ciltte uydu nodüller ile tümör nüksü gelişmiştir. Bu sonuç, adjuvan ortamda radyoterapi veya kemoterapi ile tedavi edilen benzer tarzdaki hastalardan elde edilen bulgulara benzerdir (Al-Sarraf ve ark., 1996; Thamm ve ark., 2006; Cooper ve ark., 2009) ve orta riskli kontrol grubunda (grup B3) ve düşük riskli grupta (grup C) elde edilen sonuçtan farklı değildir, DFI ve OS üzerinde de herhangi bir farklılık görülmemiştir. Smith ve arkadaşları (2015) tarafından da gösterildiği gibi, bu çalışmada tanımlandığı şekliyle düşük-orta grade MCT’li hastalar için, temiz cerrahi sınırların yokluğunda bile sistemik adjuvan tedavi gereksiz olabilir. Bu çalışmada kullanılan nüks veya metastaz riskine göre sınıflandırma ideal değildir ve adjuvan tedavilerin kullanımı hakkında daha doğru kararlar verebilmek için daha iyi bir sınıflandırma gereklidir. “De novo” MCT gelişimi, orta riskli hastalarda sporadik olarak (%7,5) görülmekte olup, düşük riskli hastalarda rapor edilmemiştir, ancak Davies ve arkadaşları (2004) tarafından önerildiği üzere, bu durum kötü bir sonuçla ilişkilendirilmemiştir. Bu nedenle, orta riskli hastalarda adjuvan tedavi ihtiyacını belirlemek için daha fazla sayıda vaka içeren daha geniş kapsamlı çalışmalara ihtiyaç vardır. Yazarlar, bazı vakalarda kemoterapi uygulanmadığı ve bazı hastalar için kurtarma tedavileri denendiği için bu çalışmanın randomizasyon açısından eksik olduğunu kabul etmektedir. Bununla birlikte, adjuvan kemoterapi için açık endikasyonu olan, özellikle yüksek riskli hastalar olmak üzere, bundan fayda görebilecek hastalar için tedavi etik olarak reddedilemezdi. Yan etkiler genellikle prednizon ile birlikte lomustin veya vinblastin kullanılan kemoterapi sırasında ortaya çıkmıştır. Köpeklerde lomustinin miyelosupresif ve hepatotoksik etkileri iyi bilinmektedir (Gustafon ve Page, 2013) ve bu protokol vinblastin ile olandan daha toksiktir. Bununla birlikte, Cooper ve arkadaşları (2009) tarafından bildirildiği üzere, vinblastin ve lomustinin dönüşümlü olarak kullanıldığı bir protokolde hastaların %54’ünde ortaya çıkan yan etkilere rağmen, bu çalışmada bu ilaçlar hastalar tarafından iyi tolere edilmiştir. Thamm ve arkadaşları (1999), adjuvan ortamda tedavi edilen MCT’li hastaların %20’sinde vinblastine bağlı yan etkiler bildirmiştir ve bu çalışmada da gözlemlendiği gibi, yan etkiler genel olarak hafiftir ve hastanın yaşam kalitesinde belirgin bir düşüş görülmemiştir. Klorambusil kesinlikle en güvenli protokoldü ve ALT ve ALP’deki anormallikler muhtemelen glukokortikoidlerle ilişkiliydi, bununla birlikte uzun vadeli toksisiteler değerlendirilmemiştir. Köpeklerde, kemoterapötik ajanların çoğu, ilaçların farmakinektiğini etkileyebilecek fizyolojik parametreler ve ısı kaybıyla daha yakından bağlantılı olan vücut yüzey alanı temelinde hesaplanmaktadır. Bununla birlikte, bu doz yöntemi dozların doğrusal olmayan bir şekilde dağılımını sağlar ve tüm ilaçlar için uygun olmayabilir. Küçük köpeklerde doz vücut yüzey alanına göre hesaplandığında melfalan, sisplatin, karboplatin ve doksorubisin toksisitesinin daha yüksek olduğu bildirilmiştir (Price ve Frazier, 1998). İlaçların çoğunda, köpeklerde dozu belirtmek için en uygun yöntem konusunda hala kriter eksikliği vardır ve prednizon da dahil olmak üzere bu çalışmada kullanılan ilaçlar için vücut yüzey alanı temelinde hesaplanan toksisite, köpek boyutuna veya bazal metabolizmaya göre farklı olabilir ve bu tür farklılıkları ortaya çıkarmak için yeni çalışmalar gereklidir. |
SONUÇÇok ajanlı tedavi, Patnaik grade 3 olarak sınıflandırılan yüksek riskli MCT’nin yanı sıra lenf nodu veya uzak metastaz ve/veya mitotik sayımla tahmin edilen yüksek büyüme fraksiyonu ile birlikte orta grade olanlar için ek tedavide daha etkili görünmektedir. Eş zamanlı glukokortikoidlerle birlikte lomustin ve klorambusilin ardışık kullanımının bu hastalar için yararlı olduğu kanıtlanmıştır ve sağkalımı uzatabilir ve tümör nüksünü veya metastazı önleyebilir. Orta riskli hastalar, düşük risklilere benzer şekilde, serbest cerrahi sınırlar olmasa bile adjuvan tedavilere ihtiyaç duymayabilir. Vinblastin ve/veya klorambusil bu gruptaki hastalar için avantajlı olmamıştır. Bununla birlikte, nüks sonrası köpek MCT ile ilişkili kötü prognoz göz önüne alındığında, daha yüksek nüks ve tümör yayılımı riskini ortadan kaldırmak için prognostik faktörlerin geniş ve dikkatli bir şekilde değerlendirilmesi gerekmektedir. |
TEŞEKKÜRLERUlusal Bilimsel ve Teknolojik Gelişim Konseyi (CNPq), Yükseköğretim Personelinin Geliştirilmesi Koordinasyonu (CAPES), Karşılaştırmalı Patoloji Laboratuvarı, VETPAT Laboratuvarı, PROGEN Biyoteknolojisi. |
| KAYNAKÇA ABADIE, J.J.; AMARDEILH, M.A.; DELVERDIER, M.E. Immunohistochemical detection of proliferating cell nuclear antigen and Ki-67 in mast cell tumors from dogs. J. Am. Vet. Med. Assoc., v.215, p.1629-1634, 1999. AL-SARRAF, R.; MAUDLIN, G.N.; PATNAIK, A.K.; MELEO, K.A. A prospective study of radiation therapy for the treatment of grade 2 mast cell tumours in 32 dogs. J. Vet. Intern. Med., v.10, p.376-378, 1996. AVERY, A.C. Molecular diagnostics of hematologic malignancies in small animals. Vet. Clin. Small Anim. Pract., v.42, p.97-110, 2012. BLACKWOOD, L.; MURPHY, S.; BURACCO, P. et al. European consensus document on mast cell tumours in dogs and cats. Vet. Comp. Oncol., v.10, p.e1-e29, 2012. BOSTOCK, D.E. The prognosis following surgical removal of mastocytomas in dogs. J. Small Anim. Pract., v.14, p.27-41, 1973. CAMPS-PALAU, M.A.; LEIBMAN, N.F.; ELMSLIE, R. et al. Treatment of canine mast cell tumours with vinblastine, cyclophosphamide and prednisone: 35 cases (1997-2004). Vet. Comp. Oncol., v.5, p.156-167, 2007. Common Terminology Criteria for Adverse Events. Version 1.1. [Washington]: Veterinary and Comparative Oncology, 2011, 30p. COOPER, M.; TSAI, X.; BENNETT, P. Combination CCNU and vinblastine DAVIES, D.R.; WYATT, K.; JARDINE, J.E. et al. Vinblastine and prednisolone as adjunctive therapy for canine cutaneous mast cell tumors. J. Am. Anim. Hosp. Assoc., v.40, p.124-130, 2004. DOBSON, J.M.; SCASE, T.J. Advances in the diagnosis and management of cutaneous mast cell tumours in dogs. J. Small Anim. Pract., v.48, p.424-431, 2007. FRIMBERGER, A.E.; MOORE, A.S.; LARUE, S.M. et al. Radiotherapy of incompletely resected, moderately differentiated mast cell GUSTAFON, D.L.; PAGE, R.L. Cancer chemotherapy. In: WITHROW, S.J.; VAIL, D.M.; PAGE, R.L. Withrow and MacEwen’s KIUPEL, M.; WEBSTER, J.D.; BAILEY, K.L. et al. Proposal of 2-tier histologic gradind system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Vet. Pathol., v.48, p.147-155, 2011. KIUPEL, M.; WEBSTER, J.D.; KANEENE, J.B. et al. The use of KIT and Tryptase expression patterns as prognostic tools for canine cutaneous mast cell tumors. Vet. Pathol., v.41, p.371-377, 2004. LONDON, C.A.; THAMM, D.H. Mast cell tumors. In: WITHROW, S.J.; VAIL, D.M.; PAGE, R.L. Withrow and MacEwen’s small MILLER, R.L.; VAN LELYVELD, S.; WARLAND, J. et al. A retrospective review of treatment and response of high-risk mast cell MICHELS, G.M.; KNAPP, D.W.; DENICOLA, D.B.; GLICKMAN, N.; BOONEY, P. Prognosis following surgical excision of canine cutaneous mast cell tumors with histopathologically tumor free versus nontumor-free margins: a retrospective study of 31 cases. J. Am. Vet. Med. Assoc., v. 38, p. 458-466, 2002. PATNAIK, A.K.; EHLER, W.J.; MACEWEN E.G. Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 PRICE, G.S.; FRAZIER, D.L. Use of body surface area (BSA)-based dosages to calculate chemotherapeutic drug dose in dogs: I. potential problems with current BSA Formulae. J. Vet. Intern. Med., v.12, p.267-271, 1998. RASSNICK, K.M.; MOORE, A.S.; WILLIAMS, L.E. et al. Treatment of canine mast cell tumors with CCNU (lomustine), J. Vet. Intern. Med., v.13, p.601-605, 1999. ROMANSIK, E.M.; REILLY, C.M.; KASS, P.H. et al. Mitotic índex is predictive for survival for canine cutaneous mast cell tumors. Vet. Pathol., v.44, p.335-341, 2007. SCASE, T.J.; EDWARDS, D.; MILLER, J. et al. Canine mast cell tumors: correlation of apoptosis and proliferation markers with prognosis. J. Vet. Intern. Med., v.20, p.151-158, 2006. SMITH, J.; KIUPEL, M.; FARRELLY, J. et al. Recurrence rates and clinical outcome for dogs with grade II mast cell tumours with a low AgNOR count and Ki67 index treated with surgery alone. Vet. Comp. Oncol., v.15, p.1-10, 2015. STREFEZZI, R.F.; KLEEB, S.R.; XAVIER, J.G. Prognostic indicators for mast cell tumors. Braz. J. Vet. Pathol., v.2, p.110-121, 2009. TAYLOR, F.; GEAR, R.; HOATHER, T.; DOBSON, J. Clorambucila and prednisolone chemotherapy for dogs with inoperable mast cell tumours: 21 cases, J. Small Anim. Pract., v.50, p.284-289, 2009. THAMM, D.H.; MAULDIN, E.A.; VAIL, D.M. Prednisone and vinblastine chemotherapy for canine mast cell tumor–41 cases (1992-1997), J. Vet. Intern. Med., v.13, p.491-497, 1999. THAMM, D.H.; TUREK, M.M.; VAIL, D.M. Outcome and prognostic factors following adjuvant prednisone/vinblastine chemotherapy for high-risk canine mast cell tumour: 61 cases, J. Vet. Med. Sci., v.68, p.581-587, 2006. VAN LELYVELD, S.; WARLAND, J.; MILLER, R.; MAW, H.; FOALE, R.; GOODFELLOW, M.; DOBSON, J. Comparison between ki-67 index and mitotic índex for predicting outcome in canine mast cell tumours. J. Small Anim. Pract., v. 56, n. 5, p. 312-319, 2015. WARLAND, J.; BRIOSCHI, V.; OWEN, L.; DOBSON, J. Canine mast cell tumours: decision-making and treatment. In Practice, v.37, p.315-332, 2015. WEBSTER, J.D.; YUZBASIYAN-GURKAN, V.; KANEENE, J.B. et al. The role of c-kit in tumorigenesis: evaluation in canine cutaneous WEBSTER, J.D.; YUZBASIYAN-GURKAN, V.; THAMM, D.H. et al. Evaluation of prognostic markers for canine mast cell tumors WEISHAAR, K.M.; THAMM, D.H.; WORLEY, D.R. et al. Correlation of nodal mast cells with clinical outcome in dogs with mast cell tumour and a proposed classification system for the evaluation of node metastasis. J. Comp. Pathol., v.151, p.329-338, 2014. ZEMKE, D.; YAMINI, B.; GURKANYUZBASIYAN, V. Mutation in the juxtamembrane domain of c-kit are associated with higher grade mast cell tumors in dogs. Vet. Pathol., v.39, p.529-535, 2002. |