1 Veteriner Fakültesi, Michigan Eyalet Üniversitesi, East Lansing, MI 48824, ABD
2 Mikrobiyoloji ve Moleküler Genetik Bölümü, Veteriner Fakültesi, Michigan Eyalet Üniversitesi, East Lansing, MI 48824, ABD
3 Küçük Hayvan Klinik Bilimleri Bölümü, Veteriner Fakültesi, Michigan Eyalet Üniversitesi, East Lansing, MI 48824, ABD
* İletişim: vygsu@msu.edu
Bu makaleye atıfta bulunmak için: Yang, Y.-T.; Yuzbasiyan- Gurkan, V. Sorafenib and Doxorubicin Show Synergistic Effects in Human and Canine Osteosarcoma Cell Lines. Int. J. Mol. Sci. 2022, 23, 9345.https://doi.org/10.3390/ ijms23169345
Academik Editör: Claudio Di Cristofano
Sunum Tarihi: 29 Temmuz 2022
Kabul Tarihi: 16 Ağustos 2022
Yayın Tarihi: 19 Ağustos 2022
Yayıncının Notu: MDPI, makalenin yayınlandığı ülkelerdeki ve kurumsal bağlantılardaki yasal hak iddiaları konusunda tarafsız kalmaktadır.
Telif Hakkı: © 2022 yazarlar tarafından. Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution (CC BY) lisansının hüküm ve koşulları altında dağıtılan açık erişimli bir makaledir (https:// creativecommons.org/licenses/by/ 4.0/).
Özet: Osteosarkom (OSA) hem insanlarda hem de köpeklerde en sık görülen kemik tümörüdür ve köpeklerde insanlardan yaklaşık on kat daha yüksek bir insidansa sahiptir. Diğer kanserlerin tedavisinde kaydedilen ilerlemelere rağmen, OSA için genel sağkalım oranları son kırk yıldır değişmemektedir. Bu nedenle, yeni ve etkili tedavilerin belirlenmesine büyük ihtiyaç vardır. Bu çalışmada bir dizi tirozin kinaz inhibitörü taranmış ve bir multi-kinaz inhibitörü olan sorafenib, köpek ve insan OSA hücre hatları üzerinde tek başına ve sisplatin, karboplatin ve doksorubisin kombinasyonu ile ileri düzeyde incelenmek üzere seçilmiştir. Elde ettiğimiz veriler, sorafenib doksorubisin ile kombine edildiğinde sinerjik etkiler görüldüğüne, ancak hem insan hem de köpek OSA’sında sisplatin veya karboplatin ile kombine edilemediğine işaret etmektedir. Mevcut bulgulara dayanarak, köpeklerde kavram kanıtlama çalışmalarında doksorubisin ve sorafenib kombinasyonunu kullanan klinik çalışmalar yapılması gerekmektedir. Bu çalışmalar, vaka yükünün yüksek olduğu köpeklerde nispeten daha hızlı bir şekilde gerçekleştirilebilir ve insanlarda klinik çalışmaların başlatılması için faydalı veriler sağlayabilir.
Bu makaleye atıfta bulunmak için: Yang, Y.-T.; Yuzbasiyan- Gurkan, V. Sorafenib and Doxorubicin Show Synergistic Effects in Human and Canine Osteosarcoma Cell Lines. Int. J. Mol. Sci. 2022, 23, 9345.https://doi.org/10.3390/ ijms23169345
Academik Editör: Claudio Di Cristofano
Sunum Tarihi: 29 Temmuz 2022
Kabul Tarihi: 16 Ağustos 2022
Yayın Tarihi: 19 Ağustos 2022
Yayıncının Notu: MDPI, makalenin yayınlandığı ülkelerdeki ve kurumsal bağlantılardaki yasal hak iddiaları konusunda tarafsız kalmaktadır.
Telif Hakkı: © 2022 yazarlar tarafından. Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution (CC BY) lisansının hüküm ve koşulları altında dağıtılan açık erişimli bir makaledir (https:// creativecommons.org/licenses/by/ 4.0/).
Anahtar kelimeler: osteosarkom; sorafenib; doksorubisin; kombinasyon tedavisi
1. Giriş
Osteosarkom (OSA) hem insanlarda hem de köpeklerde en sık görülen primer kemik tümörüdür ve Amerika Birleşik Devletleri’nde her yıl insanlarda yaklaşık 1000, köpeklerde ise 10.000 OSA vakası bildirilmektedir [1]. Köpek osteosarkomu agresif bir kanserdir; kliniklerde osteosarkom tanısı konduğunda köpeklerin yaklaşık %80-90’ında mikro-metastaz hastalığı görülür. Köpek OSA’sı (cOSA), histopatolojik görünüm, moleküler belirteçler ve geleneksel kemoterapilere yanıt da dahil olmak üzere insan OSA’sına (hOSA) yakından benzemektedir. İnsanlar ve köpekler genomları ve yaşama koşulları bakımından benzerlikler gösterdiğinden, köpek hastalığı osteosarkomun incelenmesi için mükemmel ve paralel bir hastalıktır. cOSA’da kullanılan mevcut birinci basamak kemoterapiler sisplatin, karboplatin ve doksorubisindir [2-4]. Mevcut standart tedavi ile insan hastalar yüksek nüks oranı göstermekte ve kemoterapiye direnç geliştirmektedir. Bu klinik zorlukların üstesinden gelmek için, hem insanlar hem de köpekler için etkili ve iyi tolere edilen terapötik ilaçların kullanılması gerekmektedir.
Birçok çalışma OSA’nın genomik karmaşıklığını değerlendirmiş ve somatik kopya sayısı ve epigenetik değişiklikler bildirmiştir [5-8]. Genom tabanlı yapılan bir ilişkilendirme çalışmasında CDKN2A/B, AKT2 ve BCL2 gibi risk lokusları tanımlanmıştır [9]. MAPK ve PI3K/AKT yolaklarındaki genlerde değişiklikler cOSA tümör örneklerinin %17 ve %37’sinde bulunmuştur [6]. Ayrıca, test edilen üç ırkta (golden retriever, greyhound ve Rottweiler) incelenen tümör örneklerinin %21’inde SETD2’de mutasyonlar bulunmuştur [5]. Yapılan başka bir çalışmada cOSA tümörlerinin %42’sinde SETD2 mutasyonları bildirilmiştir [6]. Başka bir çalışmada, hem hOSA hem de cOSA’da karşılaştırmalı DNA metilasyonu yoluyla epigenetik kontrole odaklanılmış ve iki tür arasındaki karşılaştırmada anahtar transkripsiyonel modeller arasında güçlü korelasyonlar tespit edilmiştir [7]. hOSA ve cOSA tarafından paylaşılan moleküler benzerlikler, köpeklerin hayvan modeli olarak kullanımını destekler niteliktedir.
Int. J. Mol. Sci. 2022, 23, 9345.https://doi.org/10.3390/ijms23169345https://www.mdpi.com/journal/ijms
Osteosarkom sekanslamasından elde edilen bulgular, tümör yapısının karmaşıklığına ilişkin bilgilerimizi artırmıştır. Bununla birlikte, her iki türde de, sürücü mutasyonlar henüz tanımlanmamış olsa da, OSA’da birkaç anahtar yolak yüksek oranda aktive olmaktadır. OSA hastalarında P13K/AKT ve MAPK yolağının aktivasyonu belgelenmiştir [6,10]. İlgili anahtar sinyal yollarının tanımlanmasıyla, daha hedefe yönelik terapötik ajanlar kullanılabilir ve bunların değerlendirilmesi gerekir. Potansiyel adaylardan biri sorafenibdir.
Oral küçük moleküler bir inhibitör olan Sorafenib (BAY 43-9906, Nexavar®, Whippany, NJ, ABD) çeşitli sinyal iletim yollarını inhibe eder. Sorafenib öncelikle RAF inhibitörü olarak geliştirilmiştir, ancak VEGFR-2 (vasküler endotelyal büyüme faktörü reseptörü), VEGFR-3, PDGFR (trombosit kaynaklı büyüme faktörü reseptörü), RAF-1, B-RAF ve c-KIT dahil olmak üzere diğer hedefleri de inhibe ettiği bulunmuştur [11-13]. Sorafenib, insanlarda hepatoselüler karsinom (HCC) [14,15] ile böbrek [16,17], karaciğer [18] ve tiroid [19] kanseri olan hastaların tedavisinde endikedir. Literatürde, OSA tedavisinde sorafenib kullanımına ilişkin sınırlı sayıda rapor bulunmaktadır. Bu çalışmalar, ikisi sorafenibi tek ajan olarak kullanan [20,21] ve biri mTOR inhibitörü ile birleştiren [22] birkaç klinik çalışmanın yanı sıra sorafenibi RANKL inhibitörü denosumab ile birleştiren bir vaka çalışmasını da içermektedir [23]. Ancak köpeklerde herhangi bir klinik çalışma yapılmamıştır. Çeşitli kanserleri olan küçük bir grup köpekte sorafenibin tolere edilebilir dozajını bildiren yeni bir çalışma yapılmıştır [24] ve bu çalışma sorafenibin üç ila sekiz dozda verilen 3 mg/kg’a kadar iyi tolere edildiğini göstermiştir. Sorafenib diğer solid tümörlerde çalışılmış olsa da, sorafenibin cOSA ve hOSA tedavisindeki potansiyelinin değerlendirmesi oldukça sınırlıdır. Şimdiye kadar, sorafenibin anti-tümör aktivitesi üzerine yapılan çalışmaların çoğu HCC ile ilgili yapılmıştır. Sorafenib tek başına 2007’den beri HCC hastaları için standart tedavi olarak kullanılmaktadır ve sorafenib ve doksorubisin kombinasyonu klinik çalışmalarda ilerlemiş (HCC) tedavisinde kullanılmaktadır [14,15,25]. Topoizomeraz II inhibitörü olan doksorubisin, topoizomeraz-II aracılı DNA onarımını ve serbest radikal oluşumunu bozarak DNA hasarına neden olur ve hOSA ve cOSA için ilk basamak kemoterapilerden biridir [26,27]. Bununla birlikte, OSA’da sorafenib ve doksorubisin kombinasyonunun kullanımına ilişkin çok sınırlı bilgi bulunmaktadır.
Bu çalışmada, ilk olarak üç OSA hücre hattı üzerinde on tirozin kinaz inhibitöründen (TKI) oluşan bir paneli taradık ve daha ileri çalışmalar için üç TKI (sorafenib, sunitinib ve gefitinib) seçtik. IC50 değerlerine dayanarak sorafenibi potansiyel terapötik aday olarak belirledik; sunitinib ve gefitinibin IC50 değerleri literatürde bildirilen ulaşılabilir plazma konsantrasyonlarının üzerindeydi. Bu çalışmanın odak noktası, tirozin kinaz inhibitörü olan sorafenibin cOSA ve hOSA hücreleri üzerindeki etkilerini tek başına ve OSA için mevcut kemoterapötik ajanlarla birlikte değerlendirmekti. Burada, sorafenibin tek başına hem hOSA hem de cOSA hücre hatlarında büyüme inhibisyonu etkileri gösterdiğini bildiriyoruz. Ayrıca, sorafenibin tek başına ve doksorubisin ile kombinasyon halinde cOSA ve hOSA hücreleri üzerinde sinerjik etkiye sahip olduğunu ortaya koyduk. Bu preklinik bulgular, çoklu kinaz inhibitörü sorafenibin tek başına ve doksorubisin ile kombinasyon halinde gelecekteki klinik çalışmalarda kullanılmasının dikkate alınması gerektiğini ve köpeklerin bu tür deneyler için kavram kanıtlama çalışmalarında rol oynayabileceğini göstermektedir.
2. Sonuçlar
- Sorafenib, Gefitinib ve Sunitinib Büyüme İnhibisyonu Potansiyeli Göstermiştir
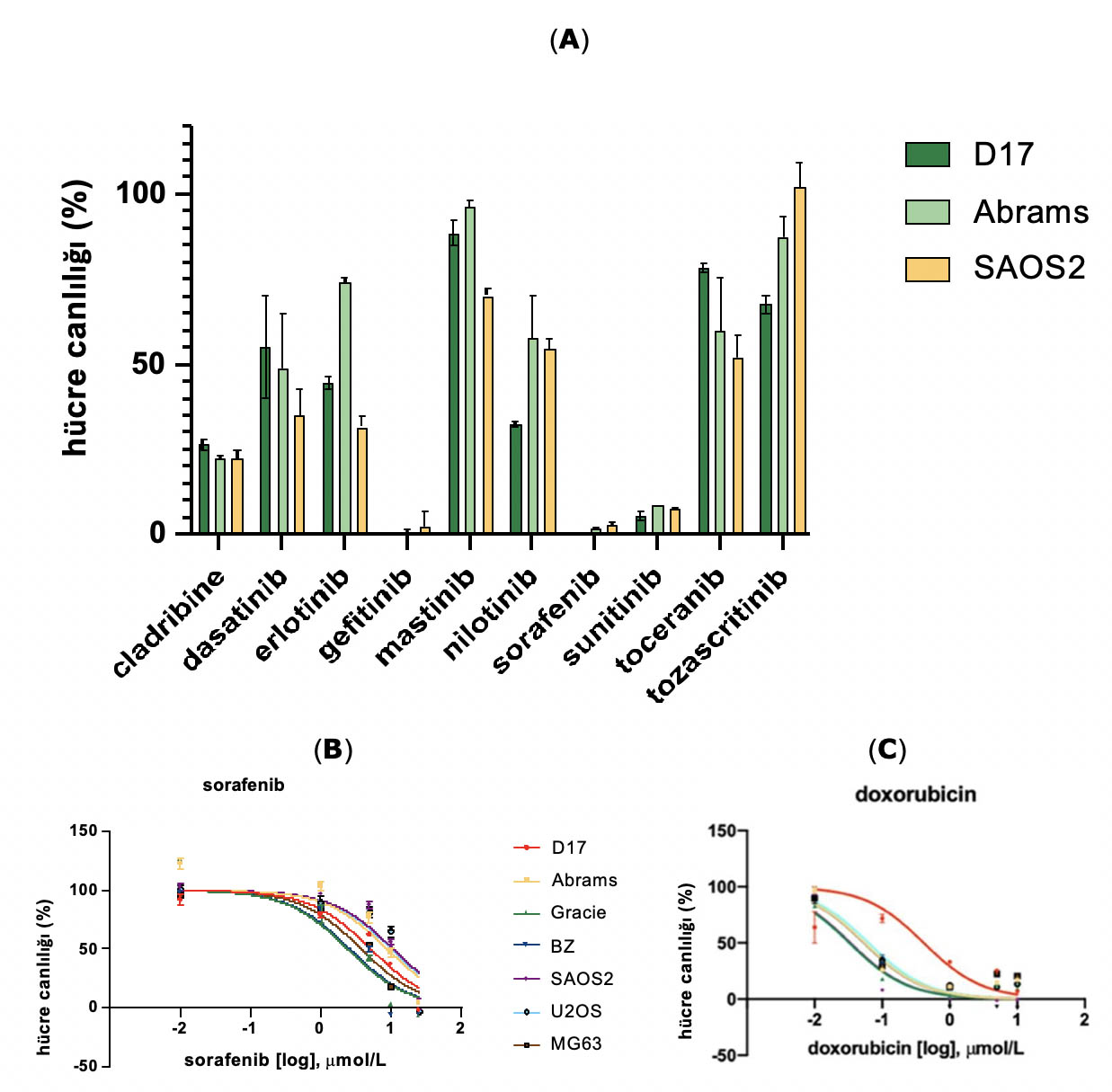
Şekil1A’da görüldüğü gibi, 48 saatlik inkübasyondan sonra, hücre canlılığı 10 tirozin kinaz inhibitöründe ölçülmüştür. Bunlar arasında sadece sorafenib, sunitinib ve gefitinib hücre canlılığını 100 µM’de %10’un altına düşürebilmiştir. Bu nedenle, daha ileri çalışmalar için bu üç TKI’yi seçtik.
Şekil 1. Hücre canlılığı, dört köpek OSA (D17, Abrams, Gracie ve BZ) ve üç insan OSA (SAOS2, U2OS ve MG63) hücre hattı dahil olmak üzere yedi OSA hücre hattının tamamında CellTiter-Glo assay ile ölçülmüştür. Tüm hücre hatları 72 saat boyunca ilaçla işlem görmüştür. (A) On TKI, OSA hücre canlılığı üzerinde farklı düzeylerde inhibisyon göstermektedir. (B)OSA hücre hatları 72 saat boyunca sorafenib ile işlem görmüştür. (C) OSA hücre hatları doksorubisin ile işlem görmüştür.
- OSA Tedavisi için Sorafenib ve Konvansiyonel Kemoterapötikler ile Sitotoksisite Deneyi
Üç TKI, gefitinib, sorafenib ve sunitinib, daha ileri değerlendirme için seçilmiştir. Sorafenib ve diğer ilaçların dört cOSA hücre hattının (D17, Abrams, BZ ve Gracie) ve üç hOSA hücre hattının (SAOS2, U2OS ve MG63) hücre büyümesi inhibisyonu üzerindeki etkisi MTS testi ile incelenmiştir. 72 saatlik inkübasyondan sonra, çeşitli konsantrasyonlarda hücre canlılığına dayalı doz-yanıt eğrileri oluşturulmuş ve IC50 değerleri GraphPad Prism yazılımı kullanılarak hesaplanmıştır (Şekil1B,C). Literatürde bildirilen ulaşılabilir plazma konsantrasyonlarının üzerinde IC50 değerleri gösteren iki TKI, gefitinib [ 28] ve sunitinib [29], daha sonraki çalışmalara dahil edilmemiştir.
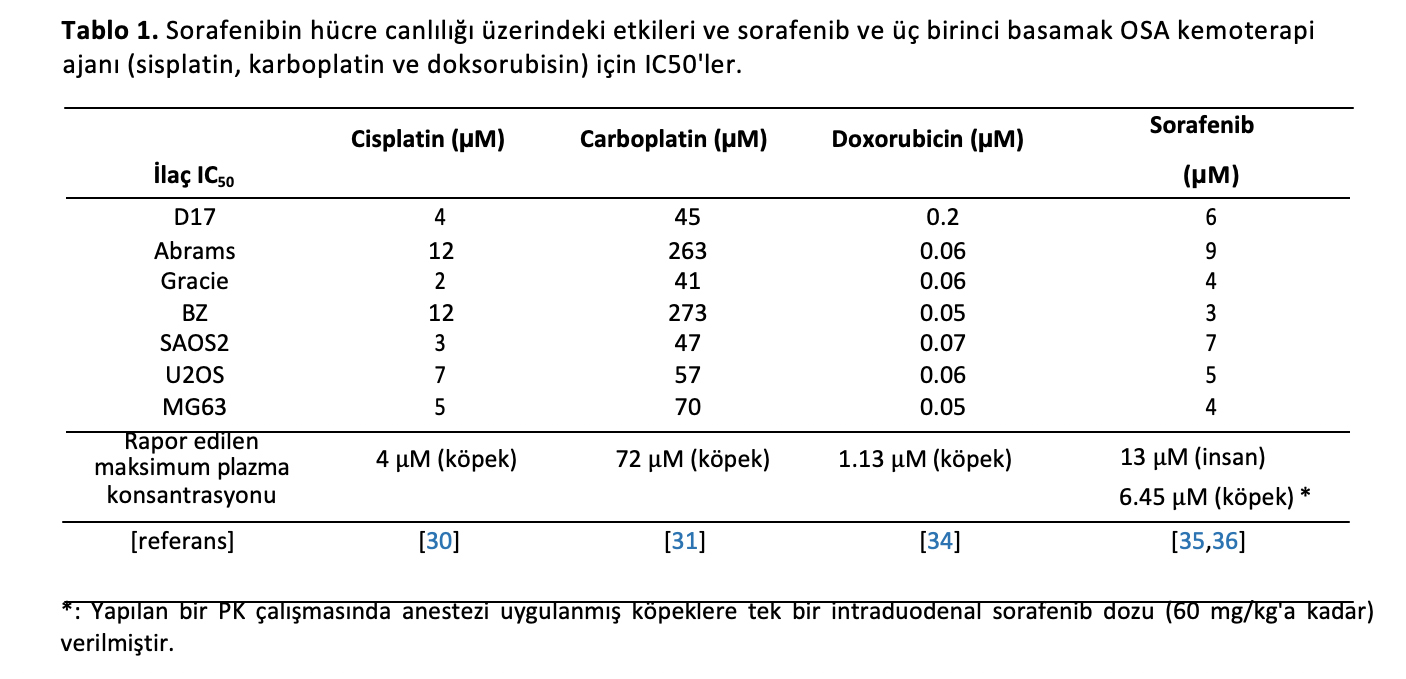
Geleneksel kemoterapötikler olan sisplatin, karboplatin ve doksorubisin için IC50 değerleri de hücre hatlarımızda belirlenmiştir (Tablo1). Sisplatin [30] ve karboplatinin [31] IC50 değerlerinin literatürde bildirilen ulaşılabilir plazma konsantrasyonundan daha büyük olduğu bulunmuştur. Bununla birlikte, doksorubisin için IC50 değerleri hücre hatlarımızda 58-226 nM arasında değişmektedir ve bu değerler köpeklerde belgelenen 1130 nM’lik ulaşılabilir plazma konsantrasyonundan daha düşüktür. Ek olarak, sorafenib için IC50 değerleri 3-9 µM arasında değişirken, çalışmalar insanlarda 13 µM ve köpeklerde 6,45 µM ulaşılabilir plazma konsantrasyonları bildirmiştir. Rapor edilen ulaşılabilir plazma konsantrasyonları ile yapılan bu karşılaştırmalar, her biri klinik olarak ilgili dozlarda terapötik etkilere ulaşma potansiyeline sahip ilaç kombinasyonlarını seçmek amacıyla sorafenib ve doksorubisinin daha ileri değerlendirme için dahil edilmesi için dayanak sağlamıştır [32,33].
2.3.Hücre Migrasyon Yeteneği Sorafenib Tarafından İnhibe Edildi
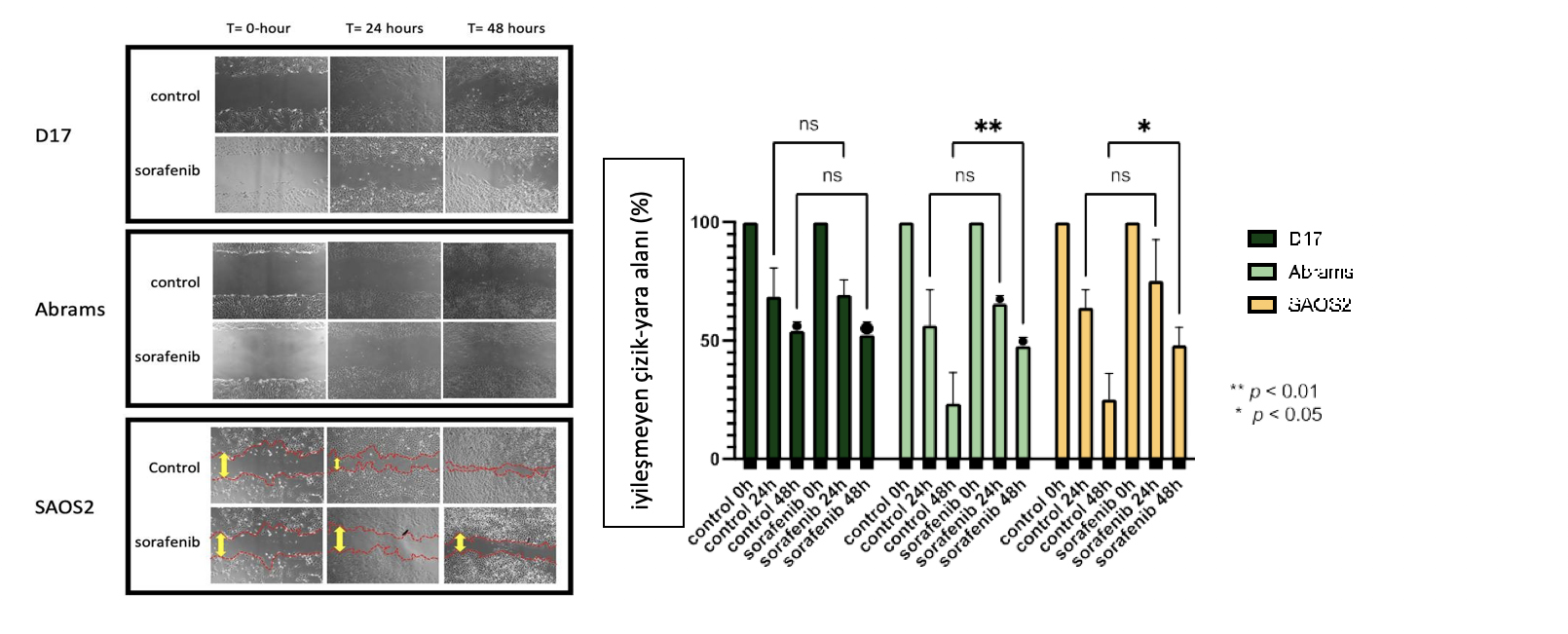
Şekil2’de gösterildiği gibi, sorafenibin OSA hücrelerinin migrasyon kapasiteleri üzerindeki etkisi yara iyileştirme deneyi ile belirlenmiştir. D17, Abrams ve SAOS2 hücreleri, 6 kuyucuklu bir plakanın merkezinde bir çizik oluşturduktan sonra 48 saate kadar inkübasyon süresi boyunca sorafenib ile veya sorafenib olmadan işlem görmüştür. Bu deneyde, sorafenib SAOS2 ve Abrams hücre hatlarının migrasyonunu etkili bir şekilde baskılamıştır. Hücre sitotoksik etkilerinden kaçınmak için, bu çalışmada IC50’lerden daha düşük dozda sorafenib kullandık. 24 ve 48 saatlik tedaviden sonra, sorafenib ile inkübe edilen SAOS2 hücreleri kontrol grubuna göre daha az migrasyon göstermiştir (Şekil2).
Şekil 2. Nikon kamera ile 40× büyütmede çekilen fotomikrograflar, 48 saate kadar sorafenib içeren ve içermeyen üç OSA hücre hattında yara iyileşmesini karşılaştırmaktadır (D17: 3 µM, Abrams: 4 µM, SAOS2: 3 µM). **: p < 0.01, *: p < 0.05 ve Tukey’in çoklu karşılaştırma testi ile iki yönlü ANOVA ile belirlenen kontrole kıyasla sorafenib tedavisi için ns (anlamlı değil).
- Sorafenib Abrams ve D17 Hücre Hatlarında STAT3 ve ERK Fosforilasyonunu İnhibe Etmiştir
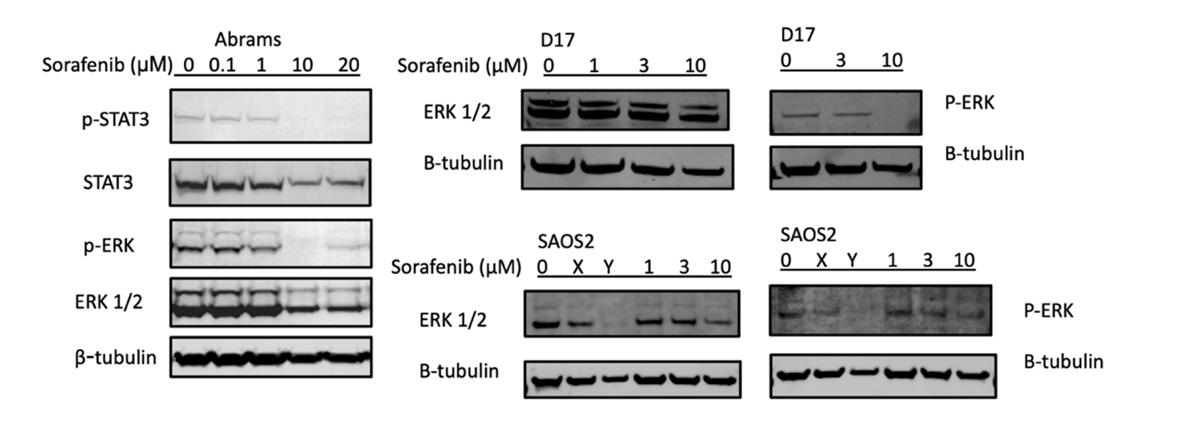
Reseptör tirozin kinazlar tarafından aktive edilen iki ana sinyal iletim yolu PI3K/AKT (fosfatidilinositol 3-kinaz/serin-treonin protein kinaz) ve MAPK/ERK (mitojenle aktive olan protein kinazlar/ hücre dışı sinyalle düzenlenen kinazlar) yollarıdır [37,38]. Şekil3’te, sorafenib tedavilerinin potansiyel mekanizmaları, anahtar yolakların Western blot analizi kullanılarak araştırılmıştır. Köpek Abrams hücre hattında, p-ERK ve p-STAT3 10 µM veya daha yüksek sorafenib konsantrasyonlarında azalmıştır. D17 hücre hattı da 10 µM sorafenib ile işleme tabi tutulduğunda p-ERK’nin tamamen kaybolduğu görülürken, SAOS2’de bu yolağın tedaviden etkilenmediği görülmüştür.
Şekil 3. Sorafenib protein analizinde p-STAT3 ve p-ERK ekspresyonunu azaltır. Köpek osteosarkomu Abrams hücreleri 24 saat boyunca DMSO (kontrol) veya çeşitli sorafenib konsantrasyonları (0,1, 1, 10, 20 µM) ile muamele edilmiş ve ardından Western blot analizine tabi tutulmuştur. Yükleme kontrolleri olarak β-aktin ve β-tubulin kullanılmıştır. X: JQ1 0,1 µM, Y: bortezomib 25 nM.
- Sorafenib ve Doksorubisin Sinerjik Etkiler Göstermiştir
Ardından, farklı etki şekillerine sahip ilaçların kombinasyonları yoluyla anti-tümör etkilerini iyileştirme olasılığını değerlendirdik. Sorafenib ile kombinasyon halinde üç ilacı (sisplatin, karboplatin ve doksorubisin) inceledik. İki OSA hücre hattı (D17 ve SAOS2) 72 saat boyunca çeşitli sorafenib konsantrasyonlarına, diğer üç ilaçtan birine veya bunların kombinasyonuna maruz bırakıldı. Daha sonra, hücre canlılığı MTS testi kullanılarak incelendi ve etkiler CompuSyn yazılımı (Combosyn, Paramus, NJ) kullanılarak hesaplandı. Şekil4A’da görüldüğü gibi, doksorubisin ile kombine edilen sorafenib, sinerjik etkilere işaret eden 1’den küçük birkaç kombinasyon indeksi değeriyle sonuçlanmıştır. Sisplatin (Şekil4B) ve karboplatin (Şekil4C) kombinasyonlarının çoğu D17 ve SAOS2 hücre hatlarında sorafenib ile antagonistik etkiler göstermiştir.
Şekil 4. Üç farklı sorafenib ve doksorubisin oranı SAOS2 ve D17 hücreleri üzerinde kombinasyon indeksi (CI) deneyi ile incelenmiştir. (A) Normalleştirilmiş izobologram. Üç farklı sorafenib ve doksorubisin oranını (20:1, 50:1 ve 100:1) dahil ettik. (B) Sorafenib ve sisplatin kombinasyonu D17 ve SAOS2 hücreleri üzerinde 4:1 oranında incelenmiştir. (C) Sorafenib ve karboplatin kombinasyonu D17 ve SAOS2 hücreleri üzerinde 1:5 oranında incelenmiştir.
Hücre Döngüsünün Sorafenib ve Doksorubisin ile Arresti
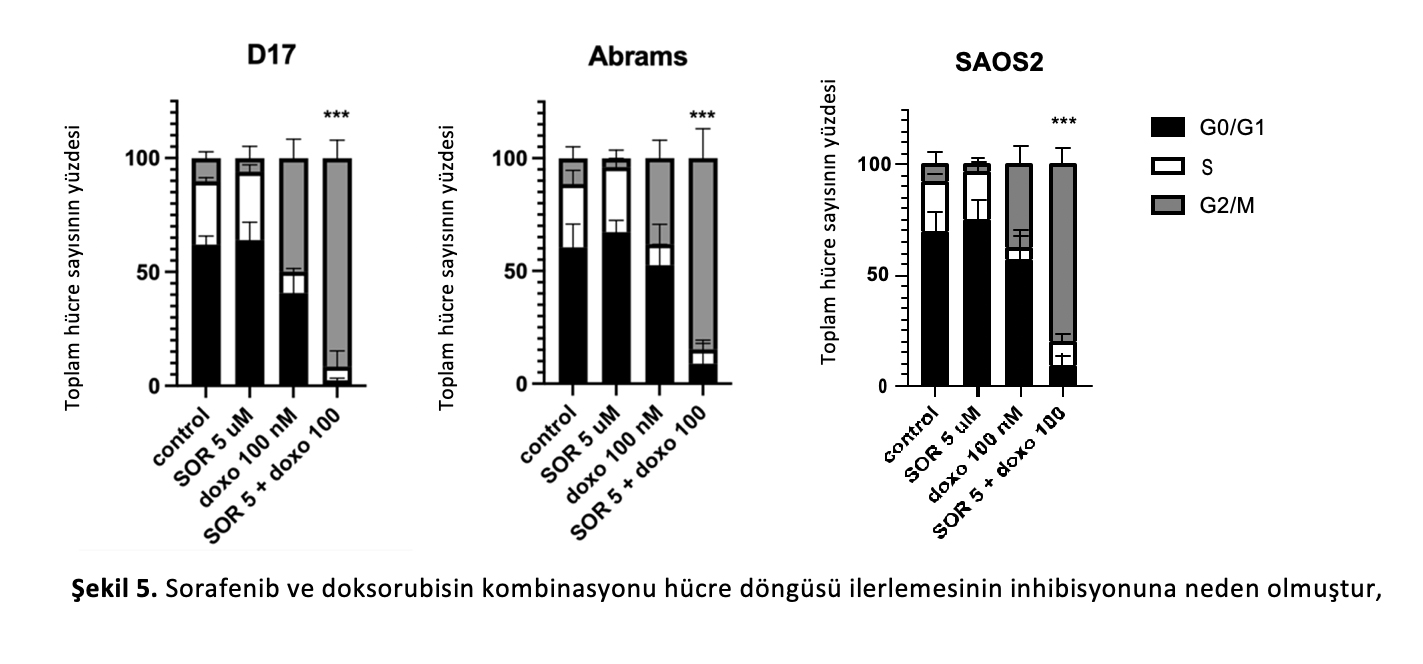
2.6.Üç OSA hücre hattında sorafenib ve doksorubisin kullanımıyla hücre döngüsü değişikliklerinin etkilerini inceledik ve bunların birlikte kullanımıyla tüm hücre hatlarında G2/M fazında hücre arresti tespit ettik. Dağılımlar tek başına 5 µM sorafenib ile tedaviden sonra çok benzerdir (Şekil5A,B), ancak 5 µM sorafenib ve 100 nM doksorubisin birlikte kullanıldığında G2/M arresti açıkça artmış (Şekil5D), G2/M’yi %10’dan %91’e değiştirmiş ve G2/M fazında hücre arrestine neden olmuştur. Bu gözlem her üç OSA hücre hattı (D17 (Şekil5E), Abrams (Şekil5F) ve SAOS2 (Şekil5G)) arasında tutarlıydı. İlginç bir şekilde, tek başına doksorubisin tarafından indüklenen apoptotik fraksiyon sorafenib varlığında azalmıştır (Şekil5C,D).
D17 hücrelerinde G2/M arrestine yol açmıştır. DMSO (kontrol), (B) sorafenib 5 µM, (C) doksorubisin 100 nM veya (D) hem sorafenib 5 µM hem de doksorubisin 100 nM ile 24 saat boyunca işlem gören D17 OSA hücrelerinin hücre döngüsü dağılımı. Temsili akış histogramları köpek OSA D17 hücre hattında hücre döngüsü ilerlemesindeki değişiklikleri göstermektedir. Sorafenib ve doksorubisin kombinasyonu G2/M fazında hücre arrestine yol açmıştır. Temsili hücre döngüsü dağılım grafikleri (E) D17, (F) Abrams ve insan OSA ve (G) SAOS2 hücre hatlarında G2/M hücre arrestini göstermektedir. ***: Dunnett’in çoklu karşılaştırma testi ile tek yönlü ANOVA ile belirlenen kombine tedaviye (5 µM sorafenib ve 100 nM doksorubisin) kıyasla G2/M arresti için p < 0.001.
3. Tartışma
Kemik kanserlerinde, terapötik tedavi stratejisi olarak MAPK/ERK yolağının hedeflenmesi in vitro [12,39,40], in vivo [41-43] ve klinik çalışmalarda [22,44] incelenmiştir. Sorafenibin MEK/ERK sinyal yolağı üzerindeki inhibitör etkileri rapor edilmiştir [12,39,44]. Yapılan bir çalışmada, insan hastalardaki OSA tümörlerinin yaklaşık %67’si (20/30 örnek) histopatolojide p-ERK için immünopozitiflik göstermiştir; bu da ERK yolağının hOSA’da yüksek oranda aktive olduğunu ve p-ERK’nin bloke edilmesinin önemli bir terapötik seçenek olabileceğini göstermektedir [45]. STAT3 aktivasyonu da hücrelerin hayatta kalmasını ve çoğalmasını desteklediği için OSA hücrelerinde kritik bir rol oynamaktadır [45-47]. Daha önce yapılan bir çalışma, STAT3 aktivasyonunun insan ve köpek OSA hücrelerinin hayatta kalmasına ve çoğalmasına katkıda bulunduğunu göstermiş, böylece STAT3’ün tedaviye yönelik strateji için potansiyel bir hedef olduğunu düşündürmüştür [46]. Önceki çalışmalar sorafenib ve türevi sc-1’in STAT3 ve ERK yolaklarının aktivasyonunu aşağı regüle edebildiğini ve tümör hacimlerini azaltabildiğini bildirmiştir [47]. Köpek Abrams OSA hücre hattı üzerinde yaptığımız çalışma, sorafenibin p-STAT3 ve p-ERK ekspresyonunu aşağı regüle etmesi bakımından benzer sonuçlar göstermektedir. MAPK/ERK ve STAT3 sinyal yolaklarının yanı sıra, sorafenib için bir diğer hedef VEGFA’dır. Yakın zamanda yapılan bir çalışmada, osteosarkom hastasından türetilmiş bir ksenograft modelinde (PDTX) farklı amplifikasyonları tedavi etmek için hedefe yönelik potansiyel ilaçları belirlemeye yardımcı bir yaklaşım olarak somatik kopya sayısı değişimleri (SCNA) araştırılmıştır [8]. VEGFA ile amplifiye edilmiş OSA’nın PDTX modelinde sorafenib, araca kıyasla tümör hacminin azalmasına neden olurken VEGFA ile amplifiye edilmiş OSA’nın olmadığı başka bir PDTX modelinde sorafenib tedavisinden fayda sağlanmamıştır. Bu bulgu sorafenibin VEGFA-amplifiye tümörleri olan OSA hastalarında da kullanılabileceğini düşündürmektedir. Sorafenib tarafından apoptoz indüksiyonunun gözlemlenmesi, D17 hücre hattında sorafenib ile tedavi edilen hücrelerde kaspaz-3 aktivitesinin arttığının belgelendiği önceki çalışmayla tutarlılık göstermektedir [48].
Hücre döngüsü deneyinde, üç farklı sorafenib konsantrasyonunu (1.25, 2.5 ve 5 µM) karşılaştırdık. Sorafenib tek başına 1,25 µM ila 5 µM arasında hücre döngüsünün aşamaları üzerinde herhangi bir etkiye sahip değildi, bu da önceki bir çalışmayla tutarlılık göstermektedir [48]. Ayrıca sisplatin, D17 hücre hattında sorafenib ve karboplatin (bir sisplatin türevi) kombinasyonuna ilişkin önceki bulgularla uyumlu olarak sorafenib ile antagonistik etki göstermiştir (Şekil4C) [48]. Sorafenib ve doksorubisin tekli tedaviler olarak kapsamlı bir şekilde çalışılmış olsa da, bu çalışma sorafenib ve doksorubisin kombinasyonunun cOSA hücre büyümesini inhibe etmedeki ileri derecede etkinliğini gösteren ilk çalışmadır.
İnsanlarda, sorafenib osteosarkom için çeşitli klinik çalışmalarda kullanılmıştır. Son yıllarda osteosarkom hastalarında iki klinik çalışma rapor edilmiştir. Faz II randomize olmayan bir çalışmada, nükseden ve rezeke edilemeyen OSA’lı 35 hastada sorafenib tedavisi araştırılmış ve ortalama sağkalımın 7 ay olduğu bildirilmiştir [21]. Randomize olmayan bir başka faz II klinik çalışmada, araştırmacılar 38 yüksek gradeli osteosarkom hastasından oluşan bir grubu tedavi etmek için sorafenib ve everolimus kullanmışlardır. Bu hastalar arasında, hem P-ERK1/2 hem de P-RPS6 aşırı ekspresyonu olan bir hasta alt grubu, progresyonsuz sağkalımın sırasıyla 7 ay ve 2 ay olduğu çift negatif hastalara göre daha iyi yanıt vermiştir [22]. Bu küçük kohortlar, OSA’yı tedavi etmek için sorafenibin tek başına veya diğer ilaçlarla birlikte kullanılmasının sonuçları iyileştirebileceğine işaret etmektedir, ancak her hasta için en uygun ilacı belirlemek üzere daha kişiselleştirilmiş bir yaklaşım belirlemek için daha sağlam çalışmalara ihtiyaç vardır. Bu klinik çalışmaların kısıtlayıcı yönlerinden biri, çalışmaya alınan hastaların tümünün ilerlemiş ve nüks etmiş osteosarkoma sahip olmasıdır.
Bu nedenle, erken evre hastaları tedavi etmek için sorafenibin tek başına veya diğer kemo-terapötik ajanlarla birlikte kullanılması konusunda bilgi eksikliği vardır. Sorafenib için günde iki kez 400 mg maksimum tolere edilebilir doz olarak belirlenmiş ve solid tümörler üzerinde yapılan çeşitli klinik çalışmalarda kullanılmıştır [13,49]. Bu raporlarda tanımlanan en yaygın yan etkiler arasında lenfopeni ve hipofosfatemi (%16), el ve ayak sendromu (%13-39), yorgunluk (%5-39), oral mukozit (%5-20), diyare (%5-55), anemi trombositopeni (%11) ve kızarıklık (%19-61) yer almaktadır [16,22,49-52]. Bu toksik etkiler, hastalarda doz azaltımına, kısa süreli kesintilere veya ilacın kesilmesine yol açmıştır. Bu toksik etkileri azaltmak için geliştirilen stratejilerden biri kombinasyon tedavileri kullanmaktır. Bu nedenle, sorafenib ve doksorubisin gibi diğer terapötik ajanların dahil edilmesi daha etkili olabilir ve tolere edilemeyen yan etkileri önleyebilir. Buna ek olarak, farklı etki mekanizmaları kullanan ilaçlarla kombinasyon kemoterapileri, ilaç direnci olasılığını azaltma ve tedavi etkinliğini korurken ilaç dozajını azaltma potansiyeline de sahiptir. Sorafenib yüklü selenyum nanopartiküllerinin kullanımı gibi ilginç yaklaşımlar yakın zamanda ortaya çıkmıştır [53].
Köpeklerde sorafenib kullanımına ilişkin çok sınırlı rapor bulunmaktadır. Bir raporda, sağlıklı köpeklerde sorafenib üzerine farmakokinetik çalışmalar yayınlanmış ve 4 haftalık bir çalışmada günde 60 mg/kg’ın iyi tolere edildiği gösterilmiştir [35]. Bugüne kadar, farklı kanser türlerine sahip küçük bir grup köpekte toleransla ilgili sadece birkaç çalışma bulunmaktadır [24,54-56]. Müşterinin sahip olduğu 12 köpekte sorafenib toleransına ilişkin ilk rapor, bu köpeklerin ilacı 3 ila 8 haftalık tedavi boyunca 3 mg/kg’lık bir doza kadar tolere ettiğini belgelemiştir. Köpek transizyonel karsinomu vakasında, 4 mg/kg/gün olarak başlanan oral sorafenib dozları 10 mg/kg/gün’e çıkarılmıştır. Köpek üç ay boyunca stabil hastalıkla kalmıştır [54]. Bu dört çalışma arasında sadece bir tanesi sorafenibin etkinliğini ele almıştır. Rezeke edilemeyen HCC’li toplam 13 köpek iki gruba ayrılmıştır: sorafenib (günde iki kez 5 mg/kg) ve metronomik kemoterapi (talidomid, piroksikam ve siklofosfamid). Genel sağkalım, sorafenib alan köpeklerde 361 gün iken metronomik kemoterapi alan köpeklerde 32 gün olmuştur [56]. Yakın zamanda yapılan bir çalışmada, toleransı ve pik plazma konsantrasyonlarını (Cmax) belirlemek için 3 mg/kg sorafenib verilen farklı tümör yükü tiplerine sahip altı köpek yer almıştır. Tüm köpekler dozu tolere etmiş ve herhangi bir yan etki göstermemiştir. Ortalama (Cmaks) 118,2 + 72,1 nM olup, zirveye ulaşma süresi dozlamadan sonra ortalama 4 saattir (aralık 2-12 saat) [55] ve bu da köpeklerde farmakokinetikte oldukça büyük bir değişkenlik olduğunu göstermektedir. Bu çalışmalar, terapötik etkinliği değerlendirmek üzere cOSA’da gelecekteki klinik çalışmaların başlatılması için bir temel oluşturmaktadır. Ek olarak, insan klinik çalışmalarında, yeni ilaç çalışmaları için işe alınan hastalar, birinci basamak tedavilerden sonra yanıt vermeyen veya nüks eden hastalardır [21,22]. Bununla birlikte, köpek hastalarda, hem naif hem de nükseden vakalarda çalışmalar başlatılabilir ve bu tür bilgiler insan klinik çalışmalarını da kolaylaştırabilir.
Dasatinib [57,58] ve toceranib [59-62] gibi diğer TKI’lerin kullanımı, köpek onkolojisi alanında oral tolerabilite ve güvenlik doğrulaması için az sayıda osteosarkom hastasında yeniden denenmiştir. İki klinik çalışma dasatinibin cOSA tedavisi için potansiyel olduğunu göstermiştir. Çalışmalardan biri, bir köpek hastadan türetilen hücreler üzerinde 86 küçük moleküllü kinaz inhibitörünü içeren ilaç taramasıydı ve dasatinib ve sorafenib için IC50 değerlerinin sırasıyla 0,15 ve 9,5 µM olduğunu ve dasatinibin en umut verici terapötik ajan olduğu rapor edildi. Hasta, amputasyon ve beş kür karboplatin ve ardından dasatinib tedavilerinin ardından ilk tanıdan sonra 730 günden fazla hayatta kalmıştır [57]. Başka bir çalışmada, 6,5 ila 25 ay boyunca her gün veya gün aşırı 0,5-0,75 mg/kg dasatinib kullanılarak tedavi edilen ve 456-1003 gün arasında değişen sağkalım süreleri bildirilen dört cOSA hastası rapor edilmiş ve makalenin yayınlandığı tarihte bir köpeğin hala hayatta olduğu ve tedaviden 1003 gün sonra olduğu bildirilmiştir [58]. Bu iki rapor, dasatinibin cOSA için adjuvan tedavi olarak potansiyel klinik faydalarına işaret etmektedir, ancak daha büyük ölçekli çalışmalara ihtiyaç vardır. Veteriner kullanımı için onaylanan ilk TKI olan Toceranib fosfat, Amerika Birleşik Devletleri’nde en çok kullanılan moleküler hedefli ajandır. Toceranib, C-KIT, VEGFR-2, PDGFa/b ve CSF-1 (koloni uyarıcı faktör-1) dahil olmak üzere reseptör tirozin kinazları hedef alır ve mast hücreli tümörleri olan köpekler için birinci basamak tedavi olarak kullanılır [63]. KOSA’da toceranibin kullanıldığı ilk klinik çalışma, toplam 23 KOSA hastasından 11’inde klinik faydaya katkıda bulunduğunu, bu 11 hastanın ya kısmi yanıt ya da stabil hastalık gösterdiğini bildirmiştir [64].
İlerleyen zamanlarda, iki küçük kohorttan oluşan 20 [59] ve 22 [60] akciğer metastazı olan cOSA hastası farklı bir sonuç bildirmiştir, çünkü amputasyon ve adjuvan kemoterapiler ve toceranib ile tedavi edilen köpek hastaların ortalama sağkalım süreleri sırasıyla 90 ve 89 gün iken, metastatik cOSA hastalarının bildirilen çalışmalarında 76 [65] ve 95 [66] gündür ve bu da klinik yararın sınırlı olduğunu göstermektedir. Bu iki çalışma, toceranib kullanımının metastatik osteosarkomlu köpek hastalar üzerinde terapötik bir etkisi olmadığını gösterirken [59,60], diğer çalışmalar metastatik hastalığı olmayan cOSA’da toceranibin diğer terapötik ajanlarla kombinasyonunu araştırmıştır. Toceranib ve karboplatin ile tedavi edilen 10 cOSA hastasını rapor eden bir klinik çalışma, 253 günlük genel sağkalım süreleri ile sonuçlanmıştır [61]; bu, amputasyon ve dört kür karboplatin ile tedavi edilen 48 cOSA hastasını içeren bir çalışmadan elde edilen 321 günlük önceki yayınlanmış ortalama sağkalım süresinden daha düşüktür [67]. 126 cOSA hastası üzerinde yapılan bir başka çalışmada, karboplatin/piroksikam/siklofosfamid tedavisine toceranib eklenmesinin sonuçları karşılaştırılmıştır [62]. Toceranib eklenmiş tedavi grubunda genel sağkalım süresi 318 gün iken, kontrol grubunda genel sağkalım süresi 242 gün olmuştur; ancak istatistiksel analizde toceranibin klinik faydası bulunmamıştır [62]. Bu bulgular şaşırtıcı değildir, çünkü toceranib esas olarak c-KIT’i hedef alır ve c-KIT OSA’da önemli bir etken değildir. Buna ek olarak, toceranibin VEGFR-2, PDGFa/b ve CSF-1 gibi diğer hedefler üzerindeki etkileri köpek OSA’sında tam olarak incelenmemiştir. On cOSA hastası ile yapılan bir klinik çalışma, toceranib tedavisi alan cOSA hastalarında VEGF düzeylerinin zaman içinde değişmediğini bildirmiştir [61]. Buna ek olarak, yakın tarihli bir çalışmada, toceranib tedavilerinin in vivo bir çalışmada kontrol grubuna göre VEGFR-2, PDGFa/b ve c-KIT ekspresyonunu değiştirmediği belgelenmiştir [68]. VEGFR-2 ekspresyonu farklı OSA hücre hatlarında ve tümörlerinde değişiklik göstermiştir [8,69], bu da VEGFR-2’nin aşırı eksprese edildiği hastalarda toceranib kullanımının potansiyelinin yanı sıra bireysel hedefli tedavinin önemini ortaya koymaktadır. Sorafenib ve dasatinib ise OSA ile ilgili olan çoklu reseptör tirozin kinazları inhibe etmektedir. Çalışmamızdan elde edilen veriler, köpek klinik çalışmalarında sorafenibin tek başına ve doksorubisin ile kombinasyon halinde kullanımını da desteklemektedir.
Sorafenib ve doksorubisin kombinasyonu hepatoselüler karsinom (HCC) üzerinde klinik çalışmalarda incelenmiş ve uygulanmıştır [25,70,71]. Daha önce 2010 yılında yapılan bir klinik çalışmada, sorafenib ve doksorubisini birlikte alan ileri evre HCC hastalarının, tek başına doksorubisine kıyasla daha uzun bir sağkalım süresine sahip olduğu bildirilmiştir [25]. Bununla birlikte, daha yeni iki klinik çalışma sorafenib ve doksorubisin kullanımı sorusunu ele almıştır. Bir faz III klinik çalışma, tek başına sorafenib veya sorafenib artı doksorubisin ile tedavi edilen HCC hastaları arasında genel veya progresyonsuz sağkalım açısından fark olmadığını bildirmiştir [70]. Başka bir klinik çalışmada, HCC hastaları sorafenib ile radyolojik progresyon belirtileri gösterdikten sonra doksorubisin eklenmiştir, ancak tarihsel kontrollerle karşılaştırıldığında sonuçlarda bir iyileşme olmamıştır [71]. HCC hastaları arasındaki moleküler heterojenitenin farklı sonuçlara katkıda bulunması muhtemeldir; bu nedenle, gelecekteki klinik çalışmalara tümörlerin moleküler karakterizasyonunun dahil edilmesi, her bir tedaviden fayda görebilecek hastaların belirlenmesine yardımcı olacaktır.
Bu çalışmada, bir multi-kinaz inhibitörü olan sorafenibin hem insan hem de köpek osteosarkom hücrelerine karşı etkili bir ilaç olduğunu gösterdik. OSA hücre hatları üzerindeki IC50’ler 3-9 µM arasında değişmektedir ve bu değer yakın tarihli bir raporda [72] belirtildiği gibi bir insan fibroblast hücre hattı olan MRC-5’in 19,7 µM değerinden oldukça düşüktür. İn vitro anti-proliferasyon ve migrasyon inhibisyonu etkilerine dair kanıtlar sağladık. Köpek Abrams hücre hattında, ERK ve STAT3 yolaklarının aktivasyonu 10 µM’de sorafenib tarafından inhibe edilmiştir. Bununla birlikte, PI3K-AKT yolağında, p-AKT en yüksek dozda bile tedavilerle değişmeden kalmıştır. İlaç kombinasyonlarının potansiyelini araştırdığımızda, sorafenib ve doksorubisin sinerjik bir etki göstermiş ve D17 ve Abrams’ta G2/M fazında hücre arrestiyle sonuçlanmıştır. Bu bulgular, sorafenibin tek başına veya doksorubisin ile kombinasyon halinde, ERK yolağının aktivasyonunu gösteren bazı köpek ve insan OSA’larının tedavisinde yeni terapötik stratejiler için kullanılabileceğini göstermektedir.
4. Materyal ve Metod
4.1. Hücre kültürü
Köpek OSA hücre hattı D17 ve insan OSA hücre hattı (SAOS2, U2OS ve MG63) ATCC’den satın alınmıştır. Abrams köpek OSA hücre hattı Dr. Elizabeth McNeil tarafından sağlanmıştır ve orijinal olarak Dr. Doug Thamm tarafından kurulmuş ve paylaşılmıştır. BZ köpek OSA hücre hattı laboratuvarımız tarafından bir Alman çoban köpeğinden oluşturulmuştur. D17 bir kanişin akciğer metastazından; köpek Abrams hücre hattı metastatik bir nodülden ve köpek Gracie hücre hattı ise birincil tümör örneğinden türetilmiştir. ATCC deposunda belirtildiği gibi, SAOS2 hücre hattı Kafkasyalı bir dişinin primer tümöründen, U2OS Kafkasyalı bir dişinin tibia biyopsi örneğinden ve MG63 Kafkasyalı bir erkekten elde edilmiştir.
Hücre kültürü bakımı için, insan OSA hücre hatları DMEM ortamı ile inkübe edilmiş ve köpek OSA hücre hatları a-MEM ortamı ile muhafaza edilmiştir ve tüm hücreler %10 fetal sığır serumu ile desteklenmiş ve %5 CO2 ile 37 ◦C’de nemlendirilmiş bir inkübatörde inkübe edilmiştir.
4.2. İlaç Taramasında Kullanılan Bileşikler
Sorafenib LC laboratories’den (Woburn, MA, ABD) satın alınmıştır. Sorafenib DMSO içinde çözülürken, sisplatin PBS içinde ve karboplatin su içinde çözülmüştür. Kladribin, dasatinib, erlotinib, gefitinib, masitinib, nilotinib, sorafenib, sunitinib, toceranib ve tozasertib dahil olmak üzere diğer TKI’lerin tümü Sigma-Aldrich’ten satın alınmış ve DMSO içinde çözülmüştür.
4.3. Hücre Canlılığı Deneyi (MTS Deneyi) ve TKI’lerle Küçük Panel İlaç Taraması
Sorafenib ve diğer bileşiklerin OSA hücreleri üzerindeki IC50 değerlerini belirlemek için MTS deneyi (Promega Corp., Madison, MI, ABD) kullanılmıştır. Hücreler 96 kuyulu plakalara 2500-3500/kuyu yoğunluğunda ekilmiştir. 24 saat sonra, hücre kültürü ortamı, belirlenen konsantrasyonlarda her bir bileşik içeren tam ortamla değiştirilmiştir. Hücre canlılığı CellTiter 96 Aqueous Non-Radioactive Cell Proliferation Assay (MTS) kullanılarak analiz edilmiş ve canlı hücreler tarafından üretilen renkli formazan boya miktarı ile belirlenmiştir. Üretilen formazan boyasının absorbansı 490 nm dalga boyunda ölçülmüş ve IC50 değerleri PRISM İstatistik Yazılımı kullanılarak hesaplanmıştır. IC50 hesaplamaları için her bir ilacın her bir konsantrasyonu üç kopya halinde test edilmiştir.
Bu çalışmada, üç OSA hücre hattını (D17, Abrams ve SAOS2) 48 saat boyunca on tirozin kinaz inhibitörünü (cladribine, dasatinib, erlotinib, gefitinib, masitinib, nilotinib, sorafenib, sunitinib, toceranib ve tozasertib) içeren küçük bir bileşik paneli ile tedavi ettik.
1 DMSO içeren araç kontrol tedavisi. Tüm TKI’ler için 100 µM’lik yüksek bir ilaç dozu kullandık.
4.4. Yara İyileştirme Deneyi
Yara iyileştirme deneyi, tek tabakalı hücrelerin göç kapasitesini incelemek için kullanılmıştır. Kısaca, 100.000 hücre/kuyu gece boyunca yerleştirilmiş ve 6 kuyulu plakalarda %70-80 konfluansa ulaşmalarına izin verilmiştir. Ardından, 1 mL pipet ucu kullanılarak plakalar üzerinde kazıntılar yapılmıştır.
Hücreler daha sonra sorafenib içeren veya içermeyen hücre kültürü ortamıyla inkübe edilmiştir (D17: 3 µM, Abrams: 4 µM, SAOS2: 3 µM). Her kazıma yapıldıktan sonra ve sonraki her belirli zaman noktasında fotoğraflanmıştır.
4.5. Kombinasyon İndeksi (CI)
Hücreler aynı anda iki bileşikle sabit bir oranda (sorafenib: doksorubisin = 20:1, 50:1 veya 100:1; sorafenib: sisplatin = 4:1; ve sorafenib: karboplatin = 1:5) 72 saat boyunca inkübe edilmiştir. Her ilaç çiftinin sinerjik etkileri CompuSyn yazılımı (Combosyn, Paramus, NJ, ABD) kullanılarak izobologram ve kombinasyon indeksi (CI) analizi yoluyla belirlenmiştir. Analiz Chou ve Talalay’ın ortalama prensip yöntemlerinden uyarlanmıştır [73]: CI < 1, CI = 1 ve CI > 1 sonuçları sırasıyla sinerjizm, ekleme ve antagonizmayı gösterir.
4.6. Hücre Döngüsü Analizi
Hücreler 24 saat boyunca %1 DMSO (kontrol), sorafenib (1,25, 2,5 veya 5 µM), doksorubisin (25, 50 veya 100 nM) veya kombinasyon ( oran 50:1) ile işlem görmüş, ardından santrifüj ile toplanmış ve gece boyunca 4 ◦C’de %70 etanol ile sabitlenmiştir. Etanol santrifüj yoluyla uzaklaştırılmış ve hücresel DNA, RNaz (1 mg/mL) içeren propidium iyodür (50 µg/mL) ile boyanmıştır. Hücreler en az 4 saat boyunca boyandıktan sonra, tek tek çekirdeklerin PI floresanı FACScan ile kaydedilmiştir. Hücre döngüsü fazı ve apoptozun kantitatif değerlendirmesi daha sonra debris ve agregat hücre popülasyonları için düzeltme yapıldıktan sonra Modfit LtTM yazılımı kullanılarak belirlenmiştir.
4.7. Protein Analysis Using Western Blots
Abrams OSA hücreleri (6 kuyulu plakada 500.000/kuyu) 24 saat boyunca araç (%0,1 DMSO) veya sorafenib ile işleme tabi tutulmuştur. 250 µL CelLytic M lizis tamponu (C2978, Sigma-Aldrich, St. Louis, MO, ABD), 2 µL proteaz inhibitörü (P8340, Sigma-Aldrich) ve 2 µL fosfataz kokteyl inhibitörü B (sc-45045, Santa Cruz, Dallas, TX, ABD) ile üretici protokolüne göre lize edilmiştir. Protein konsantrasyonları QubitTM Protein Test Kiti ile ölçülmüştür. Kuyu başına toplam 60 µg protein Bolt Bis-Tris %4-12 poliakrilamid jellere (Thermo Fisher Scientific Inc.) yüklenmiş ve poliviniliden diflorür membranlara aktarılmıştır. Membranlar oda sıcaklığında 2 saat boyunca %5 sığır serum albümini (BSA) ile inkübe edilmiş, ardından antijeni tespit etmek için gece boyunca 4 ◦C’de aşağıdaki primer antikorlarla inkübe edilmiştir: ERK (1:500), p-ERK (1:250), STAT3 (1:500), p-STAT3 (1:500), β-tubulin (1:4000) (Cell Signaling Technology). 0,05 Tween 20 içeren tris-tamponlu salinde üç yıkamadan sonra membranlar uygun ikincil antikorla (eşek anti-fare (1:15.000) veya keçi anti-tavşan (1:15.000)) oda sıcaklığında 1 saat süreyle inkübe edilmiştir. Membranlar Odyssey Kızılötesi Görüntüleme Sistemi (LI-COR Biosciences, Lincoln, NE, ABD) kullanılarak görüntülenmiş ve Image Studio™ Lite yazılımı (LI-COR, Lincoln, NE, ABD) kullanılarak analiz edilmiştir.
4.8. İstatistiksel Analiz
Elde ettiğimiz sonuçlar en az üç ayrı deneyi temsil etmektedir. İstatistiksel analiz GraphPad Prism (8.0.0, Graph Pad Software Inc., San Diego, CA, ABD) ile gerçekleştirilmiş ve kategoriler arasındaki farklar tek yönlü ANOVA ile analiz edilmiştir; <0.05 p-değerleri istatistiksel olarak anlamlı kabul edilmiştir.
5. Sonuç
Sonuç olarak, çalışmalarımızdan elde edilen bulgular, tirozin kinaz inhibitörü sorafenibin OSA hücrelerinde ERK/MAPK ve STAT3 yolaklarının inhibisyonu yoluyla proliferasyonun engellenmesi ve apoptozun indüklenmesi yoluyla tek başına anti-tümör aktivite sergilediğini göstermektedir. Sorafenib osteosarkomda nispeten yeni bir ilaçtır; bu nedenle, geniş ölçekli klinik veriler ve diğer ilaç kombinasyonları hakkındaki bilgiler sınırlıdır. Buna ek olarak, sorafenibin doksorubisin ile kombinasyonunun klinik olarak ilgili dozlarda sinerjik olduğu ve G2/M fazında hücre döngüsü arrestine neden olduğu bulunmuştur. Mevcut bulgulara dayanarak, köpeklerde kavram kanıtlama çalışmalarında doksorubisin ve sorafenib kombinasyonunu kullanan klinik denemeler gereklidir. Bu çalışmalar, vaka yükünün yüksek olduğu köpeklerde nispeten hızlı bir şekilde gerçekleştirilebilir ve insanlarda klinik çalışmaların başlatılması için yararlı bilgiler sağlayabilir.
Katkıda bulunan yazarlar: Kavramsallaştırma, V.Y.-G.; veri düzenleme, Y.-T.Y.; resmi analiz, Y.-T.Y.; araştırma, Y.-T.Y.; metodoloji, Y.-T.Y.; proje yönetimi, V.Y.-G.; gözetim, V.Y.-G.; doğrulama, Y.-T.Y.; yazım-orijinal taslak, Y.-T.Y.; yazım-inceleme ve düzenleme, V.Y.-G. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir.
Finansman: Bu araştırma Michigan Eyalet Üniversitesi’nin sağladığı yerel fonlarla finanse edilmiştir. Y.Y. Michigan Eyalet Üniversitesi’nden Lisansüstü Bursu almıştır.
Etik Kurul Beyanı: Çalışma, Michigan Eyalet Üniversitesi Hayvan Bakım ve Kullanım Komitesi tarafından, Blaze hücre hattının bu projeyle ilgisi olmayan nedenlerle başkaları tarafından toplanan ve atılacak olan dokulardan oluşturulması dışında mevcut hücre hatlarını kullandığı için muaf tutulmuştur.
Bilgilendirilmiş Onam Beyanı: Geçerli değildir.
Veri Erişim Beyanı: Makalenin bütünü tüm verileri içermektedir.
Teşekkür: Yazarlar, akış sitometrisi ve Modfit LtTM yazılımı veri analizi konusundaki yardımları için Michigan Eyalet Üniversitesi Araştırma Teknolojisi Destek Tesisi’nden Louis King’e teşekkür eder.
Çıkar Çatışması Beyanı: Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Kaynakça
- Osteosarcoma—Childhood and Adolescence: Statistics. Available online:http://www.cancer.net/cancer-types/ osteosarcoma-childhood/statistics(accessed on 25 March 2022).
- Szewczyk, ; Lechowski, R.; Zabielska, K. What do we know about canine osteosarcoma treatment? Review. Vet. Res. Commun.
2015, 39, 61–67. [CrossRef] [PubMed]
- Selmic, E.; Burton, J.H.; Thamm, D.H.; Withrow, S.J.; Lana, S.E. Comparison of carboplatin and doxorubicin-based chemotherapy protocols in 470 dogs after amputation for treatment of appendicular osteosarcoma. J. Vet. Intern. Med. 2014, 28, 554–563. [CrossRef] [PubMed]
- Isakoff, M.S.; Bielack, S.S.; Meltzer, ; Gorlick, R. Osteosarcoma: Current Treatment and a Collaborative Pathway to Success. J. Clin. Oncol. 2015, 33, 3029–3035. [CrossRef]
- Sakthikumar, ; Elvers, I.; Kim, J.; Arendt, M.L.; Thomas, R.; Turner-Maier, J.; Swofford, R.; Johnson, J.; Schumacher, S.E.; Alfoldi, J.; et al. SETD2 Is Recurrently Mutated in Whole-Exome Sequenced Canine Osteosarcoma. Cancer Res. 2018, 78, 3421–3431. [CrossRef] [PubMed]
- Gardner, L.; Sivaprakasam, K.; Briones, N.; Zismann, V.; Perdigones, N.; Drenner, K.; Facista, S.; Richholt, R.; Liang, W.; Aldrich, J.; et al. Canineosteosarcoma genome sequencing identifies recurrent mutations in DMD and the histone methyltransferase gene SETD2. Commun. Biol. 2019, 2, 266. [CrossRef] [PubMed]
- Mills, L.J.; Scott, M.C.; Shah, ; Cunanan, A.R.; Deshpande, A.; Auch, B.; Curtin, B.; Beckman, K.B.; Spector, L.G.; Sarver, A.L.; et al. Comparative analysis of genome-wide DNA methylation identifies patterns that associate with conserved transcriptional programs in osteosarcoma. Bone 2022, 158, 115716. [CrossRef] [PubMed]
- Sayles, C.; Breese, M.R.; Koehne, A.L.; Leung, S.G.; Lee, A.G.; Liu, H.Y.; Spillinger, A.; Shah, A.T.; Tanasa, B.; Straessler, K.; et al. Genome-Informed Targeted Therapy for Osteosarcoma. Cancer Discov. 2019, 9, 46–63. [CrossRef]
- Karlsson, K.; Sigurdsson, S.; Ivansson, E.; Thomas, R.; Elvers, I.; Wright, J.; Howald, C.; Tonomura, N.; Perloski, M.; Swofford, R.; et al. Genome-wide analyses implicate 33 loci in heritable dog osteosarcoma, including regulatory variants near CDKN2A:B. Genome Biol. 2013, 14, R132. [CrossRef]
- Moriarity, S.; Otto, G.M.; Rahrmann, E.P.; Rathe, S.K.; Wolf, N.K.; Weg, M.T.; Manlove, L.A.; LaRue, R.S.; Temiz, N.A.; Molyneux, S.D.; et al. ASleeping Beauty forward genetic screen identifies new genes and pathways driving osteosarcoma development and metastasis. Nat. Genet. 2015, 47, 615–624. [CrossRef]
- Keir, S.T.; Maris, J.M.; Lock, R.; Kolb, E.A.; Gorlick, R.; Carol, H.; Morton, C.L.; Reynolds, P.; Kang, M.H.; Watkins, A.; et al. Initial testing (stage1) of the multi-targeted kinase inhibitor sorafenib by the pediatric preclinical testing program. Pediatric Blood Cancer 2010, 55, 1126–1133. [CrossRef]
- Gollob, A.; Wilhelm, S.; Carter, C.; Kelley, S.L. Role of Raf kinase in cancer: Therapeutic potential of targeting the Raf/MEK/ERK signal transduction pathway. Semin. Oncol. 2006, 33, 392–406. [CrossRef] [PubMed]
- Strumberg, D. Preclinical and clinical development of the oral multikinase inhibitor sorafenib in cancer treatment. Drugs Today
2005, 41, 773–784. [CrossRef] [PubMed]
- Marisi, ; Cucchetti, A.; Ulivi, P.; Canale, M.; Cabibbo, G.; Solaini, L.; Foschi, F.G.; De Matteis, S.; Ercolani, G.; Valgiusti, M.; et al. Ten years of sorafenib in hepatocellular carcinoma: Are there any predictive and/or prognostic markers? World J. Gastroenterol. 2018, 24, 4152–4163. [CrossRef]
- da Motta Girardi, ; Correa, T.S.; Crosara Teixeira, M.; Dos Santos Fernandes, G. Hepatocellular Carcinoma: Review of Targeted and Immune Therapies. J. Gastrointest. Cancer 2018, 49, 227–236. [CrossRef]
- Escudier, ; Eisen, T.; Stadler, W.M.; Szczylik, C.; Oudard, S.; Siebels, M.; Negrier, S.; Chevreau, C.; Solska, E.; Desai, A.A.; et al. Sorafenib in advanced clear-cell renal-cell carcinoma. N. Engl. J. Med. 2007, 356, 125–134. [CrossRef] [PubMed]
- Jäger, ; Ma, J.H.; Mardiak, J.; Ye, D.W.; Korbenfeld, E.; Zemanova, M.; Ahn, H.; Guo, J.; Leonhartsberger, N.; Stauch, K.; et al. Sorafenib treatment of advanced renal cell carcinoma patients in daily practice: The large international PREDICT study. Clin. Genitourin. Cancer 2015, 13, 156–164.e1.[CrossRef]
- Llovet, J.M.; Ricci, S.; Mazzaferro, ; Hilgard, P.; Gane, E.; Blanc, J.-F.; de Oliveira, A.C.; Santoro, A.; Raoul, J.-L.; SHARP Investigators StudyGroup; et al. Sorafenib in advanced hepatocellular carcinoma. N. Engl. J. Med. 2008, 359, 378–390. [CrossRef]
- Kloos, T.; Ringel, M.D.; Knopp, M.V.; Hall, N.C.; King, M.; Stevens, R.; Liang, J.; Wakely, P.E., Jr.; Vasko, V.V.; Saji, M.; et al. Phase II trial of sorafenib in metastatic thyroid cancer. J. Clin. Oncol. 2009, 27, 1675–1684. [CrossRef]
- Raciborska, ; Bilska, K. Sorafenib in patients with progressed and refractory bone tumors. Med. Oncol. 2018, 35, 126. [CrossRef]
- Grignani, G.; Palmerini, E.; Dileo, ; Asaftei, S.D.; D’Ambrosio, L.; Pignochino, Y.; Mercuri, M.; Picci, P.; Fagioli, F.; Casali, P.G.; et al. A phase II trial of sorafenib in relapsed and unresectable high-grade osteosarcoma after failure of standard multimodal therapy: An Italian Sarcoma Group study. Ann. Oncol. 2012, 23, 508–516. [CrossRef]
- Grignani, G.; Palmerini, E.; Ferraresi, ; D’Ambrosio, L.; Bertulli, R.; Asaftei, S.D.; Tamburini, A.; Pignochino, Y.; Sangiolo, D.; Marchesi, E.; et al.Sorafenib and everolimus for patients with unresectable high-grade osteosarcoma progressing after standard treatment: A non-randomised phase 2 clinical trial. Lancet. Oncol. 2015, 16, 98–107. [CrossRef]
- Cathomas, R.; Rothermundt, C.; Bode, B.; Fuchs, B.; von Moos, R.; Schwitter, M. RANK ligand blockade with denosumab in combination with sorafenib in chemorefractory osteosarcoma: A possible step forward? Oncology 2015, 88, 257–260. [CrossRef] [PubMed]
- Foskett, A.; Manley, ; Naramore, R.; Gordon, I.K.; Stewart, B.M.; Khanna, C. Tolerability of oral sorafenib in pet dogs with a diagnosis of cancer. Vet. Med. 2017, 8, 97–102. [CrossRef] [PubMed]
- Abou-Alfa, K.; Johnson, P.; Knox, J.J.; Capanu, M.; Davidenko, I.; Lacava, J.; Leung, T.; Gansukh, B.; Saltz, L.B. Doxorubicin Plus Sorafenib vs Doxorubicin Alone in Patients With Advanced Hepatocellular Carcinoma. JAMA 2010, 304, 2154–2160. [CrossRef]
- Meyers, A.; Schwartz, C.L.; Krailo, M.; Kleinerman, E.S.; Betcher, D.; Bernstein, M.L.; Conrad, E.; Ferguson, W.; Gebhardt, M.; Goorin, A.M.; et al.Osteosarcoma: A randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J. Clin. Oncol. 2005, 23, 2004–2011. [CrossRef]
- Meyers, A.; Schwartz, C.L.; Krailo, M.D. Osteosarcoma: The addition of muramyl tripeptide to chemotherapy improves overall survival—A report from the Children’s Oncology Group. J. Clin. Oncol. 2008, 26, 633–638. [CrossRef]
- McKillop, ; Partridge, E.A.; Hutchison, M.; Rhead, S.A.; Parry, A.C.; Bardsley, J.; Woodman, H.M.; Swaisland, H.C. Pharmacoki- netics of gefitinib, an epidermal growth factor receptor tyrosine kinase inhibitor, in rat and dog. Xenobiotica 2004, 34, 901–915. [CrossRef]
- Goodman, L.; Rock, E.P.; Dagher, R.; Ramchandani, R.P.; Abraham, S.; Gobburu, J.V.; Booth, B.P.; Verbois, S.L.; Morse, D.E.; Liang, C.Y.; et al. Approval summary: Sunitinib for the treatment of imatinib refractory or intolerant gastrointestinal stromal tumors and advanced renal cell carcinoma. Clin. Cancer Res. 2007, 13, 1367–1373. [CrossRef]
- Yin, X.; Wei, Z.; Xu, J.J.; Sun, Z.Q. In vivo pharmacokinetic and tissue distribution investigation of sustained-release cisplatin implants in the normal esophageal submucosa of 12 beagle dogs. Cancer Chemother. Pharmacol. 2015, 76, 525–536. [CrossRef]
- Chen, C.; Wang, ; Zhou, H.; Huang, J.; Liu, P.; Song, T.; Sun, M. Pharmacokinetic comparison between systemic and local chemotherapy by carboplatin in dogs. Reprod. Sci. 2009, 16, 1097–1102. [CrossRef]
- Spilker, M.E.; Chen, X.; Visswanathan, R.; Vage, ; Yamazaki, S.; Li, G.; Lucas, J.; Bradshaw-Pierce, E.L.; Vicini, P. Found in Translation:Maximizing the Clinical Relevance of Nonclinical Oncology Studies. Clin. Cancer. Res. 2017, 23, 1080–1090. [CrossRef] [PubMed]
- Liston, R.; Davis, M. Clinically Relevant Concentrations of Anticancer Drugs: A Guide for Nonclinical Studies. Clin. Cancer Res.
2017, 23, 3489–3498. [CrossRef] [PubMed]
- Gustafson, D.L.; Thamm, D.H. Pharmacokinetic modeling of doxorubicin pharmacokinetics in dogs deficient in ABCB1 drug J. Vet. Intern. Med. 2010, 24, 579. [CrossRef]
- Scientific Discussion for the Approval of Sorafenib. 2006. Available online:https://www.ema.europa.eu/en/documents/ scientific-discussion/nexavar-epar-scientific-discussion_en.pdf(accessed on 2 May 2020).
- Blanchet, B.; Billemont, B.; Cramard, J.; Benichou, A.S.; Chhun, S.; Harcouet, L.; Ropert, S.; Dauphin, A.; Goldwasser, ; Tod, M. Validation of an HPLC-UV method for sorafenib determination in human plasma and application to cancer patients in routine clinical practice. J. Pharm. Biomed. Anal. 2009, 49, 1109–1114. [CrossRef] [PubMed]
- Regad, Targeting RTK Signaling Pathways in Cancer. Cancers 2015, 7, 1758–1784. [CrossRef]
- Eckstein, ; Röper, L.; Haas, B.; Potthast, H.; Hermes, U.; Unkrig, C.; Naumann-Winter, F.; Enzmann, H. Clinical pharmacology of tyrosine kinaseinhibitors becoming generic drugs- the regulatory perspective. J. Exp. Clin. Cancer Res. 2015, 34, 134. [CrossRef]
- Mei, J.; Zhu, X.; Wang, ; Wang, Z. VEGFR, RET, and RAF/MEK/ERK pathway take part in the inhibition of osteosarcoma MG63 cells with sorafenib treatment. Cell Biochem. Biophys. 2014, 69, 151–156. [CrossRef]
- Walter, ; Wolfesberger, B.; Miller, I.; Mair, G.; Burger, S.; Galle, B.; Steinborn, R. Human osteosarcoma cells respond to sorafenib chemotherapy bydownregulation of the tumor progression factors S100A4, CXCR4 and the oncogene FOS. Oncol. Rep. 2014, 31, 1147–1156. [CrossRef]
- Yu, ; Luk, F.; Yang, J.L.; Walsh, W.R. Ras/Raf/MEK/ERK pathway is associated with lung metastasis of osteosarcoma in an orthotopicmouse model. Anticancer Res. 2011, 31, 1147–1152.
- Noh, K.; Kim, K.-O.; Patel, N.R.; Staples, J.R.; Minematsu, H.; Nair, ; Lee, F.Y. Targeting inflammatory kinase as an adjuvant treatment for osteosarcomas. J. Bone Joint. Surg. Am. 2011, 93, 723–732. [CrossRef]
- Sasaki, ; Hitora, T.; Nakamura, O.; Kono, R.; Yamamoto, T. The role of MAPK pathway in bone and soft tissue tumors. Anticancer Res. 2011, 31, 549–553. [PubMed]
- Pignochino, ; Grignani, G.; Cavalloni, G.; Motta, M.; Tapparo, M.; Bruno, S.; Bottos, A.; Gammaitoni, L.; Migliardi, G.; Camussi, G.; et al. Sorafenibblocks tumour growth, angiogenesis and metastatic potential in preclinical models of osteosarcoma through a mechanism potentially involving the inhibition of ERK1/2, MCL-1 and ezrin pathways. Mol. Cancer 2009, 10, 118. [CrossRef] [PubMed]
- Tu, ; Du, L.; Fan, Q.M.; Tang, Z.; Tang, T.T. STAT3 activation by IL-6 from mesenchymal stem cells promotes the proliferation and metastasis of osteosarcoma. Cancer Lett. 2012, 325, 80–88. [CrossRef] [PubMed]
- Fossey, L.; Liao, A.T.; McCleese, J.K.; Bear, M.D.; Lin, J.; Li, P.K.; Kisseberth, W.C.; London, C.A. Characterization of STAT3 activation and expression in canine and human osteosarcoma. BMC Cancer 2009, 9, 81. [CrossRef] [PubMed]
- Wang, T.; Lin, C.S.; Shiau, C.W.; Chu, P.Y.; Hsiao, C.C.; Chiang, Y.L.; Tai, W.T.; Chen, K.F. SC-1, a sorafenib derivative, shows anti-tumor effects in osteogenic sarcoma cells. J. Orthop. Res. 2013, 31, 335–342. [CrossRef]
- Wolfesberger, ; Tonar, Z.; Gerner, W.; Skalicky, M.; Heiduschka, G.; Egerbacher, M.; Thalhammer, J.G.; Walter, I. The tyrosine kinase inhibitorsorafenib decreases cell number and induces apoptosis in a canine osteosarcoma cell line. Res. Vet. Sci. 2010, 88, 94–100. [CrossRef]
- Awada, ; Hendlisz, A.; Gil, T.; Bartholomeus, S.; Mano, M.; de Valeriola, D.; Strumberg, D.; Brendel, E.; Haase, C.G.; Schwartz, B.; et al. Phase Isafety and pharmacokinetics of BAY 43-9006 administered for 21 days on/7 days off in patients with advanced, refractory solidtumours. Br. J. Cancer 2005, 92, 1855–1861. [CrossRef]
- Minami, H.; Kawada, K.; Ebi, H.; Kitagawa, K.; Kim, I.; Araki, K.; Mukai, H.; Tahara, M.; Nakajima, H.; Nakajima, K. Phase I and pharmacokinetic study of sorafenib, an oral multikinase inhibitor, in Japanese patients with advanced refractory solid tumors. Cancer Sci. 2008, 99, 1492–1498. [CrossRef]
- Strumberg, ; Richly, H.; Hilger, R.A.; Schleucher, N.; Korfee, S.; Tewes, M.; Faghih, M.; Brendel, E.; Voliotis, D.; Haase, C.G.; et al. Phase I clinical andpharmacokinetic study of the Novel Raf kinase and vascular endothelial growth factor receptor inhibitor BAY 43-9006 in patients with advanced refractory solid tumors. J. Clin. Oncol. 2005, 23, 965–972. [CrossRef]
- Strumberg, ; Clark, J.W.; Awada, A.; Moore, M.J.; Richly, H.; Hendlisz, A.; Hirte, H.W.; Eder, J.P.; Lenz, H.J.; Schwartz, B. Safety, pharmacokinetics, and preliminary antitumor activity of sorafenib: A review of four phase I trials in patients with advanced refractory solid tumors. Oncologist 2007, 12, 426–437. [CrossRef]
- Varlamova, E.G.; Goltyaev, V.; Simakin, A.V.; Gudkov, S.V.; Turovsky, E.A. Comparative Analysis of the Cytotoxic Effect of a Complex of Selenium Nanoparticles Doped with Sorafenib, “Naked” Selenium Nanoparticles, and Sorafenib on Human Hepatocyte Carcinoma HepG2 Cells. Int. J. Mol. Sci. 2022, 23, 6641. [CrossRef] [PubMed]
- Kim, H.; Ahn, D.H.; Moon, J.S.; Han, H.J.; Bae, K.; Yoon, K.A. Longitudinal assessment of B-RAF V595E levels in the peripheral cell-free tumor DNA of a 10-year-old spayed female Korean Jindo dog with unresectable metastatic urethral transitional cell carcinoma for monitoring the treatmentresponse to a RAF inhibitor (sorafenib). Vet. Q. 2021, 41, 153–162. [CrossRef] [PubMed]
- Cawley, R.; Stewart, S.D.; Mochel, J.P.; Veluvolu, S.; Khanna, C.; Fenger, J.M. Pharmacokinetic Exposures Associated With Oral Administration of Sorafenib in Dogs With Spontaneous Tumors. Front. Vet. Sci. 2022, 9, 888483. [CrossRef] [PubMed]
- Marconato, L.; Sabattini, S.; Marisi, G.; Rossi, ; Leone, V.F.; Casadei-Gardini, A. Sorafenib for the Treatment of Unresectable Hepatocellular Carcinoma: Preliminary Toxicity and Activity Data in Dogs. Cancers 2020, 12, 1272. [CrossRef] [PubMed]
- Davis, E.; Hofmann, N.E.; Li, G.; Huang, E.T.; Loriaux, M.M.; Bracha, S.; Helfand, S.C.; Mata, J.E.; Marley, K.; Mansoor, A.; et al. A case study of personalized therapy for osteosarcoma. Pediatr. Blood Cancer 2013, 60, 1313–1319. [CrossRef]
- Marley, ; Gullaba, J.; Seguin, B.; Gelberg, H.B.; Helfand, S.C. Dasatinib Modulates Invasive and Migratory Properties of Canine Osteosarcoma and has Therapeutic Potential in Affected Dogs. Transl. Oncol. 2015, 8, 231–238. [CrossRef]
- Laver, ; London, C.A.; Vail, D.M.; Biller, B.J.; Coy, J.; Thamm, D.H. Prospective evaluation of toceranib phosphate in metastatic canine osteosarcoma. Vet. Comp. Oncol. 2018, 16, E23–E29. [CrossRef]
- Kim, C.; Matsuyama, A.; Mutsaers, A.J.; Woods, P. Retrospective evaluation of toceranib (Palladia) treatment for canine metastatic appendicular osteosarcoma. Can. Vet. J. 2017, 58, 1059–1064.
- Gieger, L.; Nettifee-Osborne, J.; Hallman, B.; Johannes, C.; Clarke, D.; Nolan, M.W.; Williams, L.E. The impact of carboplatin and toceranib phosphateon serum vascular endothelial growth factor (VEGF) and metalloproteinase-9 (MMP-9) levels and survival in canine osteosarcoma. Can. J. Vet. Res. 2017, 81, 199–205.
- London, A.; Gardner, H.L.; Mathie, T.; Stingle, N.; Portela, R.; Pennell, M.L.; Clifford, C.A.; Rosenberg, M.P.; Vail, D.M.; Williams, L.E.; et al. Impact of Toceranib/Piroxicam/Cyclophosphamide Maintenance Therapy on Outcome of Dogs with Appendicular Osteosarcoma following Amputation andCarboplatin Chemotherapy: A Multi-Institutional Study. PLoS ONE 2015, 10, e0124889. [CrossRef]
- London, C.A.; Malpas, B.; Wood-Follis, S.L.; Boucher, J.F.; Rusk, A.W.; Rosenberg, M.P.; Henry, C.J.; Mitchener, K.L.; Klein, M.K.; Hintermeister, J.G.; et al. Multi-center, placebo-controlled, double-blind, randomized study of oral toceranib phosphate (SU11654), a receptor tyrosine kinase inhibitor, for the treatment of dogs with recurrent (either local or distant) mast cell tumor following surgical excision. Clin. Cancer Res. 2009, 15, 3856–3865. [CrossRef] [PubMed]
- London, C.; Mathie, ; Stingle, N.; Clifford, C.; Haney, S.; Klein, M.K.; Beaver, L.; Vickery, K.; Vail, D.M.; Hershey, B.; et al. Preliminary evidence for biologic activity of toceranib phosphate (Palladia((R))) in solid tumours. Vet. Comp. Oncol. 2012, 10, 194–205. [CrossRef] [PubMed]
- Boston, E.; Ehrhart, N.P.; Dernell, W.S.; Lafferty, M.; Withrow, S.J. Evaluation of survival time in dogs with stage III osteosarcoma that undergo treatment: 90 cases (1985–2004). J. Am. Vet. Med. Assoc. 2006, 228, 1905–1908. [CrossRef] [PubMed]
- Batschinski, K.; Dervisis, N.G.; Kitchell, B.E. Evaluation of ifosfamide salvage therapy for metastatic canine osteosarcoma. Comp. Oncol. 2014, 12, 249–257. [CrossRef]
- Bergman, J.; MacEwen, E.G.; Kurzman, I.D.; Henry, C.J.; Hammer, A.S.; Knapp, D.W.; Hale, A.; Kruth, S.A.; Klein, M.K.; Klausner, J.; et al. Amputation and carboplatin for treatment of dogs with osteosarcoma: 48 cases (1991 to 1993). J. Vet. Intern. Med. 1996, 10, 76–81. [CrossRef] [PubMed]
- Sanchez-Cespedes, R.; Accornero, ; Miretti, S.; Martignani, E.; Gattino, F.; Maniscalco, L.; Gola, C.; Iussich, S.; Martano, M.; Morello, E.; et al. In vitro and in vivo effects of toceranib phosphate on canine osteosarcoma cell lines and xenograft orthotopic models. Vet. Comp. Oncol. 2020, 18, 117–127. [CrossRef] [PubMed]
- Liu, K.; Ren, ; Huang, Y.; Sun, K.; Bao, X.; Wang, S.; Zheng, B.; Guo, W. Apatinib promotes autophagy and apoptosis throughVEGFR2/STAT3/BCL-2 signaling in osteosarcoma. Cell Death Dis. 2017, 8, e3015. [CrossRef]
- Abou-Alfa, G.K.; Shi, Q.; Knox, J.J.; Kaubisch, A.; Niedzwiecki, D.; Posey, ; Tan, B.R., Jr.; Kavan, P.; Goel, R.; Lammers, P.E.; et al. Assessment of Treatment With Sorafenib Plus Doxorubicin vs Sorafenib Alone in Patients With Advanced Hepatocellular Carcinoma: Phase 3 CALGB 80802 Randomized Clinical Trial. JAMA Oncol. 2019, 5, 1582–1588. [CrossRef]
- El Dika, I.; Capanu, M.; Chou, F.; Harding, J.J.; Ly, M.; Hrabovsky, A.D.; Do, R.K.G.; Shia, J.; Millang, B.; Ma, J.; et al. Phase II trial of sorafenib and doxorubicin in patients with advanced hepatocellular carcinoma after disease progression on sorafenib. Cancer Med. 2020, 9, 7453–7459. [CrossRef]
- Palakhachane, S.; Ketkaew, ; Chuaypen, N.; Sirirak, J.; Boonsombat, J.; Ruchirawat, S.; Tangkijvanich, P.; Suksamrarn, A.; Limpachayaporn, P.Synthesis of sorafenib analogues incorporating a 1,2,3-triazole ring and cytotoxicity towards hepatocellular carcinoma cell lines. Bioorganic Chem. 2021, 112, 104831. [CrossRef]
- Ashton, J.C. Drug combination studies and their synergy quantification using the Chou-Talalay method. Cancer Res. 2010, 70, 440–446. [CrossRef][PubMed]