David M. Vail, Veteriner Hekimi, ACVIM Diplomatı (Onkoloji)
Douglas H. Thamm, Veteriner Hekimi, ACVIM Diplomatı (Onkoloji)
Hayvan Kanser Tedavi Merkezi, Veteriner Hekimliği ve Biyomedikal Bilimler Fakültesi, Colorado Eyalet Üniversitesi, Fort Collins, Colorado 80523.
Giriş
Veteriner klinik onkolojide mevcut olan tüm tedavi yöntemleri arasında cerrahi, en sık uygulanan ve iyileşme olasılığı en yüksek olan yöntem olmaya devam etmektedir. Lokal nüks ve/veya uzak metastaz, cerrahiden sonra gelişen tümörle ilişkili morbidite ve mortalitenin çoğuna neden olmaktadır. Sistemik hematopoetik hastalıklarda (örn. lenfoma, miyelom) yardımcı (yani cerrahiden önce veya sonra) ve birincil kemoterapinin faydası ve genel amaçlı kullanımı son on yılda büyük ölçüde artmıştır. Maligniteleri olan köpek ve kediler için yeni sitotoksik ajanların ve uygulama yöntemlerinin etkinliğini ele alan çeşitli kurumlarda iyi tasarlanmış birçok klinik çalışma tamamlanmış veya halen devam etmektedir. Veteriner hekimlerin kemoterapötik tedavi yöntemleri ile ilgili genişleyen bilgi tabanından haberdar olmaları, ister bu bilgileri kendi uygulamalarında kullanmayı planlasınlar isterse de hastalarını onkoloji merkezlerine yönlendirmek için kullansınlar, büyük önem taşımaktadır. Buna ek olarak, yeni tedavileri değerlendirmeyi amaçlayan veteriner klinik araştırmalarının giderek artan sayısı ve hayvan sahiplerinin internet üzerinden araştırma mekanizmaları konusunda daha bilgili hale gelmesiyle birlikte, kanser vakalarının güvenilir ve doğru klinik araştırma merkezlerine nereden ve nasıl yönlendirileceği konusunda bilgi sahibi olmak da aynı derecede önemlidir.
Bu makalenin amacı, yeni veya farklı kemoterapötik ajanları, kemoterapötik ilaçların yenilikçi uygulamalarını ve daha yaygın kullanılan bazı ilaçlar için başvurulabilecek yeni kullanım yöntemlerini tartışmaktır. Tartışma daha geleneksel “sitotoksik” kemoterapötik ajanlarla sınırlıdır ve immün modülatörler, antianjiyojenik ilaçlar veya moleküler tabanlı, hedefe yönelik “statik” ilaçlar hakkında ayrıntılı bilgi verilmemektedir.
Bu konunun geniş kapsamı nedeniyle, bu çalışma derinlemesine bir çalışma olarak tasarlanmamıştır, ancak yazarlar mümkün olduğunca kapsamlı bilgi kaynakları sağlamaya çalışmıştır.
Yeni İlaçların Değerlendirilmesi
Yeni bir ilacın veya bileşiğin genel klinik kullanıma nasıl sunulduğu hakkında bilgi sahibi olmak oldukça önemlidir. Hayvanlarda yeni sitotoksik ilaçlar değerlendirilirken, ilk klinik adım normalde tolere edilebilir maksimum dozu (MTD) belirlemektir. MTD, hayvanların çoğunda rutin olarak kullanılabilen ve “kabul edilebilir” düzeyde toksisite ile sonuçlanan dozdur. Çoğu veteriner onkoloğun görüşüne göre, kabul edilebilir toksisite seviyesi, tedavi edilen popülasyonun <%5’inde hastaneye yatış gerektiren ve herhangi bir toksisite ile sonuçlanan doz şeklinde tanımlanmaktadır.
Bu sorular genellikle faz III çalışmalar bağlamında yanıtlanır. Faz III çalışmalar genellikle standart tedaviye karşı yeni kemoterapötik ilacı değerlendiren randomize, prospektif çalışmalardır veya standart tedavi artı yeni ilacın tek başına standart tedaviye karşı değerlendirildiği çalışmalardır. Bu makaledeki bilgilerin çoğu faz I ve II çalışmalarından elde edilen verileri içermektedir. Faz III denemeler şu anda veteriner hekimlikte daha az yaygındır. Bununla birlikte, hayvanlarda bu tür birkaç deneme gerçekleştirilmiş veya devam etmektedir ve ilgili yerlerde tartışılmaktadır.
Yeni İlaçlar
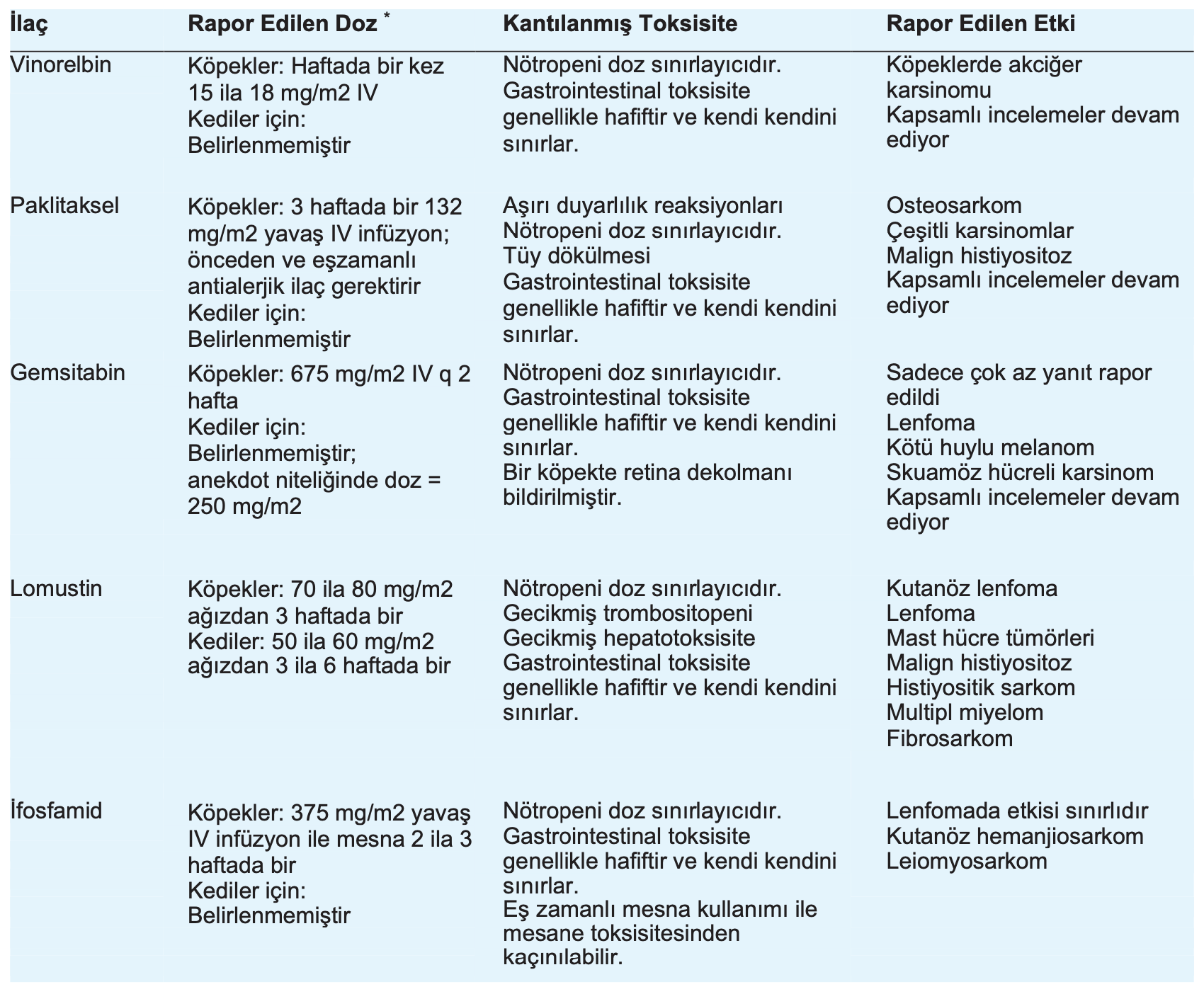
“Yeni” kemoterapötik ilaçların birçoğu aslında birkaç yıldır piyasada bulunmaktadır; ancak kullanımları anekdot niteliğindedir ve güvenlik ve etkinlikle ilgili bilgiler ancak son zamanlarda hakemli yayınlarda bilimsel incelemenin zorluklarına tabi tutulmuştur [bkz. Tablo].
Vinorelbin
Vinorelbina (Navelbin; jenerikleri de mevcuttur) vinka alkaloid ilaç sınıfının yarı sentetik bir türevidir. Bu nedenle, etki mekanizması grubun diğer üyelerine benzer; mikrotübüller, özellikle de mitotik iğ aparatını oluşturanlar bozulur ve sonuçta bölünen hücrelerde metafaz durmasına neden olur.1 Köpekler üzerinde yapılan yeni bir faz I çalışmasında, vinorelbin iyi tolere edilen bir toksisite profiline ve belirli tümör tiplerine karşı kayda değer bir etkinliğe sahipti.1 Vinorelbin bu çalışmada haftada bir kez, intravenöz (IV) olarak, 10 ila 20 mg/m2 arasında değişen dozlarda verildi.1 MTD haftada bir kez 15 ila 18 mg/m2 arasındaydı. Köpeklerde tedaviye 15 mg/m2 ile başlanması ve toksisitenin kabul edilebilir olması halinde dozajın 18 mg/m2’ye çıkarılması değerlendirilebilir. Nötropeni doz sınırlayıcı toksisite olmuştur. Anoreksi, kusma, diyare ve bir vakada deride döküntü de gözlenmiştir, ancak bu yan etkiler genellikle kendi kendini sınırlamış ve hastaneye yatış gerektirmemiştir.1 Vinorelbin için henüz bir faz II çalışması rapor edilmemiş olsa da, faz I çalışması primer akciğer tümörü olan köpeklerde belirgin düzeyde etkinlik göstermiştir. Artık bir MTD belirlendiğine göre, etkinlik verileri gelecekte mutlaka
MTD genellikle faz I çalışması ile belirlenir. Faz I çalışması, tanımı gereği, doz belirleyici nitelikte toksisite çalışmasıdır. Normalde kemirgen veya insanlar için dozaj önerilerinden yola çıkarak güvenli başlangıç dozunun tahmin edilmesini ve bu dozun tümör taşıyan evcil hayvanların küçük bir alt kümesinde (genellikle üç) kullanılmasını ve toksisite açısından önemli ölçüde gözlemlenmesini içermektedir. Faz I denemelerine katılan evcil hayvanlar her tür kansere sahip ve tipik olarak geleneksel tedaviye yanıt vermemiş hayvanlardır. Buna ek olarak, kanserler geleneksel tedavinin mevcut olmadığı türde olabilir. Hayvanların ilk alt kümesinde önemli bir toksisite gözlenmezse, başka bir alt küme daha yüksek dozda tedavi edilir ve toksisite açısından dikkatle izlenir. Bu doz artırımı, belirli bir dozaj grubunda yer alan hayvanların önceden belirlenmiş, ancak kabul edilemez bir yüzdesinde ciddi toksisite gelişene kadar devam eder. MTD, bir önceki tedavi grubunda güvenli bir şekilde kullanılan dozajda belirlenir.
Faz I çalışmasında sadece nispeten güvenli ve genel bir doz belirlenir. Araştırılan ilacın antikanser etkisi faz I çalışmasında belirlenmez; ancak genellikle ilacın etkinliği hakkında bazı bilgiler elde edilir. Faz I çalışmalarının en büyük sınırlaması, genellikle sadece kısa vadeli toksisitelerin (örneğin kemik iliği, gastrointestinal) değerlendirilmesidir ve uzun vadeli veya daha az yaygın toksisiteler sadece sonraki, daha büyük etkinlik çalışmalarında tespit edilebilir.
MTD belirlendikten sonra, bir sonraki olağan adım faz II denemesi ile ilacın etkinliğini belirlemektir. Faz II denemesi, MTD’de belirli bir tümör tipine sahip bir dizi hayvanı tedavi eder ve antitümör yanıtları belirler. Yanıtlar, ölçülebilir tümörün küçülmesi, hastalığın stabilizasyonu, yaşam kalitesinde iyileşme veya remisyon veya sağkalımın uzaması gibi bir veya daha fazla parametre ile karakterize edilebilir. Faz II çalışmasının amaçları, hangi tümör tiplerinin yeni ilaca yanıt verdiğini belirlemek ve toksisite profili hakkında daha kapsamlı bilgi edinmektir.
Tedaviye yanıt veren tümör tipleri belirlendikten sonra yanıtlanması gereken sonraki sorular, ilacın o tümör tipi için mevcut olan ” standart tedaviden” daha etkili, daha az toksik veya daha ucuz olup olmadığı ve/veya bu yeni ilacın yaygın olarak uygulanmasının daha da etkili bir tedaviyle sonuçlanıp sonuçlanmayacağıdır.
oluşturulacaktır. Şu anda, kedilerde yayınlanmış veri bulunmamaktadır.
Paklitaksel
vinorelbin için
Aslen Pasifik Porsuk ağacının kabuğundan elde edilen paklitakselb (Taxol; jenerikleri de mevcuttur) bir mitotik iğ zehiridir.2 Çeşitli epitelyal kanser türlerine sahip insanlarda önemli etkinliği vardır ve yakın zamanda hayvanlarda da değerlendirilmiştir.2 Paklitaksel kullanımının en zor yönü, ilacı çözünür hale getirmek için kullanılan taşıyıcı kremofor EL ile ilişkilidir. Kremofor EL çoğu türde yüksek oranda alerjeniktir ve köpekler ve kediler de bu durumdan etkilenmektedir. Köpeklerde paklitaksel kullanımı, ilaç verilmeden önce ve ilaç verilmesi sırasında antihistaminik ve kortikosteroidlerle tedavi gerektirir.
Daha önceden yapılan bir çalışmanın özetine göre 165 mg/m2’lik başlangıç dozu kabul edilemez toksisiteye neden olmuştur.2 Köpeklerde önerilen güncel doz 3 haftada bir, yavaş IV infüzyonla 132 mg/m2’dir.2
Tedavi protokolü, tedaviden önceki akşam verilen oral prednizon (1 mg/kg) ile başlar. Tedavi günü, paklitaksel infüzyonundan 30 ila 60 dakika önce, köpeklere difenhidramin (4 mg/kg intramüsküler [IM]) ve deksametazon sodyum fosfat (2 mg/kg IV) ile premedikasyon uygulanır. Paklitaksel (6 mg/mL) hacminin 10 katı %5 dekstroz/su içinde seyreltilir ve 10 dakika boyunca saatte 30 mL IV infüzyon başlatılır. Eğer 10 dakika sonra önemli bir alerjik reaksiyon görülmezse, infüzyon hızı iki katına çıkarılarak 10 dakika süreyle saatte 60 mL’ye çıkarılır. Bu hızda herhangi bir reaksiyon kaydedilmezse, infüzyon hızı infüzyonun geri kalanı için IV olarak saatte 90 mL’ye çıkarılır. Önemli alerjik reaksiyonlar (örn. kurdeşen, kaşıntı, ajitasyon, baş titremesi, kusma) görülürse, infüzyon kesilir.
Köpek tekrar difenhidramin ve deksametazon ile ön tedaviye tabi tutulur ve 15 dakika sonra infüzyon daha düşük bir hızda yeniden başlatılır.
İnfüzyonla ilgili yan etkiler dışında, paklitaksel ile köpeklerde doz sınırlayıcı toksisite nötropeniydi. Tüy dökülmesi, kusma ve ishal (genellikle kendi kendini sınırlandırabilen) gibi yan etkiler de gözlenmiştir. Metastatik osteosarkom, meme adenokarsinomu ve malign histiyositozu olan köpeklerde antitümör yanıtlar alınmıştır.2 Metastatik pilomatriks karsinomu (n=1), anal kese adenokarsinomu (n=1) ve akciğer karsinomu (n=1) olan köpeklerde de hastalığın stabilizasyonu gözlenmiştir.2 Daha geniş kapsamlı çalışma popülasyonlarının daha detaylı değerlendirmeleri halen devam etmektedir. Paklitakselin uygulanması zor olsa da, köpeklerin alt grupları muhtemelen kullanımından fayda görecektir.
Yazarların deneyimlerine göre, paklitaksel kaynaklı alerjik reaksiyonlar kedilerde genellikle ilacın terapötik dozajda verilmesine izin vermeyecek kadar şiddetlidir.
Benzer bir ilaç olan Dosetakselc (Taxotere) şu anda küçük hayvanlarda incelenmektedir. Bu ürünle şiddetli anafilaktoid reaksiyonların görülme sıklığı paklitakselden daha az olabilir; ancak jenerik formları henüz mevcut değildir ve maliyeti bazı hasta sahipleri için engelleyici olabilir.
Gemsitabin
Gemsitabind (Gemzar), hayvanlarda hem doğrudan sitotoksik ajan hem de radyasyon hassaslaştırıcı olarak kullanılan bir antimetabolit nükleozit (pirimidin) analoğudur.3-5 Diğer pirimidin analoglarında olduğu gibi, gemsitabinin etki yöntemi deoksiribonükleik asit (DNA) içine dahil olmasına ve DNA replikasyonunun nihai inhibisyonuna bağlanmaktadır.3 Çeşitli anekdotal dozaj rejimleri önerilmiş olsa da, iki haftada bir (2 haftada bir) 675 mg/m2 IV uygulamasının köpeklerde iyi tolere edildiği görülmektedir.4 İlaç, uygulamadan hemen önce 10 mL/kg normal salin (%0,9 sodyum klorür [NaCl]) içinde seyreltilir. Kedi için güvenli doz henüz yayınlanmamıştır. Anekdot olarak belirtmek gerekirse, 250 mg/m2 IV kullanılmıştır.3
Bu ilaç küçük hayvanlarda kapsamlı olarak çalışılmamış olsa da, tümör taşıyan köpeklerde yalnızca belirli ölçüde etkinlik rapor edilmiştir ve çoğu vakada sonuçlar hayal kırıklığı yaratmıştır. Lenfoma, oral malign melanom ve perianal skuamöz hücreli karsinomu (SCC) olan az sayıda köpekte olumlu yanıtlar gözlenmiştir.4 Diğer bazı tümör tiplerinde de kısa süreler için (örn. 2 ila 5 ay) hastalığın stabilizasyonu gözlenmiştir. Oral SCC’li az sayıda kedide hastalığın kısa süreli stabilizasyonu gözlenmiştir.3
Önerilen dozajda, köpeklerde hematolojik ve gastrointestinal toksisite hafiftir ve çoğu vakada kendi kendini sınırlar. Gemsitabin alan bir köpekte bir retina dekolmanı vakası da bildirilmiştir. Köpekte 50 mg/m2 IV ve kedide 25 mg/m2 IV olmak üzere haftada iki kez uygulanan radyosensitizasyon dozları bir çalışmada kabul edilemez hematolojik ve lokal doku toksisitesine neden olmuştur.5
Lomustin
Eski bir ilaç olmasına rağmen, son zamanlarda lomustin (CCNU) kullanımına olan ilgi yeniden artmıştır. Lomustin, kemoterapötiklerin alkilleyici ajan sınıfına aittir.3,6-10 Şu anda köpeklerde yaygın olarak kullanılmaktadır ve kedilerde de değerlendirilmektedir. Köpeklerde en yaygın kullanılan doz 3 haftada bir 70 ila 80 mg/m2 ağızdan (PO) verilmesidir. 10 ve 40 mg’lık kapsüller halinde mevcuttur ve eczaneler genellikle diğer dozaj türlerini formüle etmektedir. Kedilerde, 3 ila 6 hafta arasında değişen aralıklarla 50 ila 60 mg/m2 PO dozları kullanılmıştır.8,9 Yazarların deneyimlerine göre, çoğu kedi 3 haftalık doz aralıklarını tolere etmektedir; ancak, hematolojik parametreler bazı kedilerin ilacı 4 ila 6 haftalık doz aralıklarında almasını gerektirebilir.
Hem köpeklerde hem de kedilerde lomustin için akut doz sınırlayıcı toksisite öncelikle tedaviden 7 gün sonra en belirgin olan nötropenidir.
Her lomustin dozundan 1 hafta sonra ve sonraki uygulamalardan hemen önce tam kan sayımlarının izlenmesi önerilir. Akut gastrointestinal toksisite oluşabilir; ancak genellikle hafif ve kendi kendini sınırlayıcıdır. Potansiyel olarak daha ciddi, gecikmiş toksisiteler daha yüksek kümülatif lomustin dozları ile ilişkili olabilir. Bu gecikmiş yan etkiler hepatotoksisite ve trombositopeniyi içermektedir. Bu tür yan etkiler genellikle lomustin kemoterapisinin başlamasından birkaç hafta ila ay sonra gelişir ve tedavi öncesi serum alanin transaminaz (ALT) ve trombosit sayısının ölçülmesini ve periyodik olarak (örn. 2 ayda bir) değerlerinin yeniden gözden geçirilmesini gerektirir. ALT’de sürekli yükselme veya trombosit sayısında düşme eğilimi gözlenirse, lomustinin kesilmesi endikedir.
Lomustin şu anda kutanöz lenfoma ve mast hücre tümörlü köpekler için birinci basamak kemoterapötik ajan olarak kullanılmaktadır.6,7,10 Lomustin ayrıca daha geleneksel çoklu ilaç protokollerine yanıt vermeyen lenfomalı köpeklerde ikinci basamak kurtarma ajanı olarak da kullanılmaktadır. Anekdotal kanıtlar, lomustinin sistemik ve malign histiyositoz ve histiyositik sarkomlu köpeklerde de etkili olduğunu göstermektedir. Kedilerde lenfoma, mast hücreli tümörler, multipl miyelom ve fibrosarkomların tedavisinde olumlu yanıtlar alınmıştır.8,9
İfosfamid
İfosfamidf, tümör taşıyan köpek ve kedilerde (daha az oranda) incelenmiş alkilleyici bir ajandır.3,11 Mesane için toksik olan bir metabolite bağlı steril hemorajik sistiti önlemek için salin diürezi ve bir tiyol bileşiği olan mesna ile eş zamanlı olarak verilmelidir. Mesna ve ifosfamid birlikte satılır ve paketlenir. Köpekler için önerilen dozaj ve uygulama programı, hesaplanan ifosfamid dozunun %20’si oranında mesna (%0,9 NaCl içinde 20 mg/mLkonsantrasyonda sulandırılarak) verilmesidir. Mesna IV bolus olarak verilir ve ardından köpeğe 30 dakika boyunca IV olarak saatte 18,3 mg/kg dozunda %0,9 NaCl ile diürez uygulanır. İfosfamid (375 mg/m2 %0,9 NaCl içinde 9,15 mL/kg hacimde sulandırılarak) daha sonra 30 dakika boyunca IV olarak verilir ve ardından 5 saatlik IV salin diürezi (saatte 18,3 mL/kg) uygulanır. Diürez döneminde 2. ve 5. saatlerde iki ek mesna dozu verilir. İfosfamid köpeklerde 2 veya 3 haftalık aralıklarla verilebilir. İfosfamidin kedilerde kullanımına ilişkin yalnızca anekdot niteliğinde raporlar mevcuttur ve daha yüksek dozların tolere edildiği görülmektedir. Bununla birlikte, ifosfamidin kedilerde kullanımına ilişkin daha kapsamlı araştırmalara ihtiyaç vardır.
Mesna ile birlikte verildiğinde, ifosfamidin doz sınırlayıcı toksisitesi, öncelikle nötropeni olarak ortaya çıkan miyelosupresyondur. Hafif, kendi kendini sınırlayan gastrointestinal toksisite (örn. inappetans, kusma, diyare) de görülebilir. Tümör taşıyan 72 köpek üzerinde yapılan bir çalışmada, %6’lık hayal kırıklığı yaratan genel yanıt oranı kaydedilmiştir.11 Olumlu yanıtlar çoğunlukla kutanöz hemanjiosarkom ve leiomyosarkom dahil olmak üzere sarkomlu köpeklerde görülmüştür. Lenfomalı 40 köpekten yalnızca biri ifosfamide olumlu yanıt vermiştir.11
Yeni Yöntemler
Sitotoksik ilaçların yeni uygulama, formülasyon veya süre tayin etme yöntemleri de küçük hayvanlarda incelenmiştir. Bazı yöntemler doktorların kullanımına sunulmuşken, diğerleri halen geliştirilme aşamasındadır.
Lipozomal Formülasyonlar
Lipozomlar, bir veya daha fazla lipid çift tabakadan oluşan kapalı veziküler yapılardır. Birkaç farklı lipozom türü, ilaç farmakokinetiğini ve/veya farmakodinamiğini önemli ölçüde değiştiren farklı fiziksel özelliklerle tasarlanabilir. Lipozomlar, çift tabakanın bir parçası olarak ya da vezikülün merkezinde paketlenmiş olarak ilaçlarla veya diğer bileşiklerle yüklenebilir. Çoğu lipozomal formülasyon antitümör etkinliğini artırmak, normal doku toksisitesini azaltmak veya iki etkinin bir kombinasyonunu indüklemek için tasarlanmıştır. Şu anda lipozomal formülasyonlarda birkaç sitotoksik ilaç mevcuttur.
Doksorubisinin lipozomal formülasyonu olan Doksilg, köpek ve kedilerde etkili bir şekilde kullanılmaktadır.12,13 Doksorubisinin orijinal formundan farklı olarak, miyelosupresyon ve kardiyotoksisite Doksil ile doz sınırlayıcı değildir. Bu da Doksil’i önceden kardiyak hastalığı olan köpeklerde veya kardiyotoksik seviyelere yaklaşan kümülatif kapsüllenmemiş doksorubisin dozları almış köpeklerde kullanım için uygun bir ilaç haline getirmektedir. Köpeklerde, lipozomal doksorubisinin doz sınırlayıcı toksisitesi palmar-plantar eritrodizestezi adı verilen kutanöz bir toksisitedir. Palmer-plantareritrodizestezi, hafif eritem ve alopesiden şiddetli kabuklanma ve ülserasyona kadar değişen lezyonlarla karakterize olup, özellikle aksilla, inguinal bölge ve patileri çevreleyen deride görülür. Bu deri lezyonlarının şiddeti, tedavi süresince B6 vitamini (örn. 8 saatte bir 25 ila 50 mg PO piridoksin) verilmesiyle azaltılabilir.14 Kedilerde Doksil’in doz sınırlayıcı toksisitesi gecikmiş nefrotoksisitedir; bu nedenle, ilacı alan kedilerde böbrek fonksiyonlarının yeterli olması zorunludur. Hem köpeklerde hem de kedilerde önerilen Doksil dozu 3 haftada bir 1 mg/kg IV’tür.13
Köpeklerde lipozomal doksorubisine olumlu yanıt verdiği bildirilen tümör tipleri arasında lenfoma, malign histiyositoz, nörofibrosarkom, fibrosarkom, meme adenokarsinomu, anal kese adenokarsinomu ve SCC yer almaktadır.12,15 Ayrıca, doksorubisine dirençli lenfoması olan köpekler Doksil’e olumlu yanıt vermiştir, bu da ilaç direncini ortadan kaldıran bazı mekanizmaların varlığına işaret etmektedir. Kedi aşı ile ilişkili sarkomlar Doksil’e olumlu yanıt vermiştir; ancak kapsüllenmemiş doksorubisin de aynı derecede etkili görünmektedir.13
Doksorubisinin bir başka lipozomal formülasyonu olan Myoceth de melfalan ve doksorubisine dirençli multipl miyelomu olan bir köpekte başarıyla kullanılmıştır.15 Bu formülasyon 35 mg/m2 IV dozunda verilmiş ve kalıcı remisyon sağlamıştır.15 Formülasyon aynı zamanda kardiyotoksisite gelişmeden >500 mg/m2 kümülatif doksorubisin dozu verilmesine olanak sağlamıştır.
Sisplatinin lipozomal formülasyonları da köpek ve kedilerde kullanılmıştır. Güvenli oldukları ve kapsüllenmemiş sisplatin ile ilişkili renal toksisiteyi
(köpeklerde) ve solunum toksisitesini (kedilerde) ortadan kaldırdıkları görülmüş olsa da, yüksek terapötik etkinlik göstermemişlerdir.16-19
İnhalasyon Kemoterapisi
İnhalasyon kemoterapisi, akciğer kanseri olan köpeklerin tedavisinde başarıyla kullanılmaktadır. Teoride ve pratikte, inhalasyon kemoterapisi ile tümör seviyesinde önemli ölçüde daha yüksek ilaç seviyelerine ulaşılabilirken, tüm vücut ilaç seviyeleri düşük tutulduğu için daha az sistemik toksisite gözlenmektedir. Bununla birlikte, inhalasyon kemoterapisi rutinde mevcut değildir ve okuyucu, konuyla ilgili daha kapsamlı bilgiler edinmek için yakın tarihli bir makale okumalıdır.20
İntralezyonel Kemoterapi
Kemoterapötik ilaçların doğrudan tümöre enjekte edilmesi, önemli intratümöral ilaç seviyeleri ve daha az sistemik toksisite ile sonuçlanabilir. Hayvanlarda intralezyonel kemoterapi genellikle platin ajanlarının (örn. karboplatin) deri tümörlerine (örn. kedi ve atlarda solar kaynaklı SCC’ler) ve atlarda sarkoidlere enjekte edilmesiyle gerçekleştirilmiştir. Saflaştırılmış susam yağı içinde 10 ila 14 günlük aralıklarla intralezyonel karboplatin (100mg/m2) enjeksiyonu, kedilerde nazal planum SCC’si tedavisinde iyi bir etkinlik göstermiştir.21 İlerlemiş nazal planum SCC’si olan kedilerde intralezyonel karboplatin (1,5 mg/cm3 q 7 gün) radyoterapi ile birlikte kullanıldığında da önemli iyileşme gözlenmiştir.22
İntralezyonel 5-florourasil enjeksiyonu bazı insan kutanöz malignitelerinin tedavisinde kullanılmaktadır ve bazı at tümörlerinde etkili olduğuna dair anekdot niteliğinde kanıtlar vardır. Ön kanıtlar, bleomisinin intralezyonel enjeksiyonunun at ve kedi SCC’lerinde ve köpek akantomatöz epulisinde antitümör aktivite gösterebileceğini ortaya koymaktadır.23,24
Metronomik Kemoterapi
Son zamanlarda, bazen “metronomik” kemoterapi olarak da adlandırılan, sitotoksik ajanların düşük dozda, sürekli verilmesi kavramı ortaya atılmıştır.25 Bu uygulama yönteminde, sitotoksik ajanı MTD’de uygulamak yerine, tedaviler normal dokuların iyileşmesi için yeterli zamana sahip olacak şekilde aralıklandırılır. Metronomik uygulama ile ilacın daha sık (örn. günlük) düşük dozu (MTD’nin çok altında) sürekli olarak verilir. Bu şekilde uygulanan sitotoksik ajanların büyüyen tümör vaskülatürünün endotelini etkilediğini ve etkilerini tümör hücresi sitotoksisitesinden ziyade antianjiyojenik bir mekanizma yoluyla gösterdiğini öne süren önemli in vitro ve in vivo (kemirgen tümör modellerinde) kanıtlar vardır.25 Metronomik kemoterapinin teorik neticesi hastalığın gerilemesinden ziyade stabilizasyonudur. Kemoterapötiklerin bu şekilde uygulanması, MTD’nin çok altında dozlar kullanıldığı için daha az toksik olma gibi potansiyel bir avantaja da sahiptir.
Metronomik kemoterapinin bazı doğal antianjiyojenik aktiviteye sahip olduğu bilinen ilaçlar (örn. doksisiklin) ve siklooksijenaz-2 inhibitörleri (örn. piroksikam) ile birleştirilmesinin antitümör yanıt olasılığını artırabileceği görülmektedir. Şu anda, insanlarda ve hayvanlarda çeşitli
metronomik tedavi denemeleri devam etmektedir. Bu çalışmaların titiz bir değerlendirmeye tabi tutulmadığı ve bu nedenle metronomik kemoterapinin kullanımı doğru klinik çalışmalarla doğrulanmayı beklemektedir.
Sonuç
Her yıl birkaç yeni antineoplastik ilaç veya tedavi yöntemi kullanıma sunulmaktadır. Nihayetinde amaç, refakatçi hayvanlar için yaşam kalitesini koruyan ve uzatan daha az toksik, daha etkili tedaviler geliştirmektir. Bu tür ilaçların faz I denemeleri yoluyla değerlendirilmesi, öncelikle her hayvan türü için uygun bir dozun belirlenmesi için gereklidir. Bir doz belirlendikten sonra, daha ileri etkinlik analizlerine başlanabilir. Daha az toksik, daha hedefe yönelik yaklaşımlar kullanılabilir hale geldikçe, bunların yaygın kullanımı daha etkili ve daha iyi tolere edilen terapötik protokollerle sonuçlanacaktır. Bölgesel ve ulusal olarak yürütülen veteriner klinik çalışmalarının sayısının giderek artması nedeniyle, veteriner hekimlerin Veteriner Kanser Derneği’ninki (www.vetcancersociety.org) de dahil olmak üzere bilgilendirici web sitelerini ziyaret ederek bu çalışmalardan haberdar olmaları tavsiye edilmektedir.
a Navelbine; Glaxo Smith Kline, Research Triangle Park, NC 27709 b Taxol; Bristol-Myers Squibb, Princeton, NJ 08543
c Taxotere; Aventis Pharmaceuticals, Bridgewater, NJ 08807
d Gemzar; Eli Lilly & Co., Indianapolis, IN 46285
e CCNU; Bristol-Myers Squibb, Princeton, NJ 08543
f Ifex; Bristol-Myers Squibb, Princeton, NJ 08543
g Doxil; Ortho Biotech Products, Bridgewater, NJ 08807 h Myocet; The Liposome Company, Princeton, NJ 08540
Kaynakça
- Poirier VJ, Burgess KE, Adams WM, et al. Toxicity, dose and efficacy of vinorelbine (Navelbine) in dogs with spontaneous neoplasia. J Vet Intern Med 2004;18:536-539.
- Poirier VJ, Hershey AE, Burgess KE, et al. Efficacy and toxicity of paclitaxel (Taxol) for the treatment of canine malignant tumors. J Vet Intern Med 2004;18:219-222.
- Moore AS, Kitchell BE. New chemotherapy agents in veterinary med- icine. Vet Clin North Am Small Anim Pract 2003;33:629-649.
- Kosarek CE, Kisseberth WC, Gallant SL, et al. Clinical evaluation of gemcitabine in dogs with spontaneously occurring malignancies. J Vet Intern Med 2005;19:81-86.
- LeBlanc AK, LaDue TA, Turrel JM, et al. Unexpected toxicity follow- ing use of gemcitabine as a radiosensitizer in head and neck carcino- mas: a Veterinary Radiation Therapy Oncology Group pilot study. Vet Radiol Ultrasound 2004;45:466-470.
- Moore AS, London CA, Wood CA, et al. Lomustine (CCNU) for the treatment of resistant lymphoma in dogs. J Vet Intern Med 1999;13:395-398.
7. Kristal O, Rassnick KM, Gliatto JM, et al. Hepatotoxicity associated with CCNU (lomustine) chemotherapy in dogs. J Vet Intern Med 2004;18:75-80.
8. Rassnick KM, Gieger TL, Williams LE, et al. Phase I evaluation of CCNU (lomustine) in tumor-bearing cats. J Vet Intern Med 2001;15:196-199.
9. Fan TM, Kitchell BE, Dhaliwal RS, et al. Hematological toxicity and therapeutic efficacy of lomustine in 20 tumor-bearing cats: critical assessment of a practical dosing regimen. J Am Anim Hosp Assoc 2002;38:357-363.
10. Rassnick KM, Moore S, Williams LE, et al. Treatment of canine mast cell tumors with CCNU (lomustine). J Vet Intern Med 1999;13:601- 605.
11. Rassnick KM, Frimberger AD, Wood CA, et al. Evaluation of ifos- famide for treatment of various canine neoplasms. J Vet Intern Med 2000;14:271-276.
12. Vail DM, Kravis LD, Cooley AJ, et al. Preclinical trial of doxorubicin entrapped in sterically stabilized liposomes in dogs with sponta- neously arising malignant tumors. Cancer Chemother Pharmacol 1997;39:410-416.
13. Poirier VJ, Thamm DK, Kurzman ID, et al. Liposome-encapsulated doxorubicin (Doxil) and doxorubicin in the treatment of vaccine-asso- ciated sarcoma in cats. J Vet Intern Med 2002;16:726-731.
14. Vail DM, Chun R, Thamm DH, et al. Efficacy of pyridoxine to ame- liorate the cutaneous toxicity associated with doxorubicin containing pegylated (stealth) liposomes: a randomized, double-blind clinical trial using a canine model. Clin Cancer Res1998;4:1567-1571.
15. Kisseberth WC, MacEwen EG, Helfand SC, et al. Response to lipo- some-encapsulated doxorubicin (TLC D-99) in a dog with myeloma. J Am Vet Med Assoc 1995;9:425-428.
16. Vail DM, Kurzman ID, Glawe PA, et al. Stealth liposomal cisplatin versus carboplatin as adjuvant therapy for spontaneously arising osteosarcoma in the dog: a randomized multicenter clinical trial. Canc Chemother Pharmacol 2002;50:131-136.
17. Thamm DH, Vail DM. Preclinical evaluation of a sterically stabilized liposome-encapsulated cisplatin in clinically normal cats. Am J Vet Res 1998;59:286-289.
18. Fox LE, Rosenthal RC, King RR, et al. Use of cis-bis-neodecanoato- trans-R,R-1,2-diaminocyclohexane platinum (II), a liposomal cisplatin analogue, in cats with oral squamous cell carcinoma. Am J Vet Res 2000;61:791-795.
19. Marr AK, Kurzman ID, Vail DM. Preclinical evaluation of Lipoplatin, a liposome-encapsulated formulation of cisplatin in normal dogs. Am J Vet Res 2004;65:1474-1478.
20. Hershey AE, Kurzman ID, Bohling C, et al. Inhalation chemotherapy for macroscopic primary or metastatic lung tumors: proof of principle in a companion animal model. Clin Cancer Res 1999;5:2653-2659.
21. Theon AP, VanVechten MK, Madewell BR. Intratumoral administra- tion of carboplatin for treatment of squamous cell carcinoma of the nasal planum in cats. Am J Vet Res 1996;57:205-210.
22. de Vos J, Burm A, Focker B. Results from the treatment of advanced stage squamous cell carcinoma of the nasal planum in cats, using a combination of intralesional carboplatin and superficial radiotherapy: a pilot study. Vet Compar Oncol 2004;2:75-81.
23. Theon AP, Pascoe JR, Madigan JE, et al. Comparison of intratumoral administration of cisplatin versus bleomycin for treatment of periocu- lar squamous cell carcinomas in horses. Am J Vet Res 1997;58:431- 436.
24. YoshidaK,WataraiY,SakaiY,etal.Theeffectofintralesional bleomycin on canine acanthomatous epulis. J Am Anim Hosp Assoc 1998;34:457-461.
25. Kerbel RS, Kamen BA. The anti-angiogenic basis of metronomic chemotherapy. Nature Rev 2004;4:423-436.