| 1Veteriner Farmakoloji ve Toksikoloji Anabilim Dalı, Veteriner Hekimliği Fakültesi, Çin Ziraat Üniversitesi, Pekin, Çin, 2TCVM Modernizasyonu Shanxi Merkez Laboratuvarı, Veteriner Hekimliği Fakültesi, Shanxi Ziraat Üniversitesi, Jinzhong, Çin, 3Veteriner İlaç Kalıntı ve Yasadışı Katkı Tespit Merkezi Laboratuvarı, Tarım ve Köyişleri Bakanlığı, Pekin, Çin |
| AÇIK ERİŞİM EDIİTLEYEN: İNCELEYEN: Dawei Guo, Nanjing Ziraat Üniversitesi, Çin Fernando Costa Ferreira, Lizbon Üniversitesi, Portekiz *İLETİŞİM wjz2020@foxmail.com; -XingyuanCao SUNUM: 11 Aralık 2023 Atıfta bulunmak için: doi: 10.3389/fvets.2024.1353775 TELİF HAKKI |
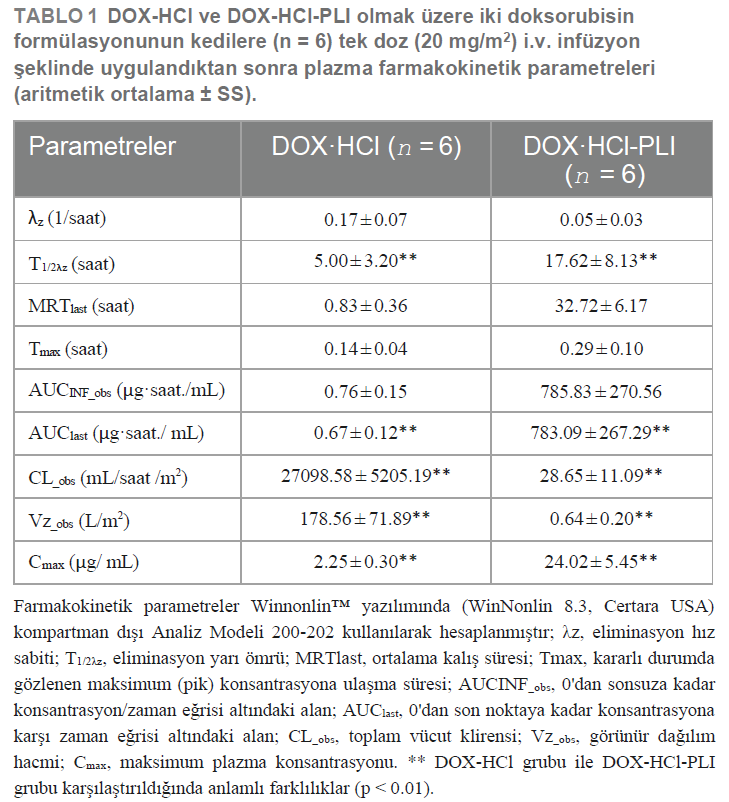
| Kanser tedavisinde yaygın olarak kullanılan ve çok güçlü bir kemoterapötik ajan olan doksorubisin, özellikle çeşitli formülasyonlarda karmaşık farmakokinetik davranışlar sergilemektedir. Kedilerde kanser vakalarının görülme sıklığının artmasıyla birlikte, ilacın kedi deneklerdeki farmakokinetiğini anlamak kritik olmakla birlikte henüz yeterince araştırılmamıştır. Bu nedenle, bu çalışmada on iki kedide tek doz 20 mg/m2 dozunda doksorubisin hidroklorür (DOX-HCl) veya doksorubisin hidroklorür pegile lipozomun (DOX-HCl-PLI) yavaş bir şekilde intravenöz olarak uygulanmasından sonra doksorubisinin farmakokinetik profili araştırılmıştır. Tedavi öncesi zaman diliminde (0 saat) ve 192 saat boyunca toplanan kan örnekleri ultra-performans sıvı kromatografisi-kütle spektrometrisi (UPLC-MS/MS) kullanılarak analiz edilmiştir. Doksorubisinin elde edilen farmakokinetik parametreleri iki formülasyon arasında önemli farklılıklar ortaya koymuştur ve bu farklılıklar aşağıdaki gibidir: eliminasyon yarı ömrü (T1/2λz) 5.00±3.20 saat (DOX-HCl) ve 17.62±8.13 saat (DOX-HCl-PLI), 0’dan son noktaya kadar konsantrasyon/zaman eğrisi altında kalan alan (EAAlast) 0.67±0.12 μghr. /mL (DOX-HCl) ve 783,09±267,29 μghr./mL (DOX-HCl-PLI) ve toplam vücut klirensi (CL_obs) 27098,58±5205,19 mL/sa/m2 (DOX-HCl) ve 28,65±11,09 mL/sa/m2 (DOX-HCl-PLI). Ayrıca, görünür dağılım hacminde (Vz_obs) 178,56±71,89 L/m2 (DOX-HCl) ve 0,64±0,20 L/m2 (DOX-HCl-PLI) ve maksimum plazma konsantrasyonunda (Cmax) 2,25±0,30 μg/mL (DOX-HCl) ve 24,02±5,45 μg/mL (DOX-HCl-PLI) farklılıklar tespit edilmiştir. Özellikle, DOX-HCl uygulamasından sonra plazmada doksorubisin metaboliti olan düşük konsantrasyonda doksorubisinol tespit edilmiş, DOX-HCl-PLI uygulandığında ise daha da az bulunmuştur. Bu araştırma, DOX-HCl ve DOX-HCl-PLI’nin kedilerdeki farklı farmakokinetik davranışları hakkında değerli bilgiler sağlayarak, gelecekteki çalışmalar ve kedi onkolojisindeki potansiyel klinik uygulamalar için önemli bir zemin oluşturmaktadır. ANAHTAR KELİMELER doksorubisin, doksorubisinol, karşılaştırmalı farmakokinetik, kedi, kanser |
GirişMeme ve yumurtalık kanseri tedavisinde yaygın olarak kullanılan doksorubisin, çeşitli büyüme döngülerindeki hücrelerde DNA, RNA ve protein sentezini inhibe eden geniş spektrumlu bir antrasiklin antitümör antibiyotiktir (1, 2). Günümüzde, insan tedavilerinde klinik kullanım için onaylanmış iki Doksorubisin formülasyonu bulunmaktadır: hidroklorür doksorubisin ve hidroklorür lipozom doksorubisin (3). Doksorubisin kayda değer antitümör etkinliğe sahip olmasına rağmen, klinik çalışmalarda birçok yan etkisi olduğu da bildirilmiştir (4-6). Örneğin, yapılan araştırmalar doksorubisin ve onun metaboliti olan doksorubisinolün kombine edildiğinde insanlarda ve diğer türlerde güçlü toksik yan etkiler ortaya çıkardığını göstermiştir (7, 8). Doksorubisinin lipozomal formu üzerine yapılan araştırmalar, ilacın farmakokinetik profilini in vivo olarak değiştirme kapasitesini ortaya koymuş ve sonuç olarak ilacın anti-tümör etkinliğini artırmıştır (9-13). Kedi meme karsinomu, yüksek malignite ve metastaz oranı gösteren, klinikopatolojik, epidemiyolojik ve histolojik özellikler gösteren ve moleküler sınıflandırması insan kanserinde bulunanlara benzeyen, kedilerde en sık görülen tümörlerden biri olmaya devam etmektedir (14- 16). Son yıllarda, çeşitli kedi tümörlerinde kedilerdeki klinik tümörlerin tedavisinde doksorubisin etkinliğini kademeli olarak tanımlayan birkaç çalışma yapılmıştır (17-20). Özellikle, bir raporda mezenterik hemanjiosarkom tedavisinde debulking cerrahisi ve adjuvan doksorubisin kemoterapisinin kullanımı detaylı olarak anlatılmış ve bunun sonucunda kedide sağkalım süresinin uzadığı rapor edilmiştir (18). Bununla birlikte, diğer raporlar ilacın kedilerde böbrek hasarı, miyelosupresyon, anoreksi ve kilo kaybına yol açan ciddi toksisitesine ilişkin endişeleri dile getirmiştir (21). Kedilerin klinik sonuçlarını iyileştirmeyi amaçlayan terapötik seçenekleri ortaya çıkarmak için kapsamlı bir araştırmaya ihtiyaç vardır. Bu tür çalışmalar, sitotoksisite deneyleri için mevcut kedi hücre dizilerinin bulunmaması nedeniyle sınırlı kalmaktadır (22). Ayrıca, doksorubisinin iki formülasyonunu karşılaştırırken, lipozomun fiziksel özellikleri ilacın farmakokinetiğini değiştirmede önemli bir rol oynamakta olup, bu faktör hem etkinlik hem de yan etkilerle yakından ilişkilidir (23). Buna rağmen, kedilerde doksorubisinin farmakokinetik profilini karakterize eden sadece birkaç çalışma bulunmaktadır. Hedef türlerde doksorubisin ve doksorubisinolün farmakokinetik profilinin değerlendirilmesi, gelecekteki klinik tedavilerde etkinliğin anlaşılması ve potansiyel yan etkilerin yönetilmesi için son derece kritik bir adımdır. Bu nedenle, bu çalışmanın temel amacı, kedilerde iki farklı doksorubisin formülasyonundan elde edilen doksorubisin ve onun metaboliti olan doksorubisinolün farmakokinetiğini karakterize etmektir. |
Materyal ve metotMateryalDoksorubisin hidroklorür standart ürünü (saflık = %98,0), doksorubisinol standart ürünü (saflık = %96,4) ve daunorubisin hidroklorür standart ürünü (Dahili standart, saflık = %98,8) TLC Pharmaceutical Standers’dan temin edilmiştir. Enjeksiyonluk doksorubisin hidroklorür (DOX-HCl, 10 mg) ShanXi Pude Pharmaceutical Co., Ltd. firmasından ve doksorubisin hidroklorür pegile lipozom enjeksiyonu (DOX-HCl-PLI, 20 mg:10 mL) CSPC Pharmaceutical Group Ouyi Pharmaceutical Co., Ltd. firmasından temin edilmiştir. Kullanılan diğer tüm kimyasallar ve reaktifler kromatografik sınıfta olup ticari tedarikçilerden (Fisher Scientific) temin edilmiştir. |
Deney tasarımıBu çalışmada Çin Tarım Üniversitesi Deney Hayvanları Merkezi’nden temin edilen on iki evcilleştirilmiş Çin köy kedisi (altı dişi ve altı erkek; 3-3,6 kg; yaş aralığı 2-3 yaş) kullanılmıştır. Çalışma öncesinde, kedilerin fiziksel muayeneye göre sağlıklı olduğu doğrulandı. Tüm prosedürler Çin Tarım Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından incelenmiş ve onaylanmıştır (NO.13303-21-E-001). Önceden ayarlanmış deney, tek doz ve paralel doz tasarımında gerçekleştirilmiştir. On iki kedi eşit büyüklükteki iki tedavi grubuna rastgele dağıtılmıştır. Grup I’e 20 mg/m2 vücut yüzeyi dozunda DOX-HCl verilirken, grup II’ye aynı dozda DOX-HCl-PLI verilmiştir. Klinik uygulamaya benzer şekilde, her iki formülasyon da %0,9 NaCl ile seyreltildikten sonra yavaş bir şekilde intravenöz (i.v.) infüzyon yoluyla (10 dakika boyunca uygulandı) yaklaşık 10 μL/s enjeksiyon hızı korunarak uygulandı. Kediler ilaç uygulamasından 16 saat önce ve 8 saat sonra aç bırakılmıştır. Her kedi, tedavinin ilk gününde ilaç uygulamasından hemen önce tartılmıştır. 0,5 mL’lik kan örnekleri 0 (ön uygulama) ve 0,033, 0,083, 0,167, 0,25, 0,5, 0,75, 1, 1,5, 3, 6, 12, 24, 48, 72, 96, 120, 144, 168 ve 192 saat sonra ön bacak venleri yoluyla heparinize tüplere alınmıştır. Daha sonra, kan örnekleri 4000 rpm’de 10 dakika santrifüj edilmiş ve plazma örnekleri analiz edilene kadar -20°C’de saklanmıştır. |
Örneklerin AnaliziDoksorubisin ve doksorubisinolün plazma konsantrasyonları, daha önce bildirildiği gibi geçerliliği onaylanmış ultra performanslı sıvı kromatografisi-kütle spektrometrisi (UPLC-MS/MS) yöntemi kullanılarak analiz edilmiştir (7, 24). Plazmada doksorubisin ve doksorubisinol için alt miktar belirleme limiti (LLOQ) sırasıyla 10 ng/mL ve 2 ng/mL idi. Hem testler arası hem de test içi varyasyon katsayıları %15’in altında kalmıştır. Ortalama doksorubisin geri kazanımları -14,51 ile %10,00 arasında değişirken, doksorubisinol geri kazanımları -14,00 ile %10,63 arasında değişmiştir. Doksorubisin ve doksorubisinol kalibrasyon eğrileri sırasıyla 10 ila 2000 ng/mL (r2 > 0.99) ve 2 ila 400 ng/mL (r2 > 0.99) konsantrasyon aralığında tatmin edici doğrusallık sergilemiştir. |
Veri analiziFarmakokinetik parametreler WinNonlin™ yazılımında (WinNonlin 8.3, Certara Amerika Birleşik Devletleri) Kompartmansız Analiz Modeli 200-202 (Lineer Trapezoidal Lineer İnterpolasyon Yöntemi, Tekdüze Ağırlıklandırma) kullanılarak belirlenmiştir. İstatistiki farklılıkları değerlendirmek için, eliminasyon yarı ömrü (T1/2λz), 0’dan son noktaya kadar konsantrasyon/zaman eğrisi altında kalan alan (AUClast), toplam vücut klirensi (CL_obs), görünür dağılım hacmi (Vz_obs) ve maksimum plazma konsantrasyonunda (Cmax) logaritmik dönüşümü takiben çalışma grupları arasında SPSS Statistics 20.0 (International Business Machines, Armonk, NY, Amerika Birleşik Devletleri) aracılığıyla T-testi uygulanmıştır. İstatistiksel olarak anlamlı farklılıklar 0.01’in altındaki p-değerleri (p) için kabul edilmiş ve tüm veriler ortalama ± standart sapma (SS) olarak ifade edilmiştir. |
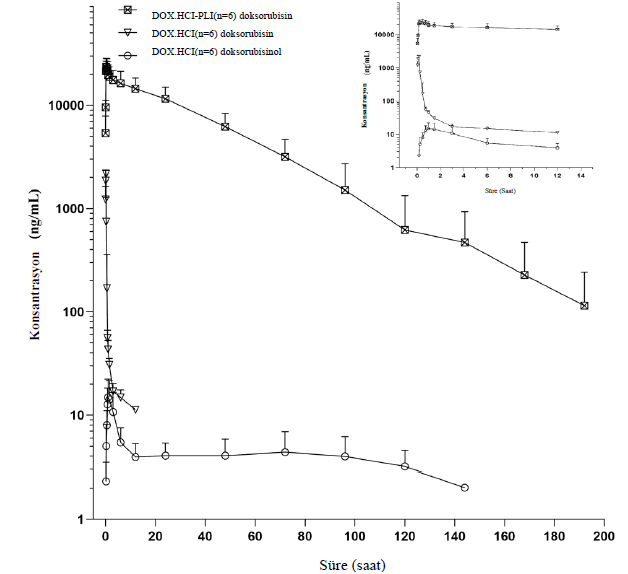
SonuçlarHem DOX-HCl hem de DOX-HCl-PLI grupları için doksorubisinin plazma konsantrasyonu/zaman eğrileri Şekil 1’de gösterilmiştir. Ayrıca, DOX-HCl grubu için doksorubisinol eğrisi sunulurken, DOX-HCl-PLI grubu için eğri, uygulama sonrası ölçülen zaman noktalarının sınırlı olması nedeniyle gösterilmemiştir. Sonuçlar, iki formülasyonun uygulanmasından sonra doksorubisinin farmakokinetik profilinin belirgin şekilde farklı olduğunu göstermiştir. İki doksorubisin formülasyonunun farmakokinetik parametreleri Tablo 1’de sunulmuştur. Sonuçlar, DOX-HCl ve DOX-HCl-PLI olmak üzere iki grup arasında T1/2λz, AUClast, CL_obs, Vz_obs ve Cmax değerleri açısından istatistiki olarak anlamlı farklılıklar olduğunu göstermiştir (p < 0.01). Metabolit doksorubisinolün düşük konsantrasyonu ve sınırlı sayıda ölçülen zaman dilimleri göz önüne alındığında, doksorubisinolün farmakokinetik parametreleri mevcut doksorubisin dozuna göre kesin olarak elde edilememiştir. Hiçbir kedide yan etki gözlenmemiştir. |
TartışmaDoksorubisin birçok kanser türünde kayda değer terapötik etkinlik göstermiştir ve onaylanmış en güçlü kemoterapötik ilaçlardan biri olarak kabul edilmektedir. Daha önce yapılan farmakokinetik çalışmalar öncelikle insanlar ve diğer türler üzerine odaklanmıştır (25); ancak son yıllarda kediler arasında rapor edilen klinik tümör vakalarında artış eğilimi görülmektedir (18, 21). Bu nedenle, yaptığımız çalışmada kedilerde doksorubisin ve metaboliti doksorubisinolün plazma konsantrasyonlarını ölçerek iki doksorubisin formülasyonunun farmakokinetiği araştırılmıştır. Yaygın bulgularla tutarlı biçimde, elde ettiğimiz sonuçlar plazma örneklerinde doksorubisin ve doksorubisinol tespit etmiş olup, ana ilaç uygulandıktan sonra ağırlıklı olarak plazmada bulunmuştur (26). Elde ettiğimiz bulgular doksorubisin ve doksorubiksinolün farmakokinetik profillerinde DOX-HCl ve DOX-HCl-PLI formülasyonları arasında önemli farklılıklar olduğunu göstermiştir. Bu sonuçlar, A. Gabixon ve arkadaşlarının doksorubisin lipozom formülasyonu çalışmasında, geleneksel doksorubisin ile karşılaştırıldığında i.v. uygulamayı takiben plazmada daha uzun dolaşım süresi ve daha az gözle görülür dağılım hacmi rapor ettikleri çalışma ile paralellik göstermektedir (27). Ayrıca, çalışmamız DOX-HCl-PLI uygulamasından sonra DOX-HCl grubuna kıyasla daha uzun süreli eliminasyon yarı ömrü göstermiştir. Aynı özellik, köpeklerde lipozomal doksorubisin uygulamasından sonra 27 ± 5 saatlik eliminasyon yarı ömrünün gösterdiği gibi, diğer türlerde de gözlenmiştir (28). Lipozomal doksorubisinin yüzeyinde polietilen glikol (PEG) moleküllerinin bulunması, farelerde 18 saati ve insanlarda 50 saati aşan in vivo dolaşım sürelerinin uzamasına katkıda bulunmaktadır (29). İki formülasyon arasındaki dolaşım süresindeki belirgin fark muhtemelen mononükleer fagosit sistemi (MPS) ile etkileşimlerini azaltan ve böylece karaciğerdeki eliminasyonu atlamaya yardımcı olan PEG kaplamasına bağlanmaktadır (30). Ayrıca, DOX-HCl-PLI grubunun dağılım hacmi DOX-HCl grubuna kıyasla ciddi oranda daha düşüktü, bu da lipozomal formülasyonun çoğunlukla intravasküler kompartman içinde hapsolduğunu göstermektedir (2). Ayrıca, DOX-HCl’nin EAAlast’ı (0,67 ± 0,12 μg-saat /mL) kedilerde DOX-HCl-PLI’den (783,09 ± 267,29 μg-saat /mL) daha düşüktü. |
| Bu sonuçlar, DOX-HCl-PLI’nin potansiyel olarak biyoyararlanımı arttırdığını ve anti-tümör etki potansiyelini geliştirdiğini göstermektedir. A. Rahmab ve arkadaşları tarafından yapılan bir çalışmada, 6 mg/kg i.v. dozda uygulanan sıçanlarda serbest doksorubisin ve kardiyolipin lipozomlara hapsedilmiş doksorubisinin karşılaştırmalı farmakokinetiği araştırılmıştır. Serbest doksorubisinin 5. dakikadaki pik plazma konsantrasyonu 1,7 μg/mL iken, kardiyolipin lipozom formülasyonu 5. dakikada 20,9 μg/mL pik plazma doksorubisin konsantrasyonu üretmiştir. Serbest doksorubisin ve lipozomal doksorubisin için EAA sırasıyla 1.95 μg-saat /mL ve 81.4 μg-saat /mL olmuştur (31). Benzer şekilde, farelerde DOX-HCl’nin EAAlast’ı (72.98 ± 15.79 μg-saat /mL) DOX-HCl-PLI’den (499.61 ± 72.35-μg saat /mL) daha düşüktür (32). Mevcut bulgular, DOX-HCl’nin DOX-HCl-PLI’ye kıyasla daha büyük dağılım hacmi, daha hızlı klerens ve daha kısa yarılanma ömrü sergilediğini göstermektedir. Bununla birlikte, yaptığımız çalışmada DOX-HCl uygulamasından hemen sonra doksorubisinol konsantrasyonunun düşük olduğu, DOX-HCl-PLI uygulandığında ise daha da az olduğu tespit edilmiştir. Bu gözlemler önceki bulgularla uyuşmaktadır (29, 33) ve doksorubisin lipozomal formda uygulandığında doksorubisinin doksorubisinole dönüşümünün önemli ölçüde azaldığını göstermektedir. Bu çalışmadaki veriler potansiyel olarak lipozomal doksorubisin ile ilişkili ciddi oranda düşük kardiyotoksisitenin nedenini açıklamada bilimsel kanıt olarak kullanılabilir. Sonuç olarak, bu araştırma kedilerde iki farklı doksorubisin formülasyonunun farmakokinetiğini anlamaya yönelik yapılmış ilk araştırmadır. Ön hazırlık niteliğinde olsa da, bulgular doksorubisinin pratik ve klinik uygulamasında, özellikle de kedi deneklerde kanser tedavisinde kritik öneme sahip olabilecek temel bilgiler sunmaktadır. |
Veri Erişim BeyanıÇalışmada sunulan özgün katkılar makale / ek materyalde yer almaktadır, daha fazla bilgi için ilgili yazarlarla iletişime geçebilirsiniz. Etik BeyanHayvan çalışması Çin Ziraat Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi tarafından onaylanmıştır (NO. 13303-21- E-001). Çalışma yerel mevzuata ve kurumsal gerekliliklere uygun şekilde yürütülmüştür. Katkıda bulunan yazarlarYL: Yazma – orijinal taslak, Biçimsel analiz, Doğrulama, Yazma – gözden geçirme ve düzenleme. SC: Yazma – gözden geçirme ve düzenleme, Biçimsel analiz, Doğrulama. ZW: Yazma – gözden geçirme ve düzenleme, Doğrulama. JM: Yazım – gözden geçirme ve düzenleme, Veri toplama, Doğrulama. YY: Yazma – inceleme ve düzenleme, Doğrulama. YZ: Yazma – inceleme ve düzenleme, Doğrulama. JW: Yazma – inceleme ve düzenleme. XC: Yazma – gözden geçirme ve düzenleme. FinansmanYazar(lar), bu makalenin araştırması, yazarlığı ve/veya yayını için herhangi bir finansal destek almadıklarını beyan etmiştir. TeşekkürlerXiaohui Gong, Pan Sun ve Jing Li’ye ilacın analitik tayini ve deneysel sarf malzemelerinin tedariki için yardımlarından dolayı teşekkür ederiz. Çıkar çatışmasıYazarlar, araştırmanın herhangi bir ticari veya finansal ilişki olmaksızın yürütüldüğünü ve bu durumun herhangi bir çıkar çatışması teşkil etmeyeceğini beyan etmiştir. Yayıncının beyanıBu makalede yer alan tüm iddialar yalnızca yazarlara aittir ve bağlı oldukları kuruluşların ya da yayıncının, editörlerin ve hakemlerin görüşlerini temsil etmemektedir. Bu makalede değerlendirilebilecek herhangi bir ürün veya üreticisi tarafından ileri sürülebilecek herhangi bir hak iddiası yayıncı tarafından teminat altına alınmamakta veya desteklenmemektedir. |
Kaynakça
|