Genel bakış: Köpeklerde lenfoma tedavisi için çeşitli kemoterapi protokolleri mevcuttur; ancak farklı çalışmalardan elde edilen protokollerin karşılaştırılması, özellikle sağkalım süresi ve toksikozlar değerlendirilirken oldukça zordur.
Hipotez: COAP (C, siklofosfamid; O, vinkristin; A, sitozin arabinosid; P, prednizon) ve modifiye edilmiş Wisconsin Üniversitesi 19 haftalık (UW-19) indüksiyon protokolünün lenfomalı köpeklerde genel sağkalım süreleri üzerinde herhangi bir etkisi yoktur.
Hayvanlar: Multisentrik lenfomalı yüz bir tane köpek.
Yöntemler: Retrospektif çalışma (2001-2006). İdame tedavisi ile birlikte 8 haftalık COP (C, cyclophospha- mide; O, vincristine; and P, prednisone) temelli protokol (COAP grubu) veya 19 haftalık CHOP (C, cyclophosphamide; H, doxorubicin; O, vincristine; and P, prednisone) temelli protokol (UW-19 grubu) uygulanan köpekler ilk remisyon süresi, sağkalım süresi, toksikozlar ve maliyet açısından karşılaştırıldı.
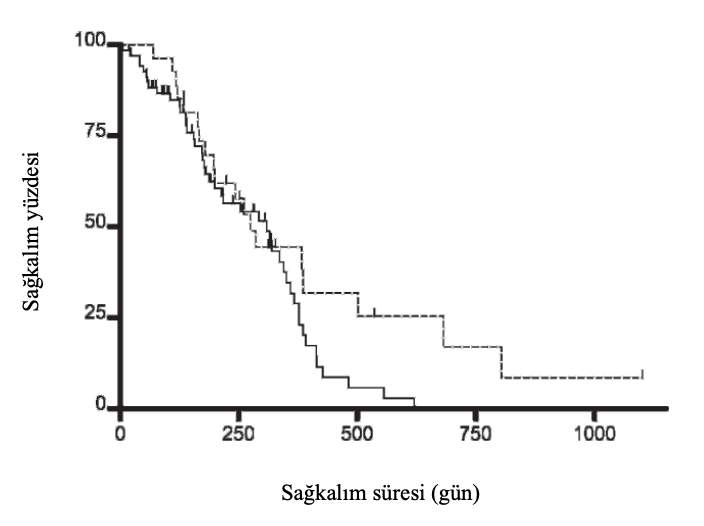
Sonuç: COAP grubunda 71 köpek ve UW-19 grubunda 30 köpek vardı. İlk nüksetmeden sonra çeşitli protokoller kullanılmıştır. COAP ve UW-19 grupları için ilk remisyonun ortalama süresi sırasıyla 94 gün (aralık, 6-356 gün) ve 174 gün (28-438 gün) idi (P , .01). COAP ve UW-19 gruplarındaki köpekler için ortalama sağkalım süreleri sırasıyla 309 gün (6-620 gün) ve 275 gün (70-1102+ gün) olmuştur (P 5 .09). COAP grubundaki köpeklerin ölüm tehlike oranı UW-19 grubuna göre 1,9 (%95 CI 1,1-3,4) idi (P 5 .03), karıştırıcılar kontrol edildikten sonra (Dünya Sağlık Örgütü klinik evresi, yaş, cinsiyet, reindüksiyon sırasında doksorubisin kullanımı). Nötropeni ve gastrointestinal toksikozların şiddeti UW-19 grubunda COAP grubuna göre anlamlı derecede daha yüksekti (sırasıyla P 5 .01 ve P , .01).
Sonuç ve Klinik Değerlendirme: Uzun süreli doksorubisin içeren ardışık kombinasyon kemoterapi protokolünün kullanımı, doksorubisin içermeyen protokole kıyasla daha düşük nüks ve ölüm riski taşımaktadır.
Anahtar kelimeler: Kanser; Kemoterapi; CHOP; COP; Maliyet.
Veteriner Klinik Bilimleri Bölümü ve Veteriner Eğitim Hastanesi’nden (Hosoya, Kisseberth, Alvarez, Lara- Garcia, Kosarek, London, Couto); ve Veteriner Önleyici Tıp Bölümü (Lord), Veteriner Fakültesi, The Ohio State University, Columbus, OH. Dr. Kosarek halen Georgia Üniversitesi, Veteriner Fakültesi, Küçük Hayvan Hekimliği ve Cerrahisi Bölümü, Athens, GA’da görev yapmaktadır. Veteriner Kanser Derneği’nin 26. Yıllık Konferansı’nda kısmen sunulmuştur, Pine Mountain, GA, 19-22 Ekim 2006.
Yeniden basım talepleri: William C. Kisseberth, DVM, PhD, DACVIM (Onkoloji), Veteriner Klinik Bilimleri Bölümü ve Veteriner Eğitim Hastanesi, Veteriner Fakültesi, Ohio Devlet Üniversitesi, Columbus, OH 43210; e-posta: kisseberth.2@ osu.edu.
İbraz tarihi 28 Kasım 2006; Revize tarihi 14 Mart 2007, 2 Mayıs,
2007, 2 Haziran 2007; 29 Haziran 2007.
Telif Hakkı E 2007 Amerikan Veteriner İç Hastalıkları Fakültesi tarafından
0891-6640/07/2106-0027/$3.00/0
Ayrıca, çoğu zaman protokoller arasındaki karşılaştırmalar farklı kurumlarda, farklı onkologlar tarafından ve farklı hayvan popülasyonlarında yapılan çalışmalar arasında yapılmıştır. Yakın zamanda, bu grup tarafından yapılan retrospektif bir çalışma, COP ve CHOP tabanlı protokollerle lenfoma tedavisi uygulanan köpekler arasında sağkalım süreleri açısından herhangi bir fark olmadığını ortaya koymuştur.9 Bu çalışma yalnızca CHOP tabanlı protokol uygulanan az sayıda köpeği içermektedir ve CHOP tabanlı protokol, mediastinal form veya gastrointestinal form gibi COP tabanlı kemoterapiye daha az yanıt verdiği düşünülen vakalar için seçici olarak kullanılmıştır.
İki protokol (COAP [C, siklofosfamid; O, vinkristin; A, sitozin arabinosid; P, prednizon] protokolü ve modifiye edilmiş Wisconsin-Madison Üniversitesi 19 haftalık protokolü [UW-19]) 2001 yılından bu yana Ohio Eyalet Üniversitesi Veteriner Eğitim Hastanesi’nde (OSU-VTH) tedavi edilen multisentrik lenfomalı köpeklerde başlangıç indüksiyon protokolleri olarak kullanılmıştır. İndüksiyon protokolü seçildikten sonra, köpekler aynı klinisyen kadrosu tarafından tedavi edilmiş, böylece farklı kurumlarda farklı protokollerle tedavi edilen köpeklerin karşılaştırılmasında ortaya çıkan önyargıların birçoğu potansiyel olarak ortadan kaldırılmıştır. Nüks sırasında çeşitli reindüksiyon veya kurtarma protokolleri eşit derecede mevcuttu ve ayrıca hasta sahibinin tercihine ve nüks sırasında köpeğin bakımına atanan klinisyenin kararına göre seçilmiştir.
Bu çalışmanın amacı, idame tedavisi ile birlikte COAP veya idame tedavisi olmaksızın UW-19 protokolü ile indüklenen multisentrik lenfomalı köpeklerde ilk remisyon ve sağkalım sürelerini karşılaştırmaktır. UW-19 protokolünün COAP’a göre daha uzun ilk remisyon süresiyle ilişkili olacağı, ancak başlangıç indüksiyon protokolü seçiminin genel sağkalım süresi üzerinde önemli bir etkisi olmayacağı varsayılmıştır.
Materyal ve Metot
Köpek Popülasyonu ve Seçimi
OSU-VTH’de 1 Ocak 2001 ile 31 Ocak 2006 tarihleri arasında tedavi edilen multisentrik lenfomalı köpeklerin tıbbi kayıtları retrospektif olarak incelenmiştir. Dahil edilme kriterleri (1) histolojik veya sitolojik lenfoma tanısı; (2) çalışma döneminde indüksiyon kemoterapisine başlanması; (3) çok merkezli nodal tutulumun klinik belirtisi, yani öncelikle ekstranodal bölgeleri tutan lenfomalar hariç tutulmuştur; (4) kortikosteroidler dışında daha önce kemoterapi öyküsünün olmaması.
Lenfoma tanısı, büyümüş lenf nodlarının sitolojisi, lenf nodu biyopsisinin histolojisi veya her ikisine göre konulmuştur. İmmünofenotip (B veya T hücresi) CD3 (T hücresi işaretleyicisi) ve CD 79a ve BLA 36 (B hücresi işaretleyicisi) antikorları kullanılarak immünohistokimya ile, çoklu hücre yüzeyi işaretleyicileri kullanılarak akış sitometrisi ile veya polimeraz zincir reaksiyonu kullanılarak klonalite testi ile belirlenmiştir.24 -26 Tüm köpekler, Dünya Sağlık Örgütü’nün (DSÖ) köpek lenfoması için klinik sınıflandırma sistemi kullanılarak, fizik muayene, tam kan sayımı, toraks radyografileri, abdominal ultrasonografi ve kemik iliği aspirasyon sitolojisi kayıtlarının bir kısmına veya tamamına dayanarak retrospektif olarak evrelendirilmiştir.27
Tam kan sayımındaki değişiklikler kemik iliği tutulumuna işaret ediyorsa rutin olarak kemik iliği aspirasyonu yapılmamıştır. Bu nedenle, (1) neoplastik lenfositlerin varlığı kemik iliği sitolojisi ile ortaya konulduğunda veya (2) nötropeni (,3,0 3 106 hücre/L; referans aralığı, 3,0-10,4 3 106 hücre/L) olsun veya olmasın trombositopeni (,106 3 109 trombosit/L; referans aralığı, 106-424 3 109 trombosit/L) ve periferik kan yaymasında dolaşan neoplastik lenfoid hücrelerin varlığı tespit edildiğinde köpeklerde kemik iliği tutulumu olduğu kabul edilmiştir. Köpekler ayrıca alt evre a (klinik hastalık yok veya hafif) veya alt evre b (orta-şiddetli letarji veya diğer sistemik belirtiler) şeklinde sınıflandırılmıştır. Sistemik hastalık olmaksızın, oküler belirtiler, sitopeniler, hiperkalsemi ile kanıtlanan klinik, hematolojik veya biyokimyasal anormallikler tek başına alt evre b kriterleri olarak değerlendirilmemiştir.
Tıbbi kayıtlardan çıkarılan bilgiler arasında ırk, yaş, cinsiyet, hormonal durum (kısırlaştırılmamış ve kısırlaştırılmış), ağırlık, DSÖ klinik evresi (I-V), alt evre (a veya b), immünofenotip (B’ye karşı T), ekstranodal tutulum olup olmadığı (göz/merkezi sinir sistemi [MSS]/testis, kemik iliği, diğer) ve hiperkalsemi olup olmadığı (.13.0 mg/dL; referans, 9.3-11.6 mg/dL) yer almıştır.
Tedavi Protokolleri
COAP (C, siklofosfamid; O, vinkristin; A, sitozin arabinosid; P, prednizon) ve modifiye edilmiş Wisconsin Üniversitesi 19 haftalık (UW-19) protokolleri olmak üzere iki kemoterapi protokolü kullanılmıştır (Tablo 1).9,15 COAP protokolündeki köpekler için, hayvan remisyondaysa indüksiyonun sonunda LMP (L, klorambusil; M, metotreksat; P, prednizon) idamesi9 kullanılmıştır. UW-19 protokolündeki köpekler için kemoterapi, indüksiyon fazının tamamlanmasının ardından kesilmiştir. Hemorajik sistit gelişen köpeklerde siklofosfamid yerine klorambusil kullanılmıştır.
Reindüksiyon veya kurtarma protokolleri (Tablo 2) vinkristin bazlı protokolleri (COP, CLOP, COAP, LMP/vincristine ve LMP/vincristine/L-asparaginase protokolleri) ve doksorubisin temelli protokoller (tek ajan doksorubisin, doksorubisin/siklofosfamid [AC], CHOP, UW-19 ve UW-19 modifikasyonları), CCNU (lomustin) temelli protokoller (tek ajan CCNU; CCNU/L-asparaginaz; CCNU/vincristine; ve CVM: siklofosfamid, vinkristin, metotreksat); DMAC (deksametazon, melfalan, aktinomisin D, sitozin arabinosid); ve diğerleri (tek ajan L-asparaginaz, sitozin arabinosid/mitoksantron ve araştırma ajanları) içermektedir.28
Tümör Yanıtı
Yanıt, hastalığın tamamen rezolüsyonu olarak görülen tam yanıt (CR); lenf nodu boyutunda >%50 ancak <%100 azalma olarak görülen kısmi remisyon (PR); lenf nodu boyutunda <%50 azalma veya <%25 artış olarak görülen stabil hastalık (SD); lenf nodu boyutunda <%25 artış veya yeni bir ekstranodal lezyon gelişimi olarak görülen progresif hastalık (PD) olarak kategorize edilmiştir. CR veya PR sınıflandırması için en az 3 haftalık remisyon süresi gerekliydi. Yanıt oranı (RR), aynı protokolü alan tüm köpekler arasında belirli bir protokolle CR veya PR elde eden köpeklerin yüzdesi olarak tanımlanmıştır. Belirli bir protokol için remisyon süresi, protokolün başlangıcından progresif hastalık gelişimine kadar geçen gün cinsinden süre olarak tanımlanmıştır. Remisyon süresi analizinde sansürlenen olaylar arasında hastalıkla ilgisi olmayan ölüm ve CR veya PR ile takip kaybı yer almıştır. Sağkalım süresi, kemoterapinin başlamasından ölüm zamanına kadar geçen süre olarak gün cinsinden tanımlanmıştır. Sağkalım süresi analizi için sansürlenen olaylar arasında analiz sırasında hayatta olma (1 Ekim 2006), hastalıkla ilgisi olmayan ölüm, birinci veya ikinci reindüksiyon protokolünün başlatılmasından hemen sonra takip kaybı ve CR veya PR ile takip kaybı yer almıştır. Hastalık SD veya PD’de iken takip kaybı hastalıkla ilişkili ölüm olarak kabul edilmiş ve son temas anında sayılmıştır.
Gastrointestinal toksikozlar, tıbbi kayıtlardaki klinik bulguların ve uygulanan tedavinin açıklamaları gözden geçirilerek değerlendirilmiştir. Gastrointestinal toksikozlar her kemoterapi dozundan sonra VCOG-CTCAE’ye göre derecelendirilmiştir. Köpekte tedaviden önce söz konusu parametrede anormallikler varsa, tedaviden sonra bir sonraki grade’e ilerlemediği sürece toksikoz 0 olarak puanlanmıştır. Spesifik bir protokol için toksisite grade’leri, protokolün ilk dozundan hastalığın ilerlemesine kadar geçen süre boyunca en yüksek grade olarak ifade edilmiştir. Köpekler PD’deyken kaydedilen toksikozlar analizde dikkate alınmamıştır, çünkü anormalliğin tedaviyle mi yoksa hastalıkla mı ilgili olduğunu değerlendirmek zordur.
Tedavi Maliyeti
Hem tedavi hem de yan etkilerin kontrolü tamamen OSU VTH’de yapılan köpekler için, tüm remisyon dönemi boyunca (hastalığın nihai ilerlemesine kadar tekrar yapılan tedaviler sırasında ve sonrasındaki dönem dahil) fatura OSU-VTH muhasebe veri tabanından çıkarılmıştır. Hiperkalsemi ile getirilen köpekler, ilk hastaneye yatış nedeniyle oluşan maliyet nedeniyle analiz dışında tutulmuştur. Çalışma dönemi boyunca (2001-2006; tipik olarak yılda yaklaşık %5 artış) hastane masraflarında bazı küçük değişiklikler olmasına rağmen, bu faktör analizde dikkate alınmamıştır.
İstatiksel Analiz
Kategorik değişkenler arasındaki karşılaştırmalar ki-kare testi kullanılarak yapılmıştır. Karşılaştırmada belirli bir hücrenin beklenen değeri 5’ten küçük olduğunda kategorik değişkenler için Fisher Kesin Olasılık Testi kullanılmıştır. Sürekli değişkenler arasındaki karşılaştırmalar Student t-testi kullanılarak yapılmıştır. Toksikozların şiddeti Mann-Whitney U testi kullanılarak karşılaştırılmış ve grade 3 toksikozların sıklığı ki-kare testi kullanılarak veri setleri arasında karşılaştırılmıştır. Tüm remisyon dönemi boyunca toplam maliyet zamana karşı grafiğe geçirilmiş ve aykırı değerler hariç tutulduktan sonra Student t-testi ile karşılaştırılmıştır.
Remisyon süresi ve sağkalım süresi eğrileri Kaplan-Meier yöntemi kullanılarak oluşturulmuş ve ortalama ilk remisyon süresi ve sağkalım süresi hesaplanmıştır. Tedavi grupları arasındaki karşılaştırmalar log-rank testi kullanılarak yapılmıştır. Potansiyel karıştırıcılar ayarlandıktan sonra 2 tedavi grubu arasında ilk remisyon süresini ve sağkalım süresini karşılaştırmak için Cox orantılı tehlikeler modelleri kullanılmıştır. Modellerde değerlendirilen potansiyel karıştırıcılar arasında yaş (yıl olarak), hormonal durum (kısılaştırılmamış veya kısırlaştırılmış), cinsiyet, vücut ağırlığı, immünofenotip (B hücreli, T hücreli veya bilinmeyen), DSÖ klinik evresi (evre I-IV veya V), alt evre (a veya b), pratisyen hekim, kemik iliği tutulumu olup olmadığı, hiperkalsemi olup olmadığı, hastaneye yatış yılı, kemoterapi başlamadan önce kortikosteroid kullanılıp kullanılmadığı ve reindüksiyon döneminde doksorubisin kullanılıp kullanılmadığı yer aldı. Birincil karşılaştırma 2 tedavi grubu arasındaki farka odaklandığından, tedavi grubu değişkeni ilk modele zorunlu olarak dahil edilmiştir. Daha sonra çok değişkenli analize dahil edilmek üzere potansiyel karıştırıcı değişkenleri taramak için iki değişkenli Cox orantılı tehlikeler regresyon modeli analizleri yapılmıştır. Bu iki değişkenli analizlerde P değerleri #.25 olan değişkenler çok değişkenli analize dahil edilmiştir. Değişkenler, olabilirlik oranı testinin sonuçlarına göre tam çok değişkenli modelden çıkarılmıştır. Modeldeki ana etki değişkenleri arasındaki biyolojik olarak anlamlı etkileşimler de benzer şekilde dahil edilmek üzere test edilmiştir.
Model oluşturma sürecinden önce, log tehlike oranı fonksiyonunun zaman içinde sabit olup olmadığını belirlemek için Schoenfeld kalıntıları ve grafik teknikleri aracılığıyla her değişken için orantılı tehlikeler varsayımı test edilmiştir.30 Model oluşturma sürecinden sonra, nihai modele dahil edilen her değişken için orantılı tehlikeler varsayımı tekrar test edilmiştir.
COAP, siklofosfamid, vinkristin, sitozin arabinosid, prednizon; UW-19, Wisconsin Üniversitesi 19 haftalık indüksiyon protokolü; CNS, merkezi sinir sistemi.
Tüm analizlerde P değeri ,.05 istatistiksel olarak anlamlı kabul edilmiştir. İstatistiksel analizler Prism 4c ve Stata sürüm 9.1.d kullanılarak gerçekleştirilmiştir.d
Sonuçlar
Köpekler
Yüz bir köpek çalışmaya dahil edilme kriterlerini karşılamıştır: 71 köpek (%70) COAP protokolü (COAP grubu) ve 30 köpek (%30) UW- 19 protokolü (UW- 19 grubu) ile indüklenmiştir. Dahil edilen ırklar COAP grubunda karışık ırk (13), Golden Retriever (9), Labrador Retriever (6), Boxer (4), Rottweiler (4), Doberman Pinscher (4) ve Alman Çoban Köpeği (4); UW-19 grubunda ise karışık ırk (8), Golden Retriever (4), Shih Tzu (3), Labrador Retriever (2) ve Rottweiler (2) idi. Yaş COAP ve UW-19 gruplarında sırasıyla 8,0 + 2,6 yıl (ortalama + SD) ve 8,4 + 2,7 yıldı (P = .47). Vücut ağırlığı COAP ve UW-19 gruplarında sırasıyla 30.3 + 13.8 kg ve 29.7 + 16.2 kg idi (P = .86). COAP grubunda 37 erkek (6 kısırlaştırılmamış) ve 34 dişi (1 kısırlaştırılmamış), UW-19 grubunda ise 13 erkek (2 kısırlaştırılmamış) ve 17 dişi (1 kısırlaştırılmamış) vardı (P = .51). Kısırlaştırılan hayvanların oranlarında gruplar arasında önemli bir fark yoktu (P = 1.00).
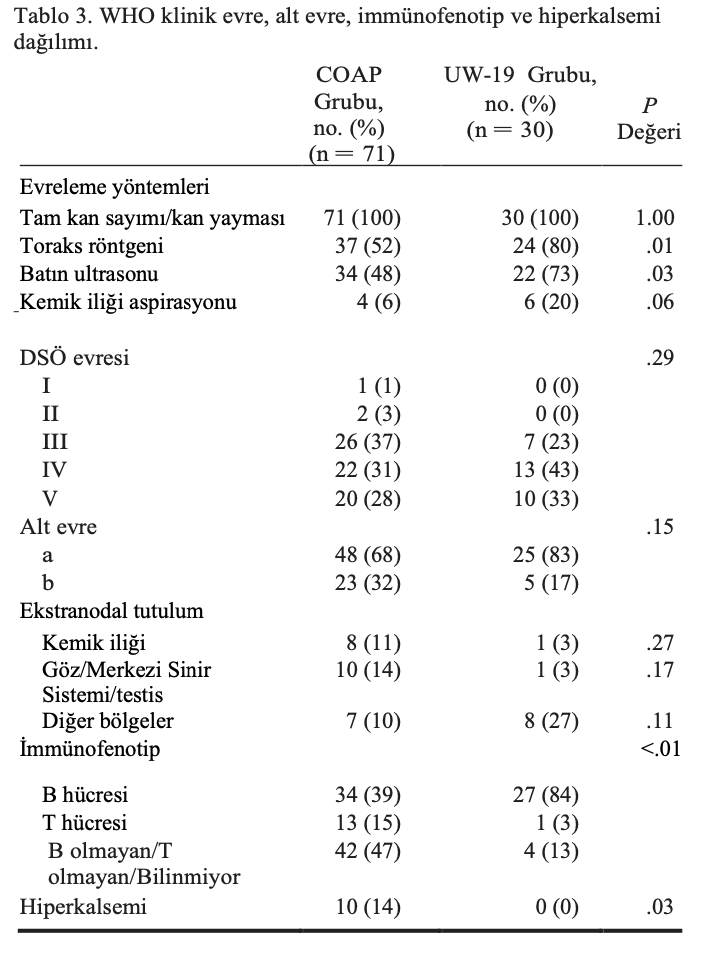
Evreleme yöntemleri ve DSÖ klinik evresi, alt evre, immünofenotip ve hiperkalsemi olup olmadığının dağılımı Tablo 3’te özetlenmiştir.
UW-19 grubundaki köpeklerde toraks radyografileri ve batın ultrasonu COAP grubundakilere kıyasla daha sık yapılmıştır (sırasıyla P = .01 ve .03). COAP ve UW-19 grupları arasında DSÖ klinik evresi (P = .29), alt evre (P = .15) veya ekstranodal tutulum (kemik iliği, P = .27; oküler/ CNS, P = .17; diğer bölgeler, P = .11) açısından anlamlı bir fark bulunmamıştır. COAP grubundaki köpeklerde hiperkalsemi UW-19 grubuna göre daha yaygındı (P = .03). Benzer şekilde, COAP grubunda UW-19 grubuna kıyasla anlamlı derecede daha fazla T-hücreli lenfomalı köpek vardı (P < .01), ancak COAP grubunda immünofenotip UW-19 grubuna göre daha az biliniyordu (P < .01). Altı köpek hastaneye yatıştan önce lenfoma nedeniyle kısa bir süre kortikosteroid almıştır (<2 hafta) ve ek olarak 2 köpek lenfoma dışındaki nedenlerle kronik olarak kortikosteroid kullanmıştır.
Reindüksiyon protokolü
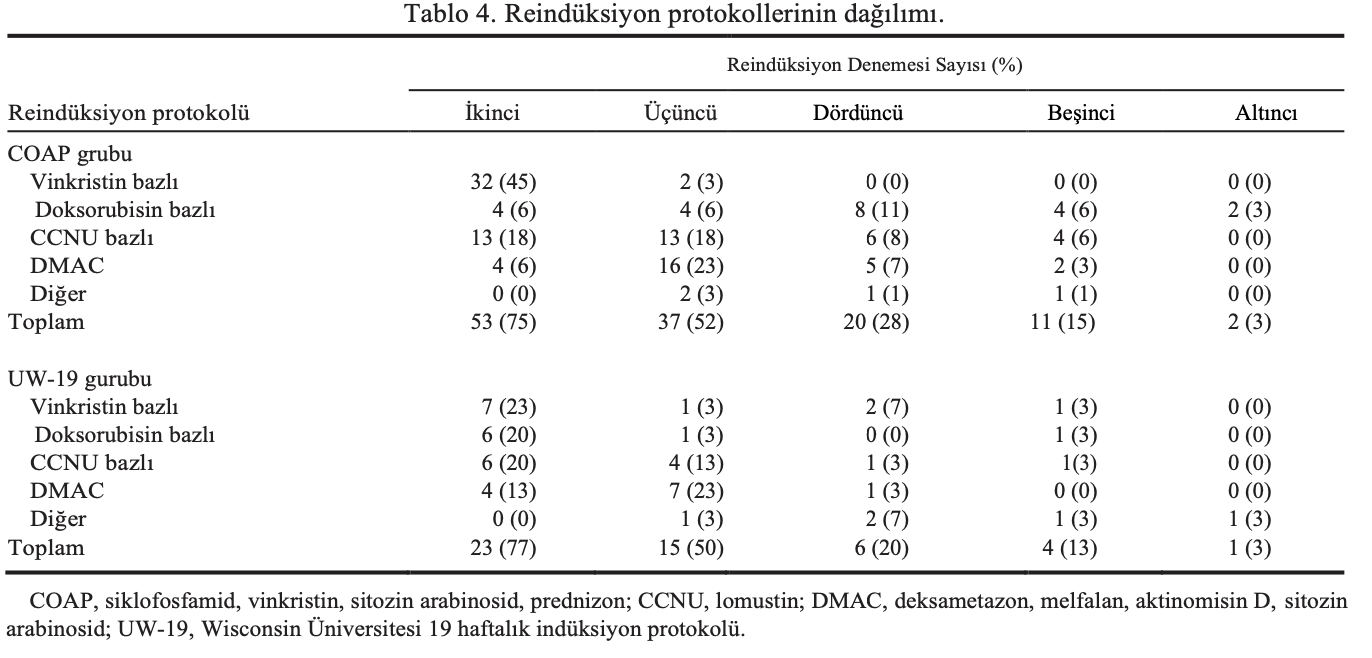
COAP grubundaki 18 köpek (%25) ve UW-19 grubundaki 7 köpek (%23) reindüksiyon kemoterapisi almamıştır. COAP grubunda 2., 3., 4., 5. ve 6. indüksiyon kemoterapisi uygulanan köpeklerin yüzdesi sırasıyla 75, 52, 28, 15 ve %3; UW-19 grubunda ise sırasıyla 77, 50, 20, 13 ve %3’tür (Tablo 4). COAP ve UW-19 grupları arasında bu reindüksiyon kemoterapi protokollerini alan köpeklerin oranı açısından bir fark yoktu (P = .79).
İlk Remisyon Süresi
COAP grubundaki ilk tedavi yanıtı 43 köpekte (%61) Tam Yanıt (CR), 22 köpekte (%31) Kısmi Yanıt (PR), 2 köpekte (%3) Stabil Hastalık (SD) ve 4 köpekte (%6) Progresif Hastalık (PD) olup Yanıt Oranı (RR) %92’dir. UW-19 grubunda ilk yanıt 23 köpekte (%77) CR ve 7 köpekte (%23) PR olup RR %100’dür.
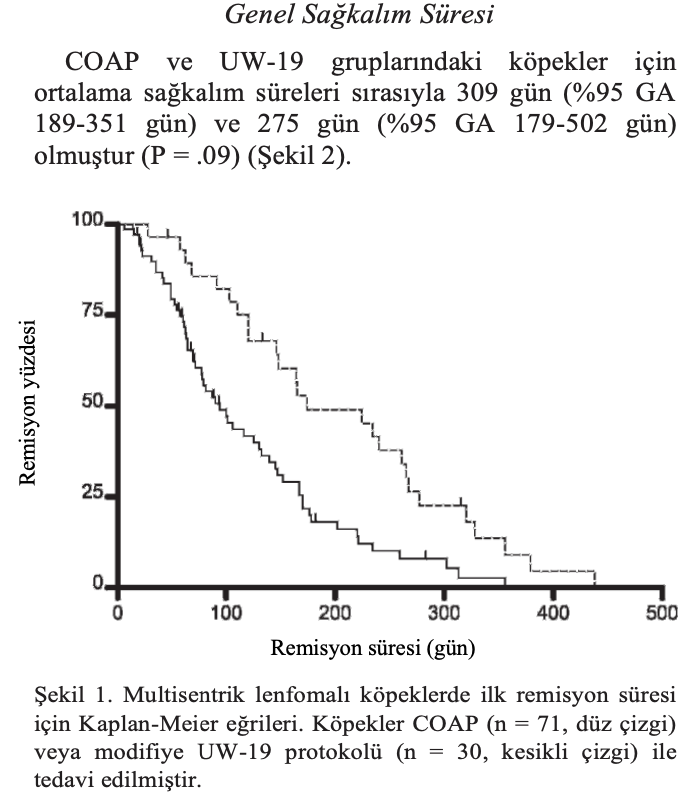
Gruplar arasında CR oranı veya RR açısından anlamlı bir fark bulunmamıştır (sırasıyla P = .17 ve .18). Bununla birlikte, ortalama ilk remisyon süresi COAP grubunda 94 gün (%95 GA 69-132 gün) iken UW-19 grubunda 174 gün (%95 GA 120-265 gün) ile bu süre istatistiki olarak anlamlı derecede daha kısaydı (P < .01) (Şekil 1). DSÖ klinik evresi (I-IV’e kıyasla V) çok değişkenli Cox orantılı tehlikeler modelinde önemli bir karıştırıcı değişken olarak tanımlanmıştır (Tablo 5). DSÖ klinik evresi belirlendikten sonra, COAP grubundaki köpeklerin UW-19 grubundaki köpeklere kıyasla 2,6 kat daha yüksek nüks riskine sahip olduğu görülmüştür (%95 GA 1,6-4,4, P < .01).
COAP grubu için 1 ve 2 yıllık sağkalım oranları sırasıyla %32 ve %0’dır. UW-19 grubu için 1 ve 2 yıllık sağkalım oranları sırasıyla %45 ve %17’dir. Sadece B- hücreli lenfomalı köpekler karşılaştırıldığında sonuçlar benzerdi (veriler gösterilmemiştir). COAP grubu içindeki T ve B hücreli lenfomalar (sırasıyla n = 11 ve 24) karşılaştırıldığında, immünofenotipler arasında sağkalım süresi açısından anlamlı bir fark bulunmamıştır (B hücresi, 321 gün; T hücresi, 378 gün; P = .58). B ve T hücreli lenfomalı köpeklerde sağkalım sürelerinin karşılaştırılması UW-19 grubunda yapılmamıştır, çünkü grupta T hücreli lenfomalı sadece 1 köpek bulunmaktadır.
Çok değişkenli Cox orantılı tehlikeler modelinde DSÖ klinik evresi (I-IV, V’e avantaj sağlar), cinsiyet (dişi, erkeğe avantaj sağlar), yaş (genç köpekler, yaşlı köpeklere avantaj sağlar) ve reindüksiyon sırasında doksorubisin kullanımı (reindüksiyon aşamasında herhangi bir zamanda doksorubisin alan köpekler almayanlara avantaj sağlar) önemli karıştırıcı değişkenler olarak tanımlanmıştır (Tablo 5). Bu karıştırıcılar hesaba katıldıktan sonra, COAP grubundaki köpeklerin UW-19 grubundaki köpeklere kıyasla 1,9 kat daha yüksek ölüm riskine sahip olduğu bulunmuştur (%95 GA 1,1-3,4, P = .03).
Şekil 2. Multisentrik lenfomalı köpeklerin sağkalım süreleri için Kaplan-Meier eğrileri. Köpekler COAP (n 5 71, düz çizgi) veya modifiye UW-19 protokolü (n 5 30, kesikli çizgi) ile indüklenmiştir. İlk nüksetmeden sonra çeşitli protokoller kullanılmıştır.
ooxikcsoiseitse
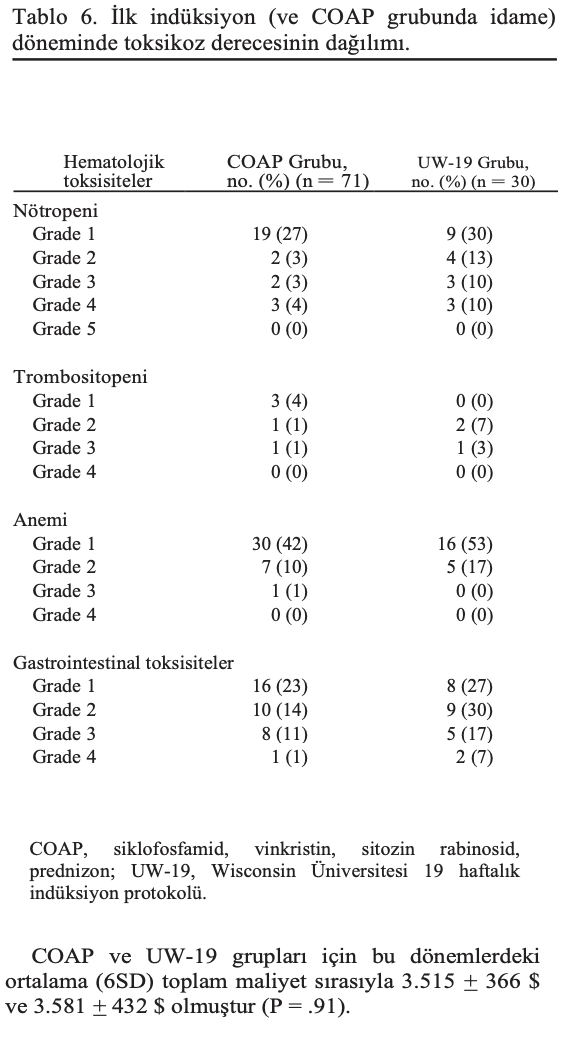
Ortalama nötropeni ve gastrointestinal toksikoz dereceleri UW-19
grubunda anlamlı olarak daha yüksekti (sırasıyla P = .01 ve P < .01) (Tablo 6). Hematolojik toksikozlar > grade 3 COAP grubunda 7 köpekte (%10) ve UW-19 grubunda 7 köpekte (%23) meydana gelmiştir. Gastrointestinal toksikozlar > grade 3 COAP grubunda 9 köpekte (%13) ve UW-19 grubunda 7 köpekte (%23) meydana gelmiştir. Diğer toksikozlar arasında COAP grubunda akut tümör lizis sendromu (1 köpek) ve UW-19 grubunda hemorajik sistit (2 köpek) ve akut tümör lizis sendromu (1 köpek) yer almıştır. İki grup arasında > grade 3 nötropeni (P = .08), trombositopeni (P = .15) ve > grade 3 gastrointestinal toksikozların (P = .23) sıklığındaki farklılıklar istatistiksel olarak anlamlı değildi.
Maliyet Analizi
COAP grubundaki 34 köpek ve UW-19 grubundaki 22 köpek, indüksiyon protokolünün başlangıcından nihai hastalık ilerlemesine veya takibin sonlandığı tarihe kadar OSU-VTH’de tüm tedavi ve toksikoz tedavilerini almıştır. UW-19 grubundaki iki köpeğin toplam remisyon süreleri (794 ve 1102 gün) son derece uzundu ve maliyet karşılaştırmasından çıkarıldılar. Kalan köpekler için, COAP ve UW-19 gruplarının ortalama (+SD) tüm remisyon süresi (veya takip süresi) sırasıyla 197 + 26 gün ve 243 + 37 gündü (P = .30).
Tartışma
Bu çalışmada, aynı zaman diliminde tek bir kurumda remisyon indüksiyonu için COAP ve LMP idame kemoterapisi veya idamesiz UW-19 protokolü ile indüklenen çok merkezli lenfomalı 2 grup köpek karşılaştırılmıştır. İlk indüksiyon protokolü olarak UW- 19 protokolünün kullanılması, COAP protokolü ve LMP idamesi ile tedavi edilen köpeklere kıyasla daha uzun bir ilk remisyon süresi ve önemli bir sağkalım avantajı sağlamıştır. Bununla birlikte, UW-19 protokolü ile nötropeni ve gastrointestinal toksikozların şiddeti COAP protokolüne göre önemli ölçüde daha yüksekti.
Hasta popülasyonu bu çalışmadaki 2 grup arasında karşılaştırılabilirdi; ancak, ilk indüksiyon protokolünün seçimi kısmen klinisyen tercihine göre belirlenmiş olsa da, hasta seçiminde bazı potansiyel sapmalar söz konusudur. Örneğin, mali kısıtlamaları olan veya evcil hayvanları için kemoterapi alma konusunda emin olmayan hasta sahipleri, indüksiyon olarak UW-19 protokolü yerine COAP protokolünü seçme eğiliminde olabilir. Ayrıca, bazı klinisyenler göz, MSS veya her ikisinin de tutulumu olan veya hiperkalsemisi olan köpekler için COAP protokolünü tercih etmektedir.
Ayrıca, bu süre zarfında, kayıt için UW-19 ile indüksiyon gerektiren bir klinik çalışma devam etmekteydi ve T hücreli lenfomalı veya hiperkalsemili köpekler daha yaygın olarak COAP ile tedavi edilmekteydi.
Tarihsel olarak T-hücresi fenotipine sahip köpeklerin prognozunun kötü olduğu bildirildiğinden, bu seçim yanlılığı remisyon ve sağkalım verilerini UW-19 grubu lehine çarpıtmış olabilir; ancak, immünofenotiplemenin mevcut olduğu hayvanlarda COAP grubundaki fenotipler arasında remisyon süresi ve sağkalım süresi eğrileri farklı değildi.22,31-34 Evreleme yöntemlerindeki farklılıklar 2 gruptaki DSÖ klinik evre dağılımını etkilemiş olabilir; UW-19 grubundaki köpeklerde batın ultrasonu ve toraks röntgeni daha yaygın olarak yapılmıştır ve bu da hekimlerin bireysel tercihlerini yansıtmaktadır. Bununla birlikte, bu farklılığın remisyon ve sağkalım verileri üzerinde herhangi bir etkisi olması muhtemel değildir, çünkü III. ve IV. evre lenfomalı köpekler tarihsel olarak aynı prognoza sahiptir ve COAP grubunda sadece 1 köpek toraks röntgeni ve batın ultrasonu sonuçları olmadan I. evre olarak sınıflandırılmıştır.17,35 V. evre vakaların çoğu toraks grafilerinde veya batın ultrasonunda saptanan ekstranodal tutulum nedeniyle bu şekilde sınıflandırıldığından, Cox orantılı tehlikeler modeli V. evre sınıflandırması olarak yalnızca kemik iliği tutulumu ile tekrarlanmış ve sonuçlar benzer bulunmuştur (veriler gösterilmemiştir).
Son olarak, köpeklerin yalnızca bir muayenehanede, özellikle de üçüncü basamak sağlık hizmeti veren bir hastanede değerlendirilmesi, dahil edilen vaka türlerinin uzmanlık alanı dışında kalan genel bir muayenehanede tedavi gören lenfomalı köpekler için standart olmadığı sonucuna varılabilir.
Bu çalışmada COAP ve UW-19 protokolleri için ilk remisyon süreleri ve sağkalım süreleri genellikle aynı protokolleri kullanan daha önce yayınlanmış çalışmalarla tutarlıydı, ancak UW-19 protokolü için ilk remisyon süresi ve sağkalım süresi Wisconsin protokolünün diğer versiyonları için bildirilenden biraz daha kısaydı.4,9,14,15 UW-19 protokolünün kullanıldığı bir başka retrospektif çalışmada, ilk remisyon süresi ve genel sağkalım süresi sırasıyla 206 ve 310 gün olup bu çalışmayla karşılaştırılabilir.15 İlk remisyon süresi kemoterapi indüksiyonunun başlangıcından nükse kadar hesaplanmıştır. COAP protokolüne (8 hafta) kıyasla oldukça uzun (19 hafta) olması nedeniyle UW-19 protokolünde remisyon süreleri daha uzun olsa da, indüksiyon protokolünün tamamlanmasından sonraki medyan remisyon süresi 2 protokolde de benzerdir (COAP protokolünde 44 gün ve UW-19 protokolünde 48 gün).
Hayatta kalma süresinin karşılaştırılması, kullanılan çeşitli reindüksiyon protokolleri nedeniyle karmaşıktır ve bu nedenle bu veriler yorumlanırken dikkatli olunmalıdır. Tüm köpekler aynı zaman diliminde aynı klinisyen grubu tarafından tedavi edildiğinden ve reindüksiyon uygulanan köpeklerin oranında veya kullanılan reindüksiyon protokollerinin türünde herhangi bir farklılık olmadığından, bunun geçerli bir karşılaştırma olduğuna inanıyoruz. Tek değişkenli analizde ortanca sağkalım süreleri COAP ve UW-19 grupları arasında anlamlı farklılık göstermemiştir.
Aslında, sağkalım eğrileri yaklaşık 300 güne kadar neredeyse aynıydı, ancak 1 ve 2 yıllık sağkalım oranları UW-19 grubunda COAP grubundan daha yüksekti. Ayrıca, veriler önemli karıştırıcılara (yaş, cinsiyet, reindüksiyon sırasında doksorubisin kullanımı ve WHO klinik evresi) göre ayarlandığında, COAP grubundaki köpeklerin ölüm riski UW-19 grubundaki köpeklere göre önemli ölçüde daha yüksekti. Cinsiyet ve WHO klinik evresinin diğer çalışmalarda da prognostik faktörler olduğu bildirilmiştir.3,4,19,20,36 Bu bulgular, başlangıç indüksiyon protokolü seçiminin sağkalım üzerindeki etkisinin köpeklerin çoğunluğu için nispeten küçük olmasına rağmen, başlangıç indüksiyonu için UW-19 protokolü ile tedavi edilen köpeklerin bir kısmının uzun vadeli sağkalım avantajına sahip olduğunu gösterebilir. Bu hipotezi test etmek için daha fazla çalışma yapılması gerekmektedir.
Gastrointestinal toksikozun retrospektif olarak değerlendirilmesi dikkatli bir yorum gerektirse de, >3. derece hematolojik veya gastrointestinal toksikozların sıklığı 2 indüksiyon protokolü arasında farklı değildi. Toksikoz sıklığının UW-19 protokolünde daha yüksek olması beklenirdi, ancak anlamlılık olmaması her iki protokolde de bu tür toksikoz sıklığının düşük olmasıyla açıklanabilir. Mevcut çalışmada 2 protokol arasındaki fark istatistiksel olarak anlamlı olmasa da, gerçek sıklık önceki çalışmalara benzerdir (COP tabanlı protokollerde %8,7 ve CHOP tabanlı protokollerde %17).9,17 >3. derece toksikozların sıklığı önemli ölçüde farklılık göstermese de, ortalama nötropeni ve gastrointestinal toksikoz derecesi UW-19 protokolünde COAP protokolüne göre önemli ölçüde daha yüksektir. Bu beklenen bir durumdur çünkü UW-19 protokolü doksorubisin içermektedir ve tedavi protokolü COAP protokolünden çok daha uzundur.
COAP protokolü başlangıçta daha düşük tedavi maliyetleri ve potansiyel olarak daha düşük toksikoz yönetim maliyeti ile ilişkili olsa da, COAP ile tedavi edilen köpeklerin çoğu, UW-19 ile tedavi edilen köpeklerden daha kısa sürede müteakip reindüksiyon protokollerini almıştır, bu nedenle toplam maliyet uzun vadede benzer hale gelmiştir. Aslında, her iki gruptaki köpekler genel olarak çok benzer tedavi görmüş, sadece tedavilerin sırası ve zamanlaması farklılık göstermiştir.
Köpeklerde lenfoma tedavisine yönelik her retrospektif çalışmada olduğu gibi, bu çalışmada da protokol seçimini etkileyen faktörler, sahibinin tedaviye bağlılığı ve mali hususlar, sunuma dayalı hayvan seçimi ve tutarsız olarak kullanılan reindüksiyon protokolleri gibi kontrol edilemeyen faktörler nedeniyle önyargılar mevcut olabilir. Bu nedenle, mevcut çalışmanın bulgularının aşırı ifade edilmemesine özen gösterilmelidir. Ayrıca, modellememizde kontrol edilmeyen başka karıştırıcıların olması da mümkündür. Bununla birlikte, modellerimiz COAP ile tedavi edilen köpeklerin, UW-19 protokolü ile indüklenen köpeklere göre nüks ve ölüm açısından yaklaşık 2 kat daha yüksek risk altında olduğunu göstermektedir. Lenfomalı köpeklerde indüksiyon protokolü ve idame kemoterapisinin sağkalım üzerindeki etkisini daha fazla değerlendirmek için gelecekte yapılacak randomize prospektif çalışmalara ihtiyaç vardır.
b CD 79a and BLA 36 B-cell markers, DAKO Corp, Carpinteria, CA
c Prism 4, GraphPad, Inc, San Diego, CA
d Stata version 9.1 (StataCorp, College Station, TX
Kaynakça
1. Dorn CR, Taylor DO, Schneider R. The epidemiology of canine leukemia and lymphoma. Bibl Haematol 1970;403–415.
2. MacEwen EG, Brown NO, Patnaik AK, et al. Cyclic combination chemotherapy of canine lymphosarcoma. J Am Vet Med Assoc 1981;178:1178–1181.
3. MacEwen EG, Hayes AA, Matus RE, et al. Evaluation of some prognostic factors for advanced multicentric lymphosarcoma in the dog: 147 cases (1978–1981). J Am Vet Med Assoc 1987;190:564–568.
4. Keller ET, MacEwen EG, Rosenthal RC, et al. Evaluation of prognostic factors and sequential combination chemotherapy with doxorubicin for canine lymphoma. J Vet Intern Med 1993;7:289– 295.
5. Myers NC, 3rd, Moore As, Rand WM, et al. Evaluation of a multidrug chemotherapy protocol (ACOPA II) in dogs with lymphoma. J Vet Intern Med 1997;11:333–339.
6. Valerius KD, Ogilvie GK, Mallinckrodt CH, et al. Doxoru- bicin alone or in combination with asparaginase, followed by cyclophosphamide, vincristine, and prednisone for treatment of multicentric lymphoma in dogs: 121 cases (1987–1995). J Am Vet Med Assoc 1997;210:512–516.
7. Khanna C, Lund EM, Redic KA, et al. Randomized controlled trial of doxorubicin versus dactinomycin in a multiagent protocol for treatment of dogs with malignant lymphoma. J Am Vet Med Assoc 1998;213:985–990.
8. Zemann BI, Moore AS, Rand WM, et al. A combination chemotherapy protocol (VELCAP-L) for dogs with lymphoma. J Vet Intern Med 1998;12:465–470.
9. Baskin CR, Couto CG, Wittum TE. Factors influencing first remission and survival in 145 dogs with lymphoma: A retrospective study. J Am Anim Hosp Assoc 2000;36:404–409.
10. Boyce KL, Kitchell BE. Treatment of canine lymphoma with COPLA/LVP. J Am Anim Hosp Assoc 2000;36:395–403.
11. Chun R, Garrett LD, Vail DM. Evaluation of a high-dose chemotherapy protocol with no maintenance therapy for dogs with lymphoma. J Vet Intern Med 2000;14:120–124.
12. Dobson JM, Blackwood LB, McInnes EF, et al. Prognostic variables in canine multicentric lymphosarcoma. J Small Anim Pract 2001;42:377–384.
13. Moore AS, Cotter SM, Rand WM, et al. Evaluation of a discontinuous treatment protocol (VELCAP-S) for canine lymphoma. J Vet Intern Med 2001;15:348–354.
14. Garrett LD, Thamm DH, Chun R, et al. Evaluation of a 6 month chemotherapy protocol with no maintenance therapy for dogs with lymphoma. J Vet Intern Med 2002;16:704–709.
15. MacDonald VS, Thamm DH, Kurzman ID, et al. Does L- asparaginase influence efficacy or toxicosis when added to a standard CHOP protocol for dogs with lymphoma? J Vet Intern Med 2005;19:732–736.
16. Frimberger AE, Moore AS, Rassnick KM, et al. A combination chemotherapy protocol with dose intensification and autologous bone marrow transplant (VELCAP-HDC) for canine lymphoma. J Vet Intern Med 2006;20:355–364.
17. Siedlecki CT, Kass PH, Jakubiak MJ, et al. Evaluation of an actinomycin-D-containing combination chemotherapy protocol with extended maintenance therapy for canine lymphoma. Can Vet J 2006;47:52–59.
18. Simon D, Nolte I, Eberle N, et al. Treatment of dogs with lymphoma using a 12-week, maintenance-free combination che- motherapy protocol. J Vet Intern Med 2006;20:948–954.
19. Cotter SM, Goldstein MA. Treatment of lymphoma and leukemia with cyclophosphamide, vincristine, and prednisone, I: Treatment of dog. J Am Anim Hosp Assoc 1983;19:159–165.
20. Carter RF, Withrow SJ, et al. Chemotherapy of canine lymphoma with histopathological correlation: Doxorubicin alone compared to COP as first treatment regimen. J Am Anim Hosp Assoc 1987;23:587–596..
21. Jeffreys AB, Knapp DW, Carlton WW, Thomas RM, et al. Influence of asparaginase on a combination chemotherapy pro- tocol for canine multicentric lymphoma. J Am Anim Hosp Assoc 2005;41:221–226..
22. Greenlee PG, Filipa DA, Quimby FW, et al. Lymphoma in dogs: A morphologic, immunologic, and clinical study. Cancer 1990;66:480–490..
23. Stone MS, Goldstein MA, Cotter SM. Comparison of two protocols for induction of remission in dogs with lymphoma. J Am Anim Hosp Assoc 1991;27:315–321..
24. Aquino SM, Hamor RE, Valli VE, et al. Progression of an orbital T-cell rich B-cell lymphoma to a B-cell lymphoma in a dog. Vet Pathol 2000;37:465–469.
25. Gibson D, Aubert I, Woods JP, et al. Flow cytometric immunophenotype of canine lymph node aspirates. J Vet Intern Med 2004;18:710–717.
26. Burnett RC, Vernau W, Modiano JF, et al. Diagnosis of canine lymphoid neoplasia using clonal rearrangements of antigen receptor genes. Vet Pathol 2003;40:32–41.
27. Owen LN. TNM classification of tumours in domestic animals, 1st ed Geneva; 1980:46–47..
28. Alvarez FJ, Kisseberth WC, Gallant SL, Couto CG. Dexamethasone, melphalan, actinomycin D, cytosine arabinoside
(DMAC) protocol for dogs with relapsed lymphoma. Journal of Veterinary Internal Medicine 2006;20:1178–1183..
29. Veterinary co-operative oncology group common terminol- ogy criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineoplastic therapy in dogs and cats v1.0. Vet Comp Oncol 2004;2:194–213..
30. Cleves MA, Gould WW, Gutierrez RG. An Introduction to Survival Analysis Using Stata.Revised ed. College Station, TX: Stata Press; 2004:175–190.
31. Vail DM, Kisseberth WC, Obradovich JE, et al. Assessment of potential doubling time (Tpot), argyrophilic nucleolar organizer regions (AgNOR), and proliferating cell nuclear antigen (PCNA) as predictors of therapy response in canine non-Hogikin’s lymphoma. Exp Hematol 1996;24:807–815.
32. Ruslander DA, Gebhard DH, Tompkins MG, et al. Immunophenotypic characterization of canine lymphoproliferative disorders. In Vivo 1997;11:169–172.
33. Appelbaum FR, Sale GE, Storb R, et al. Phenotyping of canine lymphoma with monoclonal antibodies directed at cell surface antigens: classification, morpholoty, clinical pre- sentation and response to chemotherapy. Hematol Oncol 1984;2: 151–168.
34. Teske E, van Heerde P, Rutteman GR, et al. Prognostic factors for treatment of malignant lymphoma in dogs. J Am Vet Med Assoc 1994;205:1722–1728.
35. Vail DM, MacEwen EG, Young KM. Canine lymphoma and lymphoid leukemias. In: Withrow SJ, MacEwen EG, eds. Small Animal Clinical Oncology. 3rd ed. Philadelphia, PA: WB Saunders; 2000:558–590.
36. Jagielski D, Lechowski R, Hoffmann-Jagielska M, et al. A retrospective study of the incidence and prognostic factors of multicentric lymphoma in dogs (1998–2000). J Vet Med A Physiol Pathol Clin Med 2002;49:419–424.