1) Küçük Hayvan İç Hastalıkları Laboratuvarı, Azabu Üniversitesi, 1-17-71 Fuchinobe, Chuo-ku, Sagamihara, Kanagawa 252-5201, Japonya
2)Azabu Üniversitesi Veteriner Eğitim Hastanesi, Azabu Üniversitesi, 1-17-71 Fuchinobe, Chuo-ku, Sagamihara, Kanagawa 252-5201, Japonya
3)Shoko Hayvan Hastanesi, 407-8 Shinzen-cho, Soka, Saitama 340-0054, Japonya
4)Klinik Tanı Laboratuvarı, Azabu Üniversitesi, 1-17-71 Fuchinobe, Chuo-ku, Sagamihara, Kanagawa 252-5201,
Japonya
ÖZET: Nonrejeneratif anemi ve trombositopenisi olan 5 yaşındaki dişi kediye, periferik kan ve kemik iliği (BM) incelemesinde çeşitli displaziler ve %19 blast oranı tespit edilmesi nedeniyle miyelodisplastik sendrom (MDS) tanısı konuldu. Azasitidin (AZA; 70-35 mg/m2, 3-5 gün, üç kür) ile kemoterapi ve prednizolon, antibiyotik ve K2 vitamini ile tedavi ve kan transfüzyonu uygulandı. 106. günde, BM’de blast hücreleri ve displazi azalmış ve kedi en az 1.474 gün hayatta kalmıştır. Bu rapor, AZA ile tedavi edilen kedi MDS’si ile ilgili ilk rapor olup, uygun ilaç dozu, aralığı ve etkili kombinasyonun araştırılması ve gelecekte farmakolojik ve hücre biyolojik mekanizmalarının aydınlatılması gerektiğini göstermektedir.
ANAHTAR KELİMELER kedi, kemoterapi, lösemi, miyelodisplazi, sağkalım süresi
J. Vet. Med. Sci.
84(1): 142–148, 2022
doi: 10.1292/jvms.20-0352
Sunum: 10 Haziran 2020 Kabul: 12 Nisan 2021 Epub: 6 Aralık 2021
Miyelodisplastik sendrom (MDS), prelösemi evresinde heterojen bir hastalık olarak karakterize edilir ve henüz etkili tedaviler geliştirilememiştir [8, 9, 11, 23, 25]. Veterinerlik alanında, MDS ve akut miyeloid lösemi (AML), kedi lösemi virüsü (FeLV) ile enfekte olmuş genç ve orta yaşlı kediler arasında görülen nadir hastalıklardır [2, 8, 10, 18, 23, 25]. Etkilenen kedilerde sıklıkla ateş, enerji kaybı, halsizlik, immün yetmezliğe bağlı fırsatçı enfeksiyonlar, lökopeni, nonrejeneratif anemi ve trombositopeni görülür ve sıklıkla akut lösemiye dönüşürler [8, 23, 25]. MDS’nin sitopenik patolojisi, hematopoetik kök hücrelerin klonal genişlemesinden ve belirgin şekilde azalmış diferansiyasyon ve olgunlaşma özelliklerinden kaynaklanır [10, 15, 16].
Kedi MDS’si için etkili bir tedavi rejimi geliştirilememiştir ve MDS’li kedilerin çoğu lösemi progresyonu, kısa sağkalım süresi ve kötü prognoz göstermektedir [8, 23-26]. Özellikle, önceki raporumuz yüksek riskli kedi MDS grubunun blast fazlalığı (RAEB), transformasyonda RAEB (RAEB in T) ile refrakter anemi (RA) olarak sınıflandırıldığını göstermiştir, ve Fransız-Amerikan-İngiliz (FAB) sınıflandırmasına göre kronik miyelomonositik löseminin (CMMoL) akut lösemiye dönüşme olasılığının daha yüksek ve prognozunun RA grubu da dahil olmak üzere düşük riskli gruplara göre daha kötü olması, RAEB’nin şimdiye kadar kullanılan tedavilere dirençli olduğunu düşündürmektedir [8, 11, 23, 25]. Önceki bazı raporlarda, MDS’li kediler kan transfüzyonu, antibiyotikler, prednizolon, siklosporin ve eritropoietin ile tedavi edilmiştir [8, 9, 25, 26]. Bu tedaviler destekleyici tedavilerdi, çünkü az sayıda spontan kedi MDS vakası nedeniyle kemoterapi kullanan ayrıntılı bir vaka raporu sunulmamıştır.
Bir metilasyon inhibitörü olan azasitidin (AZA), MDS’li insan hastalarda sağkalım süresini iyileştirebileceğini gösteren sonuçlar nedeniyle son zamanlarda dikkat çekmiştir [12-14, 17, 22]. Bu nedenle AZA, MDS için potansiyel bir terapötik aday olarak düşünülmektedir. AZA, sitidinin pirimidin halkasının 5-pozisyonundaki karbon atomunun bir nitrojen atomuna dönüştürüldüğü bir nükleozid analoğudur [13, 14]. 1960’larda sentezlenmiş ve AML tedavisi için bir sitarabin analoğu ve sitotoksik bir ajan olarak araştırılmıştır. Azasitidinin aktif formu hem RNA hem de DNA’ya bağlanır ve aktif olarak çoğalan hücrelerde RNA transkripsiyonu veDNA metiltransferaz I aktivitesi ile etkileşim yoluyla sitotoksik etkisini gösterir [13, 14, 22]. Son çalışmalar, bazı tümör baskılayıcı genlerin baskılanmasının hematolojik malignitelerin oluşumunda önemli bir rol oynadığını ve promotör bölgelerdeki anormal hipermetilasyonun bu genlerin epigenetik transkripsiyon mekanizmalarını etkilediğini öne sürmüştür [12-14]. Buna ek olarak, DNA metilasyonu ve transkripsiyonel düzenleme anormallikleri insan MDS’sinde yaygındır; bu nedenle, hipometillenmiş ilaçların dünya çapında MDS için yeni terapötik ajanlar olması beklenmektedir [12-14].
Veterinerlik alanında, AZA’nın kedi MDS’sinde kullanımını açıklayan herhangi bir çalışma rapor edilmemiştir ve sitopeniyi iyileştirme veya prognozu uzatmadaki klinikopatolojik etkileri bilinmemektedir. Bununla birlikte, spontan kedi tümörü vakalarında AZA tedavisi klinik veteriner hekimlikte henüz sunulmamıştır. Bununla birlikte, bazı çalışmalar in vitro olarak kedi lenfoid ve meme tümör hücre dizilerinde anti-metilasyon ve sitostatik etkiler göstermiştir, bu da AZA’nın insan tümörlerinde olduğu gibi köpek ve kedi tümörlerinde de terapötik potansiyele sahip olduğunu düşündürmektedir [5-7]. Bu nedenle, AZA uygulaması ile sitopenide iyileşme, kemik iliğinde (BM) blastlarda azalma ve uzun süreli sağkalım gösteren bir kedide MDS’nin klinikopatolojik bulgularını, klinik seyrini ve prognozunu sunuyoruz.
5 yaşında, 3,32 kg ağırlığında, kısırlaştırılmış dişi, American short hair kedi iştahsızlık, nonrejeneratif anemi ve trombositopeni şikayetleriyle Azabu Üniversitesi Veteriner Eğitim Hastanesi’ne sevk edilmiştir. Kedi 14 gün boyunca kan transfüzyonu (40 ml/kedi), prednizolon (2 mg/kg/gün, PO), doksisiklin (5 mg/kg, günde bir kez [SID], PO) ve vitamin K2 analoğu menatetrenon (2 mg/kg, günde iki kez [BID], PO) ile tedavi edilmiş, ancak sitopeni devam etmiştir. Fizik muayenede anemiye bağlı sistolik üfürüm, oküler ve oral mukozal solukluk ve vücut kondisyon skoru 3 (BCS 3) olarak tespit edildi. Sistemik lenf nodu şişmesi gözlenmedi.
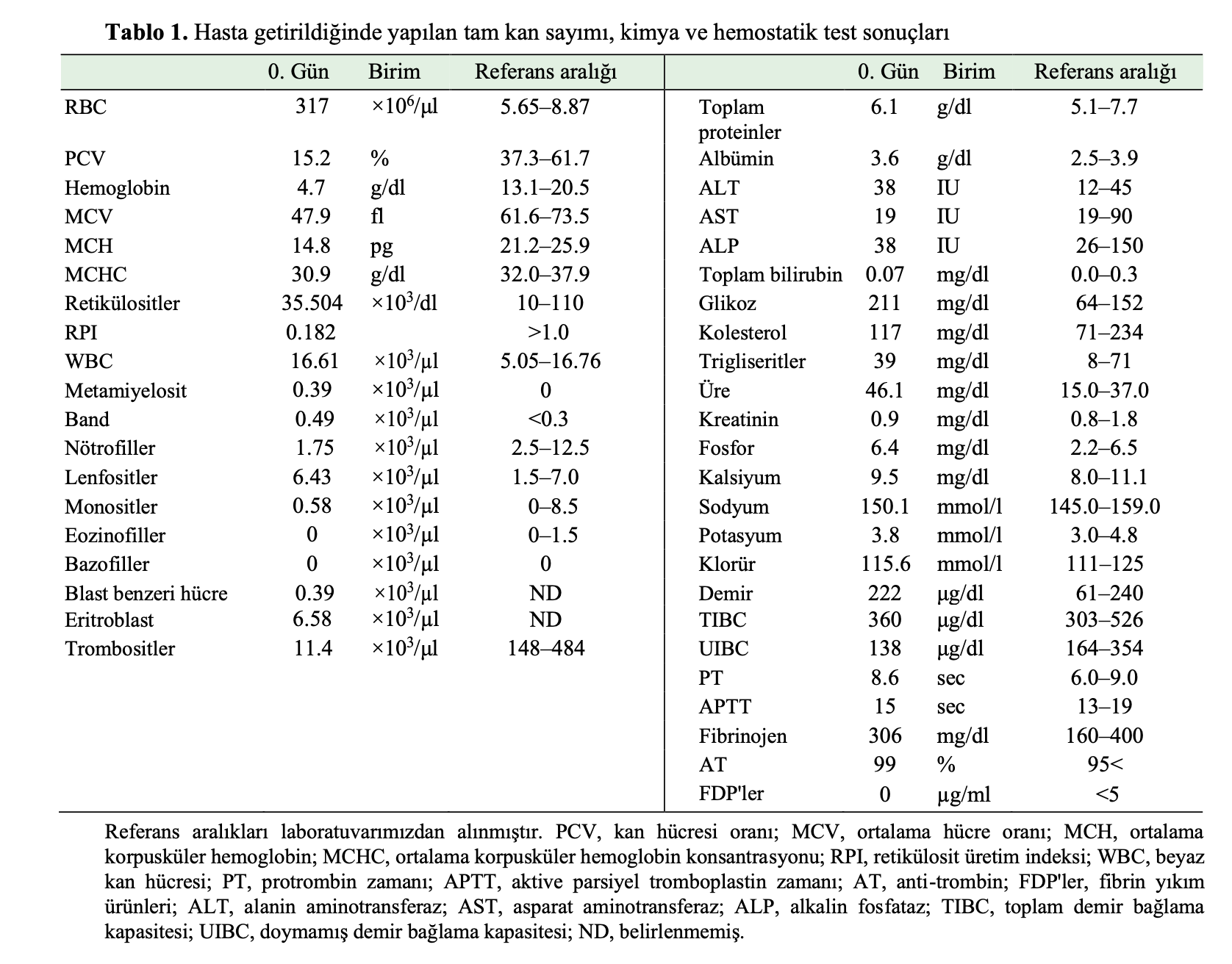
Hastanın fizik muayenesinde ateş (40°C) tespit edilmiştir. Tam kan sayımı (CBC) sonuçları (Sysmex XT2000, Kobe, Japonya) şiddetli nonrejeneratif anemi; kırmızı kan hücresi (RBC): 3,17 × 106/μl, hemoglobin (Hb) düzeyi: 4,7 g/dl, kan hücresi oranı (PCV): %15.2, retikülosit yüzdesi: %1.12 ve trombositopeni (trombosit sayısı: 114 × 103/μl) (Tablo 1) ortaya koymuştur. Beyaz kan hücresi (WBC) sayısı 16.650/μl idi ve diferansiyel lökogramda nötropeni ve belirlenemeyen hücre sayısında artış saptandı. Sonuçlar aşağıdaki gibiydi; bant nötrofil sayısı: 487/μl, segmente nötrofil sayısı: 1,753/μl, lenfosit sayısı: 6,426/μl, monosit sayısı: 84/μl, eozinofil sayısı: 97/μl, miyelosit sayısı: 390/μl, eritroblast sayısı: 6.580/μl ve blast benzeri belirsiz hücreler: 390/μl. Retikülosit sayısı 35.504/μl (%1,12) olduğu için kedi eritroid rejenerasyon eksikliği göstermiştir. Wright Giemsa ile boyanan periferik kan yaymalarının sitolojik analizi, eritrosit rejenerasyonu olmayan eritroblastlar, megaloblastoid değişiklikler, eritroblastların nükleositoplazmik olgunlaşma uyumsuzluğu, yalancı Pelger-Huët anomalisi ve mikromegakaryositler dahil olmak üzere MDS’nin karakteristik displazilerini ortaya çıkardı (Şekil 1). Periferik kanda miyeloblastlardan metamiyelositlere kadarolgunlaşmanın her aşamasında birkaç eritroblast ve hematopoetik hücre mevcuttu. Plazma kimyası (Cobas®6000, Roche Diagnostics K.K., Tokyo, Japonya) hafif azotemi (üre: 46,1 mg/dl) ve hiperglisemi (glukoz: 211 mg/dl) gösterdi (Tablo 1). Protrombin zamanı, aktive parsiyel tromboplastin zamanı, antitrombin aktivitesi ve fibrin yıkım ürünü seviyelerinin ölçümlerini içeren koagülasyon ve fibrinoliz incelemelerinin sonuçları normaldi (COAGE2V, HITACHI, Tokyo, Japonya). Torasik ve abdominal radyografiler ve abdominal ultrasonografi bulgularında herhangi bir farklılık yoktu.
Demir eksikliği anemisi ve anemiye bağlı kronik hastalık dışlanarak serum demiri ve doymamış demir bağlama kapasitesi (DBBK) incelemeleri yapıldı (Tablo 1). Serum demir düzeyi 222 μg/dl, Total Demir Bağlama Kapasitesi (TIBC) 360 μg/dl olup demir eksikliği anemisi ve anemiye bağlı kronik hastalık olasılığının düşük olduğunu göstermiştir. Test kiti (SNAP FIV/FeLV Combo Test, IDEXX, Westbrook, ME, ABD) ile yapılan FeLV antijen ve kedi immün yetmezlik virüsü (FIV) antikor testleri negatif sonuç vermiştir. Ayrıca, periferik kan kullanılarak ticari bir laboratuvarda kedi hemotropik mikoplazmaları için gerçek zamanlı PCR yapılmıştır. Latent retrovirüs enfeksiyonunun tespiti için, BM numunesinde FeLV ve FIV provirüsünün PCR testi ticari bir laboratuvar (IDEXX laboratuvarı) tarafından gerçekleştirilmiştir. Tüm PCR incelemelerinin bulguları negatifti.
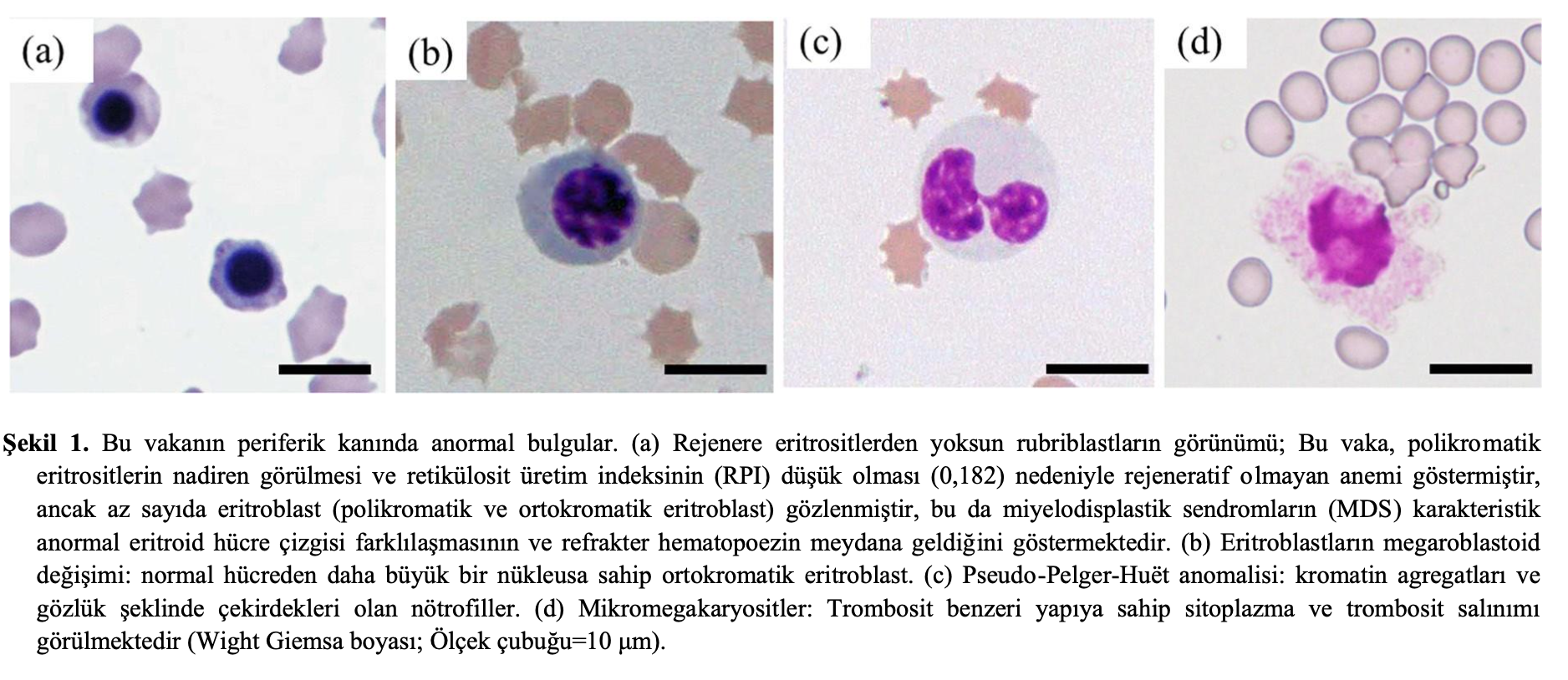
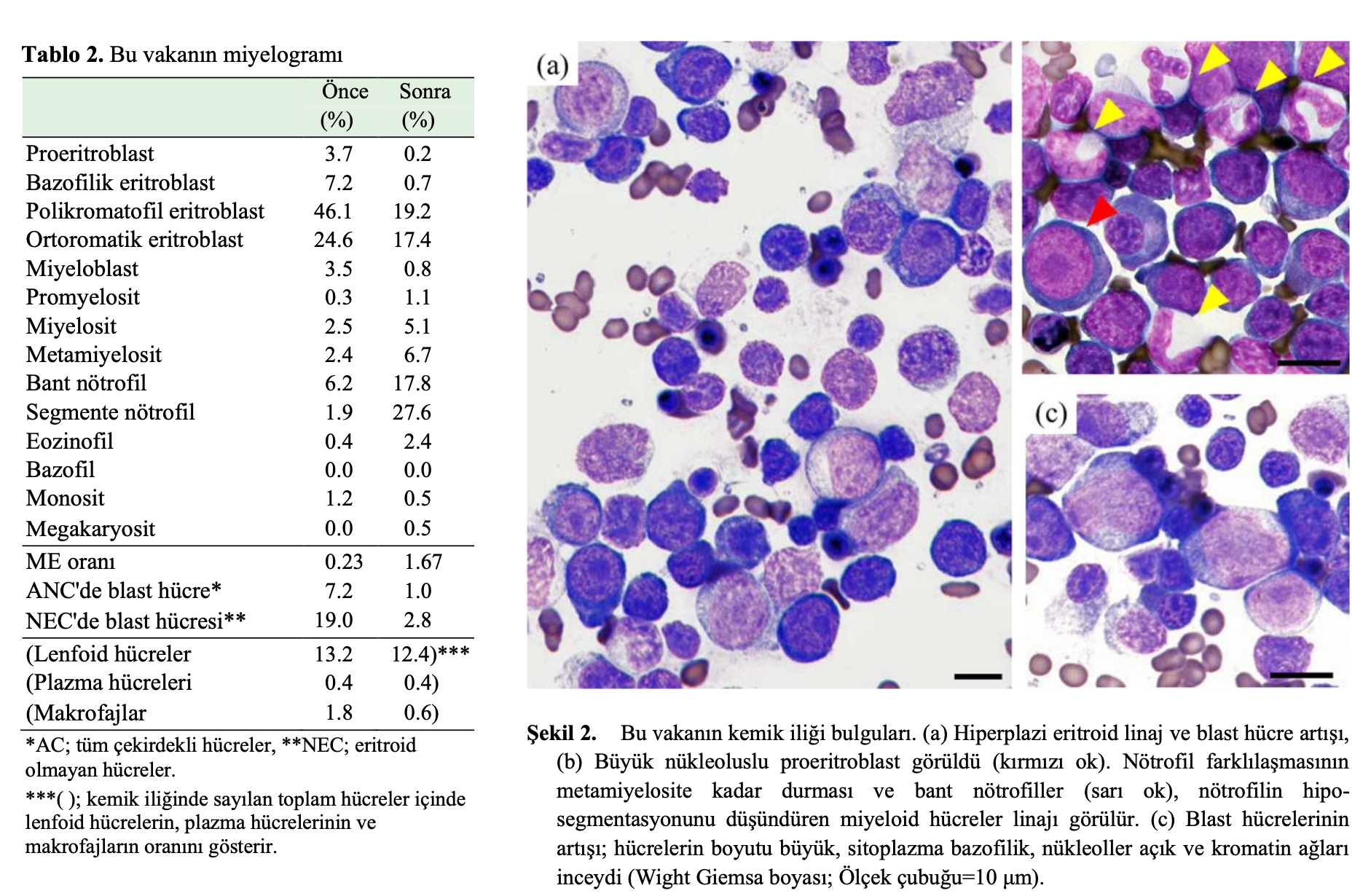
İlk başvuru tarihinden on sekiz gün önce, hayvan kliniğinde BM aspirasyonu gerçekleştirilmiştir. Rejeneratif olmayan aneminin altında yatan potansiyel mekanizmayı daha fazla araştırmak ve BM dokusunun durumunu değerlendirmek için sağ humerus ve sol femurdan BM örnekleri aspire edildi. Kemik iliği örneği sevk eden veteriner hekim tarafından gönderilmiş ve ACVP kurul sertifikalı bir veteriner klinik patolog BM yaymalarının sitolojisini değerlendirmiştir. Sağ humerus ve sol femurdan alınan çok sayıda BM yayması üzerinde 500 hücre diferansiyel sayımı yapıldı. Tüm yaymalar hemen hemen aynı bulguları gösterdi. BM değerlendirmeleri, miyeloblastlar ve eritroblastlar dahil olmak üzere blast sayısında artış ile hiperplazi gösterdi (Şekil 2). Miyelografi, eritroid hiperplazi, nötrofillerin hipo-segmentasyonu ve miyeloid hücre farklılaşması ve olgunlaşmasının durması ile miyeloid eritroid (M:E) oranının 0,23 olduğunu ve tüm çekirdekli hücreler ve eritroid olmayan hücrelerdeki blast oranının sırasıyla %7,2 ve %19,0 olduğunu ortaya koydu (Tablo 2). Blast hücre artışı ve displaziyi düşündürecek bulgular gözlenmesine rağmen kemik iliğinde kesin displastik değişikliklere rastlanmamıştır. Ayrıca, kemik iliğinde makrofajlar tarafından hemofagositoz bulunmadığı için herhangi bir immünolojik yıkıma dair kesin bir bulgu gösterilememiştir. Hematolojik hastalıklar, rejeneratif olmayan immün aracılı anemi (NRIMA), immün aracılı nötropeni (IMN) ve edinilmiş amegakaryositik trombositopeni (AAMT), aşağıdaki nedenlerden dolayı dışlanmıştır. 1) Kemik iliğinde patogenezin eritroleukemi olarak düşünüldüğünü gösteren blast hücrelerinin artışı, 2) Periferik kan yaymasında kesin anormal eritroblast olgunlaşması; eritroid hematopoezin son ürünü olan polikromatik eritrositlerde artış olmaksızın eritroblastik hücrelerin görünümü, 3) Periferik kanda miyeloid, eritroblast ve megakaryosit hücre soylarında MDS’nin tipik ve belirgin displazisi görüldü. Bu olgunun patogenezinin minimum displazi ile eritrolöseminin lösemi öncesi evresi olduğu düşünülmüştür.
FAB sınıflandırması temelinde, bu kediye MDS-RAEB tanısı konmuştur [11, 25]. Bu kediye hastanemize ilk kabulünden önce 14 gün boyunca prednizolon ve menatetrenon uygulaması ve kan transfüzyonu içeren bir tedavi protokolü uygulanmış ve bu tedavilerin sitopeniyi iyileştirmede ve remisyonu kolaylaştırmada yetersiz kaldığı belirtilmiştir. Hastanın önceki tedaviye refrakter olduğunu düşündük ve hasta sahibine aşağıdaki açıklamayı yaptık: 1) MDS-RAEB önceki kanıtlara dayanarak kötü bir prognoza sahiptir, 2) prednizolon ve menatetrenon tedavilerine zayıf yanıt vermiştir ve 3) AZA’nın yan etkileri ve kedi MDS’si için terapötik etkileri belirsizliğini korusa da, AZA insan MDS hastaları için kanıtlara dayanarak MDS-RAEB için etkili olabilir. Tedavi öncesinde, hasta sahibi AZA’nın etkinliği ve yan etkileri hakkında yeterli bilgilendirilmiş onam vermiş ve bu ilacın kullanılmasına rıza göstermiştir.
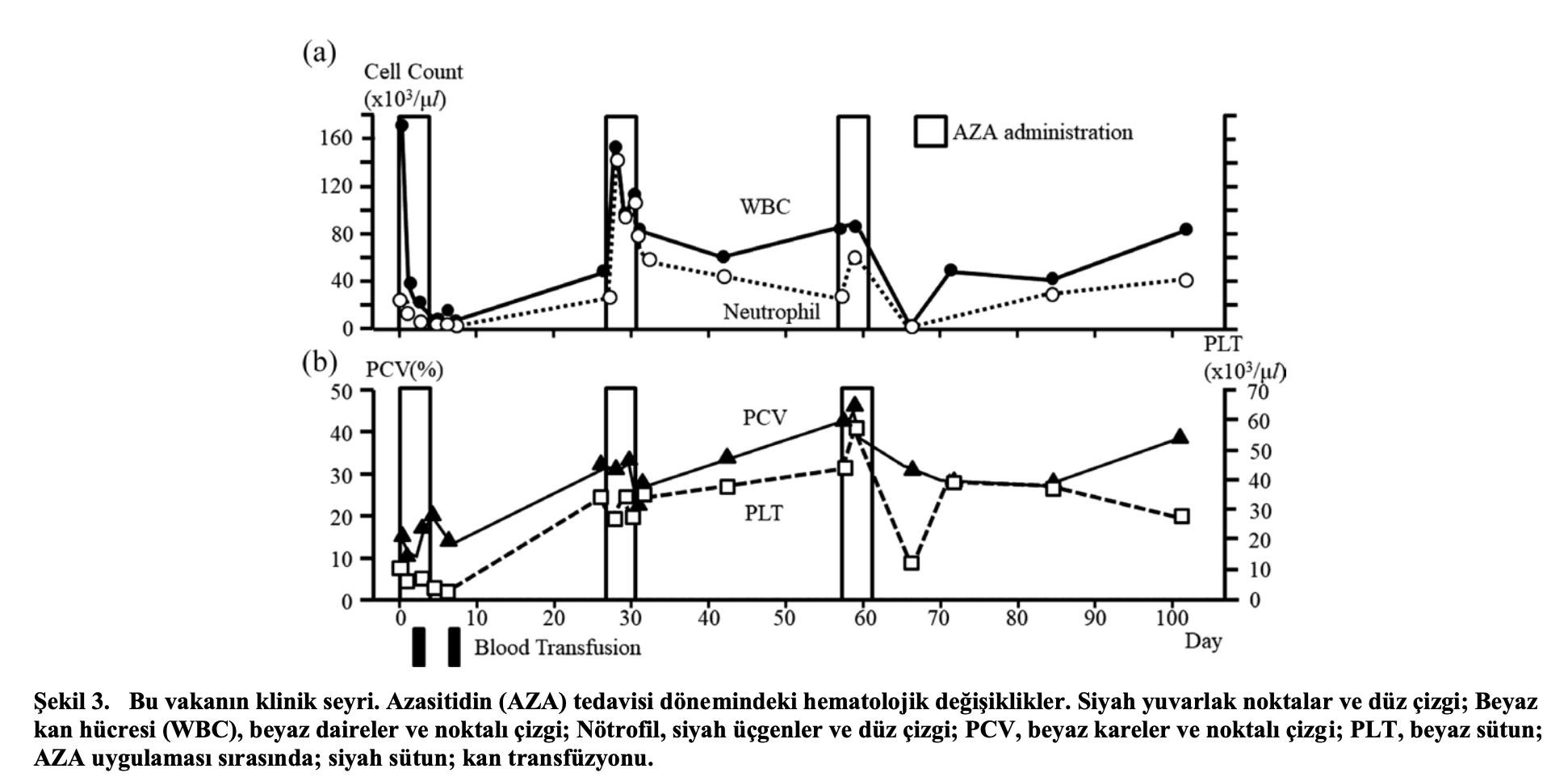
Tedavide AZA (Vidaza, Nihon Shinyaku, Kyoto, Japonya) 35-70 mg/m2 SID, SC, bir döngüde 3-5 gün süreyle uygulanmış ve toplam üç döngü gerçekleştirilmiştir (Şekil 3). Ek olarak, kortikosteroid tedavisi (prednizolon; 2 mg/kg, SID, SC), antibiyotik uygulaması (enrofloksasin; 2,5 mg/kg, SID, SC), menatetrenon; 2 mg/kg, BID, SC, antiemetik tedavi (omeprazol ve maropitant; sırasıyla 1 mg/kg, SID, SC) ve tam kan transfüzyonu (40 ml/1 kedi) gerektiği şekilde uygulandı. AZA 70 mg /m2 dozunda uygulandı ve kedide hareketlilikte azalma, kusma ve ishal meydana geldi (1. gün).
Aynı miktarda AZA uygulandı ve 2. günde sitopeninin ilerlemesiyle birlikte ( Beyaz kan hücresi sayısı: 4.000/ μl, nötrofil sayısı: 1.230/μl, PCV: %12, trombosit sayısı: 102 × 103/μl) kusma görüldü. Periferik kan yaymalarında miyeloblastlar ve rubrisitler kayboldu. Antibiyotik ve granülosit-koloni uyarıcı faktör (G-CSF) (filgrastim: 1.0 mg/kg, SID, SC, 7 kez) kombinasyonu uygulandı. AZA dozu, lökopeni ( Beyaz kan hücresi sayısı: 2,860/μl), nötropeni (nötrofil sayısı: 180/μl), kusma, ishal ve şiddetli sitopeni gibi yan etkiler nedeniyle 3. günde 35 mg/m2’ye düşürüldü. Daha sonra, 4. günde ateş kayboldu (38,6°C) ve sindirim semptomları da kayboldu. Ancak nötropeni devam etti (nötrofil sayısı aralığı: 0 ila 160/μl) ve antibakteriyel ilaçlar ve G-CSF uygulamasına devam edildi. 8. günde Beyaz kan hücresi sayısı ve nötrofil sayıları sırasıyla 1.310/μl ve 150/μl idi ve sitopenide ilerleme görülmedi. Bu nedenle tam kan transfüzyonu (36 ml) yapıldı ve hasta hastaneden taburcu edildi.
Tam kan sayımı incelemesi 29. günde belirgin hematolojik iyileşmeler gösterdi: Beyaz kan hücresi sayısı 5.300/μl; nötrofil sayısı 2.430/μl; PCV %32,1; ve trombosit sayısı 340 × 103/μl. İkinci kür olarak, AZA 29. ve 32. günler arasında hastanede yatış sırasında uygulandı; AZA dozu 35 mg/m2’ye düşürüldü; ve ilaç üç kez (29., 31. ve 32. günlerde) uygulandı. 29. günde kusma ve ishal meydana geldi ve AZA uygulaması sırasıyla 31. ve 32. güne ertelendi. Hastanede yatış süresi boyunca, 35 mg/m2 AZA uygulamasının hematolojik yan etkileri görülmedi ve lökosit ve nötrofil sayıları sırasıyla 5.300 ila 14.780/μl ve 2.430 ila 3.680/μl idi. Hastanın 60. günde yapılan tam kan sayımında beyaz kan hücresi sayısının 7.010/μl ve nötrofil sayısının 2.500/μl olduğu görülmüştür. AZA tedavisinin üçüncü kürüne başlandı ve AZA 60. günden itibaren 3 ardışık gün boyunca 35 mg/m2 dozunda uygulandı. 63. günde, WBC (7.170/μl) ve nötrofil (5.640/μl) sayıları referans aralıkta olduğu ve sadece bir hafif ishal atağı görüldüğü için kedi taburcu edildi. Ancak 69. günde AZA’ya bağlı ciddi lökopeni ve anemi ortaya çıktı; WBC sayısı 600/μl ve PCV %28,9 idi. G-CSF (filgrastim: 1.0 mg/kg, SID, SC, 3 kez) ve antibiyotikler (enrofloksasin: 5 mg/kg, SID, SC) uygulandı ve 74. günde sitopeni düzeldi (WBC sayısı: 4,900/μl, PCV: %28.9 ve PLT sayısı: 410 × 103/μl). 106. günde hematolojik remisyon sağlanmıştır (Beyaz kan hücresi sayısı: 6.000/μl, nötrofil sayısı: 3.790/μl, PCV: %28,9 ve trombosit sayısı: 285 × 103/μl) . BM dokusunun durumunu doğrulamak ve daha fazla kemoterapiye ihtiyaç olup olmadığını belirlemek için BM incelemeleri yapılmıştır. Hiçbir diferansiyasyon veya normal hücre olgunlaşması anormalliği gözlenmediği ve BM’de displazi bulunmadığı için BM incelemesi tam remisyonu doğruladı (Tablo 2). AZA tedavisinden önce %19,0 olan blast oranı %2,8’e düşmüş ve eritroid hiperplazi (ME oranı: 0,23) de miyeloid hiperplaziye (ME oranı: 1,67) normalize olmuştur. Kedi sonunda sahibinin istekleri doğrultusunda hastanemizden başka bir yerde bulunan genel bir veteriner hastanesine nakledildi. Prednizolon ve menatetrenon almaya devam etti ve AZA uygulaması bittikten sonra en az 1.411 gün hayatta kaldı. AZA uygulamasından sonra hayatta kalma süresi en az 1.474 gündü. Hasta sahibi daha sonra hastaneyi ziyaret etmeyi bırakmıştır ve sonraki sonuç bilinmemektedir.
Bildiğimiz kadarıyla bu rapor, AZA uygulamasından sonra kedi MDS’sinde uzun süreli sağkalımı gösteren ilk rapordur. 1990- 2020 yılları arasında 50’den az olan sınırlı vaka sayısı nedeniyle bugüne kadar kedi MDS’si için standart bir tedavi rejimi sunulmamıştır [2, 8, 11, 23, 24, 26]. Nitekim AML ve MDS’li kedilerde ilaç tedavisinin etkilerini kontrol grubundakilerle karşılaştıran herhangi bir rapor bulunmamaktadır ve bu hastalığın nadir görülmesi etkili bir tedavi yöntemi bulunmasının önünde bir engeldir. Bu çalışmada, MDS’li kedilere AZA uygulanması sitopenide iyileşme, blast oranında azalma, displazinin ortadan kalkması ve uzun süreli sağkalım ile sonuçlanmıştır. Daha önceki bir çalışmada, RAEB’li yüksek riskli MDS’nin sağkalım süresinin 0,2 ila 6 ay ( ortalama 2 ay) olduğunu ve tüm hastaların öldüğünü göstermiştik [8]. RAEB, insanlarda lösemiye benzer bir tür olarak kabul edilir ve kötü prognozla birlikte lösemi ilerleme riski yüksektir [8, 11, 23, 25]. Bu vakada, günümüze kadar sağkalım teyit edilmiş ve geçmiş verilerle karşılaştırıldığında uzun süreli sağkalım elde edilmiştir. MDS’li kedilerde tedavinin seyri hakkında çeşitli raporlar bulunmaktadır [8, 11, 23, 25]. Önceki bazı raporlarda, MDS’li kediler kan transfüzyonu, antibiyotikler, prednizolon, siklosporin, eritropoietin, menatetrenon ile tedavi edilmiştir [8, 9, 25, 26]. İlginç bir şekilde, önceki çalışmalarda, MDS’li kediler, AZA ile aynı antimetabolit aktiviteyi gösteren, diferansiye edici ve demetilasyon etkileri olan sitarabin aldıktan sonra uzun sağkalım süreleri göstermiştir [8]. Bu nedenle, demetilasyon ilaçları kedi MDS’si için etkili olabilir. Ancak, bu vakada metilasyon durumu analiz edilmemiştir ve etki mekanizması bilinmemektedir.
Bu vakada, AZA kullanılarak MDS’de tam remisyon elde edilmiştir; bu da AZA’nın blast hücrelerini azaltmada ve sitopeniyi iyileştirmede etkili olduğunu göstermektedir. AZA, antineoplastik etkilerini kemik iliğindeki anormal hematopoetik hücreler üzerindeki sitotoksik etkiler ve DNA’nın hipometilasyonu dahil olmak üzere birden fazla etki mekanizması yoluyla gerçekleştirir, ancak bireysel etki mekanizmalarının klinik sonuçlar üzerindeki göreceli önemi henüz netlik kazanmamıştır [13, 14, 17, 20, 22]. AZA’nın sitotoksik etkilerine dahil olan mekanizmalar DNA, RNA ve protein sentezinin inhibisyonunu, AZA’nın RNA ve DNA’ya dahil edilmesini; apoptozun indüklenmesini ve DNA hasar yollarının aktivasyonunu içerebilir [13, 14, 20]. Bu vakada, tedavi için prednizolon ve menatetrenon kullanıldığından AZA’nın tek başına etkisi bilinmiyordu. Bu nedenle, AZA’nın tek ajan etkisi doğrulanamamıştır, bu da eşlik eden ilaçlarla sinerjistik bir etkiye sahip olabileceğini düşündürmektedir. İnsanlarda, yakın zamanda yapılan bir çalışma AZA’nın tek başına yaşam prognozu üzerinde olumsuz bir etkisi olduğunu göstermiştir [12, 21]. Şu anda, AZA ile lenalidomid veya vorinostat dahil olmak üzere kombinasyon tedavisi üzerine araştırmalar devam etmektedir [21], bu da kedi MDS’sini iyileştirmek için AZA ve diğer ilaçlarla kombinasyon tedavisinin gerekli olacağını düşündürmektedir. Akiyama ve arkadaşları, VK2 tedavisinin düşük/orta-1 MDS’li hastalarda anemi ve trombositopenide iyileşme için umut verici göründüğünü göstermiştir. VK2 monoterapisine (45 mg/gün) 16 hafta sonra genel yanıt oranı, hem anemi hem de trombositopenide iyileşme gösteren dört vaka ve trombositopenide iyileşme gösteren bir vaka dahil olmak üzere %13 (5/38) olmuştur [1]. Ayrıca, Sada ve arkadaşları VK2’nin bir reseptörü olarak tanımlanan steroid ve ksenobiyotik reseptörünün (SXR) miyeloid progenitörler üzerinde bulunduğunu bildirmişlerdir. VK2’nin miyeloid progenitörler üzerindeki başlıca etkisi hücre farklılaşmasının teşvik edilmesiydi ve bu da VK2’nin nötropenide iyileşmeye katkıda bulunabileceğini düşündürüyordu [19]. Bu vakada AZA’ya ek olarak K2 vitamini kullandık ve bu kombinasyonun sinerjik etkileri remisyonla sonuçlanmış olabilir. Bununla birlikte, AZA ve K2 vitamini kombinasyonunun sinerjik etkisi bilinmemektedir ve gelecekte MDS’li diğer kedilerde bu etkinin incelenmesi gerekmektedir.
Böylece, mevcut tedaviye ek olarak AZA uygulandığında olumlu bir prognoz elde edilmiştir. İnsan MDS’sinde, lenalidomid, venetoklaks, nükleozid analoğu sapasitabin ve histon deasetilaz inhibitörleri gibi yeni terapötik ajanların AZA ile birlikte kullanıldığında prognozu iyileştirdiği veya prognostik bir etkiye sahip olduğu düşünülmektedir [21, 22]. Bu nedenle, gelecekteki çalışmalar kedi MDS’si için uygun bir ilaç kombinasyonu belirlemeyi hedeflemelidir.
Bu vakada, kedi retrovirüs enfeksiyonunun olmaması prognozun iyileşmesine katkıda bulunmuş olabilir. Önceki çalışmamız birçok FeLV enfeksiyonunun MDS ve AML ile ilişkili olduğunu ve patolojilerinde rol oynadığını göstermektedir [8]. FeLV tümör oluşumunu indüklediğinden, ilaç tedavisi ile tümör remisyonu sağlansa bile tümör nüksünün ortaya çıkması ve bunun da kötü prognozla sonuçlanması beklenir. Aslında, FeLV ile enfekte olmuş bireylerde kedi lenfomasının açıkça kötü bir prognoz gösterdiği bildirilmiştir [3]. Bugüne kadar, kedilerdeki MDS vakalarının neredeyse tamamı FeLV enfeksiyonlarını içermekteydi, ancak son yıllarda FeLV ile enfekte olmamış akut lösemi salgınları sporadik olarak rapor edilmiştir [4, 26]. Tümör oluşumunu indükleyen enfeksiyöz bir ajan olan FeLV bu vakada gözlenmemiştir, bu da hastanın prognozunun sonuç olarak olumlu olabileceğini düşündürmektedir.
Bu rapor bağlamında tartışılması gereken bazı kısıtlamalar vardır. İlk olarak, hastanın hematopoetik hücrelerinin metilasyon durumu ilaç uygulamasından önce ve sonra doğrulanamamış ve AZA tarafından metilasyonun inhibisyonunun değerlendirilmesi yoluyla doğrudan etki değerlendirilememiştir. Ayrıca, K2 vitamini ve diğer terapötik ajanlar da kullanıldığından, AZA’nın tek başına etkisi belirsizdir. Uygun dozları ve protokolleri belirlemek için bu konudaki araştırmalara devam etmek gerekebilir. İkinci olarak, bu vakada uygulanan AZA dozunun doğru olmaması mümkündür çünkü kedi 35 ila 70 mg/m2 arasındaki AZA dozlarında şiddetli nötropeni, ateş, kusma ve ishal göstermiştir. Neyse ki kedi antibiyotik, antiemetik ve infüzyon uygulamasından sonra iyileşmiştir. İnsan MDS’sinde, çeşitli çalışmalar neredeyse tüm hastalarda (hastaların %97’si) ciddi yan etkilerin ortaya çıkabileceğini belirtmektedir [20]. AZA tedavisi ile tedaviye bağlı yan etkiler (TRAE’ler) ilk iki kür sırasında meydana gelmiş ve devam eden tedavi ile düzelmiştir. AZA tedavisi ile en sık bildirilen yan etkiler hematolojik olaylardır [20]. Son raporlar AZA tedavisi ile en sık bildirilen yan etkilerin anemi, trombositopeni, nötropeni dahil olmak üzere hematolojik olaylar olduğunu açıklamıştır [20].
Sonuç olarak, bulgular AZA’nın yüksek riskli kedi MDS’si için tedavi seçeneklerinden biri olduğunu göstermektedir. Ancak, AZA’nın metilasyon üzerindeki etkileri, ilacın etkinliği ve uygun AZA dozu dahil olmak üzere AZA’nın etkisinin altında yatan farmakolojik ve hücre biyolojik mekanizmalar bilinmemektedir. Gelecekte bu konuları açıklığa kavuşturmak için daha fazla araştırma yapılması gerekmektedir.
ÇIKAR ÇATIŞMASI BEYANI. Yazarların çıkar çatışmasına ilişkin herhangi bir beyanı yoktur.
TEŞEKKÜRLER. Bu vakayı bu çalışmaya yönlendirdiği için Dr. S. Yoshimura’ya ve transferden sonra tedaviye devam ettiği ve tıbbi kayıt bilgilerini sağladığı için Iseki Hayvan Hastanesi’nden Dr. A. Iseki’ye teşekkür ederiz. Ayrıca Azabu Üniversitesi Eğitim Hastanesi’ndeki asistanlara, veteriner hekimlere ve hayvan hemşirelerine bu vakadaki katkılarından dolayı teşekkür ederiz.
KAYNAKÇA
- Akiyama, N., Miyazawa, K., Kanda, , Tohyama, K., Omine, M., Mitani, K. and Ohyashiki, K. 2010. Multicenter phase II trial of vitamin K2 monotherapy and vitamin K2 plus 1alpha-hydroxyvitamin D3 combination therapy for low-risk myelodysplastic syndromes. Leuk. Res. 34: 1151–1157. [Medline] [CrossRef]
- Breuer, , Hermanns, W. and Thiele, J. 1999. Myelodysplastic syndrome (MDS), acute myeloid leukaemia (AML) and chronic myeloproliferative disorder (CMPD) in cats. J. Comp. Pathol. 121: 203–216. [Medline] [CrossRef]
- Ettinger, N. 2003. Principles of treatment for feline lymphoma. Clin. Tech. Small Anim. Pract. 18: 98–102. [Medline] [CrossRef]
- Fischer, , Tan, E. and Bienzle, D. 2012. Erythroleukemia in a retrovirus-negative cat. J. Am. Vet. Med. Assoc. 240: 294–297. [Medline] [CrossRef]
- Fujita, and Kaneda, M. 2017. DNA methylation inhibitor causes cell growth retardation and gene expression changes in feline lymphoma cells.
- Vet. Med. Sci. 79: 1352–1358. [Medline] [CrossRef]
- Hahn, M., Bonney, P. L., Dhawan, D., Jones, D. R., Balch, C., Guo, Z., Hartman-Frey, C., Fang, F., Parker, H. G., Kwon, E. M., Ostrander, E. A., Nephew, K. P. andKnapp, D. W. 2012. Subcutaneous 5-azacitidine treatment of naturally occurring canine urothelial carcinoma: a novel epigenetic approach to human urothelial carcinoma drug development. J. Urol. 187: 302–309. [Medline] [CrossRef]
- Harman, R. M., Curtis, M., Argyle, D. J., Coonrod, S. A. and Van de Walle, G. R. 2016. A comparative study on the in vitro effects of the DNA methyltransferase inhibitor 5-azacytidine (5-AzaC) in breast/mammary cancer of different mammalian species. J. Mammary Gland Biol. Neoplasia 21: 51–66. [Medline] [CrossRef]
- Hisasue, M., Okayama, H., Okayama, , Suzuki, T., Mizuno, T., Fujino, Y., Naganobu, K., Hasegawa, A., Watari, T., Matsuki, N., Masuda, K., Ohno, K. and Tsujimoto, H. 2001. Hematologic abnormalities and outcome of 16 cats with myelodysplastic syndromes. J. Vet. Intern. Med. 15: 471–477. [Medline] [CrossRef]
- Hisasue, M., Nishigaki, K., Katae, H., Yuri, , Mizuno, T., Fujino, Y., Setoguchi, A., Hasegawa, A., Watari, T., Masuda, K., Ohno, K. and Tsujimoto, H. 2000. Clonality analysis of various hematopoietic disorders in cats naturally infected with feline leukemia virus. J. Vet. Med. Sci. 62: 1059–1065. [Medline] [CrossRef]
- Hisasue, , Nagashima, N., Nishigaki, K., Fukuzawa, I., Ura, S., Katae, H., Tsuchiya, R., Yamada, T., Hasegawa, A. and Tsujimoto, H. 2009. Myelodysplasticsyndromes and acute myeloid leukemia in cats infected with feline leukemia virus clone33 containing a unique long terminal repeat. Int. J. Cancer 124: 1133–1141. [Medline] [CrossRef]
- Jain, N. C., Blue, J. , Grindem, C. B., Harvey, J. W., Kociba, G. J., Krehbiel, J. D., Latimer, K. S., Raskin, R. E., Thrall, M. A. and Zinkl, J. G. 1991. Proposedcriteria for classification of acute myeloid leukemia in dogs and cats. Vet. Clin. Pathol. 20: 63–82. [Medline] [CrossRef]
- Kubasch, A. S. and Platzbecker, U. 2018. Beyond the edge of hypomethylating agents: novel combination strategies for older adults with advanced MDS and AML.Cancers (Basel) 10: E158. [Medline] [CrossRef]
- Montoro, , Yerlikaya, A., Ali, A. and Raza, A. 2018. Improving treatment for myelodysplastic syndromes patients. Curr. Treat. Options Oncol. 19:
- [Medline] [CrossRef]
- Müller, A. M. and Florek, M. 2014. 5-azacytidine/5-azacitidine. Recent Results Cancer Res. 201: 299–324. [Medline] [CrossRef]
- Nagashima, N., Hisasue, M., Nishigaki, K., Miyazawa, , Kano, R. and Hasegawa, A. 2005. In vitro selective suppression of feline myeloid colony formation isattributable to molecularly cloned strain of feline leukemia virus with unique long terminal repeat. Res. Vet. Sci. 78: 151–154. [Medline] [CrossRef]
- Nagashima, , Hisasue, M., Higashi, K., Kano, R., Tsujimoto, H. and Hasegawa, A. 2001. Bone marrow colony-forming unit assay in cats with naturally occurring myelodysplastic syndromes. Int. J. Hematol. 73: 453–456. [Medline] [CrossRef]
- Platzbecker, U. 2019. Treatment of MDS. Blood 133: 1096–1107. [Medline] [CrossRef]
- Prihirunkit, , Narkkong, N. A. and Apibal, S. 2008. Acute monoblastic leukemia in a FeLV-positive cat. J. Vet. Sci. 9: 109–111. [Medline] [CrossRef]
- Sada, E., Abe, , Ohba, R., Tachikawa, Y., Nagasawa, E., Shiratsuchi, M. and Takayanagi, R. 2010. Vitamin K2 modulates differentiation and apoptosis of bothmyeloid and erythroid lineages. Eur. J. Haematol. 85: 538–548. [Medline] [CrossRef]
- Scott, J. 2016. Azacitidine: a review in myelodysplastic syndromes and acute myeloid leukaemia. Drugs 76: 889–900. [Medline] [CrossRef]
- Sekeres, A., Othus, M., List, A. F., Odenike, O., Stone, R. M., Gore, S. D., Litzow, M. R., Buckstein, R., Fang, M., Roulston, D., Bloomfield,
- D., Moseley, A., Nazha, A., Zhang, Y., Velasco, M. R., Gaur, R., Atallah, E., Attar, E. C., Cook, E. K., Cull, A. H., Rauh, M. J., Appelbaum,
- R. and Erba, H. P. 2017. Randomized phase II study of azacitidine alone or in combination with lenalidomide or with vorinostat in higher- risk myelodysplasticsyndromes and chronic myelomonocytic leukemia: North American intergroup study SWOG S1117. J. Clin. Oncol. 35: 2745–2753. [Medline] [CrossRef]
- Shapiro, M. and Lazo-Langner, A. 2018. Systematic review of azacitidine regimens in myelodysplastic syndrome and acute myeloid leukemia.
BMC Hematol. 18: 3. [Medline] [CrossRef]
- Shimoda, , Shiranaga, N., Mashita, T. and Hasegawa, A. 2000. A hematological study on thirteen cats with myelodysplastic syndrome. J. Vet. Med. Sci. 62: 59–64. [Medline] [CrossRef]
- Shirani, D., Nassiri, S. M., Aldavood, S. J., Seddigh, H. S. and Fathi, E. 2011. Acute erythroid leukemia with multilineage dysplasia in a cat. Vet. J. 52: 389–393. [Medline]
- Weiss, J. 2003. New insights into the physiology and treatment of acquired myelodysplastic syndromes and aplastic pancytopenia. Vet. Clin. North Am. Small Anim. Pract. 33: 1317–1334. [Medline] [CrossRef]
- Weeden, A. L., Taylor, R., Terrell, S. P., Gallagher, A. E. and Wamsley, H. L. 2016. Suspected myelodysplastic/myeloproliferative neoplasm in a feline leukemia virus-negative cat. Vet. Clin. Pathol. 45: 584–593. [Medline] [CrossRef]