Özet
Mezotelyoma, köpeklerde nadir görülen bir kanserdir ve bu kanser için belirlenmiş standart bir tedavi yöntemi yoktur. Etkinliğine dair kesin bir kanıt olmamasına rağmen kemoterapi sıklıkla önerilmektedir. Bu çalışmanın amacı, mezotelyomalı köpeklerde kemoterapinin sağkalım üzerindeki etkisini değerlendirmektir. Retrospektif çok merkezli bir çalışma yürütülmüştür. Çalışmaya dahil edilebilmek için köpeklerin klinik olarak evrim göstermesi ve morfolojik olarak mezotelyoma tanısı almış olması gerekmekteydi. Diğer efüzyon nedenlerinin hariç tutulması ve tam klinik takip de gerekliydi. Kırk köpek çalışmaya dahil edildi, 27’si kemoterapi aldı (grup 1) ve 13’ü almadı (grup 2). Gruplar, tedavilerinin bir parçası olarak ameliyat geçiren hayvanların oranı açısından birbirinden farklı (grup 1’de 16, grup 2’de 2; p = .016), bunun dışındaki gruplar ise birbirine benzerdi. Tek değişkenli analiz, grup 1’deki köpeklerin grup 2’deki köpeklerden önemli ölçüde daha uzun süre hayatta kaldığını göstermiştir (MST: 366 vs. 74 gün; p < .001). İlk kemoterapi uygulamasından sonra efüzyonun tamamen iyileşmesi grup 1’de sağkalımla pozitif korelasyon göstermiştir (MST: 415’e karşı 160 gün; p < .01). Test edilen diğer tüm değişkenlerin tek değişkenli analizde sağkalım üzerinde istatistiksel olarak anlamlı bir etkisi olmamıştır, ancak cerrahi uygulanan köpekler ve tıbbi görüntülemede seröz membran modifikasyonu olan köpekler daha uzun süre hayatta kalma eğilimi göstermiştir. Çok değişkenli analiz, kemoterapinin çalışmamızda sağkalımla bağımsız olarak ilişkili tek değişken olduğunu doğrulamıştır (odds oranı 5.57-6.12; p < .01).
ANAHTAR KELİMELER
köpekler, ilaç tedavisi, mezotelyoma
1 | GİRİŞ
Mezotelyoma, köpeklerde mezotelyal hücrelerden kaynaklanan
nadir bir neoplazmdır. Başlıca klinik belirtisi, bu hastalıktan
Franck Floch halen AniCura TRIOVet, Rennes’de ve Didier Lanore de Hopia, Guyancourt, Fransa’da çalışmaktadır.
etkilenen koelomik boşlukların efüzyonudur. Teşhisi genellikle zordur. Nitekim, neoplastik ve reaktif hiperplastik mezotel hücreleri birbirine çok benzer görünebilir ve çoğu vakada sitopatolojik incelemede birini diğerinden ayırt etmek zordur.1,2 Histopatolojik analiz bazı vakalarda ayrım yapılmasına yardımcı olabilir: alttaki dokuların invazyonu ve uzak veya lenf nodu metastazı varlığı mezotelyomayı reaktif mezotelyumdan ayırt etmek için önerilen kriterlerdir.3
Bu, özgün çalışmaya uygun şekilde atıfta bulunulması, kullanımın ticari olmaması ve herhangi bir değişiklik veya uyarlama yapılmaması koşuluyla, herhangi bir ortamda kullanım ve dağıtıma izin veren Creative Commons Attribution-NonCommercial-NoDerivs Lisansı koşulları altında açık erişimli bir makaledir.
© 2022 Yazarlar. Veterinary and Comparative Oncology John Wiley & Sons Ltd. tarafından yayınlanmıştır.
Bununla birlikte, lenf nodunda embolize mezotelyal hücrelerin varlığı benign vakalarda rapor edilmiştir ve biyopsi tekniğine bağlı olarak daha derin yapılara invazyon her zaman değerlendirilememektedir.4,5 Ayrıca, doku invazyonunun olmaması mezotelyoma tanısını koymayı engellemez.3,6 A yrıca, immünokimya mezotelyal kökeni tespit etmeye yardımcı olabilir ancak proliferasyonun neoplastik doğasını kanıtlayamaz.6 -8 Ayrıca, mezotelyoma için spesifik ve doğrulanmış bir belirteç veya belirteç kombinasyonu bulunmamaktadır.7-9 Sonuç olarak, histopatoloji veya immünokimya ile birlikte bile tek başına morfolojik değerlendirme mezotelyoma tanısı koymak için yetersiz görünmektedir; ve nihai tanı genellikle klinik, görüntüleme ve patolojik verilerin bütünleştirilmesi ile konulmaktadır.
Köpek mezotelyomasının tedavi yöntemlerine ilişkin bilgi yetersizliğinden, tanı yöntemleri konusunda fikir birliği olmaması ve hastalığın nadir görülmesi kısmen sorumlu olabilir . İnsanlarda mezotelyoma çoğunlukla plevraldir. Ayrıca nadir görülen ve nispeten az belgelenmiş bir hastalıktır. Mevcut tedavi önerileri, eğer mümkünse cerrahi rezeksiyon ve platin bazlı kemoterapiye dayanmaktadır.10-12 Köpeklerde ise tedaviye ilişkin bilgiler sınırlıdır. Cerrahi prosedürler genellikle efüzyonun sonuçlarını azaltmak için ve bazen de sitoredüktif bir amaçla önerilmektedir. Örneğin, perikardiyal mezotelyoma tedavisi için perikardiyektomi yaygın olarak uygulanmaktadır ve plevral port cihazı plevral mezotelyoma tedavisi için giderek daha fazla kullanılmaktadır. Yine de, bu cerrahi prosedürlerle ilişkili sonuçlar yeterince belgelenmemiştir .13-16 Sistemik tedavilerle ilgili olarak, yıllarca kemoterapi kullanımının gerekçesi, çok küçük köpek kohortlarında veya izole raporlarda tedavi edilen köpeklerin tarihsel verilere kıyasla daha iyi hayatta kalma eğilimi göstermesine dayanıyordu.1,17,18 Yakın zamanda, bir kontrol grubu da dahil olmak üzere 34 köpekten oluşan daha geniş bir kohort Moberg ve ark. tarafından yayınlanmış ve kemoterapi ile tedavi edilen mezotelyomalı köpeklerde daha iyi sonuçlar alındığı bildirilmiştir.16 Bu çalışmada, köpeklerin çoğunda plevral mezotelyoma vardı ve en çok kullanılan kemoterapötik ajan intrakaviter olarak uygulanan 5-fluorourasil idi. Hiçbir sağkalım prognostik faktörü tanımlanmamıştır.
Bu çalışmanın birincil amacı mezotelyomalı köpeklerde kemoterapinin sağkalım üzerindeki etkisini değerlendirmektir. İkincil amaç ise tedavi edilen köpekler arasında sağkalım ile ilişkili prognostik faktörleri belirlemektir.
2 | METOD
2.1 | Hücre hattı kullanma beyanı Hücre hattı kullanılmamıştır.
2.2 | Vaka seçimi
Ocak 2004 ve Nisan 2020 tarihleri arasında mezotelyoma teşhisi konulan köpekler altı veterinerlik kurumundan çalışmaya dahil edilmiştir. Çalışmaya dahil edilmek için köpeklerin dört dahil edilme kriterini karşılaması gerekiyordu.
İlk olarak, kurul sertifikalı bir patolog veya klinik patolog tarafından morfolojik mezotelyoma tanısı konulması gerekliydi. Ancak, mezotelyomanın morfolojik tanısı konusunda fikir birliği olmadığı için bu yeterli görülmemiştir. İkinci kriter, mezotelyoma şüphesi uyandıran klinik bir seyir ve nedeni tespit edilemeyen tekrarlayan efüzyonlardı. Üçüncüsü, tanı sırasında ilgili boşluğun tıbbi görüntülemesinin yapılması gerekmiştir. Dördüncü olarak, tıbbi kayıtların ve takiplerin eksiksiz bir şekilde incelenmeye hazır olması gerekiyordu.
2.3 | Verilerin toplanması
Tüm hayvanlar için, tanısal prosedürlerle ilgili toplanan bilgiler sitopatolojik veya histopatolojik raporun, neoplastik boşlukların görüntüleme raporlarının ve evreleme prosedürlerinin incelenmesini içeriyordu. Varsa immün boyama sonuçları da toplanmıştır. Sitokeratin AE1/AE3 ve vimentin veya düz aktine karşı antikor boyanması için çift pozitiflik mezotelyal kökenli olduğunu düşündürmüştür. Evreleme prosedürleri, tanımlanan herhangi bir şüpheli lezyonun morfolojik analizi ile ilişkili torasik, kardiyak ve/veya abdominal görüntüleme işlemlerini kapsamıştır. Görüntüleme prosedürleri arasında toraks için radyografiler veya BT taraması, kardiyak değerlendirme için ekokardiyografi ve batın için ultrasonografi veya BT taraması yapılmıştır. Tedavilerle ilgili olarak toplanan veriler, doz ve sıklık dahil olmak üzere uygulanan her terapötik prosedürü veya verilen ilaçları kapsıyordu. Kemoterapi ile ilgili toplanan veriler arasında molekül, doz, sıklık, uygulama yolu (intravenöz, intrakaviter veya her ikisi), yan etkiler, tedaviye yanıt ve varsa nüks tarihi yer almıştır. Yan etkiler retrospektif olarak VCOG- CTCAE’ye göre sınıflandırılmıştır .19 T edaviye yanıt, sonografide efüzyonun devam etmesine göre değerlendirilmiştir. Eğer mümkünse, ölçülebilir nodül veya kitlenin gelişimi RECIST kriterlerine göre değerlendirilmiştir.20,21 Terapötik cerrahi ile ilgili olarak, perikardiyektomi veya plevral port yerleştirme gibi dekompresif veya sitoredüktif cerrahi prosedürler dahil edilmiştir. Aksine, tanısal cerrahi prosedürler (örn. biyopsi alınması) terapötik bir prosedür olarak kabul edilmemiştir.
Ayrıca, tıbbi dosyalardan hayvanların özellikleri (yaş, ırk, cinsiyet ve üreme durumu), tanıdan önceki klinik belirtilerin süresi, tanı sırasındaki neoplastik efüzyonların sayısı ve yeri ile sağkalım süresi bilgileri de alınmıştır.
2.4 | İstatiksel analiz
Köpekler aldıkları tedaviye bağlı olarak iki gruba ayrılmıştır. Kemoterapi alan köpekler 1. grubu, diğer köpekler ise 2. grubu oluşturmuştur.
İlk olarak, gruplar arasındaki homojenlik kontrol edilmiştir. Test edilen kategorik veriler cinsiyet, üreme durumu, efüzyonların sayısı ve yeri, ilk klinik belirtilerin süresi (30 günden fazla veya az olarak kategorize edildi), tıbbi görüntülemede seröz membranlarda anormalliklerin varlığı ve ameliyatın gerçekleştirilmesiydi. Bunlar için, her bir veri setinde beşten fazla birey olduğunda Pearson’un Ki-kare testi, yoksa Fisher’in kesin testi uygulanmıştır. Sürekli veriler arasında yaş ve klinik belirtilerin süresi yer almıştır.
Dağılım türlerini değerlendirmek için Shapiro-Wilk testi yapılmıştır. Her ikisi de normal dağılım göstermediğinden gruplar arasındaki homojenliği değerlendirmek için Mann-Whitney U testi kullanılmıştır. Tüm analizler için istatistiksel anlamlılık eşiği p < .05 olarak belirlenmiştir.
Çalışmanın son noktası sağkalımdı. Bu nokta, ilk morfolojik tanıdan hastalığın ilerlemesi veya sansür nedeniyle ölüme kadar geçen süre şeklinde tanımlanmıştır. Köpekler, veri toplama sırasında hala hayattalarsa, takipten çıkmışlarsa veya başka bir nedenden ölmüşlerse sansürlenmiştir. Sağkalım analizleri için, klinik belirtilerin süresi <30 gün veya ≥30 gün olarak iki gruba ayrılmış ve kategorik bir veri şeklinde değerlendirilmiştir. Sağkalım üzerindeki etkileri açısından değerlendirilen kategorik veriler arasında daha önce bahsedilenler ve gruplar yer almıştır. Yaş değerlendirilen tek sürekli veriydi. Sağkalımların karşılaştırılması Kaplan-Meier yöntemi ve ardından kategorik veriler için log-rank testleri ve sürekli veriler için Pearson korelasyon çarpımı kullanılarak yapılmıştır. Tek değişkenli analiz için anlamlılık p < .05 olarak belirlenmiş, ancak p < .20 olan tüm veriler daha sonra Cox orantılı tehlikeler modeli çok değişkenli analizine dahil edilmiştir.
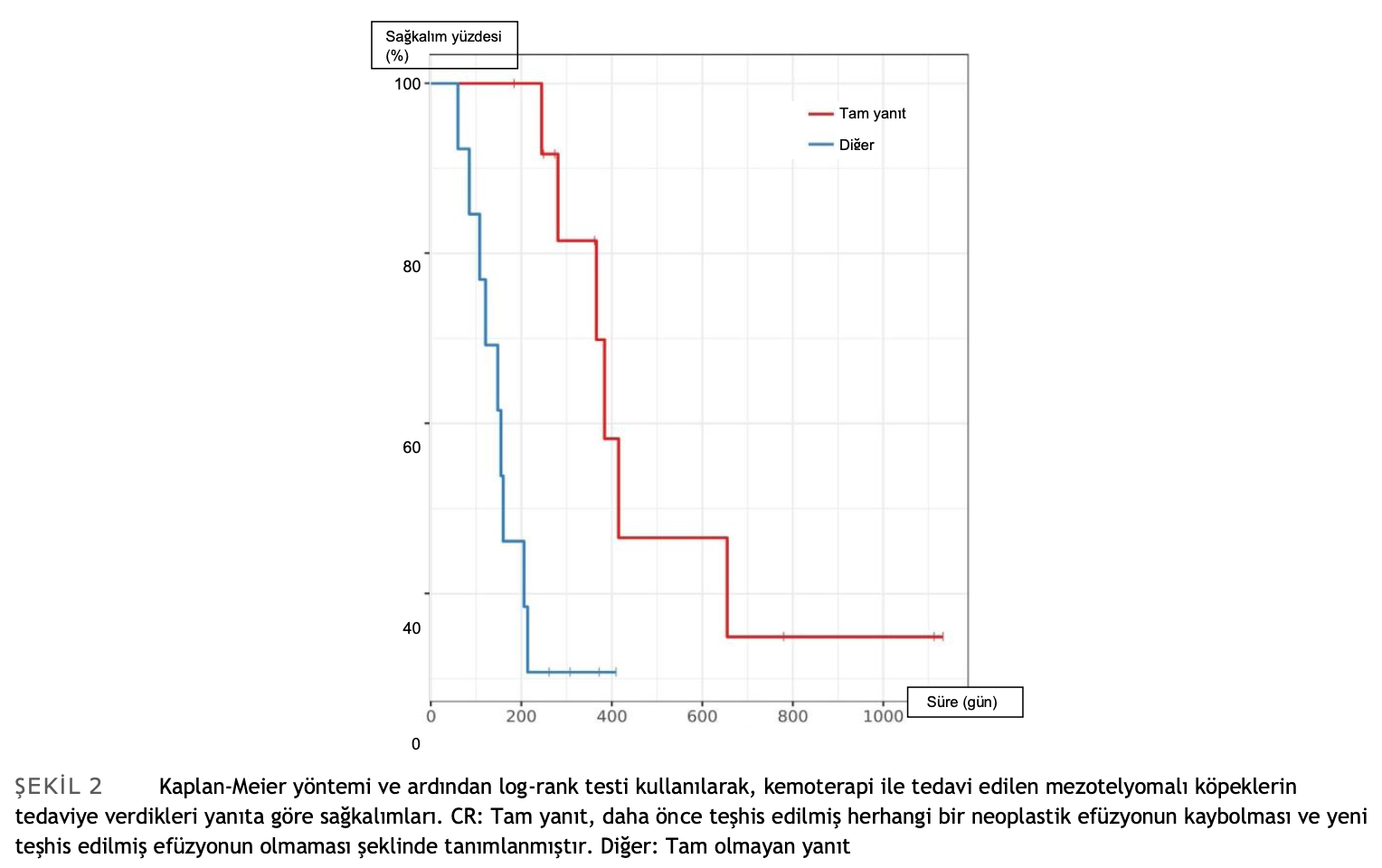
İlgili herhangi bir prognostik faktörü tespit etmek için 1. grup arasında başka bir analiz daha yapılmıştır. Test edilen parametreler arasında tedaviye yanıt, kemoterapi uygulama yolu ve daha önce bahsedilen tüm kategorik veriler yer almıştır. Tedaviye yanıt, ilk kemoterapi seansından 3 hafta sonra yapılanultrasonografiye dayanarak retrospektif olarak tam ve tam olmayan şeklinde sınıflandırılmıştır. Tam yanıt (CR), daha önce tanı konmuş herhangi bir neo-plastik efüzyonun kaybolması, yeni tanı konmuş efüzyonun bulunmaması şeklinde tanımlanmıştır. Progresyonsuz geçen süre (PFI) yalnızca tam yanıt verenler için değerlendirilmiş ve ilk belgelenen CR ile efüzyon nüksü arasındaki süre şeklinde tanımlanmıştır.
3 | SONUÇLAR
3.1 | Hasta grubu ve klinik tablo
Kırk köpek, Tablo S1’de tamamı gösterilen dahil edilme kriterlerini karşılamıştır. Ortalama yaş 10,2 idi (aralık: 3-13 yaş). 18’i sağlam, 4’ü kısırlaştırılmış ve 1’inin üreme durumu bilinmeyen 23 erkek köpek vardı. 5’i kısırlaştırılmamış ve 12’si kısırlaştırılmış olmak üzere 17 dişi vardı. Köpeklerin çoğu safkandı (36/40). Golden Retriever en çok sayıda görülen cins olmuştur (11/40). Birden fazla köpeğin yer aldığı diğer ırklar arasında Alman Çoban Köpeği (4/40), Yorkshire Terrier (4/40), Bernese Dağ Köpeği (3/40) ve Amerikan Staffordshire Terrier (2/40) yer almaktadır.
İlk morfolojik tanıdan önce klinik belirtilerin ortalama süresi 14 gündü (aralık 1-395 gün, n = 31). Mezotelyoma 15 köpekte plevral, 12’sinde perikardiyal, 2’sinde peritoneal, 6’sında perikardiyal ve plevral, 2’sinde peritoneal ve plevral, 1’inde peritoneal ve perikardiyal ve 2’sinde perikardiyal, plevral ve peritoneal idi. 26 köpekte (%65) başlangıçta efüzyonlar birkaç vücut boşluğunu etkiliyordu. Bunların 10’unda doğrulanmış çoklu neoplastik efüzyon, 4’ünde sadece bir tümöral efüzyon ve 12’sinde doğrulanmış bir neoplastik efüzyon ve doğası bilinmeyen diğer efüzyonlar mevcuttu.
On dört köpekte başvuru sırasında benzersiz bir tümöral efüzyon mevcuttu; bunlardan 2’sinde başka efüzyon öyküsü vardı. İstatistiksel analizler için, mezotelyoma ile ilişkili olduğundan şüphelenilen doğası bilinmeyen efüzyonlar şüpheli neoplastik olarak kaydedilmiştir.
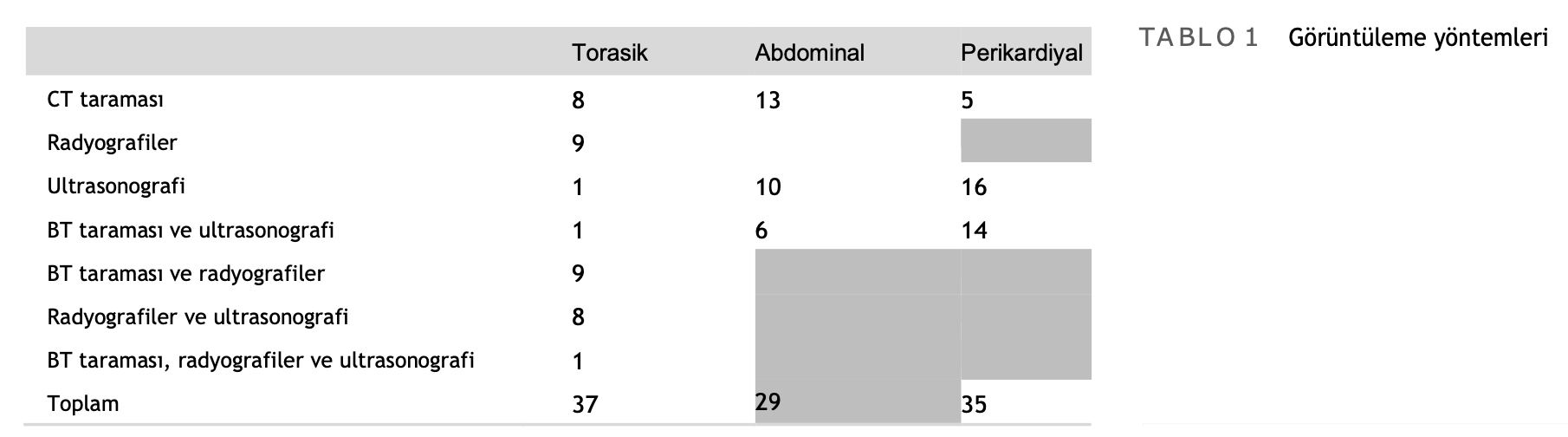
3.2 | Görüntüleme yöntemleri
Plevral boşluk görüntüleme 37 köpekte (%92,5) bilgisayarlı tomografi (BT) taraması (19), radyografiler (27) veya ultrasonografi (11) ile gerçekleştirilmiştir. Perikardiyal boşluk görüntülemesi 35 köpekte (%87,5) BT taraması (19) veya ekokardiyografi (30) ile gerçekleştirilmiştir. Abdominal görüntüleme 29 köpekte (%72,5) BT taraması (19) veya ultrasonografi (16) ile gerçekleştirilmiştir (Tablo 1).
Görüntüleme raporları 38 köpekte retrospektif olarak incelendi; seröz membranlar normal sınırlarda (21/38, %55,3), kalınlaşmış (11/38, %28,9), nodüller göstermiş (4/38, %10,5), kitle göstermiş (2/38, %5,3) veya BT taramasında hipertrofi olmaksızın fokal olarak artmıştı (2/38, %5,3). İki köpekte hem nodül hem de seröz membran kalınlaşması vardı. Kitle görülen her iki köpekte de mezotelyal proliferasyonu doğrulayan histopatolojik tanı vardı; kitlelerden biri kalp tabanlı, multilobüle ve heterojen, diğeri ise sağ atriyum yerleşimli, düzensiz şekilli, heterojen ve zayıf görünümlüydü. Dört köpekte çok hafif intrakaviter lenfadenopati ve iki köpekte orta derecede sus-sternal lenfadenopati görüldü, ancak lezyonlar küçük boyutları nedeniyle aspire edilemedi. Bir köpekte plevral ve perikardiyal efüzyon ile birlikte akciğer lobu torsiyonu görüldü; köpeğe lobektomi ve perikardiyektomi yapıldıktan sonra yırtık lobun parietal tarafında histolojik olarak mezotelyoma tanısı kondu.
3.3 | Morphological assessment
Tüm köpeklerin efüzyonları sitopatolojik olarak değerlendirilmiş ve 36/40’ında (%90) mezotelyomayı işaret etmiştir. Üç sitopatolojik inceleme zayıf hücresellik nedeniyle sonuçsuz kalmıştır. Bu üç vakada, daha sonra yapılan histopatolojik inceleme mezotelyomayı düşündürmüştür. Kalan vakada, sitopatolojik inceleme herhangi bir malignite kriteri olmaksızın iyi farklılaşmış mezotel hücrelerinin proliferasyonunu ortaya çıkardı; mezotelyoma tanısı histopatoloji ve immünohistokimya ile desteklendi.
Histopatoloji 19 köpeğe uygulanmış ve 16/19’unda (%84,2) mezotelyomayı düşündürmüştür. İki köpekte histopatoloji kaynağı bilinmeyen mezotelyal hiperplazi olduğunu gösterirken bir köpekte biyopsilerin kalitesi düşüktü. Her üçünde de sitopatolojik değerlendirmenin mezotelyoma ile uyumlu olduğu perikardiyal efüzyon vardı. Hepsine perikardiyektomi uygulanmış ve efüzyonun plevral boşlukta yeniden toplanması ve ikinci bir sitopatolojik inceleme ile doğrulanması sonrasında tanı desteklenmiştir. Histopatolojide tümöral tanı konulan 16 örnekten altısında emboli (%37,5) görüldü; dördünde lenfatik, birinde lenfatik ve vasküler, birinde ise başka şekilde tanımlanmamıştı.
İmmünohisto-boyama 10 köpekte gerçekleştirilmiştir: AE1/AE3 ve vimentin (6/10), AE1/AE3 ve düz aktin (1/10), tek başına AE1/AE3 (2/10) ve tek başına vimentin (1/10). Bir köpek AE3 ve düz aktin için pozitiflik ve AE1 için negatiflik gösterdi; sonuçlar diğer tüm vakalar için pozitifti. AE1/AE3 ve vimentin ile 3 köpekte immünosit boyama yapıldı ve hepsi çift pozitifti.
3.4 | Tedavi
Yirmi yedi köpek kemoterapi aldı (1. grup) ve 13’ü almadı (2. grup). Kemoterapi 12 köpekte (%44,4) intrakaviter, 2 köpekte (%7,4) intravenöz ve 13 köpekte (%48,1) hem intrakaviter hem de intravenöz olarak uygulandı. İntrakaviter kemoterapi için kullanılan ajanlar arasında sisplatin (13/25, %52) ve karboplatin (12/25, %48) yer almıştır. İntravenöz kemoterapi için kullanılan ajanlar arasında karboplatin (5/15, %33,3), doksorubisin (4/15, %26,7), karboplatin ve doksorubisin alternansı (4/15, %26,7), karboplatin ve mitoksantron alternansı (1/15, %6,6) ve sisplatin, karboplatin, mitomisin C ve mitoksantron kombinasyonu (1/15, %6,6) yer almıştır. On bir köpek ilk kemoterapi protokolünün bir parçası olarak birkaç molekül almıştır (%41). Bir köpek protokolün sonunda klorambusil ile metronomik tedavi almıştır. Kemoterapiye yanıt 26 köpekte bildirilmiştir ve 13’ünde (%50) ilk uygulamadan 3 hafta sonra tam yanıt alınmıştır. 2 köpekte nodül takibi yapıldı; biri 1 ay sonra tekrar değerlendirildi ve tüm nodüllerin kaybolduğu, diğeri ise 5 ay sonra tekrar değerlendirildi ve nodül boyutunun küçüldüğü görüldü. Tedavinin 3 haftasından sonra tam yanıt alınamayan köpeklerde daha sonra CR görülmemiştir. Uygulama sayısı 1 ila 10 arasında değişmiştir ( ortalama = 4; n = 23). Dört yan etki kaydedilmiştir: grade 3 ve grade 4 nötropeni, grade 2 trombositopeni ve grade 2 kusma. Herhangi bir renal toksisite bildirilmemiştir.
Tam yanıt alınan on köpekte ortalama 242,5 günlük PFI sonrasında nüks görülmüştür. Kemoterapi uygulanan tüm köpekler arasında dokuz köpek nüksettikten sonra (4/27, %14,8) veya birinci basamak tedaviye yanıt alınamamasını takiben (5/27, %18,5) ikinci bir tedavi protokolü almıştır. Bunlar arasında önceki kemoterapi protokolünün tekrarlanması (2/27, %7,4), bir diğer tolere edilebilir maksimum doz protokolünün başlatılması (5/27, %18,5), toceranib uygulanması (2/27, %7,4) ve plöredezis (2/27, %7,4) yer almıştır. İlk protokollerinde CR elde eden 4 köpekten üçü ikinci protokolde CR elde etmiştir; biri toceranib ile tedavi edilmiş ve ikisi ilk platin bazlı intrakaviter protokollerinin tekrarını almıştır.
İlk protokollerinde CR elde edemeyen köpeklerde kurtarma protokolünden sonra iyileşme görülmemiştir.
On sekiz köpeğe (%45) perikardiyektomi (13/18, %72,2), lobektomi ve perikardiyektomi (1/18, %5,6), plevral port yerleştirme (3/18, %16,7) ve plevral port yerleştirme ve perikardiyektomiden (1/18, %5,6) oluşan terapötik cerrahi prosedürler uygulandı. Bunlar arasında sadece iki köpek grup 2’deydi; her ikisine de perikardiyektomi uygulandı.
Uygulanan diğer tedaviler arasında prednizolon (27/40, %67,5), non-steroid anti-enflamatuar ilaçlar (6/40, %15), furosemid (8/40, %20) ve sotalol (1/40, %2,5) yer aldı. Yedi köpek tamamlayıcı tedavi almamıştır- 1. gruptan 4 ve 2. gruptan 3 köpek.
3.5 | Sağkalım analizi ve prognostik faktörler
Yirmi altı köpek tümörle ilişkili nedenlerden ölmüş ve 14 köpek çalışmadan sansürlenmiştir. Altısı diğer nedenlerden (nüks sonrası ameliyat sırasında kalp durması, piroplazmoz, leishmaniasis, histiyositik sarkom ve araba çarpması) ve biri de mezotelyoması hala remisyondayken bilinmeyen bir nedenle ölmüştür. Altı köpek ortalama 273 günlük (aralık 41-779 gün) takip süresinin ardından takip dışı kalmıştır ve bir tanesi veri toplama sırasında (274 günlük takip süresinin ardından) hala hayattaydı.
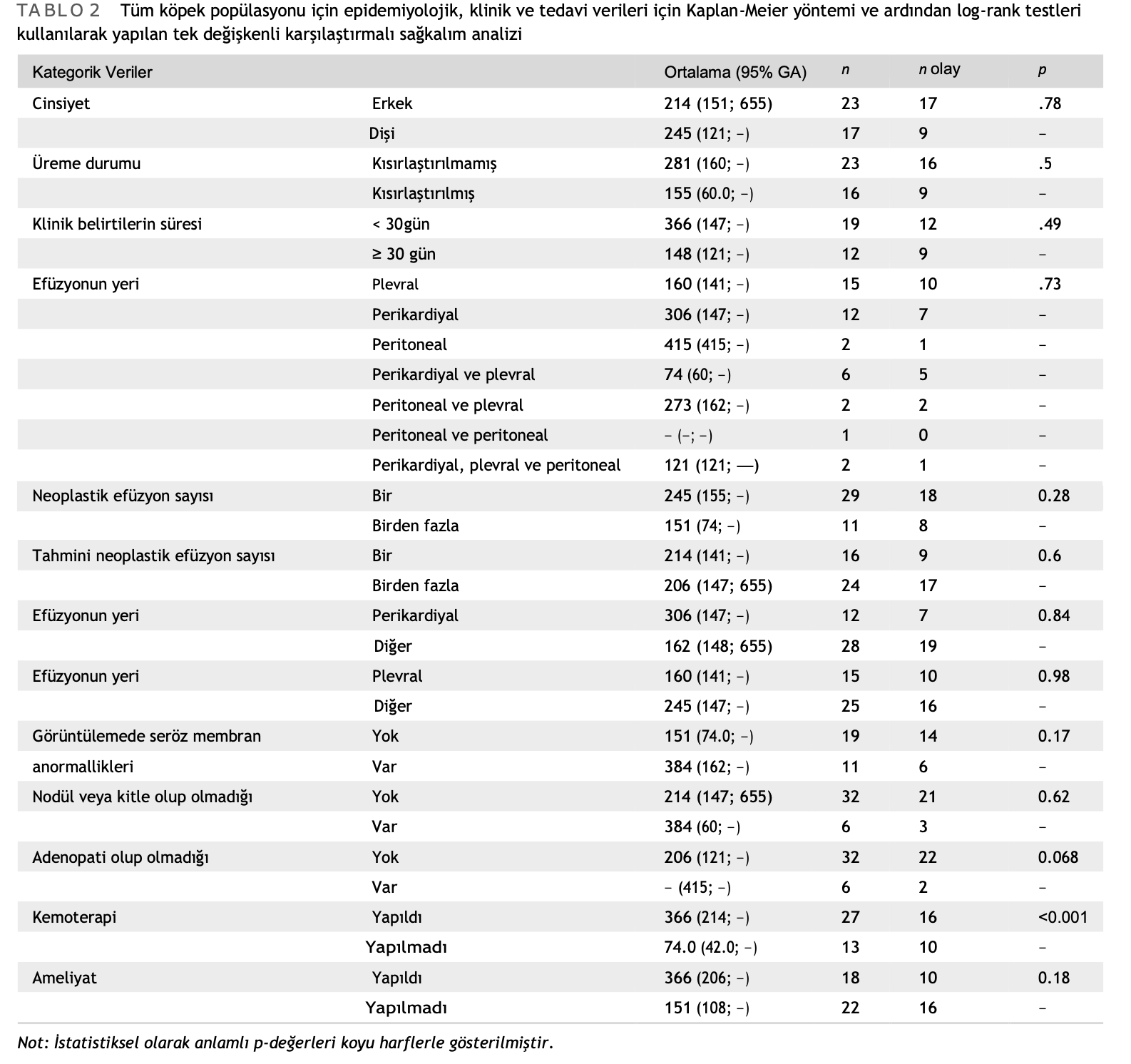
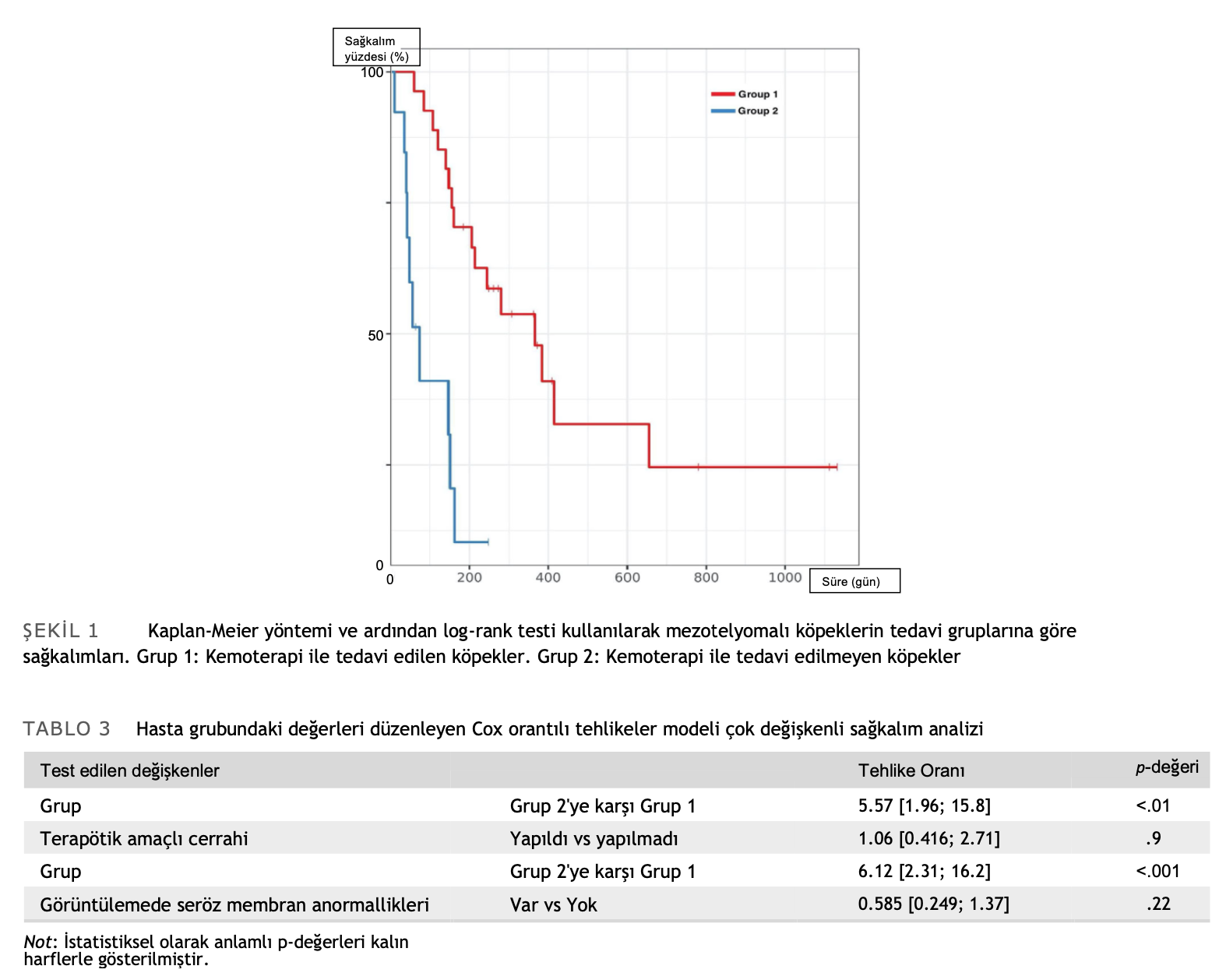
1. ve 2. grup terapötik amaçlı cerrahi uygulanması dışında homojendi: 1. grupta cerrahi uygulanan köpeklerin yüzdesi 2. gruba göre istatistiksel olarak anlamlı derecede yüksekti (p = .016). Tek değişkenli analizde sağkalım üzerindeki etkileri açısından test edilen tüm faktörler arasında yalnızca kemoterapi, grup 1’deki köpekler için 366 gün ve grup 2’deki köpekler için 74 gün olan ortalama sağkalım süresi (MST) ile sonuçla önemli ölçüde ilişkiliydi (p < .001) (Tablo 2, Şekil 1). Tedavi protokollerinin bir parçası olarak ameliyat edilen köpekler diğerlerinden daha uzun yaşama eğilimindeydi, ancak bu istatistiksel olarak anlamlı değildi (MST 366 vs. 151 gün, p = .18). Görüntüleme sırasında seröz membran anormallikleri olan köpekler de daha uzun yaşama eğilimindeydi (MST 288 vs. 155 gün, p = .17). Vaka sayısının az olması nedeniyle her üç parametreyi de içeren çok değişkenli bir analiz yapılamamıştır; bu nedenle, kemoterapi performansı birinci değişken ve görüntüleme sonuçları veya cerrahi performans ikinci değişken olarak kullanılarak iki ayrı çok değişkenli analiz yapılmıştır. Her iki analizde de sadece kemoterapi sağkalımla anlamlı şekilde ilişkili bulunmuştur (tehlike oranı 5.37-6.12; p < .01, Tablo 3).
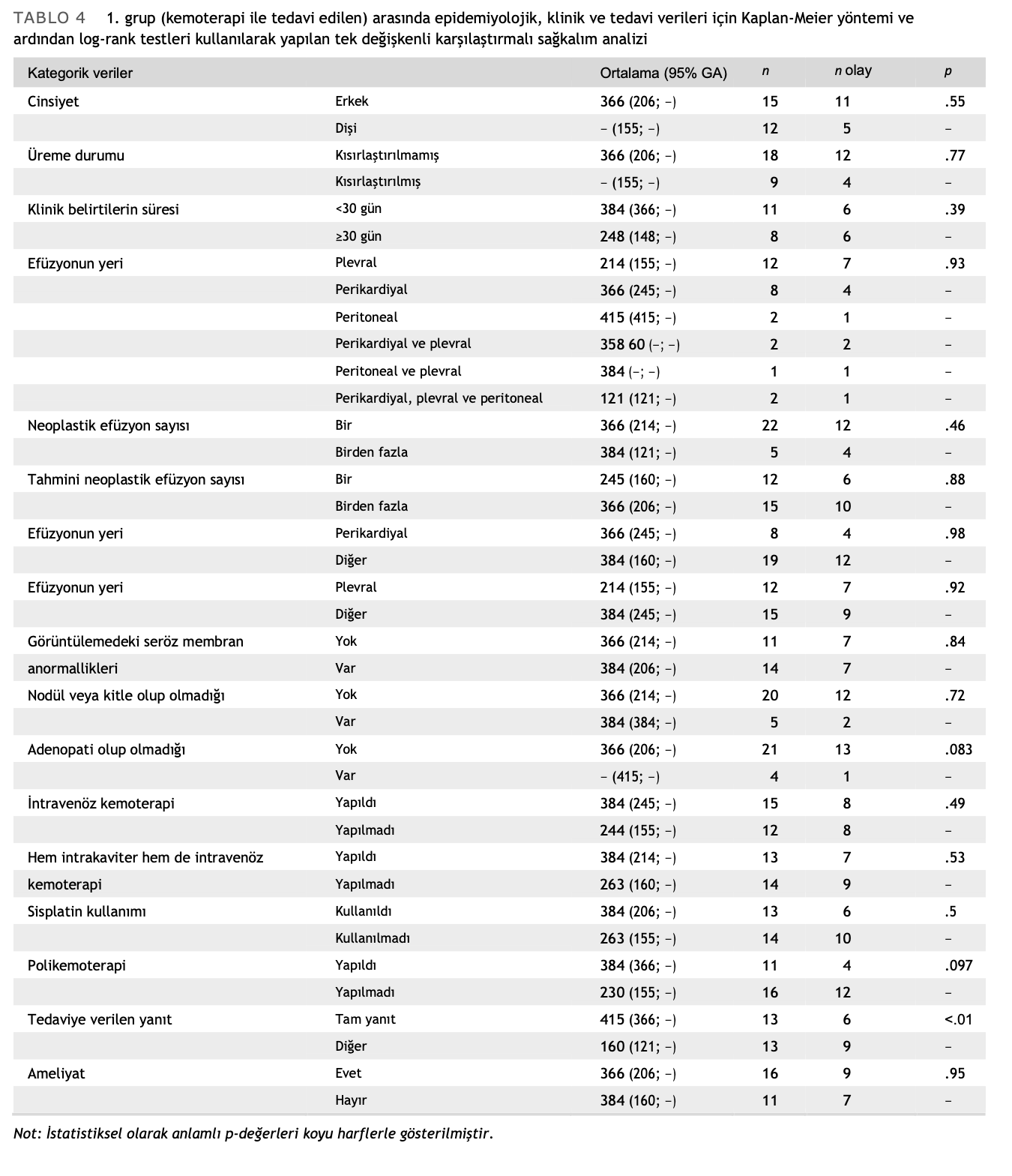
1. grupta, tedaviye yanıt tek değişkenli analizde bulunan tek prognostik faktördü; ilk kemoterapi uygulamasından sonra tam yanıt verenlerin MST’si 415 gün iken tam yanıt vermeyenlerin 160 gündü (p < .01) (Tablo 4, Şekil 2). Vaka sayısının sınırlı olması nedeniyle çok değişkenli analiz yapılamamıştır.
3.6 |
Alt hasta grupları arasında sağkalım analizi
Sadece plevral mezotelyoma göz önüne alındığında, kemoterapi sonuçla anlamlı şekilde ilişkili olan tek tedaviydi (MST 214’e karşı 40 gün, p < .001). Cerrahi, plevral mezotelyoma için sağkalımla anlamlı bir ilişki göstermemiştir (MST 281 vs. 150 gün, p = .38).
Sadece perikardiyal mezotelyoma göz önüne alındığında, kemoterapi (MST 366 vs. 102 gün, p = .086) ve/veya cerrahi (MST 366 vs. 147 gün, p = .42) ile tedavi edilen köpekler daha uzun yaşama eğilimindeydi ancak bu istatistiksel olarak anlamlı değildi. Multikaviter efüzyonlu köpeklerde kemoterapi sonuçları pozitif yönde etkilerken (MST 366 vs. 74 gün, p > .001), cerrahi sonuçlarla istatistiksel olarak anlamlı bir ilişki göstermemiştir (MST 366 vs. 147 gün, p = .15). Vaka sayısının az olması nedeniyle çok değişkenli çalışmalar yapılamamıştır. Tam sonuçlar Tablo S2’de gösterilmiştir.
Histopatolojide tümöral tanısı olan köpekler arasında emboli gösteren tüm köpekler (n = 6) kemoterapi ile tedavi edilmiş ve 5/6’sına cerrahi uygulanmıştır. Bunların 3/6’sında kemoterapiye CR vardı. Embolisi olmayan köpeklerin MST’si 655 gün iken embolisi olanlarınki 310 gündü, ancak bu istatistiksel olarak anlamlı değildi (p = .43) (Tablo S3).
4 | TARTIŞMA
Yakın zamanda yayınlanan ve nispeten geniş bir mezotelyoma serisini ele alan retrospektif bir çalışma dışında,16 bu tümöre ilişkin veriler veteriner literatüründe oldukça dağınık durumdadır. Sonuçlarımızı tartışmak için sistematik bir inceleme yapılmıştır. Bu derleme, Moberg ve arkadaşlarının çalışmasının sonuçlarını içermemektedir ve bunlar ayrıca tartışılmıştır. Çalışmamızda belirlenen dört dahil etme kriterini karşılayan toplam 122 mezotelyoma vakası, 47 münferit vaka raporu ve 10 vaka serisinde komplike bulunmuştur.1,6,13,17,18,22-73 Morfolojik değerlendirme, bir vakada tekrarlanan sitopatolojik incelemeler ve diğer tüm vakalarda histopatoloji ile yapılmıştır. Kırk dört olguya immünohisto-kimya uygulanmıştır. Moberg ve arkadaşlarının çalışmasında, histopatoloji (32/34) veya hücre bloğu sitopatolojisi (2/34) ile tanı konulan 34 olgu tanımlanmıştır. On yedisine immünohistokimya uygulanmıştır.
Bizim popülasyonumuzda, plevral (%62,5) ve perikardiyal (%50) boşluklar en sık etkilenen boşluklar olmuştur. Benzer şekilde, Moberg’in serisinde de köpeklerin çoğunda plevral kavite tutulumu görülmüş (%91,2) ve perikardiyal kavite ikinci en sık etkilenen kavite olmuştur (%47).16
Literatür taramamızda 120 köpekte lokalizasyon tespit edildi; kaviteler 13’ünde (%10,8) plevral, 77’sinde (%64,2) perikardiyal, 15’inde (%12,5) peritoneal, 6’sında (%5) perikardiyal ve plevral, 3’ünde (%2,5) plevral ve peritoneal, 1’inde (%0,8) peritoneal ve perikardiyal, 2’sinde (%1,7) tri- kaviter ve 3’ünde (%2,5) tunika vajinalis yerleşimliydi. Böylece, vakaların %24’ünde plevral boşluk, %71,7’sinde ise perikardiyal boşluk tutulmuştur. Bu fark seleksiyon yanlılığından kaynaklanabilir; aslında 61 perikardiyal mezotelyoma perikardiyal hastalık veya perikardiyektomi ile ilgili vaka serilerinden dahil edilmiştir.1,6,38,39,45,57 Bunun aksine, plevral veya peritoneal hastalık kohortlarından hiçbir mezotelyoma dahil edilmemiştir . Son olarak, insanlarda olduğu gibi, köpek mezotelyoması esas olarak plevral boşluğu tutuyor gibi görünmektedir; ancak perikardiyal boşluk köpeklerde daha sık tutulabilir.11,74
Mezotelyoma tanısı sırasında, özellikle diğer efüzyon nedenlerini dışlamak için neoplastik boşluğun tıbbi olarak görüntülenmesi gerekir. Nitekim mezotelyoma görüntülemesi hakkında çok az şey bilinmektedir; malign ve benign hastalıkların toraks BT görüntüleri üzerinde yapılan iki çalışmada parietal plevra kalınlaşması, nodüler diyafragma kalınlaşması ve torasik duvar invazyonunun torasik malignitelerle ilişkili olduğu gösterilmiştir.75,76
Bununla birlikte, tüm toraks içi maligniteler aynı düzeyde tedavi edilmiş ve sadece sınırlı sayıda mezotelyoma dahil edilmiştir. Bizim kohortumuzda, tıbbi görüntüleme vakaların %55,3’ünde dikkat çekici değildi; anormal olduğunda, ana bulgu seröz membran kalınlaşması (%28,9) ve daha az sıklıkla nodüller veyakitlelerdi (%15,8). Moberg’in serisinde 27 torasik ve abdominal BT tanımlaması mevcuttu.
Köpeklerin %33’ünde gros hastalık tespit edilmemiştir; plevral (%30) ve/veya perikardiyal (%11) kalınlaşmanın yanı sıra nodüller de oldukça yaygındır (≥%33). Daha önce yayınlanan mezotelyoma vakalarında, 56 köpeğin görüntüleme prosedürlerinin bilgileri mevcuttu; 47’sinde torasik/perikardiyal boşluk ve 21’inde abdominal boşluk değerlendirildi.
Otuz köpekte (%53,6) anormal lezyon bulunmadı; yaygın bulgular serozal nodüller/kitleler (17/56, %30,4) ve serozal kalınlaşma (9/56, %16,1) idi. Sonuçlar, uzun bir süre boyunca çeşitli görüntüleme teknikleriyle elde edildiği için dikkatle karşılaştırılmalıdır. Bununla birlikte, elde edilen sonuçlar görüntülemede anormallik görülmeme durumunun yaygın olduğunu göstermektedir. Varsa, serozal kalınlaşma, nodüller ve kitleler en sık görülen anormalliklerdir.
In Serimizde, kemoterapi sağkalımla istatistiksel olarak anlamlı
ve bağımsız bir şekilde ilişkili olan tek tedaviydi. MST, kemoterapi
alan köpekler için 366 gün iken almayanlar için 74 gündü. Moberg
34 köpekten oluşan bir kohortta benzer sonuçlar bulmuştur;
kemoterapi uygulanan 25 köpekte teşhisten ölüme kadar geçen
süre 234 gün, diğerlerinde ise 29 gündür.16 Literatürde
mezotelyoma tedavisi için kemoterapi uygulanan yirmi dört köpek vakası daha tespit edilmiştir.1,17,18,30,32,33,36,39-41,46,47,49,53,56,61,69,70,73
14’ünde (%58,3) intrakaviter, 7’sinde (%29,1) intravenöz ve 3’ünde (%12,5) her ikisi birlikte uygulanmıştır. İntrakaviter uygulanan moleküller sisplatin (10), karboplatin (4), mitoksantron ve karboplatin (1), gemsitabin ve karboplatin (1) ve paklitaksel yüklü yağ dokusu (1) idi. İntravenöz moleküller doksorubisin (5), mitoksantron (2), cisplatin (1) ve karboplatin (1) idi. Yayınlanmış vakalarda, kemoterapi ile tedavi edilen köpeklerin de daha uzun süre hayatta kaldığı görülmüştür (Tablo S4), ancak bu bir seleksiyon yanlılığı olabilir. Sonuç olarak, üç kohort kemoterapinin faydalı olduğunu gösteriyor gibi görünmektedir. Çalışmamızda, kemoterapiye yanıt, kemoterapi ile tedavi edilen köpekler arasında sağkalım ile ilişkili tek prognostik faktördü. İlk kemoterapi seansından sonra, %50’si CR’de idi.
Moberg ve ark. kemoterapinin başlamasından 3 hafta sonra klinik olarak ve rezidüel efüzyon drenajının ölçülmesiyle yanıt değerlendirildiğinde tam yanıt verenlerin oranını %4, yanıt verenlerin oranını ise %37 olarak bildirmiştir. Yayınlanan diğer 13 vakada kemoterapiye yanıt çalışmamızda tanımlanan kriterlere göre değerlendirilmiştir; 3/13 köpekte tam yanıt elde edilmiştir. Tam yanıt oranlarındaki farklılıklar, olası değerlendirme yanlılığı ve grup başına oldukça az sayıda vaka göz önünde bulundurularak ihtiyatlı bir şekilde yorumlanmalıdır. Bununla birlikte, bu durum uygulanan farklı protokollerle de bağlantılı olabilir.Örneğin, bizim çalışmamızda köpeklerin %52’sinde, literatür taramamızda %46’sında sisplatin kullanılırken, Moberg’in çalışmasında hiçbir köpekte sisplatin kullanılmamıştır . İnsanlarda, sisplatin mezotelyomanın ilk basamak tedavisinin bir parçasıdır .10-12,77 Köpeklerde, esas olarak ilişkili nefrotoksisitesi nedeniyle sık kullanılmamaktadır; ancak, yeterli salin diüreziyle intrakaviter olarak uygulandığında iyi tolere edildiği görülmektedir .17,78 Bizim kohortumuzda hiçbir nefrotoksisite vakası bildirilmemiştir . Ayrıca, kohortumuzdaki köpeklerin %41’inde, literatür taramamızda %25’inde ve Moberg’in kohortunda %17’sinde ilk basamak kemoterapi olarak çeşitli moleküller uygulanmıştır . İnsanlarda yanıt oranları, tek ajanlı protokollere kıyasla çok ajanlı protokollerde daha yüksektir.79
Çalışmamızda, cerrahi ile tedavi edilen köpekler istatistiksel olarak anlamlı olmasa da daha uzun yaşama eğilimindeydi. Moberg’in serisinde 20 köpeğe perikardektomi uygulanmış ve 22 köpeğe deri altı plevral ve/veya peritoneal port yerleştirilmiştir ancak bu prosedürlerle ilişkili sonuçlar gösterilmemiştir.16 Literatürde 71/105 (%67,6) köpeğe cerrahi uygulanmıştır . Bunların 61’inde (%85,9) perikardiyektomi, 9’unda (%12,6) debulking ve 1’inde (%1,4) her ikisi birden uygulanmıştır. Ameliyatla tedavi edilen köpekler daha uzun süre hayatta kalma eğilimindeydi; ancak, bizim kohortumuzda olduğu gibi, çoğu köpek ya ameliyat ve kemoterapi aldı ya da hiçbir tedavi almadı. Bizim kohortumuzda, kemoterapi almayan grupta sadece iki köpek
ameliyat edilmiştir, bu da etkinliği değerlendirmek için yeterli değildir . Analizimizi kemoterapi alan köpeklerle sınırlandırdığımızda, ne literatürde ne de kohortumuzda cerrahi ile sonuç arasında bir eğilim bulunamamıştır. Cerrahinin sonuç üzerindeki etkisinin daha fazla değerlendirilmesi gerekmektedir; ideal olarak, çeşitli cerrahi prosedürlerin karşılaştırılması ile spesifik lokalizasyonda prospektif çalışmalar gerekli olacaktır.
Çalışmamızın temel kısıtlamaları retrospektif olmasından kaynaklanmaktadır. Tanı, evreleme ve tedavi protokolleri standardize edilmemiştir. Çoğu vakada sonuca varmak için çok değişkenli analizler gerekliydi ancak dahil edilen vaka sayısının sınırlı olması nedeniyle her zaman gerçekleştirilemedi. Tüm köpeklerde tam evreleme yapılmamış olsa da, neoplastik kavitenin görüntülenmesi her zaman gerçekleştirilmiştir. Bu nedenle, etkilenen boşlukta herhangi bir kitle olmaksızın karsinomatöz veya sarkomatöz efüzyon vakaları olası görünmediğinden sitopatolojik incelemelere dayalı tanıya izin verilmiştir.80 Ayrıca, insan tıbbında sitoloji, klinik ve görüntüleme bağlamı mezotelyoma lehine olduğunda ve biyopsiler alınamadığında kabul edilebilir bir tanı aracı olabilir.10,81 Ayrıca, histopatolojik incelemeler her zaman güvenilir değildir ve immünohistokimya proliferasyonun neoplastik doğasını değil, yalnızca mezotelyal kökenini doğrulayabilir.6 Bu nedenle, çalışmamızda morfolojik inceleme her zaman klinik ve görüntüleme sonuçlarıyla karşı karşıya getirilmiş ve bu da yanlış tanı riskini azaltmıştır.
5 | SONUÇ
Sonuç olarak, kemoterapi kohortumuzdaki mezotelyomalı köpeklerde sağkalım artışı sağlamıştır; ilk uygulamadan sonra tam yanıt, tespit edilen tek pozitif prognostik faktördür. Cerrahinin sağkalım üzerindeki etkisi bilinmemektedir ve neoplastik yerleşime bağlı olabilir.
TEŞEKKÜRLER
Yazarlar, Dr. Esther Piccirillo ve Dr. Laurie Boissy’ye dosyaların bir kısmının toplanmasındaki yardımları için içtenlikle teşekkür etmektedir. Yazarlar, bazı vakaların dahil edildiği Advetia (Velizy- Villacoublay, Fransa) veteriner hastanesine ve Toulouse veterinerlik okuluna teşekkür etmektedir. Yazarlar ayrıca Dr.Isabelle Bublot’a (VetAgro Sup’ta kardiyoloji eski pratisyeni) ve VetAgro Sup yoğun bakım ünitesine bazı vakaların yönetimindeki yardımları ve bu çalışmanın ön çalışmalarındaki yardımları için teşekkür etmektedir. Son olarak, yazarlar vakaların teşhisinde yer alan tüm sevk eden veteriner hekimlere, radyologlara, sitopatologlara ve patologlara teşekkür etmektedir.
FİNANSMAN BİLGİLERİ
Bu çalışma herhangi bir finansman desteği almamıştır.
ÇIKAR ÇATIŞMASI BEYANI
Yazar herhangi bir çıkar çatışması olmadığını beyan etmektedir.
833
VERİ ERİŞİM BEYANI
Bu çalışmanın bulgularını destekleyen veriler, talep edilmesi halinde ilgili yazardan temin edilebilir.
ORCID
David Sayag
KAYNAKÇA
https://orcid.org/0000-0001-5084-8892
1. Stepien RL, Whitley NT, Dubielzig RR. Idiopathic or mesothelioma- related pericardial effusion: clinical findings and survival in 17 dogs studied retrospectively. J Small Anim Pract. 2000;41(8):342-347. doi: 10.1111/j.1748-5827.2000.tb03215.x
2. Cagle LA, Epstein SE, Owens SD, Mellema MS, Hopper K, Burton AG. Diagnostic yield of cytologic analysis of pericardial effusion in dogs. J Vet Intern Med. 2014;28(1):66-71. doi:10.1111/jvim.12253
3. Munday JS, Löhr CV, Kiupel M. Tumors of the alimentary tract. Tumors in Domestic Animals. John Wiley & Sons, Ltd; 2016:499-601. doi:10.1002/9781119181200.ch13
4. Goupil A, Bolliger C, Lapointe C, Morency A, Girard C. Embolised mesothelial cells in a tracheobronchial lymph node associated with idiopathic chylopericardium in a dog. J Small Anim Pract. 2012;53(11): 664-667. doi:10.1111/j.1748-5827.2012.01285.x
5. Peters M, Tenhündfeld J, Stephan I, Hewicker-Trautwein M. Embolized mesothelial cells within mediastinal lymph nodes of three dogs with idiopathic haemorrhagic pericardial effusion. J Comp Pathol. 2003;128(2–3):107-112. doi:10.1053/jcpa.2002.0612
6. Milne E, Martinez Pereira Y, Muir C, et al. Immunohistochemical dif- ferentiation of reactive from malignant mesothelium as a diagnostic aid in canine pericardial disease: immunohistochemistry of canine mesothelioma. J Small Anim Pract. 2018;59(5):261-271. doi:10.1111/ jsap.12830
7. Tickman RJ, Cohen C, Varma VA, Fekete PS, DeRose PB. Distinction between carcinoma cells and mesothelial cells in serous effusions use- fulness of Immunohistochemistry. Acta Cytol. 1990;34(4):491-496.
8. Andreasen CB, Mahaffey EA, Duncan JR. Intermediate filament staining in the cytologic and histologic diagnosis of canine skin and soft tissue tumors. Vet Pathol. 1988;25(5):343-349. doi:10.1177/ 030098588802500502
9. Desnoyers MM, Haines DM, Searcy GP. Immunohistochemical detec- tion of intermediate filament proteins in formalin fixed normal and neoplastic canine tissues. Can J Vet Res Rev Can Rech Veterinaire. 1990;54(3):360-365.
10. Janes SM, Alrifai D, Fennell DA. Perspectives on the treatment of malignant pleural mesothelioma. N Engl J Med. 2021;385(13):1207- 1218. doi:10.1056/NEJMra1912719
11. Nadal E, Bosch-Barrera J, Cedrés S, et al. SEOM clinical guidelines for the treatment of malignant pleural mesothelioma (2020). Clin Transl Oncol. 2021;23(5):980-987. doi:10.1007/s12094-020-02532-2
12. Board PATE. Malignant Mesothelioma Treatment (Adult) (PDQ®). National Cancer Institute, 2021. Accessed August 9, 2021. https:// www.ncbi.nlm.nih.gov/books/NBK65983/
13. Atencia S, Doyle RS, Whitley NT. Thoracoscopic pericardial window for management of pericardial effusion in 15 dogs. J Small Anim Pract. 2013;54(11):564-569. doi:10.1111/jsap.12138
14. Jackson J, Richter KP, Launer DP. Thoracoscopic partial Peri- cardiectomy in 13 dogs. J Vet Intern Med. 1999;13(6):529-533. doi: 10.1111/j.1939-1676.1999.tb02205.x
15. Michelotti KP, Youk A, Payne JT, Anderson J. Outcomes of dogs with recurrent idiopathic pericardial effusion treated with a 3-port right- sided thoracoscopic subtotal pericardiectomy. Vet Surg. 2019;48(6): 1032-1041. doi:10.1111/vsu.13223
- Moberg HL, Gramer I, Schofield I, et al. Clinical presentation, treat- ment and outcome of canine malignant mesothelioma: a retrospective study of 34 cases. Vet Comp Oncologia. 2021;20:1-9. doi:10.1111/ vco.12777
- Moore AS, Kirk C, Cardona A. Intracavitary cisplatin chemotherapy experience with six dogs. J Vet Intern Med. 1991;5(4):227-231. doi:10.1111/j.1939-1676.1991.tb00953.x
- SpugniniEP,CrispiS,ScarabelloA,CarusoG,CitroG,BaldiA.Piroxicam and intracavitary platinum-based chemotherapy for the treatment of advanced mesothelioma in pets: preliminary observations. J Exp Clin Cancer Res CR. 2008;27(1):6. doi:10.1186/1756-9966-27-6
- LeBlanc AK, Atherton M, Bentley RT, et al. Veterinary cooperative oncology group-common terminology criteria for adverse events (VCOG-CTCAE v2) following investigational therapy in dogs and cats. Vet Comp Oncol. 2021;19(2):311-352. doi:10.1111/vco.12677
- Nguyen SM, Thamm DH, Vail DM, London CA. Response evaluation criteria for solid tumours in dogs (v1.0): a veterinary cooperative oncology group (VCOG) consensus document. Vet Comp Oncologia. 2015;13(3):176-183. doi:10.1111/vco.12032
- Eisenhauer EA, Therasse P , Bogaerts J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J
Cancer. 2009;45(2):228-247. doi:10.1016/j.ejca.2008.10.026
- Breeze R, Lauder I. Pleural mesothelioma in a dog. Vet Rec. 1975; 96(11):243-246. doi:10.1136/vr .96.11.243
- van Ooijen PG. Exfoliative cytology in the diagnosis of diffuse meso- thelioma in the dog. Illustration by a case report. Tijdschr Diergeneeskd. 1978;103(20):1116-1120.
- Ikede BO, Zubaidy A, Gill CW. Pericardial mesothelioma with cardiac tamponade in a dog. Vet Pathol. 1980;17(4):496-500. doi:10.1177/ 030098588001700412
- Trigo FJ, Morrison WB, Breeze RG. An ultrastructural study of canine mesothelioma. J Comp Pathol. 1981;91(4):531-537. doi:10.1016/ 0021-9975(81)90081-5
- Harbison ML, Godleski JJ. Malignant mesothelioma in urban dogs. Vet Pathol. 1983;20(5):531-540. doi:10.1177/030098588302000504
- Craig JA, Helman RG, Walker M. Costal bone changes similar tohypertrophic osteopathy associated with pulmonary and abdominal mesothelioma in a dog. J Am Vet Med Assoc. 1985;186(10):1100- 1101.
- Cihak RW, Roen DR, Klaassen J. Malignant mesothelioma of the tunica vaginalis in a dog. J Comp Pathol. 1986;96(4):459-462. doi:10. 1016/0021-9975(86)90041-1
- Smith DA, Hill FWG. Metastatic malignant mesothelioma in a dog. J Comp Pathol. 1989;100(1):97-101. doi:10.1016/0021-9975(89) 90094-7
- Ogilvie GK, Reynolds HA, Richardson RC, et al. Phase II evaluation of doxorubicin for treatment of various canine neoplasms. J Am Vet Med Assoc. 1989;195(11):1580-1583.
- Forbes DC, Matthews BR. Abdominal mesothelioma in a dog. Can Vet J. 1991;32(3):176-177.
- Ogilvie GK, Obradovich JE, Elmslie RE, et al. Efficacy of mitoxantrone against various neoplasms in dogs. J Am Vet Med Assoc. 1991;198(9): 1618-1621.
- Keller ET, Vail DM. Intrapleural administration of cisplatin (DDP) for treatment of pleural neoplasia. J Vet Intern Med. 1992;6(3):198-199.
- Leisewitz AL, Nesbit JW. Malignant mesothelioma in a seven-week- old puppy. J S Afr Vet Assoc. 1992;63(2):70-73.
- Schoning P, Layton CE, Fortney WD, Willard LH, Cook JE. Sclerosing peritoneal mesothelioma in a dog evaluated by electron microscopy and immunoperoxidase techniques. J Vet Diagn Invest. 1992;4(2):217- 220. doi:10.1177/104063879200400226
- McDonough SP, MacLachlan NJ, Tobias AH. Canine pericardial meso- thelioma. Vet Pathol. 1992;29(3):256-260. doi:10.1177/ 030098589202900312
37. DiPinto M, Dunstan R, Lee C. Cystic, peritoneal mesothelioma in a dog. J Am Anim Hosp Assoc. 1995;31(5):385-389. doi:10.5326/ 15473317-31-5-385
38. Kerstetter KK, Krahwinkel DJ, Millis DL, Hahn K. Pericardiectomy in dogs: 22 cases (1978-1994). J Am Vet Med Assoc. 1997;211(6):736-740. 39. Dunning D, Monnet E, Orton EC, Salman MD. Analysis of prognostic
indicators for dogs with pericardial effusion: 46 cases (1985-1996).
J Am Vet Med Assoc. 1998;212(8):1276-1280.
40. Closa JM, Font A, Mascort J. Pericardial mesothelioma in a dog: long-
term survival after pericardiectomy in combination with chemother- apy. J Small Anim Pract. 1999;40(8):383-386. doi:10.1111/j.1748- 5827.1999.tb03105.x
41. Neath PJ, Brockman DJ, King LG. Lung lobe torsion in dogs: 22 cases (1981-1999). J Am Vet Med Assoc. 2000;217(7):1041-1044. doi:10. 2460/javma.2000.217.1041
42. Dias Pereira P, Azevedo M, Gärtner F. Case of malignant biphasic mesothelioma in a dog. Vet Rec. 2001;149(22):680-681. doi:10.1136/ vr .149.22.680
43. Kim JH, Choi YK, Yoon HY, Kweon OK, Kim DY. Juvenile malignant mesothelioma in a dog. J Vet Med Sci. 2002;64(3):269-271. doi:10. 1292/jvms.64.269
44. Geninet C, Bernex F, Rakotovao F, Crespeau FL, Parodi AL, Fontaine JJ. Sclerosing peritoneal mesothelioma in a dog – a case report. J Vet Med Ser A. 2003;50(8):402-405. doi:10.1046/j.0931- 184X.2003.00566.x
45. Machida N, Tanaka R, Takemura N, Fujii Y, Ueno A, Mitsumori K. Development of pericardial mesothelioma in golden retrievers with a long-term history of idiopathic haemorrhagic pericardial effusion. J Comp Pathol. 2004;131(2–3):166-175. doi:10.1016/j.jcpa.2004. 03.002
46. Charney SC, Bergman PJ, McKnight JA, et al. Evaluation of intracavitary mitoxantrone and carboplatin for treatment of carcino- matosis, sarcomatosis and mesothelioma, with or without malignant effusions: a retrospective analysis of 12 cases (1997-2002)*. Vet Comp Oncol. 2005;3(4):171-181. doi:10.1111/j.1476-5810.2005. 00075.x
47. Reggeti F, Brisson B, Ruotsalo K, Southorn E, Bienzle D. Invasive epi- thelial mesothelioma in a dog. Vet Pathol. 2005;42(1):77-81. doi:10. 1354/vp.42-1-77
48. Sato T , Miyoshi T , Shibuya H, Fujikura J, Koie H, Miyazaki Y . Perito- neal biphasic mesothelioma in a dog. J Vet Med Ser A. 2005;52(1):22- 25. doi:10.1111/j.1439-0442.2004.00680.x
49. Brisson BA, Reggeti F, Bienzle D. Portal site metastasis of invasive mesothelioma after diagnostic thoracoscopy in a dog. J Am Vet Med Assoc. 2006;229(6):980-983. doi:10.2460/javma.229.6.980
50. Brower A, Herold LV, Kirby BM. Canine cardiac mesothelioma with granular cell morphology. Vet Pathol. 2006;43(3):384-387. doi:10. 1354/vp.43-3-384
51. Morini M, Bettini G, Morandi F, Burdisso R, Marcato P. Deciduoid peritoneal mesothelioma in a dog. Vet Pathol. 2006;43(2):198-201. doi:10.1354/vp.43-2-198
52. Liptak JM, Brebner NS. Hemidiaphragmatic reconstruction with a transversus abdominis muscle flap after resection of a solitary dia- phragmatic mesothelioma in a dog. J Am Vet Med Assoc. 2006;228(8): 5-1208.
53. Seo KW, Choi US, Jung YC, et al. Palliative intravenous cisplatin treat- ment for concurrent peritoneal and pleural mesothelioma in a dog. J Vet Med Sci. 2007;69(2):201-204. doi:10.1292/jvms.69.201
54. Echandi RL, Morandi F, Newman SJ, Holford A. Imaging diagnosis— canine thoracic mesothelioma. Vet Radiol Ultrasound. 2007;48(3):243- 245. doi:10.1111/j.1740-8261.2007.00236.x
55. Vural SA, Ozyildiz Z, Ozsoy SY. Pleural mesothelioma in a nine- month-old dog. Iran Vet J. 2007;60(1):30-33. doi:10.1186/2046- 0481-60-1-30
- Avakian A, Alroy J, Rozanski E, Keating J, Rosenberg A. Lipid-rich pleural mesothelioma in a dog. J Vet Diagn Invest. 2008;20(5):665- 667. doi:10.1177/104063870802000525
- MacDonald KA, Cagney O, Magne ML. Echocardiographic and clinico- pathologic characterization of pericardial effusion in dogs: 107 cases (1985-2006). J Am Vet Med Assoc. 2009;235(12):1456-1461. doi:10. 2460/javma.235.12.1456
- Espino L, Vazquez S, Faílde D, Barreiro A, Miño N, Goicoa A. Local- ized pleural mesothelioma causing cranial vena cava syndrome in a dog. J Vet Diagn Invest. 2010;22(2):309-312. doi:10.1177/ 104063871002200228
- Gumber S, Fowlkes N, Cho DY. Disseminated sclerosing peritoneal mesothelioma in a dog. J Vet Diagn Invest. 2011;23(5):1046-1050. doi:10.1177/1040638711416625
- Vascellari M, Carminato A, Camali G, Melchiotti E, Mutinelli F. Malignant mesothelioma of the tunica vaginalis testis in a dog: histo- logical and Immunohistochemical characterization. J Vet Diagn Invest. 2011;23(1):135-139. doi:10.1177/104063871102300125
- Gallach RG, Mai W. Cardiac MRI findings in a dog with a diffuse peri- cardial mesothelioma and pericardial effusion. J Am Anim Hosp Assoc. 2013;49(6):398-402. doi:10.5326/JAAHA-MS-5925
- Yamamoto S, Fukushima R, Kobayashi M, Machida N. Mixed form of pericardial mesothelioma with osseous differentiation in a dog. J Comp
Pathol. 2013;149(2– 3):229-232. doi:10.1016/j.jcpa.2013.01.009
- de Brot S, Hilbe M. Pulmonary alveolar microlithiasis with concurrent pleural mesothelioma in a dog. J Vet Diagn Invest. 2013;25(6):798- 802. doi:10.1177/1040638713504571
- D’Angelo AR, Di Francesco G, Rosaria G. Sclerosing peritoneal meso- thelioma in a dog: histopathological, histochemical and immunohisto- chemical investigations. Vet Ital. 2014;50(4):301-305. doi:10.12834/ VetIt.20.1309.130
- Stevens BJ, Montgomery SA, Phillips KL, Wester MW, Jennings SH. Pathology in practice. J Am Vet Med Assoc. 2014;245(1):57-59. doi:10.2460/javma.245.1.57
- Di Tommaso M, Rocconi F, Marruchella G, et al. Invasive pleural malignant mesothelioma with rib destruction and concurrent osteo- sarcoma in a dog. Acta Vet Scand. 2015;57:85. doi:10.1186/s13028- 015-0176-1
- Son NV, Chambers JK, Shiga T, et al. Sarcomatoid mesothelioma of tunica vaginalis testis in the right scrotum of a dog. J Vet Med Sci. 2018;80(7):1125-1128. doi:10.1292/jvms.18-0186
- Pascotto E, Gianoncelli A, Calligaro C, et al. Ferruginous bodies resolved by synchrotron XRF in a dog with peritoneal malignant mesothelioma. Environ Sci Pollut Res Int. 2018;25(35):35707-35714. doi:10.1007/s11356-018-3521-x
- Nabeta R, Nakagawa Y, Chiba S, et al. Pericardial mesothelioma in a dog: the feasibility of ultrasonography in monitoring tumor progres- sion. Front Vet Sci. 2019;6:121. doi:10.3389/fvets.2019.00121
- Hartmann HF, De Oliveira MT, Feranti JPS, et al. Thoracoscopic peri- cardiectomy associated with fully implantable catheter via thoracoscopy in the management of mesothelioma in a bitch. J Vet Med Sci. 2019;81(6):946-948. doi:10.1292/jvms.17-0631
- Morgan KRS, Dominic CG, Beeler-Marfisi J, et al. Presumptive seeding metastasis of pericardial mesothelioma following repeated
pericardiocentesis in a dog. Can Vet J Rev Veterinaire Can. 2019;60(9):
972-975.
72. Rivera P A, Borgarelli M. Cardiovascular images: constrictive pericardi-
tis and tricavitary effusion in a dog with pericardial mesothelioma.
J Vet Cardiol. 2020;32:55-59. doi:10.1016/j.jvc.2020.09.005
73. Zeira O, Ghezzi E, Pettinari L, et al. Case report: microfragmented adi- pose tissue drug delivery in canine mesothelioma: a case report on safety, feasibility, and clinical findings. Front Vet Sci. 2020;7:585427.
doi:10.3389/fvets.2020.585427
74. McGehee E, Gerber DE, Reisch J, Dowell JE. Treatment and out-
comes of primary pericardial mesothelioma: a contemporary review of 103 published cases. Clin Lung Cancer. 2019;20(2):e152-e157. doi:10.1016/j.cllc.2018.11.008
75. Watton TC, Lara-Garcia A, Lamb CR. Can malignant and inflammatory pleural effusions in dogs be distinguished using computed tomogra- phy?VetRadiolUltrasoundoffJAmCollVetRadiolIntVetRadiolAssoc. 2017;58(5):535-541. doi:10.1111/vru.12534
76. Reetz JA, Suran JN, Zwingenberger AL, Stefanovski D. Nodules and masses are associated with malignant pleural effusion in dogs and cats but many other intrathoracic CT features are poor predictors of the effusion type. Vet Radiol Ultrasound off J Am Coll Vet Radiol Int Vet Radiol Assoc. 2019;60(3):289-299. doi:10.1111/vru.12706
77. Ettinger DS, Wood DE, Akerley W, et al. NCCN guidelines insights: malignant pleural mesothelioma, version 3.2016. J Natl Compr Cancer Netw JNCCN. 2016;14(7):825-836.doi:10.6004/jnccn.2016.0087
78. Barabas K, Milner R, Lurie D, Adin C. Cisplatin: a review of toxicities and therapeutic applications. Vet Comp Oncol. 2008;6(1):1-18. doi:10. 1111/j.1476-5829.2007.00142.x
79. Vogelzang NJ, Rusthoven JJ, Symanowski J, et al. Phase III study of pemetrexed in combination with cisplatin versus cisplatin alone in patients with malignant pleural mesothelioma. J Clin Oncol off J Am Soc Clin Oncol. 2003;21(14):2636-2644. doi:10.1200/JCO.2003.11.136
80. Weston PJ, Baines SJ, Finotello R, Mortier JR. Clinical, CT, and ultrasonographic features of canine and feline pleural and peritoneal carcinomatosis and sarcomatosis. Vet Radiol Ultrasound. 2021;62(3): 331-341. doi:10.1111/vru.12951
81. Alì G, Bruno R, Fontanini G. The pathological and molecular diagnosis of malignant pleural mesothelioma: a literature review. J Thorac Dis. 2018;10(Suppl 2):S276-S284. doi:10.21037/jtd.2017.10.125
EK BİLGİ
Ek destekleyici bilgiler, yayıncının web sitesindeki makalenin çevrimiçi versiyonunda bulunabilir.
Bu makaleye atıfta bulunmak için: Lajoinie M, Chavalle T , Floch F, et al. Outcome of dogs treated with chemotherapy for mesothelioma: A retrospective clinical study on 40 cases and a literature review. Vet Comp Oncol. 2022;20(4):825‐835. doi:10.1111/vco.12843