1North 1North Downs Hastanesi, Brewerstreet Dairy Business Park, Surrey, Birleşik Krallık
2Küçük Hayvan Klinik Bilimleri Bölümü, Veteriner Bilimleri Enstitüsü, Sağlık ve Yaşam Bilimleri Fakültesi, Liverpool Üniversitesi, Neston, Birleşik Krallık
3Bologna Üniversitesi, Veteriner Tıp Bilimleri Bölümü, Bologna, İtalya
4Centro Oncologico Veterinario, Sasso Marconi, İtalya
5Centro Veterinario Torinese, Torino, İtalya
6Radyasyon Onkolojisi Bölümü, Veteriner Hekimlik Fakültesi, Zürih Üniversitesi, Zürih, İsviçre
İlgili Yazar
L. Marconato, Centro Oncologico Veterinario, via San Lorenzo 1-4, 40037 Sasso Marconi (BO), İtalya.
E-posta: marconato@centroncologicovet.it
Rezeke edilemeyen veya metastatik (ilerlemiş) primer pulmoner karsinom (PPK), cerrahinin kontrendike olabileceği ve tolere edilebilir maksimum doz (MTD) kemoterapinin tedavi edici rolünün belirsiz kaldığı durumlarda oldukça zor bir tedavi yöntemidir. Bu çalışma, ilerlemiş PPK’li köpeklerde metronomik kemoterapinin (MK) etkisini araştırmak için yapılmıştır. Daha önce tedavi edilmemiş, ileri evre (T3 veya N1 veya M1) PPK’li, tam evreleme çalışması ve takip verileri olan, MK (düşük doz siklofosfamid, piroksikam ve talidomid içeren), cerrahi, MTD kemoterapi alan veya onkolojik tedavi almayan köpekler çalışmaya dahil edilmeye uygun bulunmuştur. Tüm hastaların progresyona kadar geçen süre (PKGS) ve sağkalım süresi (ST) değerlendirilmiştir. Yaşam kalitesi (YK) yalnızca MK alan hastalarda değerlendirilmiştir. Yaşam kalitesini değerlendirmek için, MK alan köpeklerin sahiplerinden tedavi öncesinde ve tedavi sırasında bir anket doldurmaları istenmiştir.
Doksan bir köpek çalışmaya dahil edilmiştir: 25’i MK, 36’sı cerrahi, 11’i MTD kemoterapi ile tedavi edilmiş ve 19’una hiçbir tedavi uygulanmamıştır. Yaşam kalitesi MK alan köpeklerde iyileşmiştir. Ortalama PKGS, MK uygulanan hastalarda (172 gün) cerrahi uygulanan (87 gün), MTD kemoterapi alan (22 gün) veya onkolojik tedavi uygulanmayan (20 gün) hastalara göre istatistiksel olarak anlamlı derecede daha uzundu. Ortalama ST, MK uygulanan hastalarda (139 gün) cerrahi (92 gün), MTD kemoterapi (61 gün) ve onkolojik tedavi uygulanmayan (60 gün) hastalara göre benzer şekilde daha uzundu. İlerlemiş PPK’li köpeklerde MK, önemli bir risk veya toksisite olmaksızın ölçülebilir nitelikte klinik fayda sağlamıştır. Bu da MK’yi bilinen diğer tedavi yöntemlerine potansiyel bir alternatif haline getirmektedir.
ANAHTAR KELİMELER
ileri evre, kanin, köpek, akciğer karsinomu, metronomik kemoterapi, prognoz, talidomid
1 | GİRİŞ
Primer pulmoner tümörler köpeklerde nadirdir ve tipik olarak hava yolu epitelinden veya alveolar parankimden kaynaklanır.1
Çeşitli prognostik faktörler tümörün ilerlemesi ve köpeklerin sağkalımı ile ilişkilendirilmiştir. Tanı anında klinik belirtiler gösteren köpeklerin, pulmoner neoplazinin tesadüfi şekilde teşhis edildiği köpeklere kıyasla daha kısa hastalıksız geçen süreye (HGS) ve sağkalım süresine (ST) sahip olması beklenmektedir.2
Bu çalışmanın bulguları, 2017 yılında Lyon’da düzenlenen Avrupa Veteriner Onkoloji Derneği Toplantısı’nda kısmen sunulmuştur.
Lokorejyonel lenf nodu tutulumu da kısa HGS ve ST’nin belirleyicilerindendir.2-5 Histolojik özelliklerle ilgili olarak, iyi diferansiye tümörlere sahip köpeklerin orta veya kötü diferansiye tümörlere sahip köpeklerden daha uzun HGS ve ST’ye sahip olması muhtemeldir; ayrıca, skuamöz hücre diferansiyasyonuna sahipköpeklerde ST’nin daha kısa olması muhtemeldir.4,6 Tümör remisyonu ile önemli ölçüde ilişkili diğer faktörler, primer tümör yayılımının derecesi, cerrahi müdahale sonrası gros tümör rezidüel hastalığının olmaması ve pulmoner metastatik hastalığın olmamasıdır.4 Tümör lokalizasyonu ve tümör hacmi de ST’nin belirleyicileri olarak kabul edilir; periferik lezyonlar, tüm lobu içeren lezyonlardan ve 100 cm3 ‘ten küçük tümör hacimlerinden elde edilen daha iyi sonuçlarla ilişkilidir.6
Köpek primer pulmoner karsinomu (PPK) için tedavi stratejisi temel olarak anatomik yerleşim, evre ve histolojik tipe göre değişmektedir. Cerrahi rezeksiyon, primer akciğer tümörlerinin tedavisinde önerilen tedavi yöntemidir ve şu anda küratif amaçlı tek tedavi metodudur. Bununla birlikte, cerrahi eksizyon, kesinintrapulmoner yerleşim, komşu organların invazyonu veya nodal veya uzak metastazların varlığı nedeniyle her zaman uygulanabilir veya endike değildir; bunlardan sonuncusu tanı sırasında köpeklerin %13,5- %23,1’inde görülmektedir.7 Bu nedenle, ilerlemiş (rezeke edilemeyen veya metastatik) PPK’li köpeklerde tümör büyümesini kontrol altına almak için henüz karşılanmayan büyük bir tıbbi ihtiyaç vardır.
Geleneksel tolere edilebilir maksimum doz (MTD) kemoterapisi, rezeke edilemeyen PPK için kullanılmış ve değişken sonuçlar elde edilmiştir. Bir çalışmada, vinorelbin ile tedavi edilen makroskopik akciğer tümörlü 7 köpekten 2’sinde tümör hacminde >%50 azalma görülmüştür.8 Daha yakın zamanda, vinorelbin makroskopik hastalığı olan 16 köpekte birincil tedavi olarak veya diğer kemoterapötik ajanları takiben uygulanmıştır. Üç köpekte kısmi remisyon (KR), 7’sinde stabil hastalık (SH) ve 6’sında progresif hastalık (PH) görülmüştür. Genel ortalama progresyona kadar geçen süre (PKGS) ve ST sırasıyla 55 ve 92 gün olarak bildirilmiştir.9 Doksorubisin ve mitoksantron dahil olmak üzere diğer ilaçlar , PPK tedavisinde bazı anti-tümör aktivite göstermiştir.10,11 Bununla birlikte, çalışma tasarımı, düşük vaka sayısı ve hastaların ve tümörlerin heterojenliği, genel olarak PPK tanısı konan köpek popülasyonuna ekstrapolasyonu sınırlamaktadır.
Anti-tümör tedavi alanında, metronomik kemoterapi (MK), geleneksel MTD kemoterapiye kıyasla uygun toksisite profili ve uygulama kolaylığı nedeniyle son zamanlarda cazip bir tedavi yöntemi olarak ilgi görmektedir.
MK, sitotoksik ilaçların uzun süreli ilaçsız molalar olmadan ve MTD’den çok daha düşük dozlarda, hem anti-anjiyojenik hem de immün-modülatör etkilerin terapötik etkisiyle birlikte uygulanmasını ifade eder.12
Veteriner onkolojisinde, MK çoğunlukla palyatif bir ortamda kullanılmıştır . MK olarak nitelendirilen ve rapor edilen tedavi protokolleri arasında, kullanılan sitotoksik ajanların ve destekleyici tedavilerin seçimi açısından farklılık bulunmaktadır .13-20 Benzer şekilde, yumuşak doku sarkomu, hemanjiyosarkom, osteosarkom ve transizyonel hücreli karsinom dahil olmak üzere, bu çeşitli tedavi protokollerini test etmek için bir dizi farklı kanser türü substrat olarak kullanılmıştır.13,14,17,18,20 Makroskopik tümörlerin tedavisi zaman zaman tümör boyutlarında ölçülebilir iyileşme sağlamakta ve vakaların %3-%11’inde KR veya tam remisyon (CR) elde edilmektedir .15-17 Bununla birlikte, MK’nin varsayılan etki şekli ile tutarlı olarak, bunun yerine stabil veya minimal bir seyir sağlanabilmekte ve makroskopik tümör ile tedavi edilen vakaların %30-%67’sinde bu durum rapor edilmiştir .15 -Bu ayrıca hemanjiyosarkom ve tam olarak eksize edilmemiş yumuşak doku sarkomlarında mikroskopik hastalığın adjuvan tedavisine ilişkin kanıtlarla da desteklenmektedir.14,20,21 Amputasyon ve konvansiyonel kemoterapinin ardından MK uygulanan osteosarkom vakalarında herhangi bir avantaj görülmemiştir.18
Metronomik rejimlerde sıkça kullanılan ilaçlar arasında siklofosfamid ve piroksikam bulunmaktadır.13,14,18 Köpeklerde talidomidin tek ajan olarak ya da siklofosfamid ve piroksikam ile birlikte metronomik tedavinin bir parçası olarak kullanıldığına dair
rapor sayısı daha azdır. Bu raporlarda toksisite profilinin olumlu olduğu ve bazı anti-tümör aktivitelerinin bulunduğu belirtilmiştir.20,22–24
Bu makalede, tek bir merkezde (Centro Oncologico Veterinario) ileri evre PPK için birinci basamak tedavi olarak MK ile tedavi edilen köpeklerin prospektif olarak kaydedildiği bir kohort anlatılmaktadır: değerlendirilen sonuçlar arasında PKGS, ST ve sağlıkla ilgili yaşam kalitesi (YK) yer almaktadır. Okuyucuya MK’ye alınan yanıtı değerlendirmek için yaklaşık olarak karşılaştırılabilir bir hasta popülasyonu sağlamak amacıyla, aynı ve diğer Uzman veteriner hastanesi arşivlerinden diğer modalitelerle eşzamanlı olarak tedavi edilen ileri PPK’li köpeklerden de geriye dönük olarak veri toplanmıştır.
2 | MATERYAL VE METOD 2.1 | Vaka seçimi
Bu çalışmada ileri evre PPK’li köpek hastaların sonuçları rapor edilmiştir. Tüm hastalar Ocak 2011 ile Ocak 2017 tarihleri arasında 5 kurumdan (Centro Oncologico Veterinario, Sasso Marconi, İtalya; North Downs Hastanesi, Surrey, Birleşik Krallık; Küçük Hayvan Eğitim Hastanesi, Liverpool Üniversitesi; Radyasyon Onkolojisi Bölümü, Vetsuisse Fakültesi, Zürih Üniversitesi, İsviçre; Centro Veterinario Torinese, Torino, İtalya) 1’ine başvurmuştur. Katılım için, köpeklerin daha önce tedavi edilmemiş, klinik olarak ilerlemiş, sitolojik veya histolojik olarak doğrulanmış PPK ile hastaneye getirilmesi ve hematoloji, biyokimya, idrar tahlili ve tüm vücut bilgisayarlı tomografi (TBCT) veya 3 poz toraks röntgeni gibi temel evrelemeden geçirilmesi şart koşulmuştur . Klinik evre kriterleri akciğer tümörleri için DSÖ TNM siteminden uyarlanmıştır (Ek A).25 Lenf düğümleri ile ilgili olarak, yalnızca BT’de genişlemiş olan veya kontrast artış paterni gösteren lenf düğümleri örneklenmiştir.
Klinik evre değerlendirmeleri evre T3 veya N1 veya M1’i gösteriyorsa veya görüntülemede tümör ile trakea arasında lobektominin güvenli bir şekilde yapılabilmesi için yeterli normal bronşiyal doku yoksa PPK ” ileri” evre olarak kabul edilmiştir.
Bulgular, tanı yöntemi, karsinom tipi, tümörün kaynaklandığı bölge, primer pulmoner lezyonun en uzun çapı, klinik evre, metastaz bölgesi, tedavi, tedaviye yanıt, PKGS, ST ve ölüm nedeni ile ilgili bilgiler klinik kayıtlardan elde edilmiştir. PKGS, tanı tarihinden ilk belgelenen progresyon tarihine veya PHkaydedilmemişse ölüm tarihine kadar hesaplanmıştır. ST, tanı ile ölüm veya son takip görüşmesi arasındaki zaman aralığı olarak tanımlanmıştır.
Bilinen başka ileri kardiyak, hepatik ve/veya renal hastalıkları veya hayatı tehdit etme potansiyeli olan diğer durumları olan vakalar hariç tutulmuştur; ayrıca takip bilgilerine ulaşılamayan vakalar da hariç tutulmuştur.
2.2 | Metronomik kemoterapi grubu
MK oral yoldan uygulanmış ve düşük doz siklofosfamid (10 mg/m2 24 saatte bir veya 48 saatte bir; Endoxan, Baxter s.r.l., Lurago d’Erba, Como, İtalya), piroksikam (0,3 mg/kg 24 saatte bir; Piroksikam, Pfizer Italia s.r.l, Latina, İtalya) ve talidomid (2 mg/kg
24 saatte bir; Talidomid, Fagron Italia s.r.l., Quarto Inferiore, Bologna, İtalya); MK ilaçları hastalar için ayrı ayrı hazırlanmıştır. Talidomid uygulayan hasta sahipleri, bilinen teratojenik etkisi konusunda kapsamlı bir şekilde bilgilendirilmiştir . MK alan köpekler , eş zamanlı MTD kemoterapi almadıkları takdirde çalışmaya dahil edilmeye uygun görülmüştür .
Çalışma sırasında araştırmacıların klinik uzmanlığına dayalı olarak bir YK anketi uygulanmış ve bu anket başlangıçta (MK’ye başlamadan önce) ve tedavi sırasında (1 ay, 2 ay ve sonrasında her 3 ayda bir; Ek B) değerlendirilmiştir .
Göğüs radyografisi, hematoloji, biyokimya ve idrar tahlili ile hastalık değerlendirmesi tedavinin ilk 6 ayı boyunca her 6 ila 8 haftada bir ve sonrasında her 3 ayda bir yapılmıştır. Yanıt cRECIST kriterlerine göre TY, KR ve SH şeklinde tanımlanmış ve bu çalışma için 4 haftadan uzun sürmesi şart koşulmuştur. Yanıt oranı (YO) TY ve KR elde eden tüm hastaların toplamı şeklinde tanımlanmıştır. Klinik fayda oranı (KF) TY, KR ve SH elde eden tüm hastaların toplamı şeklinde tanımlanmıştır .26
Yan etkiler Veteriner Onkoloji Grubu (VCOG) kılavuzlarına göre kaydedilmiştir .27
Tüm MK vakaları, bazı kurumlar için talidomid tedarikindeki zorluklar ve Birleşik Krallık’ta bulunan merkezler için yürürlükte olan kısıtlamalar nedeniyle Centro Oncologico Veterinario aracılığıyla çalışmaya dahil edilmiştir.
2.3 | Diğer klinik gruplar
Katılımcı merkezlerden herhangi birinde cerrahi, MTD kemoterapi ile tedavi edilen veya onkolojik tedavi uygulanmayan ileri evre PPK’li köpeklerden elde edilen veriler, sonuç analizleri için karşılaştırma grubu olarak sunulmak üzere alınmıştır. Sonuca ilişkin bilgiler dahil edilmek için şarttı.
MTD kemoterapi alan köpekler için yanıt, KF ve yan etkiler daha önce açıklandığı gibi değerlendirilmiştir.
2.4 | İstatistiksel analiz
Köpek ve tümör özelliklerinin analizinde tanımlayıcı istatistikler kullanılmıştır. Uygun hallerde, veri setleri D’Agostino ve Pearson omnibus normallik testi kullanılarak normallik açısından test edilmiştir. Değerler, normal dağılım durumunda ortalama SD olarak veya normal olmayan dağılım halinde bir aralıkla birlikte ortalama olarak ifade edilmiştir . T edavi grupları arasında evre dağılımındaki farklılıkları değerlendirmek için χ2 testi ve Fisher kesin olasılık testi uygulanmıştır.
Başlangıçta ve MK süresince toplam ve kısmi YK skorlarındaki farklılıklar eşleştirilmiş Student t-testi ile değerlendirilmiştir.
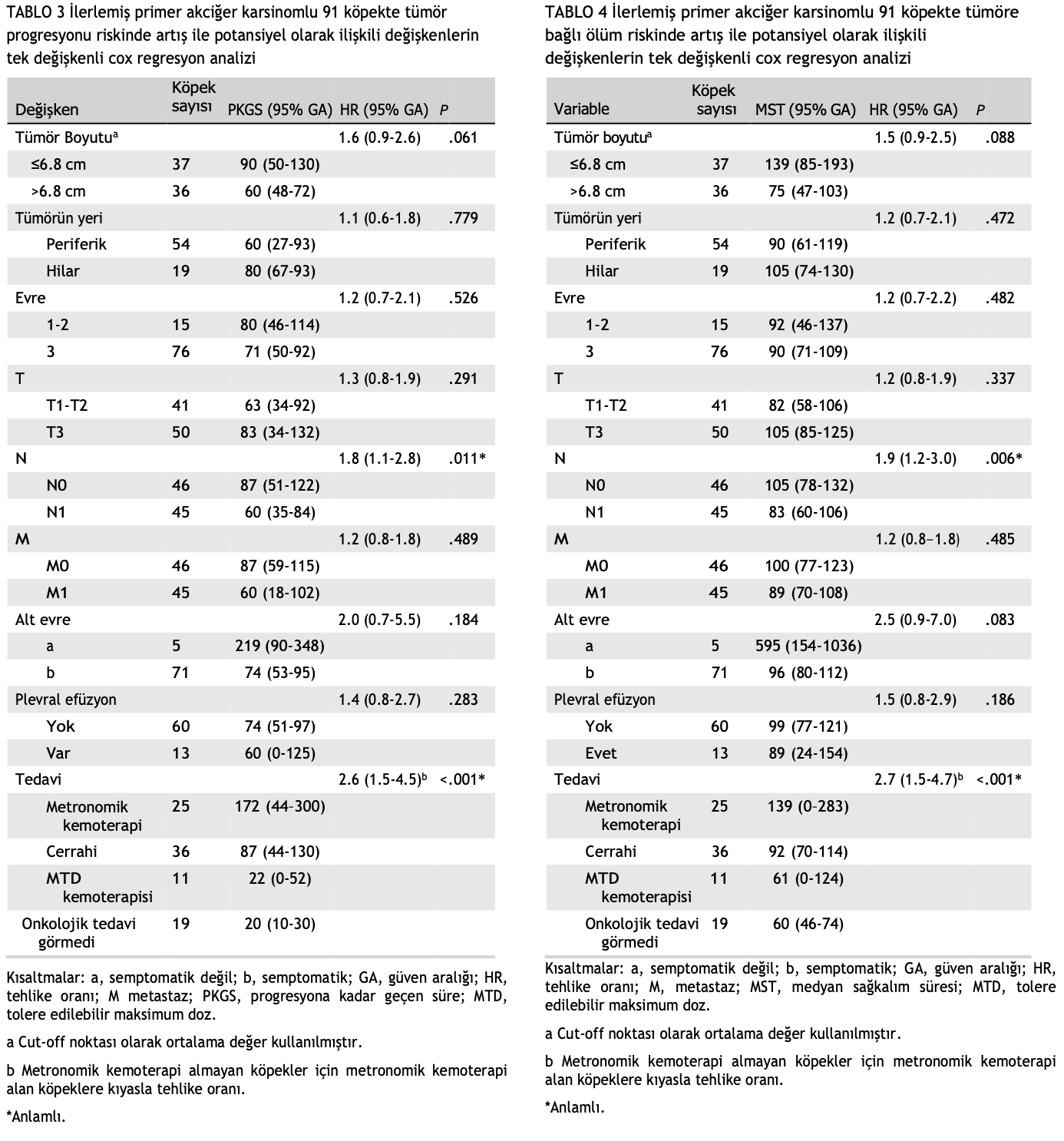
Alınan tedavinin ve diğer potansiyel prognostik değişkenlerin (tümör boyutu, yerleşim yeri, evre, T, N, M, alt evre, plevral efüzyon ve tedavi) PKGS ve ST üzerindeki etkisi tek değişkenli ve çok değişkenli Cox regresyon analizleri ile incelenmiştir.
Prognostik faktör analizine dahil edilebilmek için değişkenlerin vakaların %70’i veya daha fazlasının kaydedilmiş olması gerekiyordu.
Potansiyel risk faktörleri için tehlike oranları, zamandan bağımsız değişkenlerle birlikte Cox regresyon modeli ile hesaplanmıştır. Confidence intervals (95%) were calculated for hazard ratios. T ehlike oranları için güven aralıkları (%95) hesaplanmıştır. Tek değişkenli analizde P < .05 değerine sahip değişkenler çok değişkenli model için tercih edilmiştir.
Sağkalım eğrileri Kaplan-Meier çarpım-limit yöntemine göre oluşturulmuştur. Sağkalım tahminleri, karşılık gelen %95 güven aralıkları (%95 GA) ile birlikte ortalama olarak sunulmuştur.
Sağkalım analizi için, tümörle ilişkili veya ilişkili olmayan nedenlerle (ST) veya kayıt altına alınmış PH (PKGS) nedeniyle ölen köpekler olay olarak değerlendirilmiştir. Köpekler, çalışma süresinin sonunda hayattaysa (ST) veya belgelenmiş PH’si yoksa (PKGS) sansürlenmiştir.
İstatistiksel analiz SPSS Statistics v.19 (IBM, New York, Amerika Birleşik Devletleri) ile gerçekleştirilmiştir. Anlamlılık P < .05 olarak belirlenmiştir.
3 | SONUÇLAR
3.1 | Köpekler ve tümör özellikleri
Doksan bir köpek dahil edilme kriterlerine uymuş ve dahil edilmiştir: 35 köpek Centro Oncologico Veterinario’dan, 26 köpek North Downs Hastanesi’nden, 17 köpek Liverpool Üniversitesi Küçük Hayvan Eğitim Hastanesi’nden, 10 köpek Zürih Üniversitesi Vetsuisse Fakültesi Radyasyon Onkolojisi Bölümü’nden ve 3 köpek Centro Veterinario Torinese’den alınmıştır. Karma ırk köpekler çoğunluktaydı (n = 35; %38,4), bunu Dobermann Pinscher (n = 7; %7,7), Boxer (n = 6; %6,6), İngiliz Springer Spaniel (n = 4; %4,4), Border Collie (n = 3; %3. 3), Labrador (n = 3; %3,3), Staffordshire bull terrier (n = 3; %3,3), Bernese dağ köpeği (n = 2; %2,2), Cocker Spaniel (n = 2; %2,2), Jack Russell Terrier (n = 2; %2. 2) ve 1’er adet Airedale Terrier, Beagle, Belçika Çoban Köpeği, Bull Mastiff, Cavalier King Charles Spaniel, Chihuahua, Dogo Argentino, İngiliz Setter, Fox Terrier, Alman Çoban Köpeği, Alman Kısa Tüylü Pointer, Golden Retriever, Lurcher,Minyatür Kaniş, Minyatür Schnauzer, İngiliz Çoban Köpeği, Parson Russell Terrier, Pug, Segugio Italiano, Spitz, Standart Kaniş, Weimaraner, West Highland White Terrier ve Yorkshire Terrier takip etmiştir. Köpeklerin 55’i (%60,4) dişi (24’ü kısırlaştırılmış) ve 36’sı (%39,6) erkekti (19’u kısırlaştırılmış). Ortanca yaş 11 yıl (dağılım, 4- 16 yıl) ve ortanca ağırlık 23,4 kg (dağılım, 3,7- 50,4 kg) idi.
Yetmiş bir (%78) köpek başlangıçta semptomatikti; öksürük en yaygın klinik belirtiydi (vakaların %95,8’i), bunu hemoptizi (%7), nefes nefese kalma (%4,2), egzersiz intoleransı (%2,8) ve kilo kaybı (%2,8) izledi. Bilgilerin rapor edildiği köpeklerde klinik belirtilerin süresi 2 hafta ile 6 ay arasındaydı ve şiddeti hafif ile şiddetli arasında değişiklik gösteriyordu. Beş köpekte (%5,5) PPK tesadüfi bir bulguydu. Geri kalan 15 (%16,5) köpek için klinik bulgular mevcut değildi.
Altmış yedi (%84,6) köpeğe TBCT, 5’ine (%5,5) toraks BT ve batın ultrasonu, 19’una (%20,9) ise toraks röntgeni ve batın ultrasonu uygulandı.
Karsinomlar 54 (%59,3) köpekte akciğer periferinde (sağ kaudal lob, n = 18; sol kraniyal lob, n = 11; sol kaudal lob, n = 7; aksesuar lob, n = 7; sağ kraniyal lob, n = 3; belirtilmemiş, n = 8) ve 19 (%20,9) köpekte hilus yakınında ortaya çıkmıştır. 18 (%19,8) köpek için tümör yerleşimi ile ilgili veri mevcut değildi.
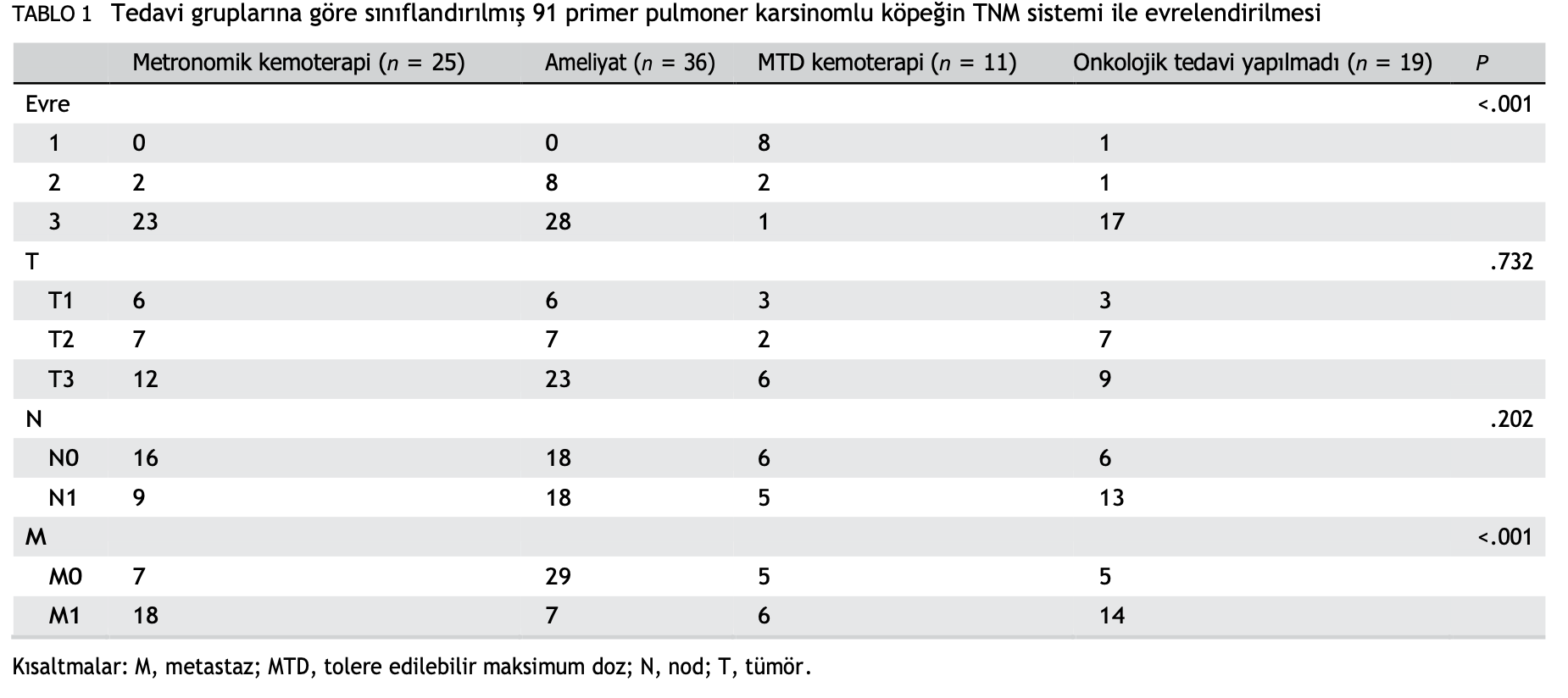
Kırk dört (%48,4) köpekte sitolojik veya histopatolojik olarak trakeobronşiyal lenf nodu metastazı (N1); 46 (%50,5) köpekte primer kitleye ek olarak daha küçük pulmoner nodüllerin varlığıyla kendini gösteren pulmoner metastaz (M1) vardı. On iki (%13,2) köpekte plevral efüzyon ve 2 (%2,2) köpekte perikardiyal efüzyon (T3) vardı. Tedaviye göre gruplandırılan tüm köpekler için TNM evrelemesi Tablo 1’de verilmiştir.
Kırk sekiz (%52,7) köpek sitolojik tanı alırken, 43 (%47,3) köpek histopatolojik tanı almıştır (n = 19 papiller karsinom; n = 13 adenokarsinom; n = 6 bronko-alveolar karsinom; n = 2 adenoskuamöz karsinom; n = 2 skuamöz hücreli karsinom; n = 1 az diferansiye karsinom). Tüm köpeklere ilk evreleme çalışması sırasında PPK’den ultrason veya BT eşliğinde örnekleme yapılmıştır.
3.2 | Metronomik kemoterapi alan hasta grubu
Yirmi beş köpek MK almıştır. Genel olarak, tedavi iyi tolere edilmiştir: 8 (%32) köpekte iştah azalması ve/veya kusma şeklinde grade 1 (n = 3) veya 2 (n = 5) gastrointestinal toksisite ve 1 (%4) köpekte grade 1 letarji gelişmiştir. Özellikle, 1 köpekte (%4) MK’ye başladıktan 1009 gün sonra ortaya çıkan grade 3 renal toksisite nedeniyle tedavi kesilmiştir. Bu köpek 1088 gün sonra PPK’si hala stabil kabul edilirken ölmüştür. Otopsi yapılmasına izin verilmemiştir.
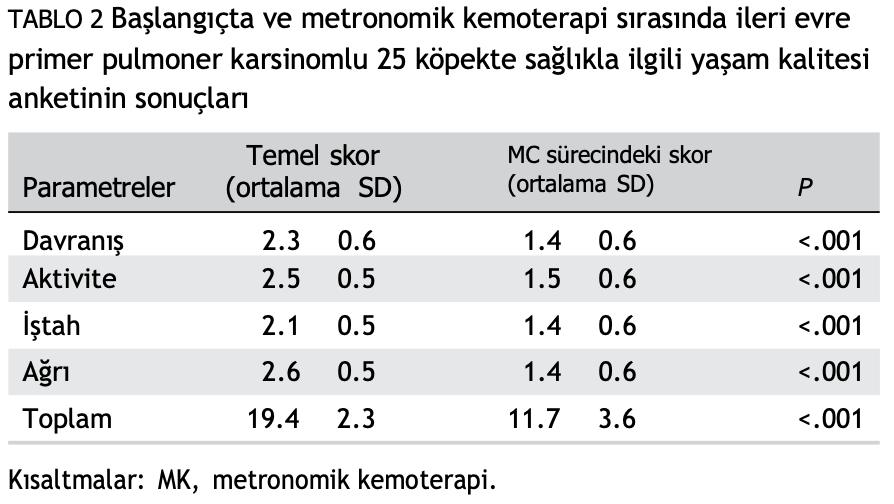
Sahiplerine göre, 23 semptomatik köpeğin 21’inde (%91,3) yaşam kalitesi iyileşmiştir. Anket sonuçlarına göre, genel yaşam kalitesi skoru, başlangıç değerlendirmesine kıyasla MK uygulanan köpeklerde ciddi oranda iyileşmiştir (P < .001). Anketin 5 ayrı parametresinin her biri için de istatistiksel olarak anlamlı bir iyileşme kaydedilmiştir (davranış, aktivite iştah ve ağrı, P = .001; Tablo 2).
Anti-tümör tepkiler göz önüne alındığında, 4 köpekte (%16) KY, 19 köpekte (%76) SD (ortalama yanıt süresi: 99 gün; aralık: 28- 1088) ve 2 köpekte (%8) progresyon gözlenmiştir. RR %16; KF oranı %92 idi. Ortalama PKGS 172 gündü (%95 GA, 44-300).
Yirmi köpek çalışma süresi boyunca kanser (n = 18; %88), kanser tedavisi (n = 1; %4) veya kanserle ilişkili olmayan nedenlerle (n = 1; %4) ölürken, 5 köpek (%20) ortalama 351 günlük (aralık, 62-1088 gün) takip süresiyle veri analizinin kapanışında hayattaydı. Genel ortalama ST 139 gündü (%95 GA, 0-282,6).
3.3 | Ameliyat edilen hasta grubu
Otuz altı köpeğe tek tedavi olarak cerrahi PPK eksizyonu uygulandı. Altı köpeğe ameliyat sırasında anestezi altında ötenazi yapıldı, 1 köpek ameliyattan 1 gün sonra öldü, diğer bir köpeğe ise 10 gün sonra ötenazi yapıldı. Ötenazi nedenleri arasında transplevral infiltrasyon (3), torasik karsinomatozis (1), karinanın ötesinde bronş içinde karsinom progresyonu (1) ve kayıt altına alınmayan (1) nedenler yer aldı.
Ortalama PKGS 87 gündü (%95 GA, 48,4-125,6).
Veri analizi tamamlandığında tüm köpekler ölmüştü (34’ü tümöre bağlı, 2’si tümöre bağlı olmayan nedenlerle). Ortalama ST 92 gündü (%95 GA, 61.1-122.9).
Ameliyattan ve hemen ameliyat sonrası dönemden sağ çıkan 28 köpeğin ortalama PKGS ve ST’si sırasıyla 110 ve 111 gündü.
3.4 | MTD kemoterapi grubu
On bir köpek tek tedavi olarak MTD kemoterapi almıştır. Sekiz köpek vinorelbin (haftada bir kez 15-18 mg/m2), 2 köpek karboplatin (üç haftada bir 300 mg/m2) ve 1 köpek gemsitabin (haftada bir kez 800 mg/m
Vinorelbin ile tedavi edilen bir köpekte KY elde edilmiştir; bu köpek 13 doz ile 4’ten fazla kemoterapi tedavisi alan tek hastadır. Üç köpek stabil kalmış ve 7’sinde PH görülmüştür. RR %9; KF oranı %36,4’tür. İki köpekte hematolojik toksisite (1’inde grade 1 nötropeni ve 1’inde grade 4 nötropeni), 1’inde grade 2 gastrointestinal toksisite (iştah azalması ve kusma) ve 3’ünde grade 2 letarji görülmüştür.
Tüm köpekler kanser nedeniyle ölmüştür. Ortalama PKGS ve ST sırasıyla 22 (%95 GA, 0-52) ve 61 gün (%95 GA, 0-124) idi.
3.5 | Onkolojik tedavi görmeyen hasta grubu
On dokuz köpeğe onkolojik tedavi uygulanmamıştır. Köpekler prednizon (n = 12), meloksikam (n = 6) veya piroksikam (n = 1) ile palyatif olarak tedavi edildi. Hasta sahiplerine göre, 5’i prednizon (n = 4) veya meloksikam (n = 2) alan 6 köpekte semptomlarda hafif bir iyileşme görülürken, diğerlerinde ilerleme kaydedilmiştir. Ortalama PKGS ve ST sırasıyla 20 (%95 GA, 10.0-30.0) ve 60 gün (%95 GA, 45.9-74.1) idi.
3.6 | Sonuçların karşılaştırılması
Tedavi grupları arasında T evresi ve lenf nodu metastazı varlığı açısından anlamlı bir fark bulunmamıştır (χ2, P = 0.732 ve 0.202, sırasıyla). Ancak, uzak metastaz sıklığı metronomik ve tedavisiz gruplarda daha yüksekti ve 3. evre tümörler MTD kemoterapi grubunda daha az sayıdaydı (P < .001; Tablo 1).
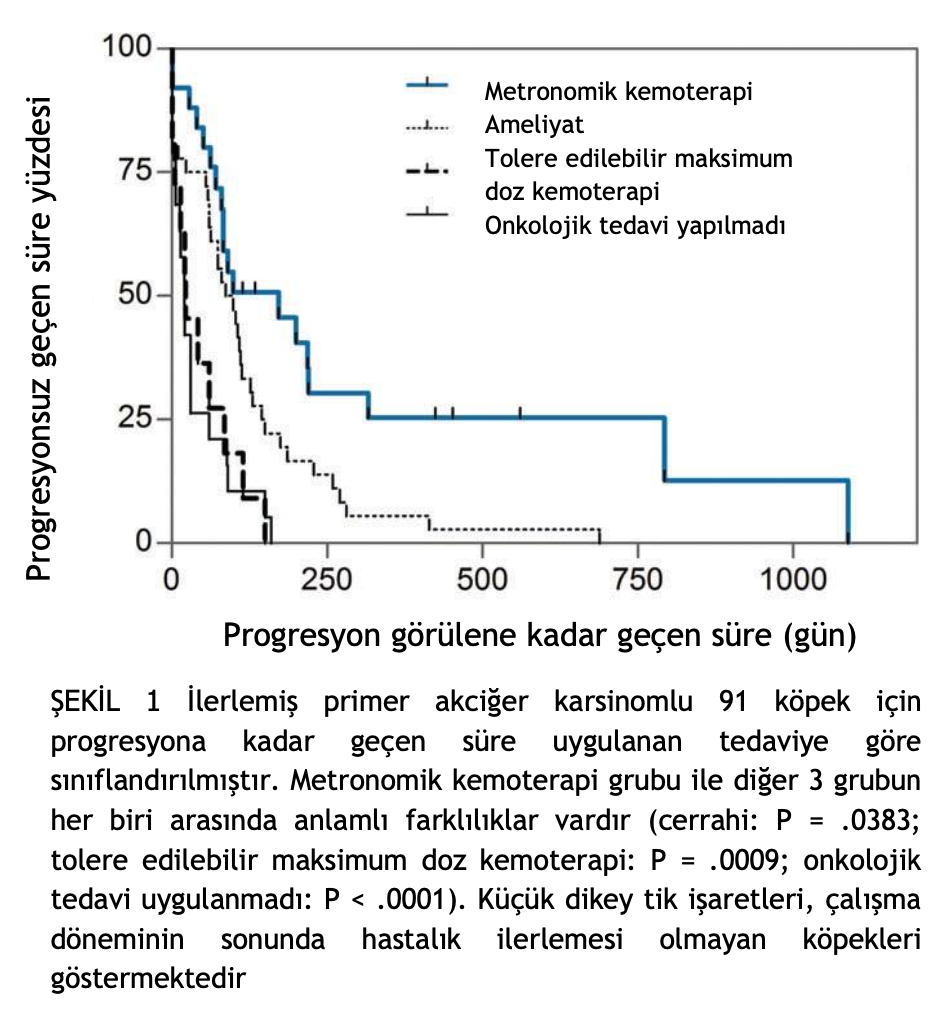
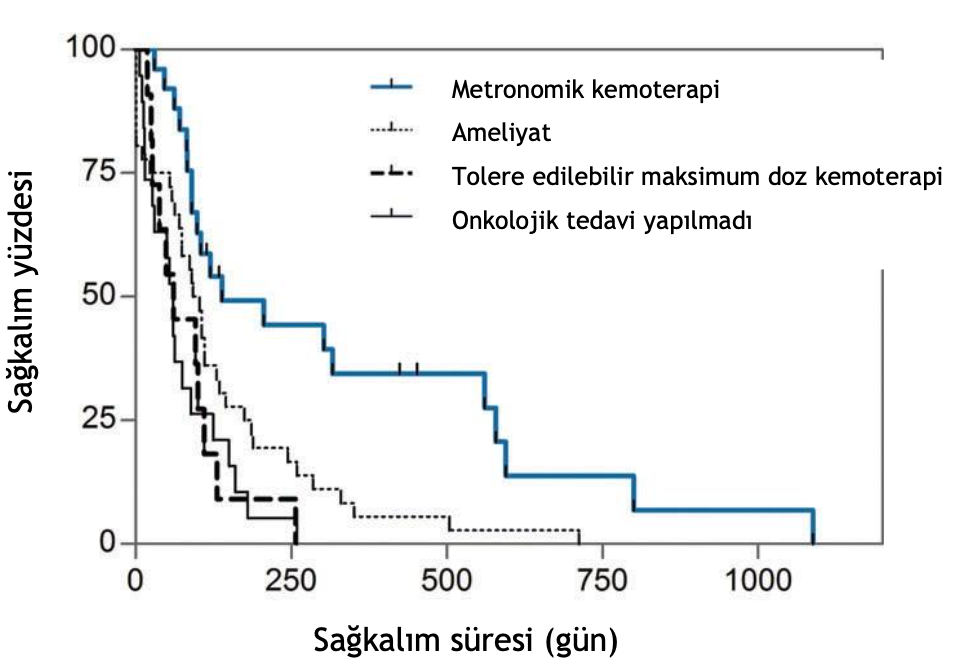
Hem PKGS hem de ST, MK grubu ile diğer 3 grubun her biri arasında önemli ölçüde farklıydı (P < .001; Şekil 1 ve 2). Özellikle, MK almayan köpeklerde tümör ilerlemesi riski 2,6 (%95 GA, 1,5-4,5; P < .001) ve ölüm riski 2,7 (%95 GA, 1,6-4,7; P < .001) artmıştır (Tablo 3 ve 4).
Tedavinin yanı sıra, nodal metastazların varlığı tek değişkenli analizde hem PKGS (HR = 1.8; %95 GA 1.1-2.8; P = .011) hem de ST
ŞEKİL 2 İlerlemiş primer akciğer karsinomlu 91 köpek için sağkalım süresi uygulanan tedaviye göre sınıflandırılmıştır. Metronomik kemoterapi grubu ile diğer 3 grubun her biri arasında anlamlı farklılıklar vardır (cerrahi: P = .0072; tolere edilebilir maksimum doz kemoterapi: P = .0029; onkolojik tedavi yapılmadı: P < .0001). Küçük dikey tik işaretleri, çalışma döneminin sonunda hala hayatta olan köpekleri göstermektedir
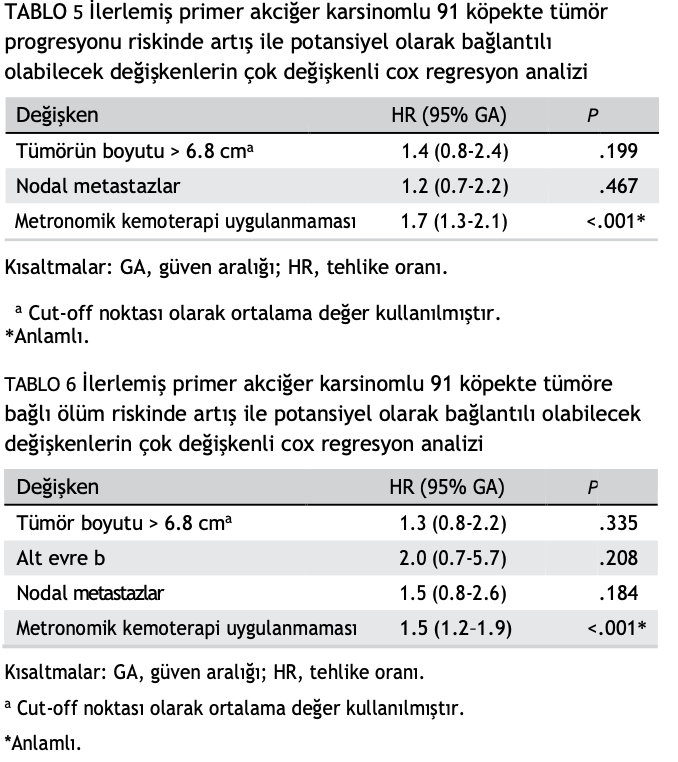
(HR = 1.9; %95 GA = 1.2-3.0; P = .006) ile ciddi şekilde bağlantılı tek parametre olmuştur (Tablo 3 ve 4). Çok değişkenli sağkalım analizinde, yalnızca yapılan tedavi prognostik önemini korumuştur; MK almayan köpeklerde tümör ilerlemesi riski 1,7 (%95 GA, 1,3-2,1; P < .001) ve ölüm riski 1,5 (%95 GA, 1,2-1,9; P < .001) artmıştır (Tablo 5 ve 6).
3 | TARTIŞMA
Klinik olarak ilerlemiş PPK, kötü prognoza sahip tedavi edilemez bir hastalık olmaya devam etmektedir. Bu çalışmada, bu zorlu klinik koşullarda MK tedavisi değerlendirilmiştir. Soliter PPK vakalarında cerrahinin değeri şüphesiz olsa da, ilerlemiş hastalığı olan vakalarda cerrahiyi takip eden ST, 26 ila 60 gün arasında rapor edilen ortalama ST’ler göz önüne alındığında sürekli kötü seyretmiştir.2,4,25 Metastazı olmayan ancak T3 olarak sınıflandırılan vakalarda bile cerrahiyi takip eden ve 1 çalışmaya göre ortalama 23 gün süren karşılaştırılabilir nitelikte ST rapor edilmiştir.25 Mevcut çalışmada cerrahi ile tedavi edilen 36 köpek için 92 gün olan ortalama ST, bu önceki verilerle genel olarak karşılaştırılabilir niteliktedir. Vinorelbin, doksorubisin ve mitoksantron dahil olmak üzere bir dizi sitotoksik ajanın ileri PPK’de bir miktar anti-tümör aktivitesi gösterdiği ve rapor edilen sonuçların cerrahi sonrası sonuçlara benzer olduğu gösterilmiştir.8- 11 Tek bir çalışmada rapor edilen en büyük kohortta, ölçülebilir hastalık için vinorelbin alan 16 vakanın 3’ünde KY görülmüş ve tüm grubun ortalama PKGS’si 55 gün ve ST’si 92 gün olmuştur.9 Bu sonuçlar, fark marjları küçük olsa da bizim bulgularımızla olumlu yönde karşılaştırılabilir.
MK birçok tümörde olumlu yanıtlar alınmasını sağlamıştır.13,14,16,17,20,24 MK’nin tümör hücrelerine karşı güçlü sitotoksik etki göstermesi beklenmemektedir. Bunun yerine, terapötik avantajın anti-anjiyojenik etkilerle kazanılacağı düşünülmektedir. Bu neo-plastik olmayan, genomik olarak stabil hücre hedef alınarak, pozitif yanıtlar teorik olarak uzun bir süre boyunca sürdürülebilir.28,29
Ayrıca, MK seçici olarak T düzenleyici lenfosit (T-regs) sayısını azaltır ve işlevlerini bozar, böylece bağışıklık modüle edici bir etki gösterir. 12
Veteriner MK çalışmalarında siklofosfamid, klorambusil ve lomustin dahil olmak üzere çeşitli kemoterapötikler kullanılmıştır; ancak siklofosfamid, bu bileşiği destekleyen literatürün daha güvenilir olması nedeniyle tercih edilmiştir.13 -17,20,24,28 Bu çalışmada kullanılan siklofosfamid dozu (10 mg/m2) daha önce diğer MK klinik makalelerinde rapor edilenlerle tutarlıydı; ancak Burton ve arkadaşlarının ön sonuçlarında tavsiye edilenden daha düşüktü.14,20,28 Aslında onların çalışmasında, 15 mg/m2’den düşük dozların T-regs bileşeni ve muhtemelen mikrodamar
yoğunluğu (MVD) üzerinde etki gösterme olasılığı daha düşüktü. Bu nedenle, gelecekteki MK çalış
maları için 15 mg/m2 dozu önerilmiştir.28 Ancak, az sayıda doku örneği incelenmiş ve tedavinin başlaması ile tümör örneklemesi arasında geçen süre rapor edilmemiştir.28 Ayrıca, daha düşük siklo-fosfamid dozlarının anti- anjiyojenik etkisinin olmadığı varsayımı MVD’ye göre değerlendirilmemelidir, çünkü bunun anti-anjiyojenik tedaviye yanıtı değerlendirmede yanlış bir araç olduğu iyi bilinmektedir.30 Bu çalışmanın amacı doğrultusunda daha yüksek bir siklofosfamid dozu seçilebilecek olsa da, şu anda belirli bir tümör alt tipinde anjiyogenezi inhibe edebilecek minimum etkili biyolojik siklofosfamid dozunu ortaya koyabilecek hiçbir veterinerlik çalışması bulunmamaktadır.
T alidomid son zamanlarda veteriner onkolojisinde 1-3 mg/kg arasındaki dozlarda MK stratejilerinde yer alarak ilgi çekmektedir.20,22-24 Talidomidin anti-anjiyojenik etkisinin vasküler endotelyal büyüme faktörü (VEGF), bazik fibroblastik büyüme faktörü (bFGF) ve tümör nekroz faktörü alfa (TNF-a) inhibisyonu yoluyla gerçekleştiğine inanılmaktadır. Ayrıca talidomid, T-regs’i inhibe eden, sitotoksik T-hücresi ve doğal öldürücü lenfosit reaksiyonlarını artıran ve interlökin 12’yi inhibe eden immünomodülatör bir etki yaratma potansiyeline de sahiptir.31 Bununla birlikte, bu mekanizmalar küçük hayvan hastalarda hala kanıtlanmamıştır ve sonuç olarak, talidomidin optimal metro- nomik dozu bilinmemektedir. Genel olarak, mevcut literatürün sınırlı hacmi, tedavi edilen tümörlerin eklektik doğası ve hastaların ve kanser evrelerinin değişkenliği, daha geniş ve çok ajanlı bir MK tedavi yönteminde daha fazla araştırma yapılması için kesinlikle bir temel oluşturduğunu söylemek dışında, literatür taramasından anlamlı sonuçlar çıkarmayı imkansız kılmaktadır.
Sonuçlarımız, düşük doz siklofosfamid, piroksikam ve talidomidden oluşan MK’nin, cerrahi, MTD kemoterapi veya hiç onkolojik tedavi uygulanmamasına kıyasla klinik olarak eşdeğer ve hatta daha üstün bir sonuç elde etme potansiyeli nedeniyle ileri PPK hastalarında cazip bir seçenek olabileceğini göstermektedir.
Cerrahi ve onkolojik tedavi uygulanmayan gruplarda, hastalığın ilerlemesini sınırlamak için sürekli tedavi uygulanmamıştır, bu nedenle devam eden ve etkili bir tedavinin daha üstün sonuçlar elde etmesi muhtemeldir.
MK grubundaki köpekler, MTD kemoterapi grubuna kıyasla önemli ölçüde daha uzun ST ve PKGS elde etmiştir. Çoğu köpeğe kemoterapi ölene veya ötenaziye kadar devam ettirilmiştir ve cRECIST’e göre yanıt oranları gruplar arasında karşılaştırılabilir düzeydedir. Ancak, MTD kemoterapi ile KF sürdürülememiştir. Bu durum, bu 2 tedavinin hücresel hedefleri arasındaki farkı yansıtıyor olabilir. Daha önce de belirtildiği gibi, anti-anjiyojenik tedavinin genomik olarak stabil endotelyal progenitör hücreleri hedef aldığı
düşünülürken, MTD kemoterapi, daha fazla genetik ve epigenetik plastisiteye sahip ve sitotoksik tedavilere direnç kazanmaya daha hazır daha eklektik bir yapı olarak kabul edilen genomik açıdan stabil olmayan tümör hücrelerini hedef almaktadır.28,29
MK grubunda, RR (%16) ile KF deneyimleyen köpeklerin oranı (%92) arasında bir eşitsizlik vardı. Bu çalışma, “sitotoksik” tedavinin aksine “sitostatik” tedaviye bağlı sonuçları rapor eden ilk çalışma değildir. Ancak bu gözlem, kanser tedavisinde bilimsel literatürde nadiren rapor edilen eski bir paradigmayı ortaya koyduğu için kesinlikle tartışmaya değerdir. Veteriner kanser tedavisinin kilit taşı, yaşam kalitesinin iyileştirilmesidir. Bu durum, burada bildirilen ileri evre PPK’de örneklendiği gibi, tedavisi mümkün olmayan hastalığı olan vakalarda giderek daha da önem kazanmaktadır. Ayrıca, MK alan 23 semptomatik köpeğin 21’inde yaşam kalitesinin iyileştiği bildirilmiştir. Bununla birlikte, bu sonuçların kısmen sahiplerin “temenni dolu düşüncelerinden” kaynaklanabileceğini de göz ardı edemeyiz.
Ne yazık ki, retrospektif veri toplama nedeniyle, MTD kemoterapisi alan köpeklerde sahiplerin yaşam kalitesi algısı hakkında bilgi edinmek mümkün olmamıştır, bu nedenle karşılaştırmalar yapılamamıştır.
İnsan onkolojisinde, ilerlemiş/metastatik küçük hücreli olmayan akciğer karsinomu (KHDAK) hastalar için tedavi yöntemi değişkenlik gösterir ve esas olarak spesifik tümör histolojik/genetik alt tiplerine bağlıdır.32 Ayrıca, tedavi yaklaşımı hastalığın ilerlemesine ve daha ileri seviyedeki biyopsi sonuçlarına bağlı olarak zamanla bile değişebilir. Tedavi stratejisinde hastanın yaşı, genel sağlık durumu, eşlik eden hastalıkların varlığı ve hastanın tercihleri de dikkate alınmaktadır.32 Hastaların önerilen tedaviyi uygulama ya da uygulamama kararını etkileyen önemli ve duygusal bir faktör de bulunmaktadır; örneğin sigara içen hastalar tanı konulduktan sonra kendilerini suçlu hissedebilmekte, hastalıkları ve olası sonuçları hakkında daha karamsar olabilmekte ve tüm bunlar da yaşam kalitesi üzerinde olumsuz etkilere yol açabilmektedir. Genel olarak, ileri/metastatik KHDAK’li bir hastanın tedavisi palyatif sistemik kemoterapi, tirozin kinaz inhibitörleri veya monoklonal antikorlar, cerrahi ve radyoterapiyi içeren multimodal yöntemden palyatif tek ajanlı oral MK’ye kadar değişebilmektedir.32 Oral vinorelbin, KHDAK’li hastaların ilk MK tercihidir. Bu tedavinin, sistemik intravenöz kemoterapi veya multimodal yöntemler uygulanmasına elverişli olmayan ileri evre KHDAK’li yaşlı hastalar için güvenli ve etkili bir tedavi şekli olduğu gösterilmiştir. Bununla birlikte, vinorelbinin MK ortamındaki etki mekanizması siklofosfamide göre çok daha belirsizdir ve talidomide göre çok daha az öngörülebilirdir. Metronomik siklofosfamid ile ilgili olarak, bu ileri evre KHDAK’de çok sık kullanılmamaktadır; ancak radyasyon ve MK siklofosfamid alan ileri evre KHDAK hastaları ile sadece radyasyon alan hastaları karşılaştıran yeni bir çalışma, MK siklofosfamid eklendiğinde küçük ama anlamlı bir sağkalım avantajı olduğunu göstermiştir.33 Buna karşılık, MTD kemoterapi/kemoradyoterapiyi talidomid ile veya talidomid olmadan karşılaştıran birkaç randomize kontrollü klinik çalışmanın tutarlı sonuçlar vermediği ve KHDAK tedavisinde talidomidin rolünü sorgulamak gerektiği belirtilmelidir.34 Ancak, insanlarda MK siklofosfamid ve talidomidi birlikte kullanan herhangi bir çalışma mevcut değildir.
KHDAK’nin yanı sıra, insan onkolojisinde, MK rejimleri, MTD kemoterapi stratejilerine göre progresyonsuz sağkalımda terapötik eşdeğerlik ve hatta üstünlük göstermektedir.35 MK, metastatik kanserde, geriatrik hastalarda veya diğer önemli komorbiditelerde
ilk basamak tedavi olarak bile önerilmektedir ve MK’nin ilerlemiş köpek PCC’sinin tedavisindeki rolünü araştırmayı gerektirmektedir36
İlerlemiş kanser vakalarında, tedaviye kalıcı yanıt alınması mümkün olmadığında, güvenlik konusu daha büyük önem kazanabilmektedir. Perioperatif morbidite ve mortalite, ameliyat geçiren köpeklerin kötü sonuçlar almasında önemli bir faktör olmuştur. Özellikle, ameliyat geçiren 36 köpeğin 8’i (%22,9) ameliyat sonrası dönemde (10 gün içinde) ölmüş veya ötenazi yapılmıştır.
Morbidite, MTD kemoterapi grubunda nispeten önemsizdi ve 11 köpekten sadece 1’i ciddi toksisite ( grade 4 nötropeni) yaşadı.
MK alan köpekler arasındaki şiddetli toksisite insidansı benzerdi: 1 köpekte grade 3 renal toksisite gelişti ve sonuçta 1088 gün sonra ötenaziye yol açtı. Piroksikamın nefrotoksik olabileceği daha önce rapor edilmiştir.37 Bununla birlikte, MTD kemoterapi uygulanan köpeklerin aksine, uzun süreli tedaviden sonra ciddi toksisite gelişmiştir. Bununla birlikte, piroksikam dışındaki diğer nedenler de göz ardı edilememiştir.
İnsan onkolojisinde, talidomidin MTD kemoterapi protokollerine eklenmesi, şiddetli olmayan hematolojik toksisitelerin (yani, baş dönmesi, kabızlık, kızarıklık ve venöz tromboembolik olaylar) daha yüksek oranda görülmesiyle sonuçlanmış ve bu tür stratejilerin güvenlik profili konusunda önemli endişelere yol açmıştır. Diğer taraftan, bu çalışmanın ve önceki veterinerlik çalışmalarının sonuçları, talidomidin MK stratejileriyle kombine edildiğinde dahi toksisite profilinin güvenli olduğu yönündedir.34,38 İlacın genellikle akşam saatlerinde uygulanmasından kaynaklanan hafif geçici sedasyon dışında, yan etkiler doz veya rejimden bağımsız olarak genellikle rapor edilmemektedir.20,22-24,39-41 Bununla birlikte, talidomid ve MTD kemoterapi kombinasyonuna ilişkin veriler yetersizdir ve insan verilerine dayanarak dikkatli olunmalıdır. Talidomid kullanan hekimin, evcil hayvanlarının tedavisine dahil olan bakıcıların tedavinin kullanımı ve uygulanmasının potansiyel risklerinin farkında olmalarını sağlamak gibi bir sorumluluğu vardır. Talidomid, ciddi ve yaşamı tehdit edebilecek doğumsal kusurlara neden olan güçlü bir insan teratojenidir.42 Birçok ülkede, ilaç dağıtımını düzenleyen kurallara göre talidomid veteriner hekimlerin kullanımına sunulmamaktadır.
Bu çalışmanın retrospektif doğasından kaynaklanan bazı zayıf yönleri bulunmaktadır. Evre dağılımı tedavi grupları arasında tam olarak dengeli değildi; bu şüphesiz bir dereceye kadar seçim yanlılığını göstermektedir. Hastaların farklı hastalık yüklerinden etkilendiklerinde nasıl farklı şekilde cerrahi veya medikal tedaviye yönlendirilebileceklerini anlamak kolaydır. Nodal veya uzak metastazı olan hastalara cerrahi önerilmesi pek olası değildir. Bu durum istatistiksel analizle ortaya konmuştur ve Tablo 1’in dikkatli bir şekilde incelenmesi halinde açıkça görülmektedir. Ancak, MK grubu en yüksek 3. evre vaka oranına sahip olduğu için bu yanlılığın MK’nin görünür etkisini azaltmaktadır. Gerçekten de, bu hasta grubunda MK’nin olumlu etkisi hafife alınmış olabilir.
Tümör yanıtını ölçmek için kullanılan parametreler kontrol gruplarındaki tüm köpekler için geçerli değildi ve tanı ve takip protokollerinde değişkenlik söz konusuydu. Karşılaştırılan hasta grupları, tarihsel karakterli bir kontrol grubundan oluşmaktadır ve
bu grubun kullanılması, köpeklerin tedavi ve kontrol gruplarına randomize bir şekilde prospektif olarak dağıtılmasından ziyade daha az tercih edilen bir yöntemdir. Bu zayıf noktalar, farklı yönetim stratejileri uygulanan birden fazla karşılaştırmalı popülasyonun kullanılmasıyla bir dereceye kadar dengelenmiştir.
Son olarak, kombinasyon tedavisi etkinliği artırabilirken, MK grubunda gözlenen terapötik faydanın birlikte verilen 3 ilacın aditif veya sinerjik etkisine mi yoksa yalnızca talidomide mi bağlı olduğu şu anda bilinmemektedir. Veri toplamadaki tutarsızlıklara rağmen, çok değişkenli sağkalım analizi tedavinin hem tümör progresyonu hem de sağkalım için en güçlü bağımsız prognostik faktör olduğunu göstermiştir.
Sonuç olarak, elde ettiğimiz bulgular MK’nin ilerlemiş PKC’li köpeklerde yüksek oranda KF sağlayabileceğini göstermektedir. Bu durum, güvenli toksisite profili, oral uygulama kolaylığı ve yaşam kalitesinde gözlenen iyileşme ile birlikte MK’yi ilerlemiş PPK’li köpekler için cazip bir tedavi seçeneği haline getirebilir.
TEŞEKKÜRLER
Yazarlar, çalışmanın deneysel/epidemiyolojik tasarımı konusundaki yardımları için Istituto per lo Studio e la Prevenzione Oncologica (ISPO), Firenze, İtalya’dan Dr. Calogero Saieva’ya teşekkür etmektedir.
ORCID
R. Finotello
C. Rohrer Bley
L. Marconato
KAYNAKÇA
1. Wilson DW, Dungworth DL. Tumors of the respiratory tract. Tumors in Domestic Animals. 4th ed. Ames, IA: Iowa State University Press; 2002:380-390.
2. MKNiel EA, Ogilvie GK, Powers BE, Hutchison JM, Salman MD, Withrow SJ. Evaluation of prognostic factors for dogs with primary lung tumors: 67 cases (1985-1992). J Am Vet Med Assoc. 1997;211: 1422-1427.
3. Ogilvie GK, Haschek WM, Withrow SJ, et al. Classification of primary lung tumors in dogs: 210 cases (1975-1985). J Am Vet Med Assoc. 1989;195:106-108.
4. Ogilvie GK, Weigel RM, Haschek WM, et al. Prognostic factors for tumor remission and survival in dogs after surgery for primary lung tumor: 76 cases (1975-1985). J Am Vet Med Assoc. 1989;195:109-112.
5. Paoloni MK, Adams WM, Dubielzig RR, Kurzman I, Vail DM, Hardie RJ. Comparison of results of computed tomography and radi- ography with histopathologic findings in tracheobronchial lymph nodes in dogs with primary lung tumors: 14 cases (1999-2002). J Am Vet Med Assoc. 2006;228:1718-1722.
6. Mehlhaff CJ, Leifer CE, Patnaik AK, Schwarz PD. Surgical treatment of primary pulmonary neoplasia in 15 dogs. J Am Anim Hosp Assoc. 1984;20:799-803.
7. Griffey SM, Kraegel SA, Madewell BR. Rapid detection of K-ras gene mutations in canine lung cancer using single-strand conformational polymorphism analysis. Carcinogenesis. 1998;19:959-963.
8. Poirier VJ, Burgess KE, Adams WM, Vail DM. Toxicity, dosage, and efficacy of vinorelbine (Navelbine) in dogs with spontaneous neopla- sia. J Vet Intern Med. 2004;18:536-539.
9. Wouda RM, Miller ME, Chon E, Stein TJ. Clinical effects of vinorel- bine administration in the management of various malignant tumor types in dogs: 58 cases (1997-2012). J Am Vet Med Assoc. 2015;246: 1230-1237.
- Ogilvie GK, Reynolds HA, Richardson RC, et al. Phase II evaluation of doxorubicin for treatment of various canine neoplasms. J Am Vet Med Assoc. 1989;195:1580-1583.
- Ogilvie GK, Obradovich JE, Elmslie RE, et al. Efficacy of mitoxantrone against various neoplasms in dogs. J Am Vet Med Assoc. 1991;198: 1618-1621.
- Kareva I, Waxman DJ, Klement GL. Metronomic chemotherapy: an attractive alternative to maximum tolerated dose therapy that can activate anti-tumor immunity and minimize therapeutic resistance. Cancer Lett. 2015;358:100-106.
- Lana S, U’ren L, Plaza S, et al. Continuous low-dose oral chemother- apy for adjuvant therapy of splenic hemangiosarcoma in dogs. J Vet Intern Med. 2007;21:764-769.
- Elmslie RE, Glawe P, Dow SW. Metronomic therapy with cyclophos- phamide and piroxicam effectively delays tumor recurrence in dogs with incompletely resected soft tissue sarcomas. J Vet Intern Med. 2008;22:1373-1379.
- Tripp CD, Fidel J, Anderson CL, et al. Tolerability of metronomic administration of lomustine in dogs with cancer. J Vet Intern Med. 2011;25:278-284.
- Leach TN, Childress MO, Greene SN, et al. Prospective trial of metro- nomic chlorambucil chemotherapy in dogs with naturally occurring cancer. Vet Comp Oncol. 2012;10:102-112.
- Schrempp DR, Childress MO, Stewart JC, et al. Metronomic adminis- tration of chlorambucil for treatment of dogs with urinary bladder transitional cell carcinoma. J Am Vet Med Assoc. 2013;242: 1534- 1538.
- London CA, Gardner HL, Mathie T, et al. Impact of toceranib/piroxi- cam/cyclophosphamide maintenance therapy on outcome of dogs with appendicular osteosarcoma following amputation and carboplatin che- motherapy: a multi-institutional study. PLoS One. 2015;10:e0124889.
- Denies S, Cicchelero L, de Rooster H, et al. Immunological and angio- genic markers during metronomic temozolomide and cyclophospha- mide in canine cancer patients. Vet Comp Oncol. 2017;15:594-605.
- Finotello R, Henriques J, Sabattini S, et al. A retrospective analysis of chemotherapy switch suggests improved outcome in surgically removed, biologically aggressive canine haemangiosarcoma. Vet Comp Oncol. 2017;15:493-503.
- Wendelburg KM, Price LL, Burgess KE, Lyons JA, Lew FH, Berg J. Survival time of dogs with splenic haemangiosarcoma treated by sple- nectomy with or without adjuvant chemotherapy: 208 cases (2001- 2012). J Am Vet Med Assoc. 2015;247:393-403.
- BrayJP,OrbellG,CaveN,MundayJS.Doesthalidomideprolongsur- vival in dogs with splenic haemangiosarcoma? J Small Anim Pract. 2017;59:85-91. hPKGSs://doi.org/10.1111/jsap.12796.
- de Campos CB, Lavalle GE, Fialho Ligório S, et al. Absence of signifi- cant adverse events following thalidomide administration in bitches diagnosed with mammary gland carcinomas. Vet Rec. 2016;179:514.
- Cancedda S, Marconato L, Meier V, et al. Hypofractionated radiother- apy for macroscopic canine soft tissue sarcoma: a retrospective study of 50 cases treated with a 5×6 Gy protocol with or without metro- nomic chemotherapy. Vet Radiol Ultrasound. 2016;57:75-83.
- Polton GA, Brearley MJ, Powell SM, Burton CA. Impact of primary tumour stage on survival in dogs with solitary lung tumours. J Small Anim Pract. 2008;49:66-71.
- NguyenSM,ThammDH,VailDM,LondonCA.Responseevaluationcri- teria for solid tumours in dogs (v1.0): a veterinary cooperative oncology group (VCOG) consensus document. Vet Comp Oncol. 2015;13:176-183.
- Veterinary Cooperative Oncology Group. Common terminology cri- teria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Vet Comp Oncol. 2016;14:417-446.
- Burton JH, Mitchell L, Thamm DH, Dow SW, Biller BJ. Low-dose cyclophosphamide selectively decreases regulatory T cells and inhibits angiogenesis in dogs with soft tissue sarcoma. J Vet Intern Med. 2011; 25:920-926.
- Gatenby RA, Silva AS, Gillies RJ, Frieden BR. Adaptive therapy. Cancer Res. 2009;69:4894-4903.
- Hlatky L, Hahnfeldt P, Folkman J. Clinical application of antiangio- genic therapy: microvessel density, what it does and doesn’t tell us. J Natl Cancer Inst. 2002;94:883-893.
31. Laubach J, Mitsiades CS, Hideshima T , Anderson KC, Richardson P . Tha- lidomide and its analogs in the treatment of hematologic malignancies, including multiple myeloma, and solid tumors. In: Chabner BA, Longo DL, eds. Cancer Chemotherapy and Biotherapy: Principles and Practice. 5th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 2011:632-648.
32. Novello S, Barlesi F, Califano R, et al. Metastatic non-small-cell lung cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2016;27(suppl 5):v1-v27.
33. Revannasiddaiah S, Joshi SC, Pandey KC, Rastogi M, Sharma M, Gupta M. The results with the addition of metronomic cyclophospha- mide to palliative radiotherapy for the treatment of non-small cell lung carcinoma. Ann Trans Med. 2015;3:305.
34. Liu Y , He S, Ding Y , Huang J, Zhang Y , Chen L. The efficacy and safety of thalidomide-based therapy in patients with advanced non-small cell lung cancer: a meta-analysis. Contemp Oncol. 2014;18:39-47.
35. Lien K, Georgsdottir S, Sivanathan L, Chan K, Emmenegger U. Low-dose metronomic chemotherapy: a systematic literature analysis. Eur J Cancer. 2013;49:3387-3395.
36. Fontana A, Falcone A, Derosa L, Di Desidero T, Danesi R, Bocci G. Metronomic chemotherapy for metastatic prostate cancer: a ‘young’ concept for old patients? Drugs Aging. 2010;27:689-696.
37. Knapp DW, Richardson RC, Chan TC, et al. Piroxicam therapy in 34 dogs with transitional cell carcinoma of the urinary bladder. J Vet Intern Med. 1994;8:273-278.
38. El Accaoui RN, Shamseddeen WA, Taher AT. Thalidomide and throm- bosis. A meta-analysis. Thromb Haemost. 2007;97:1031-1036.
39. Kanbayashi T, Nishino S, Tafti M, Hishikawa Y, Dement WC, Mignot E. Thalidomide, a hypnotic with immune modulating properties, increases cataplexy in canine narcolepsy. Neuroreport. 1996;7:1881-1886.
40. Teo S, Evans M, Ehrhart J, et al. Lack of peripheral neuropathy in bea- gle dogs after 53 weeks oral administration of thalidomide capsules. Hum Exp Toxicol. 2000;19:615-622.
41. Teo SK, Evans MG, Brockman MJ, et al. Safety profile of thalidomide after 53 weeks of oral administration in beagle dogs. Toxicol Sci. 2001;59:160-168.
42. European Medicines Agency, 2015. Thalidomide Celgene EPAR sum- mary for the public. EMA/740933/2015. London, UK.
Bu makaleye atıfta bulunmak için: Polton G, Finotello R, Sabattini S,et al. Survival analysis of dogs with advanced primary lung carcinoma treated by metronomic cyclophosphamide, piroxi-cam and thalidomide. Vet Comp Oncol. 2018;1–10. https:// doi.org/10.1111/vco.12393
EK A
Primer akciğer tümörleri için TNM sistemi ile klinik evreleme (Owen, 1980).
• T1:Akciğerveyavisseralplevraileçevrilisolitertümör. • T2: Herhangi bir boyutta çoklu tümörler.
• T3:Komşudokularıistilaedentümör.
• N0: Lenf nodu tutulumuna dair kanıt yok.
• N1: Neoplastik lenf nodu büyümesi. • M0:Metastazadairkanıtyok.
• M1:Metastazlarmevcut.
EKB
Metronomik kemoterapi alan primer pulmoner karsinomlu 25 köpeğin sağlıkla ilgili yaşam kalitesini değerlendirmek için anket. Parametreler davranış (soru 1, 4 ve 7), aktivite (soru 2 ve 8), iştah (soru 5) ve ağrıyı (soru 3 ve 6) içermektedir. Anket başlangıçta ve tedaviden sonra puanlanmış ve farklılıklar istatistiksel olarak değerlendirilmiştir.
1. Köpeğiniz aileye ne kadar ilgi gösteriyor?
a. Tamamen ilgisiz (3 puan)
b. Dikkati azalmış (2 puan)
c. Dikkati değişmedi (1 puan)
2. Evcil hayvanınız hala hareketli mi?
- Evcil hayvanım gün boyu tek bir yerde yatıyor (3 puan)
- Ara sıra (2 puan)
- Evcil hayvanım normal bir şekilde hareket ediyor ve oynuyor (1 puan)
3. Köpeğinizin uyku durumu nasıl?
a. Çok kötü durumda/hiç uyumuyor (3 puan)
b. Ara sıra uyuyup uyanıyor (2 puan)
c. Uykusu normal (1 puan)
4. Köpeğiniz hijyenik alışkanlıklarını koruyor mu (yani köpeğiniz kendi kendini temizliyor mu)?
a. Hayır (3 puan)
b. Eskisine göre daha az sıklıkta (2 puan)
c. Evet (1 puan)
5. Köpeğinizin iştahı yerinde mi?
a. Hayır (3 puan)
b. Çok az. Mama yemesi için zorlamak gerekiyor (2 puan)
c. Normal (1 puan)
6. Köpeğinizin solunumu nasıl?
a. Tedavi başlamadan önceki gibi/kötü (3 puan)
b. Daha iyi (2 puan)
c. Normal (1 puan)
7. Köpeğinizin ruh hali nasıl?
a. Tamamen değişti (3 puan)
b. Biraz depresif (2 puan)
c. Normal (1 puan)
8. Köpeğiniz hemen yoruluyor mu?
a. Evet, daima (3 puan) b. Sık sık (2 puan)
c. Hayır (1 puan)