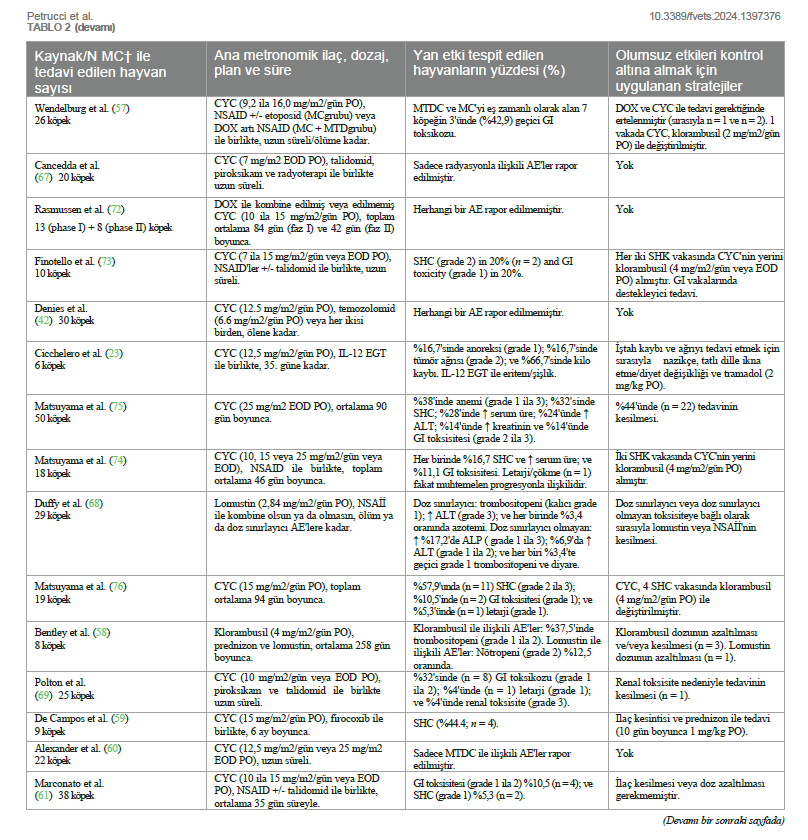
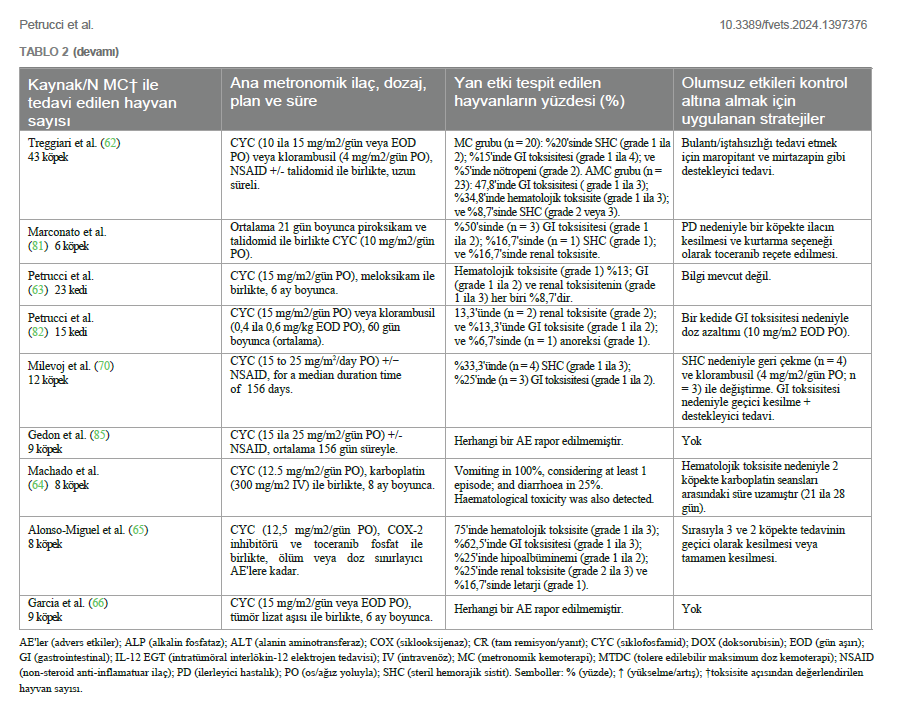
| 1Onevet Hospital Veterinário do Porto, Porto, Portekiz, 2Hayvan ve Veteriner Hekimliği Bölümü, Sağlık Bilimleri Üniversitesi Enstitüsü, CESPU, CRL, Gandra, Portekiz, 3Hayvan ve Veterinerlik Araştırma Merkezi (CECAV), Trás-os-Montes ve Alto Douro Üniversitesi, Vila Real, Portekiz, 4Veteriner Bilimleri Bölümü, Vasco da Gama Araştırma Merkezi (CIVG), Vasco da Gama Üniversitesi Fakültesi (EUVG), Coimbra, Portekiz, 5Veteriner Bilimleri Bölümü, Trás-os-Montes ve Alto Douro Üniversitesi, Vila Real, Portekiz, 6Hayvan ve Veteriner Bilimleri Ortak Laboratuvarı (AL4AnimalS), Trás-os-Montes ve Alto Douro Üniversitesi, Vila Real, Portekiz, 7Hayvan Bilimi Çalışma Merkezi, CECA-ICETA, Porto Üniversitesi, Porto, Portekiz AÇIK ERİŞİM EDİTLEYEN: İNCELEYEN: *İLETİŞİM: SUNUM: 07 Mart 2024 BU MAKALEYE ATIFTA BULUNMAK İÇİN: TELİF HAKKI |
| Veteriner onkolojisi son on yılda önemli bir evrim geçirmiştir ve kemoterapi bugün birçok neoplazmda terapötik başarı ile uygulanmaktadır. Geleneksel olarak, kemoterapi protokolleri tolere edilebilir maksimum doz (MTD) kapsamında klasik sitostatik ilaçları temel alır ve bu da daha yüksek toksisite ve direnç riski ile ilişkilendirilmiştir. Bu nedenle, kanser tedavisinde yeni bir paradigma getiren metronomik kemoterapi (MC) gibi yeni terapötik alternatifler ortaya çıkmıştır. MC, sitotoksik, antianjiyojenik ve immünomodülatör etkilerin kombinasyonu sayesinde tümör mikroçevresini (TME) modüle ederek uzun süre boyunca sürekli olarak düşük dozlarda kemoterapi ilaçlarının uygulanmasıdır. Bu çok hedefli tedavi, 2007 yılından bu yana çeşitli köpek ve kedi kanserlerinde tedavi seçeneği olarak nitelendirilmiş ve özellikle köpeklerde meme karsinomları ve yumuşak doku sarkomlarında olmak üzere literatürde olumlu sonuçlar yayınlanmıştır. Bu inceleme makalesinin amacı, etki mekanizmalarına, en yaygın kullanılan ilaçlara ve klinik sonuçlara odaklanarak, MC’nin küçük hayvan onkolojisinde kullanımına ilişkin mevcut bilgileri tanımlamaktır. ANAHTAR KELİMELER |
GirişRefakatçi hayvanlarda neoplastik hastalık prevalansı son birkaç yıldır artmaktadır. Bu olgu, kısmen, evcil hayvanlarda gözlemlenen ve onları kanser gibi yaşa bağlı hastalıkların gelişmesine daha duyarlı hale getiren uzun ömürlülüğe bağlanabilir (1, 2). Bu nedenle, veteriner onkolojisinde etkili tedavi stratejileri büyük önem taşımaktadır. Antikanser ilaçları, sınırı hastanın sağlıklı dokuları üzerindeki toksik etkilere bağlı olan “tolere edilebilir maksimum doz” (MTD) konseptine göre uygulanmıştır (3–5). Bu sınırlamaların bazılarının üstesinden gelmek amacıyla, daha az yan etkiyle tümör kontrolünü sağlayacak yeni terapötik stratejilere ihtiyaç duyulmuş ve bu da metronomik kemoterapinin (MC) geliştirilmesine öncülük etmiştir. Bu yeni kemoterapötik yöntem, bazı antikanser ilaçların konvansiyonel kemoterapi rejimlerinin bir parçası olarak daha düşük dozlarda sürekli kullanıldığında daha üstün etkinliğe sahip olduğunu gösteren çeşitli araştırmaların bir sonucu olarak ortaya çıkmıştır (6, 7). Bu avantajın daha sonra, bu rejim altında uygulandığında söz konusu sitostatiklerin antianjiyojenik etkisinden kaynaklandığı ve doğrudan sitotoksisitenin ötesinde yeni ve umut verici bir terapötik odak noktası oluşturduğu anlaşılmıştır (8). Mevcut literatür kesin terapötik protokoller oluşturmak için net kanıtlar sunmasa da, bu derleme küçük hayvan hekimliğinde MC’nin mevcut durumuna kapsamlı şekilde genel bir bakış sunmayı amaçlamaktadır. Mevcut verileri ve önemli bulguları sentezleyerek, bu derleme, MC’nin mevcut kullanımını ve potansiyel faydalarını açıklığa kavuşturmayı ve veteriner onkolojik tedavinin ilerlemesine yönelik görüşlere katkıda bulunmayı amaçlamaktadır. |
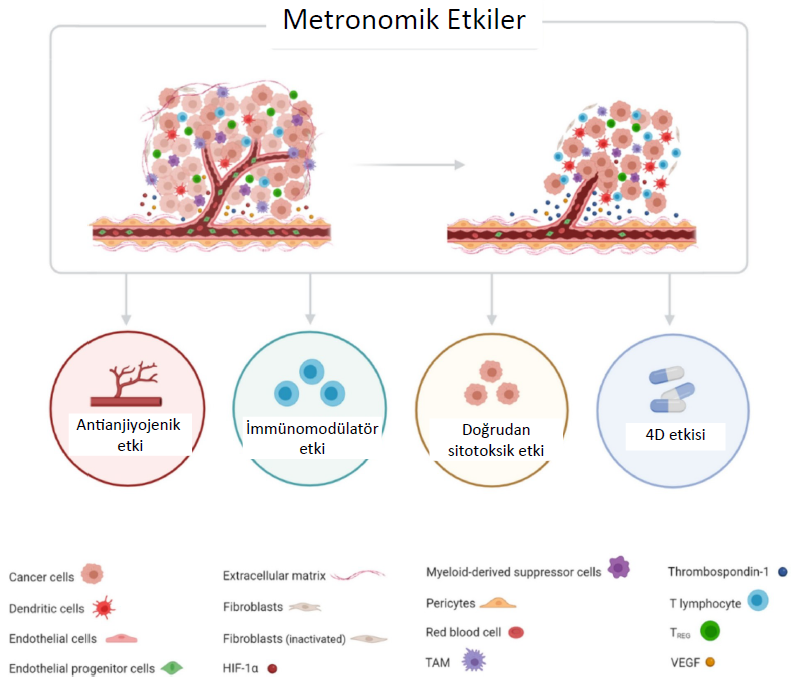
Metronomik kemoterapi: tanımdan eylem odaklı etkilere“Metronomik kemoterapi” terimi 2000’li yılların başında Douglas Hanahan tarafından önerilmiştir (9), ancak bu yeni tedavinin geliştirilmesine yönelik ilk adımlar otuz yıl önce Judah Folkman’ın tümör neovaskülarizasyonunu inhibe etmenin potansiyel olarak terapötik bir etkisi olduğunu öne sürmesiyle başlamıştır (10, 11). Bu hipotezi takiben, Baguley ve arkadaşları (12) birkaç yıl sonra kemoterapötik ajanların farelerde ilaca dirençli tümörlerin kan akışını azaltabildiğini kanıtlamış ve bu da farklı programların deneysel olarak değerlendirilmesini teşvik etmiştir. O zamanın en önemli çalışmalarından ikisi Browder ve arkadaşları (6) ile Klement ve arkadaşları (7) tarafından gerçekleştirilmiş ve sırasıyla daha yüksek sıklıkta ve sürekli olarak düşük dozda kullanılan ilaç protokollerinin tümör endotel hücreleri üzerindeki yıkıcı etkiyi artırarak apoptozisi ve sonuç olarak tümör regresyonunu indüklediğini göstermiştir. Daha sonra, özellikle geleneksel kemoterapiye kıyasla daha düşük toksisite ve kemorezistansın üstesinden gelmede daha fazla etkinlik gibi başka avantajlar da tespit edilmiştir (6, 13). Bu umut verici keşifler ve kanser ile tümör mikroçevresi (TME) hakkında giderek derinleşen bilgiler ışığında, bu konsept preklinik çalışmalardan insan ve hayvan hastalar üzerinde klinik deneylere doğru evrilmiştir (14, 15). Günümüzde MC, sitostatik ajanların uzun süreli ara vermeden düşük ve minimal toksik dozlarda sürekli olarak uygulanması şeklinde tanımlanabilir. Başlangıçta antianjiyojenik bir tedavi olarak tasarlanmasına rağmen, o zamandan beri kapsamı, sadece tümör endotelini etkilemekle kalmayıp aynı zamanda immünomodülatör etkiler gösteren, tümör proliferasyonunu doğrudan inhibe eden ve neoplastik dormansi halini indükleyen çok hedefli bir stratejiyi de içerecek şekilde genişletilmiştir (Şekil 1) (14, 16). Antianjiyojenik etkiTümör büyümesi ve metastazı için çok önemli bir süreç olan tümör neovaskülarizasyonu, anjiyogenez ve vaskülogenezi kapsamaktadır (17). Tanım olarak anjiyogenez, mevcut damarlardaki olgun endotel hücrelerinden üretilen yeni damarlanmaya karşılık gelirken, vaskülogenezde kan damarları kemik iliğindeki endotelyal progenitör hücrelerden (EPC’ler) ortaya çıkar (18–20). Aslında, tümörler her iki mekanizmayı da eş zamanlı olarak kullanabilir (21). Endotelyal proliferasyonu ve yeni damar oluşumunu teşvik etmek için tümörler proanjiyojenik maddelerin salınımını tetikler ve endostatin ve trombospondin-1 (TSP-1) gibi endojen antianjiyojenik faktörleri baskılar (2, 19, 22, 23). “Anjiyojenik anahtar” olarak adlandırılan bu fenomen, tümörlerin uyku halinden çıkmasını sağlar ve tümörün çeşitli ilerleme aşamalarında meydana gelir (17, 19, 24). Hipoksi ana tetikleyicilerinden biridir, çünkü TME’deki düşük oksijen konsantrasyonları tipik olarak proanjiyojenik faktörlerin üretilmesini tetikler (22). Vasküler endotelyal büyüme faktörü (VEGF), bazik fibroblast büyüme faktörü (bFGF), platelet kaynaklı büyüme faktörü (PDGF), dönüştürücü büyüme faktörü-β (TGF-β), hipoksi ile indüklenebilir faktör-1α (HIF-1α) ve anjiyopoietin-1 dahil olmak üzere bu faktörlerin birçoğu halihazırda tespit edilmiştir (25–29). Bu antianjiyojenik etkiler, tümör anjiyogenezinin ve vaskülogenezinin MC tarafından endotelyal ve EPC proliferasyonunun ve dolaşımının azaltılması, olgunlaşmamış endotelyal hücre farklılaşmasının engellenmesi ve proanjiyojenik ve antianjiyojenik faktörlerin modüle edilmesi dahil olmak üzere birçok yolla inhibe edilebileceğini öne süren çalışmalarla kanıtlanmıştır (6, 15, 30–33). İnterlökin (IL)-12 gibi immün sistemi uyarıcı sitokinlerin uygulanması, farelerdeki deneysel çalışmalara göre MC’nin antianjiyojenik özelliklerini potansiyel olarak artırabilir (34, 35). Refakatçi hayvanlarda bu faydaya dair kanıtlar hala azdır, ancak yapılan bir ön çalışmada küçük bir köpek grubunda umut verici terapötik sonuçlar elde edilmiştir (23). Son olarak, bazı VEGF izoformlarının yeni intra ve peritümöral lenfatik damarların oluşumuyla ilişkili olduğu düşünüldüğünde, MC’nin lenfanjiyogenezi inhibe ederek lenfatik yolla neoplastik yayılımı önlemede de önemli bir etkiye sahip olabileceği varsayılabilir (36, 37). İmmünomodülatör etkiNeoplazmların immün takibinden kaçmak için, TME’de immünosupresif durum yaratan miyeloid türevli baskılayıcı hücrelerin (MDSC’ler) ve düzenleyici T-hücrelerinin (Treg’ler) aktivasyonu gibi çeşitli stratejileri vardır (19, 22). Bu hücreler de makrofaj ve nötrofil polarizasyonunu teşvik ederek, dendritik hücrelerin aktivasyonunu tehlikeye atarak, efektör hücreleri (örneğin sitotoksik ve yardımcı T hücreleri ve doğal öldürücü hücreler) baskılayarak ve interlökin (IL)-10 ve dönüştürücü büyüme faktörü-β (TGF-β) gibi immünosupresif sitokinlerin salgılanmasını uyararak immün sistemden kaçışa ve tümör ilerlemesine neden olur (22, 27, 32, 38). Yapılan çeşitli çalışmalara göre MC, immünomodülatör etki göstererek yukarıda bahsedilen immün sistemden kaçınma stratejilerine karşı koymakta, yani MDSC ve Treg fonksiyonunu baskılamakta, lenfosit, bellek T hücresi ve doğal öldürücü hücre proliferasyonunu artırmakta ve dendritik hücreleri yukarı doğru regüle etmektedir (23, 39–44). Doğrudan sitotoksik etkiMC’ye atfedilen bir diğer etki mekanizması da tümör hücreleri, özellikle de kanser kök hücreleri (CSC’ler) üzerindeki doğrudan sitotoksik etkisidir (14, 15, 45, 46). Kendini yenileme ve çeşitli kanser hücresi tiplerine diferansiye olma kapasiteleri nedeniyle terapötik dirençteki rolleri bilinen bu CSC’ler, tümör proliferasyonu, invazyonu ve metastazında temel rol oynamaktadır (47). |
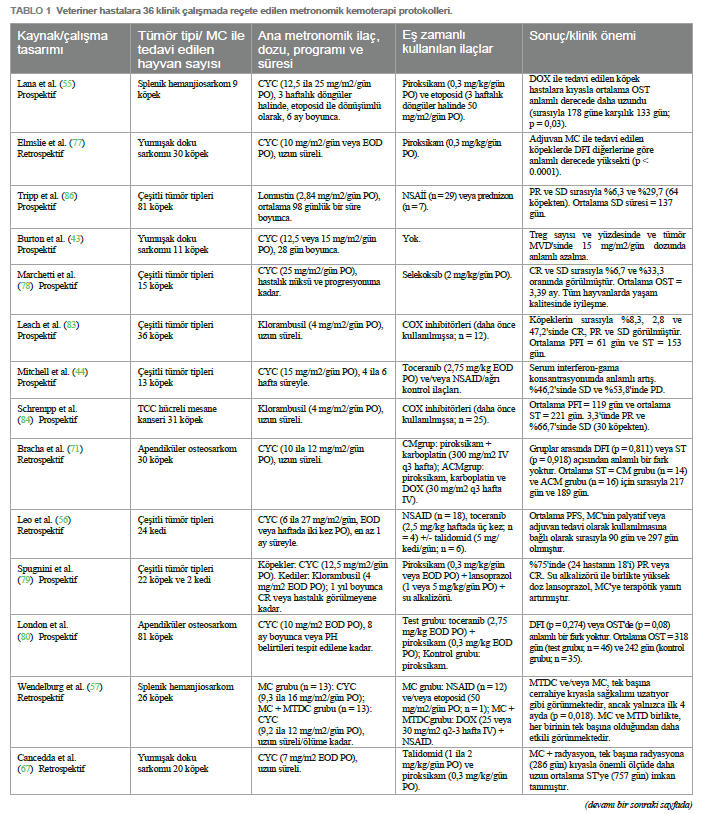
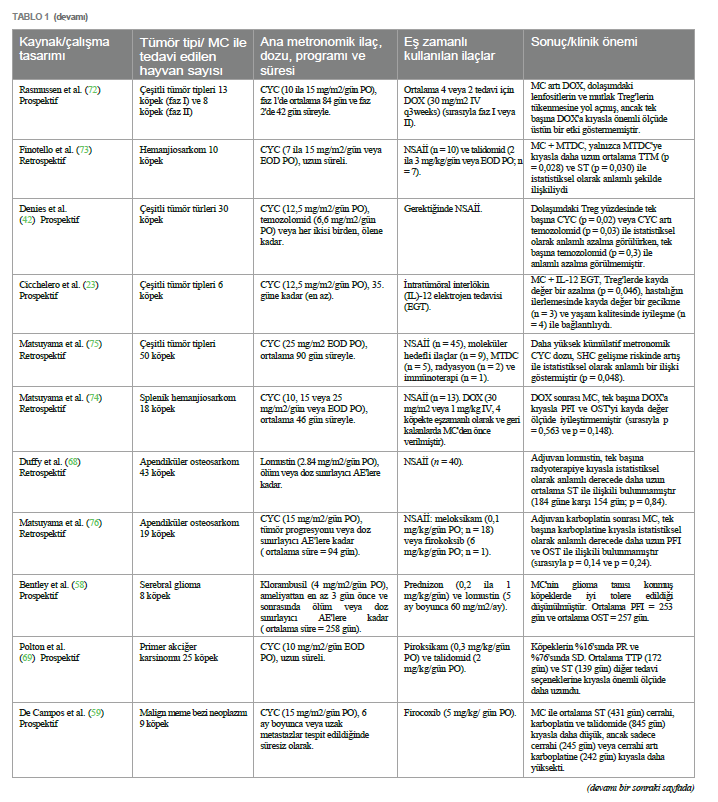
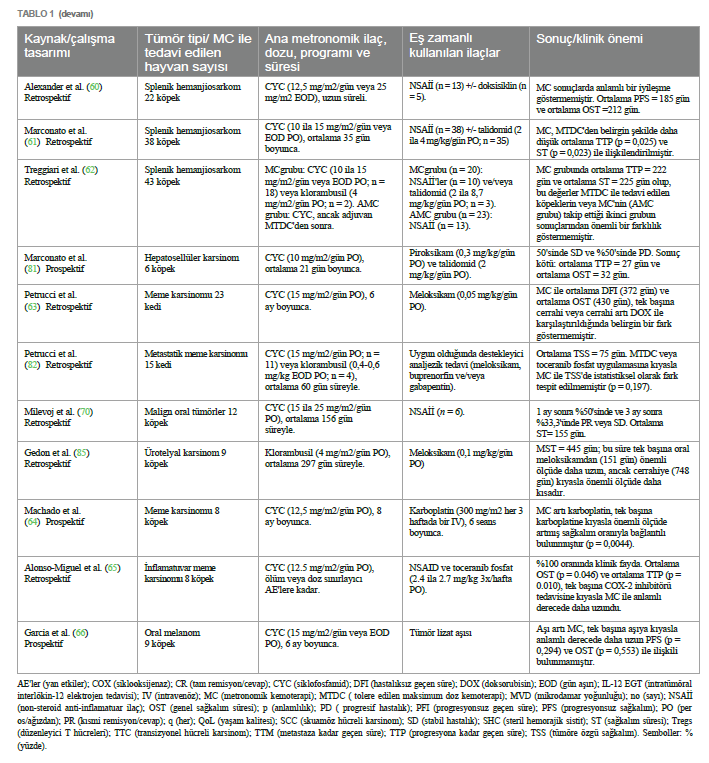
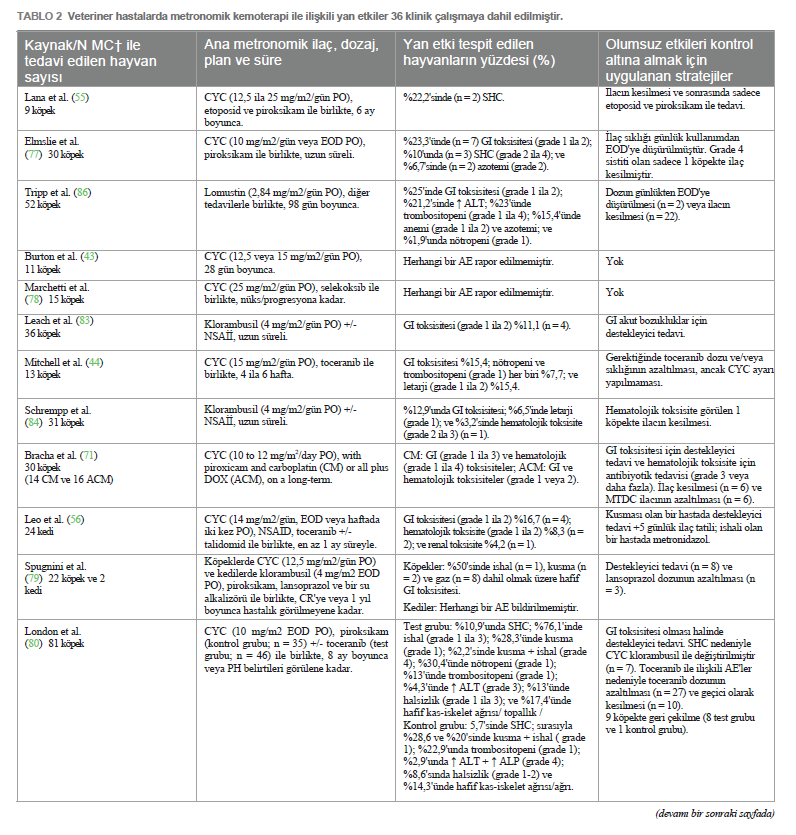
Geleneksel yüksek doz kemoterapinin aksine MC, potansiyel olarak anjiyogenezi sınırlandırarak ve VEGF ekspresyonunu doğrudan etkileyerek CSC popülasyonlarını azaltmada etkinlik göstermiştir (48, 49). Ayrıca, MC’nin etkisi tümör mikro çevresinin üç kompartmanına (bağışıklık sistemi, tümör hücreleri ve vaskülatür) kadar uzanmaktadır. Bu kompartımanlar arasındaki karmaşık etkileşim, tümör uyku halini, hücre proliferasyonu ve hücresel apoptoz arasında dinamik bir dengeyi indükleyip sürdürebilir ve potansiyel olarak hastalığın uzun süreli asemptomatik kontrolünü sağlayabilir (15, 32, 50, 51). 4D etkisiİlaca dayalı bağımlılık/yoksunluk etkisi (4D etkisi olarak da bilinir), tümörün sitotoksik ajanlara uzun süre maruz kalması ve ardından aniden kesilmesiyle elde edilebilir (52). Bu etki, in vitro çalışmalara göre, ilaca bağımlı hücreleri daha aşırı duyarlı ve dolayısıyla terapötik stratejilere karşı daha savunmasız bırakır; bu durum, anti-hormonal tedavilere dirençli meme kanseri hücrelerinde gözlemlenen bir olgudur (53, 54). Bu nedenle, MC protokollerinde sıklıkla kullanılan bir strateji olan uzun süreli kemoterapi sonrası geçici olarak ilaca ara verilmesinin tümör direncini kırabileceği ve kanser hücrelerinin ölümünü tetikleyebileceği öne sürülmektedir (52– 54). Bu yaklaşım, kanser tedavisini optimize ederek tedavi etkinliğini artırmak için ilacın uygulanmasında stratejik bir manipülasyon yapılması gerektiğini öngörmektedir. Bununla birlikte, 4D etkisi yalnızca insan tıbbında araştırılmıştır, bu nedenle MC protokollerine tabi tutulan in vivo hayvan modellerinde bu etkinin avantajlarını doğrulamak için daha fazla araştırma yapılması gerekmektedir. Veteriner onkolojide metronomik kemoterapiKüçük hayvan pratiğinde MC kullanımı ilk kez 2007 yılında, siklofosfamid, etoposid ve piroksikam içeren sürekli düşük doz oral kemoterapi protokolü ile tedavi edilen dalak hemanjiyosarkomu tanılı bir grup köpekte rapor edilmiştir (55). Düşük doz metronomik siklofosfamid daha sonra sarkomlar ve karsinomlar gibi farklı spontan maligniteler tanısı alan kedi hastalarında da rapor edilmiştir (56). O zamandan bu yana, daha az yan etki, daha az destekleyici ilaç ihtiyacı, genellikle düşük maliyet, daha az stresli uygulama, evcil hayvan sahiplerine kolaylık ve diğer tedavilerle olası kombinasyon sayesinde bu modalite veteriner hastalara giderek daha fazla uygulanmaktadır (14). Başlangıçta bazı yazarlar tarafından sadece palyatif bir tedavi olarak görülse de, günümüzde MC’nin cerrahi (57–66), radyoterapi (67, 68) veya elektrokemoterapi (66) ile birlikte veya hatta ilerlemiş, metastatik veya tedavi edilemez hastalık için ilk basamak tedavi olarak daha büyük terapötik potansiyele sahip olduğu bilinmektedir (69, 70). Ayrıca, MTD kemoterapi (MTDC) ile kombinasyon halinde, eşzamanlı olarak veya idame tedavisi için ikincisinden sonra (kemo- switch rejimi) kullanımı da rapor edilmiştir (57, 60, 62, 71–76). İlaçlar, dozlar ve planlarSon birkaç yıldır veteriner onkoloji hastalarında MC protokollerinde çeşitli sitotoksik ilaçlar kullanılmaktadır. En yaygın olarak kullanılan oral siklofosfamid olup, yayınlanan birkaç klinik çalışmaya göre dozu günde bir ila gün aşırı bir kez olmak üzere 6 ila 27 mg/m2 arasında değişmektedir (23, 42–44, 55–57, 59–67, 69–72, 74–82). Daha seyrek olmakla birlikte, oral klorambusil köpeklerde günde 4 mg/m2 dozunda (58, 62, 83–85) ve kedilerde 0,4 ila 0,6 mg/kg veya gün aşırı 4 mg/m2 dozunda (79, 82) bu iki türdeki bazı neoplazmların tedavisi için ana ilaç olarak rapor edilmiştir. Steril hemorajik sistit oluştuğunda siklofosfamid yerine de kullanılmıştır (57, 70, 73, 74, 76, 80). Buna karşılık, lomustin (68, 86), temozolomid (42) ve etoposidin (55, 57, 87) metronomik reçetesi de bazı köpek hastaların onkolojik tedavisinde sırasıyla 2,84 mg/m2, 6,6 mg/m2 ve 50 mg/m2 günlük dozlarda kullanılmıştır. Yukarıda belirtilen ilaç dozları ve planlarına rağmen, yayınlanmış veriler hala az olduğundan ve çoğu köpek ve kedi tümör tipi için oldukça heterojen olduğundan, şu anda ilaç dozları için standart bir öneri bulunmamaktadır. Buna rağmen, birçok yazar reçete edilen dozun hastanın terapötik yanıtı üzerinde önemli bir etkisi olduğunu göstermiştir. Örneğin, Burton ve arkadaşları (43) yumuşak doku sarkomu olan köpeklerde daha yüksek dozda oral siklofosfamid (15 mg/m2’ye karşı 12,5 mg/m2) kullanıldığında önemli ölçüde daha fazla immünomodülatör ve antianjiyojenik etki bildirmiştir. Bununla birlikte, daha yüksek dozlarda klorambusil (6 ila 8 mg/m2’ye karşı 4 mg/m2) ile tedavi edilen köpek hastalarda daha önce tanımlandığı gibi, daha yüksek dozların genellikle yan etkilerin daha erken ve daha sık ortaya çıkmasıyla ilişkili olduğu unutulmamalıdır (88). Her bir spesifik tümör tipinin tedavisi için minimum etkili ilaç dozunun belirlenmesi için daha fazla araştırma yapılması gerekmektedir. Son yirmi yılda, Tablo 1’de gösterildiği gibi, farklı dozlar ve planlar içeren MC’ye dayalı çeşitli klinik çalışmalar yayınlanmıştır. Diğer terapötik ilaçlarla kombinasyonMC, antianjiyojenik ve immünomodülatör etkilerini güçlendirmek için genellikle sitotoksik ve sitotoksik olmayan ajanların uygulanmasıyla kombine edilir (4, 19, 89). İlk senaryoda, MC, uygulamalar arasında neoplastik yeniden büyüme riskini azaltmak için MTDC ile birlikte kullanılabilir. Aslında, birkaç yazar bu kombine kullanımın, bu hastaların prognozunu potansiyel olarak iyileştirebilecek bir katkı ve sinerjistik etki olasılığını öne sürmüştür (57, 72). MTDC ortamında MC ile birlikte en yaygın olarak kullanılan iki intravenöz ilaç doksorubisin (57, 71, 72, 74) ve karboplatindir (64, 71). Ayrıca, tirozin kinaz inhibitörleri de metronomik siklofosfamid ile birlikte, özellikle de gün aşırı veya haftada üç kez 2,4 ila 2,75 mg/kg dozunda oral toceranib şeklinde reçete edilmiştir (44, 56, 65, 80, 90). Sitotoksik olmayan ajanlarla ilgili olarak, steroid olmayan anti-enflamatuar ilaçlar (NSAID’ler), çeşitli köpek ve kedi tümörlerinde ekspresyonu negatif bir prognostik faktör olarak kabul edilen siklooksijenaz izoform-2’yi (COX-2) inhibe etme yetenekleri nedeniyle MC ile birlikte en çok reçete edilenlerdir (91). Bu inhibitör etki, endotelyal hücre tüpü oluşumunu ve VEGF ekspresyonunu tehlikeye atarak tümör ilerlemesini önler (73, 78, 80). Bu nedenle, piroksikam (55, 56, 61, 62, 67, 69–71, 73–75, 77, 79–81, 86, 90), meloksikam (56, 61–63, 70, 73–76, 82, 85, 86, 90), firokoksib (56, 59, 62, 65, 73, 76, 86, 90), karprofen (68, 70, 86), derakoksib (74, 75, 86), selekoksib (78) ve cimikoksib (65) gibi çeşitli COX-2 inhibitörleri MC protokollerine dahil edilmiştir. Bunlar arasında, bir oksikam türevi olan piroksikam, günde 0,3 mg/kg veya gün aşırı önerilen dozda antikanser ilaç olarak etkinliği en çok kabul edilen NSAİİ’dir (69, 79, 92). MC’nin prednizon gibi kortikosteroidlerle birlikte kullanıldığı birkaç vaka da bildirilmiştir (58, 86). MC uygulanan hastalarda da tanımlanan diğer sitotoksik olmayan ilaçlar talidomid (56, 61, 62, 67, 69, 73, 81) ve doksisiklindir (60, 74, 75, 90). Talidomid, etki mekanizması henüz tam olarak anlaşılmamış olsa da VEGF, FGF ve TNF-α ekspresyonunu inhibe ederek anti- enflamatuar ve antianjiyojenik etkilerle ilişkilendirilmiştir (59, 69, 93). Bu ilacın köpek hastalarda günlük 10 mg/kg dozda iyi tolere edildiği düşünülmektedir (94), ancak tipik olarak siklofosfamid ve piroksikam ile birlikte günde 2 ila 4 mg/kg dozda kullanılmıştır (61, 69, 73, 81). Gıda alımı biyoyararlanımını etkiliyor, emilimini geciktiriyor ancak artırıyor gibi göründüğünden, uygulama zamanına dikkat edilmelidir (95). Buna rağmen, insanlarda bildirilen ciddi teratojenik etkiler nedeniyle talidomidin küresel pazardaki erişilebilirliği sınırlıdır (96) ve bu da bazı coğrafi bölgelerde veteriner metronomik protokollerinde rutin kullanımını engelleyebilir. Buna karşılık doksisiklin, tümör hücreleri üzerinde antianjiyojenik ve sitotoksik aktivitesi olduğu bildirilen bir tetrasiklin antibiyotiktir (97, 98). Bununla birlikte, köpek ve kedi neoplastik hastalıklarında spesifik terapötik etkisine ilişkin kanıtlar hala eksiktir ve antikanser amaçlı önerilen dozlar henüz belirlenmemiştir. Yan etkilerGünümüzde, köpek ve kedilerde antineoplastik tedavilerin toksisitesi, Veteriner Kooperatif Onkoloji Grubu (VCOG-CTCAE) tarafından yayınlanan kriterlere göre yan etkilere (AE’ler) dayalı olarak tahmin edilmektedir (99). |
Veteriner onkolojide metronomik kemoterapiKüçük hayvan pratiğinde MC kullanımı ilk kez 2007 yılında, siklofosfamid, etoposid ve piroksikam içeren sürekli düşük doz oral kemoterapi protokolü ile tedavi edilen dalak hemanjiyosarkomu tanılı bir grup köpekte rapor edilmiştir (55). Düşük doz metronomik siklofosfamid daha sonra sarkomlar ve karsinomlar gibi farklı spontan maligniteler tanısı alan kedi hastalarında da rapor edilmiştir (56). O zamandan bu yana, daha az yan etki, daha az destekleyici ilaç ihtiyacı, genellikle düşük maliyet, daha az stresli uygulama, evcil hayvan sahiplerine kolaylık ve diğer tedavilerle olası kombinasyon sayesinde bu modalite veteriner hastalara giderek daha fazla uygulanmaktadır (14). Başlangıçta bazı yazarlar tarafından sadece palyatif bir tedavi olarak görülse de, günümüzde MC’nin cerrahi (57–66), radyoterapi (67, 68) veya elektrokemoterapi (66) ile birlikte veya hatta ilerlemiş, metastatik veya tedavi edilemez hastalık için ilk basamak tedavi olarak daha büyük terapötik potansiyele sahip olduğu bilinmektedir (69, 70). Ayrıca, MTD kemoterapi (MTDC) ile kombinasyon halinde, eşzamanlı olarak veya idame tedavisi için ikincisinden sonra (kemo- switch rejimi) kullanımı da rapor edilmiştir (57, 60, 62, 71–76). İlaçlar, dozlar ve planlarSon birkaç yıldır veteriner onkoloji hastalarında MC protokollerinde çeşitli sitotoksik ilaçlar kullanılmaktadır. En yaygın olarak kullanılan oral siklofosfamid olup, yayınlanan birkaç klinik çalışmaya göre dozu günde bir ila gün aşırı bir kez olmak üzere 6 ila 27 mg/m2 arasında değişmektedir (23, 42–44, 55–57, 59–67, 69–72, 74–82). Daha seyrek olmakla birlikte, oral klorambusil köpeklerde günde 4 mg/m2 dozunda (58, 62, 83-85) ve kedilerde 0,4 ila 0,6 mg/kg veya gün aşırı 4 mg/m2 dozunda (79, 82) bu iki türdeki bazı neoplazmların tedavisi için ana ilaç olarak rapor edilmiştir. Steril hemorajik sistit oluştuğunda siklofosfamid yerine de kullanılmıştır (57, 70, 73, 74, 76, 80). Buna karşılık, lomustin (68, 86), temozolomid (42) ve etoposidin (55, 57, 87) metronomik reçetesi de bazı köpek hastaların onkolojik tedavisinde sırasıyla 2,84 mg/m2, 6,6 mg/m2 ve 50 mg/m2 günlük dozlarda kullanılmıştır. Yukarıda belirtilen ilaç dozları ve planlarına rağmen, yayınlanmış veriler hala az olduğundan ve çoğu köpek ve kedi tümör tipi için oldukça heterojen olduğundan, şu anda ilaç dozları için standart bir öneri bulunmamaktadır. Buna rağmen, birçok yazar reçete edilen dozun hastanın terapötik yanıtı üzerinde önemli bir etkisi olduğunu göstermiştir. Örneğin, Burton ve arkadaşları (43) yumuşak doku sarkomu olan köpeklerde daha yüksek dozda oral siklofosfamid (15 mg/m2’ye karşı 12,5 mg/m2) kullanıldığında önemli ölçüde daha fazla immünomodülatör ve antianjiyojenik etki bildirmiştir. Bununla birlikte, daha yüksek dozlarda klorambusil (6 ila 8 mg/m2’ye karşı 4 mg/m2) ile tedavi edilen köpek hastalarda daha önce tanımlandığı gibi, daha yüksek dozların genellikle yan etkilerin daha erken ve daha sık ortaya çıkmasıyla ilişkili olduğu unutulmamalıdır (88). Her bir spesifik tümör tipinin tedavisi için minimum etkili ilaç dozunun belirlenmesi için daha fazla araştırma yapılması gerekmektedir. Son yirmi yılda, Tablo 1’de gösterildiği gibi, farklı dozlar ve planlar içeren MC’ye dayalı çeşitli klinik çalışmalar yayınlanmıştır. Diğer terapötik ilaçlarla kombinasyonMC, antianjiyojenik ve immünomodülatör etkilerini güçlendirmek için genellikle sitotoksik ve sitotoksik olmayan ajanların uygulanmasıyla kombine edilir (4, 19, 89). İlk senaryoda, MC, uygulamalar arasında neoplastik yeniden büyüme riskini azaltmak için MTDC ile birlikte kullanılabilir. Aslında, birkaç yazar bu kombine kullanımın, bu hastaların prognozunu potansiyel olarak iyileştirebilecek bir katkı ve sinerjistik etki olasılığını öne sürmüştür (57, 72). MTDC ortamında MC ile birlikte en yaygın olarak kullanılan iki intravenöz ilaç doksorubisin (57, 71, 72, 74) ve karboplatindir (64, 71). Ayrıca, tirozin kinaz inhibitörleri de metronomik siklofosfamid ile birlikte, özellikle de gün aşırı veya haftada üç kez 2,4 ila 2,75 mg/kg dozunda oral toceranib şeklinde reçete edilmiştir (44, 56, 65, 80, 90). Sitotoksik olmayan ajanlarla ilgili olarak, steroid olmayan anti-enflamatuar ilaçlar (NSAID’ler), çeşitli köpek ve kedi tümörlerinde ekspresyonu negatif bir prognostik faktör olarak kabul edilen siklooksijenaz izoform-2’yi (COX-2) inhibe etme yetenekleri nedeniyle MC ile birlikte en çok reçete edilenlerdir (91). Bu inhibitör etki, endotelyal hücre tüpü oluşumunu ve VEGF ekspresyonunu tehlikeye atarak tümör ilerlemesini önler (73, 78, 80). Bu nedenle, piroksikam (55, 56, 61, 62, 67, 69–71, 73–75, 77, 79–81, 86, 90), meloksikam (56, 61–63, 70, 73–76, 82, 85, 86, 90), firokoksib (56, 59, 62, 65, 73, 76, 86, 90), karprofen (68, 70, 86), derakoksib (74, 75, 86), selekoksib (78) ve cimikoksib (65) gibi çeşitli COX-2 inhibitörleri MC protokollerine dahil edilmiştir. Bunlar arasında, bir oksikam türevi olan piroksikam, günde 0,3 mg/kg veya gün aşırı önerilen dozda antikanser ilaç olarak etkinliği en çok kabul edilen NSAİİ’dir (69, 79, 92). MC’nin prednizon gibi kortikosteroidlerle birlikte kullanıldığı birkaç vaka da bildirilmiştir (58, 86). MC uygulanan hastalarda da tanımlanan diğer sitotoksik olmayan ilaçlar talidomid (56, 61, 62, 67, 69, 73, 81) ve doksisiklindir (60, 74, 75, 90). Talidomid, etki mekanizması henüz tam olarak anlaşılmamış olsa da VEGF, FGF ve TNF-α ekspresyonunu inhibe ederek anti- enflamatuar ve antianjiyojenik etkilerle ilişkilendirilmiştir (59, 69, 93). Bu ilacın köpek hastalarda günlük 10 mg/kg dozda iyi tolere edildiği düşünülmektedir (94), ancak tipik olarak siklofosfamid ve piroksikam ile birlikte günde 2 ila 4 mg/kg dozda kullanılmıştır (61, 69, 73, 81). Gıda alımı biyoyararlanımını etkiliyor, emilimini geciktiriyor ancak artırıyor gibi göründüğünden, uygulama zamanına dikkat edilmelidir (95). Buna rağmen, insanlarda bildirilen ciddi teratojenik etkiler nedeniyle talidomidin küresel pazardaki erişilebilirliği sınırlıdır (96) ve bu da bazı coğrafi bölgelerde veteriner metronomik protokollerinde rutin kullanımını engelleyebilir. Buna karşılık doksisiklin, tümör hücreleri üzerinde antianjiyojenik ve sitotoksik aktivitesi olduğu bildirilen bir tetrasiklin antibiyotiktir (97, 98). Bununla birlikte, köpek ve kedi neoplastik hastalıklarında spesifik terapötik etkisine ilişkin kanıtlar hala eksiktir ve antikanser amaçlı önerilen dozlar henüz belirlenmemiştir. Yan etkilerGünümüzde, köpek ve kedilerde antineoplastik tedavilerin toksisitesi, Veteriner Kooperatif Onkoloji Grubu (VCOG-CTCAE) tarafından yayınlanan kriterlere göre yan etkilere (AE’ler) dayalı olarak tahmin edilmektedir (99). |
Köpek dalak hemanjiosarkomuSplenik hemanjiosarkomlu hastalarda total splenektomi önerilmektedir ve bu hastaların prognozunu iyileştirmek için özellikle doksorubisin bazlı adjuvan kemoterapi protokolleri ile ilişkilendirilmiştir (57, 118). Daha yakın zamanlarda, birkaç yazar bu hayvanların adjuvan tedavisine metronomik siklofosfamid eklenmesini önermiştir, ancak literatüre göre potansiyel terapötik faydası henüz tam olarak net değildir. Aslında, bazı yazarlar prognoz ile ilgili kayda değer bir pozitif etki olduğunu belirtirken (55, 73), diğerleri bunu belirtmemiştir (60–62, 74). Önceki iki çalışmada, doksorubisin ile konvansiyonel kemoterapiyi takiben (73) veya ona alternatif olarak (55) metronomik siklofosfamid ile tedavi edilen hemanjiosarkomlu köpeklerin, sadece adjuvan MTDC ile tedavi edilenlere kıyasla önemli ölçüde daha uzun yaşadığı sonucuna varılmıştır. Aksine, diğer beş çalışmada MC cerrahiye eklendiğinde (57), cerrahi artı MTDC’yi takiben uygulandığında (60, 62, 74) veya adjuvan konvansiyonel kemoterapiye alternatif olarak kullanıldığında (61, 62) sonuçlarda anlamlı bir iyileşme olmadığı bildirilmiştir. Bununla birlikte, bunlardan biri en azından kısa vadede (ilk 4 ay) terapötik fayda sağladığını öne sürmüştür (57). Metronomik lomustin (86) ve klorambusil (62) kullanımına ilişkin raporlar da vardır, ancak bu hastalarda faydalı etkisini destekleyen bir kanıt hala yoktur. Bu nedenle, doksorubisin bu malign neoplazmın adjuvan tedavisinde tek etkili sitotoksik ilaç olarak kabul edilmeye devam ettiğinden, MC şu anda bir öncekinin kontrendike olduğu vakalara (örneğin, kalp hastalığı olan köpekler) veya sağkalım süresinin potansiyel pahasına tedaviye bağlı daha az toksisite ile daha iyi bir yaşam kalitesine öncelik verildiğinde seçilmelidir (119). Köpek apendiküler osteosarkomuEtkilenen uzvun ampütasyonu ve ardından karboplatin kemoterapisi apendiküler osteosarkomlar için tercih edilen tedavidir, ancak etkinliğini artırmak için bu hayvanlarda MC’nin adjuvan kullanımı da araştırılmıştır (68, 71, 76, 80). Ancak, yapılan üç çalışmaya göre, metronomik siklofosfamid ve bir NSAİİ’nin konvansiyonel tedaviye eklenmesi, toceranib de eklendiğinde bile, hastalıksız geçen süreyi veya sağkalım süresini uzatmada önemli bir fayda sağlamamıştır (71, 76, 80)(80). Metronomik lomustin de apendiküler osteosarkomlu köpeklerde kullanılmıştır, ancak iyi tolere edilmesine rağmen (68, 86), radyoterapi gibi diğer tedavilere kıyasla bu hastaların sağkalımını önemli ölçüde iyileştirdiği görülmemiştir (68). Dolayısıyla, şimdiye kadar elde edilen veriler, apendiküler osteosarkom tanısı konan köpeklerde MC kullanımını desteklememektedir. Köpek meme karsinomuMastektomi köpeklerde malign meme tümörleri için tercih edilen tedavi olmaya devam etmektedir, ancak lokal nüks veya metastaz riski taşıyan lezyonlar için siklofosfamid, 5-florourasil, mitoksantron, karboplatin ve gemsitabin gibi tekli veya çoklu sitotoksik ilaçlarla adjuvan MTDC yöntemi önerilmiştir (120). Bu tümörlerin karmaşıklığı göz önüne alındığında, NSAID’lerle kombine edilmiş MC gibi çok hedefli tedaviler gibi yeni terapötik yaklaşımlar da araştırılmıştır. Buna paralel olarak, De Campos ve arkadaşları ile Machado ve arkadaşları, cerrahiyi takiben metronomik siklofosfamid ve dört (59) ila altı (64) kür intravenöz karboplatinin, tek başına cerrahiye (59) veya cerrahi artı sadece konvansiyonel kemoterapiye (59, 64) kıyasla daha iyi bir sonuçla sonuçlandığını göstermiştir. İlginç bir şekilde, bu çalışmalardan birine göre, siklofosfamid yerine eklendiğinde bu hastalarda daha iyi bir prognoz sağlayan tek adjuvan ilaç talidomid olmuştur (59). Dolayısıyla, bu iki çalışmaya göre, MC köpek meme karsinomlarının terapötik yönetiminde klinik fayda ile ilişkili görünmektedir. Buna karşılık, köpeklerde meme kanserinin en agresif formu olan inflamatuar meme karsinomu, kemoterapinin faydası konusunda fikir birliği olmaksızın, uygulanan terapötik yaklaşımlara rağmen çok kötü bir prognozla ilişkilendirilmiştir (121). Bununla birlikte, bu tümörler daha yüksek COX-2 ekspresyonu ile ilişkili olduğundan, piroksikam gibi inhibitörlerinin kullanımı da ortaya konmuştur (122, 123). Buna paralel olarak, Alonso- Miguel ve arkadaşları (65) yakın zamanda metronomik siklofosfamid ve toceranib fosfatın tek başına COX-2 inhibitörü tedavisine eklenmesinin potansiyel faydasını değerlendirmiş ve sağkalımda önemli bir artış olduğunu göstermiştir. Bununla birlikte, değerlendirilen köpek sayısının az olması ve çalışmanın geriye dönük doğası, daha fazla klinik sonuca varılmasını engellemektedir. Aslında, mevcut bilimsel kanıtlara dayanarak, etkili bir tıbbi tedavi henüz bulunmamıştır ve bu tedavi muhtemelen yeni terapötik hedeflere göre belirlenecektir (121, 124). Köpek yumuşak doku sarkomlarıYumuşak doku sarkomları (STS), lokal rekürrensi önlemek ve potansiyel olarak terapötik kür elde etmek için geniş sınırlarla eksize edilmelidir. Buna ek olarak, bilimsel kanıt düzeyi hala düşük kabul edilse de, tam olarak rezeke edilmemiş ve yüksek grade’li tümörler için ek kemoterapi ve/veya radyoterapi protokolleri uygulanmaktadır (125). Bununla birlikte, metronomik siklofosfamid, tam olarak rezeke edilmemiş bu tümörlerin nüksünü önlemede etkili olarak tanımlanmış ve tek başına cerrahiye kıyasla daha uzun hastalıksız geçen sürelere olanak sağlamıştır (77). Cancedda ve arkadaşları (67) tarafından, hipofraksiyone radyoterapi ve ardından oral siklofosfamid, piroksikam ve talidomid ile MC uygulanan ya da uygulanmayan makroskopik STS’li köpekler üzerinde yapılan retrospektif çalışmada da sağkalım açısından fayda sağlandığı rapor edilmiştir. Bu çalışmada, adjuvan MC uygulanan köpekler önemli ölçüde daha uzun yaşamış (p = 0.023), ancak progresyonsuz aralıkta önemli bir fark elde edilmemiştir. Bu hastalarda metronomik klorambusil kullanımı da değerlendirilmiştir. Leach ve arkadaşları (83), yan tarafında STS olan bir köpeğin bu ilaca başladıktan 35 hafta sonra hala tam remisyonda olduğunu bildirmiştir. Bu çalışmalara göre, MC bu hastaların adjuvan tedavisinde uygun bir seçenek gibi görünmektedir. Köpek idrar yolu tümörleriNSAID’lerle birlikte mitoksantron, karboplatin veya vinblastin gibi kemoterapötik ajanların uygulanması, genellikle cerrahinin uygulanabilir olmasını engelleyen tipik olarak zorlu konum nedeniyle köpeklerde idrar yolu tümörleri için tercih edilen tedavi olarak kabul edilmiştir (126). İki çalışma, mesaneyi (84, 85) ve/veya üretrayı (85) etkileyen malign neoplazm tanısı konmuş köpeklerde klorambusilin metronomik kullanımını rapor etmiştir. Schrempp ve arkadaşlarına (84) göre, klorambusil bazlı metronomik protokol, özellikle diğer tedavilerin başarısız olduğu durumlarda, mesanenin transizyonel hücreli karsinomu olan köpekler için iyi tolere edilen ve etkili bir seçenek olarak görünmektedir. Daha yakın zamanda, Gedon ve arkadaşları (85) ürotelyal karsinomlu hastalarda meloksikam ile birlikte oral klorambusil uygulamasının tek başına NSAID tedavisine kıyasla iyi bir terapötik seçenek olduğunu göstermiştir. Daha fazla çalışmaya ihtiyaç vardır, ancak bu sonuçlar göz önüne alındığında, bu protokol en az 3 klinik senaryoda düşünülmelidir: (1) konvansiyonel kemoterapi başarısız olduğunda; (2) daha düşük toksisiteye sahip alternatif bir kemoterapötik yaklaşım amaçlandığında ve (3) metronomik klorambusil ilavesi terapötik etkisini artırıyor gibi göründüğünden NSAID tedavisi seçildiğinde. Köpek malign ağız tümörleriKöpeklerde malign oral tümörlerin tedavisinde cerrahi ve/veya radyoterapi tercih edilen yaklaşımlar olsa da, Milevoj ve arkadaşları (70) tarafından önerildiği gibi, sahiplerinin bunları reddettiği durumlarda oral metronomik siklofosfamid palyatif bir seçenek olarak faydalı olabilir. Bu çalışmada, hayvanların yarısında 1 ay sonra kısmi yanıt veya stabil hastalık görülmüştür. Bununla birlikte, çalışmaya dahil edilen hayvan sayısının az olması, histolojik tiplerin değişkenliği ve kontrol grubunun bulunmaması gibi kanıt elde etme oranını düşüren çeşitli kısıtlamalar bulunmaktadır. Buna karşın, Garcia ve arkadaşları (66) oral melanomlu köpeklerde immünoterapi protokolüne metronomik siklofosfamid eklenmesinin klinik bir faydası olmadığını tespit etmiştir. Bu nedenle, köpeklerde oral malign tümörlerde MC’nin potansiyel avantajını açıklığa kavuşturmak için randomize ve kontrollü çalışmalara ihtiyaç vardır. Köpek primer akciğer karsinomuPrimer pulmoner tümörlerin cerrahi olarak çıkarılması daha iyi prognoz sağlayacak bir tedavi yöntemidir, ancak konumları ve boyutları göz önüne alındığında bu mümkün olmayabilir ve alternatif olarak karboplatin, vinorelbin veya gemsitabin içeren MTDC gibi sistemik tedaviyi gerektirir (69, 127, 128). Siklofosfamid, piroksikam ve talidomide dayalı bir MC protokolü de Polton ve arkadaşları (69) tarafından bildirilmiş olup, bu protokol ilerlemiş primer akciğer karsinomu teşhisi konulan köpeklerde önemli bir terapötik fayda ile ilişkilendirilmiştir. Yapılan çok değişkenli sağkalım analizine göre, MC almayan ve cerrahi, MTDC veya hiçbir onkolojik tedavi uygulanmayan hastalarda tümör hastalığının ilerlemesi ve ölüm riski sırasıyla 1,7 ve 1,5 artmıştır. Bu sonuç, bildirilen düşük toksisite ve hastaların çoğunda (%91,3) tanımlanan yaşam kalitesindeki iyileşme göz önüne alındığında, MC rezeke edilemeyen ve/veya metastatik primer akciğer tümörlerinde iyi bir terapötik alternatif olarak görünmektedir, ancak bu kanıtı güçlendirmek için daha fazla çalışmaya ihtiyaç vardır. Köpek hepatosellüler karsinomuKöpeklerde hepatosellüler karsinomlarda MC’nin terapötik kullanımı üzerine tek bir çalışma yayınlanmıştır (81). Yazarların amacı, tam cerrahi rezeksiyon mümkün olmadığında prognoz genelde kötü olduğundan, bu tümör tipi için etkili ve iyi tolere edilen bir kemoterapi alternatifini araştırmaktı. Ancak, metronomik siklofosfamid, piroksikam ve talidomid ile tedavi edilen hayvanların sonuçları kötü çıkmıştır. Bu nedenle, köpek hepatoselüler karsinomunun tedavisi için potansiyel olarak etkili bir sistemik tedavi (MC gibi) henüz bulunamamıştır. Köpek serebral gliomasıKöpek intrakraniyal tümörlerinin tedavisi için cerrahi ve/veya radyoterapi önerilen seçeneklerdir. Buna karşın, bu tümörlerin heterojenliği ve kan-beyin bariyerinin sitotoksik ilaçlara yeterli dozlarda maruz kalmayı genellikle engellediği gerçeği göz önüne alındığında, kemoterapinin çok düşük bir terapötik değeri vardır (129). Buna rağmen, Bentley ve arkadaşları (58) köpek serebral gliomlarının mikrocerrahi rezeksiyonundan sonra prednizon ve aylık lomustin ile birlikte günlük klorambusilin metronomik kullanımını ortaya koymuştur. Bu adjuvan yaklaşım iyi tolere edilmiş ve bu hastalar daha önce semptomatik yaklaşım ve tek başına lomustin ile tedavi edilen diğer hastalara kıyasla daha iyi bir sonuca sahip olmuştur (130, 131). Ancak bu umut verici sonuçlar, çalışmaya dahil edilen köpek sayısının azlığı göz önünde bulundurularak dikkatle yorumlanmalıdır. Bu nedenle, sadece bu protokolü değerlendirmek için değil, aynı zamanda MC’nin adjuvan radyoterapi gibi bu hastalarda tipik olarak önerilen diğer tedavilerle birleştirilmesinin potansiyel faydasını araştırmak için daha fazla çalışmaya ihtiyaç vardır. Kedi meme karsinomuKedi meme karsinomları oldukça maligndir ve genellikle radikal mastektomi ve ardından doksorubisin (132, 133), karboplatin (134) veya mitoksantron (135) içeren agresif bir yaklaşım gerektirir. Daha az AE ile ilişkili ve kediler için potansiyel olarak stresli tedavi seanslarından kaçınabilecek adjuvan alternatifler bulmak için son zamanlarda metronomik protokoller önerilmiştir. Ancak bu çalışmalara göre, metronomik siklofosfamid (63, 82) veya klorambusil (82) ile tedavi edilen dişi kediler, yalnızca cerrahi (63), cerrahi artı doksorubisin bazlı MTDC (63, 82) veya hatta cerrahi artı toceranib fosfat (82) uygulanan kedilerden çok da uzun yaşamamıştır. Dolayısıyla, bugüne kadar bu hasta grubunda MC kullanımını destekleyen bilimsel bir kanıt bulunmamaktadır. Köpek ve kedi metastatik tümörleriMC, siklofosfamid (78, 79), klorambusil (83) veya lomustin (86) ile birlikte köpek metastatik tümörlerinin tedavisinde de uygulanmıştır. Bu hastaların tipik prognozu göz önüne alındığında, bazı hayvanlarda stabil hastalık (78, 83, 86) ve hatta kısmi (79, 86) ve tam yanıtlar (78, 79) elde edildiği için MC ile umut verici sonuçlar bildirilmiştir. Kedilerde ilerlemiş veya metastatik tümörler metronomik siklofosfamid (56, 82) veya klorambusil (79) ile de tedavi edilmiş ve bazı kedilerde stabil hastalık görülmüştür (56). Bu nedenle, bu çalışmalara göre, MC metastatik neoplastik hastalığı olan hastalarda sadece palyatif tedavi olarak değil, aynı zamanda özel duruma bağlı olarak adjuvan veya hatta ilk basamak tedavi yöntemi olarak da düşünülmelidir. Klinik uygulamada metronomik kemoterapiye ilişkin sınırlamalarDaha uygun maliyet, daha düşük ilaç direnci riski ve daha düşük yan etki oranı ile ilişkili olarak yukarıda tartışılan ve genel olarak umut verici olan kanıtlar, veteriner onkolojisinde MC’nin popülaritesindeki son artışı açıklamaktadır. Bununla birlikte, günümüzde MC’nin klinik uygulamada kullanımını sınırlayan ve göz ardı edilmemesi gereken bazı faktörler bulunmaktadır. İlk olarak, spesifik tümör tipleri için standartlaştırılmış doz protokollerinin ve kapsamlı klinik çalışmaların olmaması, yaygın klinik kullanımının önünde zorluklar teşkil etmektedir. İkinci olarak, MC genellikle geleneksel kemoterapiye kıyasla daha az ve daha az ciddi yan etkilerle ilişkilendirilse de (61), uzun süreli uygulama yine de bazı hastalarda dikkatli takip ve tedavi gerektiren kümülatif toksisiteye yol açabilir (65, 75, 86). Buna ek olarak, insan tıbbında antianjiyojenik ilaçlara karşı direnç mekanizmaları tespit edildiğinden, zaman içinde kemorezistan gelişme riski de söz konusu olabilir (136, 137). Son olarak, bu tedavi yaklaşımı her zaman evde ilacın oral yoldan uygulanmasından sorumlu olan hayvan sahibinin tedaviye yeterli düzeyde uyum göstermesine bağlı olacaktır. Aslında, sahibinin uyumsuzluğu, yani bir veya daha fazla ilacın günlük olarak ağızdan verilmesindeki zorluk nedeniyle, evcil hayvanlarda MC uygulamasını sınırlamaya devam eden ana faktörlerden biri olabilir. Bu husus, özellikle evde ilaç tedavisinin daha zorlayıcı olduğu ve genellikle kedi sahibi ve kedi için olumsuz deneyimlere yol açtığı düşünülen kedi hastaları için geçerli olabilir (138). Köpeklere kıyasla bu türde MC kullanımına ilişkin önemli ölçüde daha az klinik çalışmanın varlığı, bildirilen bu kısıtlamayla nispeten açıklanabilir. Bu sınırlamaların üstesinden gelmek için, metronomik dozların optimize edilmesi, potansiyel toksisitenin değerlendirilmesi ve daha geniş bir neoplastik hastalık yelpazesinde terapötik etkilerin tam spektrumunun araştırılması ve bu tedavi yaklaşımının tam potansiyeline ulaşmasının sağlanması için daha fazla araştırmaya yönelik çaba gösterilmesi çok önemli olacaktır. Sonuçlar ve geleceğe yönelik hedeflerMC, geleneksel yüksek doz rejimlerinden kemoterapötik ajanların sürekli ve düşük dozda uygulanmasına öncelik veren bir stratejiye geçiş yaparak kanser tedavisi yaklaşımında devrim niteliğinde bir değişime işaret etmektedir. Bu yöntem, TME içindeki karmaşık etkileşimlerden, anjiyogenez sürecinden ve kanser hücrelerinin doğrudan hedeflenmesinden yararlanarak maligniteyle mücadelede alternatif bir yol sunmaktadır. Bu doğrultuda, köpek ve kedilerdeki çeşitli neoplazmlarda, monoterapi olarak veya diğer tedavi yaklaşımlarıyla kombinasyon halinde, özellikle de köpek meme karsinomları ve köpek yumuşak doku sarkomlarında terapötik faydalar göstermiştir. Geleceğe bakıldığında, veteriner onkolojisinin durumu, en etkili dozaj stratejilerini belirlemek için MC protokollerini iyileştirmeyi amaçlayan sürekli araştırmalarla önemli ölçüde gelişecektir. Buna ek olarak, MC’nin immünoterapi ve hedefe yönelik tedaviler de dahil olmak üzere yeni terapötik protokollere entegre edilmesi, kişiselleştirilmiş onkolojik tedavi olasılığının önünü açarak daha iyi sonuçlara katkıda bulunacaktır. Bu da, metastatik ve başka türlü tedavi edilemeyen hastalıklar da dahil olmak üzere çeşitli tümör türlerinin tedavisinde daha yaygın klinik kullanımının önünü açabilir ve daha uzun sağkalım ve daha iyi yaşam kalitesi için umut verebilir. Katkıda bulunan yazarlarGP: Kavramsallaştırma, Veri düzenleme, Biçimsel analiz, Araştırma, Yazım – orijinal taslak. TM: Veri düzenleme, Biçimsel analiz, Araştırma, Doğrulama, Yazım – orijinal taslak. MD: Veri düzenleme, Araştırma, Yazım – orijinal taslak. FQ: Kavramsallaştırma, Finansman temini, Proje yönetimi, Süpervizyon, Yazım – inceleme ve düzenleme. FinansmanYazar(lar) bu makalenin araştırması, yazarlığı ve/veya yayını için finansal destek aldıklarını beyan etmiştir. Bu çalışma UIDB/00772/2020 projesi kapsamında Ulusal Fonlar (FCT/MCTES, Fundação para a Ciência e a Tecnologia ve Ministério da Ciência, Tecnologia e Ensino Superior) tarafından finanse edilmiştir. Yazarlar ayrıca FCT/MCTES’ten UIDB/00211/2020 ve LA/P/0059/2020 projeleri ile alınan mali destek için teşekkürlerini sunmaktadır. Çıkar çatışması beyanıYazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişki olmaksızın yürütüldüğünü beyan etmiştir. GP ve FQ adlı yazarlar, başvuru sırasında Frontiers’ın yayın kurulu üyesi olduklarını beyan etmişlerdir. Bu durumun hakem değerlendirme süreci ve nihai karar üzerinde herhangi bir etkisi olmamıştır. Yayıncının beyanıBu makalede ifade edilen tüm iddialar yalnızca yazarlara aittir ve bağlı oldukları kuruluşların veya yayıncının, editörlerin ve hakemlerin iddialarını temsil etmeyebilir. Bu makalede değerlendirilebilecek herhangi bir ürün veya üreticisi tarafından ileri sürülebilecek herhangi bir iddia, yayıncı tarafından garanti edilmez veya desteklenmez. |
Kaynakça1. Paoloni MC, Khanna C. Comparative oncology today. Vet Clin North Am Small Anim Pract. (2007) 37:1023–32. doi: 10.1016/j.cvsm.2007.08.003 2. Pierini A, Bocci G, Giorgi M, Owen H, Marchetti V. From humans to dogs and Back: the translational lesson of metronomic chemotherapy. Am J Anim Vet Sci. (2012) 7:198–212. doi: 10.3844/ajavsp.2012.198.212 3. Skipper HE, Schabel FM Jr, Mellett LB, Montgomery JA, Wilkoff LJ, Lloyd HH, et al. Implications of biochemical, cytokinetic, pharmacologic, and toxicologic relationships in the design of optimal therapeutic schedules. Cancer Chemother Rep. (1970) 54:431–50. 4. Mutsaers AJ. Metronomic chemotherapy. Top Companion Anim Med. (2009) 24:137–43. doi: 10.1053/j.tcam.2009.03.004 5. Scharovsky OG, Mainetti LE, Rozados VR. Metronomic chemotherapy: changing the paradigm that more is better. Curr Oncol. (2009) 16:7–15. doi: 10.3747/co.v16i2.420 6. Browder T, Butterfield CE, Kräling BM, Shi B, Marshall B, O’Reilly MS, et al. Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res. (2000) 60:1878–86. 7. Klement G, Baruchel S, Rak J, Man S, Clark K, Hicklin DJ, et al. Continuous low- dose therapy with vinblastine and VEGF receptor-2 antibody induces sustained tumor regression without overt toxicity. J Clin Invest. (2000) 105:R15–24. doi: 10.1172/JCI8829 8. Colleoni M, Rocca A, Sandri MT, Zorzino L, Masci G, Nolè F, et al. Low-dose oral methotrexate and cyclophosphamide in metastatic breast cancer: antitumor activity and correlation with vascular endothelial growth factor levels. Ann Oncol. (2002) 13:73–80. doi: 10.1093/annonc/mdf013 9. Hanahan D, Bergers G, Bergsland E. Less is more, regularly: metronomic dosing of cytotoxic drugs can target tumor angiogenesis in mice. J Clin Invest. (2000) 105:1045–7. doi: 10.1172/JCI9872 10. Folkman J. Tumor angiogenesis: therapeutic implications. N Engl J Med. (1971) 285:1182–6. doi: 10.1056/NEJM197111182852108 11. Folkman J, Merler E, Abernathy C, Williams G. Isolation of a tumor factor responsible for angiogenesis. J Exp Med. (1971) 133:275–88. doi: 10.1084/jem.133.2.275 12. Baguley BC, Holdaway KM, Thomsen LL, Zhuang L, Zwi LJ. Inhibition of growth of colon 38 adenocarcinoma by vinblastine and colchicine: evidence for a vascular mechanism. Eur J Cancer. (1991) 27:482–7. doi: 10.1016/0277-5379(91)90391-P 13. Emmenegger U, Man S, Shaked Y, Francia G, Wong JW, Hicklin DJ, et al. A comparative analysis of low-dose metronomic cyclophosphamide reveals absent or low-grade toxicity on tissues highly sensitive to the toxic effects of maximum tolerated dose regimens. Cancer Res. (2004) 64:3994–4000. doi: 10.1158/0008-5472. CAN-04-0580 14. Gaspar TB, Henriques J, Marconato L, Queiroga FL. The use of low-dose metronomic chemotherapy in dogs-insight into a modern cancer field. Vet Comp Oncol. (2018) 16:2–11. doi: 10.1111/vco.12309 15. Cazzaniga ME, Cordani N, Capici S, Cogliati V, Riva F, Cerrito MG. Metronomic chemotherapy. Cancers (Basel). (2021) 13:22363. doi: 10.3390/cancers13092236 16. Romiti A, Falcone R, Roberto M, Marchetti P. Current achievements and future perspectives of metronomic chemotherapy. Investig New Drugs. (2017) 35:359–74. doi: 10.1007/s10637-016-0408-x 17. Benazzi C, Al-Dissi A, Chau CH, Figg WD, Sarli G, de Oliveira JT, et al. Angiogenesis in spontaneous tumors and implications for comparative tumor biology. Sci World J. (2014) 2014:919570:1–16. doi: 10.1155/2014/919570 18. Bertolini F, Shaked Y, Mancuso P, Kerbel RS. The multifaceted circulating endothelial cell in cancer: towards marker and target identification. Nat Rev Cancer. (2006) 6:835–45. doi: 10.1038/nrc1971 19. Biller B. Metronomic chemotherapy in veterinary patients with cancer: rethinking the targets and strategies of chemotherapy. Vet Clin North Am Small Anim Pract. (2014) 44:817–29. doi: 10.1016/j.cvsm.2014.05.003 20. Vailhé B, Vittet D, Feige JJ. In vitro models of vasculogenesis and angiogenesis. Lab Investig. (2001) 81:439–52. doi: 10.1038/labinvest.3780252 21. Auguste P, Lemiere S, Larrieu-Lahargue F, Bikfalvi A. Molecular mechanisms of tumor vascularization. Crit Rev Oncol Hematol. (2005) 54:53–61. doi: 10.1016/j. critrevonc.2004.11.006 22. Muñoz R, Girotti A, Hileeto D, Arias FJ. Metronomic anti-cancer therapy: a multimodal therapy governed by the tumor microenvironment. Cancers (Basel). (2021) 13:13215414. doi: 10.3390/cancers13215414 23. Cicchelero L, Denies S, Vanderperren K, Stock E, Van Brantegem L, de Rooster H, et al. Immunological, anti-angiogenic and clinical effects of intratumoral interleukin 12 electrogene therapy combined with metronomic cyclophosphamide in dogs with spontaneous cancer: a pilot study. Cancer Lett. (2017) 400:205–18. doi: 10.1016/j. canlet.2016.09.015 24. Bergers G, Benjamin LE. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. (2003) 3:401–10. doi: 10.1038/nrc1093 25. Romiti A, Cox MC, Sarcina I, Di Rocco R, D’Antonio C, Barucca V, et al. Metronomic chemotherapy for cancer treatment: a decade of clinical studies. Cancer Chemother Pharmacol. (2013) 72:13–33. doi: 10.1007/s00280-013-2125-x 26. Kim JY, Kim YM. Tumor endothelial cells as a potential target of metronomic chemotherapy. Arch Pharm Res. (2019) 42:1–13. doi: 10.1007/s12272-018-01102-z 27. Mutsaers AJ, Biller BMolecular/Targeted Therapy of Cancer. Section C: antiangiogenic and metronomic therapy. In: DM Vail, DH Thamm and JM Liptak, editors. Withrow and MacEwen’s small animal clinical oncology. (Sixth Edition). St. ed. Louis (MO): W.B. Saunders (2019). 263–8. 28. Beck L Jr, D’Amore PA. Vascular development: cellular and molecular regulation. 29. Folkman J. Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat Med. (1995) 1:27–30. doi: 10.1038/nm0195-27 30. Cai XJ, Fei WD, Xu YY, Xu H, Yang GY, Cao JW, et al. Combination of metronomic administration and target delivery strategies to improve the anti-angiogenic and anti- tumor effects of triptolide. Drug Deliv Transl Res. (2020) 10:93–107. doi: 10.1007/ s13346-019-00665-8 31. Chesney JA, Mitchell RA, Yaddanapudi K. Myeloid-derived suppressor cells-a new therapeutic target to overcome resistance to cancer immunotherapy. J Leukoc Biol. (2017) 102:727–40. doi: 10.1189/jlb.5VMR1116-458RRR 32. Pasquier E, Kavallaris M, André N. Metronomic chemotherapy: new rationale for new directions. Nat Rev Clin Oncol. (2010) 7:455–65. doi: 10.1038/ nrclinonc.2010.82 33. Schito L, Rey S, Xu P, Man S, Cruz-Muñoz W, Kerbel RS. Metronomic chemotherapy offsets HIFα induction upon maximum-tolerated dose in metastatic cancers. EMBO Mol Med. (2020) 12:e11416. doi: 10.15252/ emmm.201911416 34. Denies S, Cicchelero L, Van Audenhove I, Sanders NN. Combination of interleukin-12 gene therapy, metronomic cyclophosphamide and DNA cancer vaccination directs all arms of the immune system towards tumor eradication. J Control Release. (2014) 187:175–82. doi: 10.1016/j.jconrel.2014.05.045 35. Malvicini M, Alaniz L, Bayo J, Garcia M, Piccioni F, Fiore E, et al. Single low-dose cyclophosphamide combined with interleukin-12 gene therapy is superior to a metronomic schedule in inducing immunity against colorectal carcinoma in mice. Onco Targets Ther. (2012) 1:1038–47. doi: 10.4161/onci.20684 36. Singh PP, Sood NK, Gupta K, Narang D. Intratumoural and peritumoural lymphangiogenesis in canine mammary tumour linked to tumour spread and poor survival. Curr Sci. (2018) 115:1312–9. doi: 10.18520/cs/v115/i7/1312-1319 37. Dieterich LC, Tacconi C, Ducoli L, Detmar M. Lymphatic vessels in cancer. Physiol Rev. (2022) 102:1837–79. doi: 10.1152/physrev.00039.2021 38. Gallimore AM, Simon AK. Positive and negative influences of regulatory T cells on tumour immunity. Oncogene. (2008) 27:5886–93. doi: 10.1038/onc.2008.269 39. Banissi C, Ghiringhelli F, Chen L, Carpentier AF. Treg depletion with a low-dose metronomic temozolomide regimen in a rat glioma model. Cancer Immunol Immunother. (2009) 58:1627–34. doi: 10.1007/s00262-009-0671-1 40. Salem ML, El-Naggar SA, Cole DJ. Cyclophosphamide induces bone marrow to yield higher numbers of precursor dendritic cells in vitro capable of functional antigen presentation to T cells in vivo. Cell Immunol. (2010) 261:134–43. doi: 10.1016/j. cellimm.2009.11.011 41. Stockler MR, Harvey VJ, Francis PA, Byrne MJ, Ackland SP, Fitzharris B, et al. Capecitabine versus classical cyclophosphamide, methotrexate, and fluorouracil as first- line chemotherapy for advanced breast cancer. J Clin Oncol. (2011) 29:4498–504. doi: 10.1200/JCO.2010.33.9101 42. Denies S, Cicchelero L, de Rooster H, Daminet S, Polis I, Van de Maele I, et al. Immunological and angiogenic markers during metronomic temozolomide and cyclophosphamide in canine cancer patients. Vet Comp Oncol. (2017) 15:594–605. doi: 10.1111/vco.12203 43. Burton JH, Mitchell L, Thamm DH, Dow SW, Biller BJ. Low-dose cyclophosphamide selectively decreases regulatory T cells and inhibits angiogenesis in dogs with soft tissue sarcoma. J Vet Intern Med. (2011) 25:920–6. doi: 10.1111/j.1939-1676.2011.0753.x 44. Mitchell L, Thamm DH, Biller BJ. Clinical and immunomodulatory effects of toceranib combined with low-dose cyclophosphamide in dogs with cancer. J Vet Intern Med. (2012) 26:355–62. doi: 10.1111/j.1939-1676.2011.00883.x 45. Gnoni A, Silvestris N, Licchetta A, Santini D, Scartozzi M, Ria R, et al. Metronomic chemotherapy from rationale to clinical studies: a dream or reality? Crit Rev Oncol Hematol. (2015) 95:46–61. doi: 10.1016/j.critrevonc.2015.01.008 46. Munzone E, Colleoni M. Clinical overview of metronomic chemotherapy in breast cancer. Nat Rev Clin Oncol. (2015) 12:631–44. doi: 10.1038/nrclinonc.2015.131 47. Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. (2001) 414:105–11. doi: 10.1038/35102167 48. Hermann PC, Huber SL, Heeschen C. Metastatic cancer stem cells: a new target for anti-cancer therapy? Cell Cycle. (2008) 7:188–93. doi: 10.4161/cc.7.2.5326 49. Vives M, Ginestà MM, Gracova K, Graupera M, Casanovas O, Capellà G, et al. Metronomic chemotherapy following the maximum tolerated dose is an effective anti- tumour therapy affecting angiogenesis, tumour dissemination and cancer stem cells. Int J Cancer. (2013) 133:2464–72. doi: 10.1002/ijc.28259 50. André N, Carré M, Pasquier E. Metronomics: towards personalized chemotherapy? 51. Natale G, Bocci G. Does metronomic chemotherapy induce tumor angiogenic dormancy? A review of available preclinical and clinical data. Cancer Lett. (2018) 432:28–37. doi: 10.1016/j.canlet.2018.06.002 52. Chen YL, Chang MC, Cheng WF. Metronomic chemotherapy and immunotherapy in cancer treatment. Cancer Lett. (2017) 400:282–92. doi: 10.1016/j.canlet.2017.01.040 53. Jordan VC. The 38th David A. Karnofsky lecture: the paradoxical actions of estrogen in breast cancer—survival or death? J Clin Oncol. (2008) 26:3073–82. doi: 10.1200/JCO.2008.17.5190 54. André N, Pasquier E. Response to ‘Intermittent androgen blockade should be regarded as standard therapy in prostate cancer’. Nat Clin Pract Oncol. (2009) 6:E1. doi: 10.1038/ncponc1317 55. Lana S, U’Ren L, Plaza S, Elmslie R, Gustafson D, Morley P, et al. Continuous low- dose oral chemotherapy for adjuvant therapy of splenic hemangiosarcoma in dogs. J Vet Intern Med. (2007) 21:764–9. doi: 10.1892/0891-6640(2007)21[764:clocfa]2.0.co;2 56. Leo C, Stell A, Borrego J, Martinez de Merlo E, Ruess-Melzer K, Lara-Garcia 57. Wendelburg KM, Price LL, Burgess KE, Lyons JA, Lew FH, Berg J. Survival time of dogs with splenic hemangiosarcoma treated by splenectomy with or without adjuvant chemotherapy: 208 cases (2001-2012). J Am Vet Med Assoc. (2015) 247:393–403. doi: 10.2460/javma.247.4.393 58. Bentley RT, Thomovsky SA, Miller MA, Knapp DW, Cohen-Gadol AA. Canine (pet dog) tumor microsurgery and intratumoral concentration and safety of metronomic chlorambucil for spontaneous glioma: a phase I clinical trial. World Neurosurg. (2018) 116:e534–42. doi: 10.1016/j.wneu.2018.05.027 59. De Campos CB, Lavalle GE, Monteiro LN, Pêgas GRA, Fialho SL, Balabram D, et al. Adjuvant thalidomide and metronomic chemotherapy for the treatment of canine malignant mammary gland neoplasms. In Vivo. (2018) 32:1659–66. doi: 10.21873/ invivo.11429 60. Alexander CK, Cronin KL, Silver M, Gardner HL, London C. The addition of metronomic chemotherapy does not improve outcome for canine splenic haemangiosarcoma. J Small Anim Pract. (2019) 60:32–7. doi: 10.1111/jsap.12926 61. Marconato L, Chalfon C, Finotello R, Polton G, Vasconi ME, Annoni M, et al. Adjuvant anthracycline-based vs metronomic chemotherapy vs no medical treatment for dogs with metastatic splenic hemangiosarcoma: a multi-institutional retrospective study of the Italian Society of Veterinary Oncology. Vet Comp Oncol. (2019) 17:537–44. doi: 10.1111/vco.12519 62. Treggiari E, Borrego JF, Gramer I, Valenti P, Harper A, Finotello R, et al. Retrospective comparison of first-line adjuvant anthracycline vs metronomic-based chemotherapy protocols in the treatment of stage I and II canine splenic haemangiosarcoma. Vet Comp Oncol. (2020) 18:43–51. doi: 10.1111/vco.12548 63. Petrucci GN, Henriques J, Lobo L, Vilhena H, Figueira AC, Canadas-Sousa A, et al. Adjuvant doxorubicin vs metronomic cyclophosphamide and meloxicam vs surgery alone for cats with mammary carcinomas: a retrospective study of 137 cases. Vet Comp Oncol. (2021) 19:714–23. doi: 10.1111/vco.12660 64. Machado MC, Yamamoto PA, Pippa LF, de Moraes NV, Neves FMF, Portela RD, et al. Pharmacokinetics of carboplatin in combination with low-dose cyclophosphamide in female dogs with mammary carcinoma. Animals (Basel). (2022) 12:3109. doi: 10.3390/ ani12223109 65. Alonso-Miguel D, Valdivia G, García-San José P, Alonso-Diez Á, Clares I, Portero M, et al. Clinical outcome of dogs diagnosed with canine inflammatory mammary cancer treated with metronomic cyclophosphamide, a cyclooxygenase-2 inhibitor and toceranib phosphate. Vet Comp Oncol. (2022) 20:179–88. doi: 10.1111/vco.12760 66. Garcia JS, Nowosh V, López RVM, Massoco CO. Association of systemic inflammatory and immune indices with survival in canine patients with oral melanoma, treated with experimental immunotherapy alone or experimental immunotherapy plus metronomic chemotherapy. Front Vet Sci. (2022) 9:9. doi: 10.3389/fvets.2022.888411 67. Cancedda S, Marconato L, Meier V, Laganga P, Roos M, Leone VF, et al. Hypofractionated radiotherapy for macroscopic canine soft tissue sarcoma: a retrospective study of 50 cases treated with a 5×6 gy protocol with or without metronomic chemotherapy. Vet Radiol Ultrasound. (2016) 57:75–83. doi: 10.1111/ vru.12308 68. Duffy ME, Anderson CL, Choy K, Fidel JL. Metronomic administration of lomustine following palliative radiation therapy for appendicular osteosarcoma in dogs. Can Vet J. (2018) 59:136–42. 69. Polton G, Finotello R, Sabattini S, Rossi F, Laganga P, Vasconi ME, et al. Survival analysis of dogs with advanced primary lung carcinoma treated by metronomic cyclophosphamide, piroxicam and thalidomide. Vet Comp Oncol. (2018) 16:399–408. doi: 10.1111/vco.12393 70. Milevoj N, Nemec A, Tozon N. Metronomic chemotherapy for palliative treatment of malignant oral tumors in dogs. Front Vet Sci. (2022) 9:856399. doi: 10.3389/ fvets.2022.856399 71. Bracha S, Walshaw R, Danton T, Holland S, Ruaux C, Obradovich J. Evaluation of toxicities from combined metronomic and maximal-tolerated dose chemotherapy in dogs with osteosarcoma. J Small Anim Pract. (2014) 55:369–74. doi: 10.1111/jsap.12228 72. Rasmussen RM, Kurzman ID, Biller BJ, Guth A, Vail DM. Phase I lead-in and subsequent randomized trial assessing safety and modulation of regulatory T cell numbers following a maximally tolerated dose doxorubicin and metronomic dose cyclophosphamide combination chemotherapy protocol in tumour-bearing dogs. Vet Comp Oncol. (2017) 15:421–30. doi: 10.1111/vco.12179 73. Finotello R, Henriques J, Sabattini S, Stefanello D, Felisberto R, Pizzoni S, et al. A retrospective analysis of chemotherapy switch suggests improved outcome in surgically removed, biologically aggressive canine haemangiosarcoma. Vet Comp Oncol. (2017) 15:493–503. doi: 10.1111/vco.12193 74. Matsuyama A, Poirier VJ, Mantovani F, Foster RA, Mutsaers AJ. Adjuvant doxorubicin with or without metronomic cyclophosphamide for canine splenic hemangiosarcoma. J Am Anim Hosp Assoc. (2017) 53:304–12. doi: 10.5326/JAAHA- MS-6540 75. Matsuyama A, Woods JP, Mutsaers AJ. Evaluation of toxicity of a chronic alternate day metronomic cyclophosphamide chemotherapy protocol in dogs with naturally occurring cancer. Can Vet J. (2017) 58:51–5. 76. Matsuyama A, Schott CR, Wood GA, Richardson D, Woods JP, Mutsaers AJ. Evaluation of metronomic cyclophosphamide chemotherapy as maintenance treatment for dogs with appendicular osteosarcoma following limb amputation and carboplatin chemotherapy. J Am Vet Med Assoc. (2018) 252:1377–83. doi: 10.2460/javma.252.11.1377 77. Elmslie RE, Glawe P, Dow SW. Metronomic therapy with cyclophosphamide and piroxicam effectively delays tumor recurrence in dogs with incompletely resected soft tissue sarcomas. J Vet Intern Med. (2008) 22:1373–9. doi: 10.1111/j.1939-1676.2008.0179.x 78. Marchetti V, Giorgi M, Fioravanti A, Finotello R, Citi S, Canu B, et al. First-line metronomic chemotherapy in a metastatic model of spontaneous canine tumours: a pilot study. Investig New Drugs. (2012) 30:1725–30. doi: 10.1007/s10637-011-9672-y 79. Spugnini EP, Buglioni S, Carocci F, Francesco M, Vincenzi B, Fanciulli M, et al. High dose lansoprazole combined with metronomic chemotherapy: a phase I/II study in companion animals with spontaneously occurring tumors. J Transl Med. (2014) 12:225. doi: 10.1186/s12967-014-0225-y 80. London CA, Gardner HL, Mathie T, Stingle N, Portela R, Pennell ML, et al. Impact of toceranib/piroxicam/cyclophosphamide maintenance therapy on outcome of dogs with appendicular osteosarcoma following amputation and carboplatin chemotherapy: a multi-institutional study. PLoS One. (2015) 10:e0124889. doi: 10.1371/journal. pone.0124889 81. Marconato L, Sabattini S, Marisi G, Rossi F, Leone VF, Casadei-Gardini A. Sorafenib for the treatment of unresectable hepatocellular carcinoma: preliminary toxicity and activity data in dogs. Cancers (Basel). (2020) 12:1272. doi: 10.3390/ cancers12051272 82. Petrucci G, Henriques J, Gregório H, Vicente G, Prada J, Pires I, et al. Metastatic feline mammary cancer: prognostic factors, outcome and comparison of different treatment modalities—a retrospective multicentre study. J Feline Med Surg. (2021) 23:549–56. doi: 10.1177/1098612X20964416 83. Leach TN, Childress MO, Greene SN, Mohamed AS, Moore GE, Schrempp DR, et al. Prospective trial of metronomic chlorambucil chemotherapy in dogs with naturally occurring cancer. Vet Comp Oncol. (2012) 10:102–12. doi: 10.1111/j.1476-5829.2011.00280.x 84. Schrempp DR, Childress MO, Stewart JC, Leach TN, Tan KM, Abbo AH, et al. Metronomic administration of chlorambucil for treatment of dogs with urinary bladder transitional cell carcinoma. J Am Vet Med Assoc. (2013) 242:1534–8. doi: 10.2460/ javma.242.11.1534 85. Gedon J, Kehl A, Aupperle-Lellbach H, von Bomhard W, Schmidt JM. BRAF mutation status and its prognostic significance in 79 canine urothelial carcinomas: a retrospective study (2006-2019). Vet Comp Oncol. (2022) 20:449–57. doi: 10.1111/ vco.12790 86. Tripp CD, Fidel J, Anderson CL, Patrick M, Pratt C, Sellon R, et al. Tolerability of metronomic administration of lomustine in dogs with cancer. J Vet Intern Med. (2011) 25:278–84. doi: 10.1111/j.1939-1676.2011.0684.x 87. Ong SM, Saeki K, Tanaka Y, Nishimura R, Nakagawa T. Effects of etoposide alone and in combination with piroxicam on canine osteosarcoma cell lines. Vet J. (2016) 218:51–9. doi: 10.1016/j.tvjl.2016.11.007 88. Custead MR, Weng HY, Childress MO. Retrospective comparison of three doses of metronomic chlorambucil for tolerability and efficacy in dogs with spontaneous cancer. Vet Comp Oncol. (2017) 15:808–19. doi: 10.1111/vco.12222 89. Penel N, Adenis A, Bocci G. Cyclophosphamide-based metronomic chemotherapy: after 10 years of experience, where do we stand and where are we going? Crit Rev Oncol Hematol. (2012) 82:40–50. doi: 10.1016/j.critrevonc.2011.04.009 90. Chan CM, Frimberger AE, Moore AS. Incidence of sterile hemorrhagic cystitis in tumor-bearing dogs concurrently treated with oral metronomic cyclophosphamide chemotherapy and furosemide: 55 cases (2009-2015). J Am Vet Med Assoc. (2016) 249:1408–14. doi: 10.2460/javma.249.12.1408 91. Gregório H, Magalhães TR, Pires I, Prada J, Carvalho MI, Queiroga FL. The role of COX expression in the prognostication of overall survival of canine and feline cancer: a systematic review. Vet Med Sci. (2021) 7:1107–19. doi: 10.1002/vms3.460 92. Khan SA, McLean MK. Toxicology of frequently encountered nonsteroidal anti- inflammatory drugs in dogs and cats. Vet Clin North Am Small Anim Pract. (2012) 42:289–306, vi-vii. doi: 10.1016/j.cvsm.2012.01.003 93. Zhang ZL, Liu ZS, Sun Q. Effects of thalidomide on angiogenesis and tumor growth and metastasis of human hepatocellular carcinoma in nude mice. World J Gastroenterol. (2005) 11:216–20. doi: 10.3748/wjg.v11.i2.216 94. Matsuyama F, Fujita Y, Fukazawa E, Kobayashi T. Safety and pharmacokinetics of thalidomide in tumor-bearing dogs. J Vet Med Sci. (2023) 85:1261–8. doi: 10.1292/ jvms.23-0200 95. Pierini A, Sartini I, Giorgi M, Łebkowska-Wieruszewska B, Lisowski A, Poapolathep A, et al. Pharmacokinetics of thalidomide in dogs: can feeding affect it? A preliminary study. J Vet Sci. (2020) 21:e60. doi: 10.4142/jvs.2020.21.e60 96. Vargesson N, Stephens T. Thalidomide: history, withdrawal, renaissance, and safety concerns. Expert Opin Drug Saf. (2021) 20:1455–7. doi: 10.1080/14740338.2021.1991307 97. Ghasemi K, Ghasemi K. A brief look at antitumor effects of doxycycline in the treatment of colorectal cancer and combination therapies. Eur J Pharmacol. (2022) 916:174593. doi: 10.1016/j.ejphar.2021.174593 98. Hadjimichael AC, Foukas AF, Savvidou OD, Mavrogenis AF, Psyrri AK, Papagelopoulos PJ. The anti-neoplastic effect of doxycycline in osteosarcoma as a metalloproteinase (MMP) inhibitor: a systematic review. Clin Sarcoma Res. (2020) 10:7. doi: 10.1186/s13569-020-00128-6 99. LeBlanc AK, Atherton M, Bentley RT, Boudreau CE, Burton JH, Curran KM, et al. Veterinary cooperative oncology group-common terminology criteria for adverse events (VCOG-CTCAE v2) following investigational therapy in dogs and cats. Vet Comp Oncol. (2021) 19:311–52. doi: 10.1111/vco.12677 100. Eichstadt LR, Moore GE, Childress MO. Risk factors for treatment-related adverse events in cancer-bearing dogs receiving piroxicam. Vet Comp Oncol. (2017) 15:1346–53. doi: 10.1111/vco.12276 101. Bulman-Fleming JC, Turner TR, Rosenberg MP. Evaluation of adverse events in cats receiving long-term piroxicam therapy for various neoplasms. J Feline Med Surg. (2010) 12:262–8. doi: 10.1016/j.jfms.2009.09.007 102. Setyo L, Ma M, Bunn T, Wyatt K, Wang P. Furosemide for prevention of cyclophosphamide-associated sterile haemorrhagic cystitis in dogs receiving metronomic low-dose oral cyclophosphamide. Vet Comp Oncol. (2017) 15:1468–78. doi: 10.1111/vco.12292 103. Zhang W, Gou P, Dupret JM, Chomienne C, Rodrigues-Lima F. Etoposide, an anticancer drug involved in therapy-related secondary leukemia: enzymes at play. Transl Oncol. (2021) 14:101169. doi: 10.1016/j.tranon.2021.101169 104. Prommer EE. Review article: palliative oncology: thalidomide. Am J Hosp Palliat Med. (2010) 27:198–204. doi: 10.1177/1049909109348981 105. Smith AN, Klahn S, Phillips B, Parshley L, Bennett P, Flory A, et al. ACVIM small animal consensus statement on safe use of cytotoxic chemotherapeutics in veterinary practice. J Vet Intern Med. (2018) 32:904–13. doi: 10.1111/jvim.15077 106. IARC Monographs on the identification of carcinogenic hazards to humans [internet]. International Agency for Research on Cancer. [cited 26/04/2024]. Available at: https://monographs.iarc.who.int/. 107. Biller B, Berg J, Garrett L, Ruslander D, Wearing R, Abbott B, et al. 2016 AAHA oncology guidelines for dogs and cats. J Am Anim Hosp Assoc. (2016) 52:181–204. doi: 10.5326/JAAHA-MS-6570 108. Laganga P, Marconato L, Cancedda S, Leone VF, Rohrer-Bley C, Rossi F. Radiation therapy for the treatment of canine progressive cutaneous angiomatosis: description of 2 cases. Can Vet J. (2018) 59:1067–70. 109. Binanti D, De Zani D, Fantinato E, Allevi G, Sironi G, Zani DD. Intradural- extramedullary haemangioblastoma with paraspinal extension in a dog. Aust Vet J. (2015) 93:460–5. doi: 10.1111/avj.12376 110. Togni A, Rütten M, Bley CR, Hurter K. Metastasized Leydig cell tumor in a dog. 111. Weishaar KM, Edmondson EF, Thamm DH, Olver CS. Malignant mesenchymoma with widespread metastasis including bone marrow involvement in a dog. Vet Clin Pathol. (2014) 43:447–52. doi: 10.1111/vcp.12180 112. Jung MJ, Yoon KY, Kim YM, Lee JS, Choi JW, Kim JH, et al. Long-term adjuvant metronomic chemotherapy in a dog with recurrent maxillofacial osteosarcoma. Vet Med (Praha). (2023) 68:225–30. doi: 10.17221/43/2022-VETMED 113. Wada A, Nagata K. Huge myxosarcoma arising from the greater omentum in a dog. J Vet Med Sci. (2021) 83:461–8. doi: 10.1292/jvms.20-0509 114. Trovatelli M, Bassi J, Giudice C, Ferrari R, Longo M, Brizzola S. Prostatic leiomyosarcoma in a dog treated using a multimodal approach. J Vet Intern Med. (2021) 35:1105–10. doi: 10.1111/jvim.16081 115. Treggiari E, Pellin MA, Romanelli G, Maresca G, Gramer I, Yale AD, et al. Tonsillar carcinoma in dogs: treatment outcome and potential prognostic factors in 123 cases. J Vet Intern Med. (2023) 37:247–57. doi: 10.1111/jvim.16623 116. Yee-Ka Cheng K, Krockenberger M, Bennett P. Use of metronomic chemotherapy in the management of a cat with abdominal haemangiosarcoma. JFMS Open Rep. (2018) 4:2055116918793455. doi: 10.1177/2055116918793455 117. McNally A, Rossanese M, Suárez-Bonnet A, Hardas A, Yale AD. Urinary bladder hemangiosarcoma in a cat treated with partial cystectomy and adjuvant metronomic cyclophosphamide and thalidomide. J Vet Intern Med. (2023) 37:1488–92. doi: 10.1111/ jvim.16750 118. Griffin MA, Culp WTN, Rebhun RB. Canine and feline haemangiosarcoma. Vet Rec. (2021) 189:e585. doi: 10.1002/vetr.585 119. de Nardi AB, de Oliveira Massoco Salles Gomes C, Fonseca-Alves CE, de Paiva FN, Linhares LCM, Carra GJU, et al. Diagnosis, prognosis, and treatment of canine hemangiosarcoma: a review based on a consensus organized by the Brazilian Association of Veterinary Oncology, ABROVET. Cancers (Basel). (2023) 15:15072025. doi: 10.3390/ cancers15072025 120. Nosalova N, Huniadi M, Horňáková Ľ, Valenčáková A, Horňák S, Nagoos K, et al. Canine mammary tumors: classification, biomarkers, traditional and personalized therapies. Int J Mol Sci. (2024) 25:2891. doi: 10.3390/ ijms25052891 121. Raposo TP, Arias-Pulido H, Chaher N, Fiering SN, Argyle DJ, Prada J, et al. Comparative aspects of canine and human inflammatory breast cancer. Semin Oncol. (2017) 44:288–300. doi: 10.1053/j.seminoncol.2017.10.012 122. Clemente M, Sánchez-Archidona AR, Sardón D, Díez L, Martín-Ruiz A, Caceres S, et al. Different role of COX-2 and angiogenesis in canine inflammatory and non- inflammatory mammary cancer. Vet J. (2013) 197:427–32. doi: 10.1016/j.tvjl.2013.02.009 123. Marconato L, Romanelli G, Stefanello D, Giacoboni C, Bonfanti U, Bettini G, et al. Prognostic factors for dogs with mammary inflammatory carcinoma: 43 cases (2003-2008). J Am Vet Med Assoc. (2009) 235:967–72. doi: 10.2460/javma.235.8.967 124. Itoh H, Naruse R, Tani K, Sunahara H, Nemoto Y, Nakaichi M, et al. Establishment of a new canine inflammatory mammary carcinoma cell line and analysis of its Cystine-glutamate transporter subunit expression. J Vet Res. (2022) 66:273–9. doi: 10.2478/jvetres-2022-0023 125. Hohenhaus AE, Kelsey JL, Haddad J, Barber L, Palmisano M, Farrelly J, et al. Canine cutaneous and subcutaneous soft tissue sarcoma: an evidence-based review of case management. J Am Anim Hosp Assoc. (2016) 52:77–89. doi: 10.5326/JAAHA-MS-6305 126. Cannon CM, Allstadt SD. Lower urinary tract cancer. Vet Clin North Am Small Anim Pract. (2015) 45:807–24. doi: 10.1016/j.cvsm.2015.02.008 127. Ichimata M, Kagawa Y, Namiki K, Toshima A, Nakano Y, Matsuyama F, et al. Prognosis of primary pulmonary adenocarcinoma after surgical resection in small-breed dogs: 52 cases (2005-2021). J Vet Intern Med. (2023) 37:1466–74. doi: 10.1111/jvim.16739 128. Wouda RM, Miller ME, Chon E, Stein TJ. Clinical effects of vinorelbine administration in the management of various malignant tumor types in dogs: 58 cases (1997-2012). J Am Vet Med Assoc. (2015) 246:1230–7. doi: 10.2460/javma.246.11.1230 129. Magalhães TR, Queiroga FL. Chapter 1. Canine primary intracranial tumors: a review. In: OP Jenkins, editor. Advances in animal science and zoology. 21. New York: Nova Science Publishers (2023). 1–31. 130. Moirano SJ, Dewey CW, Wright KZ, Cohen PW. Survival times in dogs with presumptive intracranial gliomas treated with oral lomustine: a comparative retrospective study (2008-2017). Vet Comp Oncol. (2018) 16:459–66. doi: 10.1111/vco.12401 131. Van Meervenne S, Verhoeven PS, de Vos J, Gielen IM, Polis I, Van Ham LM. Comparison between symptomatic treatment and lomustine supplementation in 71 dogs with intracranial, space-occupying lesions. Vet Comp Oncol. (2014) 12:67–77. doi: 10.1111/j.1476-5829.2012.00336.x 132. Novosad CA, Bergman PJ, O’Brien MG, McKnight JA, Charney SC, Selting KA, et al. Retrospective evaluation of adjunctive doxorubicin for the treatment of feline mammary gland adenocarcinoma: 67 cases. J Am Anim Hosp Assoc. (2006) 42:110–20. doi: 10.5326/0420110 133. Borrego JF, Cartagena JC, Engel J. Treatment of feline mammary tumours using chemotherapy, surgery and a COX-2 inhibitor drug (meloxicam): a retrospective study of 23 cases (2002-2007)*. Vet Comp Oncol. (2009) 7:213–21. doi: 10.1111/j.1476-5829.2009.00194.x 134. De Campos CB, Nunes FC, Lavalle GE, Cassali GD. Use of surgery and carboplatin in feline malignant mammary gland neoplasms with advanced clinical staging. In Vivo. (2014) 28:863–6. 135. Cunha SC, Corgozinho KB, Souza HJ, Silva KV, Ferreira AM. Adjuvant chemotherapy with mitoxantrone for cats with mammary carcinomas treated with radical mastectomy. J Feline Med Surg. (2015) 17:1000–4. doi: 10.1177/1098612X14567159 136. Haibe Y, Kreidieh M, El Hajj H, Khalifeh I, Mukherji D, Temraz S, et al. Resistance mechanisms to anti-angiogenic therapies in Cancer. Front Oncol. (2020) 10:221. doi: 10.3389/fonc.2020.00221 137. Ebos JM, Lee CR, Kerbel RS. Tumor and host-mediated pathways of resistance and disease progression in response to antiangiogenic therapy. Clin Cancer Res. (2009) 15:5020–5. doi: 10.1158/1078-0432.CCR-09-0095 138. Taylor S, Caney S, Bessant C, Gunn-Moore D. Online survey of owners’ experiences of medicating their cats at home. J Feline Med Surg. (2022) 24:1283–93. doi: 10.1177/1098612X221083752 |