Özet: Mantle hücreli lenfoma (MCL), tipik olarak agresif seyreden ve nüksetme eğilimi gösteren nadir bir non-Hodgkin lenfoma alt tipidir. B-hücre reseptörü (BCR) sinyal sağkalım yolağı MCL’de kronik şekilde aktive olarak patogenezine katkıda bulunur. İbrutinib, bu yolağın önemli bir bileşeni olan Bruton tirozin kinazın bir inhibitörüdür. Bu makale, tamamlanmış ve yayınlanmış klinik çalışmalar dahil olmak üzere MCL hastalarının tedavisinde ibrutinib ile ilgili mevcut klinik deneyimleri ayrıntılarıyla ele almakta ve ibrutinib tedavisi ile ilişkili potansiyel yan etkileri (AE’ler) ve tehlikeleri incelemektedir. İbrutinib ile tedavi edilen hastaların yaşadığı AE’lerin çoğu hafif olmasına rağmen, bazıları ciddi ve tedaviyi sınırlayıcı olabilir ve hedef dışı etkilerden kaynaklanabilir. İbrutinib, kayda değer yanıt oranları ile MCL hastaları için son derece umut verici bir ilaçtır. Bununla birlikte, tek bir ajan olarak kullanıldığında, hastaların yaklaşık üçte biri tedavinin ilk 2 yılında nüks etmektedir. Yakın zamanda rapor edilen kombinasyon tedavileri kayda değer etki göstermiştir. İlaç direncinin potansiyel mekanizmalarını ve tedavinin başarısız olmasından sonraki kötü klinik sonuçları değerlendiren yeni veriler de tartışılmaktadır.
Direncin ve etkilerinin yalnızca nükseden hastalıkta değil, ilk aşamada da daha iyi anlaşılması gerekmektedir. Direncin üstesinden gelmeye yönelik stratejilerin araştırılmasına hâlâ klinik anlamda büyük ihtiyaç duyulmaktadır.
Anahtar Kelimeler: yan etkiler, ibrutinib, mantle hücreli lenfoma, direnç
Ther Adv Hematol
2015, Vol. 6(5) 242–252
DOI: 10.1177/ 2040620715592569
© Yazar(lar), 2015. Yeniden basım ve izinler: http://www.sagepub.co.uk/ journalsPermissions.nav
Giriş
Mantle hücreli lenfoma (MCL), siklin D1 aşırı ekspresyonu veya t(11;14) ile tanımlanan non- Hodgkin (NHL) B hücreli lenfomanın nadir görülen bir alt tipidir. MCL’nin genellikle klinik seyri agresiftir ve prognozu genel olarak kötüdür. Genç, fit hastalar tipik olarak kemoimmünoterapi ve ardından otolog kök hücre nakli (SCT) ile tedavi edilir [Geisler ve ark. 2008; Romaguera ve ark. 2010; Merli ve ark. 2012; Le Gouill ve ark. 2014]. Bununlabirlikte, MCL tanısı konan hastaların ortalama yaşı 68’dir [Zhou et al. 2008] ve bu grupta tıbbi komorbiditeler tedavi sırasında sıklıkla ortaya çıkmaktadır. Bu nedenle, bendamustin ve rituksimab (BR) [Rummel ve ark. 2013; Flinn ve ark. 2014] veya rituksimab idameli rituksi mab, siklofosfamid, doksorubisin, vinkristin ve prednizon (RCHOP) [Kluin-Nelemans ve ark. 2012] gibi alternatif ve daha tolere edilebilirkemoimmünoterapötik rejimler bu popülasyonda
242
ön basamak tedavi için yaygın olarak kullanılmaktadır. Başlangıç tedavisi ile yüksek genel yanıt oranlarına (ORR’ler) rağmen, çoğu hasta sonunda nüksedecek ve hastalıklarından ölecektir. Son on yılda, klinik sonuçlar iyileşmiş gibi görünmektedir ve çalışmalar belirli kohortlar arasında genel sağkalımın (OS) iyileştiğini göstermektedir [Herrmann et al. 2009; Chandran et al. 2012]. Bununla birlikte, agresif ön tedavi stratejilerinin dahil edilmesine ve yeni ajanların kullanılmasına rağmen, sağkalım eğrilerinde hiçbir duraklama görülmemekte ve 5 yıllık remisyondan sonra bile geç nüksler görülebilmektedir [Romaguera ve ark. 2010; Geisler ve ark. 2012; Robak ve ark. 2015]. MCL hastaları için yeni ve daha etkili terapötik yöntemlere ihtiyaç olduğu açıktır.
B-hücresi reseptörü (BCR) yolağı üzerinden kronik aktif sinyalizasyon, MCL de dahil olmak üzere B-hücresi malignitelerinin birçok alt
İletişim:
Deborah M. Stephens, DO Hematoloji Bölümü, İç Hastalıkları Bölümü, Huntsman Kanser Enstitüsü,Utah Üniversitesi, 2000 Circle of Hope, Room 4246, Salt Lake City, UT 84112,ABDdeborah.stephens@hci. utah.edu
Stephen E. Spurgeon, MD
Hematoloji ve Tıbbi Onkoloji Bölümü, İç Hastalıkları Bölümü, Oregon Sağlık Bilimleri Üniversitesi Knight Kanser Enstitüsü, Portland, OR, ABD
tipinin patogenezinde rol oynamıştır. BCR yolağındaki integral bir protein olan Bruton tirozin kinazın (BTK) aşırı ekspresyonu MCL hücre hatlarında ve hasta örneklerinde görülmüştür [Rinaldi et al. 2006; Cinar et al. 2013]. BTK ve alt hedeflerinin aktivasyonu, nükleer transkripsiyonun modülasyonunun yanı sıra B hücresi proliferasyonu, farklılaşması, hayatta kalması ve migrasyonunun düzenlenmesi de dahil olmak üzere normal ve malign B hücrelerinde hayati bir rol oynar [Herrera ve Jacobsen, 2014]. MCL’de, hücre hatlarının fosfoproteomik analizi, bu malignitede BCR sinyalizasyonunun prosurvival rolüne işaret etmektedir [Pighi et al. 2011]. BCR sinyal yolağı proteinlerinin B-hücreli malignite patogenezindeki
önemi, bu seçenekleri artırmıştır. proteinlerin inhibitörlerinin tedavi ilgiyi olarak kullanılmasına olan İbrutinib, BTK aktif bölgesindeki bir sistein kalıntısına (C481) geri dönüşümsüz olarak bağlanan BTK’nın güçlü, oral olarak biyoyararlanabilen bir inhibitörüdür. MCL hücre hatlarında yapılan preklinik çalışmalarda ibrutinib’in, downstream BCR sinyalizasyonunu ve hücre apoptozunu inhibe ettiği görülmüştür [Cinar et al. 2013]. Preklinik hayvan çalışmalarında, spontan köpek B hücreli lenfoması olan sekiz köpek ibrutinib ile güvenli bir şekilde tedavi edilmiştir. Günde 2,5-20mg/kg’lık tek uygulama, 24 saat boyunca periferik kanda ve tümör dokusunda BTK’yı tamamen kontrol altına almak için yeterliydi. Üç köpek kısmi yanıt (PR) elde etti ve üç köpekte stabil hastalık (SD) devam etti [Honigberg et al. 2010]. Preklinik güvenlik verilerinin tamamlanmasıyla, ibrutinib insanlarda klinik denemelere geçti. Bu makalenin amacı, MCL’li hastalarda ibrutinib kullanılan klinik uygulamaları tartışmak ve hedefe yönelik ajanlar çağında potansiyel düşüşleri, terapötik zorlukları ve fırsatları tespit etmektir. Klinik etkinliği göz önüne alındığında, ibrutinib şu anda ABD Gıda ve İlaç Dairesi (FDA) tarafından nükseden/refrakter MCL, kronik lenfositik lösemi (KLL) ve Waldenstrom makroglobulinemi (WM) için ve del(17p13.1) karyotipli KLL ve WM hastalarında ön basamak olarak onaylanmıştır.
Bu çalışmada yer alan dokuz MCL hastasından yedisinde tedaviye yanıt alınmıştır (üçü CR). Çoğu yan etki (AE) grade 1-2 olup en sık görülen AE’ler diyare, bulantı, halsizlik ve miyaljidir. Grade 3-4 AE’ler nadirdi ve en yaygın olanı sitopeniydi (<%15). Günlük 560 mg ağızdan alınan doz iyi tolere edilmiş ve çeşitli bireysel vücut ağırlıklarında hedefi tam olarak yakalamıştır ve bu nedenle faz II çalışması için seçilmiştir [Advani et al. 2013].
R/R MCL’de ibrutinibin FDA onayını almasını sağlayan çok önemli faz II çalışmasında, MCL’li 111 hasta tek ajan ibrutinib (günde 560 mg) almıştır. Çalışmadaki hastaların ortalama yaşı 68’dir (aralık 40-84) ve bu nedenle tipik MCL hasta popülasyonunu temsil etmektedir. ORR %68 ve CR oranı %21 idi. Yine en sık görülen grade 1- 2 AE’ler diyare, bulantı ve halsizlik olmuştur. Grade 3-4 sitopeniler %20’den azdı (en sık nötropeni). İlk 15,3 aylık takipten sonra, tahmini ortalama progresyonsuz sağkalım (PFS) 13,9 ay [%95 güven aralığı (CI) 7,0-ulaşılamadı] ve tahmini OS’ye ulaşılamamıştır [Wang et al. 2013]. Bununla birlikte, 26,7 aylık genişletilmiş ortalama takip süresiyle, tahmini ortalama PFS 13 ay olmuş ve hastaların yaklaşık üçte biri 2 yılda tedaviye yanıt vermemiştir ve ortalama OS 22,5 ay olmuştur [Wang ve ark. 2014b].
İbrutinibin MCL’de FDA onayı almasından önce, R/R MCL’li 149 hasta tek ajan ibrutinib kullanılarak açık etiketli erken erişimli bir tedavi protokolüne kaydedilmiştir. Bu çalışmadaki hastaların ortalama yaşı da 68 idi (aralık 39-90). Bu hastaların %58,5’inde refrakter hastalık vardı ve %66,7’si daha önce en az üç sıra tedavi almıştı. Hastaların %39,6’sında en sık sitopeni (<%10) olmak üzere Grade 3-4 AE’ler gözlenmiştir. Özellikle ilgi çeken AE’ler bir hastada majör kanama ve bir hastada intrakraniyal kanama olmuştur. Uzun vadeli takip henüz rapor edilmemiştir; ancak çalışmadaki hastaların üçte ikisi çalışma tamamlandığında hala ibrutinib almaktaydı (ABD FDA onayı) [Martin et al. 2014a].
MCL hastalarında ibrutinib kombinasyon
tedavisi
MCL’li hastaların tedavisinde tek ajan olarak ibrutinibin umut verici etkinliğini geliştirmek
için, birçok araştırmacı bu ajanı diğer tedavilerle birleştirmeye çalışmıştır (Tablo 1). Rituximab, CD20’yi hedef alan monoklonal bir antikordur ve CD-20-pozitif B-hücreli malignitelerde yaygın olarak kullanılmaktadır. Rituximab, MCL dahil olmak üzere çeşitli B-hücreli maligniteleri olan hastalarda ibrutinib ile kombinasyon halinde çalışılmıştır. Klinik öncesi çalışmalarda, ibrutinibin hedef dışı etkilerinin kombinasyon halinde kullanıldığında rituximabın etkinliğini sınırlayabileceğine dair endişeler ortaya çıkmıştır. Özellikle, KLL’deki klinik öncesi çalışmalar ibrutinibin CD20’nin KLL hücre yüzeyi ekspresyonunu azaltabileceğini [Bojarczuk et al. 2014] ve doğal öldürücü (NK) hücrelerde interlökin-2 ile indüklenebilir kinazın (ITK) hedef dışı inhibisyonu yoluyla monoklonal antikorların antikora bağlı hücre aracılı sitotoksisitesini azaltabileceğini veya ortadan kaldırabileceğini [Kohrt et al. 2014] göstermektedir [Dubovsky et al. 2013]. Bu endişelere rağmen, kombinasyonla yapılan klinik çalışmalar ilerlemiştir. Bir faz II çalışmasında, R/R MCL’li 50 hasta rituksimab (375 mg/m2 intravenöz olarak haftalık × 4, daha sonra 2 yıla kadar aylık) ve ibrutinib (günde 560 mg oral) ile tedavi edilmiştir. Ortalama 6,5 aylık (dağılım: 1-10) takip süresi ile ORR %87 ve CR oranı %38 olmuştur. SD veya progresif hastalığı olan tüm hastaların proliferasyon indeksi (Ki67) en az %50 idi. Ki67 değeri %50’nin altında olan 33 hastada ORR %100 ve CR oranı %48 olmuştur. Bu veriler, bu rejimin genellikle yüksek Ki67 ile ilişkili olan blastoid varyantı olmayan hastalarda daha etkili olabileceğini düşündürmektedir. Ancak, %50’lik bir Ki67 sınırının MCL standartlarına göre yüksek olduğu ve nispeten küçük bir veri seti kullanarak sonuçları sınıflandırmaya çalışıldığı göz önünde bulundurulduğunda, bu bulgunun klinik ve biyolojik ilişkisi dikkatle yorumlanmalıdır. Grade 3 AE’ler nötropeni (1) ve trombositopenidir (1). Özellikle altı hastada atriyal fibrilasyon (afib) gelişmiştir [Wang et al. 2014a]. Devam eden benzer bir faz II çalışmasında ibrutinib, R/R MCL ve KLL hastalarında yeni bir glikomühendislik ürünü anti-CD20 monoklonal antikor olan ublituximab ile eşleştirilmiştir [ClinicalTrials.gov identifier: NCT02013128]. Erken analizler bu kombinasyonun MCL hastalarında etkili olduğunu ve iyi tolere edildiğini göstermektedir [Sharman et al. 2014].
Sitotoksik kemoterapi artı rituximab ve ibrutinib kullanan kemoimmünoterapi rejimleri de aktif bir çalışma alanıdır. Bendamustin, MCL’de etkinliği olan ve genellikle rituksimab ile birlikte kullanılan, %90’dan fazla ORR gösteren alkilleyici bir ajandır [Flinn et al. 2014]. Faz I/Ib çalışması, NHL’li 48 hastada bendamustin (altı kür boyunca 1. ve 2. günlerde 90 mg/m2) ve rituximab (altı kür boyunca 1. günde 375 mg/m2) ile ibrutinibin (süresiz olarak günde 280 veya 560 mg) güvenliliğini değerlendirmiştir. Bu hastaların 17’sinde MCL vardı (daha önce tedavi edilmemiş = 5). Doz sınırlayıcı toksisite (DLT) gözlenmemiştir. En yaygın grade 3/4 AE’ler sitopeni ve ciltte görülen kızarıklıktı. MCL’li hastalar arasında ORR %94 ve CR oranı %76 olmuştur [Maddocks et al. 2015]. Yakın zamanda hasta kabulüne kapatılan ve devam etmekte olan randomize uluslararası bir çalışma, yeni tanı konmuş MCL’li 65 yaş üstü hastalarda bu kombinasyonu (ardından 2 yıllık idame rituksimab) araştırmaktadır (SHINE çalışması) [ClinicalTrials.gov kodu: NCT01776840]. Benzer şekilde, RCHOP kemoterapisi MCL’yi tedavi etmek için uzun süredir önemli bir verimlilikle kullanılmaktadır [Flinn et al. 2014]. Bir başka faz Ib çalışmasında, MCL’li beş hasta da dahil olmak üzere tedaviye naif NHL’li 33 hastada RCHOP ile ibrutinib güvenli bir şekilde birleştirilmeye çalışılmıştır. Tüm hastalar arasında en sık görülen Grade 3 AE’ler sitopeni olmuştur. Grup bir bütün olarak %72 CR oranı ile %94 ORR göstermiştir. MCL’li hastalar için spesifik yanıt verileri dahil edilmemiştir [Younes et al. 2014]. Daha önce tedavi edilmiş indolent MCL hastaları için randomize bir faz III çalışması olmadığından, ibrutinibin BR veya RCHOP ile kombinasyonunun avantaj sağlayıp sağlamadığı belirsizdir. İbrutinibin agresif indüksiyon yöntemlerine sağladığı katkıyı belirlemek amacıyla Avrupa MCL Ağı, MCL hastalarını üç gruptan birine randomize eden Triangle Çalışması’na sponsorluk yapmaktadır: Bunlar; rituksimab, deksametazon, sitarabin ve sisplatin (RDHAP) ile dönüşümlü RCHOP ve ardından otolog SCT; ibrutinib ile dönüşümlü RCHOP/RDHAP ve ardından ibrutinib idamesi ile otolog SCT; ve ibrutinib ile dönüşümlü RCHOP/RDHAP ve ardından ibrutinib idamesi. BR ve RCHOP tabanlı rejimler dahil olmak üzere çeşitli indüksiyon tedavilerini takiben MCL hastaları için idame tedavisi olarak ibrutinib kullanan bir başka çalışma daha kabul için açıktır [ClinicalTrials. gov identifier: NCT02242097]. Bu çalışmalar, ibrutinibin kemoimmünoterapi rejimleriyle en iyi şekilde nasıl kullanılacağını ele almaya çalışmaktadır.
Lenalidomid, MCL dahil R/R NHL’de tek ajan aktivitesine sahip oral immünomodülatör bir ajandır [Habermann et al. 2009; Goy et al. 2013; Zinzani et al. 2013].
Lenalidomidin ibrutinib ile kombine edildiği R/R NHL hastalarına yönelik bir faz I çalışması rapor edilmiştir. Son rapor tarihinde 13 hasta tedavi edilmiştir (MCL’li iki hasta). Lenalidomid 15 mg ve ibrutinib 420 mg’ın ilk doz seviyesinde (DL1), iskemik inme ve grade 3 döküntü dahil olmak üzere iki DLT görülmüştür.
İbrutinibin hedef dışı etkilerine bağlı AE’ler
BTK’nın inhibisyonuna ek olarak ibrutinib, aktif bölgelerinde benzer sistein kalıntıları bulunan ITK, epidermal büyüme faktörü reseptörü (EGFR), tirozin protein kinaz (TEC), B-lenfosit kinaz (BLK), epitelyal/endotelyal tirozin kinaz (BMX), insan epidermal büyüme faktörü 2 reseptörü (HER2) gibi diğer kinazları da inhibe edebilir, ve insan epidermal büyüme faktörü 4 (HER4) diğerleri arasındadır [Herrera ve Jacobsen, 2014; Woyach ve ark. 2014], bu da hedef dışı yan etkilere yol açabilir. ITK normalde proksimal T-hücresi reseptör sinyalini yönlendirir ve antikor kaplı hedeflerin algılanması yoluyla NK hücresinin Fc Reseptörü tarafından tetiklenen sitotoksisitesini pozitif yönde düzenler [Khurana et al. 2007]. İbrutinibin ITK’yı geri dönüşümsüz olarak inhibe ettiği [Dubovsky et al. 2013] ve preklinik modellerde antikora bağlı NK hücre aracılı sitotoksisitenin ablasyonu yoluyla monoklonal antikor tedavilerinin terapötik aktivitesini sınırladığı görülmüştür [Kohrt et al. 2014]. Ancak, rituximab ile kombinasyon halinde ibrutinib ile görülen etkileyici klinik aktivite göz önüne alındığında [Wang ve ark. 2014a] bu bulgu klinik olarak anlamlı olmayabilir. Ayrıca, bu etki obinutuzumab gibi yeni Fc mühendisliği ürünü tip II antikorlarda pek de önemli olmayabilir [Da Roit et al. 2015].
MCL hastalarında ibrutinib ile diğer
kombinasyonlar
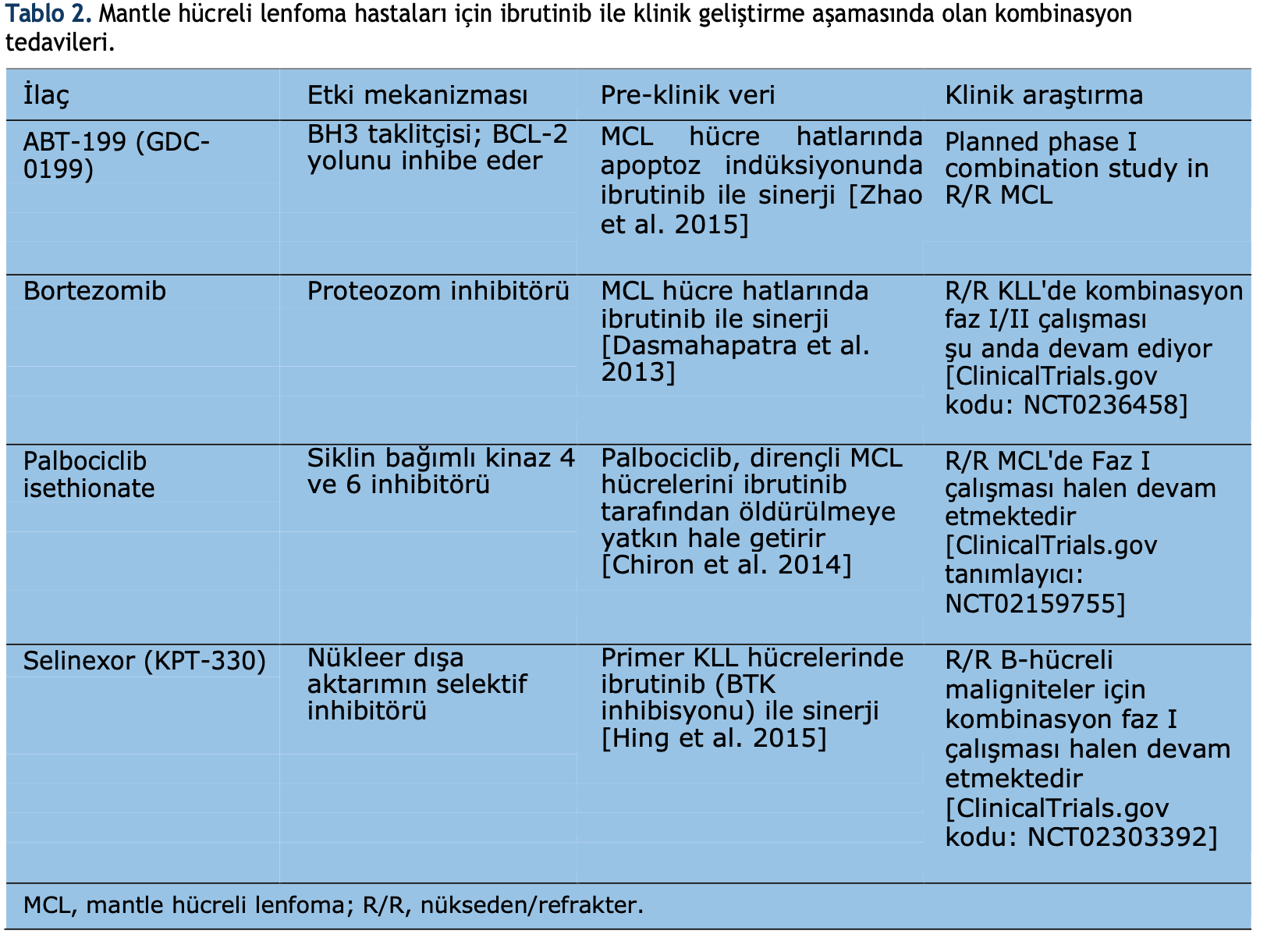
Tablo 2’de açıklanan diğer
kombinasyon çalışması veya çalışma yöntemi çeşitli geliştirme ve uygulama aşamalarındadır.
MCL hastaları için ibrutinib kullanımındaki tehlikeler
MCL hastalarının tedavisinde ibrutinibin dikkate değer klinik etkinliğine rağmen, ilacın gelecekteki gelişimini veya klinikte kullanımını etkileyebilecek maliyet, hedef dışı etkiler, ilaç etkileşimleri ve direnç gelişimi gibi bazı faktörler bulunmaktadır.
İbrutinibin hedef dışı etkilerine bağlı AE’ler
BTK’nın inhibisyonuna ek olarak ibrutinib, aktif bölgelerinde benzer sistein kalıntıları bulunan ITK, epidermal büyüme faktörü reseptörü (EGFR), tirozin protein kinaz (TEC), B-lenfosit kinaz (BLK), epitelyal/endotelyal tirozin kinaz (BMX), insan epidermal büyüme faktörü 2 reseptörü (HER2) gibi diğer kinazları da inhibe edebilir, ve insan epidermal büyüme faktörü 4 (HER4) diğerleri arasındadır [Herrera ve Jacobsen, 2014; Woyach ve ark. 2014], bu da hedef dışı yan etkilere yol açabilir. ITK normalde proksimal T-hücresi reseptör sinyalini yönlendirir ve antikor kaplı hedeflerin algılanması yoluyla NK hücresinin Fc Reseptörü tarafından tetiklenen sitotoksisitesini pozitif yönde düzenler [Khurana et al. 2007]. İbrutinibin ITK’yı geri dönüşümsüz olarak inhibe ettiği [Dubovsky et al. 2013] ve preklinik modellerde antikora bağlı NK hücre aracılı sitotoksisitenin ablasyonu yoluyla monoklonal antikor tedavilerinin terapötik aktivitesini sınırladığı görülmüştür [Kohrt et al. 2014]. Ancak, rituximab ile kombinasyon halinde ibrutinib ile görülen etkileyici klinik aktivite göz önüne alındığında [Wang ve ark. 2014a] bu bulgu klinik olarak anlamlı olmayabilir. Ayrıca, bu etki obinutuzumab gibi yeni Fc mühendisliği ürünü tip II antikorlarda pek de önemli olmayabilir [Da Roit et al. 2015].
Anti-CD20 tedavisinin klinik etkinliğine potansiyel olarak müdahale etmenin yanı sıra, ITK inhibisyonunun başkaca klinik sonuçları da olabilir. Hastaların çoğunda nadir görülen genetik ITK eksikliği sendromu ile ölümcül lenfoproliferatif bozukluklara yol açabilen ciddi Epstein Barr virüsü enfeksiyonları gelişmektedir [Huck et al. 2009]. Özellikle daha fazla hasta uzun süreli ITK inhibitasyonuna maruz kaldıkça bu durumdan daha fazla bahsedilmesi gerekse de, bugüne kadar ibrutinib alan hastalarda bu durum pek rapor edilmemiştir.
İbrutinibin EGFR’yi inhibe ettiği görülmüştür [Gao et al. 2014]. EGFR inhibe edici ajanlar şu anda birçok solid tümör tipinin tedavisinde kullanılmaktadır. Epidermisin bazal tabakasında [Nanney et al. 1984] ve normal gastrointestinal mukozada [Hirsh et al. 2014] yüksek düzeyde EGFR ekspresyonu olduğundan, EGFR inhibe edici ajanlarla tedavi edilen hastalarda en sık görülen AE’ler deri döküntüleri ve ishaldir. Bu nedenle, ibrutinib ile tedavi edilen hastalarda yaygın olarak görülen deri döküntüleri ve ishal şaşırtıcı değildir [Byrd ve ark. 2013, Wang ve ark. 2014b]. Diğer EGFR inhibitörlerine benzer şekilde, ibrutinib ile ilişkili döküntüler reaksiyonun şiddetine göre tedavi edilmelidir. Örneğin, fiziksel semptomları olmayan lokalize reaksiyonlar topikal düşük potensli steroid (%1 hidrokortizon) veya topikal antibiyotiklerle (%2 klindamisin) tedavi edilebilir. Orta derecelireaksiyonlar (sistemik semptomları olanlar) topikal tedaviler ve oral tetrasiklin antibiyotik ilavesiyle (doksisiklin 100 mg günlük veya minosiklin 100 mg günde iki kez 4 hafta boyunca) tedavi edilebilir. Şiddetli reaksiyonlar en azından ilacın geçici olarak kesilmesi ve önceki tedavi seçeneklerinin kullanılması ile önlenmelidir [Melosky ve Hirsh, 2014]. İbrutinib, döküntü en azından orta şiddete düşmüşse doz azaltımı ile yeniden başlatılabilir. EGFR inhibitörüyle ilişkili diğer yan etki olan diyarenin, tedaviye başlandıktan sonraki ilk 4 hafta içinde ortaya çıkma olasılığı yüksektir ve daha da önemlisi, risk zamanla azalmaktadır. İbrutinib ile tedavi edilen hastaların yaklaşık yarısında, çoğunluğu grade 1-2 olan ishal görülecektir ve mekanizma net olmamakla birlikte ishalin esas olarak sekretuar olduğu düşünülmektedir [Hirsh et al. 2014]. EGFR inhibitörüne bağlı ishalin tedavisine benzer şekilde, ibrutinib kaynaklı ishali olan hastaların tedavisi de hasta eğitimi, farmakolojik olmayan tedavi yöntemleri (diyet değişikliği ve sıvı alımının artırılması dahil), farmakolojik tedavi yöntemleri (en yaygın olarak loperamid) veya grade 3 ishal (günde en az yedi dışkı veya günlük yaşam aktivitelerini engelleme) için ilacın geçici olarak kesilmesi gibi yöntemleri içermelidir.
İbrutinib ile tedavi edilen hastaların %50’si kadarında rapor edilen diğer AE’ler farklı şiddetlerde görülen kanamalardır. Bu olayların çoğu grade 1/2’dir (spontan morarma veya peteşi), ancak hastaların %5’inde olaylar travmayı takiben grade 3 veya daha yüksektir [Advani et al. 2013; Byrd et al. 2013; Wang et al. 2014b]. İn vitro olarak, ibrutinibin BTK ve TEC kinazı inhibe ederek GPV1- ve GP1b-aracılı trombosit fonksiyonunun inhibisyonuna yol açtığı görülmüştür, bu da esasen trombosit agregasyonunu inhibe ederek von Willebrand faktörü üzerinde trombosit adezyonunun azalmasını sağlar [Levade et al. 2014]. Klinik çalışmalarda kaydedilen kanama AE’leri, ibrutinib çalışmaları sırasında hastaların antikoagülan, özellikle de varfarin kullanımının kısıtlanmasına yol açmıştır. Daha da önemlisi, kanamaların çoğu küçük olduğundan, tedavide önemli kesintiler veya doz değişiklikleri olmadan yönetilebilir. Bununla birlikte, bu yan etki hastalar için özellikle endişe verici olabilir ve bu nedenle, bu potansiyel AE konusunda onlara danışmanlık verilmelidir. Klinik çalışmalarda rapor edilmemiş olmasına rağmen, ibrutinib kullanma deneyimimizde, tekrarlayan spontan hemotipanum ve hemotoraks dahil olmak üzere biraz atipik bölgelerde kanama da gördük. NHL ve KLL hastaları tipik olarak daha yaşlıdır ve sürekli antikoagülasyon gerektirebilir, bu da bu hastalarda ibrutinib kullanımını sınırlayabilir. Yeni oral antikoagülanlar ve ibrutinib kombinasyonunun güvenliğini ayrıntılı olarak açıklayan hiçbir veri mevcut değildir. Bu nedenle, ibrutinib kullanan hastalarda mümkün olduğunca antikoagülasyondan kaçınılmalıdır. Bununla birlikte, gerekirse, kısa etkili olduğu ve kanama durumunda etkileri tersine çevrilebildiği için tercihen düşük ağırlıklı moleküler heparin (tipik olarak enoksaparin) kullanırız. Diğer uygun klinik seçenekleri olmayan hastalarda, tam doz ibrutinib ile kombinasyon halinde oral direkt trombin inhibitörleri ile bir dizi hastayı başarılı ve güvenli bir şekilde tedavi ettik, ancak hastalara potansiyel riskler konusunda kapsamlı danışmanlık verilmesi gerektiğini ve bu yaklaşımın özellikle altta yatan trombositopenisi olan hastalarda dikkatle yapılması gerektiğini belirttik. Ayrıca, aspirin ve klopidogrel gibi antitrombosit ajanların kullanımı kesinlikle kontrendike olmasa da, bu ajanların kesinlikle gerekli görülmediği sürece kullanımlarının kesilmesini öneriyoruz. Bir kanama epizodu durumunda, trombosit transfüzyonunun ibrutinib ile ilişkili anormal hemostazı düzelttiği gösterilmiştir [Levade et al. 2014]. Bir hastanın minör veya majör cerrahiye ihtiyacı varsa, minör veya majör bir prosedürden önce ve sonra sırasıyla 3 ila 7 gün boyunca ibrutinibden uzak durulmasını öneren prospektüsü takip ediyoruz.
KLL hastalarında ibrutinibin ofatumumab (anti CD20 monoklonal antikor) ile kıyaslandığı bir faz III klinik çalışma olan RESONATE çalışmasında [Byrd et al. 2014] en dikkat çekici olan, çok sayıda klinik çalışmada ibrutinibe atfedilen bir diğer AE afibdir. İbrutinib alan hastaların %5’inde (%3’ü grade ⩾ 3) afib görülürken, ofatumumab alan hastaların %1’inden daha azında (hiçbirinde grade ⩾ 3) afib görülmemiştir. Bu AE’nin mekanizmaları iyi tanımlanmamıştır; ancak klinik öncesi bir fare modeli, afibin kardiyak miyositlerde fosfatidilinositol 3-kinaz p110- (PI3K; BCR sinyal yolağının bir başka önemli elemanı) inhibisyonu ile indüklenebileceğini öne sürmüştür [McMullen et al. 2014]. Bu çalışmanın yazarları, RESONATE’de ibrutinib alan hastaların afib bakımından başlangıçta daha yüksek risk altında olabileceği sonucuna varmışlardır. Buna göre, ibrutinib ile afibin potansiyel risklerinin daha iyi anlaşılması gerekse de, afib ibrutinib ile tedavi için mutlak bir kontrendikasyon değildir ve afib gelişimi ibrutinibin kesilmesini gerektirmez çünkü risk genellikle ibrutinibin klinik faydasından daha ağır basmamaktadır. Bununla birlikte, potansiyel ilaç etkileşimleri göz önüne alındığında, ibrutinib alan hastalarda farmakolojik kardiyoversiyon sadece bir eczacı ile görüşüldükten sonra düşünülmeli ve bu hastalar yakından izlenmelidir. Daha önce de belirtildiği gibi, bir hastaya afib için antikoagülasyon gerektiriyorsa, dikkatli davranılmalıdır.
İbrutinib kullanan çalışmalarda tedavinin kesilmesi kapsamlı olarak değerlendirilmemiştir. Bunun yerine, çalışmalar remisyon elde edildikten sonra bile sürekli dozlama gerektirmiştir. Yukarıda açıklanan potansiyel toksisitelerin yanı sıra devam eden tedavinin mali yükü (ayda >10.000 $) göz önüne alındığında, daha kısa tedavi sürelerini, yanıt yüksekliğini (yani minimal rezidüel hastalık negatifliği elde etme olasılığı) ve yanıt veren hastalarda planlı doz kesintilerini değerlendirmek için daha fazla çalışmaya ihtiyaç vardır. İbrutinibin hedef dışı yan etkilerinin klinik etkisine sekonder olarak, ACP-196 gibi ikinci nesil ve daha spesifik BTK inhibitörleri geliştirilmiştir ve bunlar klinik çalışmaların belirli aşamalarındadır. [ClinicalTrials.gov kodu: NCT02213926], CC-292 ve ONO-4059 [ClincalTrials.gov kodu: NCT01659255]. Klinik çalışmanın daha erken aşamasında olmasına rağmen, CC-292 tedavisi en yaygın AE diyare
ACP-196 ile yapılan klinik çalışmaların sonuçları, gelişmiş bağlanma özgüllüğünün ibrutinib ile görülen hedef dışı AE’lerin bazılarını etkisi azalmadan ortadan kaldırıp kaldırmayacağını gösteren sonuçlar henüz rapor edilmemiştir.
İbrutinib’in diğer ilaçlarla etkileşimi
İbrutinib tedavisi düşünülürken ilaç etkileşimleri de dikkatle analiz edilmelidir. İlaç karaciğerde sitokrom P450 3A4 (CYP3A4) tarafından metabolize edilir, bu da CYP3A4 indükleyicileri veya inhibitörleri ile ilaç etkileşimlerine neden olabilir [Herrera ve Jacobsen, 2014]. CYP3A4’ün başlıca inhibitörleri greyfurt suyu, azol antifungal ajanlar, anti-insan immün yetmezlik virüsü ajanları, metronidazol, siprofloksasin ve tetrasiklindir. CYP3A4’ün önemli indükleyicileri antiseizure ilaçlardır (karbamazepin, oksikarbazepin, fosfenitoin, fenitoin, pentobarbital ve fenobarbital). İbrutinib tedavisine başlamadan önce, etkileşime girme potansiyeli olan ilaçlardaki değişikliklerle birlikte mevcut ilaçların dikkatli bir şekilde gözden geçirilmesi hasta güvenliği için gereklidir.
Relapses after and refractoriness to ibrutinib
İbrutinib ile tedavi edilen MCL hastalarında edinilmiş ve birincil direnç görülmüş ve bu hastalarda kötü klinik sonuçlar ortaya çıkmıştır. Uzun süreli tirozin kinaz inhibitörü tedavisinden sonra edinilmiş direncin görülebildiği kronik miyelojenöz lösemiye benzer şekilde [O’Dwyer et al. 2004], ibrutinib ile uzun süreli tedavi BTK’nın geri dönüşümsüz bağlanmasının önlenmesi yoluyla dirence yol açabilir. Örneğin, Chiron ve arkadaşları ibrutinib ile tedavi edilen MCL hastalarında seri biyopsileri değerlendirmişlerdir. İbrutinibe karşı edinilmiş direnci olan yedi hastadan ikisinde (sırasıyla 14 ve 30 aylık yanıt süresi ile tedavide PR elde etmiş hastalar), ibrutinibin BTK bağlanma bölgesinde (BTKC481S) ibrutinibin bağlanma afinitesini azaltarak etkisiz hale getiren bir sisteinden serine mutasyon olduğu görülmüştür [Chiron et al. 2014]. Daha da önemlisi, bu mutasyonlar ibrutinib tedavisinden önce tespit edilmemiştir. Aynı mutasyon ilk olarak ibrutinibe karşı edinilmiş direnci olan KLL hastalarında görülmüştür[Woyach et al. 2014]. Tersine, BTKC481S mutasyonu ibrutinibe primer veya erken edinilmiş direnci olan (<5 aydır tedavide olan) altı MCL hastasında bulunmamıştır [Chiron et al. 2014]. Araştırmacılar bu hasta örneklerinde, BCR sinyal yolundaki downstream kinazların, özellikle PI3K ve protein kinaz B’nin (AKT) aktive olduğunu bulmuşlardır.
Benzer şekilde, başka bir grup MCL hücre hatlarında ibrutinib direncinin aktif B hücrelerinin alternatif nükleer faktör hafif zincir arttırıcı (NFB) yolağının (MAP3K14 aracılığıyla) aktivasyonundan kaynaklanabileceğini, oysa ibrutinibe duyarlı MCL hücre hatlarının patogenezinin klasik BCR-BTK- NFB yolağına bağlı olduğunu bulmuştur [Rahal et al. 2014]. Hasta verileri NF B yolağının primer ibrutinib direncindeki rolünü desteklemektedir. Rituximab içeren kemoterapi ve bortezomib tedavisinden sonra MCL R/R olan 110 hastanın tek ajan ibrutinib aldığı faz II çalışmasında (SPARK Trial) [ClinicalTrials.gov kodu: NCT01599949], 25 hastanın birincil tedavi direncine sahip olduğu düşünülürken, diğer 22 hasta SD (n = 16) veya 12 aydan kısa süren yanıt (n = 6) ile ifade edilen orta düzeyde klinik fayda görüldüğü tespit edilmiştir. İlginç bir şekilde, primer direnci olan hastaların sadece %20’sinin kötü sonuçlara bağlı agresif MCL alt tipi olan blastik MCL’ye sahip olduğu, %38’inin ise yüksek mantle hücreli uluslararası prognostik indekse sahip olduğu görülmüştür. İbrutinib direnciyle ilişkili potansiyel genetik sapmaları tanımlamak amacıyla, tedavi öncesi tümör örneklerinden DNA ekstrakte edilmiş ve potansiyel olarak ibrutinib yanıtı ve direncinde rol oynayan 97 genin kodlama bölgesine özgü prob setleriyle zenginleştirilmiş veri kütüphaneleri oluşturulmuştur. Derin dizileme gerçekleştirilmiş ve referans genomla hizalanmıştır. En az iki hastada nonsinonim varyantlar içeren toplam 27 gen bulunmuştur. Daha önce MCL veya KLL hastalarında tanımlanan ve ibrutinibe direnç kazandıran hiçbir mutasyon görülmemiştir. Daha önce diffüz büyük B hücreli lenfoma (DLBCL) patogenezinde rol oynayan karışık soy lösemi proteini 2 (MLL2) ve cAMP yanıt elemanı bağlayıcı protein (CREBBP) gibi genler, protoonkogen serin/treonin-protein kinaz (PIM1) ve erb-b2 reseptör tirozin kinaz 4 (ERBB4) kinaz genlerindeki mutasyonla birlikte mutasyona uğramıştır. Tespit edilen mutasyonların birçoğu, normalde ibrutinib tarafından inhibe edilen BCR sinyal yolunun ayrılmaz bir parçası olan NFB sinyal inhibisyonunu etkilemektedir [Balasubramanian et al. 2014]. Bu sonuçlar hipotez oluşturucu niteliktedir ve önemli sinyal yolaklarını işaret edebilir; ancak, gözlemlenen mutasyonların kötü risk işaretleri mi yoksa direnç faktörleri mi olduğu belirsizliğini korumaktadır.
İbrutinibe karşı edinilmiş direnci olan MCL hastalarının sonuçları kötüdür. Bir çalışmada, ibrutinib ile tedaviyi bırakan 42 MCL hastası rapor edilmiştir. İbrutinib sonrası hastalık progresyonu yaşayan ve kurtarma tedavisi uygulanan 31 hasta arasında ORR yalnızca %32’dir.
Ortalama 10,7 aylık (aralık: 2,4-38,9 ay) takipte, hastalık ilerlemesinden sonra ortalama OS sadece 8,4 aydı [Cheah et al. 2015]. Bir başka retrospektif, çok kurumlu kohort çalışması, ibrutinib alırken hastalık progresyonu yaşayan 32 MCL hastasını tanımlamıştır. İbrutinib sonrası kurtarma tedavisi alan 19 hastanın 17’si yanıt açısından değerlendirilebilmiş ve bu hastaların sadece 6’sı (%35) sonraki tedaviye objektif bir yanıt vermiştir. İbrutinibin kesilmesinin ardından ortalama OS sadece 4 aydı (%95 CI 2-10 ay) [Martin et al. 2014b].
MCL ibrutinib tedavisinde başarısız olan daha geniş çaplı ve uluslararası çok merkezli bir kohortun analizi devam etmektedir. Bu veriler, tedavi sırasında agresif hastalık gelişimi ve blastoid dönüşüm de dahil olmak üzere klinikte gördüklerimizle benzerdir. İbrutinib başarısızlığından sonra görülen kötü sonuçların, ilerlemiş MCL’li hastaların tedavisinde son ortak yolu mu temsil ettiği yoksa ibrutinibin biyolojik olarak daha agresif bir fenotip seçmesi sonucu mu olduğu henüz net değildir; bunlardan ikinci seçeneğin, ibrutinibin ön basamak tedavi ortamında uygulanması göz önüne alındığında önemli etkileri olabilir. İbrutinibi daha iyi anlamak, direnci tetikleyen mekanizmaları ve bu hastaların nasıl tedavi edileceğini anlamak için daha fazla çalışmaya acilen ihtiyaç vardır.
Özet
Bu makale, tamamlanmış ve yayınlanmış klinik çalışmalar ve potansiyel AE’ler ve direncin gözden geçirilmesi dahil olmak üzere MCL’li hastalarıntedavisinde ibrutinib ile ilgili klinik deneyimi ayrıntılarıyla anlatmaktadır. İbrutinib, kayda değer yanıt oranları ile MCL hastaları için umut verici bir ajandır. Bununla birlikte, tek bir ajan olarak, hastaların yaklaşık üçte biri tedavinin ilk 2 yılında nüksetmektedir, bu da kombinasyon tedavilerininaraştırılmasının yanı sıra ibrutinibin ön tedavi stratejilerine eklenmesi konusunun incelenmesini de gerektirmektedir. İbrutinib ile tedavi edilen hastaların yaşadığı AE’lerin çoğu hafif olmasına rağmen, bazıları ciddi ve tedaviyi sınırlayıcı olabilir ve ilacın hedef dışı etkilerine bağlı olabilir. Bu nedenle, bu AE’lerin bazılarını hafifletebilecek daha spesifik ikinci nesil BTK inhibitörleri geliştirme girişimleri devam etmektedir. İbrutinib reçete edilmeden önce, potansiyel ilaç etkileşimlerini belirlemek için hastanın kullandığı ilaçlar kapsamlı bir şekilde gözden geçirilmelidir. Kronik antikoagülasyon gerektiren hastalar için ibrutinib düşünülürken dikkatli olunmalı, yeni antikoagülan kullanan hastalardaki riskleri daha iyi tanımlamak için ek çalışmalara ihtiyaç olduğu unutulmamalıdır.
İbrutinibe direnç gösteren hastalar çok kötü klinik sonuçlar sergilemektedir. İbrutinib hastalığın erken dönemlerinde araştırıldığı sürece, ibrutinib başarısızlığından sonra progresyon paternlerine, hastalık biyolojisine ve sonuçlara özellikle dikkat edilmesi gerekecektir. Direncin daha fazla açıklığa kavuşturulması ve bu hastalarda klinik sonuçların iyileştirilmesine yönelik stratejilerin araştırılması, henüz klinik anlamda yetersiz kalan önemli konular arasında yer almaktadır. İkinci nesil BTK inhibitörlerinin değerlendirilmesi devam etmektedir. Daha kısa tedavi süresinin etkisi, minimal rezidüel hastalık üzerindeki etkiler, moleküler nüks üzerine tedavinin başlatılması ve yeni kombinasyonların dahil edilmesine ilişkin çalışmalar yapılması gerekmektedir.
Finansman
Bu araştırma için kamu, ticari veya kâr amacı gütmeyen sektörlerdeki herhangi bir fon kuruluşundan özel bir hibe alınmamıştır.
Çıkar çatışması beyanı
Dr. Spurgeon: Araştırma fonu: Pharmacyclics, Janssen Pharmaceuticals Inc. ve Acerta Pharma. Honoraria: Pharmacyclics.
Kaynakça
Advani, R., Buggy, J., Sharman, J., Smith, S., Boyd, T., Grant, B. et al. (2013) Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/refractory B-cell malignancies. J Clin Oncol 31: 88–94.
Balasubramanian, S., Schaffer, M., Deraedt, W., Davis, C., Stepanchick, E., Aquino, R. et al. (2014) Mutational analysis of patients with primary resistance to single-agent ibrutinib in relapsed or refractory mantle cell lymphoma (MCL). Blood (ASH Annual Meeting Abstracts) abstract 78.
Bojarczuk, K., Siernicka, M., Dwojak, M., Bobrowicz, M., Pyrzynska, B., Gaj, P. et al. (2014) B-cell
receptor pathway inhibitors affect CD20 levels and impair antitumor activity of anti-CD20 monoclonal antibodies. Leukemia 28: 1163–1167.
Brown, J., Harb, W., Hill, B., Gabrilove, J., Sharman, J., Schreeder, M. et al. (2013) Phase 1 study of single agent CC-292, a highly selective Bruton’s tyrosinekinase (BTK) inhibitor, in relapsed/refractory chronic lymphocytic leukemia (CLL). Blood (ASH Annual Meeting Abstracts) 122:abstract 3793.
Byrd, J., Brown, J., O’Brien, S., Barrientos, J., Kay, N., Reddy, N. et al. (2014) Ibrutinib versus of atumumab in previously treated chronic lymphoid leukemia. N Engl J Med 371: 213–223.
Byrd, J., Furman, R., Coutre, S., Flinn, I., Burger, J., Blum, K. et al. (2013) Targeting BTK with ibrutinib
in relapsed chronic lymphocytic leukemia. N Engl J Med 369: 32–42.
Chandran, R., Gardiner, S., Simon, M. and Spurgeon, S. (2012) Survival trends in mantle cell lymphoma in the United States over 16 years 1992- 2007. Leuk Lymphoma 53: 1488–1493.
Cheah, C., Chihara, D., Romaguera, J., Fowler, N., Seymour, J., Hagemeister, F. et al. (2015) Patients with mantle cell lymphoma failing ibrutinib are unlikely to respond to salvage chemotherapy and have poor outcomes. Ann Oncol 26: 1175–1179.
Chiron, D., Di Liberto, M., Martin, P., Huang, X., Sharman, J., Blecua, P. et al. (2014) Cell-cycle reprogramming for PI3K inhibition overrides a relapse-specific C481S BTK mutation revealed
by longitudinal functional genomics in mantle cell lymphoma. Cancer Discov 4: 1022–1035.
Christian, B., Kuruvilla, J., Smith, S., Porcu, P., Ruppert, A., Byrd, J. et al. (2014) A phase I study of ibrutinib and lenalidomide in patients with relapsed and refractory B-cell non-Hodgkin’s lymphoma. Blood (ASH Annual Meeting Abstracts) abstract4476.
Cinar, M., Hamedani, F., Mo, Z., Cinar, B., Amin, H. and Alkan, S. (2013) Bruton tyrosine kinase is commonly over expressed in mantle cell lymphoma and its attenuation by Ibrutinib induces apoptosis. Leuk Res 37: 1271–1277.
Da Roit, F., Engelberts, P., Taylor, R., Breij, E., Gritti, G., Rambaldi, A. et al. (2015) Ibrutinib interferes with the cell-mediated anti-tumour activities of therapeutic CD20 antibodies: implications for combination therapy. Haematologica 100: 77–86.
Dasmahapatra, G., Patel, H., Dent, P., Fisher, R., Friedberg, J. and Grant, S. (2013) The Bruton tyrosine kinase (BTK) inhibitor PCI-32765 synergistically increases proteasome inhibitor activity in diffuse large-B cell lymphoma (DLBCL) and mantle cell lymphoma (MCL) cells sensitive or resistant to bortezomib. Br J Haematol 161: 43–56.
Dubovsky, J., Beckwith, K., Natarajan, G., Woyach, J., Jaglowski, S., Zhong, Y. et al. (2013) Ibrutinib is an irreversible molecular inhibitor of ITK driving a Th1-selective pressure in T lymphocytes. Blood 122: 2539–2549.
Flinn, I., van der Jagt, R., Kahl, B., Wood,
P., Hawkins, T., Macdonald, D. et al. (2014) Randomized trial of bendamustine-rituximab or R-CHOP/R-CVP in first-line treatment of indolent NHL or MCL: the BRIGHT study. Blood 123: 2944– 2952.
Gao, W., Wang, M., Wang, L., Lu, H., Wu, S.,
Dai, B. et al. (2014) Selective antitumor activity of ibrutinib in EGFR-mutant non-small cell lung cancer cells. J Natl Cancer Inst 106. doi:10.1093/jnci/dju204. Print 2014 Sep.
Geisler, C., Kolstad, A., Laurell, A., Andersen, N., Pedersen, L., Jerkeman, M. et al. (2008) Long-term progression-free survival of mantle cell lymphoma after intensive front-line immunochemotherapy with in vivo-purged stem-cell rescue: a nonrandomized phase 2 multicenter study by the Nordic Lymphoma Group. Blood 112: 2687–2693.
Geisler, C., Kolstad, A., Laurell, A., Jerkeman,
M., Raty, R., Andersen, N. et al. (2012) Nordic
MCL2 trial update: six-year follow-up after intensive immunochemotherapy for untreated mantle cell lymphoma followed by BEAM or BEAC + autologous stem-cell support: still very long survival but late relapses do occur. Br J Haematol 158: 355–362.
Goy, A., Sinha, R., Williams, M., Kalayoglu Besisik, S., Drach, J., Ramchandren, R. et al. (2013) Single- agent lenalidomide in patients with mantle-cell lymphoma who relapsed or progressed after or
were refractory to bortezomib: phase II MCL-001 (EMERGE) study. J Clin Oncol 31: 3688–3695.
Habermann, T., Lossos, I., Justice, G., Vose, J., Wiernik, P., McBride, K. et al. (2009) Lenalidomide oral monotherapy produces a high response rate
in patients with relapsed or refractory mantle cell lymphoma. Br J Haematol 145: 344–349.
Herrera, A. and Jacobsen, E. (2014) Ibrutinib for the treatment of mantle cell lymphoma. Clin Cancer Res 20: 5365–5371.
Herrmann, A., Hoster, E., Zwingers, T., Brittinger, G., Engelhard, M., Meusers, P. et al. (2009) Improvement of overall survival in advanced stage mantle cell lymphoma. J Clin Oncol 27: 511–518.
Hing, Z., Mantel, R., Beckwith, K., Guinn, D., Williams, E., Smith, L. et al. (2015) Selinexor is effective in acquired resistance to ibrutinib and synergizes with ibrutinib in chronic lymphocytic leukemia. Blood 125: 3128–3132.
Hirsh, V., Blais, N., Burkes, R., Verma, S. and Croitoru, K. (2014) Management of diarrhea induced by epidermal growth factor receptor tyrosine kinase inhibitors. Curr Oncol 21: 329–336.
Honigberg, L., Smith, A., Sirisawad, M., Verner, E., Loury, D., Chang, B. et al. (2010) The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy. Proc Natl Acad Sci USA 107: 13075–13080.
Huck, K., Feyen, O., Niehues, T., Ruschendorf, F., Hubner, N., Laws, H. et al. (2009) Girls homozygous for an IL-2-inducible T cell kinase mutation that leads to protein deficiency develop fatal EBV-associated lymphoproliferation. J Clin Invest 119: 1350–1358.
Khurana, D., Arneson, L., Schoon, R., Dick, C. and Leibson, P. (2007) Differential regulation of human
NK cell-mediated cytotoxicity by the tyrosine kinase ITK. J Immunol 178: 3575–3582.
Kluin-Nelemans, H., Hoster, E., Hermine, O., Walewski, J., Trneny, M., Geisler, C. et al. (2012) Treatment of older patients with mantle-cell lymphoma. N Engl J Med 367: 520–531.
Kohrt, H., Sagiv-Barfi, I., Rafiq, S., Herman, S., Butchar, J., Cheney, C. et al. (2014) Ibrutinib antagonizes rituximab-dependent NK cell-mediated cytotoxicity. Blood 123: 1957–1960.
Le Gouill, S., Thieblemont, C., Oberic, L., Bouabdallah, K., Gyan, E., Damaj, G. et al. (2014) Rituximab maintenance versus wait and watch after four courses of R-DHAP followed by autologous stem cell transplantation in previously untreated young patients with mantle cell lymphoma: first interim analysis of the phase III prospective lyma trial. Blood (ASH Annual Meeting Abstracts) abstract 146.
Levade, M., David, E., Garcia, C., Laurent, P., Cadot, S., Michallet, A. et al. (2014) Ibrutinib treatment affects collagen and von Willebrand factor- dependent platelet functions. Blood 124: 3991–3995.
Maddocks, K., Christian, B., Jaglowski, S., Flynn, J., Jones, J., Porcu, P. et al. (2015) A phase 1/1b study of rituximab, bendamustine, and ibrutinib in patients with untreated and relapsed/refractory non-Hodgkin lymphoma. Blood 125: 242–248.
Martin, P., Goy, A., Ramchandren, R., Ferrante, L., Reddy, V., Londhe, A. et al. (2014a) Safety Results from the United States Cohort of the ibrutinib
early access treatment protocol (EAP: MCL4001)
in patients with relapsed or refractory mantle cell lymphoma. Blood (ASH Annual Meeting Abstracts) abstract 4461.
Martin, P., Maddocks, K., Noto, K., Christian, B., Furman, R., Andritsos, L. et al. (2014b) Poor overall survival of patients with ibrutinib-resistant mantle cell lymphoma. Blood (ASH Annual Meeting Abstracts) abstract 3047.
McMullen, J., Boey, E., Ooi, J., Seymour, J., Keating, M. and Tam, C. (2014) Ibrutinib increases the risk
of atrial fibrillation, potentially through inhibition of cardiac PI3K-Akt signaling. Blood 124: 3829–3830.
Melosky, B. and Hirsh, V. (2014) Management of common toxicities in metastatic NSCLC related to anti-lung cancer therapies with EGFR-TKIs. Front Oncol 4: 238.
Merli, F., Luminari, S., Ilariucci, F., Petrini, M., Visco, C., Ambrosetti, A. et al. (2012) Rituximab plus HyperCV AD alternating with high dose cytarabine and methotrexate for the initial treatment of patients with mantle cell lymphoma, a multicentre trial from Gruppo Italiano Studio Linfomi. Br J Haematol 156: 346–353.
Nanney, L., Magid, M., Stoscheck, C. and King, L., Jr (1984) Comparison of epidermal growth factor binding and receptor distribution in normal human epidermis and epidermal appendages. J Invest Dermatol 83: 385–393.
O’Dwyer, M., Mauro, M., Blasdel, C., Farnsworth, M., Kurilik, G., Hsieh, Y. et al. (2004) Clonal evolution and lack of cytogenetic response are adverse prognostic factors for hematologic relapse of chronic phase CML patients treated with imatinib mesylate. Blood 103: 451–455.
Pighi, C., Gu, T., Dalai, I., Barbi, S., Parolini, C., Bertolaso, A. et al. (2011) Phospho-proteomic analysis of mantle cell lymphoma cells suggests a pro-survival role of B-cell receptor signaling. Cell Oncol (Dordr) 34: 141–153.
Rahal, R., Frick, M., Romero, R., Korn, J., Kridel, R., Chan, F. et al. (2014) Pharmacological and genomic profiling identifies NF-kappaB-targeted treatment strategies for mantle cell lymphoma. Nat Med 20: 87–92.
Rinaldi, A., Kwee, I., Taborelli, M., Largo, C., Uccella, S., Martin, V. et al. (2006) Genomic and expression profiling identifies the B-cell associated tyrosine kinase Syk as a possible therapeutic target in mantle cell lymphoma. Br J Haematol 132: 303–316.
Robak, T., Huang, H., Jin, J., Zhu, J., Liu, T., Samoilova, O. et al. (2015) Bortezomib-based therapy for newly diagnosed mantle-cell lymphoma. N Engl J Med 372: 944–953.
Romaguera, J., Fayad, L., Feng, L., Hartig, K., Weaver, P., Rodriguez, M. et al. (2010) Ten-year follow-up after intense chemoimmunotherapy with Rituximab-HyperCVAD alternating with Rituximab- high dose methotrexate/cytarabine (R-MA) and without stem cell transplantation in patients with untreated aggressive mantle cell lymphoma. Br J Haematol 150: 200–208.
Rummel, M., Niederle, N., Maschmeyer, G., Banat, G., von Grunhagen, U., Losem, C. et al. (2013) Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: an open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 381: 1203–1210.
Sharman, J., Farber, C., Mahadevan, D., Schreeder, M., Brooks, H., Kolibaba, K. et al. (2014) Ublituximab (TG-1101), a novel glycoengineered anti- CD20 monoclonal antibody, in combination with ibrutinib is highly active in patients with relapsed and/
or refractory CLL and MCL; results of a phase II trial. Blood (ASH Annual Meeting Abstracts) abstract 4679.
Wang, M., Hagemeister, F., Westin, J., Fayad, L., Samaniego, F., Turturro, F. et al. (2014a) Ibrutinib and rituximab are an efficacious and safe combination in relapsed mantle cell lymphoma: preliminary results from a phase II clinical trial. Blood (ASH Annual Meeting Abstracts) abstract 627.
Wang, M., Rule, S., Martin, P., Goy, A., Auer, R., Kahl, B. et al. (2013) Targeting BTK with ibrutinib in relapsed or refractory mantle-cell lymphoma. N Engl J Med 369: 507–516.
Wang, M., Rule, S., Martin, P., Goy, A., Auer, R., Kahl, B. et al. (2014b) Single-agent ibrutinib demonstrates safety and durability of response at 2 years follow-up in patients with relapsed or refractory mantle cell lymphoma: updated results of an international, multicenter, open-label phase 2 study. Blood (ASH Annual Meeting Abstracts) abstract 4453.
Woyach, J., Furman, R., Liu, T., Ozer, H., Zapatka, M., Ruppert, A. et al. (2014) Resistance mechanisms for the Bruton’s tyrosine kinase inhibitor ibrutinib. N Engl J Med 370: 2286–2294.
Younes, A., Thieblemont, C., Morschhauser,
F., Flinn, I., Friedberg, J., Amorim, S. et al. (2014) Combination of ibrutinib with rituximab, cyclophosphamide, doxorubicin, vincristine, and prednisone (R-CHOP) for treatment-naive patients with CD20-positive B-cell non-Hodgkin lymphoma: a non-randomised, phase 1b study. Lancet Oncol 15: 1019–1026.
Zhao, X., Bodo, J., Sun, D., Durkin, L., Lin, J., Smith, M. et al. (2015) Combination of ibrutinib with ABT-199: synergistic effects on proliferation inhibition and apoptosis in mantle cell lymphoma cells through perturbation of BTK, AKT and BCL2 pathways. Br J Haematol 168: 765–768.
Zhou, Y., Wang, H., Fang, W., Romaguer, J., Zhang, Y., Delasalle, K. et al. (2008) Incidence trends of mantle cell lymphoma in the United States between 1992 and 2004. Cancer 113: 791–798.
Zinzani, P., Vose, J., Czuczman, M., Reeder, C., Haioun, C., Polikoff, J. et al. (2013) Long-term follow-up of lenalidomide in relapsed/refractory mantle cell lymphoma: subset analysis of the NHL- 003 study. Ann Oncol 24: 2892–2897.