| 1 1 Abel Salazar Biyomedikal Bilimler Enstitüsü (ICBAS), Porto Üniversitesi (UP), Rua de Jorge Viterbo Ferreira 228, 4050-313 Porto, Portekiz; up201809297@up.pt 2 2 Fitzpatrick Onkoloji Tedavi ve Yumuşak Doku Merkezi, 70 Priestley Rd, Guildford GU2 7AJ, Birleşik Krallık; ipereiracabral@fitzpatrickreferrals.co.uk 3 3 OncoPharma Araştırma Grubu, Sağlık Teknolojisi ve Hizmetleri Araştırma Merkezi (CINTESIS), Tıp Fakültesi, Porto Üniversitesi, Rua Doutor Placido da Costa, 4200-450 Porto, Portekiz; nunovale@med.up.pt 4 4 Halk Sağlığı, Bilgi ve Sağlık Politikaları Bilimleri Bölümü (MEDCIDS), Tıp Fakültesi, Porto Üniversitesi, Rua Doutor Placido da Costa, 4200-450 Porto, Portekiz 5 5 Sağlık Araştırma Ağı RISE Laboratuvarı, Tıp Fakültesi, Porto Üniversitesi, Alameda Profesör Hernani Monteiro, 4200-319 Porto, Portekiz 6 6 Sağlık Araştırma ve İnovasyon Enstitüsü (i3S), Universidade do Porto (UP), Rua Alfredo Allen 208, 4200-135 Porto, Portekiz 7 7 Moleküler Patoloji ve İmmünoloji Enstitüsü (IPATIMUP), Porto Üniversitesi, Rua Julio Amaral de Carvalho 45, 4200-135 Porto, Portekiz * Yazışma adresi: iamorim@ipatimup.pt + Bu yazarlar bu çalışmaya eşit derecede katkıda bulunmuştur. |
| Kısa Özet: İnsan mide kanseri, yüksek ölüm oranıyla dünya çapında görülen yaygın bir kanserdir. Diğer birçok özelliği ortak olmasına rağmen, mide kanseri insidansı köpeklerde insanlara göre daha düşüktür. Cerrahi ilk basamak tedavidir; ancak çeşitli komplikasyonlar görülmektedir. Bununla birlikte, köpek mide kanserini tedavi etmek için kemoterapi uygulamak, geç konulan tanı, hızlı ilerleme, düşük ortalama sağkalım süresi ve yüksek ölüm oranının yanı sıra somut bilimsel bulgular içeren yayınların eksikliği nedeniyle fazla ilgi görmemiştir. Bu incelemede, genellikle ölümcül olan bu hastalığın tedavisinde kullanılan farmakolojik yöntemler ele alınmaktadır. Özet: İnsan mide kanseri (MK) dünya çapında en yaygın beşinci kanserdir ve kansere bağlı ölümlerin üçüncü önde gelen nedenidir. MK insidansı köpeklerde insanlara göre daha düşüktür ve tüm köpek malignitelerinin %1’inden azını meydana getirir. Son yıllarda, MK’nin patogenezini anlamak ve cerrahiye ek olarak adjuvan kemoterapi tedavileri gibi tedavi seçeneklerini en üst düzeye çıkarmak için gereken tüm çaba gösterilmektedir. Cerrahi ilk basamak tedavi olmasına rağmen, çeşitli komplikasyonlar içermektedir. Köpek mide kanserinde kemoterapötik müdahale, geç konulan tanı, hızlı progresyon, düşük ortalama sağkalım süresi ve çok yüksek mortalite oranının yanı sıra somut bilimsel bulgular içeren yayınların eksikliği nedeniyle fazla ilgi görmemiştir. Bu derlemede, köpek MK’sini ve sıklıkla ölümcül olan bu hastalığın tedavisinde kullanılan farmakolojik yöntemleri ele aldık. |
| Anahtar Kelimeler: insan mide kanseri; köpek mide kanseri; antikanser ilaçlar; direnç; kemoterapi |
| check for updates Bu makaleye atıfta bulunmakiçin: Araujo, D.; Cabral, I.; Vale, N.; Amorim, I. Canine Gastric Cancer: Current Treatment Approaches. Vet. Sci. 2022, 9, 383. https://doi.org/10.3390/ vetsci9080383 Akademik editör: Erik Teske Teslim Tarihi: 13 Mayıs 2022 Kabul Tarihi: 24 Temmuz 2022 Yayın Tarihi: 26 Temmuz 2022 Yayıncının Notu: MDPI, makalenin yayınlandığı ülkelerdeki hak iddiaları ve kurumsal ilişkiler konusunda tarafsız kalmaktadır. |
| Telif hakkı: © 2022 yazarlar tarafından. Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution (CC BY) lisansının hüküm ve koşulları altında dağıtılan açık erişimli bir makaledir (https:// creativecommons.org/licenses/by/ 4.0/). |
| 1. Giriş İnsan mide kanseri (MK) dünya çapında en yaygın beşinci kanserdir ve kansere bağlı ölümlerin en yaygın üçüncü nedenidir [1]. Köpeklerde GK insidansı insanlara göre daha düşüktür ve tüm köpek malignitelerinin %1’inden azını meydana getirmektedir [2-7]. Ancak, bu hastalık genellikle yaşlı hayvanlarda ve ileri evrelerde teşhis edildiğinden, köpeklerde MK prevalansı düşük bulunabilir ve bu da köpek sahiplerinin daha ileri tanısal muayeneler konusunda isteksiz davranmasına neden olabilir [5]. |
| Son yıllarda, MK patogenezinin anlaşılmasında ilerleme kaydedilmiş ve tek başına cerrahi müdahaleye ek olarak adjuvan kemoterapi tedavileri gibi iyileştirici bulguları en üst düzeye çıkarabilecek uygun tedavilerin bulunması için çeşitli çalışmalar yürütülmüştür [8]. İnsan tıbbında, özellikle tümör ilerlediyse, nüks ettiyse, metastatikse ve hatta ameliyat edilemez durumdaysa tedaviyi etkileyen faktörler söz konusudur. Bu durumlarda, ortalama sağkalım süresini artırmak ve yaşam kalitesini sağlamak için kemoterapi, adjuvan tedavi (cerrahi olarak çıkarıldıktan sonra) veya neoadjuvan tedavi (diğer tedavi yöntemlerinden önce) olarak şiddetle tavsiye edilir [9,10]. Tümör tipine ve hastalığın evresine bağlı olarak radyoterapi de uygulanabilir [9,10]. Veteriner literatüründe, cerrahi rezeksiyon sonrası MK’nin klinik sonuçları ve kemoterapinin bu hastalığın ilerlemesindeki rolü hakkında sınırlı bilgi mevcuttur. Nitekim, mide karsinomunu tedavi etmek için ameliyat edilen köpekleri değerlendiren çalışmalar, birden fazla mide tümörü tipini içeren vaka raporları ve vaka serileri ile sınırlı kalmıştır [11]. Bu incelemede, köpek MK’si ve genellikle ölümcül veya kötü prognozla ilişkili olan bu hastalığın tedavisinde kullanılan farklı yöntemler kapsamlı bir şekilde ele alınmıştır. 1. Epidemiyoloji ve Risk Faktörleri İnsan MK etiyolojisi karmaşıktır ve tam olarak anlaşılamamıştır; kalıtsal kanser sendromları, bilinen risk faktörleri, diğer mide hastalıkları ve Helicobacter pylori enfeksiyonu bu hastalıkta önemli rol oynamaktadır [1]. Köpeklerde, köpek gastrik neoplazisinin gelişimi ile uzun süreli nitrozamin uygulaması ve ırk yatkınlığı gibi genetik faktörler arasındaki ilişkiler tanımlanmış olmasına rağmen, MK’nin etiyolojisi bilinmemektedir [12]. Çeşitli çalışmalar Belçika çoban köpeklerinde (Tervuren ve Groenendael) [3,5-7,13,14], Rough Collie’lerde [5-7,14,15], Staffordshire Terrier’lerde [7,14,15], Chow Chow’larda [6,16,17] ve kanişlerde [5] ırk yatkınlığı olduğunu rapor etmiştir. Erkeklerde MK insidansı daha yüksektir ve 7 ila 11 yaş arasında değişen yaşlı köpekler bu hastalıktan en sık etkilenen gruptur [2,3,5,13,18]. . 2. Teşhis ve Prognoz İnsanlarda olduğu gibi, köpeklerde de MK’nin klinik belirtileri hastalığın erken evrelerinde genellikle hafiftir veya hiç yoktur; en yaygın olanları kusma, anoreksi, kilo kaybı ve letarjidir [1,19,20]. Semptomların süresi haftalar ile aylar arasında değişiklik gösterebilir [19]. İnsanlardaki MK’nin yaklaşık %90-95’i, mide mukozasının epitel hücrelerinden kaynaklanan adenokarsinomlardır. Aynı şekilde, adenokarsinom da köpeklerin midesinde en sık görülen neoplastik oluşum olarak kabul edilmektedir ve tüm köpek mide malignitelerinin %50-90’ını meydana getirmektedir [2,4,21]. Ön tanı genellikle midenin ultrason veya endoskopik muayenesi ile elde edilir, böylece mukozanın görüntülenmesi ve kesin tanı için biyopsi alınması mümkün olur [5]. MK’nin tanı konulduğu anda ileri evrede olması ve yüksek metastaz sıklığı göz önünde bulundurulduğunda, başarılı bir tedavi için erken teşhis çok önemlidir [5,6]. Mikroskobik olarak, evcil hayvanlar için DSÖ sınıflandırmasına göre [22], karsinomlar lezyonun ana histolojik ve sitolojik özelliklerine göre papiller, tübüler, müsinöz ve taşlı yüzük hücreli alt tiplere ayrılır. Buna ek olarak, Lauren’in insanlar için geliştirdiği kriterler, karsinomları intestinal ve diffüz tipler olmak üzere iki ana histolojik alt tipe ayırarak köpek MK’sine başarıyla uyarlanmıştır [23] (Şekil 1). MK vakalarının prognozu kötüdür ve %70-90’ı tanı veya ötenazi esnasında metastaz yapmaktadır [5-7,14]. Köpek MKT’si sıklıkla küçük kurvatur veya pilorda yerleşir ve sıklıkla gastrik lenf nodları, omentum, karaciğer, duodenum, pankreas, dalak, özofagus, adrenal bezler ve akciğerler gibi diğer bölgelere yayılır [3,4,6,7,13]. Nitekim Swann ve Holt, MK’li 21 köpek vakasının 6’sında metastazın ameliyat sırasında tespit edildiğini ve her hasta sahibinin isteği üzerine tam da bu anda ötenazi yapıldığını bildirmiştir [4]. |
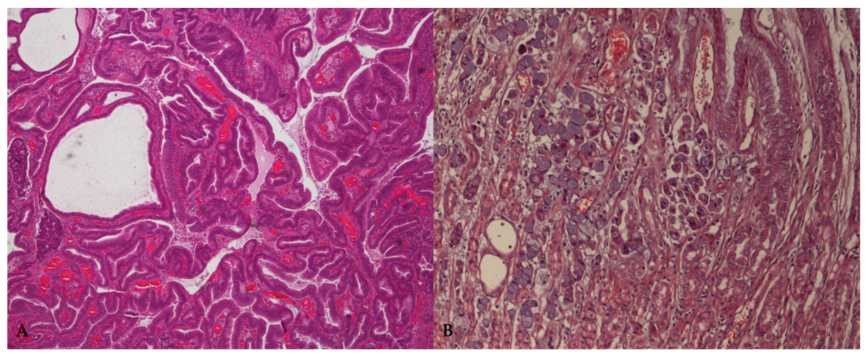
| Şekil 1. Köpek mide karsinomunun ana histolojik varyantlarının temsili mikrofotoğrafları. (A) Sırasıyla DSÖ ve Lauren sınıflandırmasına göre tubulopapiller veya intestinal tip. HE = 40 x. (B) Sırasıyla DSÖ ve Lauren sınıflandırmasına göre taşlı yüzük hücreli karsinom veya diffüz tip. HE = 100 x. |
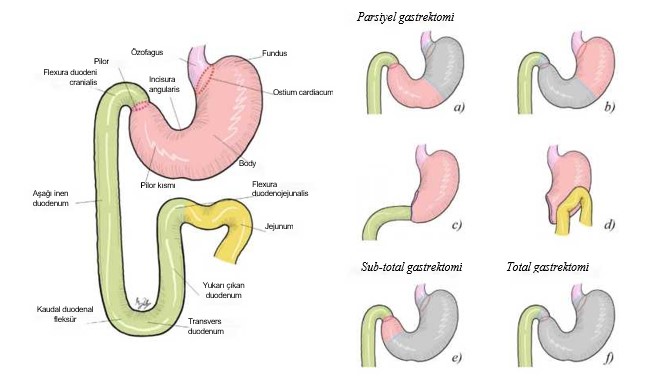
| Tedavi edilmemiş köpeklerde bildirilen hayatta kalma süresi, klinik belirtilerin başlamasından sonra 3 aydan azdır [11]. Gastrik neoplazinin cerrahi tedavisi pilorektomi ve gastroduodenostomiden (Billroth I) ibarettir [6,7,24], bu da anormal pilorik dokunun geniş bir şekilde eksizyonuna ve gastrik çıkışın iyileştirilmesine olanak sağlar (Şekil 2). Bununla birlikte, birkaç çalışmada postoperatif komplikasyonlar tespit edilmiştir. Gastrik neoplazisi olan köpeklerin postoperatif komplikasyonlar nedeniyle ölme olasılığı yüksek değildi, ancak uzun süreli sağkalım zayıftı ve genel ortalama sağkalım 33 gündü [24]. |
| Şekil 2. (a,b) Parsiyel gastrektomi (midenin <%70’inin çıkarılması). (c) Billroth I (gastroduodenostomi), parsiyel gastrektomi sonrası uygulanan bir rekonstrüksiyon tekniği. (d) Billroth II (gastrojejunostomi), parsiyel gastrektomi sonrası uygulanan bir rekonstrüksiyon tekniği. (e) Subtotal gastrektomi (>%70 ancak midenin tamamen çıkarılmaması). (f): Total gastrektomi (midenin tamamen çıkarılması). |
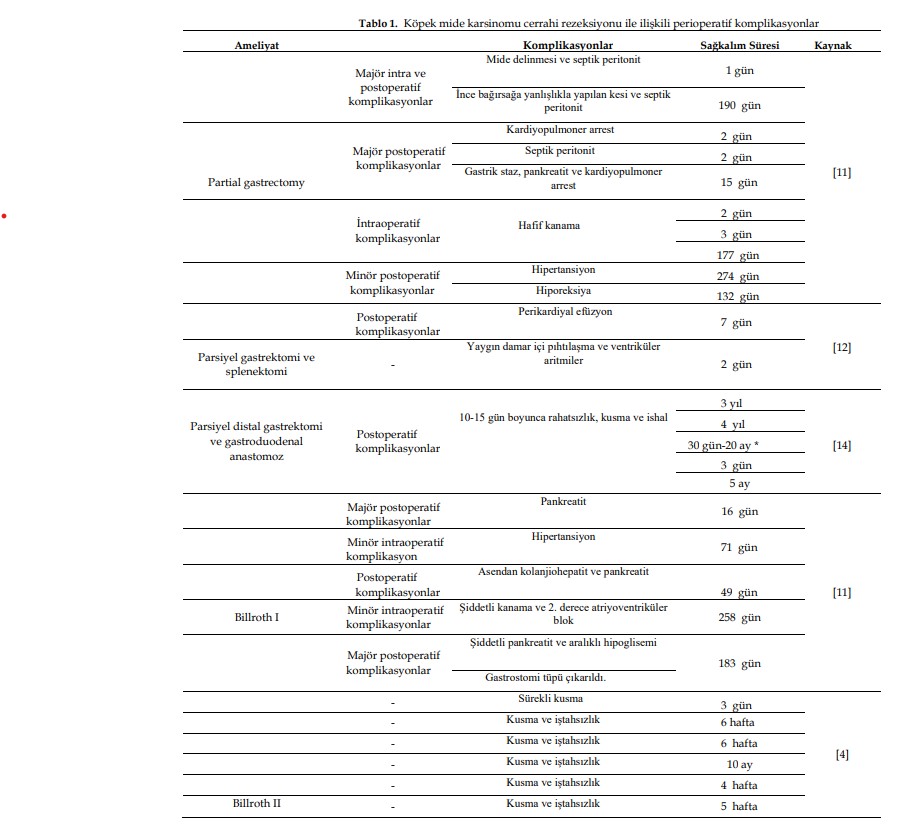
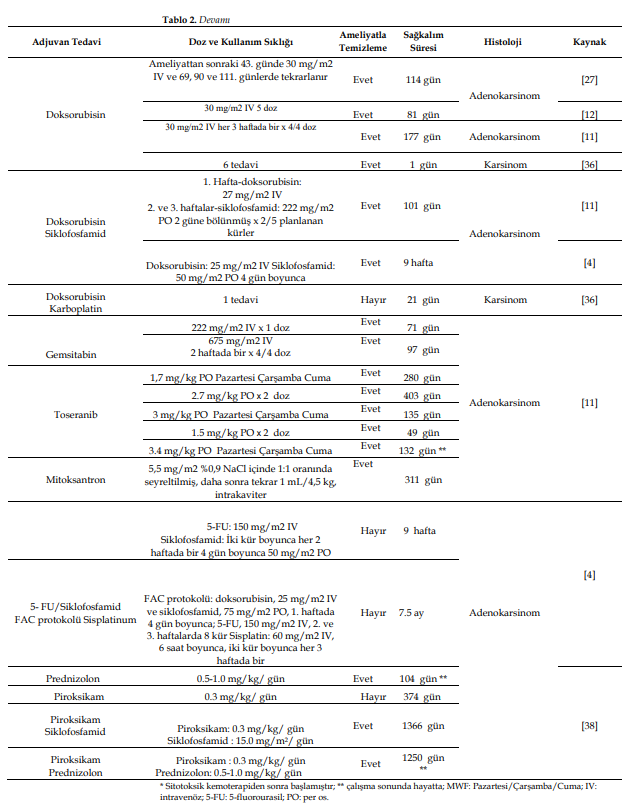
| 4. Tedavi Yöntemleri 4.1. Cerrahi Rezeksiyon Yöntemi Yapılan birkaç çalışmada, köpek MK’sini tedavi etmeyi amaçlayan cerrahi ile ilişkili varsayılan komplikasyonlar ve bunların genel hayvan sağkalımı ile ilişkisi ele alınmıştır (Tablo 1). Farklı malign neoplazileri olan on üç köpek ve benign tümörleri olan iki köpeğe pilorektomi ve gastroduodenostomi uygulanmıştır. |
| Sekiz köpekte neoplastik hastalık tam olarak eksize edilmiş ve genel ortalama sağkalım süresi 578 gün olmuştur; beş köpekte ise neoplazmın inkomplet rezeksiyonu yapılmış ve genel sağkalım süresi 33 gün olmuştur. Diğer iki köpekte eksize edilen doku sınırları rapor edilmemiştir. İnkomplet sınır rezeksiyonu yapılan sadece bir hasta postoperatif 14 gün içinde ölmüştür. Malign neoplazi veya metastatik hastalığı olan köpeklerin genel ortalama sağkalım süresi 33 gündü ve bu süre 1659 günden fazla süren benign hastalığı olan veya metastatik hastalığı olmayan hastaların genel ortalama sağkalım süresinden oldukça farklıydı. Metastazı olan sekiz hastadan sadece ikisi ameliyat sonrası dönemde 14 gün içinde ölmüştür [24]. Bu çalışmada, mide adenokarsinomu nedeniyle cerrahi rezeksiyon uygulanan köpeklerde perioperatif (intraoperatif ve/veya postoperatif) komplikasyonlar değerlendirilmiştir. Toplam hasta sayısının onunda parsiyel gastrektomi (midenin <%70’inin çıkarılması) uygulanmıştır. Bunlardan (a) iki köpekte mide delinmesi ve septik peritonit gibi majör intraoperatif ve postoperatif komplikasyonlar görülmüş ve sadece 1 gün hayatta kalmışlardır; diğerinde ise ince bağırsağa yanlışlıkla bıçakla kesi yapılmış ve septik peritonit görülmüş ve 190 gün hayatta kalmışlardır; (b) üç hastada kardiyopulmoner arrest (2 gün hayatta kalmışlardır); septik peritonit (2 gün hayatta kalmışlardır) gibi postoperatif majör komplikasyonlar görülmüştür; ve gastrik staz, pankreatit ve kardiyopulmoner arrest (15 gün hayatta kaldı); (c) üç köpek, sırasıyla 2, 3 ve 177 gün hayatta kalarak minör kanama ile intraoperatif komplikasyonlar gösterdi; (d) iki köpekte minör postoperatif komplikasyonlar vardı – 274 gün hayatta kalma süresi elde eden bir hayvanda hipertansiyon tespit edildi ve diğeri 132 gün hayatta kalarak hiporeksi yaşadı [11]. Ayrıca, MK’li 10 köpeğe parsiyel distal gastrektomi ve gastroduodenal anastomoz uygulanmış ve genel postoperatif komplikasyonlar 10-15 gün boyunca rahatsızlık, kusma ve ishal şeklinde görülmüştür. Ulaşılan genel ortalama sağkalım süresi 72 gündü. İki hasta 3 ve 4 yıl yaşamıştır ve ölüm nedenleri mide tümörü ile ilişkili değildi; altı köpeğe hastalığın ilerlemesi nedeniyle ötenazi uygulanmış ve sağkalım süresi 30 gün ile 20 ay arasında değişmiştir; bir köpek ameliyattan 3 gün sonra tedaviyle ilişkili olmayan sorunlar nedeniyle ölmüştür; ve başka bir hasta en az 5 ay yaşamıştır [14]. Başka bir araştırmada, MK’li bir köpeğe parsiyel gastrektomiden 7 gün sonra postoperatif perikardiyal efüzyon tespit edilmesi nedeniyle ötenazi uygulanmıştır. Gastrik adenokarsinoma ek olarak gastrik dilatasyon-volvulus bulunan bir köpekte, parsiyel gastrektomi ve splenektomi uygulandı. Ancak hasta ameliyattan 2 gün sonra dissemine intravasküler koagülasyon ve ventriküler aritmiler nedeniyle ötenazi edilmiştir [12]. Toplam hastaların beşine Billroth I ameliyatı (gastroduodenostomi, parsiyel gastrektomi sonrası rekonstrüksiyon ameliyatı) uygulanmıştır. Bunlar arasında (a) bir hastada majör postoperatif komplikasyon olarak pankreatit görüldü ve 16 gün hayatta kaldı; (b) bir diğerinde minör intraoperatif komplikasyon olarak hipertansiyonun yanı sıra postoperatif komplikasyon olarak asendan kolanjiohepatit ve pankreatit görüldü ve 71 gün hayatta kaldı; (c) başka bir hayvanda majör kanama ve 2. derece atriyoventriküler blok gibi minör intraoperatif komplikasyonlar görüldü ve hayatta kalma süresi 49 gündü; (d) son iki köpekte majör postoperatif komplikasyonlar görüldü; birinde şiddetli pankreatit ve intermitan hipoglisemi görüldü ve 258 gün hayatta kaldı, diğerinin ise gastrostomi tüpü çıkarıldı ancak 183 gün hayatta kaldı [11]. Dört hastaya Billroth I ameliyatı yapılmış ve bir köpeğe ameliyattan 3 gün sonra inatçı kusma nedeniyle ötenazi uygulanırken, diğer iki köpeğe 6 hafta sonra, diğerine ise 10 ay sonra kusma ve anoreksi nedeniyle ötenazi uygulanmıştır. İki vakada ise neoplazinin yayılması nedeniyle gastrojejunostomi (Billroth II) uygulanmış ve hastalar ameliyattan 4 ve 5 hafta sonra kusma ve iştahsızlık nüksü nedeniyle ötenazi edilmiştir [4]. |
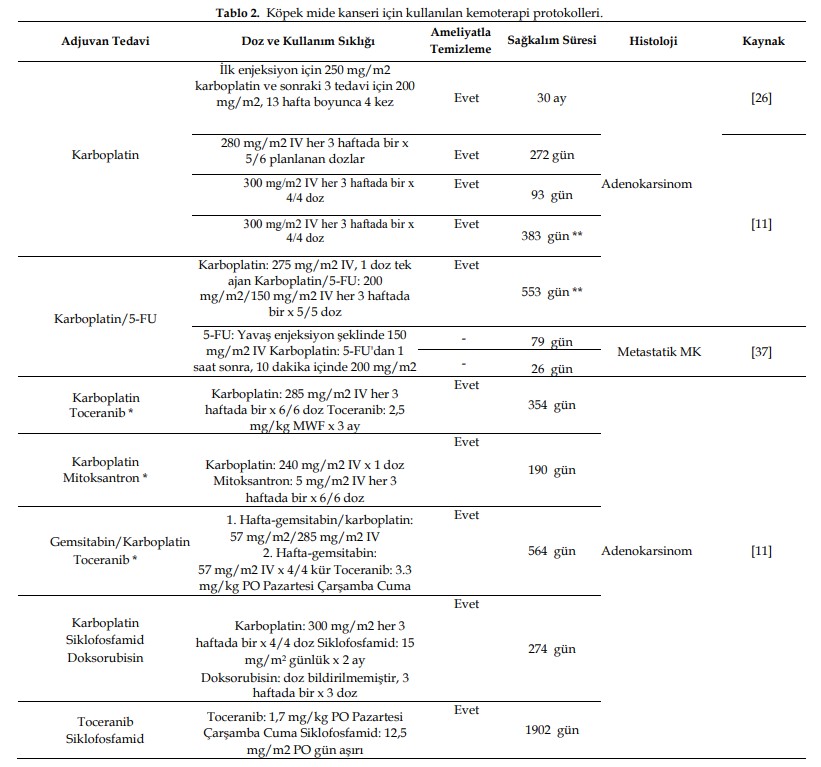
| Subtotal gastrektomi (midenin >%70’inin çıkarılması ancak tamamının çıkarılmaması) uygulanan iki hastadan birinde subtotal gastrektomiye yol açan majör intraoperatif komplikasyon ve septik peritonit gibi postoperatif komplikasyonlar görülmüş ve 13 gün hayatta kalmıştır; ikinci hastada ise minör intraoperatif kanama ve kusma gibi postoperatif komplikasyonlar görülmüş ve 93 gün hayatta kalma süresi elde edilmiştir [11]. Total gastrektomi uygulanan mide adenokarsinomlu bir başka köpek hastaya, yemek yeme sırasında ve sonrasında yaşadığı rahatsızlık nedeniyle 240 gün sonra ötenazi uygulanmıştır [25]. 1.1. Farmakolojik Yaklaşım Veteriner onkoloji giderek büyüyen bir alandır ve yaygın köpek neoplazmlarında farklı kemoterapi protokolleri belirlenmiştir. Köpek MK’sinin en yaygın tedavisi, temiz sınırlar elde etmek için geniş cerrahi rezeksiyondur. Bununla birlikte, spesifik olmayan klinik belirtiler nedeniyle, hastalık genellikle ileri aşamada teşhis edilir ve yayılımı ve konumu genellikle cerrahi müdahaleyi imkansız kılar [1,11,19,20]. Hala net olmamakla birlikte, çeşitli çalışmalarda kullanılan kemoterapi protokollerinde cerrahi rezeksiyon sonrası uygulanan tek ajanlar veya kombinasyon tedavileri yer almaktadır (bkz. Tablo 2 ve Ek Materyaller) [4,11,12,26,27]. Kemoterapötik müdahale açısından, köpek MK’si, genellikle nadir görülmesi, geç teşhis edilmesi, hızlı ilerlemesi, düşük ortalama sağkalım süresi ve çok yüksek ölüm oranının yanı sıra somut bilimsel bulgular içeren yayınların eksikliği nedeniyle fazla ilgi görmemiştir. 1.1.1. Kemoterapi Planları Karboplatin ve Sisplatin Platin ilaçlar antitümör bileşenlerin oluşturduğu önemli bir sınıftır. Tek başına veya diğer ajanlarla kombinasyon halinde, cis-diamminedichloroplatinum (II) (sisplatin) ve analogları çeşitli solid tümörlerin tedavisinde ciddi anlamda etkilidir. Bununla birlikte, sisplatin ile gözlenen yüksek toksisite profili, sisplatine dirençli olanlar da dahil olmak üzere farklı tümör tiplerine karşı daha tolere edilebilir ve aktif olan platin analoglarının geliştirilmesini beraberinde getirmiştir [28]. Sisplatine ek olarak, diğer iki platin kompleksinin yani cis-diamminecyclobutanedicarboxylato platinum (II) (carboplatin) ve 1,2-diaminocyclo- hexaneoxalato platinum (II) (oxaliplatin) kullanımı günümüzde onaylanmıştır [28]. Bu ajanların antitümör aktivitesi, DNA’ya kovalent bağlanarak iki fonksiyonlu lezyonlara ve inter- veya intrastrand çapraz bağlara sebebiyet vermeleriyle gerçekleşir [10,29-31]. Karboplatin, evcil hayvanlarda güvenle kullanılabilen ikinci nesil platin bileşimli bir kemoterapötik ajandır. Sisplatinin nefrotoksisite, bulantı, kusma, nörotoksisite, ototoksisite ve miyelosupresyon gibi sayısız yan etkisini en aza indirmek ve benzer tümör sitotoksisitesini korumak amacıyla insanlar için geliştirilmiştir [10,30-33]. Amin taşıyıcı ligandlar hem karboplatin hem de sisplatin moleküllerinde aynıdır [28]. Karboplatin, cisplatindeki iki klorürün pozisyonundaki siklobütandikarboksilat grubu ile cisplatinden farklıdır [28,34], bu da renal toksisitesi azaltılmış kompleks oluşturur [28]. |
| Sisplatin hayvan sistemlerinde en aktif antineoplastik ajan olarak kabul edilir ve bazı veteriner onkologlar hem insan hem de veteriner hekimlikte kullanıldığı için diğer platin ajanlardan daha güçlü olduğunu düşünür [33,35]. Bununla birlikte, cisplatin kediler için oldukça toksik olduğundan kediler için endike değildir [10,29,30]. Sisplatinin yüksek nefrotoksisitesi nedeniyle, karboplatin en yaygın kullanılan platin analoğudur ve sisplatine göre daha uygun maliyetli bir alternatiftir [31,33]. Bununla birlikte, karboplatin idrarla atıldığından ve sisplatinden daha az olsa da bir miktar nefrotoksisite gösterdiğinden böbrek hastalarına özellikle dikkat edilmelidir [10,29,30]. Veteriner onkolojide, karboplatin osteosarkom tedavisinde ve bağırsak ve prostat karsinomları ve anal kese adenokarsinomu gibi çeşitli sarkom ve karsinomlarda kullanılır. Bu tedavilere bağlı toksisiteler, nefrotoksisiteye ek olarak bulantı/kusma ve miyelosupresyondan oluşmaktadır [10,29-31]. Genel olarak, 15 kg’dan hafif köpeklerde 300 mg/m2 karboplatin dozu her 3-4 haftada bir intravenöz (IV) olarak uygulanırken, 15 kg’dan büyük köpeklerde 350 mg/m2 uygulanır [30,31]. Köpek MK’sinin tedavisini amaçlayan bazı çalışmalarda farklı protokoller izlense de tek başına karboplatin kullanılmıştır ve (a) İlk doz için 250 mg/m2 karboplatin ve sonraki tedaviler için 200 mg/m2, 10 haftalık bir süre içinde üç kez uygulanmıştır. Lezyon kötü prognozlu olmasına rağmen, hastanın durumu tedaviden sonra iyi kontrol edilmiş ve ameliyattan sonra 30 aylık sağkalım süresi elde edilmiştir [26] ve (b) her 3 haftada bir 280 mg/m2 IV, planlanan altı dozun beşi uygulanmıştır. Ameliyat sonrası sağkalım süresi 272 gün olup, hayvanda grade I letarji, kusma, diyare ve grade II nötropeni görülmüştür [11] ve (c) iki vakaya 3 haftada bir dört doz 300 mg/m2 IV olmak üzere aynı protokol uygulanmış ve sağkalım süreleri sırasıyla 3. dozdan sonra grade I nötropeni ile 93 gün ve grade I diyare ile 383 gün olmuştur (hayvan çalışmanın sonunda hala hayattaydı) [11]. |
| Doksorubisin Antitümör antibiyotikler, çeşitli etki mekanizmalarına sahip klinik olarak yararlı bileşikler üreten antrasiklinler (doksorubisin) ve antrasenedionların sentetik bir analoğu (mitoksantron), mitomisinler ve aktinomisinler dahil olmak üzere mikrobiyal fermantasyondan ortaya çıkan doğal ürünlerdir. Doksorubisin (DOX) çeşitli hücresel bileşenlerle reaksiyona girer ve aktiviteleri arasında DNA interkalasyonu ve RNA ve DNA polimerazların ve topoizomeraz II’nin inhibisyonu, DNA’nın alkilasyonu, reaktif oksijen üretimi, hücresel Ca2+ homeostazının bozulması, tiyoredoksin redüktazın inhibisyonu ve plazma membran bileşenleriyle etkileşim bulunmaktadır. DOX intravenöz olarak uygulanır ve tüm dokulara geniş ölçüde dağılır [10,29-31]. DOX tedavisi ile ilişkili doz sınırlayıcı toksisiteler infüzyon hızına bağlı aşırı duyarlılık, miyelosupresyon, gastrointestinal toksisite ve kümülatif doza bağlı kardiyotoksisitedir [10,29-31]. Köpeklerde, DOX’un potansiyel toksisitesini sınırlamak için, bazı protokollerde kardiyak değerlendirmeden sonra DOX kümülatif dozu 180-240 mg/m2 olarak optimize edilmiştir [29]. Deksrazoksan, kardiyak toksisiteyi azaltmak için DOX ile birlikte uygulanabilir [10,29-31]. DOX vezikan bir ilaç olduğundan ve ekstravazasyonları daha fazla cerrahi müdahale gerektirebilen doku nekrozuna neden olabileceğinden dikkatli bir şekilde uygulanmalıdır [9,10,29,31]. DOX, evcil hayvanlarda farklı tümör türlerinde kullanılabilen en aktif tek ajandır. Bu ilaç çeşitli maligniteler için tek başına veya kombinasyon protokollerinde kullanılabilir [10,29,31]. Köpeklerde, geleneksel doz uygulaması 15 kg’dan büyük köpekler için her 3 haftada bir 30 mg/m2 ve daha küçük hastalar için 1 mg/kg’dır [10,29-31]. Henüz evrensel bir reçete protokolü oluşturulmadığından, ilk DOX uygulamasını takiben doz ayarlamaları yapılmalıdır. Özellikle kalp hastalığı olan hastalarda veya dilate kardiyomiyopati yatkınlığı olan ırklarda [30,31], herhangi bir üfürüm, aritmi veya nabız defisitini tespit etmek için her DOX uygulamasından önce ekokardiyografi ve elektrokardiyografi yoluyla kardiyak performansın değerlendirilmesi son derece önemlidir [29-31]. |
| Dört köpek gastrik adenokarsinom vakasında tek başına doksorubisin kullanıldı; tüm vakalarda 30 mg/m2 IV uygulandı, ancak her biri için farklı sıklıkta uygulandı. Bir köpek ameliyattan sonraki 43. günde DOX ile sistemik kemoterapiye başladı ve 69, 90 ve 111. günlerde tedavi tekrarlandı. Hasta başlangıçta tedaviye iyi yanıt verdi; ancak 90. günden sonra (3. DOX dozu) köpek kilo kaybetmeye başladı ve 114. günde şiddetli letarji, ateş, solunum güçlüğü ve tekrarlayan pnömoni görüldü ve ötenazi uygulandı [27]. Adenokarsinomlu başka bir köpek ameliyat sonrası beş doz DOX almış ve sağkalım süresi 81 gün olmuştur [12]. Başka bir çalışmada, grade II anoreksisi olan bir köpek her 3 haftada bir dört doz adjuvan DOX ile tedavi edilmiş ve 177 gün hayatta kalmıştır [11]. Daha yakın zamanda, mide karsinomu olan bir köpek hasta cerrahi ile tedavi edilmiş (Billroth I) ve ardından spesifik dozları belirtilmeyen altı DOX uygulamasına tabi tutulmuş ve 1 yıl hayatta kalmıştır [36]. |
| Mitoksantron Mitoksantron, DNA interkalasyonunda ve RNA ve DNA polimerazların ve topoizomeraz II’nin inhibisyonunda DOX ile aynı aktiviteye sahip sentetik yapıda bir DOX analoğudur [9,10,29-31]. Bununla birlikte, mitoksantron hücrelerde oksidatif hasara neden olmaz ve reaktif oksijen türleri üretme olasılığı daha düşüktür. Bu ilaç dokulara geniş çapta dağılır ve IV uygulamadan sonra minimal seviyeler bile uzun süre kalıcıdır. Mitoksantronun bir kısmı metabolize olmaz (<%30) ve idrar ve feçesle değişmeden atılır [9,10,29,31]. Doz sınırlayıcı toksisiteler gastrointestinal bozukluklar, miyelosupresyon ve ekstravazasyon ile perivasküler hasardır [9,10,29,30]. Kardiyotoksisite insanlarda nadirdir ve köpeklerde henüz rapor edilmemiştir [29-31]. Köpeklerde mitoksantron (her 3 haftada bir 5 ila 6 mg/m2 IV yavaş bolus), hasta kümülatif DOX seviyesine ulaştığında veya kardiyomiyopati bulguları olduğunda ve hasta DOX uygulaması ile birlikte ciddi hasar riski altında olduğunda kardiyak koruyucu bir antrasiklin olarak kullanılmaktadır [9,29-31]. İntrakaviter mitoksantron (%0,9 NaCl içinde 1:1 oranında seyreltilmiş 5,5 mg/m2, daha sonra tekrar 1 mL/4,5 kg) gastrik adenokarsinomlu bir köpekte metastatik bikaviter efüzyonu tedavi etmek için palyatif intrakaviter kemoterapi olarak kullanılmıştır. İyi tolere edilmiş ve ameliyattan sonra 311 günlük bir sağkalım süresi sağlamıştır [11]. Gemsitabin Antimetabolitler, hücre büyümesi ve bölünmesi süreçleri sırasında hücresel metabolitlerin kullanımını engelleyen ajanlardan oluşur. Bu ajanlar, normal metabolizmada ve kanser kemoterapötiklerinde DNA replikasyonu ile ilişkili anabolik süreçlerde kullanılan bileşiklerin analoglarıdır [10,29]. Gemsitabin (20,20 -diflorodeoksisitidin), çok sayıda insan solid tümörü ve hematolojik maligniteye karşı ciddi klinik aktiviteye sahip bir diflorlu deoksisitidin analoğudur [10,29,31,39]. Gemsitabin, insanlardaki dengeli nükleosid taşıyıcı 1 (hENT1) etkisini gerektiren nükleosid taşıyıcılar tarafından hücrelere aktif olarak taşınır [29,39]. Bu ilacın sitotoksik etkilerini gösterebilmesi için hücre içi aktivasyona ihtiyacı vardır, çünkü aynı enzimatik mekanizma tarafından trifosfat metaboliti aktif formuna aktive edilir [39]. Bu da DNA’ya dahil olarak zincirin sonlanmasına ve DNA sentezi ve fonksiyonunun inhibisyonuna neden olur [10,39]. Bu ilaç IV yolla uygulanır ve tek bir ajan olarak kullanıldığında nispeten iyi tolere edilir. Doz sınırlayıcı ana toksisite miyelosupresyondur, ancak diğer antimetabolitlerin varlığında, gemsitabin daha uzun infüzyonlarda daha fazla hematolojik toksisite üretir [10,39]. Daha yüksek dozlarda, gastrointestinal toksisite orta dereceden ciddi dereceye kadar çıkabilir [10,29]. Veteriner onkolojide, bazı çalışmalarda tek ajan olarak veya ilaç kombinasyonlarında kullanılmasına veya radyoterapi ile kombine edilmesine rağmen, gemsitabin hakkında nadiren rapor verilmiştir. Köpeklerde doz rejimleri, diğer sitotoksiklerin kullanımına bağlı olarak hem yüksek doz (20 ila 30 dakika boyunca 800 mg/m2 IV, 4 hafta boyunca her hafta) hem de düşük doz (25 ila 50 mg/m2 IV, protokol başına haftada bir veya iki kez) gibi seçeneklerden oluşmaktadır [29,31]. Bir çalışmada, gastrik adenokarsinomlu iki köpek ameliyattan sonra 2 haftada bir 222 mg/m2 IV ve dört doz 675 mg/m2 IV gemsitabin almış, komplikasyon olmadan veya sadece grade I letarji ile iyi tolere edilmiş ve sırasıyla 71 gün ve 97 gün sağkalım süresi elde edilmiştir [11]. 5-Fluorourasil 5-Flororasil (5-FU), kolaylaştırılmış urasil baz taşıma sistemi yoluyla hücrelere giren ve hücre içinde fosforilaz ve kinaz reaksiyonları yoluyla aktif nükleotid formlarına dönüştürülerek hem florouridin hem de florodeoksiuridinin monofosfat, difosfat ve trifosfat formlarını veren, RNA ve DNA’ya dahil olan ve sentezine ve işlevine müdahale eden halojenli bir urasil analoğudur [10,29-31,39]. Bu ilaç IV yoluyla uygulanır ve çeşitli dokularda dihidropirimidin dehidrojenaz tarafından dihidroflorourasile geniş ölçüde metabolize edilir ve ayrıca a-floro-p-alanin, amonyak ve karbondioksite katabolize edilir; uygulanan bir dozun yaklaşık %90’ı metabolize edilir [29]. |
| İnsanlarda 5-FU ve analog bileşikleri, gastrointestinal maligniteler gibi solid tümörlerin tedavisinde kullanılmaktadır. Ayrıca metastatik kolorektal kanseri tedavi etmek için kombinasyon terapilerinde ve erken evre kolon kanseri için adjuvan tedavi olarak kullanılır [39]. Köpeklerde 5-FU topikal ve intralezyonel olarak uygulanabilir ve doza bağlı miyelosupresyon, gastrointestinal toksisite ve nörotoksisiteye neden olur. Bununla birlikte, 5-FU epitelyal tümörlerin (hepatik, pankreatik, renal, meme) tedavisinde nadiren kullanılır ve bunun için protokol haftada 150 mg/m2 referans doz olup IV’tür [10,29-31]. Masitinib ve Toceranib Veteriner hekimlikte, köpeklerde kullanım için onaylanmış iki kinaz inhibitörü vardır: masitinib ve toceranib [40]. Masitinib, çoğunlukla c-Kit reseptörünü ve PDGFRa/p’yi hedef alan küçük moleküllü, güçlü ve seçici bir fenilaminotiyazol tipi tirozin kinaz inhibitörüdür (TKI) [30,40,41]. Mast hücreli tümörü olan köpeklerde, masitinib hastalığın ilerlemesine kadar geçen süreyi iyileştirmiş ve KIT mutasyonlarını barındıran mast hücreli tümörleri olan köpeklerde daha iyi sonuçlar kaydedilmiştir. Uzun süreli masitinib ile tedavi edilen köpekler, plasebo ile tedavi edilen hastalara kıyasla uzun süreli sağkalım ve hastalık kontrolünde fayda sağlamıştır [42,43]. Toceranib, platelet kaynaklı büyüme faktörü reseptörü (PDGFR), vasküler endotelyal büyüme faktörü reseptörü (VEGFR), KIT protoonkogen reseptör tirozin kinaz (KIT), FMS benzeri tirozin kinaz 3 (FLT3) ve koloni uyarıcı faktör 1 reseptörü (CSF1R) gibi molekülleri hedef alarak antianjiyojenik ve antitümör özelliklere sahip bir tirozin kinaz inhibitörüdür. Toceranib mast hücreli tümörler, sarkomlar ve karsinomlarda etkinlik göstermiş ve çeşitli solid tümörlerin tedavisinde kullanılmıştır [30,31,40]. Bir çalışmada farklı köpek adenokarsinom tiplerinin (apokrin bez anal kesesi, ince bağırsak, akciğer ve böbrek hücreli karsinom) toceranib ile tedavisi değerlendirilmiştir. Sonuçlar, toceranibin etkilerinin adenokarsinom tipine bağlı olabileceğini göstermiştir. Köpekler tedaviyi iyi tolere etmiş, ancak sadece cerrahi ile tedavi edilenlere kıyasla daha yüksek oranda yan etki görülmüştür. Toceranib ile postoperatif adjuvan tedavi, tek başına cerrahi ile tedavi edilenlere kıyasla daha uzun progresyon süresiyle ilişkilendirilmiştir [44]. Başka bir çalışmada, gastrik adenokarsinomlu beş köpek ameliyattan sonra farklı doz rejimleri ve sıklıkları kullanılarak toceranib ile tedavi edilmiştir: (i) Pazartesi/Çarşamba/Cuma (MWF) günleri 1,7 mg/kg PO; (ii) MWF günleri 2,7 mg/kg PO iki doz; (iii) MWF günleri 3 mg/kg PO; (iv) MWF günleri 1,5 mg/kg PO iki doz; ve (v) MWF günleri 3,4 mg/kg PO. Üç köpekte bu tedavi, grade II diyare ve grade I letarji gibi yan etkiler nedeniyle başladıktan kısa bir süre sonra sonlandırılmıştır; diğer iki vakada toceranib iyi tolere edilmiş ve hastalıkta ilerleme kaydedilene kadar sürekli olarak kullanılmıştır. Bu tedavinin sağkalım süresi 49 ila 403 gün arasında değişmiştir (sırasıyla 280 gün, 403 gün, 135 gün, 49 gün ve 132 gün) [11]. Siklofosfamid Alkilleyici ajanlar, etki mekanizması alkil gruplarının hücresel makromoleküllere kovalent bağlanmasından oluşan bir grup antikanser ilaçtır; bu ajanlar DNA’yı hedef alır ve burada inter- veya intrastand çapraz bağlar üreten mono- veya bifonksiyonel eklentiler oluştururlar [29,30,45]. Siklofosfamid, aktif alkilleyici türleri serbest bırakmak için sitokrom p450 metabolizmasını içeren bir nitrojen mustard ön ilacıdır [29,31,45]. Siklofosfamid, esas olarak karaciğerde mikrozomal karışık fonksiyonlu oksidazlar yoluyla gerçekleşen metabolik aktivasyonun yokluğunda inaktiftir [10,29,30,45]. Bu aktivasyon, 4- hidroksiklofosfamide (4-OHCP) halka oksidasyonunu, amino aldehit aldofosfamide spontan ve geri dönüşümlü halka açılmasını ve aldofosfamidin fosforamid hardal ve akroleine geri dönüşümsüz olarak parçalanmasını gerektirir [29,30,45]. |
| Alkilleyici ajanlar farklı kanser türlerinin tedavisinde tek veya çok ajanlı protokoller olarak sıklıkla kullanılmakta olup, siklofosfamid çok çeşitli tümörlere (lenfoma, lösemi, meme karsinomu ve sarkomlar) karşı en yaygın kullanılan alkilleyici ajandır. Bu ajanların birincil doz sınırlayıcı toksisitesi kemik iliği baskılanmasıdır (nötropeni) ve bağırsak mukoza hücrelerinin çoğalmasında ikincil kısıtlayıcı etkileri vardır [10,30,31,45]. Köpeklerde gastrointestinal toksisite yaygın değildir. Bununla birlikte, steril hemorajik sistit ve sürekli tüy döken ırklarda alopesi sık görülen toksisite belirtileridir [10,29-31]. Siklofosfamid köpekte PO veya IV yolla bolus doz (250 mg/m2) olarak uygulanabilir veya düşük dozlarda ve minimum duraklamalarla sürekli olarak uzun süreli uygulandığı metronomik kemoterapi şeklinde kullanılabilir [29-31]; bu tedavi köpeklerde hemanjiosarkom, yumuşak doku sarkomu ve transizyonel hücreli karsinomda denenmiştir [9]. Prednizolon Prednizon (17a,21-dihidroksipregna-1,4-dien-3,11,20-trion) ve prednizolon (11 p, 17a,21-trihidroksipregna-1,4-dien-3,20-dion) kortizolün sentetik analoglarıdır. Prednizon karaciğerde prednizolona dönüştürülür. Her ikisi de transplant reddi ve otoimmün hastalıkları tedavi etmek için tek başına veya diğer immünosupresif ilaçlarla birlikte kullanılabilir. Prednizolon, apoptozu indükleyen bir ön ilaç [30,46-48] olarak IV yoluyla uygulanır [29]. Bu ilaçlar akut lenfatik lösemi, kronik lenfatik lösemi, timoma non-Hodgkin, lenfoma, multipl miyelom ve meme kanseri tedavisinde kemoterapi ajanları olarak, genellikle kombinasyon terapisinde kullanılır [10,49]. Prednizolon, evcil hayvanlarda lenfoid neoplazilerin, mast hücre tümörlerinin ve beyin tümörlerinin tedavisinde kullanılır. Bu ilaç köpeklerde kısa sürede iyi tolere edilir. Genellikle hastalar günde 2 mg/kg veya 40mg/m2 PO alırlar [29,31]. Kemoterapinin toksisite profilini azaltmak için prednizolon da kullanılabilir ve anti-enflamatuar dozlar uygulanabilir (günde bir kez 0,5 ila 1,0 mg/kg PO) [29]. Pilorun mukozal rezeksiyonuna maruz kalan gastrik adenokarsinomlu bir hasta 0,5-1,0 mg/kg/gün prednizolon ile tedavi edilmiş ve hayvan çalışmanın sonunda hayatta olduğu için kaydedilen sağkalım süresi nüks olmaksızın en az 104 gün olmuştur [38]. Piroksikam Bazı ilaçlar antikanser tedavilerde kullanılmak üzere tasarlanmamıştır, ancak bazıları anjiyogenezi inhibe edebilir ve bu nedenle antineoplastik bir profil sergileyebilir; bunlar arasında matriks metalloproteinaz (MMP) ve siklooksijenaz (COX) inhibitörleri bulunur. Piroksikam, oksikam ailesine ait nonsteroidal bir anti-enflamatuar ilaçtır [10,30,31,50]. En uzun yarılanma ömrüne sahip nonselektif COX inhibitörüdür ve oral uygulamadan sonra tamamen emilir [30,51]. Piroksikamın yan etkileri gastrointestinal ve deri reaksiyonları şeklinde ortaya çıkmaktadır [10,30,51]. Anjiyogenez tedavisinde COX inhibitörü olarak piroksikamın potansiyel etkisi köpek transizyonel hücreli karsinomunda incelenmiştir [10,31,52]. Köpeklerde piroksikam dozu günde bir kez 0,3 mg/kg PO’dur [10,30,53]. İyi tolere edilen bir ilaç olmasına rağmen, yan etkileri arasında ülserasyon ve renal toksisite gibi gastrointestinal toksisite bulunmaktadır [10,30,31,53,54]. Gastrik adenokarsinomlu bir köpek 0,3 mg/kg/gün piroksikam ile tedavi edilmiştir; ancak hayvan 374 gün sonra tümör progresyonu nedeniyle ölmüştür [38]. Kombinasyon Tedavileri Tek ajanlı tedavilere kıyasla farklı kemoterapi ilaçlarının kombinasyonunun etkinliği, tümör hücrelerinin doğal ve edinilmiş direncinin üstesinden gelinmesi ve doz sınırlayıcı yan etkiler açısından farklılık gösteren ajanların kullanılmasından ileri gelmektedir. İnsanlarda, tek ajanla karşılaştırıldığında, kombinasyon kemoterapisinin bazı malignitelerde iyileştirici potansiyele sahip olduğu gösterilmiştir. Veteriner onkolojisinde, kombinasyon kemoterapisi köpek lenfomasının tedavisinde başarılı olmuştur [29]. |
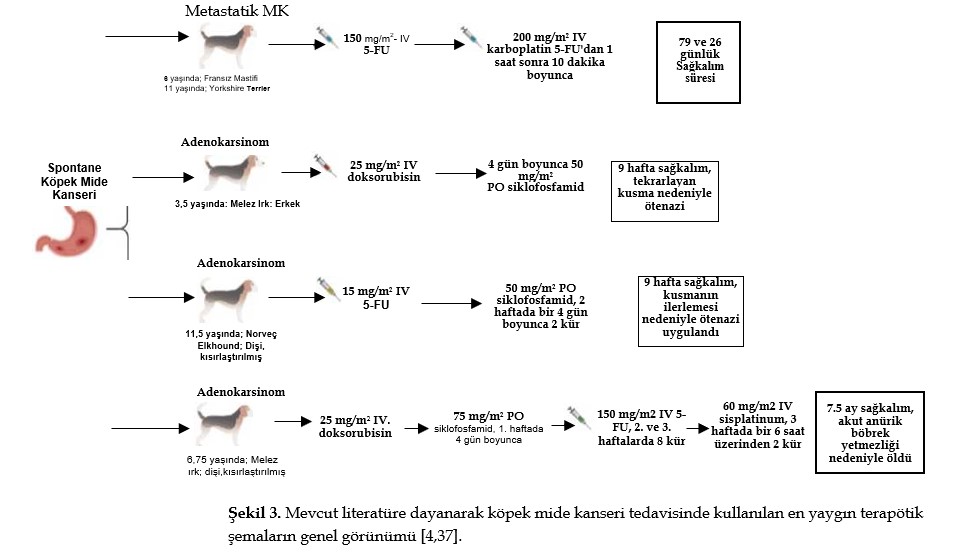
| Bazı araştırmalar köpek MK’sinde tedavi yaklaşımı olarak kombinasyon-kemoterapi protokollerini kullanmıştır (Şekil 3). Gastrik adenokarsinomda karboplatin/5-FU kullanılmıştır: ameliyattan sonra tek doz 275 mg/m2 karboplatin IV uygulanmış, ardından her 3 haftada bir beş doz 200 mg/m2 karboplatin artı 150 mg/m2 5-FU IV uygulanmış, yan etki görülmemiş ve çalışmanın sonunda hayatta kalan hasta sayısı 553 gün olmuştur [11]. Köpeklerde yapılan bir başka deney, 5-FU ve karboplatin kullanan bir kombinasyon protokolünün iyi tolere edildiğini ve özellikle gastrointestinal formlar olmak üzere çeşitli karsinomlar için kabul edilebilir bir tedavi protokolü olmaya devam ettiğini göstermiştir [37]. İki köpek metastatik mide karsinomu vakasında, 150 mg/m2 5-FU yavaş şekilde IV olarak uygulanmış ve 1 saat sonra 10 dakika boyunca 200 mg/m2 IV karboplatin eklenmiş ve sağkalım süreleri sırasıyla 79 ve 26 gün olmuştur [37]. 5-FU, köpek karsinomlarında diğer platin ajanlarla, özellikle de sisplatin ve oksaliplatin ile kombinasyon halinde de kullanılabilir. Bununla birlikte, tedaviye alınan yanıtı ve potansiyel toksisiteyi net bir şekilde değerlendirmek için daha geniş bir köpek kohortunda yapılacak çalışmalara ihtiyaç vardır [37]. Bununla birlikte, gastrik karsinomlu iki hasta karboplatin ve doksorubisin ile tedavi edilmiş ve sağkalım süreleri 21 günden uzun olmamıştır [36]. |
| Gastrik adenokarsinomlu bir köpekte, toceranib uygulaması (3 ay boyunca MWF’de (Pazartesi, Çarşamba, Cuma) 2,5 mg/kg), her 3 haftada bir altı doz 285 mg/m2 IV karboplatin sitotoksik kemoterapisinden sonra başlamış, grade III nötropeni görülmüş ve kaydedilen sağkalım süresi 354 gün olmuştur [11]. Başka bir vakada, 1. haftada 57 mg/m2 gemsitabin artı 285 mg/m2 IV karboplatin ve 2. haftada dört kür 57 mg/m2 IV gemsitabin sitotoksik kemoterapi etkisinden sonra MWF’de 3,3 mg/kg toceranib PO olarak uygulanmış, nötropeni ve grade II trombositopeni ile 564 gün sağkalım süresi elde edilmiştir. Aynı durumlar, 3 haftada bir altı doz 5 mg/m2 IV mitoksantron ve kemoterapiden sonra bir doz 240 mg/m2 IV karboplatin uygulanan ve kreatinin değerinde grade I yükselme görülen bir vakada da meydana gelmiştir. Sağkalım süresi 190 gün olmuştur [11]. Gastrik adenokarsinomu tedavi etmek için çoklu ajan protokolünde karboplatin (3 haftada bir 300 mg/m2 dört doz), siklofosfamid (günde 15 mg/m2 2 ay) ve doksorubisin (3 haftada bir üç doz; doz bildirilmemiştir) kombinasyonu kullanılmış ve elde edilen sağkalım süresi yan etki olmaksızın 274 gün olmuştur [11]. |
| Siklofosfamid, toceranib, doksorubisin, 5-FU ve piroksikam gibi farklı ilaçlarla kombinasyon halinde kullanılabilir. Adenokarsinomu tedavi etmek için MWF’de 1,7 mg/kg PO toceranib ve diğer günlerde 2,5 mg/m2 PO siklofosfamid uygulanmış, sonuçta 1902 günlük sağkalım süresi elde edilmiş ve grade II anoreksi (toceranib) görülmüştür. Adenokarsinom vakalarında iki farklı doksorubisin ve siklofosfamid protokolü uygulanmıştır: ilkinde hasta 1. haftada 27 mg/m2 IV doksorubisin alırken, 2. ve 3. haftalarda hasta 2 güne bölünmüş 222 mg/m2 PO siklofosfamid almış ve amaçlanan beş döngüden ikisini yerine getirmiştir. Hayvan, bildirilen yan etkiler olmaksızın 101 günlük sağkalım süresine ulaşmıştır [11]; ikinci protokolde, metastaz varlığı nedeniyle ameliyattan sonraki 4 gün boyunca 25 mg/m2 IV doksorubisin ve 50 mg/m2 PO siklofosfamid kullanılmıştır. Bu hastaya tanı konulduktan 9 hafta sonra tekrarlayan kusma nedeniyle ötenazi uygulanmıştır. Köpek mide adenokarsinomunu tedavi etmek için 5-FU (150 mg/m2 IV)/siklofosfamid (2 haftada bir 4 gün boyunca 50 mg/m2 PO iki kür) kombinasyonu kullanıldığında, hasta sahibi kusmanın ilerlemesi nedeniyle tanıdan 9 hafta sonra ötenaziyi seçmiştir [4]. Gastrik adenokarsinomlu başka bir köpekte doksorubisin (25 mg/m2 IV), siklofosfamid (1. haftada 4 gün boyunca 75 mg/m2 PO) ve 5-FU (2. ve 3. haftalarda 8 kür 150 mg/m2 IV) kombinasyonuna ek olarak 3 haftada bir 6 saat boyunca iki kür 60 mg/m2 IV cis-platinumdan oluşan FAC protokolü kullanılmıştır. Hasta tanıdan 7,5 ay sonra akut anürik böbrek yetmezliği nedeniyle ölmüştür [4]. Birden fazla ameliyat geçiren gastrik adenokarsinomlu bir başka köpek hasta piroksikam (0,3 mg/kg/gün) ve siklofosfamid (15 mg/m2/gün) ile tedavi edilmiştir. Sağkalım süresi 1366 gün olmuş ve ölüm nedeni safra kesesi rüptürüne bağlanmıştır [38]. Başka bir protokol de endoskopik polipektomi ve 0,3 mg/kg/gün piroksikam ve 0,5-1,0 mg/kg/gün prednizolon uygulamasından oluşuyordu. Hayatta kalma süresi nüks olmaksızın 1250 gündü ve köpek çalışmanın sonunda hayattaydı [38]. 1.1.1. Kemoterapinin Etik Açıdan Doğurduğu Sonuçlar Günümüzde, evcil hayvanlar insan dünyasında önemli bir rol oynamaktadır. Bu tür hayvanların yaşamlarının kalitesi ve süresi arasındaki denge hassas bir konu olabilir, ancak evcil hayvan-sahip ilişkisinin son derece güçlü olması nedeniyle sahibi tarafından zor anlaşılabilir. Bu nedenle, son yıllarda kanserli hayvanların temel ve özel tedavi arayışlarında giderek artan bir talep görülmüştür [55-57]. İnsan-hayvan bağı, veteriner onkolojinin insan tıbbını takip etmesine ve benzerlik göstermesine ve hatta bazı evcil hayvan sahiplerinin acıyı dindirmek için bir araç olarak ötenaziyi reddetmesi ile sonuçlanmıştır [56,57]. Çoğu zaman, hastaların yaşam kalitesini korumak ve yaşam süresini uzatmak aynı anda mümkün olmamaktadır. Evcil hayvanlarda kanser tedavisi, evcil hayvan sahibi ile tedavinin potansiyel riskleri, faydaları, toksisitesi, maliyetleri ve harcanan süre hakkında yapılacak bir görüşme ile başlamalıdır [27]. Ağrı, çeşitli nedenlerden kaynaklanan duyusal, duygusal/hissi ve işlevsel unsurları bünyesinde barındırır ve öngörülemeyen bir süre boyunca devam edebilir. Köpeklerde ağrının değerlendirilmesi zor olabilir ve gastrointestinal sistemle ilgili olarak, ağrının lokalize edilmesi zor olabilir ve hayvan belirsiz semptomlar ve davranış değişiklikleri sergileyebilir [58,59]. Kanser hastaları kemoterapi, radyoterapi veya cerrahi gibi tedavi seçeneklerinin neden olduğu ağrıdan da muzdarip olabilir. Hayvanlarda kansere bağlı ağrı insidansını ve analjezik tedavinin etkinliğini tahmin etmek zordur. Bununla birlikte, bu vakalarda ağrının tanınması ve azaltılması, yaşam kalitesinin sürdürülmesi için çok önemlidir [9,58]. Genel olarak, primer tümör yeterli morbidite ile tamamen çıkarılabiliyorsa cerrahi en iyi tedavi yöntemidir. Ancak, bazı tümörlerin geniş tutulum nedeniyle çıkarılması zor olabilir [9,55]. Kemoterapi tümör yayılımını azaltmak veya önlemek için kullanılır, ancak terapötik indeksi sınırlıdır ve önemli veya ölümcül toksisiteye neden olabilir, bu nedenle bu tedavinin hayvan hastalarda prognoz ve sağkalım süresi üzerindeki olumsuz yan etkileri ve faydalı sonuçları değerlendirilmelidir [9,60]. Veteriner onkolojide, kemoterapötik ajanlar miligram/kilogram (mg/kg) veya metre kare başına miligram (mg/m2) olarak dozlanabildiğinden, doz hesaplamalarında hataların ortaya çıkması daha olasıdır. |
| Ayrıca, ırka özgü özellikler yan etkilere neden olabilir [9]. Yapılan bir çalışmada, hayvan sahiplerinin hayvanlarını tedavi etmek için kemoterapi kullanıp kullanmayacaklarını etkileyebilecek faktörler araştırılmıştır. Sahiplerin inancı, kemoterapi ile ilgili önceki deneyimleri ve olası faydalardan ziyade olumsuz etkilerin farkında olup olmadıklarının, hayvanlarında bu tedaviyi tercih edip etmemelerini etkileyebileceği öne sürülmüştür. Katılımcıların çoğunluğu tedavi sırasında ve sonrasında yaşam kalitesinde düşüş bekliyordu. Bununla birlikte, hayvan sahiplerinin çoğu kemoterapiden sonra hayvanlarının yaşam kalitesinde iyileşme olacağını düşünmüştür, ancak tedaviden sonra hayatta kalma süresi gereğinden fazla tahmin edilmiş ve bu da yanlış beklentilere yol açmıştır. Bununla birlikte, gereğinden fazla tahmin edilen sağkalım süresinin 3 aydan az olması halinde daha az sayıda hayvan sahibi bu tedaviyi seçecekti ki bu da hayvanların yaşam kalitesinin karar sürecinde önemli olduğunu göstermektedir. İlginç bir şekilde, hayvan sahipleri kemoterapiyi hayvanlarından ziyade kendi bakış açılarına göre seçmişlerdir. Bu nedenle, hayvan sahiplerinin kemoterapi prosedürü ve etkileri konusunda yaşam kalitesi, insidans ve yan etkiler üzerinde durarak aydınlatılması zorunludur, böylece rasyonel ve bilinçli seçimler yapabilirler [60]. 5. Sonuçlar ve Geleceğe Yönelik Beklentiler Sağkalım süresi, belirlenmesi kolay olduğu için sıklıkla birincil sonlanım noktası olarak kullanılır. Bununla birlikte, veteriner onkolojisinde, tedavinin başlatılmasının geciktirilmesi veya ötenazi gibi hasta sahibi tarafından belirlenen faktörlerden de etkilenebilir [44]. Sağkalım süresi, intraoperatif komplikasyonlar ve adjuvan kemoterapi uygulanması gibi farklı prognostik faktörlerden de etkilenebilir. Çoğu vakada, adjuvan kemoterapi sağkalım süresinde iyileşme ile bağlantılı bulunmuştur. Bununla birlikte, mevcut veriler çoğunlukla retrospektif çalışmaların sonucu olduğundan ve analiz edilen tedaviler randomize olmadığından dikkatli bir şekilde yorumlanmalıdır. Bu nedenle, mevcut sonuçlar tedavi tercihinde seçim yanlılığından veya ötenazinin zamanlamasından etkilenmiş olabilir. Ek olarak, bu son faktör, ötenaziyi düşünmeden önce daha uzun süreli tedaviye izin vererek, hasta sahibinin kemoterapiyi sürdürme isteğine bağlı olabilir [11]. Ayrıca, klinik belirtilerin nüksetmesinin MK progresyonu ile ilişkili olduğu varsayılmıştır [4]. Bu çalışmaların bazı kısıtlamaları arasında küçük örneklem (köpek MK’sinin nadir görülmesi nedeniyle), hastalığın klinik evresine ilişkin bilgi eksikliği ve cerrahi prosedür protokolündeki varyasyonların yanı sıra tedavinin denendiği vakaların çoğunda postmortem incelemelerin yapılmamış olması yer almaktadır [4,11,38]. Öte yandan, spesifik kemoterapötik protokollerin etkinliği, her vakada kullanılan ilaçlar, doz, süre ve sıklıktaki farklılıklar nedeniyle analiz edilememiş, bu da köpek MK’sini tedavi etmek için güvenilir ve etkili bir kemoterapötik protokolün belirlenmesini zorlaştırmıştır. Ayrıca, vakaların sınırlı olması ve hem klinisyenler hem de patologlar tarafından sağlanan bilgilerin tutarsızlığı ve öznelliği nedeniyle histolojik özellikler ve sonuç ile anlamlı ilişkiler değerlendirilememiştir. Ancak bu bulgular, köpek MK’sinin tedavisinde kemoterapinin rolüne odaklanan ek araştırmaları haklı çıkarmaktadır [11]. Gelecekte yapılacak çalışmalar cerrahi ve histolojik sınırları ve histopatolojik özellikler ile köpek MK biyolojik davranışı arasındaki ilişkiyi değerlendirmeli, ayrıca cerrahi ve adjuvan tedavi kombinasyonunun MK’li köpeklerde daha iyi bir sonuca götürüp götürmeyeceğini araştırmalı ve büyük olasılıkla bu vakalarda hedef tedaviyi içermelidir [11,12]. İnsanlarda kemoterapi sağkalımı iyileştirir ve kombinasyon tedavileri de tek ajan tedavisine kıyasla sağkalımı iyileştirir. HER-2-pozitif tümörlerle hedef tedaviye tabi tutulan hastalarda, kapesitabin ile kombinasyon halinde trastuzumab veya sisplatin ile kombinasyon halinde 5-FU kullanan protokollerin faydalı olduğu kanıtlanmıştır. Tümörleri HER-2 negatif olan hastalar için, irinotekan, dosetaksel, oksaliplatin veya oral 5-FU gibi iki ve üç ilaç kombinasyonlu protokoller, ilerlemiş mide kanserinde etkili tedavi seçenekleridir [61]. Çoğu tek bir hastayı içeren çok az sayıda vaka bildirildiği için, köpek MK’sinde postoperatif kemoterapiye verilen yanıtı doğru bir şekilde değerlendirmek zordur. |
| Bu nedenle, in vitro modeller kullanarak ön ve kapsamlı çalışmalar yapmak son derece önemlidir. Antikanser ilaçların kanser hücre hatları kullanılarak test edilmesi, sitotoksisite değerlendirme testlerinden başka avantajlar da sunar, çünkü araştırmacıların ilaçların ve bunların kombinasyonlarının etkilerini analiz etmelerine ve direnç/duyarlılık taraması yapmalarına olanak tanır. Kanser hücre hatlarındaki araştırmaların sonuçları genellikle in vivo tümörlere ekstrapole edilir veya bu tümörlerde test edilir [62] ve hasta yönetimindeki diğer adımlar hakkında faydalı bilgiler sağlayabilir. Sonuçların iyileştirilmesi, MK’ye özgü tedavi stratejisinin geliştirilmesine ve bu hastalıkla ilişkili olumsuz tedavi etkilerini, ağrıyı ve rahatsızlığı azaltarak yaşam kalitesini iyileştirmek ve onkoloji yönetiminde bir modalite olarak adjuvan tedavi şemalarına bağlıdır [9]. Tamamlayıcı Materyaller: Aşağıdaki destekleyici bilgiler şu adresten indirilebilir: https://www. mdpi.com/article/10.3390/vetsci9080383/s1, Şekil S1: Köpek mide kanseri tedavisinde kullanılan ilaç bileşiklerinin kimyasal yapısı. Katkıda Bulunan Yazarlar: Kavram geliştirme, N.V. ve I.A.; metodoloji, D.A. ve I.C.; yazılım, N.V.; doğrulama, I.A. ve N.V.; araştırma, D.A. ve I.C.; kaynaklar, N.V. ve I.A.; yazı-orijinal taslak hazırlama, D.A.; yazı-inceleme ve düzenleme, I.C, I.A. ve N.V.; denetim, N.V. ve I.A.; proje yönetimi, N.V. ve I.A.; fon sağlama, N.V. ve I.A. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir. Finansman: Bu araştırma, COMPETE 2020-Rekabetçilik ve Uluslararası İlişkiler Operasyonel Programı (POCI), Portekiz 2020 ve IF/00092/2014/CP1255/CT0004 projesi çerçevesinde Fundafao para a Ciencia e a Tecnologia (FCT) aracılığıyla Portekiz fonları ve FMUP Onko-İnovasyon CHAIR aracılığıyla FEDER (Fundo Europeu de Desenvolvimento Regional) fonları tarafından finanse edilmiştir. Hsatane Etik Kurulu Beyanı: Mevcut değil. Bilgilendirilmiş Onam Beyanı: Mevcut değil. Veri Erişim Beyanı: Mevcut değil. Teşekkürler: Bu makale, CINTESIS Ar-Ge Birimi (referans no. UIDB/4255/2020) bünyesindeki FCT (Fundaao para a Ciencia e a Tecnologia, I.P.) aracılığıyla ulusal fonlar tarafından desteklenmiştir. Şekil 2’nin çizimindeki işbirliği için Mario Ribeiro’ya teşekkür ederiz. Çıkar Çatışması Beyanı: Yazarlar herhangi bir çıkar çatışması beyan etmemektedir. Kaynakça 1. Hugen, S.; Thomas, R.E.; German, A.J.; Burgener, I.A.; Mandigers, P.J.J. Gastric carcinoma in canines and humans, a review. Vet. Comp. Oncol. 2017,15, 692-705. [CrossRef] [PubMed] 2. Patnaik, A.K.; Hurvitz, A.I.; Johnson, G.F. Canine gastrointestinal neoplasms. Vet. Pathol. 1977,14, 547-555. [CrossRef] [PubMed] 3. Fonda, D.; Gualtieri, M.; Scanziani, E. Gastric carcinoma in the dog: A clinicopathological—Study of 11 cases. J. Small Anim. Pract. 1989, 30, 353-360. [CrossRef] 4. Swann, H.M.; Holt, D.E. Canine Gastric Adenocarcinoma and Leiomyosarcoma: A Retrospective Study of 21 Cases (1986-1999) and Literature Review. J. Am. Anim. Hosp. Assoc. 2002, 38, 157-164. [CrossRef] 5. Seim-Wikse, T.; Jorundsson, E.; N0dtvedt, A.; Grotmol, T.; Bjornvad, C.R.; Kristensen, A.T.; Skancke, E. Breed predisposition to canine gastric carcinoma—A study based on the Norwegian canine cancer register. Acta Vet. Scand. 2013, 55, 25. [CrossRef] 6. Simpson, K.W. Diseases of the stomach. In BSAVA Manual of Canine and Feline Gastroenterology, 2nd ed.; Edward, J., Hall, J.W.S., Williams, D.A., Eds.; British Small Animal Veterinary Association: Gloucester, UK, 2005; pp. 151-175. 7. Bray, J.; Neiger, R. Tumours of the stomach. In BSAVA Manual of Canine and Feline Oncology, 3rd ed.; Dobson, J.M., Lascelles, B.D.X., Eds.; British Small Animal Veterinary Association: Gloucester, UK, 2011; pp. 208-211. 8. Canzonieri, V.; Giordano, A. Gastric Cancer In The Precision Medicine Era; Springer: Cham, Switzerland, 2019. 9. Biller, B.; Berg, J.; Garrett, L.; Ruslander, D.; Wearing, R.; Abbott, B.; Patel, M.; Smith, D.; Bryan, C. 2016 AAHA Oncology Guidelines for Dogs and Cats. J. Am. Anim. Hosp. Assoc. 2016, 52, 181-204. [CrossRef] 10. Lana, S.E.; Dobson, J.M. Principles of chemotherapy. In BSAVA Manual of Canine and Feline Oncology, 3rd ed.; Dobson, J.M., Lascelles, B.D.X., Eds.; British Small Animal Veterinary Association: Gloucester, UK, 2011; pp. 60-79. 11. Abrams, B.; Wavreille, V.A.; Husbands, B.D.; Matz, B.M.; Massari, F.; Liptak, J.M.; Cray, M.T.; de Mello Souza, C.H.; Wustefeld- Janssens, B.G.; Oblak, M.L.; et al. Perioperative complications and outcome after surgery for treatment of gastric carcinoma in dogs: A Veterinary Society of Surgical Oncology retrospective study of 40 cases (2004-2018). Vet. Surg. 2019, 48, 923-932. [CrossRef] |