| Veteriner Patoloji 48(1) 73-84 ª Amerikan Veteriner Patologlar Akademisi 2011 Yeniden basım ve izin: sagepub.com/journalsPermissions.nav Bu makalenin İngilizce versiyonu için: DOI: 10.1177/0300985810388820 http://vet.sagepub.com 1Veteriner Hekimliği Fakültesi, Sidney Üniversitesi, Sidney, Yeni Güney Galler, Avustralya |
| Özet Yumuşak doku sarkomları (YDS’ler) yumuşak dokuların mezenkimal hücrelerinden köken alır ve genellikle köpeklerin deri ve deri altı bölgelerinde görülürler. Fenotipik olarak çeşitlilik göstermelerine ve histogenezlerinin genellikle tartışmaya açık olmasına rağmen, YDS’ler mikroskobik ve klinik olarak benzer özelliklere sahip oldukları için aynı grupta değerlendirilirler. Rezeksiyonu takiben, lokal nüks oranları genel olarak düşüktür, ancak bu oran histolojik grade ve cerrahi sınırların tamlığına göre değişir. Tam sınırlı cerrahi neticesinde nüks beklenmez. “Dar” sınırlara sahip çoğu I. evre YDS’ler bile nüks etmez, ancak nüks eğilimi hastalığın evresi ile birlikte artar. Metastaz sıklığı kesin olarak tahmin edilememiştir, ancak I. evre YDS’ler söz konusu olduğunda nadir olduğu ve III. evre YDS’lerde görülme olasılığının yüksek olduğu düşünülmektedir. Bununla birlikte, metastaz mutlaka kötü sağkalım ile aynı anlama gelmemektedir. Yüksek mitotik indeks sağkalım süresinin kısalmasında prognostiktir. Cerrahi sınırların tam olması ile ilişkili olarak nüks oranları ve sağkalım konusunda daha kesin tahminler yapabilmek ve evreler arasındaki metastatik oran ile ortalama sağkalım süresindeki potansiyel farklılıkları tanımlayabilmek için daha fazla araştırmaya ihtiyaç vardır. Halihazırda daha fazla araştırma gerektiren diğer potansiyel prognoz göstergeleri arasında histolojik tip, tümör boyutu, yerleşim yeri, invazivlik, evre, hücresel proliferasyon belirteçleri ve sitogenetik profiller yer almaktadır. Prognostik faktör değerlendirmesini sınırlayan başlıca sorunlar arasında retrospektif çalışmalardan kaynaklanan yanlılıklar, küçük örneklem boyutları, metastazın yetersiz doğrulanması, YDS’nin birbiriyle tutarsız şekilde sınıflandırılması ve terminolojinin doğru kullanılmaması, YDS fenotipinin ayırt edilmesindeki güçlükler ve çalışma popülasyonunun çeşitliliği (hastalığın evresi ve tedavi durumu) yer almaktadır.Anahtar Kelimeler: kanser, köpek, neoplazi, sarkom, prognostik, veteriner onkoloji |
| Yumuşak doku sarkomları (YDS’ler) yumuşak bağ dokularından köken alan mezenkimal neoplazmlardır. Vücudun herhangi bir anatomik bölgesinde ortaya çıkabilirler, en çok kutanöz ve subkutanöz dokularda görülürler. YDS’ler köpeklerdeki tüm kutanöz ve subkutanöz tümörlerin %8 ila 15’ini oluşturur ve özellikle orta yaş ile yaşlı, orta ila büyük ırk köpekler arasında yaygındır.18,33, Bu tümörlerin çoğu lokal olarak ekspansildir ve fasiyal düzlemler arasında büyür.33Genellikle bir kapsüle benzeyen ancak peritümöral bağ dokusunun sıkışmasıyla oluşan ve tümör hücreleri içerebilen veya tümör hücreleriyle birleşebilen bir psödokapsül ile çevrilidir. Kutanöz ve subkutanöz YDS’ler düşük ila orta düzeyde cerrahi sonrası nüks oranına (bildirilen aralıklar %7 ila %30’dur)7,42 ve düşük metastatik orana (bildirilen vakaların %17’sine kadar) sahiptir.11,32,33 Köpek kutanöz ve subkutanöz YDS’leri için tercih edilen tedavi cerrahi eksizyondur.17,19,22,33 Küratif amaçlı cerrahi, primer tümörün, psödokapsülün ve geniş bir normal doku kafının cerrahi olarak eksize edilmesini gerektirir. Eksizyonu takiben genel ortalama sağkalım süresi uzundur (bildirilen aralıklar 1.013 ila 1.416 gündür),11,32 ve hasta köpekler genellikle yaşlı olduğundan, YDS’ye bağlı ölüme yenik düşmeden önce genellikle diğer nedenlerden ölürler.5,11,32,40,50 Çoğu köpekte kutanöz ve subkutanöz YDS iyi bir prognoza sahip olsa da, biyolojik davranış aralığı geniştir. Hasta sahibinin endişelerini gidermek ve radikal cerrahi, ek radyasyon ve/veya kemoterapi gibi daha agresif tedavi yaklaşımlarından fayda görebilecek hastaları seçmek için doğru prognostik bilgilere ihtiyaç vardır. Bu nedenlerle, çeşitli potansiyel prognostik ve prediktif faktörler üzerinde çalışılmıştır ve bunlardan bazıları artık YDS’lerin klinik yönetimi için çok önemlidir. Bu derlemenin amacı, köpeklerde kutanöz ve subkutanöz YDS’ler için prognostik ve prediktif faktörleri değerlendiren çalışmalarda yapılan keşifleri ve karşılaşılan zorlukları özetlemektir. |
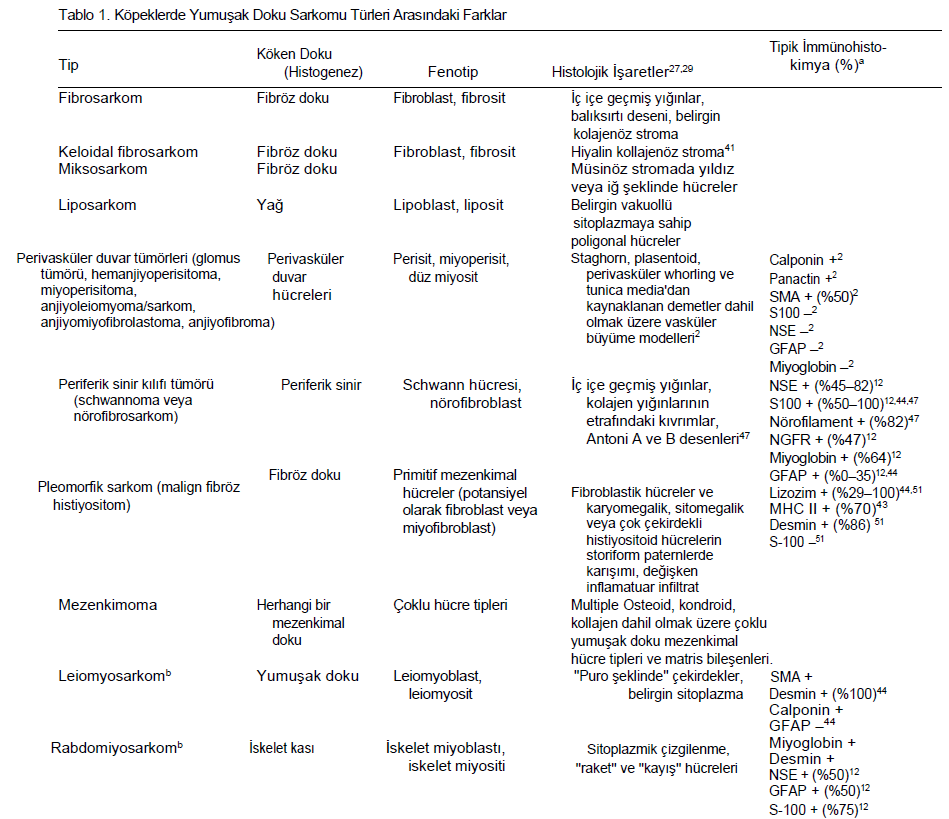
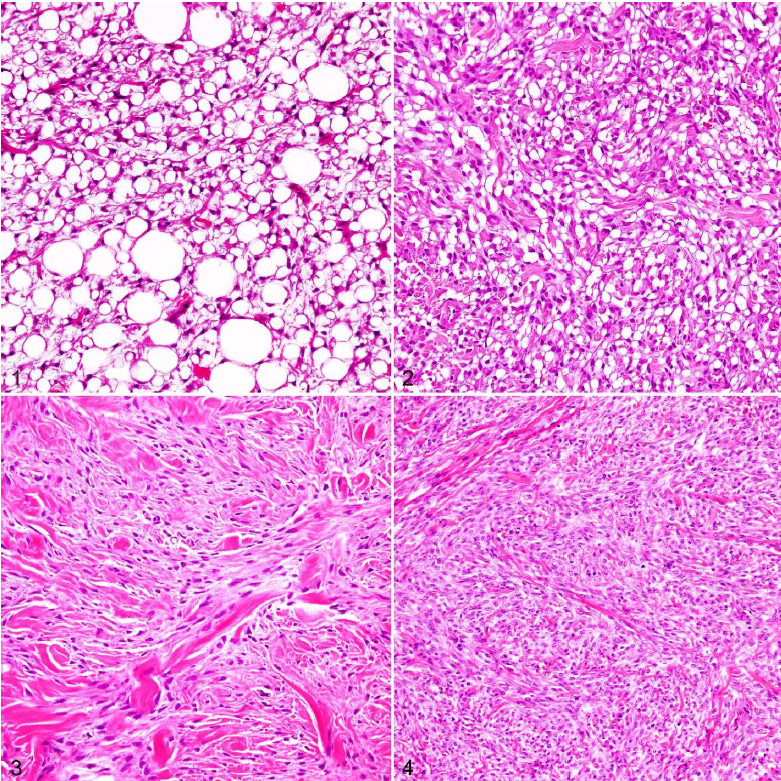
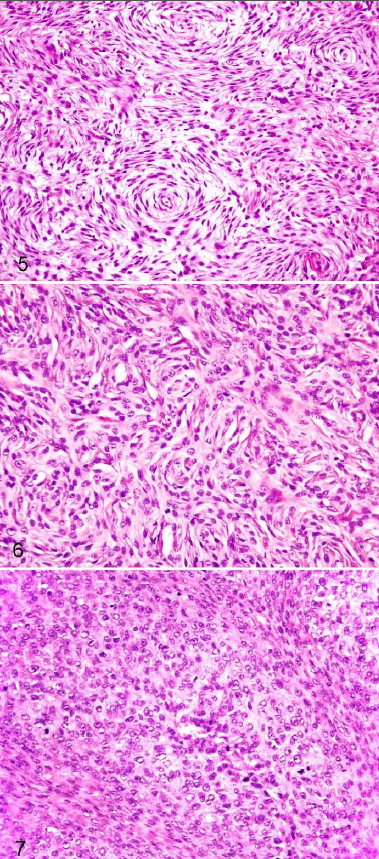
YDS TerminolojisiYDS’ler heterojen bir dizi neoplazmı kapsar ve baskın histolojik özelliklere bağlı olarak, ideal olarak varsayılan fenotip veya köken dokuya göre daha da kategorize edilebilir. Bununla birlikte, benzer histolojik özelliklere sahip oldukları ve benzer biyolojik davranışa sahip olduklarına inanıldığı için köpeklerde yaygın olarak bir grup olarak kabul edilirler.7,11,32 Bu yaklaşım basitliği teşvik etmek için tasarlanmıştır; ancak YDS terminolojisinin tutarsız kullanımı ve tümör sınıflandırması ile histogenez arasındaki korelasyonun zayıf olması veteriner hekimlerin ve teşhis koyanların kafasını karıştırmaktadır. Hem tanısal hem de prognostik çalışmalarda geleneksel olarak köpek kutanöz ve subkutanöz YDS gruplandırmasının dışında tutulan yumuşak dokudan köken alan birkaç mezenkimal neoplazm vardır. Histiyositik sarkom, lenfanjiosarkom, hemanjiosarkom, sinovyal hücreli sarkom, leiomyosarkom, rabdomyosarkom, ağız boşluğunu tutan fibrosarkomlar ve brakiyal pleksus periferik sinir kılıfı tümörlerini içeren bu neoplazmlar (PNST’ler; schwannomlar, nörofibromlar12 veya sinir kılıfı tümörleri16 olarak da adlandırılır)-, mikroskobik özellikler ve/veya anatomik konumla tutarlı bir şekilde ayırt edilebildikleri ve bir grup olarak daha kötü huylu biyolojik davranış sergiledikleri için özellikle YDS grubundan hariç tutulmaktadır.8,11,17,19,32,33,35,40,50 Bu nedenle, kutanöz ve subkutanöz köpek tümörlerine uygulandığında, yumuşak doku sarkomu terimi grup olarak dışlayıcı bir tanı haline gelmektedir. Bu, insan YDS’leri için dışlayıcı olmayan gruplandırma şemasının aksine bir durumdur.52 Veteriner hekimlerin ve prognostik çalışmaların genellikle YDS’lere dahil ettiği mezenkimal neoplazmlar arasında PNST’ler (nonbrakiyal pleksus), fibrosarkom, miksosarkom, liposarkom, perivasküler duvar tümörleri, pleomorfik sarkom (malign fibröz histiyositom [MFH] olarak da adlandırılır), malign mezenkimom ve farklılaşmamış sarkom bulunur. PNST’ler köpeklerde en sık görülen kutanöz ve subkutanöz YDS türü olabilir.32 Daha önce hemanjiyoperisitom olarak adlandırılan çoğu köpek tümörü artık PNST12 veya perivasküler duvar tümörü olarak kabul edilmektedir, ancak histogenez tartışmaya açıktır36,44 ve bu terimlerin kullanımı uluslararası veteriner patoloji topluluğu içinde tutarlılık göstermemektedir. Hemanjioperisitomların artık perivasküler duvar tümörlerinin küçük bir alt kümesi olduğuna inanılmaktadır,2 ancak bunların immünohistokimya olmadan PNST’lerden ayırt edilmesi zor olabilir.2 Köpek kutanöz ve subkutanöz YDS’lerini ışık mikroskobik düzeyde birbirinden ayırmak zordur çünkü demetler, akıntılar ve kıvrımlar oluşturan iğsi veya fuziform mezenkimal hücrelerin yanı sıra hücreler arası kolajen matriks ortak bileşenlerdir.27,29 Patologlar fenotipi belirlemek için bir tümör içinde olgun bir dokuya benzeyen alanlara veya belirli hücresel belirteçlerin ekspresyonuna bakarlar (Tablo 1). Bununla birlikte, bu YDS’ler sıklıkla birden fazla histolojik model sergiler ve histolojik modeller ve immünohistokimyasal özellikler herhangi bir hücre tipine özgü olmayabilir.2,12,56 Şu anda farklı türleri kesin olarak ayıran tutarlı bir immünohistokimyasal boya veya boya grubu bulunmamaktadır. Fenotipik farklılaşmanın karmaşıklığı, bazı yazarların bu neoplazmların topluca yumuşak dokunun köpek iğsi hücreli tümörleri olarak değerlendirilmesi gerektiği sonucuna götürmüştür.11,26,44,56 YDS için bunun gibi alternatif isimlerin popülerlik kazanmasının nedeni, çoğu yaşamı tehdit etmeyen ve metastaz yapmayan neoplazmlar için sarkom teriminin kullanımı konusunda tartışmalar olması ve yumuşak dokunun iyi huylu mezenkimal tümörlerinin bazı formlarının düşük evreli kötü huylu muadillerinden ayırt edilmesindeki belirsizliktir. Örneğin, benign ve malign PNST’ler farklı varlıklar olarak tanımlanmıştır,12,26,27,29 ancak malignitenin histomorfolojik özellikleri ile biyolojik davranışları arasındaki ilişkiyi doğrulayan hiçbir çalışma yoktur. Bazı patologlar, daha fazla sınıflandırılamayan YDSlerin yalnızca bir alt kümesine atıfta bulunmak için alternatif terminoloji kullanmaktadır.11,25,28,49 |
Köpek YDS Prognostik Çalışmalarında KısıtlamalarÇok sayıda çalışma köpek YDS’leri için prognostik ve prediktif faktörleri açıklamaktadır, ancak bunların çok azında YDS prognozunu iyileştirmeyi amaçlayan düzgün bir şekilde uygulanmış sağkalım analizi bulunmaktadır. Aslında, YDS’nin prognozuna ilişkin bilgilerin çoğu, iki veya daha fazla tedavinin etkisini karşılaştırmak gibi başka amaçlar için tasarlanmış çalışmalardan elde edilmiştir.11,23,28,38,46,48 Bu çalışmalarda amaç, sadece prognostik değişkenleri değerlendirmek yerine bir tedavi stratejisini incelemektir. Bu çalışmalar, prognostik değişkenlerin ölçümünü zorlaştıran çeşitli seçim ve tedavi yanlılıklarına açıktır. Ayrıca, köpek YDS için prognostik faktörleri inceleyen çalışmaların çoğu, şüpheli istatistiksel güce sahip sınırlı örneklem boyutlarını (yani, <100 köpek) içerir.3–6,8, 23– 25,28,32,34, 36–39, 45, 46, 49–51 Bu çalışmalar, özellikle birçoğu çalışma popülasyonunda meydana gelen olay sayısına göre gereğinden fazla sayıda prognostik değişkeni değerlendirdiği için, hastalık sonuçlarında prognostik herhangi bir faktöre atfedilebilecek istatistiksel olarak anlamlı farklılıkları tespit edememiş olabilir.55 Metastaz veya nüks oranlarına ilişkin tahminler de bu çalışmalarda kesin değildir. Buna ek olarak, köpek YDS için prognostik faktörleri değerlendiren çalışmaların çoğu retrospektif olarak yapılmıştır.3,5,7,11,23,32,46,48-50 Bu çalışmalar, takibin kesilmesi, orijinal slaytların gözden geçirilememesi,11 standart tedavi ve/veya takip protokollerinin olmaması, metastazın doğrulanamaması ve tümör boyutunun doğru bir, şekilde ölçülememesi gibi çeşitli yanlılıklar ve sınırlamalar55 nedeniyle sorun yaratabilir.48 YDS prognostik çalışmalarının bir diğer yaygın dezavantajı, çok değişkenli analiz eksikliğidir.4,5,7,11,20,25,37,40,46,49,50 Bu çalışmalarda, çok sayıda prognostik değişken, diğer prognostik değişkenlerin etkileri için herhangi bir ayarlama yapılmaksızın bağımsız olarak incelenmiştir. Çalışmalar arasında köpek YDS’lerinin gruplandırılma biçiminde bazı farklılıklar vardır. Örneğin, bazı çalışmalar visseral YDS’leri,4,34,48 bazı çalışmalar ise histiyositik sarkomları,25,48 leiomyosarkomları,48 hemanjiosarkomları,18 ve sinovyal hücreli sarkomları kapsamaktadır.45,48 Bu durum prognostik faktörlerin değerlendirilmesini zorlaştırmaktadır çünkü bu neoplazmların çoğu konvansiyonel kutanöz ve subkutanöz YDS’lerden daha agresif davranmaktadır. Son olarak, bazı çalışmalarda doğal hastalık geçmişi açısından hastalar arasında farklılıklar bulunmaktadır (örneğin, tümörün mevcut olduğu sürenin uzunluğu, tekrarlayan tümörleri veya tespit edilebilir metastazı olan hastaların dahil edilmesi);5,23,46 bunlar hastalarda prognoz açısından gerçek farklılıkları tespit etmekte başarısız olmuş olabilir. |
| Veteriner onkolojik prognostik çalışma yürütme standartları yakın zamanda ayrıntılı şekilde tanımlanmıştır.55Yukarıda açıklanan temalar, bu standartlara uymanın zorluğunu göstermekte ve aynı zamanda köpek YDS tanısı için kullanılan prognostik değişkenleri daha yakından değerlendirme ihtiyacını ortaya koymaktadır. Birçok çalışma metodolojik titizlikten yoksun olsa da, tutarlı bir şekilde gözlemlenen eğilimleri tanımlamak yine de bilgilendiricidir. Bu nedenle, bu tür çalışmalar bu derlemeye dahil edilmiş ve gerekli yerlerde sınırlamalar belirtilmiştir. Özetlenen eğilimlerin, usulüne uygun çalışma tasarımı ve analizi kullanılarak yapılan araştırmaların yerini alamayacağı belirtilmiştir. Köpek YDS prognostik araştırmalarından kaynaklanan birçok belirsizlik çözülmeyi beklemektedir ve gelecekteki çalışmaların bunu yapmak için gerekli yöntemlere uyması zorunludur. |
Prognostik ve Prediktif FaktörlerKöpek YDS için histolojik tip, histolojik grade, tümör boyutları, tümör yerleşimi, önceki tedavi, klinik olarak açıkça görülen invazivlik ve cerrahi sınırların tamlığı dahil olmak üzere çeşitli prognostik ve prediktif faktörler kronik olarak klinik ortamda değerlendirilmiştir.17,19,22,33 Bununla birlikte, aşağıda ele alındığı gibi, genel olarak prognostik öneme sahip olduğundan şüphelenilen birçok faktör için bilimsel kanıtlar sınırlı iken, diğerleri için ikna edici kanıtlar bulunmaktadır. Hiçbir faktör bir YDS’nin sonucunu tutarlı bir şekilde tahmin edemez; bu nedenle, YDS tedavisini belirlemek için tek bir faktör kullanılamaz. |
Histolojik Tipİnsanlarda, tüm YDS’ler tarihsel bir şekilde prognoz belirleme amacıyla bir grup olarak ele alınmıştır; ancak, toplanan kanıtlar YDS tiplerinin benzersiz biçimde yayılma, nüks ve prognoz paternleri sergilediğini göstermektedir.9,15 Birkaç çalışma histolojik tipi köpek YDS’si için potansiyel bir prognostik faktör olarak kabul etmiştir, ancak hiçbiri YDS tipleri arasında hastalığın ilerleyişindeki ayrıntılı farklılıkların titizlikle ölçülmesi için gerekli yöntemleri uygulamaya koymamıştır. Ayrıca, bu çalışmaların hiçbiri YDS tipinin ayrımı için ayrıntılı yöntemler sunmamıştır. Bazı çalışmalarda farklı YDS tipleri arasında sağkalım süresi veya lokal nüks açısından anlamlı farklılıklar bulunmamıştır, ancak az sayıda hayvan üzerinde çalışıldığı ve bazı YDS tipleri (özellikle pleomorfik sarkom [MFH], liposarkom ve miksosarkom) için örneklem büyüklüğü sınırlı olduğu için bu farklılıkları tespit etmek için istatistiksel potansiyel tartışma konusudur.37,39,48,49 Yapılan bir çalışmada, YDS tipi (malign PNST’ye karşı diğer tipler) mitotik indeks (MI) veya evreye göre belirlendiğinde tümör rekürrensi veya metastazı için prognostik nitelik taşımamıştır.32 YDS tipi ile MI ve/veya evre arasındaki bağlantılar, eğer varsa, YDS tipleri arasındaki farklı davranışın yüksek evre ve/veya MI açısından görülen farklı eğilimlere atfedilebileceğini düşündürmektedir.7,23,32 Bazı çalışmalar fibrosarkomun daha kötü prognoza sahip olabileceğini veya PNST’nin diğer YDS tiplerine göre daha iyi prognoza sahip olabileceğini gösteren bazı trendler ortaya koymuştur;3,5,7,25,37 ancak prognozdaki farklılıkları doğrulamak ve ölçmek için sağlam analitik yöntemlere ihtiyaç vardır. YDS tiplerinin benzer şekilde davranma derecesi şu anda bilinmemektedir ve prognozda gerçek farklılıklar olması mümkündür. Ancak, farklılıklar klinik olarak belirgin değildir; bu nedenle, YDS tipinin bu tümörlerin klinik tedavisinde şu anda çok az etkisi vardır.17,33 Potansiyel farklılıkları tespit etmede atılacak adımlardan biri, doğru sınıflandırma için yöntemler belirlemektir. Son çalışmalar, pleomorfik sarkom (MFH),43,51 keloidal fibroma ve fibrosarkom,41 liposarkom,4 perivasküler duvar tümörleri,2 ve PNST’ler gibi farklı YDS tiplerini incelemiş veya daha iyi tanımlamaya çalışmıştır.26,47 Bu çalışmalar, STS tipleri arasında histolojik paternler bakımından önemli ölçüde benzerlik gösterse de terminoloji ve tanı kesinliğini artırmaktadır. Her YDS tipi kategorisinde yeterli sayıda doğru sınıflandırılmış tümör genelinde prognozu karşılaştıran çalışmalara ihtiyaç vardır. Bu tür çalışmalar, dondurulmuş kesitlere uygulananlar da dahil olmak üzere geniş bir immünohistokimyasal marker panelinin prospektif olarak kullanılmasını gerektirmektedir.2 Patologlar arasında, çeşitli YDS tiplerinde tanısal terimlerin yaygın ve tutarsız şekilde kullanımı söz konusudur. Örneğin, PNST, perivasküler duvar tümörleri ve hemanjiyoperisitom tanıları tutarlı bir şekilde konulmamakta, bazı patologlar bir terimi diğerine tercih etmektedir. Veteriner onkologlar ve patologlar, translasyonel önemi açık olan prognostik araştırmalar ve bilgi birikimine kolayca entegre edilebilecek sonuçlar üreteceklerse, çalışmaların doğru bir şekilde karşılaştırılabilmesi için STS tiplerinin tutarlı bir şekilde (tercihen STS Nomenklatürü altında açıklandığı şekilde) sınıflandırılması gerekir. |
Rezeksiyon Derecesi ve Cerrahi Sınırların TamlığıLokal tümör nüksünü önlemek için, YDS için kullanılan geleneksel cerrahi öneriler kas-iskelet sistemi tümörlerinin Enneking sınıflandırmasını21 takiben yapılır ve küratif amaçlı ameliyatlar tipik olarak “geniş” veya “radikal” eksizyon gerektirir.17,19,33 YDS’nin geniş eksizyonunda, tümörün palpe edilebilen kenarından 30 mm lateral ve bir fasiyal düzlem veya 30 mm doku derinliği elde edilmeye çalışılır, ancak yine de kitle ile aynı anatomik bölgede kalınır. Radikal eksizyon, tipik olarak kas, kemik ve/veya uzuv dahil olmak üzere tümörü içeren tüm parçanın çıkarılmasıdır. Rezeksiyon derecesine atıfta bulunmak için kullanılan diğer terminoloji dar eksizyon (değişik şekillerde tanımlanabilir ancak genellikle kitleyi çevreleyen <3 mm normal doku anlamına gelir) ve marjinal eksizyonu (diseksiyon düzlemi psödokapsülden geçer) ifade eder. Trendler, geniş veya radikal eksizyonla çıkarılan YDS’lerin en düşük nüks oranına sahip olduğunu,6 dar eksizyonla nüksün daha sık ve marjinal eksizyonla en sık görüldüğünü göstermektedir;11 ancak istatistiksel olarak anlamlı farklılıklar henüz ortaya konmamıştır. Marjinal olarak eksize edilen YDS’lerde lokal nüks yine de oldukça yaygındır; birinci basamak tedavi ve sevk edilen kurumlarda marjinal olarak eksize edilen tümörler için sırasıyla 45’te 13 (%29)11 ve 27’de 10 (%37)10 olarak bildirilmiştir. Rezeksiyon derecesi ile sağkalım arasında nasıl bir ilişki olduğu henüz net olarak kanıtlanmamıştır. |
| Her ne kadar birkaç çalışma tarafından araştırılmış10,11,39,50 ve liposarkomlu köpeklerin tek değişkenli analizinde sağkalım bakımından önemli bir prognostik faktör olduğu görülmüş olsa da,4 çok değişkenli analizde incelenen prognostik değişkenler için yeterli sayıda olay içeren kapsamlı çalışmalara ihtiyaç vardır. Rezeksiyon derecesinin hasta sağkalımı üzerinde kayda değer bir etkisinin olmaması, tümör hastada fiziksel bozukluğa neden olmadığı sürece amputasyon gibi radikal tedaviye ihtiyaç olup olmadığını sorgulamaya neden olacaktır. Rezeksiyon derecesinin (ameliyat sırasında makroskopik olarak değerlendirilen) cerrahi sınırların tamlığına (biyopsinin işlenmesinin ardından mikroskopik olarak değerlendirilen) ne ölçüde karşılık geldiğine dair çok az araştırma yapılmıştır, ancak tam olmayan cerrahi sınırlar sıklıkla intralezyonel, marjinal veya dar yöntemlerle eksize edilen kitlelere karşılık gelmektedir.3,5,10 Bildiğimiz kadarıyla, hiçbir çalışma cerrahi sınırların tamlığını sürekli değişken şeklinde değerlendirmemiştir (yani, neoplastik hücreler ile cerrahi olarak oluşturulan kesit kenarı arasındaki minimum mesafe). Bunun yerine, cerrahi sınırların tamlığı kategorik değişken olarak değerlendirilmiştir ve kategorileri tanımlamak için kullanılan yöntemlerde geniş bir çeşitlilik vardır. Tam olmayan (”kirli”) sınırlar genellikle cerrahi sınırlarda neoplastik hücrelerin bulunması şeklinde tanımlanır; ancak bazı çalışmalarda cerrahi sınırların 1 mm içinde neoplastik hücrelerin bulunduğu tümörler de dahil edilmiştir.48 Yakın (“marjinal” veya “dar” olarak da adlandırılır) sınırlar, cerrahi sınırların ≤ 1 mm’si içinde neoplastik hücreler veya psödokapsül dışında doku olmaması;40 cerrahi sınırdan 1 ila 3 mm uzakta neoplastik hücreler;50 cerrahi sınırın < 5 mm’si içinde neoplastik hücreler;6 ve cerrahi sınırın < 10 mm’si içinde neoplastik hücreler olarak değişken şekilde tanımlanmıştır.48 Tam sınırlar, cerrahi sınırdan ≥ 1 mm mesafede tümör psödokapsülü;40 cerrahi sınırdan > 3 mm mesafede neoplastik hücreler;3,50 cerrahi sınırdan > 5 mm mesafede neoplastik hücreler;6 ve cerrahi sınırdan > 10 mm mesafede neoplastik hücreler (geniş) olarak değişken şekilde tanımlanmıştır.48 Bazı çalışmalar, cerrahi sınırların tamlığının nasıl kategorize edildiğine dair çok az ayrıntı vermektedir.11,46 Çalışmalar arasında bu kadar geniş çaplı farklılıklar olduğunda ve yöntemler kıyas kabul etmediğinde araştırma bulgularını tanı amaçlı kullanıma dönüştürmek çok zordur. Çalışmalar arasında tutarlılığı artırmak için, marjların tamlığını inceleyen araştırmacıların bunları sürekli değişken olarak ele almaları önerilir. Kategorik değişken kullanılması gerekiyorsa, marjin değerlendirmesinde prognostik önemin bulunduğu çalışmalarda kullanılan yöntemlere göre aşağıdaki terminolojinin kullanılması önerilmektedir: Tam olmayan sınırlar: Neoplastik hücreler herhangi bir düzlemde en az bir cerrahi sınır ile devamlılık gösterir. Dar sınırlar: Cerrahi olarak oluşturulan doku kenarı ile neoplastik hücreler arasındaki mesafe 3 mm’den azdır50 veya cerrahi sınırlar psödokapsül dışında normal doku içermez.40 Tam sınırlar: Cerrahi olarak oluşturulan doku kenarı ile neoplastik hücreler arasındaki mesafe en az 3 ila 5 mm’dir.3,6,50 Cerrahi sınırların tamlığını sürekli değişken olarak ele alan ve histolojik grade’i hesaba katan çok değişkenli analiz kullanan araştırmalar, bu kategorilerin doğrulanmasını kolaylaştıracaktır. |
| İnsan YDS’lerinde olduğu gibi,14 cerrahi sınırların tamlığı nüks bakımından son derece önemli bir prognostik faktördür. Cerrahi sınırı tam olan YDS’lerin nüks etme olasılığı daha düşüktür32 ve cerrahi sınırı tam olmayanlara göre tümörsüz geçen süre belirgin şekilde daha uzundur.11,40 Cerrahi sınırı tam olmayan ve dar olan YDS’lerin nüks oranları için belirtilen eğilimler benzerdir (12’de 2 [%17] ile 36’da 10 [%28] arasında değişen raporlar);32,40,50 ancak nüks oranlarındaki farklılıklar istatistiksel olarak ölçülmemiştir. Cerrahi sınırdan > 1 mm uzaklıkta tümör psödokapsülü olan YDS için nüks oranları, grade’e bakılmaksızın 30’da 0 (%0) gibi düşük bir orandır.40 Ancak bu çalışmada nükse kadar geçen ortalama süre 12 ay ve minimum takip süresi 6 ay olduğundan, nüks oranlarının düşük tahmin edilmiş olması mümkündür.40 Tam, dar ve tam olmayan sınırlar için nüks oranları ve sağkalımdaki farklılıkları ölçmek ve istatistiksel olarak karşılaştırmak ve sınır tamlığının derecesinin (neoplastik hücreler ile cerrahi olarak oluşturulan kesit kenarı arasındaki minimum mesafe açısından) herhangi bir prognostik fayda sağlayıp sağlamadığını belirlemek için daha fazla çalışmaya ihtiyaç vardır. Nüks oranları genel klinik ve sevk edilen merkezler arasında farklı göründüğünden (116’da 20 [%17]40 ile 104’te 29 [%28]11 arasında bildirilirken, 53’te 4 [%8]5 ile 75’te 11 [%15]32 arasında rapor edilmiştir), nüks bakımından prognostik faktörleri değerlendiren çalışmaların (sınırların tamlığı dahil) hedef müşteri kitlesine yönelik olması gerekecektir. Ayrıca, cerrahi sınırların tamlığı, doğru şekilde odaklanmış çalışma tasarımı ve analitik yöntemler kullanılarak sağkalım açısından prognostik bir faktör olarak henüz değerlendirilmemiştir. Cerrahi sınırların tamlığı ile ilgili birçok prognostik çalışma doku seçim yöntemlerini bir dereceye kadar hesaba katmaktadır,3,32,40,50 ancak bazı farklılıklar söz konusudur. Neoplastik hücreler ile cerrahi sınırlar arasındaki kalınlığı ve ilişkiyi belirlemeyi etkileyen çeşitli faktörler vardır; bunlar arasında cerrahlar tarafından dokunun işlem görmesi; daha büyük tümörlerin kesilmesi; sınırların işaretlenmesi; kas, yağ ve fasiyal dokunun kasılması; kaymayı ve psödokapsülün yapay olarak ortaya çıkmasını önlemek için dokunun dikilmesi; hazırlanan kesitlerin sayısı ve doku seçimi sırasında hedeflenen alanlar (düzeltme) sayılabilir. Bu faktörler, çalışmanın bulgularını tanısal veya klinik ortamda uygulamak isteyen kişiler tarafından kullanılabilmesi için çalışmanın yöntemlerinde belirtilmeli ve ele alınmalıdır. Tümör biyopsilerinin gönderilmesi, kesilmesi ve sınır değerlendirmesi için önerilen kılavuzlar yakın zamanda yayınlanmıştır.31 Cerrahi sınırların tamlığını prognostik bir faktör olarak yeniden incelemeyi amaçlayan geleceğe yönelik YDS araştırmaları, çalışmalar arasındaki tutarlılığı ve sonuçların tekrarlanabilirliğini artırmak için bu standartlara bağlı kalmalıdır. Özellikle, YDS olması muhtemel kutanöz ve subkutanöz tümörler için cerrahi sınırların belirlenmesi gereklidir. Büyük tümörler sabitlenmeden önce, tümörün tek parça halinde kalmasını ve kenarlarında yapay kayma olmadan şeklini korumasını sağlayacak şekilde, üstteki deriden ve tümörün içine doğru enine kesiler yapılabilir. Herhangi bir doku kesme yönteminin daha üstün olduğunu gösteren herhangi bir çalışma yoktur ve her biri için çeşitli sınırlamalar mevcuttur: Radyal kesit alma marjin çevresinin en az yüzdesini dikkate alır; tanjansiyel kesit alma neoplastik hücreler ile biyopsinin cerrahi olarak oluşturulan çevresi arasındaki mesafe için sayısal bir ölçüt sunmaz; ve paralel kesit alma ise değerlendirilen kesitler arasında meydana gelebilecek küçük tümör kalıntılarını gözden kaçırabilir. |
| Bu nedenlerle, birden fazla doku kesme yönteminden elde edilen kesitler ideal olarak her biyopsi için kolektif şekilde değerlendirilmelidir. Sınır değerlendirmesi için kullanılan titiz yöntemlerin bile doğruluğu büyük ölçüde bilinmemektedir ve köpek YDS’sinin infiltratif ve tentaküler eğilimi göz önüne alındığında, hata potansiyeli oldukça yüksektir. YDS cerrahi sınır değerlendirmesinin doğruluğunu ve en uygun yöntemleri belirlemek için gelecekte çalışmalar yapılması gerekmektedir. Böyle bir araştırma, prospektif yaklaşım, titiz kesit alma teknikleri ve tümör nüksü bakımından uzun süreli takip gerektirecektir. |
Histolojik Grade (Evre)Grade, insan YDS’leri için en önemli prognostik faktör olarak kabul edilmektedir.14 Köpeklerde YDS’yi değerlendirmek için kabul edilen grade sistemi ilk olarak insanlarda kullanılmak üzere geliştirilmiştir ve insanlarda YDS’yi değerlendirmek için uluslararası alanda kullanılan iki sistemden biridir.53 İlk olarak 1980’lerin sonlarında köpek kutanöz ve subkütanöz YDS’lerine uygulanmıştır.32,37,38 Doku farklılaşması, MI ve nekrozu dikkate almaktadır (Tablo 2). Bu sisteme göre sınıflandırılan köpek YDS’lerinin çoğunluğu grade I’dir.38,40 Grade I tümörler eksizyonu takiben en düşük nüks olasılığına sahiptir, ancak nüks daha önce tartışıldığı gibi cerrahi sınırların tamlığı ile de ilişkilidir.40 Cerrahi sınırlar tam olduğunda, grade I tümörlerin nadiren tekrarladığı görülmektedir.6,40,50 Cerrahi sınırlar dar olduğunda bile, grade I tümörler nadiren tekrarlamaktadır (41’de 3, %7).40 Benzer şekilde, grade I tümörlerin metastazının nadir olduğu düşünülmektedir ve bunun oluşumu bazen klinisyenler ve patologlar arasında tartışmaya neden olmaktadır. Grade I YDS’ler için lenf nodu ve pulmoner metastaz rapor edilmiştir;3,32,49 bildirildiğine göre, bir çalışmada 31 grade I YDS tümöründen 4’ü (%13),32 başka bir çalışmada 15’inden 1’i (%7),49 başka bir çalışmada ise 48 kombine grade I ve II YDS tümöründen 4’ü (%8) metastaz yapmıştır.39 Bununla birlikte, metastazın histolojik olarak doğrulanması yalnızca McKnight ve arkadaşları 39 tarafından rapor edilmiş ve metastazların grade I veya II tümörlerden olup olmadığı belirtilmemiştir. Genel olarak köpek YDS çalışmaları her zaman kapsamlı bir şekilde takip protokolleri uygulamamış ve/veya metastazı histolojik olarak doğrulamamış, metastazı göstermek için tanısal görüntüleme tekniklerine ve/veya sitolojiye güvenmiş ve metastatik oran tahminleri konusunda belirsizliğe yol açmıştır.3,7,11,23,32,34,40,48,49 Grade II tümörler orta sıklıkta görülür.23,38,40 Tam sınırlara sahip Grade II tümörlerin de nadiren, eğer varsa, tekrarladığı görülmektedir.40 Dar sınırlara sahip Grade II tümörler grade I tümörlerden daha sık tekrarlar (41’de 14, %35) ve tekrarladıklarında grade I tümörlerden daha kısa süreli tümörsüz geçen aralığa sahiptirler.40 Grade II tümörlerin metastatik oranı belirsizdir ve bir çalışmada 27’de 2 (%7),32 bir diğerinde 9’da 3 (%33),49 bir diğerinde 22’de 6 (%27),23 ve grade I ve II tümörleri birleştiren bir çalışmada 48’de 4 (%8) olarak bildirilmiştir.39 Grade I ve II tümörler arasındaki metastatik oran farkının karşılaştırılması, metastatik olay sayısının az olması, çalışma popülasyonundaki hastalık evresinin farklı olması (örneğin, primer reeksizyon vakalarının dahil edilmesi) ve metastazı tespit etmek veya takip etmek için kullanılan yöntemler nedeniyle mümkün olmamıştır.23,32,49 Grade I ve II tümörlerin metastatik oranında bir fark olup olmadığını belirlemek için daha fazla çalışmaya ihtiyaç vardır. Grade III tümörler en az görülen tümörlerdir. Köpeklerde kutanöz ve subkutan YDS’lerin yaklaşık %7 ila 17’sini oluştururlar.23,38,40 En yüksek nüks ve metastaz potansiyeline sahip oldukları düşünülmektedir; ancak insanlarda ve köpeklerde bu tümörlere ilişkin bilgiler, nispeten az sayıda grade III tümörün değerlendirildiği çalışmalara dayanmaktadır.48 Geniş cerrahi eksizyonu takiben tam cerrahi sınırlarla grade III YDS nüksü görülmüştür,6,48 ancak cerrahi sınırlar tam olduğunda nüks oranı seyrek görünmektedir.40 Dar sınırlara sahip grade III YDS’ler düşük grade tümörlere göre daha sık nüks etmektedir (4’te 3, %75),40 ve grade III YDS’lerin tamamen rezeke edilmesinin düşük grade tümörlere göre daha zor olabileceğine dair endişeler vardır.23 Daha fazla sayıda grade III tümörün analizine ihtiyaç vardır. Metastaz en sık grade III YDS’lerde görülür, ancak metastatik oran kesin olarak ölçülmemiştir. Grade III tümörler için metastatik oran raporları 9’da 2 (%22), 17’de 7 (%41) ve 39’da 17’dir (%44), ancak bu değerler kesin tahminler olmadığından ve farklı tedaviler uygulanan çalışma popülasyonlarından elde edildiğinden dikkatle genelleştirilmelidir.23,32,48 YDS grade’i ile hasta sağkalımı arasındaki ilişki konusunda net bir fikir birliği yoktur. Bazı raporlarda, grade sağkalım için prognostik iken,32 diğerlerinde değildir.23,39,40,49 Bununla birlikte, son çalışmalar daha küçük çalışma popülasyonlarına sahiptir ve bu nedenle, gerçek sağkalım farklılıklarının güvenilir bir şekilde tespit edilmesi için grade bazında daha sınırlı sayıda vaka bulunmaktadır. |
| Tümör grade’inin sağkalım üzerinde derin bir etkisi olmayabilir çünkü YDS’lerin çoğu nispeten yavaş büyür ve hastanın yaşam kalitesini etkilemeden lokal olarak tedavi edilebilir, metastazlar da yavaş büyüyor gibi görünür ve sağkalımı etkilemeyebilir,23,32,37,46,48 ve YDS teşhisi konan köpeklerin çoğu yaşlıdır ve metastatik veya lokal hastalık ölümcül hale gelmeden önce başka nedenlerden ölmeleri muhtemeldir..5,10,11,32,40,50 Histolojik grade doğası gereği subjektif bir testtir ve bu nedenle araştırma bulgularının klinik kullanıma aktarılmasını engelleyen intraobserver ve interobserver varyasyona tabidir.55 İnsan YDS’sinde, 25 vaka burada tarif edilene benzer bir YDS grade şeması ile değerlendirildiğinde 15 patolog arasında %75’lik bir uyum vardı.13,49 Farklılaşma konusundaki uyum, analiz edilen 3 kategori arasında en düşük seviyedeydi (%61).13,49 Köpek YDS’si için benzer çalışmalar yapılmamıştır. Veteriner patologlar, özellikle farklılaşma kategorisi için YDS sınıflandırmasının tekrarlanabilirliğini sıklıkla tartışmaktadır. Burada patologlar arasında kullanım tutarlılığını artırmak için bazı kılavuz ilkeler önerilmektedir; bunlar bizim uygulamalarımıza ve insan YDS’si için kullanılan grade sistemine dayanmaktadır:53
Grade, köpek kutanöz ve subkutanöz YDS tanısında 20 yılı aşkın süredir kullanılmaktadır. Özellikle nüksü öngörme ve metastaz riskini gösterme açısından (grade III tümörler) faydalı bir prognostik gösterge olduğu kanıtlanmıştır. Grade ve metastaz arasındaki ilişkiyi daha iyi açıklığa kavuşturmak için, gelecekteki çalışmalar tercihen metastazı tespit etmek ve doğrulamak için kapsamlı bir takip protokolü gerektirecektir. Bu, metastazların nekropside histolojik olarak doğrulanmasını gerektiriyor gibi görünmektedir çünkü klinik muayene, tanısal görüntüleme ve sitoloji metastazın gereğinden fazla tahmin edilmesine yol açabilir (örneğin, diğer hastalıklar radyografik olarak benzer görünebilir veya sitoloji neoplastik ve reaktif iğsi hücreler arasında doğru bir ayrım yapamayabilir). Bununla birlikte, takibi kaybetme, nekropsi yapılmaması ve yeterince uzun takip sürelerinin olmaması metastatik oranı olduğundan düşük gösterebilir. Bu durum özellikle YDS için endişe vericidir çünkü metastaza kadar geçen süre bazı vakalarda 3 yıldan uzun olabilir ve metastazlar klinik olarak gizli kalabilir.22,32,46,48 Ayrıca, metastazın önemini doğrulamak için, gelecekteki çalışmalar sağkalım ve metastaz arasındaki ilişkinin değerlendirilebileceği şekilde tasarlanmalıdır. Sağkalım prognostik sonuç olarak değerlendiriliyorsa, grade grupları arasında ortalama sağkalım süresindeki farkın büyüklüğü ölçülmelidir. Mevcut grade sistemini doğrulamayı veya geliştirmeyi amaçlayan araştırmalar, bu kategorinin tekrarlanabilirliğinin şüpheli olması ve çok değişkenli analizin MI ve nekrozun grade şemasının istatistiksel olarak anlamlı tek prognostik unsurları olduğunu göstermesi nedeniyle 2 grade şemasının (“farklılaştırma” içeren ve içermeyen) karşılaştırılmasını düşünebilir.32 |
MI ve Proliferasyon BelirteçleriMI, grade’ten bağımsız olarak oldukça önemli prognostik bilgiler sunmaktadır. Yüksek MI, YDS çalışmaları arasında tutarsız bir şekilde tanımlanmıştır; yüksek MI için kullanılan en düşük kesme değeri, 10 yüksek güçlü alan başına 9 mitotik figürdür.7,40,49 Yüksek MI, nüks, azalmış tümörsüz geçen süre, metastaz ve azalmış sağkalım süresi ile ilişkilidir.7,23,32,40,49 MI ≥ 9 için ortalama sağkalımın 150 ila 343 gün arasında değiştiği bildirilirken, MI < 9 için ortalama sağkalım 826 ila 1138 gün arasında değişmektedir.7,49 Ortalama sağkalım MI ≥ 20 için 236 gün, MI 10 ila 19 arasında 532 gün ve MI < 10 için 1.444 gün olmuştur.32 Bu sayılar dikkatle genelleştirilmelidir çünkü her biri farklı tedavi yaklaşımlarına ve doğal hastalık geçmişine sahip küçük ve çeşitli çalışma popülasyonlarından elde edilmiştir. Buna rağmen, özellikle nüksü öngörme açısından, grade’den daha fazla prognostik bilgi elde edildiği görülmüştür.28,40 AgNOR ve Ki-67 dahil olmak üzere diğer hücresel proliferasyon markerleri bakımından yüksek skorlar da düşük sağkalım süresi için prognostiktir; ancak, farklı skorlar arasında ortalama sağkalım süresindeki farkın büyüklüğü yeterince karşılaştırılmamıştır.23 Bu teknikler, tümörün değerlendirildiği andaki proliferasyon durumu hakkında ek bilgiler sağlar ve çeşitli insan neoplazmları için prognostik bilgi elde etmek amacıyla rutin olarak kullanılır.54 |
| Bununla birlikte, köpek YDS’si için, bu diğer belirteçlerin, klinik bir ortamda, özellikle zaman dahil ek maliyetleri ile tek başına MI veya grade’e göre daha iyi sonuçlar verecek düzeyde prognostik bilgi sağlayıp sağlamadığı belirsizdir. Bu diğer belirteçler henüz yaygın olarak kabul edilmemiştir. Diğer Faktörler |
| Tekrarlayan YDS’lerin primer YDS’lere kıyasla daha düşük sağkalım süresine ve daha yüksek metastatik potansiyele sahip olduğuna dair endişeler mevcuttur,33 ancak bu durum köpeklerde henüz net bir şekilde ortaya konmamıştır. İlk eksizyon doku düzlemlerini bozabilir veya kontamine edebilir, bu da sonraki tam cerrahi eksizyonu daha zor hale getirir.36 Raporlar, yeniden eksize edilen YDS’lerin nüks oranları için çelişkili oranlar sunmaktadır.3,46 Tümör boyutu veya hacmi, anatomik konuma bağlı olarak tam eksizyonu engelleyebilir ve özellikle lokal nüks için önemli bir negatif prediktif faktör olabilir. Büyük boyut genellikle kötü prediktif faktör olarak kabul edilir.19,33 Ancak, tümör boyutunu inceleyen birkaç çalışmada, tümör nüksü, sağkalım veya hastalıksız geçen süre bakımından kayda değer ölçüde prognostik olmadığı görülmüştür.3,7,11,37,46 Bu çalışmalar gerçek farklılıkları tespit edecek istatistiksel güce sahip olmayabilir. Diğer çalışmalar, büyük tümör boyutunun (> 5,5 cm veya ≥ 4 cm, en uzun boyut) düşük sağkalım süresini veya radyasyona daha kötü yanıtı öngördüğünü ileri süren eğilimleri tanımlamaktadır.4,24,32,38 Genel uygulamada rezeke edilen YDS’ler tedavi merkezlerinde rezeke edilenlerden daha küçük olma eğiliminde olduğundan,11,32 kaynak, hesaba katılması gereken önemli bir yanıltıcı olabilir. Oral kaviteyi tutan bazı YDS’ler düşük gradeli histolojik görünüme sahiptir ancak agresif bir klinik seyir gösterir13 ve diğer bölgelerdeki YDS’li köpeklere kıyasla daha kötü sağkalım oranlarına sahiptir.25 Bu nedenle, oral YDS’ler genellikle geleneksel köpek YDS gruplandırmasına dahil edilmez. Perioral yerleşim dışında, köpeklerde kutanöz veya subkutanöz YDS’lerin daha agresif olduğu düşünülen herhangi bir bölge yoktur ve tümör yerleşimi tutarlı bir şekilde prognostik bir faktör olarak tanımlanmamıştır. Tümör yerleşimi rezektabiliteyi ve tam eksizyon elde etme olasılığını etkileyebilir. Yine de birkaç çalışmada tümör yerleşimine bağlı olarak sağkalım süresi veya lokal nüks oranında farklılıklar tespit edilmemiştir.3,4,7,11 Ancak bu durumda da sınırlı istatistiksel güç göz önünde bulundurulmalıdır. Çalışmalar, uzuvlara yerleşimin daha uzun sağkalım, daha düşük metastaz ve tedaviye daha iyi yanıt için prognostik olabileceğini düşündüren eğilimleri ortaya koymaktadır.7,8,32 Tümör hareketliliği, alttaki dokulara invazyonun bir göstergesidir. İnvazivlik palpasyonla, cerrahi sırasında makroskopik olarak veya tanısal görüntüleme ile değerlendirilebilir. Açıkça invaziv olan YDS’ler daha agresif davranabilir ve invaziv tümörlerin tamamen çıkarılması daha zor olabilir, ancak invazivlik için prognostik eğilimleri tanımlayan raporlar çelişkilidir.5,11,46,50 Daha önce tedavi edilmiş tümörlerin, büyük tümör boyutlarının, spesifik tümör lokasyonlarının ve klinik olarak belirgin invazivliğin daha düşük prognoz sağlayıp sağlamadığını belirlemek için daha fazla çalışmaya ihtiyaç vardır. Bu tür bir araştırma kaçınılmaz olarak daha baskın prognostik faktörlerin etkisini hesaba katmak için çok değişkenli analiz ve incelenen değişken sayısına göre yeterli sayıda vaka gerektirecektir. İnsan YDS’si için Amerikan Kanser Ortak Komitesi evreleme sisteminden modifiye edilmiş evreleme sistemi köpeklerde kullanılmak üzere geliştirilmiştir. 33 |
| Bununla birlikte, evreleme sistemleri köpek YDS’nin klinik yönetiminde tutarlı bir şekilde kullanılmamaktadır. Bildiğimiz kadarıyla, köpek YDS için evreleme sistemlerinin prognostik önemini doğrulamaya yönelik hiçbir çalışma yapılmamıştır. Faktör VIII ile ilişkili antijen ve CD31 immün boyamasının kantitatif değerlendirmesi yoluyla belirlenen intratümöral mikrodamar yoğunluğu (IMD), yakın zamanda kutanöz ve visseral YDS’nin davranışını öngörme yöntemi olarak incelenmiştir.34 İnsanlarda, klinik özellikler, histolojik patern, immünohistokimya ve moleküler sitogenetik kombinasyonu, histogenez tartışmalı olsa da, YDS tipini doğru bir şekilde teşhis etmek için rutin olarak kullanılmaktadır.30 Füzyon genleri, spesifik onkojenik mutasyonlar ve kompleks karyotipik anormalliklerle sonuçlanan kromozomal translokasyonlar dahil olmak üzere spesifik genetik değişiklikler, insan YDS’sinde tespit edilmiş, tümörijenez mekanizmalarına ışık tutmuş ve spesifik YDS tipleri için hedefe yönelik tedavinin geliştirilmesini teşvik etmiştir. Bazı spesifik sitogenetik anormallikler, belli YDS tiplerinde prognostik bir role sahiptir.1 Bildiğimiz kadarıyla, moleküler sitogenetiğin köpek YDS tanısı ve prognostiğinde faydasını araştıran herhangi bir çalışma henüz yapılmamıştır. Deri ve Subkutisin Köpek YDS’si için Prognostik ve Prediktif Faktörlerin Raporlanmasına İlişkin KonsensüsPatologlar, histolojik tip, histolojik grade, MI ve cerrahi sınırların tamlığı dahil olmak üzere YDS için hazırlanan teşhis raporunda gözden geçirilen prognostik faktörlerin birçoğunu ideal şekilde tanımlamaktadır. Köpeklerin deri ve derialtı YDS’lerini ayırt etmek için doğru yöntemler kullanılabilir, uygun fiyatlı ve prognostik bakımdan anlamlı hale gelene kadar, bu tümörleri teşhis amaçlı bir ortamda spesifik olarak alt sınıflara ayırmak için çok az neden vardır. Bununla birlikte, histomorfolojik özellikler (Tablo 1) birçok vakada kullanılabilir. MI sağkalımla ilgili önemli bilgiler verdiğinden, histopatoloji raporunda her zaman belirtilmelidir. Bununla birlikte, grade tümör rekürrensi riski açısından daha bilgilendiricidir;40 bu nedenle MI grade yerine kullanılmamalıdır. Eksize edilen kutanöz ve subkutanöz kitlelerin kenarlarını değerlendirmek için mürekkep kullanımı ve birden fazla kesit alma tekniğini içeren standart prosedürler kullanılmalıdır.31 Cerrahi sınırların tamlığını tanımlarken, en iyi uygulama kullanılan sınır değerlendirme tekniğini (veya tekniklerini), cerrahi sınırları oluşturan ve incelenen doku düzlemlerinin sayısını, kesitlerin hazırlandığı örnek bölgelerini ve tümörü sınırlayan dokunun minimum kalınlığını (örn. neoplastik hücreler ile cerrahi olarak oluşturulan kesit kenarı arasındaki mesafe) ve bileşimini (örn. adipoz, fibröz, nekrotik, inflamasyonlu) içermelidir. |
Sınır sonuçlarının tutarlı bir şekilde yorumlanması için, yukarıda belirtilen parametrelerin yerine yakın/dar ve tam gibi belirsiz terimlerden kaçınılmasını öneriyoruz. Patologlar, nüks veya metastaz için beklenen oranları vermeden bildirilen faktörlerin prognostik önemini açıklayabilirler, çünkü kesin tahminler bildirilmemiştir (Tablo 3).SonuçSonuç olarak, YDS’ler hematoksilen ve eozin boyalı kesitlere dayanarak birbirinden ayırt edilmesi zor olan köpek deri ve derialtı neoplazmlarıdır. Araştırmalar, histolojik grade, MI ve cerrahi sınırların tamlığından elde edilen değerli prognostik bilgileri ortaya koymuştur. Tam sınırlar nüks olmayacağını öngörmektedir. Rekürrens grade ile artıyor gibi görünmektedir ve metastaz grade I ve II tümörler için nadirdir ve grade III tümörler için daha olasıdır. Yüksek MI (10 yüksek çözünürlüklü/güçlü alan başına >9 mitotik figür) düşük sağkalım için prognostik bir göstergedir. Sağkalım ile rezeksiyon derecesi ve/veya cerrahi sınırların tamlığı arasındaki ilişkiyi belirlemek, cerrahi sınırların tamlığı ile bağlantılı olarak nüks oranları hakkında daha kesin tahminler yapmak, YDS sınır değerlendirmesi için uygun yöntemleri tespit etmek ve dereceler arasında metastatik oran ve ortalama sağkalım süresindeki potansiyel farklılıkları belirlemek için daha fazla araştırma yapılması gerekmektedir. Hücresel proliferasyon belirteçleri, tümör boyutu, tümör konumu, histolojik tip, invazivlik ve sitogenetik profiller dahil olmak üzere diğer faktörler prognoz bakımından faydalı göstergeler olabilir, ancak şu anda ek araştırmalara ihtiyaç duyulmaktadır. Yardımcı moleküler teknikler hızla gelişmeye devam ettikçe, veteriner patologlar ve onkologlar YDS prognozuna yardımcı olacak yeni göstergeleri değerlendireceklerdir. Prognostik faktörleri inceleyen gelecekteki araştırmalar, büyük örneklem boyutlarını korumak, kapsamlı ve uzun süreli takip sağlamak, YDS tipini doğru bir şekilde teşhis etmek, YDS gruplamasının diğer çalışmalarla tutarlılığını sürdürmek ve retrospektif çalışmalarla ilgili sapmaları aşmak için yaratıcı yollar bulmalıdır. |
| Teşekkürler Bu çalışma Amerikan Veteriner Patologlar Akademisi Onkoloji Komitesi’nin girişimidir. Makale ayrıca Dünya Küçük Hayvan Veteriner Hekimleri Birliği tarafından incelenmiş ve onaylanmıştır. ACVP’ye desteği ve rehberliği için teşekkür ederiz.Çıkar çatışması beyanı Yazarlar, yazarlıklarıyla veya bu makalenin yayınlanmasıyla ilgili herhangi bir çıkar çatışması yaşamadıklarını beyan etmişlerdir.Finansal Destek Beyanı Yazarlar, araştırmaları ve/veya bu makalenin yazarlığı için herhangi bir mali destek almadıklarını beyan etmişlerdir. |
Kaynakça
|






