Kanser, yetişkin köpeklerde en yaygın ölüm nedenidir. Evcil köpeklerde kendiliğinden gelişen tümörlerin çoğu kendine has özelliği, insanlardaki hastalığa model olma potansiyeli taşımaktadır. Bunlar arasında benzer çevresel etkilere maruz kalma, bağışıklık sisteminin engellenmesi gibi önemli faktörler açısından bakıldığında klonal evrimin benzer olması, görüntüleme ve seri biyopsi için vücut büyüklüğünün elverişli olması gibi özellikler vardır. Ayrıca, hastalığın ilerleme süresinin nispeten kısa olması, progresyonsuz veya genel sağkalım gibi zamana bağlı nihai verilerin nispeten daha kısa bir zaman dilimi dahilinde değerlendirilmesi de mümkündür. Bu kriterler, yeni lokal tedavileri değerlendirmek, tümör hedefinin inhibisyonunu veya tümör lokalizasyonunu kanıtlamak, potansiyel antimetastatik yöntemleri değerlendirmek ve çeşitli bağışıklık temelli tedavilerin etkinliğini, güvenliğini ve bunların bağışıklık üzerindeki etkilerini değerlendirmek için kullanılmıştır. Bu köpekler için yapılan kavram kanıtlama çalışmalarından bazıları, insan klinik deneyleri için de yol gösterici olmuştur. Bu incelemede, spontan neoplazili köpeklerde yapılan klinik çalışmaların temel özellikleri ve bu çalışmaların insan kanser tedavisine nasıl katkıda bulunduğuna dair örnekler ele alınacaktır.
Editleyen: MarkW.Dewhirst, Duke Üniversitesi, ABD İnceleyen: Terence S. Herman, Oklahoma Üniversitesi Sağlık Bilimleri Merkezi, Amerika Birleşik Devletleri Allison B. Warner, Memorial Sloan Kettering Kanser Merkezi, Amerika Birleşik Devletleri Amy LeBlanc, Ulusal Kanser Enstitüsü (NCI), Birleşik Devletler
*İlgili yazar: Douglas H. Thamm dthamm@colostate.edu
Uzmanlı k bölümü: Bu makale Frontiers in Oncology dergisinin bir bölümü olan Cancer Molecular Targets and Therapeutics’e gönderilmiştir.
Sunum: 31 Temmuz 2019 Kabul : 31 Ekim 2019 Yayınlanma: 15 Kasım 2019
Atıf: Thamm DH (2019) Canine Cancer: Strategies in Experimental Therapeutics. Front. Oncol. 9:1257. doi: 10.3389/fonc.2019.01257
Anahtar Kelimeler: köpek, tümör, klinik çalışma, translasyonel, hayvan modeli
GİRİŞ
İnsan kanserinin birçok fare modelinin klinik anlamda uygulanabilirliğine ilişkin genel kaygılar arasında bağışıklık durumu, önemli ölçüde azaltılmış klonal heterojenite, göreceli tümör yükü, tümör yerleşimi (ortotopik vs. heterotopik), ilaç dağılımı/metabolizmasında türe özgü farklılıklar ve in vivo ilaç konsantrasyonlarında görülebilen farklılıklar yer almaktadır. Bunlar, murin çalışmalarının sonuçları ile antikanser ajanlarla yapılan erken insan klinik deneyleri arasında son derece zayıf korelasyon görülmesine neden olmaktadır (1). Daha öngörüye açık hayvan modellerine ihtiyaç duyulmaktadır.
Amerika Birleşik Devletleri’nde her yıl köpeklerde 1 milyondan fazla yeni kanser vakasının ortaya çıktığı düşünülmektedir ve köpek mortalitesini tanımlayan retrospektif çalışmalarda, kanser tahmini ∼%30 oranıyla en yaygın ölüm nedenidir (2-4). Köpeklerdeki bu büyük kanser oranı, çoğu histolojik olarak insan tümörlerine benzeyen, kendiliğinden oluşan bir grup tümöre dikkat çekmektedir. Yaygın olarak karşılaşılan histotipler arasında Hodgkin dışı lenfoma, malign melanom, osteosarkom (OSA), mesane karsinomu ve diğerlerinin yanı sıra çoklu beyin kanseri türleri yer almaktadır (2, 5). Kanserli köpekler, yeni antikanser tedavilerinin tolere edilebilirliği, farmakolojisi, farmakodinamik etkileri ve potansiyel etkinliğinin preklinik aşamada incelenmesinde yararlanılacak kaynaklar olarak gitgide daha fazla kabul görmektedir. Bu modelin potansiyeli, 2015 yılında düzenlenen Karşılaştırmalı Onkoloji Ulusal Tıp Akademisi Çalıştayı’nda ele alınmıştır (http://www.nap.edu/21830) (6).
Kendiliğinden kansere yakalanan sahipli köpeklerde yapılan klinik çalışmalar, köpeklerin göreceli olarak soylarının tükenmesi, büyük boyutları, immünokompetansları ve insanlarla olan fizyolojik/biyolojik benzerlikleri nedeniyle potansiyel anlamda son derece önemli translasyonel modellerdir. Kendiliğinden oluşan köpek tümörleri doğal olarak tedaviye direnç geliştirmenin yanı sıra kendiliğinden nüks ve metastaz yapar. Köpeklerdeki mutlak tümör yükleri insanlara daha benzerdir ve bu da klonal heterojenite ve hipoksi gibi biyolojik faktörler açısından aydınlatıcı olabilir. Köpek tümörlerinin nispeten büyük boyutları (kemirgen tümörlerine kıyasla) zaman içinde seri doku toplanmasına ve görüntülenmesine de olanak sağlamaktadır (2, 7). Bunun nedeni kısmen, bu hastaların prosedürler için yaygın olarak sedasyon veya anestezi altında olması ve hasta konforu konusundaki endişelerin azaltılabilmesidir. Klinik vaka yönetimi ve veri toplama çok yüksek kalitede olsa da, veteriner onkoloji klinik çalışmalarının göreceli maliyeti, hekim temelli onkolojideki benzer çalışmaların maliyetinin %10-20’si kadardır.
Köpekler ayrıca yeni tedavilerin toksisitesini değerlendirmek için kemirgenlere göre daha güvenilir modeller olabilir. İnsan hastalarda olduğu gibi, köpek hastalar da rutin klinik patoloji yoluyla hematolojik ve biyokimyasal toksisiteler açısından izlenir ve gerektiğinde gelişmiş izleme (örn. 24 saat sürekli elektrokardiyografik telemetri, sürekli kan basıncı ölçümü, oftalmolojik izleme, ekokardiyografi, yürüme analizi, gelişmiş görüntüleme) yapılabilir. Laboratuvar ortamlarından farklı olarak, destekleyici bakım (örn. antiemetikler, antidiyareikler, antibiyotikler, vb.) insan hastalarda kullanıldığına benzer şekilde sahipli hayvanlarda da kullanılmaktadır. Antineoplastik tedaviden kaynaklanan yan etkiler için evrensel olarak kabul edilmiş derecelendirme sistemleri (8, 9) ve evrensel olarak kabul edilmiş tümör yanıt kriterleri (10, 11) yayınlanmıştır.
Karşılaştırmalı Onkoloji Denemeleri Konsorsiyumu (COTC: https://ccr.cancer.gov/Comparative-Oncology- Program/sponsors/consortium), NIH-NCI-Kanser Araştırmaları Merkezi bünyesinde yer alan Karşılaştırmalı Onkoloji Programı tarafından merkezi olarak yönetilen ve 20’den fazla akademik veteriner onkoloji merkezinden oluşan bir ağdır. Programın temel amacı, insan kanserine yönelik yeni potansiyel tedavileri değerlendirmek için kanserli köpeklerde klinik deneyler planlamak ve gerçekleştirmek ve gelecekteki insan klinik deneyleri için veri sağlamak amacıyla biyolojik konuları aydınlatmaktır. COTC sponsorluğundaki denemeler genellikle farmakokinetik/farmakodinamik açıdan yoğun olup, elde edilen sonuçlar gelecekteki insan çalışmalarının tasarımına dahil edilmektedir. Bu ağın başlatılması, potansiyel sponsorların ve işbirlikçilerin köpeklerde kavram kanıtlama çalışmalarının yürütülmesi için ulusal düzeyde işbirliği grubuna erişim imkanı sağlamıştır. Potansiyel sponsorlar, COTC yönetimiyle birlikte çalışarak belirli ilaç geliştirme sorularını ele alan klinik bir protokol geliştirmekte ve bu protokol daha sonra potansiyel katılım için üyelere sunulmaktadır. COTC merkezleri, kapasite, gerekli olabilecek özel ekipman/teknikler ve/veya kurumdaki yarışan deneylere dayalı olarak katılma veya reddetme fırsatına sahiptir. Deneylerin yürütülmesi, katılımcı merkezler arasında sözleşme sürecini kolaylaştıran tek bir mutabakat anlaşması ile yönetilir.
Bu önemli özellikler, birkaç geniş kategoriye giren yeni kanser tedavilerinin klinik öncesi değerlendirilmesine olanak sağlamıştır: (1) Cerrahi, radyoterapi ve lokal olarak verilen ilaç
tedavisi gibi lokal tedavi yöntemleri; (2) Hedef inhibisyonunun kanıtı ve tümör hedefinin kanıtı; (3) Minimal rezidüel hastalık ortamındaki çalışmalar; (4) İmmünoterapi çalışmaları.
LOKAL TEDAVİ YÖNTEMLERİ
Köpeklerin vücut boyutlarının nispeten büyük olması ve tümörlerinin göreceli büyüklüğü nedeniyle, tümör taşıyan köpekler yeni lokal tedavilerin değerlendirilmesi için benzersiz ve yol gösterici bir model olabilir. Cerrahi ve radyoterapi (RT) ile ilgili çalışmalarda, kemirgenler için gereken adaptasyon veya minyatürleştirmeye gerek kalmadan, insan hastalarda kullanılan teknik ve ekipmanlar kullanılabilir. Yukarıda belirtildiği gibi, köpek tümörlerinin nispeten benzer boyutu ve büyüme hızı, oksijenasyon, pH ve interstisyel sıvı basıncı gibi önemli mikro çevre parametrelerinde benzerlikler yaratır (12-18) ve büyük tümör boyutu, seri biyopsi yapılmasını ve zaman içinde intratümöral parametrelerin ölçülmesini kolaylaştırır. Sonuç olarak, tümör taşıyan köpekler yeni cerrahi yaklaşımlar, RT, hipertermi ve bölgesel olarak verilen ilaç tedavisine yönelik translasyonel çalışmalarda kullanılmıştır.
Translasyonel Cerrahi Çalışmalar
Withrow ve arkadaşlarının 1980’lerde Ulusal Kanser Enstitüsü tarafından desteklenen çalışmaları, kemik sarkomu hastalarında uzuv kurtarma amacıyla kortikal allogreftler için cerrahi protokollere öncülük etmiştir. Bu prosedürler veteriner ve insan cerrahi onkologları tarafından birlikte geliştirilmiş ve çoğunlukla distal radius olmak üzere spontan OSA’lı çok sayıda köpekle birlikte geliştirilmiştir. Neoadjuvan RT ve kemoterapinin cerrahi başarı ve allogreft birleşmesi üzerindeki etkileri de değerlendirilmiştir (19-21). Bu gözlemler ve köpeklerde kaydedilen gelişmeler, bu yaklaşımların doğrudan insan uzuv koruyucu cerrahisinde kullanılmasına öncülük etmiştir (22). Ameliyat sonrası bakteriyel osteomiyelit gelişimi ile ilgili bir gözlem yapılmış ve köpeklerde metastazsız ve genel sağkalım süreleri artmıştır (23). Bu durum daha sonra OSA’lı insanlarda yapılan bir çalışmada da gözlemlenmiştir (24). Bu gözlemin murin sinjeneik OSA modelinde daha fazla incelenmesi, potansiyel bir etki mekanizması olarak NK ve monosit aracılı anjiyogenez inhibisyonunu akla getirmiştir (25).
Radyoterapi
1970’li ve 1980’li yıllarda Gillette ve arkadaşları tarafından hem normal hem de tümör taşıyan köpeklerde yapılan radyasyon çalışmaları, bugün insan hastalarda hala kullanılan çoğu normal doku RT doz kısıtlamasının belirlenmesini sağlamıştır (19, 26- 37). Daha yakın zamanlarda, tümör taşıyan köpeklerde yapılan çalışmalar, şu anda ticari olarak mevcut olan kesit kesit görüntü kılavuzlu yoğunluk ayarlı RT teknolojisi olan helikal tomoterapinin geliştirilmesi sürecinde doğru dozimetri ve konformal kaçınma için çok önemli bir referans noktası olmuştur (38, 39).
Hipertermi ve Radyoterapi Üzerine
Translasyonel Çalışmalar
Dewhirst ve arkadaşları tarafından NCI tarafından finanse edilen ve köpek tümörlerinde, özellikle de yumuşak doku sarkomlarında hipertermi ve hipertermi/RT kombinasyonlarının tümör mikroçevresi üzerindeki etkilerini değerlendiren öncü çalışmalar, literatürde önemli bir yer tutmaktadır.
Tümörlerin yaygın deri altı yerleşimleri ve seri biyopsi ve interstisyel prob yerleştirme gibi prosedürlerin nispeten kolay uygulanabilmesi sayesinde termal dozimetri, tümör perfüzyonu ve tümör oksijenasyonundaki değişiklikler ve klinik yanıtın belirleyicileri üzerine önemli bilgiler elde edilmiştir (36, 40-42).
Yerel/Bölgesel Olarak Uygulanan Tedaviler İnhale/pulmoner yolla verilen tedavilere ilişkin çok sayıda araştırmanın güvenliliği değerlendirilmiş ve bu çalışmalar insan tedavilerini desteklemek üzere antitümör etkinliğine ilişkin ön bulgular sağlamıştır. Bunlar arasında ölçülebilir primer veya metastatik pulmoner tümörlerin tedavisi için inhale doksorubisin, paklitaksel ve gemsitabinin değerlendirilmesi (43, 44) ve pulmoner metastatik OSA tedavisi için lipozom içeren nebülize inhale interlökin-2 (IL-2) (45) yer almaktadır. Gözlemlenen objektif antitümör yanıtlara ek olarak, son çalışmada IL-2 tedavisinden önce ve sonra lokal lökosit popülasyonunu karakterize etmek için seri olarak bronkoalveolar lavaj (BAL) sıvısı toplanmıştır. IL-2 sonrası BAL örnekleri lenfositlerde dört kattan fazla artış, CD4:CD8 oranında kayma ve ex vivo sitolitik aktivitede artış göstermiştir (45).
Tümör taşıyan köpek modellerinde çeşitli intratümör tedavileri değerlendirilmiştir. Bunlar arasında zayıflatılmış Clostridium sporları (46) ve çeşitli intralezyonel gen terapisi yöntemleri (47-50) bulunmaktadır. Bu çalışmaların çoğunda, immün infiltratları değerlendirmek ve karakterize etmek ve/veya transgen ekspresyonunu doğrulamak için seri biyopsi yapılmıştır. Birkaç yeni intralezyonel kemoterapi yöntemi (± RT veya hipertermi gibi diğer lokal tedaviler) de benzer şekilde değerlendirilmiş, tolere edilebilirlik ve etkinliğe dair ön bulgular ortaya konmuştur (50-55).
HEDEF İNHİBİSYONUNUN KANITI VEYA TÜMÖR HEDEFLEMESİ/BİRİKİMİNİN KANITI
Yine seri biyopsinin nispeten kolay olması ve köpeklerde organa özgü kan akışı ve hepatik enzim homolojileri gibi nispeten elverişli farmakokinetik parametreler sayesinde, köpek tümörleri farmakokinetik/farmakodinamik (PK/PD) ilişkilerin değerlendirilmesi, hedef inhibisyonunun gösterilmesi ve/veya tümör hedeflemesinin gösterilmesi için çok faydalı translasyonel modeller olarak faydalı olabilir. Bu durumlarda, hedef ekspresyonunu doğrulamak, köpek ve insan tümör hücrelerinde benzer ilaç davranışını sağlamak ve PD değerlendirmesi için gerekli reaktifleri ve protokolleri potansiyel olarak doğrulamak için genellikle ön in vitro çalışma gereklidir. Ayrıca, aynı hedefi eksprese eden insan tümörlerinden histolojik olarak çok farklı olan köpek tümörlerinde moleküler hedeflerin bulunabileceği bazı durumlar da söz konusudur. Örnekler arasında, insan gastrointestinal stromal tümörlerinde ifade edilen benzer bir mutasyonla birlikte köpek mast hücre tümörlerinde (MCT) mutant KIT proteininin ekspresyonu (56) ve insan melanomlarında yaygın olarak eksprese edilen V600E BRAF mutasyonunun köpek mesane kanserinde ekspresyonu (57, 58) yer almaktadır.
İlaç Hedefi İnhibisyonunun Kanıtlanması Spontan neoplazisi olan köpeklerde yeni ve hedefe yönelik bir ilacın başarılı bir şekilde değerlendirilmesinin erken örneklerinden biri de MCT’li köpeklerde “split kinaz” inhibitörü SU11654’ün (toceranib phosphate, PalladiaTM) preklinikdeğerlendirmesidir. SU11654, KIT, VEGFR2 ve PDGFR-alfa’yı içeren amaçlanan hedeflerine karşı çok benzer fizikokimyasal özelliklere ve IC50’lere sahip insan çoklu kinaz inhibitörü sunitinib’in (SutentTM) yapısal bir analoğudur. Köpek MCT büyüme inhibisyonu, apoptoz indüksiyonu ve KIT fosforilasyonunun inhibisyonunu gösteren ilk in vitro çalışmaların ardından (59), tümör taşıyan köpeklerde iyi tolere edilebilirlik ve antitümör aktivite kanıtı ile plazmada olası terapötik ilaç konsantrasyonlarına ulaşıldığını gösteren pilot çalışmalar yapılmıştır (60). Ayrıca, ilk ilaç dozundan önce ve 8 saat sonra biyopsi örneklerinde KIT aktivasyonunun ve downstream sinyalizasyonunun inhibisyonu görülmüştür (61). Bu veriler, şu anda ABD Gıda ve İlaç Dairesi (FDA) tarafından insan böbrek hücreli karsinomu, pankreatik nöroendokrin tümörler ve gastrointestinal stromal tümörlerin tedavisi için onaylanmış olan sunitinibin insanlarda kullanılmasına yönelik kritik bilgiler sağlamış ve köpek MCT’sinin tedavisi için toceranibin FDA tarafından onaylanmasını beraberinde getirmiştir (62).
Benzer bir “sıradaki lider” yaklaşımı, köpek tümör hücrelerindeki aktivite için in vitro olarak değerlendirilen ve daha sonra insan multipl miyelom tedavisi için FDA tarafından onaylanan insan analoğu selinexor’un (KPT-330, XpovioTM) (63) geliştirilmesi için destekleyici veriler sağlamak üzere tümör taşıyan köpeklerde değerlendirilen nükleer ekstraksiyon verdinexor’un (KPT-335) seçici inhibitörü ile uygulanmıştır. Verdinexor şu anda köpek kanseri tedavisinde kullanılmak üzere klinik geliştirme aşamasındadır.
İnsan klinik çalışmalarını desteklemek üzere tümör taşıyan köpeklerde preklinik veriler elde etmek için yapısal bir analoğu değerlendirmek yerine, yakın zamanda yapılan bir başka çalışmada, Bruton tirozin kinazın (Btk) sınıfının ilk inhibitörü olan PCI-32765 (ibrutinib, Imbruvica), ilk insan çalışmalarından önce spontan B-hücreli lenfomalı köpeklerde değerlendirilmiştir (64). Çalışmanın hedefleri 2 yönlüydü: (1) Daha sonraki insan çalışmalarında kullanılacak PD testini doğrulamak; (2) Sağlam B hücresi reseptör sinyalizasyonunu gösteren güvenilir murin B hücresi lenfoma modelleri mevcut olmadığından, etkinliğe dair ön kanıt oluşturmak. İbrutinib tedavisini takiben Btk reseptör yoğunluğu lenfoma dokusunda ve tedaviyi takiben periferik kanda benzerdi ve bu da insanlarda sadece kanda yapılan ölçümün muhtemelen doğru olacağını destekliyordu. Ayrıca, tedavi edilen sekiz köpeğin üçünde majör antitümör yanıtlar gözlendi ve ibrutinibin insan klinik gelişimini hızlandırma konusunda güçlü bir ivme sağladı. İbrutinib şu anda insanlarda spesifik B hücreli lenfoma alt tiplerinin, kronik lenfositik löseminin, Waldenstrom makroglobulinemisinin ve graft- vs.-host hastalığının tedavisi için FDA onayı almıştır.
Tümör Hedefleme Kanıtı
Köpek tümörleri, tümöre özgü hedef belirlemeyi ve/veya terapötiklerin tümörde birikimini teyit etmek için kullanılmıştır. İlk COTC denemesinde, insan çalışmalarına hazırlık olarak, tümör endotelinde eksprese edilen alfaV integrinleri hedefleyen ve tümör nekroz faktörü (TNF) taşıyan tümör vaskülatürü
hedefli bir adeno-ilişkili virüs faj vektörü değerlendirilmiştir. Tümör (vs. normal) vaskülatürünün selektif hedeflenmesi, intravenöz infüzyondan sonra tümör ve yakın normal dokuların seri biyopsisi yoluyla belgelenmiş ve TNF’nin tümöre yönelik ekspresyonu belgelenmiştir. Ayrıca, 14 köpeğin 2’sinde objektif antitümör yanıtlar kaydedilmiştir (65).
Bazı bakteriler, özellikle de fakültatif anaeroblar, tümör dokularında tropizm özellikleri göstermektedir. VNP20009, endotoksin üretimine katkıda bulunan MsbB geninin ve hayatta kalmak için eksojen bir pürin kaynağı gerektiren PurI geninin silinmesi yoluyla zayıflatılmış bir Salmonella typhimurium suşudur. Bu delesyonlar toksisiteyi azaltır ve in vivo tümör dokularına kolonizasyonu daha da kısıtlarken, çevrede hayatta kalmayı azaltır veya ortadan kaldırır. VNP20009’un intravenöz infüzyonu, tümör taşıyan köpeklerde güvenlik ve tümör kolonizasyonunun kanıtı açısından değerlendirilmiştir (66). İnfüzyondan 7 gün sonra kan kültürleri aynı şekilde negatif çıkarken, organizma köpeklerin %42’sinde tümör dokusundan izole edilmiştir. Objektif yanıt oranı %15’tir (%10 tam yanıt). Bu veriler, insan metastatik melanomunda VNP20009’un NCI sponsorluğundaki klinik çalışmayı desteklemiştir (67). Ancak insan melanom çalışmasında objektif antitümör yanıtlar gözlenmemiştir; bunun nedeni çalışma için tek insan tümör tipi olarak melanomun seçilmesi veya köpek ile insan arasında bakteriye karşı tolerabilite veya konakçı (örn. bağışıklık, vasküler) yanıtındaki farklılıklar olabilir. Köpek yumuşak doku sarkomlarında hipertermi ve ısıya duyarlı lipozomlar yoluyla bölgesel olarak hedeflenmiş sitotoksik ilaç verme stratejileri de araştırılmıştır (68).
Proof of Tumor Drug Accumulation
Otofaji modüle edici ajan hidroksiklorokin (HCQ) ile yapılan ve bir dizi insan klinik çalışmasıyla eş zamanlı olarak yayınlanan güncel bir köpek klinik çalışması, plazma ile karşılaştırıldığında HCQ’nun tümör dokusunda önemli ölçüde biriktiğini (∼100 kat) kanıtlayan ve iki farklı kompartmandaki ilaç konsantrasyonları veya otofaji değişiklikleri arasında korelasyon olmadığını gösteren ilk çalışmadır. Bu, periferik kanın tümör HCQ konsantrasyonu veya otofaji-modülatör aktivite için iyi bir araç olmadığını ve gelecekteki klinik çalışmaların HCQ aktivitesini daha doğru bir şekilde gösteren araçlar tespit etmesi gerektiğini göstermiştir (69).
Bir başka büyük COTC çalışmasında spontan lenfomalı köpeklerde üç farklı indenoizokinolon sınıfı topoizomeraz I inhibitörü serisi değerlendirilmiştir. Lenfomalı seksen dört köpek üç ilaçtan birini almak üzere gruplandırılmıştır. Tolere edilebilirlik, farmakokinetik, hedef etkileşimi ve antitümör etkiler değerlendirilmiştir. Üç ilaçtan biri olan LMP744, diğer iki ilaca kıyasla tümör dokusunda önemli ölçüde yüksek birikim göstermiş ve artan antitümör aktivitesi bu artan tümör birikimine bağlanmıştır (70). LMP744 başlangıçta daha ileri insan tedavisi için seçilmemiş olsa da, köpek çalışmasının beklenmedik olumlu sonuçları NCI’yi LMP744’ü insanlarda değerlendirmeye teşvik etmiştir (ClinicalTrials.gov identifier NCT03030417). Bu insan deneyi şu anda devam etmektedir ve bu nedenle insan güvenlik/etkinlik verileri şu anda mevcut değildir.
ANTİMETASTATİK ETKİNLİK
Köpek klinik kanser araştırmalarının bir diğer potansiyel avantajı, tümör ilerlemesi ve lokal nüks, metastaz ve ilaç direncinin kendiliğinden gelişmesi için nispeten daha kısa bir zaman dilimine sahip olmasıdır. Bu özellikler, progresyonsuz veya genel sağkalım gibi geçici son noktalarla “mikroskobik rezidüel hastalığa” karşı cerrahi adjuvan çalışmaların nispeten uygun bir şekilde yürütülmesine olanak tanır. Bu, özellikle öncelikle antimetastatik tedaviler olarak tasarlanan ajanlar için faydalı olabilir. Birkaç potansiyel insan tedavisi bu bağlamda tümör taşıyan köpeklerde araştırılmıştır.
Macewen, Kurzman ve arkadaşları tarafından peptidoglikan tanıma proteini agonisti ve spesifik olmayan immün uyarıcı lipozom muramil tripeptid fosfatidiletanolamin (L-MTP-PE) ile hemanjiosarkom (HSA) ve OSA’lı köpeklerde kapsamlı çalışmalar yapılmıştır. Randomize plasebo kontrollü çalışmalar,cerrahi ve kemoterapi L-MTP-PE ile kombine edildiğinde metastazda anlamlı gecikmeler ve genel sağkalım sürelerinde uzama görülmüştür (71, 72). Ayrıca, L-MTP-PE öncesinde ve sonrasında gerçekleştirilen bronkoalveolar lavaj, pulmoner alveolar makrofajlarda aktivasyon durumunun ve ex vivo antitümör sitotoksisitesinin önemli ölçüde arttığını göstermiştir (73). Bu çalışma, OSA’da metastazın geciktiğini gösteren kritik öneme sahip bir ilkesel kanıt sunmuş ve bu da doğrudan insan OSA’sında cerrahi, kemoterapi ± L-MTP-PE’nin randomize, plasebo kontrollü çalışmasının yapılmasını sağlamıştır (74). Bunun ardından, L-MTP-PE (mifamurtide, Mepact) Avrupa İlaç Ajansı tarafından insan OSA tedavisi için ruhsat onayı almıştır.
Bir başka randomize, çok merkezli cerrahi adjuvan çalışmada, apendiküler OSA’lı köpeklerde karboplatin ile standart bakım tedavisi, yeni lipozomal sisplatin ilacı SPI-77 ile tedavi ile karşılaştırılmıştır. SPI-77’nin tolere edilen maksimum serbest sisplatin dozuna kıyasla beş kat daha fazla sisplatin verme kapasitesine rağmen, geleneksel dozda karboplatin ile karşılaştırıldığında progresyonsuz sağkalım süresinde veya genel sağkalım süresinde herhangi bir iyileşme olmamıştır. Bu sonuçlar, diğer faktörlerle birlikte, SPI-77’nin klinik gelişiminin askıya alınması kararına önemli ölçüde katkıda bulunmuştur (75).
Yakın zamanda yapılan bir çalışmada, splenik HSA’lı köpekler splenektomi sonrasında doksorubisin ve eBAT olarak adlandırılan epidermal büyüme faktörü reseptörü ve ürokinaz hedefli Pseudomonas ekzotoksini kombinasyonu ile tedavi edilmiştir. Bu hedeflerin bazı insan sarkomlarında korunduğu görülmektedir ve bu nedenle köpek HSA, insan homoloğunun farklı histotipine ve nadirliğine rağmen değerli bir translasyonel model olabilir. Çok iyi tolere edilebilirliğe ek olarak, eBAT ile tedavi edilen hastalar tek başına doksorubisin alan tarihsel köpek hastalarla karşılaştırıldığında sonuçların iyileştiği öne sürülmüştür (76). eBAT tedavisinin insanlarda nasıl bir yol izleyeceği şu anda bilinmemektedir.
İMMÜNOTERAPİ
In Yukarıda bahsedilen avantajlara ek olarak, spontan köpek tümörlerinin bir şekilde göz ardı edilen benzersiz bir avantajı, bu tümörlerin zorunlu olarak, insan kanserleri tarafından kullanılanlara çok benzeyen immün-kaçınma stratejileri
geliştirmiş olmasıdır. Bu durum, immün toleransın benzer şekilde gelişmediği sinjeneik murin tümör modelleriyle tam bir tezat oluşturmaktadır. Bu immün-kaçınma stratejileri arasında IL-8, IL-10 ve dönüştürücü büyüme faktörü beta gibi immün- baskılayıcı sitokinlerin yukarı regülasyonu (77-80), düzenleyici T hücreleri (81-83), miyeloid türevli baskılayıcı hücreler (84- 86) ve “sabit durum” makrofajları (87-90) gibi doğuştan gelen immün-baskılayıcı hücrelerin kooptasyonu ve PD-L1 ve B7x gibi immün kontrol noktası moleküllerinin upregülasyonu (91- 95) sayılabilir. Dolayısıyla, köpeklerde kanser immünoterapisinin başarılı olabilmesi için, tıpkı insanlarda olduğu gibi, bu korunmuş immün-kaçınma stratejilerinin üstesinden gelinmesi gerekmektedir.
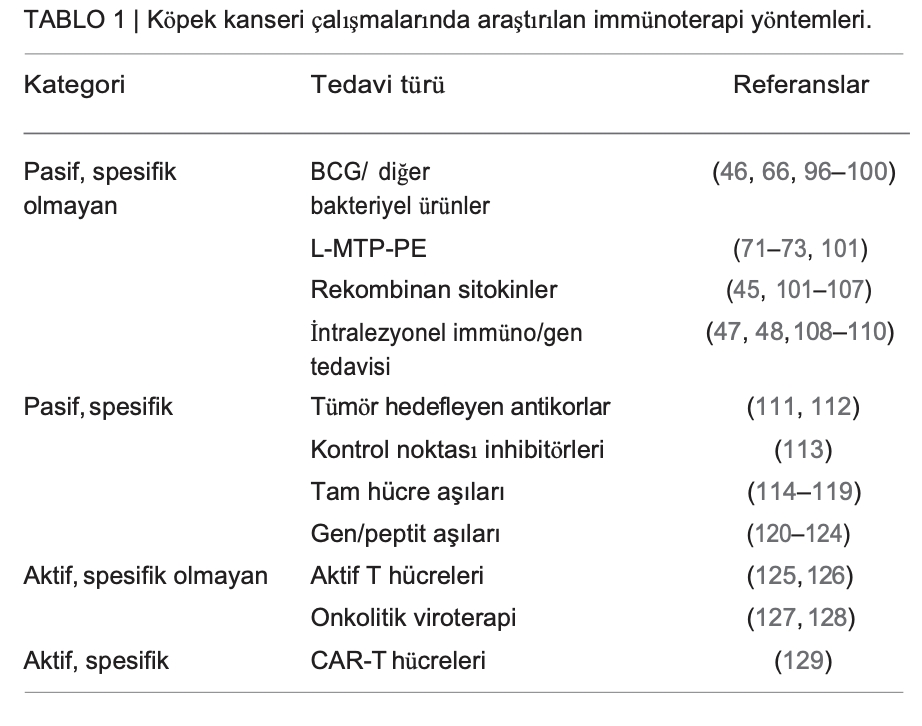
Önceki bölümlerde bahsedilen yaklaşımlara ek olarak, on yıllar boyunca köpeklerde çeşitli immünoterapi stratejileri araştırılmıştır. Bunlar pasif spesifik olmayan immünoterapi yaklaşımlarından köpek kimerik antijen reseptör mühendisliği T (CAR-T) hücreleri ile yapılan ilk çalışmalara kadar uzanmaktadır. Kanserli köpeklerde araştırılan immünoterapi yaklaşımlarının kısmi bir listesi Tablo 1’de verilmiştir. Bu yaklaşımların kapsamlı bir şekilde tartışılması bu makaleninkapsamı dışındadır; ancak bu sayıda köpek tümör immünolojisi ve immünoterapisini tartışan özel bir makale yer almaktadır. Tabloda özetlenen yaklaşımların birçoğu insan klinik çalışmalarına öncülük etmiştir (74, 130, 131).
SONUÇLAR VE GELECEĞE YÖNELİK ÇALIŞMALAR
Sonuç olarak, yeni insan tedavi ve teşhis yöntemlerinin geliştirilmesi için spontan kanserli köpeklerde yapılan çalışmalarda büyük bir potansiyel bulunmaktadır. Genel olarak, köpek çalışmalarının cevap aradığı odaklanmış, a priori bir soru olduğunda ve çalışma başlamadan önce üretilen verilerin kullanımına yönelik bir plan mevcut olduğunda, bu çalışmaların başarı potansiyeli daha yüksektir. Ayrıca, modelin güçlü yönlerinden, özellikle de tümör dokusunu tekrar tekrar örnekleme becerisinden yararlanarak PK/PD ile ilgili sağlam veriler elde etmek artı değer anlamına gelmektedir.
Bu tür veriler, bir tedavinin neden işe yaramadığına ilişkin soruların yanıtlanmasında, tedavinin nasıl işe yaradığını desteklemekten belki de daha önemlidir. Yetersiz ilaç maruziyeti söz konusu muydu? Plazmada yeterli maruziyet var ama tümörde yok muydu? Antitümör aktivite eksikliğine rağmen hedef uygun şekilde inhibe edildi mi?
Ayrıca, köpeklerdeki çalışmaların başarılı bir şekilde uygulanması genellikle hedef ekspresyonunun doğrulanması, hedefin köpek analoguna karşı ilaç aktivitesinin doğrulanması ve sonraki köpek klinik çalışmalarında uygulanacak PD son noktalarının seçilmesi/doğrulanması için preklinik çalışma yapılması gerekir. Köpeklere özgü reaktiflerin eksikliği, bu tür uygulamalar için çapraz reaktif antikorların doğrulanması için genellikle bazı aşamaların yerine getirilmesini gerektirmektedir.
Devam eden temel çalışmalar, köpek kanserinin moleküler temellerini önemli ölçüde genişletme ve insan kanseri ile karşılaştırmaları kolaylaştırma potansiyeline sahiptir. Mutasyon yükünün nicelleştirilmesi, sürücü mutasyonların tanımlanması ve MHC bağlanması için potansiyel neoantijenlerin karakterizasyonu için çeşitli köpek tümör tiplerini karakterize etmek üzere yeni nesil sekanslama (tüm-eksom sekanslama, RNASeq) kullanılması amacıyla mevcut NIH P30 hibelerine bir dizi 1 yıllık idari destek yakın zamanda onaylanmıştır. Ayrıca, insan kanser immünoterapi çalışmalarını aydınlatmak üzere köpek kanserinde yeni immünoterapi yöntemlerini araştırmak için yakın zamanda NIH tarafından bir dizi U01 hibesi finanse edilmiştir. Bu çalışmalar, köpek kanserinin moleküler etkenlerinin anlaşılmasını ve gelecekteki çalışmalar için yeni paylaşılan moleküler hedefleri ve izlenen yolları keşfetme potansiyeline sahiptir.
Devam eden birkaç büyük ölçekli boylamsal çalışma, yaşam tarzı, çevre, yaşlanma ve kanser insidansı ile ilgili çeşitli soruları yanıtlamak ve yeni müdahaleleri değerlendirmek için köpeklerin yaşam sürelerinden yararlanmaktadır. Golden Retriever Yaşam Boyu Sağlık Çalışması (www.morrisanimalfoundation. org/golden- retriever-lifetime-study), köpeklerde kanser ve diğer hastalıklar için çevresel, besinsel, genetik ve yaşam tarzı risk faktörlerini belirlemek amacıyla genç yetişkinlikten ölüme kadar 3.000 ABD golden retriever köpeğini takip etmektedir. Washington Üniversitesi Köpek Yaşlanma Projesi (https://dogagingproject.org), yaşa bağlı çeşitli hastalıkların görülme sıklığını ve risk faktörlerini belirlemek için 10.000 köpeğin profilini çıkarmayı ve takip etmeyi, ayrıca yeni yaşlanma karşıtı (ve potansiyel olarak kanser karşıtı) müdahalelerle daha küçük ölçekli denemeler yapmayı amaçlamaktadır. Köpek Kanserine Karşı Aşılama Çalışması (www.vaccs.org) 800 köpeklik, randomize, plasebo kontrollü, ileriye dönük, çok merkezli bir klinik çalışmadır ve multivalent frameshift aşısının sağlıklı yaşlı köpeklerde kanser gelişimini geciktirme veya önleme yeteneğini incelemeyi amaçlamaktadır. Bu üç uzun vadeli çalışma, kanser için genetik, çevresel, yaşam tarzı ve immünolojik risk faktörlerine önemli ölçüde ışık tutma potansiyeline sahiptir. Sonuçlar merakla beklenmektedir.
KATKIDA BULUNAN YAZARLAR
Yazar, bu çalışmanın tek yazarı olduğunu ve yayınlanması için onay verdiğini beyan etmiştir.
KAYNAKÇA
- Johnson JI, Decker S, Zaharevitz D, Rubinstein LV,Venditti JM, Schepartz S, et al. Relationships between drug activity in NCI preclinical in vitro and in vivo models and early clinical trials. Br J Cancer. (2001) 84:1424–31. doi: 10.1054/bjoc.2001.1796
- Paoloni M, Khanna C. Translation of new cancer treatments from pet dogs to humans. Nat Rev Cancer. (2008) 8:147–56. doi: 10.1038/nrc2273
- Fleming JM, Creevy KE, Promislow DE. Mortality in North American dogs from 1984 to 2004: an investigation into age-, size-, and breed- related causes of death. J Vet Intern Med. (2011) 25:187–98. doi: 10.1111/j.1939-1676.2011.0695.x
- Alvarez CE. Naturally occurring cancers in dogs: insights for translational genetics and medicine. ILAR J. (2014) 55:16–45. doi: 10.1093/ilar/ilu010
- Leblanc AK, Mazcko CN, Khanna C. Defining the value of a comparativeapproach to cancer drug development. Clin Cancer Res. (2016) 22:2133–8.doi: 10.1158/1078-0432.CCR-15-2347
- Leblanc AK, Breen M, Choyke P, Dewhirst M, Fan TM, Gustafson DL, etal. Perspectives from man’s best friend: National Academy of Medicine’s Workshop on Comparative Oncology. Sci Transl Med. (2016) 8:324ps325. doi: 10.1126/scitranslmed.aaf0746
- Vail DM, Thamm DH. Spontaneously occurring tumors in companion animals as models for drug development. In: Teicher BA, Andrews PA, editors. Anticancer Drug Development Guide: Preclinical Screening, Clinical Trials, and Approval, 2nd ed. Totowa, NJ: Humana Press (2004). p. 259–84.
- Ladue T, Klein MK, Veterinary Radiation Therapy Oncology G. Toxicity criteria of the veterinary radiation therapy oncology group. Vet Radiol Ultrasound. (2001) 42:475–6. doi: 10.1111/j.1740-8261.2001.tb00973.x
- V eterinary Cooperative Oncology Group. V eterinary Cooperative Oncology Group – common terminology criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Vet Comp Oncol. (2016) 14:417–46. doi: 10.1111/vco.283
- Vail DM, Michels GM, Khanna C, Selting KA, London CA, Veterinary Cooperative Oncology G. Response evaluation criteria for peripheral nodal lymphoma in dogs (v1.0)–a V eterinary Cooperative Oncology Group (VCOG) consensus document. Vet Comp Oncol. (2010) 8:28–37. doi: 10.1111/j.1476-5829.2009.00200.x
- Nguyen SM, Thamm DH, Vail DM, London CA. Response evaluation criteria for solid tumours in dogs (v1.0): a Veterinary Cooperative Oncology Group (VCOG) consensus document. Vet Comp Oncol. (2015) 13:176–83. doi: 10.1111/vco.12032
- Cline JM, Thrall DE, Page RL, Franko AJ, Raleigh JA. Immunohistochemical detection of a hypoxia marker in spontaneous canine tumours. Br J Cancer. (1990) 62:925–31. doi: 10.1038/bjc.1990.411
- Zeman EM, Calkins DP, Cline JM, Thrall DE, Raleigh JA. The relationship between proliferative and oxygenation status in spontaneous canine tumors. Int J Radiat Oncol Biol Phys. (1993) 27:891–8. doi: 10.1016/0360-3016(93)90465-8
- Cline JM, Thrall DE, Rosner GL, Raleigh JA. Distribution of the hypoxia marker CCI-103F in canine tumors. Int J Radiat Oncol Biol Phys. (1994) 28:921–33. doi: 10.1016/0360-3016(94)90113-9
- Raleigh JA, Zeman EM, Calkins DP, Mcentee MC, Thrall DE. Distribution of hypoxia and proliferation associated markers in spontaneous canine tumors. Acta Oncol. (1995) 34:345–9. doi: 10.3109/02841869509093987
- Cline JM, Rosner GL, Raleigh JA, Thrall DE. Quantification of CCI-103F labeling heterogeneity in canine solid tumors. Int J Radiat Oncol Biol Phys.
(1997) 37:655–62. doi: 10.1016/S0360-3016(96)00559-7
- Thrall DE, Rosner GL, Azuma C, Mcentee MC, Raleigh JA. Hypoxia marker labeling in tumor biopsies: quantification of labeling variation and criteria for biopsy sectioning. Radiother Oncol. (1997) 44:171–6. doi: 10.1016/S0167-8140(97)01931-2
- Zachos TA, Aiken SW, Diresta GR, Healey JH. Interstitial fluid pressure and blood flow in canine osteosarcoma and other tumors. Clin Orthop Relat Res. (2001) 230–6. doi: 10.1097/00003086-200104000- 00034
- Larue SM, Withrow SJ, Powers BE, Wrigley RH, Gillette EL, Schwarz PD, et al. Limb-sparing treatment for osteosarcoma in dogs. J Am Vet Med Assoc. (1989) 195:1734–44.20. Thrall DE, Withrow SJ, Powers BE, Straw RC, Page RL, Heidner GL, et al. Radiotherapy prior to cortical allograft limb sparing in dogs with osteosarcoma: a dose response assay. Int J Radiat Oncol Biol Phys. (1990) 18:1351–7. doi: 10.1016/0360-3016(90)90308-7
21. Withrow SJ, Thrall DE, Straw RC, Powers BE, Wrigley RH, Larue SM, et al. Intra-arterial cisplatin with or without radiation in limb-sparing for canine osteosarcoma. Cancer. (1993) 71:2484–90. doi: 10.1002/1097- 0142(19930415)71:8<2484::AID-CNCR2820710810>3.0.CO;2-D
22.Withrow SJ, Thrall DE, Straw RC, Powers BE, Wrigley RH, Larue SM, et al. Intra-arterial cisplatin with or without radiation in limb-sparing for canine osteosarcoma. Cancer. (1993) 71:2484–90. doi: 10.1002/1097- 0142(19930415)71:8<2484::AID-CNCR2820710810>3.0.CO;2-D Withrow SJ, Wilkins RM. Cross talk from pets to people: translational osteosarcoma treatments. ILAR J. (2010) 51:208–13. doi: 10.1093/ilar.51.3.208
23.Lascelles BD, Dernell WS, Correa MT, Lafferty M, Devitt CM, Kuntz CA, et al. Improved survival associated with postoperative wound infection in dogs treated with limb-salvage surgery for osteosarcoma. Ann Surg Oncol. (2005) 12:1073–83. doi: 10.1245/ASO.2005.01.011
24.Jeys LM, Grimer RJ, Carter SR, Tillman RM, Abudu A. Post operative infection and increased survival in osteosarcoma patients: are they associated? Ann Surg Oncol. (2007) 14:2887–95. doi: 10.1245/s10434-007-9483-8
25.Sottnik JL, U’Ren LW, Thamm DH, Withrow SJ, Dow SW. Chronic bacterial osteomyelitis suppression of tumor growth requires innate immune responses. Cancer Immunol Immunother. (2010) 59:367–78. doi: 10.1007/s00262-009-0755-y
26.Gillette EL, Maurer GD, Severin GA. Endothelial repair of radiation damage following beta irradiation. Radiology. (1975) 116:175–7. doi: 10.1148/116.1.175
27.Fike JR, Gillette EL, Clow DJ. Repair of sublethal radiation damage by capillaries. Int J Radiat Oncol Biol Phys. (1979) 5:339–42. doi: 10.1016/0360-3016(79)91213-6
28.Gavin PR, Gillette EL. Radiation response of the canine cardiovascular system. Radiat Res. (1982) 90:489–500. doi: 10.2307/3575726
29.Gillette EL, Mcchesney SL, Hoopes PJ. Isoeffect curves for radiation-induced cardiomyopathy in the dog. Int J Radiat Oncol Biol Phys. (1985) 11:2091–7. doi: 10.1016/0360-3016(85)90089-6
30.Hoopes PJ, Gillette EL, Benjamin SA. The pathogenesis of radiation nephropathy in the dog. Radiat Res. (1985) 104:406–19. doi: 10.2307/3576600 Powers BE, Mcchesney SL, Gillette EL. Late radiation response of the canine trachea with change in dose per fraction. Int J Radiat Oncol Biol Phys. (1987) 13:1673–80. doi: 10.1016/0360-3016(87)90164-7
31.Powers BE, Mcchesney SL, Gillette EL. Late radiation response of the canine trachea with change in dose per fraction. Int J Radiat Oncol Biol Phys. (1987) 13:1673–80. doi: 10.1016/0360-3016(87)90164-7
32.Ahmadu-Suka F, Gillette EL, Withrow SJ, Husted PW, Nelson AW, Whiteman CE. Exocrine pancreatic function following intraoperative irradiation of the canine pancreas. Cancer. (1988) 62:1091–5. doi: 10.1002/ 1097-0142(19880915)62:6<1091::AID-CNCR2820620611>3.0.CO;2-A
33. Ching SV, Gillette SM, Powers BE, Roberts SM, Gillette EL, Withrow SJ. Radiation-induced ocular injury in the dog: a histological study. Int J Radiat Oncol Biol Phys. (1990) 19:321–8. doi: 10.1016/0360-3016(90)90540-Z
34.Gillette SM, Powers BE, Orton EC, Gillette EL. Early radiation response of the canine heart and lung. Radiat Res. (1991) 125:34–40. doi: 10.2307/3577979
35.Powers BE, Gillette EL, Gillette SL, Lecouteur RA, Withrow SJ. Muscle injury following experimental intraoperative irradiation. Int J Radiat Oncol Biol Phys. (1991) 20:463–71. doi: 10.1016/0360-3016(91)90058-C
36.Gillette SM, Dewhirst MW, Gillette EL, Thrall DE, Page RL, Powers BE, et al. Response of canine soft tissue sarcomas to radiation or radiation plus hyperthermia: a randomized phase II study. Int J Hyperthermia. (1992) 8:309–20. doi: 10.3109/02656739209021786
37.McChesney SL, Gillette EL, Powers BE. Response of the canine lung to fractionated irradiation: pathologic changes and isoeffect curves. Int J Radiat Oncol Biol Phys. (1989) 16:125–32. doi: 10.1016/0360-3016(89)90019-9
38.Mackie TR, Kapatoes J, Ruchala K, Lu W, Wu C, Olivera G, et al. Image guidance for precise conformal radiotherapy. Int J Radiat Oncol Biol Phys. (2003) 56:89–105. doi: 10.1016/S0360-3016(03)00090-7
39.Forrest LJ, Mackie TR, Ruchala K, Turek M, Kapatoes J, Jaradat H, et al. The utility of megavoltage computed tomography images from a helical tomotherapy system for setup verification purposes. Int J Radiat Oncol Biol Phys. (2004) 60:1639–44. doi: 10.1016/j.ijrobp.2004.08.016
40.Thrall DE, Larue SM, Pruitt AF, Case B, Dewhirst MW. Changes in tumour oxygenation during fractionated hyperthermia and radiation therapy in spontaneous canine sarcomas. Int J Hyperthermia. (2006) 22:365–73.
doi: 10.1080/02656730600836386
- Chi JT, Thrall DE, Jiang C, Snyder S, Fels D, Landon C, et al.Comparison of genomics and functional imaging from canine sarcomas treated with thermoradiotherapy predicts therapeutic response and identifies combination therapeutics. Clin Cancer Res. (2011) 17:2549–60. doi: 10.1158/1078-0432.CCR-10-2583
- Thrall DE, Maccarini P, Stauffer P, Macfall J, Hauck M, Snyder S, et al. Thermal dose fractionation affects tumour physiological response. Int J Hyperthermia. (2012) 28:431–40. doi: 10.3109/02656736.2012.689087
- Hershey AE, Kurzman ID, Forrest LJ, Bohling CA, Stonerook M, Placke ME, et al. Inhalation chemotherapy for macroscopic primary or metastatic lung tumors: proof of principle using dogs with spontaneously occurring tumors as a model. Clin Cancer Res. (1999) 5:2653–9.
- Rodriguez CO Jr., Crabbs TA, Wilson DW, Cannan VA, Skorupski KA, et al. Aerosol gemcitabine: preclinical safety and in vivo antitumor activity in osteosarcoma-bearing dogs. J Aerosol Med Pulm Drug Deliv. (2010) 23:197–206. doi: 10.1089/jamp.2009.0773
- Khanna C, Anderson PM, Hasz DE, Katsanis E, Neville M, Klausner JS. Interleukin-2 liposome inhalation therapy is safe and effective for dogs with spontaneous pulmonary metastases. Cancer. (1997) 79:1409–21. doi: 10. 1002/(SICI)1097-0142(19970401)79:7<1409::AID-CNCR19>3.0.CO;2-3
- Roberts NJ, Zhang L, Janku F, Collins A, Bai RY, Staedtke V, et al. Intratumoral injection of Clostridium novyi-NT spores induces antitumor responses. Sci Transl Med. (2014) 6:249ra111. doi: 10.1126/scitranslmed.3008982
- Dow SW, Elmslie RE, Willson AP, Roche L, Gorman C, Potter TA. In vivo tumor transfection with superantigen plus cytokine genes induces tumor regression and prolongs survival in dogs with malignant melanoma. J Clin
Invest. (1998) 101:2406–14. doi: 10.1172/JCI510
- Thamm DH, Kurzman ID, Macewen EG, Feinmehl R, Towell TL, Longhofer SL, et al. Intralesional lipid-complexed cytokine/superantigen immunogene therapy for spontaneous canine tumors. Cancer Immunol Immunother. (2003) 52:473–80. doi: 10.1007/s00262-003-0387-6
- Finocchiaro LM, Villaverde MS, Gil-Cardeza ML, Riveros MD, Glikin GC. Cytokine-enhanced vaccine and interferon-beta plus suicide gene as combined therapy for spontaneous canine sarcomas. Res Vet Sci. (2011) 91:230–4. doi: 10.1016/j.rvsc.2010.12.012
- Westberg S, Sadeghi A, Svensson E, Segall T, Dimopoulou M, Korsgren O, et al. Treatment efficacy and immune stimulation by AdCD40L gene therapy of spontaneous canine malignant melanoma. J Immunother. (2013) 36:350–8. doi: 10.1097/CJI.0b013e31829d8a1b
- Theon AP, Madewell BR, Moore AS, Stephens C, Krag DN. Localized thermo-cisplatin therapy: a pilot study in spontaneous canine and feline tumours. Int J Hyperthermia. (1991) 7:881–92. doi: 10.3109/02656739109056456
- Kitchell BE, Brown DM, Luck EE, Woods LL, Orenberg EK, Bloch DA. Intralesional implant for treatment of primary oral malignant melanoma in dogs. J Am Vet Med Assoc. (1994) 204:229–36.
- Theon AP, Madewell BR, Ryu J, Castro J. Concurrent irradiation and intratumoral chemotherapy with cisplatin: a pilot study in dogs with spontaneous tumors. Int J Radiat Oncol Biol Phys. (1994) 29:1027–34. doi: 10.1016/0360-3016(94)90398-0
- Kitchell BK, Orenberg EK, Brown DM, Hutson C, Ray K, Woods L, et al. Intralesional sustained-release chemotherapy with therapeutic implants for treatment of canine sun-induced squamous cell carcinoma. Eur J Cancer.
(1995) 31A:2093–8. doi: 10.1016/0959-8049(95)00446-7
- Venable RO, Worley DR, Gustafson DL, Hansen RJ, Ehrhart EJ III, Cai S, et al. Effects of intratumoral administration of a hyaluronan-cisplatin nanoconjugate to five dogs with soft tissue sarcomas. Am J Vet Res. (2012) 73:1969–76. doi: 10.2460/ajvr.73.12.1969
- London CA, Galli SJ, Yuuki T, Hu ZQ, Helfand SC, Geissler EN. Spontaneous canine mast cell tumors express tandem duplications in the proto-oncogene c-kit. Exp Hematol. (1999) 27:689–97. doi: 10.1016/S0301-472X(98) 00075-7
- Decker B, Parker HG, Dhawan D, Kwon EM, Karlins E, Davis BW, et al. Homologous mutation to human BRAF V600E is common in naturally occurring canine bladder cancer–evidence for a relevant model system
58.Mochizuki H, Breen M. Sequence analysis of RAS and RAF mutation hot spots in canine carcinoma. Vet Comp Oncol. (2017) 15:1598–605. doi: 10.1111/vco.12275
59.Liao AT, Chien MB, Shenoy N, Mendel DB, Mcmahon G, Cherrington JM, et al. Inhibition of constitutively active forms of mutant kit by multitargeted indolinone tyrosine kinase inhibitors. Blood. (2002) 100:585– 93. doi: 10.1182/blood-2001-12-0350
60.London CA, Hannah AL, Zadovoskaya R, Chien MB, Kollias-Baker C, Rosenberg M, et al. Phase I dose-escalating study of SU11654, a small molecule receptor tyrosine kinase inhibitor, in dogs with spontaneous malignancies. Clin Cancer Res. (2003) 9:2755–68.
61.Pryer NK, Lee LB, Zadovaskaya R, Yu X, Sukbuntherng J, Cherrington JM, et al. Proof of target for SU11654: inhibition of KIT phosphorylation in canine mast cell tumors. Clin Cancer Res. (2003) 9:5729–34.
62. London CA, Malpas PB, Wood-Follis SL, Boucher JF, Rusk AW, Rosenberg MP, et al. Multi-center, placebo-controlled, double-blind, randomized study of oral toceranib phosphate (SU11654), a receptor tyrosine kinase inhibitor, for the treatment of dogs with recurrent (either local or distant) mast cell tumor following surgical excision. Clin Cancer Res. (2009) 15:3856–65. doi: 10.1158/1078-0432.CCR-08-1860
63. London CA, Bernabe LF, Barnard S, Kisseberth WC, Borgatti A, Henson M, et al. Preclinical evaluation of the novel, orally bioavailable Selective Inhibitor of Nuclear Export (SINE) KPT-335 in spontaneous canine cancer: results of a phase I study. PLoS ONE. (2014) 9:e87585. doi: 10.1371/journal.pone.0087585
64. Honigberg LA, Smith AM, Sirisawad M, Verner E, Loury D, Chang B, et al. The Bruton tyrosine kinase inhibitor PCI-32765 blocks B-cell activation and is efficacious in models of autoimmune disease and B-cell malignancy. Proc Natl Acad Sci USA. (2010) 107:13075–80. doi: 10.1073/pnas.1004594107
65. Paoloni MC, Tandle A, Mazcko C, Hanna E, Kachala S, Leblanc A, et al. Launching a novel preclinical infrastructure: comparative oncology trials consortium directed therapeutic targeting of TNFalpha to cancer vasculature. PLoS ONE. (2009) 4:e4972. doi: 10.1371/journal.pone.0004972
66. Thamm DH, Kurzman ID, King I, Li Z, Sznol M, Dubielzig RR, et al. Systemic administration of an attenuated, tumor-targeting Salmonella typhimurium to dogs with spontaneous neoplasia: phase I evaluation. Clin Cancer Res. (2005) 11:4827–34. doi: 10.1158/1078-0432.CCR-04-2510
67. Toso JF, Gill VJ, Hwu P, Marincola FM, Restifo NP, Schwartzentruber DJ, et al. Phase I study of the intravenous administration of attenuated Salmonella typhimurium to patients with metastatic melanoma. J Clin Oncol. (2002) 20:142–52. doi: 10.1200/JCO.20.1.142
68. Hauck ML, Larue SM, Petros WP, Poulson JM, Yu D, Spasojevic I, et al. Phase I trial of doxorubicin-containing low temperature sensitive liposomes in spontaneous canine tumors. Clin Cancer Res. (2006) 12:4004– 10. doi: 10.1158/1078-0432.CCR-06-0226
69. Barnard RA, Wittenburg LA, Amaravadi RK, Gustafson DL, Thorburn A, Thamm DH. Phase I clinical trial and pharmacodynamic evaluation of combination hydroxychloroquine and doxorubicin treatment in pet dogs treated for spontaneously occurring lymphoma. Autophagy. (2014) 10:1415– 25. doi: 10.4161/auto.29165
70. Burton JH, Mazcko C, Leblanc A, Covey JM, Ji J, Kinders RJ, et al. NCI Comparative Oncology Program testing of non- camptothecin indenoisoquinoline topoisomerase i inhibitors in naturally occurring canine lymphoma. Clin Cancer Res. (2018) 24:5830–40. doi: 10.1158/1078-0432.CCR-18-1498
71. Kurzman ID, Macewen EG, Rosenthal RC, Fox LE, Keller ET, Helfand SC, et al. Adjuvant therapy for osteosarcoma in dogs: results of randomized clinical trials using combined liposome-encapsulated muramyl tripeptide and cisplatin. Clin Cancer Res. (1995) 1:1595–601.
72. Vail DM, Macewen EG, Kurzman ID, Dubielzig RR, Helfand SC, Kisseberth WC, et al. Liposome-encapsulated muramyl tripeptide phosphatidylethanolamine adjuvant immunotherapy for splenic hemangiosarcoma in the dog: a randomized multi-institutional clinical trial. Clin Cancer Res. (1995)1:1165–70.
73. Kurzman ID, Shi F, Vail DM, Macewen EG. In vitro and in vivo enhancement of canine pulmonary alveolar macrophage cytotoxic activity against canine osteosarcoma cells. Cancer Biother Radiopharm. (1999)
14:121–8. doi: 10.1089/cbr.1999.14.121
- Meyers PA, Schwartz CL, Krailo M, Kleinerman ES, Betcher D,Bernstein ML, et al. Osteosarcoma: a randomized, prospective trial of the addition of ifosfamide and/or muramyl tripeptide to cisplatin, doxorubicin, and high-dose methotrexate. J Clin Oncol. (2005) 23:2004–11. doi: 10.1200/JCO.2005.06.031
- Vail DM, Kurzman ID, Glawe PC, O’Brien MG, Chun R, Garrett LD, et al. STEALTH liposome-encapsulated cisplatin (SPI-77) versus carboplatin as adjuvant therapy for spontaneously arising osteosarcoma (OSA) in the dog: a randomized multicenter clinical trial. Cancer Chemother Pharmacol. (2002) 50:131–6. doi: 10.1007/s00280-002-0469-8
- Borgatti A, Koopmeiners JS, Sarver AL, Winter AL, Stuebner K, Todhunter D, et al. Safe and effective sarcoma therapy through bispecific targeting of EGFR and uPAR. Mol Cancer Ther. (2017) 16:956–65. doi: 10.1158/1535-7163.MCT-16-0637
- Itoh H, Horiuchi Y, Nagasaki T, Sakonju I, Kakuta T, Fukushima U, et al. Evaluation of immunological status in tumor-bearing dogs. Vet Immunol Immunopathol. (2009) 132:85–90. doi: 10.1016/j.vetimm.2009.04.020
- De Andres PJ, Illera JC, Caceres S, Diez L, Perez-Alenza MD, Pena
L. Increased levels of interleukins 8 and 10 as findings of canine inflammatory mammary cancer. V et Immunol Immunopathol. (2013) 152:245–51. doi: 10.1016/j.vetimm.2012.12.010 - Kim JH, Frantz AM, Anderson KL, Graef AJ, Scott MC, Robinson S, et al. Interleukin-8 promotes canine hemangiosarcoma growth by regulating the tumor microenvironment. Exp Cell Res. (2014) 323:155–64. doi: 10.1016/j.yexcr.2014.02.020
- Troyer RM, Ruby CE, Goodall CP, Yang L, Maier CS, Albarqi HA, et al. Exosomes from osteosarcoma and normal osteoblast differ in proteomic cargo and immunomodulatory effects on T cells. Exp Cell Res. (2017) 358:369–76. doi: 10.1016/j.yexcr.2017.07.011
- Biller BJ, Elmslie RE, Burnett RC, Avery AC, Dow SW. Use of FoxP3 expression to identify regulatory T cells in healthy dogs and
dogs with cancer. V et Immunol Immunopathol. (2007) 116:69–78. doi: 10.1016/j.vetimm.2006.12.002
82. O’Neill K, Guth A, Biller B, Elmslie R, Dow S. Changes in regulatory T cells in dogs with cancer and associations with tumor type. J Vet Intern Med. (2009) 23:875–81. doi: 10.1111/j.1939-1676.2009.0333.x
83. Biller BJ, Guth A, Burton JH, Dow SW. Decreased ratio of CD8+
T cells to regulatory T cells associated with decreased survival in dogs with osteosarcoma. J V et Intern Med. (2010) doi: 10.1111/j.1939-1676.2010.0557.x
24:1118–23.
- Goulart MR, Pluhar GE, Ohlfest JR. Identification of myeloid derived suppressor cells in dogs with naturally occurring cancer. PLoS ONE. (2012) 7:e33274. doi: 10.1371/journal.pone.0033274
- Sherger M, Kisseberth W , London C, Olivo -Marston S, Papenfuss TL. Identification of myeloid derived suppressor cells in the peripheral blood of tumor bearing dogs. BMC Vet Res. (2012) 8:209. doi: 10.1186/1746-6148-8-209
- Goulart MR, Hlavaty SI, Chang YM, Polton G, Stell A, Perry J, et al. Phenotypic and transcriptomic characterization of canine myeloid-derived suppressor cells. Sci Rep. (2019) 9:3574. doi: 10.1038/s41598-019-40285-3
- Beirao BC, Raposo T, Pang LY, Argyle DJ. Canine mammary cancer cells direct macrophages toward an intermediate activation state between M1/M2. BMC Vet Res. (2015) 11:151. doi: 10.1186/s12917-015-0473-y
- Regan DP, Escaffi A, Coy J, Kurihara J, Dow SW. Role of monocyte recruitment in hemangiosarcoma metastasis in dogs. Vet Comp Oncol. (2017) 15:1309–22. doi: 10.1111/vco.12272
- Monteiro LN, Rodrigues MA, Gomes DA, Salgado BS, Cassali GD. Tumour- associated macrophages: relation with progression and invasiveness, and assessment of M1/M2 macrophages in canine mammary tumours. Vet J. (2018) 234:119–25. doi: 10.1016/j.tvjl.2018.02.016
- Seung BJ, Lim HY, Shin JI, Kim HW, Cho SH, Kim SH, et al. CD204- expressing tumor-associated macrophages are associated with malignant, high-grade, and hormone receptor-negative canine mammary gland tumors. V et Pathol. (2018) 55:417–24. doi: 10.1177/0300985817750457
- Maekawa N, Konnai S, Ikebuchi R, Okagawa T, Adachi M, Takagi S, et al. Expression of PD-L1 on canine tumor cells and enhancement of IFN-gamma production from tumor-infiltrating cells by PD-L1 blockade. PLoS ONE. (2014) 9:e98415. doi: 10.1371/journal.pone.0098415
Maekawa N, Konnai S, Okagawa T, Nishimori A, Ikebuchi R, Izumi Y, et al. Immunohistochemical analysis of PD-L1 expression in canine malignant cancers and PD-1 expression on lymphocytes in canine oral melanoma. PLoS ONE. (2016) 11:e0157176. doi: 10.1371/journal.pone.0157176
93. Ambrosius LA, Dhawan D, Ramos-Vara JA, Ruple A, Knapp DW, Childress MO. Quantification and prognostic value of programmed cell death ligand-1 expression in dogs with diffuse large B-cell lymphoma. Am J Vet Res. (2018) 79:643–9. doi: 10.2460/ajvr.79.6.643
94. Hartley G, Elmslie R, Dow S, Guth A. Checkpoint molecule expression by B and T cell lymphomas in dogs. Vet Comp Oncol. (2018) 16:352–60. doi: 10.1111/vco.12386
95. Chand SK, Pendharkar SA, Bharmal SH, Bartlett AS, Pandol SJ, Petrov MS. Frequency and risk factors for liver disease following pancreatitis: a population-based cohort study. Dig Liver Dis. (2019) 51:551–8. doi: 10.1016/j.dld.2018.11.001
96.Bech-Nielsen S, Brodey RS, Fidler IJ, Abt DA, Reif JS. The effect of BCG on in vitro immune reactivity and clinical course in dogs treated surgically for osteosarcoma. Eur J Cancer. (1977) 13:33–41. doi: 10.1016/0014-2964(77)90227-4
97.Bostock DE, Gorman NT. Intravenous BCG therapy of mammary carcinoma
in bitches after surgical excision of the primary tumour. Eur J Cancer. (1978) 14:879–83. doi: 10.1016/0014-2964(78)90104-4
98.Meyer JA, Dueland RT, Macewen EG, Macy DW, Hoefle WD, Richardson
RC, et al. Canine osteogenic sarcoma treated by amputation and MER:
an adverse effect of splenectomy on survival. Cancer. (1982) 49:1613–6.
doi: 10.1002/1097-0142(19820415)49:8<1613::AID-CNCR2820490814>3.0.CO;2- R99.Parodi AL, Misdorp W, Mialot JP, Mialot M, Hart AA, Hurtrel M, et al. Intratumoral BCG and Corynebacterium parvum therapy of canine mammary tumours before radical mastectomy. Cancer Immunol Immunother. (1983) 15:172–7. doi: 10.1007/BF00199160
100.Henry CJ, Downing S, Rosenthal RC, Klein MK, Meleo K, Villamil JA, et al. Evaluation of a novel immunomodulator composed of human chorionic gonadotropin and bacillus Calmette-Guerin for treatment of canine mast cell tumors in clinically affected dogs. Am J Vet Res. (2007) 68:1246–51. doi: 10.2460/ajvr.68.11.1246
101.Macewen EG, Kurzman ID, Vail DM, Dubielzig RR, Everlith K, Madewell BR, et al. Adjuvant therapy for melanoma in dogs: results of randomized clinical trials using surgery, liposome-encapsulated muramyl tripeptide, and granulocyte macrophage colony-stimulating factor. Clin Cancer Res. (1999) 5:4249–58.
102.Moore AS, Theilen GH, Newell AD, Madewell BR, Rudolf AR. Preclinical study of sequential tumor necrosis factor and interleukin 2 in the treatment of spontaneous canine neoplasms. Cancer Res. (1991) 51:233–8.
103.Mito K, Sugiura K, Ueda K, Hori T, Akazawa T, Yamate J, et al. IFNγ markedly cooperates with intratumoral dendritic cell vaccine in dog tumor models. Cancer Res. (2010) 70:7093–101. doi: 10.1158/0008-5472.CAN-10-0600104.Henson MS, Curtsinger JM, Larson VS, Klausner JS, Modiano JF, Mescher MF, et al. Immunotherapy with autologous tumour antigen-coated microbeads (large multivalent immunogen), IL-2 and GM-CSF in dogs with spontaneous B-cell lymphoma. Vet Comp Oncol. (2011) 9:95–105. doi: 10.1111/j.1476-5829.2010.00234.x
105.Konietschke U, Teske E, Jurina K, Stockhaus C. Palliative intralesional interleukin-2 treatment in dogs with urinary bladder and urethral carcinomas. In Vivo. (2012) 26:931–5.
106.Haagsman AN, Witkamp AC, Sjollema BE, Kik MJ, Kirpensteijn J. The effect of interleukin-2 on canine peripheral nerve sheath tumours after marginal surgical excision: a double-blind randomized study. BMC Vet Res. (2013) 9:155. doi: 10.1186/1746-6148-9-155107.Ziekman PG, Otter WD, Tan JF, Teske E, Kirpensteijn J, Koten JW , et al. Intratumoural interleukin -2 therapy can induce regression of non-resectable mastocytoma in dogs. Anticancer Res. (2013) 33:161–5.
108.Finocchiaro LM, Fondello C, Gil-Cardeza ML, Rossi UA, Villaverde MS, Riveros MD, et al. Cytokine-enhanced vaccine and interferon-beta plus