| AÇIK ERİŞİM EDİTLEYEN: Wayne S. Schwark, Cornell Üniversitesi, Amerika
İNCELEYEN: Joseph Wakshlag, Cornell Üniversitesi, Amerika Tim Karl, Batı Sydney Üniversitesi, Avustralya *İLETİŞİM: Giorgia della Rocca giorgia.dellarocca@unipg.it †Söz konusu yazarlar bu çalışmaya eşit derecede katkıda bulunmuşlardır SUNUM: 12 Nisan 2023 MAKALEYE ATIFTA BULUNMAK İÇİN: Di Salvo A, Conti MB and della Rocca G (2023) Pharmacokinetics, efficacy, and safety of cannabidiol in dogs: an update of current knowledge. Front. Vet. Sci. 10:1204526. doi: 10.3389/fvets.2023.1204526 TELİF HAKKI © 2023 Di Salvo, Conti and della Rocca. Bu makale Creative Commons Attribution License (CC BY) koşulları altında dağıtılan açık erişimli bir makaledir. Asıl yazar(lar)a ve telif hakkı sahip(ler)ine ve dergideki orijinal yayına atıfta bulunulması koşuluyla, kabul görmüş akademik teamüllere uygun olarak diğer forumlarda kullanımına, dağıtımına veya çoğaltılmasına izin verilir. Bu şartlara uymayan hiçbir kullanım, dağıtım veya çoğaltmaya izin verilmez. |
| Centro di Studio sul Dolore Animale (CeRiDA), Dipartimento di Medicina Veterinaria di Perugia, Perugia, İtalya |
| Son 5 yılda, veteriner hekimlikte ağrı, epilepsi, anksiyete, bulantı, iştahsızlık, deri lezyonları ve hatta bazı kanser türleri de dahil olmak üzere çeşitli patolojileri tedavi etmek için fitokanabinoidlerin, özellikle de kannabidiolün (CBD) kullanımına olan ilgi artmıştır. Nitekim, CBD kullanımına ilişkin olumlu bakış açısı nedeniyle, birçok evcil hayvan sahibi evcil hayvanlarını iyileştirmek için bu seçeneği giderek daha fazla talep etmekte ve birçok veteriner hekim de hastaları için bu olasılığı araştırmaktadır. CBD’nin evcil hayvanlarda yaygın ampirik kullanımının yanı sıra, araştırmalar etkinliğini ve yan etkilerinin olmadığını kanıtlamaya ve ayrıca uygun bir pozoloji tanımlamak için farmakokinetiğini belirlemeye çalışmaktadır. Bu inceleme, CBD ve kannabidiolik asidin (CBDA) köpek farmakokinetiği, etkinliği ve tolere edilebilirliği hakkında şimdiye kadar yayınlanan tüm verileri özetlemektedir. Belirli sayıda mevcut farmakokinetik çalışmaya rağmen, CBD’nin kinetik profili, muhtemelen birbirinden çok farklı deneysel koşullar nedeniyle henüz tam olarak bilinmemektedir. Etkinlik açısından, çoğu çalışma CBD’nin osteoartritik ağrıyı hafifletme yeteneğini test etmiştir. Buna karşılık, az sayıdaki çalışma CBD’nin epilepsi, davranış bozuklukları ve cilt lezyonlarındaki rolünü değerlendirmiştir. Elde edilen sonuçlara göre, CBD’nin yararlı etkisini destekleyen bazı kanıtlar mevcuttur. Bununla birlikte, yayınlanan çalışmaların sınırlı sayıda olması ve neredeyse tamamında önyargı meydana gelmesi, bulguların yorumlanmasında dikkatli olunmasını gerektirmektedir. Tolere edilebilirlik çalışmalarına göre, CBD’nin yan etkileri hafif veya önemsiz olarak sınıflandırılabilir. Bununla birlikte, CBD genellikle uzun süreli tedavi için kullanılırken, çalışmalar yaygın olarak kısa ve orta vadeli tedaviye odaklanmıştır. CBD’nin köpek tedavisinde kullanılabilir bir ek ilaç olup olmadığını daha iyi tanımlamak için daha fazla çalışma yapılması gerekmektedir. ANAHTAR KELİMELER fitokannabinoidler, kannabidiol, CBD, köpek, farmakokinetik, etkinlik, tolere edilebilirlik |
GirişSon 30 yılda, yapılan araştırmalarla endokannabinoid sistemin (ECS) ve bedensel işlevlerinin incelenmesi ve anlaşılması konusunda önemli adımlar atılmıştır. ECS sentetik olarak kannabinoid reseptörleri [Tip 1 kannabinoid reseptörü (CB1), Tip 2 kannabinoid reseptörü (CB2), G protein-bağlı reseptör 55 ve 119 (GPR55, GPR119), geçici reseptör potansiyel vanilloid (TRPV) ve peroksizom proliferatör-aktive reseptör (PPAR) gibi], endokannabinoidler [vücut tarafından üretilen ve anandamid (AEA) ve 2-Arakidonoilgliserol (2-AG) gibi kannabinoid reseptörlerine bağlanan bileşikler], bunların sentezinden ve katabolizmasından sorumlu enzimler ve bu proteinleri kodlayan genler kümesi olarak tanımlanabilir. “Endokannabinoidom” terimi yakın zamanda bu set için ortaya atılmıştır (1). Bu sistem, antioksidan, hipotansif, immünosupresif, anti-enflamatuar ve ağrı giderici etki göstererek çok sayıda homeostatik işlevin temelini oluşturduğundan organizmanın normal işleyişi için büyük önem taşımaktadır. Ayrıca, kannabinoid reseptörlerinin beyindeki dağılımı, endokannabinoidlerin hareket ve algının kontrolünde, uyku ve iştahın düzenlenmesinde, öğrenme ve hafıza süreçlerinin inhibisyonunda, duygusal durumların düzenlenmesinde (keyif ve saldırganlık gibi), nöroproteksiyonda ve opioidlerin etkisini arttırmada fizyolojik bir rol oynadığını düşündürmektedir. Yapılan çeşitli gözlemler ECS’nin vazomotor işlevlerin ve doğurganlığın yanı sıra tümör hücresi proliferasyonunun kontrolünde de rol oynadığını göstermektedir (2). Önceden oluşturulmuş endojen kannabinoid sisteminin keşfi, araştırmacıların Cannabis sativa’da (hem tıbbi hem de endüstriyel kültivar – ki bu kültivar aynı zamanda kenevir olarak da bilinir) bulunan aktif bileşenlerin, özellikle fitokannabinoidlerin, bu sistemle etkileşime girerek bitkinin hem terapötik hem de psikotropik etki yaratabileceği hipotezini ortaya atmalarına neden olmuştur. Kannabidiol (CBD), CB1, CB2, GPR55, GPR119, TRPV ve PPAR dahil olmak üzere bir dizi reseptöre afinitesi olan, psikoaktif olmayan, bol miktarda bulunan bir fitokannabinoiddir. CBD, bu reseptörlerin aktivitelerini modüle ederek nöroprotektif, antiepileptik, anksiyolitik, antipsikotik, anti-enflamatuar, analjezik ve antikanser özellikleri de dahil olmak üzere birçok terapötik etki göstermektedir (3). Veteriner hekimlikte, Kenevir türevlerinin terapötik amaçlı kullanımı birkaç yıl önce gündeme gelmeye başlamıştır. İlk çalışmalar, hayvan türlerinde ECS’nin varlığını ortaya koymaya yönelikti. Köpek türlerine özel olarak, sağlıklı köpeklerin ve atopik dermatiti (AD) olan köpeklerin deri ve deri uzantılarında (4-8), gastrointestinal sistemde (9, 10), periferik ve merkezi sinir sisteminde (11-13), eklemlerde (14) ve embriyoda (15) kannabinoid reseptörlerinin veya ligandlarının varlığı tespit edilmiştir. Esrarın hayvanlarda olası kullanımı arasında, şu gibi çeşitli başlıklar dikkate alınmıştır: ağrı yönetimi (akut ve kronik ağrı) (16), nörolojik durumlar (nöbetler, nöroinflamasyon, dejeneratif hastalıklar, beyin tümörleri) (17), sıhhat (anksiyete bozuklukları) (18), gastrointestinal sağlık (iştah modülasyonu, bulantı ve kusma, visseral ağrı/hipersensitivite, özofageal reflü, diyare/peristaltizm) (19), dermatolojik hastalıklar (deri iltihabı, yara iyileşmeleri, deri alerjileri, kaşıntı) (20), onkoloji ve immün yanıt (21). Kannabis türevlerinin, özellikle de kannabidiolün (CBD) veteriner hekimlikteki potansiyel terapötik rolüne ilişkin artan bilgi ve bazı eyaletlerde kannabinoidlerin yakın zamanda yasallaştırılması ile birlikte, daha fazla veteriner hekim ve evcil hayvan sahibi, hastaları/evcil hayvanları için kannabinoid ürünleri tedarik etme olanaklarını araştırmaktadır. Evcil hayvan sahiplerinin ve veteriner hekimlerin CBD kullanımına ilişkin görüşleri genellikle olumlu olmakla birlikte, birçok veteriner hekim kannabinoid ürünlerin terapötik ve toksik etkileri hakkında yeterince bilgi sahibi değildir (22, 23). Bu çalışma, köpek türlerinde Kannabis türevlerinin, özellikle CBD ve kannabidiolik asidin (CBDA) farmakokinetiği, etkinliği ve tolere edilebilirliği hakkında bugüne kadar yayınlanan tüm verileri özetlemeyi amaçlamaktadır. |
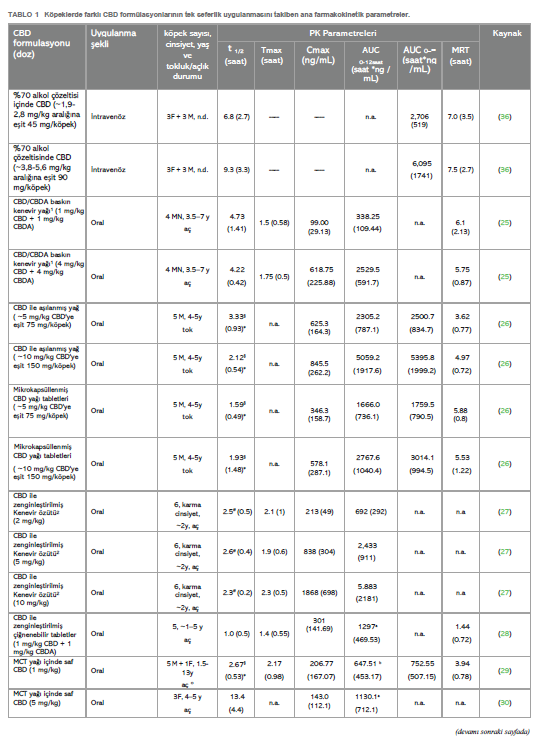
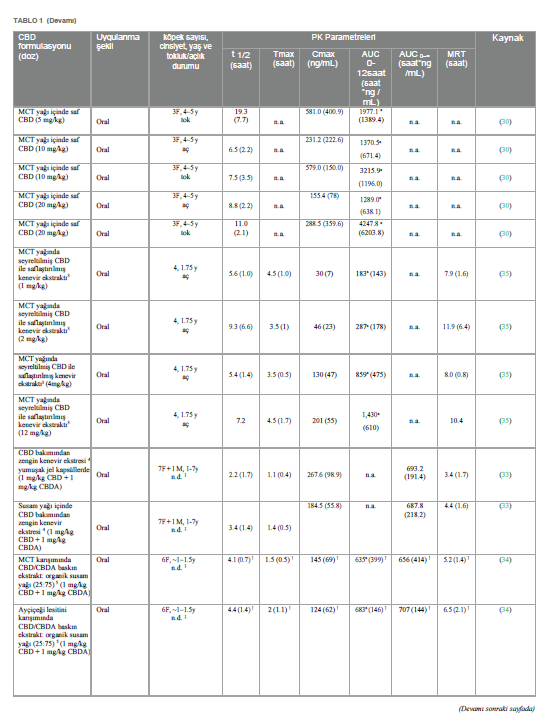
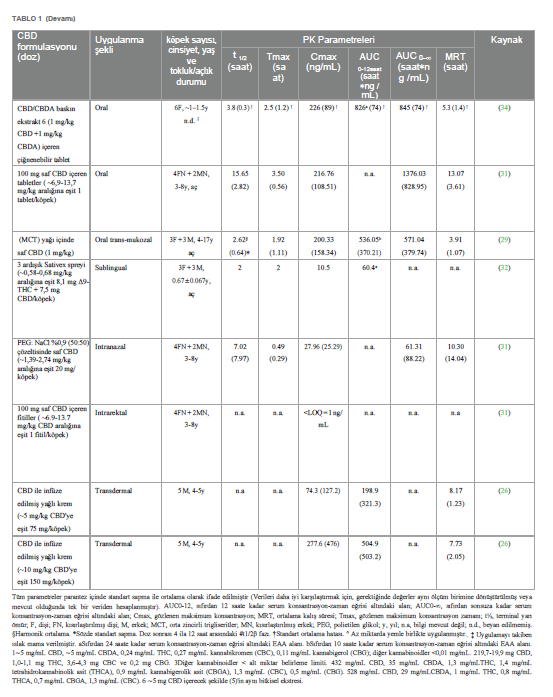
CBD’nin farmakokinetiğiKannabidiol yüksek lipofilik bir moleküldür. Veteriner hekimlik uygulamalarında genellikle ağız yoluyla uygulanır (24). Son birkaç yılda, köpeklerde CBD ile ilgili birkaç farmakokinetik çalışma yapılmıştır (25-35). Bununla birlikte, kinetik davranışı henüz tam olarak açıklığa kavuşturulmamıştır. CBD’nin gastrointestinal emilimi çok düşük görünmektedir. Nitekim, oral biyoyararlanımın değerlendirildiği tek çalışmada, bu oran %19’dan daha düşük çıkmıştır (36); ancak test edilen oral formun hammadde olarak CBD içeren bir kapsül olduğunun altını çizmek önemlidir. Yürütülen çalışmaların neredeyse tamamında gözlemlenen büyük bireysel değişkenlikle ilişkili bu düşük biyoyararlanım, uygun doz rejiminin belirlenmesinde zorluk yaratmaktadır. Bazı çalışmalar CBD farmasötik formülasyonunun köpeklerde oral emilimi üzerindeki etkisini araştırmıştır; mikrokapsüllenmiş CBD yağ tabletleri, CBD infüze edilmiş yağ ile karşılaştırıldığında daha düşük Cmax ve AUC ile sonuçlanmıştır (26). CBD bakımından zengin kenevir ekstresi içeren yumuşak jel kapsüller, aynı ekstraktın susam yağı içinde uygulanmasına kıyasla ortalama Cmax değerinde önemli bir artış göstermiş, ancak AUC değerinde artış göstermemiştir (33). Benzer bir sonuç, Wakshlag ve arkadaşları (2020) tarafından CBD/CBDA ağırlıklı ekstrakt içeren çiğnemelik yumuşak kapsüller ile %75 organik susam yağı ve %25 ayçiçeği lesitininden oluşan yağda seyreltilmiş aynı ekstraktın karşılaştırılmasıyla elde edilirken, çiğnemelik yumuşak kapsüller 75:25 organik susam ve orta zincirli trigliseritlerden (MCT) oluşan yağ karışımında çözündürülmüş ekstrakt ile karşılaştırıldığında istatistiksel olarak anlamlı bir fark gözlenmemiştir (34). Nihai “gıda etkisinin” varlığı da CBD’nin emilimini koşullandıran bir faktör olarak varsayılmıştır: nitekim, lipofilik madde olarak CBD’nin yağlı bir yemekle birlikte uygulandığında daha emilebilir olduğu düşünülmektedir, ancak beslenen ve aç bırakılan köpeklere oral yoldan uygulanan CBD’nin kinetiğini doğrudan karşılaştıran tek çalışmada sonuçlar tam olarak kesinlik taşımamaktadır. Zira, tokluk durumunda gözlenen Cmaks değeri açlık durumundan önemli ölçüde yüksek olsa da, EAA değerlerinde önemli bir fark gözlenmemiştir (30). Ancak, bu çalışmada sadece 3 köpek/grup test edilmiş ve sırasıyla 5 ve 20 mg/kg ile tedavi edilen iki grupta, aç bırakılan bir köpekte daha yüksek Cmaks ve EAA değeri görülmüştür. Kannabidiol, köpek idrarında birkaç metabolitin tespit edilmesiyle de görüldüğü üzere, oldukça büyük bir hepatik metabolizmaya tabidir (37). Bu nedenle, ilk geçiş metabolizmasını önlemek veya en azından azaltmak ve plazma konsantrasyonlarını artırmak için, tatmin edici sonuçlar olmasa da bazı alternatif CBD uygulama yolları test edilmiştir. Nitekim, altı köpeğe 6,9-13,7 mg/kg arasında bir doza karşılık gelen 100 mg CBD içeren bir fitilin rektal olarak uygulanmasının ardından, plazma konsantrasyonu alt miktar tayin sınırının altında kalmıştır (31). CBD ile aşılanmış transdermal kremin köpeklerin kulak kepçelerine ~5 ve ~10 mg/kg dozlarında uygulanmasından sonra, Cmax ve AUC’ler, CBD ile aşılanmış yağ ve mikrokapsüllenmiş CBD yağ tabletleri formülasyonlarının aynı dozlarda oral olarak uygulanmasıyla elde edilenlerden daha düşük çıkmıştır (26). Aynı şekilde, saf sentetik CBD içeren formülasyonun intranazal (IN) uygulaması, doz için normalize edildiğinde, IN tedavisini takiben önemli ölçüde daha kısa olan Tmax dışında (sırasıyla IN ve oral uygulama için 0,49 vs. 3,50 saat) MCT yağındaki saf CBD’nin oral uygulaması ile istatistiksel olarak anlamlı bir fark göstermemiştir (31). Son olarak, oral transmukozal (OTM) uygulama da test edilmiş ve ortalama plazma CBD konsantrasyonları ile zaman eğilimi oral uygulama ile neredeyse üst üste binmiştir (29). Salivasyon ve ardından yutmanın ilacın transmukozal emilimini etkilemiş olabileceği ihtimali de göz ardı edilmemiştir (38). İnsanlarda, CBD biyotransformasyonunun iki ana ürünü tespit edilmiştir: bir hidroksi- ve bir karboksi-derivesi (sırasıyla 7-OH-CBD ve 7-COOH-CBD) ve CBD’nin oral uygulamasını takiben köpek plazmasındaki nihai varlıkları bu nedenle araştırılmıştır (27, 34, 35). CBD/CBDA baskın ekstrakt veya yağda aynı ekstraktı (doz: 1 mg/kg) içeren çiğnenebilir tabletlerin ağızdan verilmesini takiben, gözlemlenen 7-COOH-CBD seviyeleri, mukayese edilebilir dozla tedavi edilen insanlarda gözlemlenenin %1-2’si kadardır. Aynı çalışmada, 7-OH-CBD tespit edilmemiştir (34). Bu son gözlem, MCT yağında seyreltilmiş CBD ile saflaştırılmış Kenevir özütünün oral uygulamasını takiben gözlenmiştir, ancak her durumda karboksi-metabolit daha büyük miktarda üretilmiştir (35). 7-OH-CBD, bitkisel Kenevir ekstresi ile oral tedaviden sonra bile köpeğin plazmasında aralıklı da olsa tespit edilmiştir. Aynı çalışmada, 6-OH-CBD, 10 mg/kg CBD’nin oral uygulamasını takiben 48 saate kadar tespit edilmiştir (27). Bu son metabolitin 7-OH-CBD’ye kıyasla daha fazla üretilmesi, CBD metabolizmasındaki köpekler ve insanlar arasındaki türe özgü farkın altını çizmektedir (27). Tablo 1, bugüne kadar yayınlanmış farmakokinetik çalışmalardan elde edilen verileri özetlemektedir. Terminal yarılanma ömrü, EAA ve MRT gibi CBD farmakokinetik parametreleri, verilen doz için normalize edildiğinde bile, yağlı çözeltilerin oral uygulamasını takiben ortalama değerlerde bazen oldukça farklılık göstermektedir. Bu farklılıklar çok küçük örneklem büyüklüğüne, çeşitli çalışmalarda uygulanan farklı deneysel örnekleme sürelerine ve büyük ölçüde bireysel farklılıklara (yani, ırk, yaş ve cinsiyet farklılıkları) attokilebilir. Nitekim yaş, vücudun farklı su/yağ oranı ve böbrek ve karaciğer fonksiyonlarında olası düşüş nedeniyle ilaç farmakokinetiğini değiştirebilecek fizyolojik ve anatomik değişikliklere neden olabilir (39). Aynı şekilde cinsiyetin de bazı ilaçların metabolizmasını etkilediği görülmüştür (40). Ayrıca, kullanılan CBD türü (saf veya diğer fitokannabinoidlerle birlikte ekstrakte edilmiş) farmakokinetik sonuçları etkilemiş olabilir. Bu konuyla ilgili olarak, farelerde CBD tam spektrumlu ekstrakta kıyasla saf molekül olarak oral yoldan uygulandığında daha yüksek Cmax ve AUC değerleri ve daha kısa yarılanma ömrü gözlenmiştir (41). Benzer şekilde, della Rocca ve arkadaşları (2023), köpeklerde oral olarak uygulanan saf CBD’nin terminal yarılanma ömrünün ortalama değerini, eşit CBD ve CBDA konsantrasyonlarının kullanıldığı çalışmalarda elde edilen değerle karşılaştırarak, formülasyonlarında CBDA bulunmamasının gözlemlenen daha kısa yarılanma ömründe rol oynamış olabileceğini varsaymışlardır (29). |
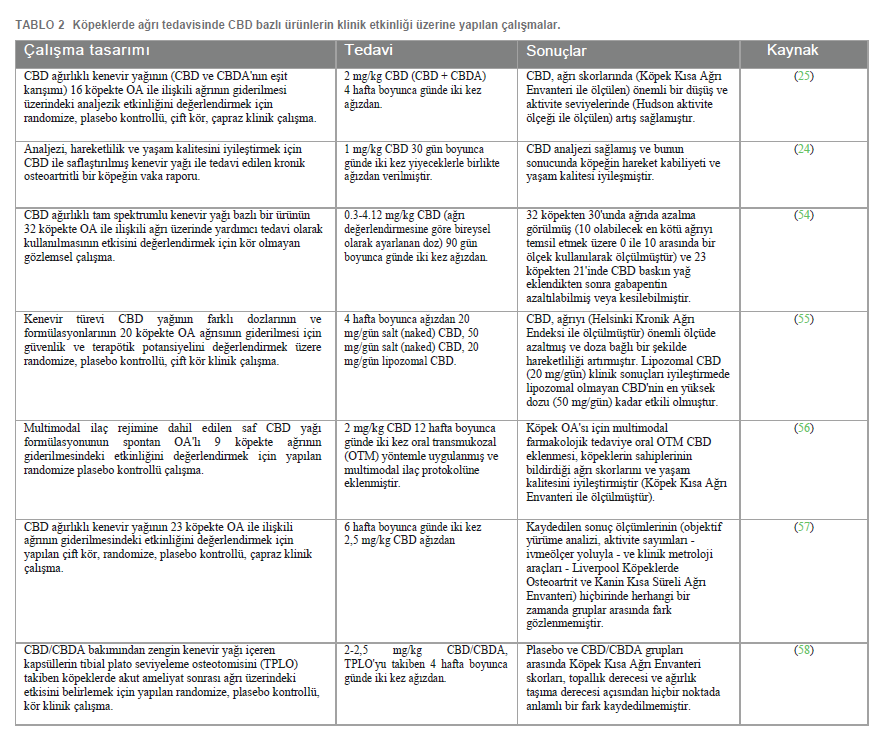
CBD’nin klinik etkinliğiAğrıKenevirin analjezik olarak ampirik kullanımı 1.500 yıldan daha eskiye dayanmaktadır. Kannabinoid reseptörlerinin keşfi, endokannabinoidlerin ve bunların biyosentetik ve bozunma yollarının tanımlanması ve sinyal iletim mekanizmalarının anlaşılması bu alandaki bilimsel araştırmaların önünü açmıştır. Endokannabinoid sistemin (ECS) ana fizyolojik rollerinden birinin ağrının modüle edilmesi olduğu kısa sürede fark edilmiştir (42). Endokannabinoidlerin ağrıyı modüle ettiği sonucuna varmak için gereken en önemli temel, ağrı modülasyonuna adanmış periferik ve merkezi yapılarda endokannabinoid reseptörlerinin, endojen kannabinoidlerin ve endokannabinoid biyosentezi ve yıkımı için enzimatik mekanizmaların varlığını ve bunların sırasıyla geçici (fizyolojik) ve enflamatuar ve nöropatik ağrı modellerinde antinosiseptif ve antihiperaljezik etkilerini gösteren preklinik çalışmalarla ortaya konmuştur (42-47). Endojen kannabinoidler periferik, spinal ve supraspinal seviyelerde antinosiseptif ve antihiperaljezik etkiler üretir (48). Periferik olarak, endokannabinoidler CB1 ve CB2 reseptörleri ve TRPV1, GPR55, GPR119 ve PPAR-α gibi diğer reseptör tipleri ile etkileşime girerek primer afferent liflerin depolarizasyonunu inhibe eder ve mast hücrelerinin degranülasyonunu modüle eder. Bu etkileşimler, nosiseptif liflerin ateşlenmesinin azalmasına ve pro-enflamatuar ve pro-ağrı aracılarının salınımının azalmasını, ardından da enflamatuar ve ağrı yanıtının azalmasını sağlar (44, 48-50). Omurilikte, deneysel veriler kannabinoidlerin nosiseptif eşiği artırdığını ve spinal CB1 reseptörleri ile etkileşime girerek geniş dinamik aralıklı nöronların ateşlenmesini azalttığını göstermektedir. Ayrıca, kannabinoidlerin noradrenerjik ve opioid spinal sistemlerin aktivitesini modüle edebildiği görülmektedir (44, 46, 48, 49). Supraspinal düzeyde, kannabinoidler azalan inhibitör kontrolün aktivasyonu ve bunun sonucunda omurilik nöronlarının aktivitesinin modülasyonu yoluyla etki edebilir. Bu etkiye muhtemelen periaqueductal gri madde, rostroventromedial medulla, talamus ve amigdalanın bazı bölgeleri ve A5 noradrenerjik çekirdek gibi ağrı kontrolüyle ilgili çeşitli bölgelerde lokalize olan CB1 reseptörleri aracılık etmektedir (44, 48, 49). ECS’nin bazal koşullarda ve hiperaljezide nosiseptif eşiği modüle edebilen tonik aktivite gösterdiği ve kannabinoidler ile opioidlerin birbirlerini karşılıklı olarak güçlendirebileceği de varsayılmıştır (44). Hayvan modellerinde yapılan çalışmalar, ECS’nin nöropatik, kanser ve osteoartritik (OA) ağrıdaki rolünü doğrulamaya özellikle dikkat etmiştir: her halükarda, “endokannabinoid mekanizması” mevcuttur ve nosiseptörlerin ve spinal nöronların uyarılabilirliğini modüle edebilmektedir (51-53). Bazı klinik öncesi çalışmalar fitokannabinoidlerin hayvan OA ağrı modellerindeki etkinliğini araştırmıştır. Veriler genel olarak, ECS’nin eksojen kannabinoidler tarafından aktivasyonunun eklem ağrısını hem merkezi hem de periferik olarak sınırlandırmada etkili olduğunu göstermektedir (53). Köpeklerde OA ağrısının tedavisinde CBD’nin klinik etkinliği ile ilgili olarak, şimdiye kadar altı bilimsel çalışma yayınlanmıştır (bunlardan dördü randomize, çift kör, plasebo kontrollü klinik çalışmalar ve kalan ikisi sırasıyla bir vaka raporu ve kör olmayan bir gözlemsel çalışmadır), çalışma tasarımı, tedaviler ve sonuçlar Tablo 2’de özetlenmiştir. Beş çalışma (24, 25, 54-56) CBD’nin ağrıyı önemli ölçüde azalttığını ve köpeklerin aktivitesini artırdığını, böylece yaşam kalitelerini iyileştirdiğini göstermiştir. Nitekim Gamble ve arkadaşları (2018), CBD tedavisi sırasında (4 hafta boyunca günde iki kez 2 mg/kg) 2. ve 4. haftalarda, başlangıca (0. hafta) kıyasla Köpek Kısa Ağrı Envanteri (CBPI) ile ölçülen ağrı puanlarında önemli bir düşüş ve Hudson aktivite ölçeği ile ölçülen aktivitede bir artış olduğunu ortaya koymuştur (25). 2019 yılında De Álava (Aktaran Coelho, 2021), CBD (30 gün boyunca günde iki kez 1 mg/kg) ile tedavi edilen kronik osteoartritli bir köpeğin vaka raporunu açıklamıştır: tedavi, köpeğin hareketliliğinde ve yaşam kalitesinde iyileşme ile birlikte analjezik etki göstermiştir (24). Kogan ve arkadaşları (2020), CBD’nin (90 gün boyunca günde iki kez 0,3-4,12 mg/kg) önceki multimodal analjezik tedaviyle (akupunktur, lazer, nutrasötikler, polisülfatlı glikozaminoglikan ve/veya gabapentin) birlikte etkisini değerlendirmiş ve 32 köpekten 30’unun ağrısının hafiflediğini ve 23 köpekten 21’inin gabapentin uygulamasını azaltabildiğini veya kesebildiğini tespit etmiştir (54). Verrico ve çalışma arkadaşları (2020) iki farklı CBD formülasyonunun (salt (naked) 20 ve 50 mg/gün ve lipozomal 20 mg/gün, 4 hafta boyunca) etkisini değerlendirmiştir: Helsinki Kronik Ağrı Endeksi (HPCI) aracılığıyla hayvanın ağrısının hasta sahibi tarafından değerlendirilmesi ve veteriner klinik muayenesi, plasebo veya 20 mg/gün salt CBD uygulamasıyla kayda değer ölçüde değişmezken, 50 mg/gün salt CBD veya 20 mg/gün lipozomal CBD uygulaması ağrı skorlarında istatistiksel olarak anlamlı düşüşler sağlamıştır (55). Son olarak, Brioschi ve arkadaşları (2021) kronik osteoartritle ilişkili ağrı için multimodal farmakolojik tedaviye (firocoxib veya prednizon, gabapentin ve amitriptilin) ek olarak oral transmukozal (OTM) CBD’nin (12 hafta boyunca günde iki kez 2 mg/kg) etkinliğini değerlendirmiş ve CBPI skorlama sistemine göre hasta sahipleri tarafından değerlendirildiğinde, CBD almayan köpeklere kıyasla skorların önemli ölçüde azaldığını tespit etmiştir (56). Buna karşılık, Mejia ve arkadaşları (2021) tarafından yapılan çalışmada, kaydedilen sonuç ölçümlerinin (aktivite sayısı, klinik metroloji araçları ve objektif yürüme analizi) hiçbirinde CBD (6 hafta boyunca günde iki kez 2,5 mg/kg) kullanımıyla herhangi bir fark gözlenmemiştir (57). Tibial plato seviyeleme osteotomisini (TPLO) takiben akut postoperatif ağrıda CBD/CBDA’nın (4 hafta boyunca günde iki kez 2-2,5 mg/kg) rolünün araştırıldığı yayınlanmış tek randomize, plasebo kontrollü, kör klinik çalışmada, plasebo ve CBD/CBDA grupları arasında ağrı skoru (CBPI), topallık derecesi, ağırlık taşıma derecesi veya osteotominin radyografik iyileşmesinde herhangi bir noktada önemli bir fark kaydedilmemiştir (58) (Tablo 2). Bununla birlikte, yakın tarihli bir yayında, daha yüksek dozda (5 mg/kg) aynı ürün (CBD/CBDA) ile cerrahi sonrası intervertebral disk hastalığında plaseboya kıyasla kör veteriner değerlendirmesine dayalı daha düşük cerrahi sonrası ağrı skorlaması öne sürülmüştür (59). |
EpilepsiSon yıllarda, epilepsi de dahil olmak üzere çeşitli nörolojik bozuklukların tedavisinde fitokannabinoidler üzerinde durulmaktadır (60). Bugüne kadar elde edilen veriler, ECS’nin epilepsi hastalarında beynin doğrudan veya dolaylı olarak etkilenen bölgelerindeki beyin aktivitelerinin modüle edilmesinde önemli bir rol oynadığı hipotezini ortaya koymaktadır. Bu hipotez çok sayıda anatomik, elektrofizyolojik, biyokimyasal ve farmakolojik bulgu ile desteklenmektedir (61). Endokannabinoidlerin antiepileptik etkisinin altında yatan moleküler mekanizmalar hala büyük ölçüde belirsizliğini korumaktadır. Çok sayıda araştırmacı, ECS’nin epileptik nöbetleri kontrol etmedeki rolünü aydınlatmak için çalışmalar yürütmektedir. CB1 reseptörünün bu konuda kritik bir rol oynadığı düşünülmektedir. Nitekim, CB1 reseptörünün aktivasyonu:
Epilepsi ve ECS arasındaki ilişki tam olarak aydınlatılamamış olsa da, beyin uyarılabilirliği ve ECS arasındaki karmaşık ilişki, fitokannabinoidlerin epilepsi üzerinde faydalı etkiler yaratabileceğini ve özellikle CBD olmak üzere endokannabinoid sinyal sisteminin bireysel unsurlarını seçici olarak hedefleyen bileşiklerin kullanımını içeren yeni tedaviler geliştirme olasılığının önünü açabileceğini düşündürmektedir (61). CBD’nin nöronal hipereksitabilitenin modülasyonuna veya önlenmesine neden olan polifarmakolojik etkileşimler yoluyla etki ettiği öne sürülmüştür. CBD’nin (a) GRP55, vanilloid (TRPV), serotonerjik (5HT1α) ve glisinerjik reseptörler gibi farklı reseptörlerle etkileşimleri; (b) sodyum ve kalsiyum akımlarının düzenlenmesi; (c) adenozin ve diğer aracıların aracılık ettiği sinaptik sinyalin güçlendirilmesi; (d) GABAerjik aktivitenin güçlendirilmesini içeren çoklu varsayılan etki mekanizmaları tartışılmaktadır (62-64). CBD’nin aşağıdaki mekanizmalar yoluyla nöronal hipereksitabiliteyi sınırlayabileceği varsayılmıştır:
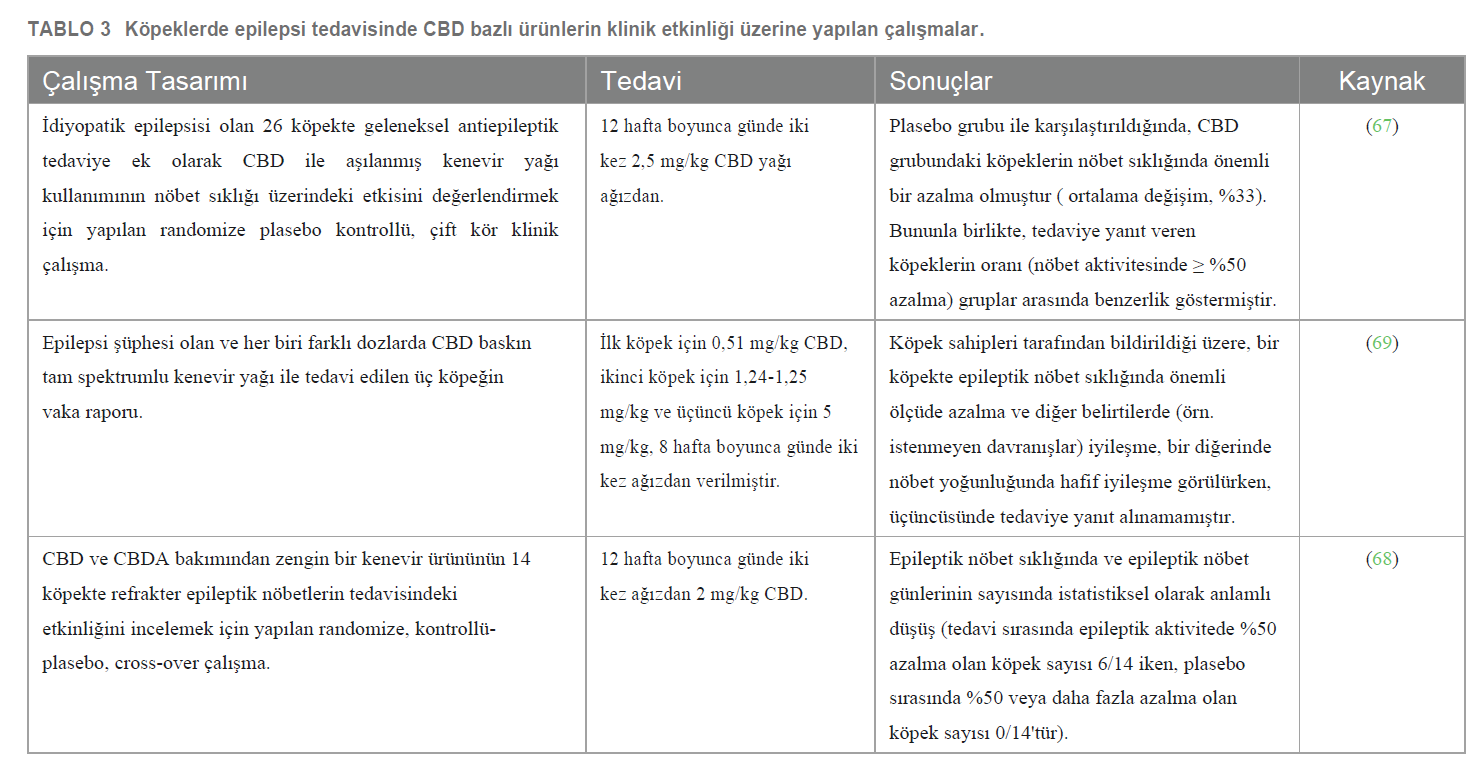
CBD’nin antiepileptik özellikleri akut epilepsinin çeşitli hayvan modellerinde incelenmiştir. Elde edilen veriler, hem ön tedavi olarak hem de epileptik nöbet başlangıcından sonra uygulanan CBD’nin antikonvülsan rolünü desteklemektedir (60). Kannabidiolün köpeklerde idiyopatik epilepsi tedavisindeki klinik etkinliği şimdiye kadar sadece üç bilimsel çalışmada araştırılmıştır (Tablo 3) ve bunlardan sadece ikisi randomize kontrollü klinik çalışmalardır. McGrath ve arkadaşları (2019), önceki antiepileptik tedaviyle (fenobarbital, potasyum bromür, levetirasetam ve/veya zonisamid) birlikte CBD’nin (12 hafta boyunca günde iki kez 2,5 mg/kg), plasebo grubuna kıyasla nöbet sıklığını önemli ölçüde azalttığını ( ortalama değişim, %33) göstermiştir. Bununla birlikte, tedaviye yanıt veren köpeklerin oranı (çalışma başlamadan önce ve çalışma sona erdiğinde ortalama aylık nöbet sıklığında ≥% 50 azalma) CBD ve plasebo grupları arasında istatistiksel olarak benzerlik göstermiştir (67). Garcia ve arkadaşları (2023), plasebo grubuna kıyasla eşit miktarda CBD/CBDA (12 hafta boyunca günde iki kez 2 mg/kg) alan köpeklerde epileptik nöbet sıklığının yanı sıra epileptik nöbet günlerinin sayısında da önemli bir azalma olduğunu bildirmiştir. Daha ayrıntılı bilgi vermek gerekirse, epileptik nöbet sıklığı plasebo tedavisi sırasında ortalama 8,0 ± 4,8 iken CBD/ CBDA bakımından zengin kenevir ekstresi ile 5,0 ± 3,6’ya düşmüş ve CBD/ CBDA bakımından zengin kenevir tedavisinin epileptik nöbet olay günleri plasebo tedavisi sırasında ortalama 5,8 ± 3,1 iken tedavi edilen köpeklerde 4,1 ± 3,4’e düşmüştür. Plasebo tedavisi sırasında epileptik aktivitede %50 azalma görülen köpek sayısı 0/14 iken, tedavi sırasında 6/14 olmuştur (68). Bir vaka serisinde, Mogi ve Fukuyama (2019) CBD (8 hafta boyunca sırasıyla günde iki kez 0,51 mg/kg, günde iki kez 1,24-1,25 mg/kg, günde iki kez 5,00 mg/kg) ile tedavi edilen ve değerlendirilen üç köpekte sırasıyla epileptik nöbetlerde önemli ölçüde azalma, hafif azalma ve hiç azalma olmaksızın farklı ve bazen çelişkili sonuçlar rapor etmiştir (69). |
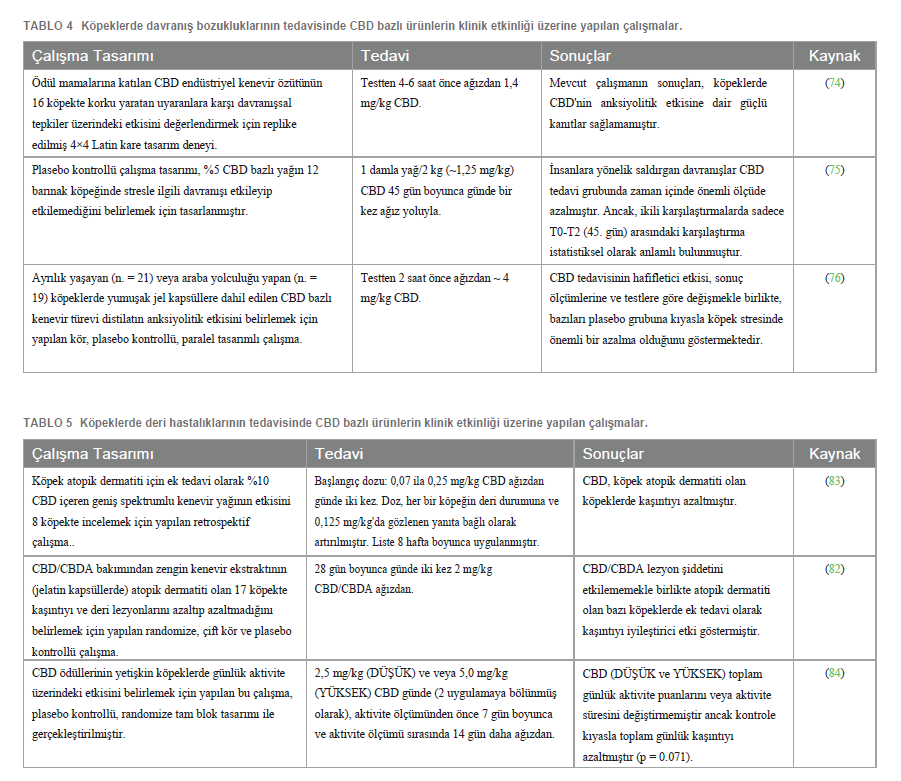
Davranış BozukluklarıDuygusal davranış da ECS ile modüle edilen birçok fizyolojik işlev arasında yer almaktadır. Bu sistem, öğrenmeden sorumlu sinaptik plastisiteyi ve duygusal olarak etkileyebilecek olumsuz olaylara yanıt verebilme yeteneğini teşvik etmek için gereklidir (70). ECS’nin duygusal davranışların modülasyonunda rol oynadığı hipotezi, CB1 reseptörlerinin ve Yağ Asidi Amid Hidrolaz’ın (FAAH – endokannabinoidlerin parçalanmasından sorumlu enzim) yanı sıra endokannabinoidler AEA ve 2-AG’nin stres, korku, duygular ve ödül mekanizmalarıyla bağlantılı beyin bölgelerinde (amigdala, nükleus akumbens, hipokampus ve prefrontal korteks gibi) eksprese edildiği ve üretildiğinin ispatlanmasıyla desteklenmiştir (71). Bununla birlikte, ECS’nin anksiyeteli hallerin modülasyonundaki etkileri tek yönlü değildir: ECS’nin karmaşıklığı CB1 reseptörlerinin yanı sıra TRPV1 ve 5 -HT1A ile etkileşime giren agonistler tarafından ortaya konan çeşitli anksiyolitik ve anksiyete yaratıcı etkilerden sorumludur (72, 73). CBD’ye gelince, bu bileşik stres kaynaklı anksiyete modeli, panik bozukluklar ve kompulsif davranış modeli, korku koşullandırma testi, korku sönme testi ve yeniden konsolidasyon blokaj testi gibi çok çeşitli hayvan modellerinde incelenmiştir. Bu çalışmalar CBD’nin anksiyete bozukluklarının tedavisinde terapötik potansiyelini ortaya koymuştur. Nitekim CBD, anksiyolitik, panikolitik ve antikompulsif eylemlerin yanı sıra otonomik uyarılmanın azalması, koşullu korku ekspresyonunun azalması, korku sönmesinin artması, rekonsolidasyon bloğu ve stresin uzun vadeli kaygı uyandırıcı etkilerinin önlenmesi gibi çok çeşitli faaliyetler sergilemiştir (70). CBD tarafından üretilen anksiyolitik ve panikolitik etkiler ve korku koşullu ekspresyonun azalması, 5-HT1A reseptörlerinin aktivasyonuna bağlı olabilir, ancak CB1 reseptörleri de sınırlı bir rol oynayabilir. Buna karşın, CB1 reseptörlerinin aktivasyonu, antikompulsif etkilere, korkunun ortadan kalkmasına, yeniden konsolidasyonun engellenmesine ve stresin uzun vadeli anksiyete üreten sonuçlarını önlemeye aracılık eder. Ayrıca, CBD, yüksek dozlarda bile, anksiyete yaratıcı etkiler üretmez (70). Köpeklerde davranış bozukluklarının tedavisinde CBD’nin klinik etkinliği ile ilgili olarak, şu anda sadece üç bilimsel çalışma (replike edilmiş 4×4 Latin kare tasarımı; plasebo kontrollü çalışma; kör, plasebo kontrollü, paralel tasarımlı çalışma) yayınlanmıştır (Tablo 4). Morris ve arkadaşları, 2020 CBD’nin (testten 4-6 saat önce 1,4 mg/kg) korku yaratan uyaranlara verilen davranışsal tepkiler üzerinde anksiyolitik bir etkisinin olmadığını rapor etmiştir (74). Corsetti ve arkadaşları (2021) tarafından yapılan çalışma, CBD’nin (45 gün boyunca günde bir kez ~ 1,25 mg/kg) barınak köpeklerinde stresle ilgili davranışları etkileyip etkilemediğini belirlemeyi amaçlamış ve istatistiksel olarak anlamlı olmasa da CBD grubunda insana yönelik saldırgan davranışların zamanla azaldığını; yer değiştirme faaliyetleri ve stereotipler gibi stresin göstergesi olan diğer davranışların ise azalmadığını bildirmiştir (75). Hunt ve arkadaşları, CBD’nin (testten 2 saat önce ~ 4 mg/kg, önceki anksiyete çalışmasından çok daha yüksek bir doz) ayrılık veya araba yolculuğu yaşayan köpeklerde anksiyolitik etkisi olduğunu göstermiştir (76). |
Deri HastalıklarıECS (reseptörleri, aracıları ve çoğu deri hücresel elemanı tarafından üretilen/eksprese edilen düzenleyici molekülleri ile) deri homeostazında ortaya çıkan önemli bir oyuncudur. Nitekim, endokannabinoid palmitoiletanolamid (PEA) ve ALIA (Autacoid Local Injury Antagonism) etkilerinin dahil olması ile deri iltihabı, kaşıntı ve ağrıya karşı koruyucu bir rol oynadığı öne sürülmüştür (77, 78). CB1 ve CB2 kannabinoid reseptörleri köpek keratinositlerinde eksprese edilmektedir (5, 7, 8) ve atopik köpeklerde CB1 ve CB2 immünoreaktivitesi sağlıklı köpeklere göre daha yüksektir (5). Köpek keratinositleri ayrıca TRPV1 reseptörlerini de eksprese etmektedir (6). Kaşıntıda kannabinoidler üzerine yayınlanan makalelerin çoğu ALIAmidler (örn. Adelmidrol®) ile ilgilidir ve PEA bu açıdan en umut verici bileşiklerden biri olarak kabul edilmektedir. Kannabinoid reseptör agonistlerinin (örn. PEA) alerjik kontakt dermatit modelinde farelerin derisindeki enflamasyonu hafiflettiği (79, 80) ve kapsamlı open label çalışması ile de atopik köpeklerde deri lezyonlarını ve kaşıntıyı azalttığı ortaya konmuştur (81). Bu etkiler esas olarak mast hücresi aşağı yönlü modülasyonuna bağlı görünmektedir, ancak diğer hücre tipleri (yani makrofajlar ve T hücreleri) PEA tarafından aşağı yönlü regüle edilmiş görünmektedir. Ayrıca PEA, endokannabinoidlerin seviyelerini yükselterek, bozulmalarını azaltarak ve reseptörleri için afinitelerini artırarak dolaylı olarak da etki etmektedir (20). Kannabidiolün CB1 veya CB2 reseptörleri ile doğrudan etkileşime girdiği görülmemiştir, ancak AEA gibi endokannabinoidlerin endojen seviyelerini değiştirdiği düşünülmektedir. CBD ayrıca, insanlarda ve kemirgenlerde yapılan in vitro ve in vivo değerlendirmelere göre, enflamatuar hücrelerdeki veya nöronlardaki diğer reseptör sistemleriyle (TRPV, adenozin geri alım inhibitörü ve PPAR gibi) etkileşime girebilir (82). Yazarların bildiği kadarıyla, köpek atopik dermatiti tedavisinde CBD ve CBD/CBDA’nın etkinliğini araştıran sadece iki çalışma (sırasıyla open-label vaka serisi çalışması ve randomize plasebo kontrollü çalışma) yapılmıştır (Tablo 5). Her iki çalışmada da fitokannabinoidler [8 hafta boyunca günde iki kez 0,07 ila 0,25 mg/kg CBD (83), 28 gün boyunca günde iki kez 2 mg/kg CBD/CBDA (82)] köpek atopik dermatiti olan köpeklerde kaşıntıyı azaltmıştır. Üçüncü bir çalışma (randomize tam blok tasarımlı, plasebo kontrollü bir çalışma) atopik köpekler üzerinde yürütülmemiş olup, CBD’nin (1,25 mg/kg veya 2,5 mg/kg günde iki kez 7 gün önce ve 14 gün daha aktivite takibi esnasında) köpeklerin günlük aktiviteleri (aktivite noktaları, aktivite süresi, dinlenme, koşma, yürüme, baş sallama ve uyku kalitesi dahil olmak üzere aktivite izleyici ile ölçülmüştür) üzerindeki etkisini belirlemeyi amaçlamıştır: kontrol edilen aktiviteler arasında, istatistiksel olarak olmasa da, kaşınma kontrol grubuna kıyasla azalma eğiliminde olup, Yazarlar CBD’nin antipruritik bir etki gösterebileceği hipotezini öne sürmüşlerdir (84) (Tablo 5). CBD’nin Tolere Edilebilirliği0,3’ten daha az THC içeren CBD bazlı formülasyonlar psikoaktif özelliklerden yoksundur (85). Bu nedenle erkeklerde, tamamen yan etkisiz olmasalar da, kötüye kullanım olasılığı düşüktür. Nitekim, CBD ile tedavi sırasında insan klinik çalışmalarında uyuklama, iştahsızlık ve ishal yaygın belirtiler olarak rapor edilmiştir (86, 87). Köpeklerde, yalnızca CBD tek bir doz olarak uygulandığında değil (25, 35, 88), aynı zamanda bu tür lipofilik bileşiklerin birikmesinin mümkün olduğu zaman zarfında da uzun süreli kullanıma yönelik tolerabilite ile ilgili bazı çalışmalar bulunmaktadır. Bununla birlikte, Yazarların bildiği kadarıyla, bu çalışmalar ağırlıklı olarak kısa ve orta vadeli tedaviye (4-6 hafta) odaklanmış olup, uzun vadeli tedavilerden sonra, yani 12 hafta (28)< ve 6 ay (89)< boyunca CBD’nin tolere edilebilirliğini değerlendiren sadece iki çalışma bulunmaktadır. Köpeklerde THC’nin oral ölümcül dozu 3.000 mg/kg’dan fazla olarak tahmin edilirken (90), CBD’nin oral ölümcül dozu hala belirlenmemiştir. CBD düşük akut intravenöz (i.v.) toksisiteye sahiptir ve maruz kalan köpeklerin %50’si için öldürücü doz >254 mg/kg’dır (91)<. Epidiolex’in (Lennox Gastaut veya Dravet Sendromlu çocuklarda nöbetler için ek tedavi olarak kullanılan saflaştırılmış CBD ekstresi) FDA onayından önce köpeklerde yapılan klinik öncesi güvenlik çalışmaları, 100 mg/kg BW CBD’nin gözlemlenebilir yan etki seviyesini (NOAEL) göstermektedir (92)<. CBD bazlı ürünler genellikle öldürücü i.v. dozun yanı sıra NOAEL’den önemli ölçüde daha düşük CBD dozu içermekte ve bu da formülasyonları nispeten güvenli hale getirmektedir. Bu hususa bakılmaksızın, günde bir kez 2 mg/kg ve günde iki kez 20 mg/kg’a kadar oral doz, hem sağlıklı hem de hastalıklı hayvanlarda iyi tolere edilmiş ve hafif yan etkiler göstermiştir (Tablo 6). Benzer şekilde pozitif ve güvenli profil, Vaughn ve arkadaşları (2020) tarafından yapılan ve 62 mg/kg’a kadar artan CBD dozlarının kullanıldığı bir çalışma ile de teyit edilmiştir (88)<. |
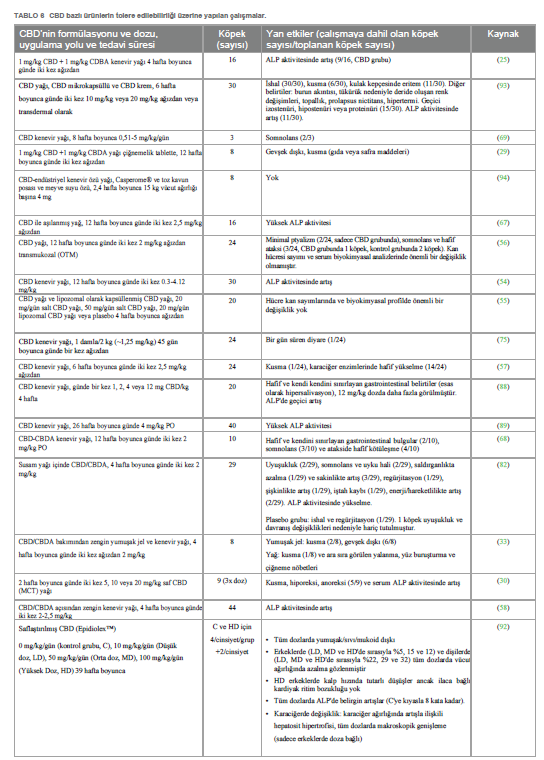
| CBD’nin yan etkileri hafif veya önemsiz olarak sınıflandırılsa da, rapor edilen klinik çalışmalar, CBD uygulamasını takiben, öncelikle mide bulantısı, ptyalizm, iştahsızlık, kusma ve dışkıda gevşeme gibi gastrointestinal rahatsızlık belirtisi gibi çeşitli olumsuz klinik belirtilerin ortaya çıkabileceğini göstermiştir (28, 30, 33, 35, 56, 57, 68, 75, 82, 93). Bunlar kısmen CBD bazlı ürünlerin ve kullanılan yağ maddesinin iğrenç tadıyla ilgili olabilir. Farklı oral formülasyonların bu belirtilerin görülme sıklığını azaltması muhtemeldir. Nitekim, CBD yağının lipozomal ambalajı, hiçbir klinik yan etki kaydedilmediği için en iyi seçenek gibi görünmektedir (55). Benzer şekilde, CBD tatsız bir yağda birleştirildiğinde sadece hafif bir ptyalizm gözlenmiştir (56). Ayrıca, sekiz köpek üzerinde yapılan pilot çalışmada (94), Boswellia serrata Roxb. ve toz halindeki kavun posası ve meyve suyu ekstraktından elde edilen terpen asitlerinin saflaştırılmış karışımına eklenen, tabletler halinde toz haline getirilmiş %99+ saf CBD kristali, lezzetli bulunmuş ve hiçbir olumsuz klinik belirti göstermemiştir. Daha az sıklıkla da olsa köpeklerde kaydedilen diğer yan etkiler somnolans ve letarji (56, 69, 82) ile ataksidir (56, 67, 68). Chicoine ve çalışma arkadaşları (2020) tarafından altı köpeğin 1:20 THC:CBD Kenevir bitkisel ekstresi (10 mg/kg CBD ve 0,5 mg/kg THC) ile tedavi edildiği çalışmada, diğerlerinin yanı sıra baş sallama, hiperestezi, ataksi veya sallanma gibi nörolojik belirtiler rapor edilmiştir. Ancak, insanlarda elde edilen veriler, köpeklerdeki bu nörolojik belirtilerin CBD’nin değil THC’nin etkilerinden kaynaklandığını göstermektedir (27). Tüm bu bulgular genellikle uygulama kesilmeden kendi kendini sınırlamaktaydı ve 10 mg/kg üzerindeki dozlarda görülme sıklıkları arttığı için doza bağlı gibi görünüyordu. Bu noktada, ilginç bir şekilde, transdermal kremde birleştirilmiş CBD ile tedavi sırasında gözlenebilen eritematöz pinnae gibi spesifik bir yan etkinin, 10 mg/kg’ın üzerindeki dozların oral uygulaması sırasında da ortaya çıkması muhtemeldir (93). Ayrıca, bir köpeğin anksiyete için oral kenevir yağı formülasyonu (CBD 0,3 mg/kg, günde bir kez) aldıktan 5 gün sonra anoreksi ve diyare ile ilişkili yaygın kutanöz eritem ve ülserasyon gösterdiği vaka raporu (95) da dikkate değerdir. Kutanöz veya sistemik hastalık öyküsünün olmaması, histopatolojik bulgular ve semptomatik tedavi ve CBD ürününün kesilmesinden sonra remisyon, Yazarların erkeklerde (96) tarif edildiği gibi CBD’ye veya ajan içindeki ek maddelere karşı olası bir CADR (ilaçlara karşı kutanöz yan etki) olduğunu düşündürmüştür. Bahsedilen belirtilerin yanı sıra, klinik çalışmalarda tüm köpeklerde olmasa da bazı köpeklerde CBD ile uzun süreli tedavi sırasında görülen yaygın bulgulardan biri de alkalin fosfataz enzim (ALP) aktivitesinin yükselmesidir ve genellikle belirli bir arınma döneminden sonra başlangıç değerlerine geri döner (25, 35, 54, 56, 58, 67, 82, 88, 89, 93). Bu değişiklik genellikle karaciğerin sitokrom p450 aracılı oksidatif metabolizmasının geri dönüşümlü olarak yukarı doğru regüle edilmesine bağlanmaktadır (97, 98). Bu bulgunun klinik önemi hala bilinmemektedir ve safra asitleri ya da histopatolojik incelemeler gibi karaciğer fonksiyonlarını değerlendirmeye yönelik diğer incelemelerin sonuçları olmadan bu bulguların bir geçerliliği olmayabilir: bu anlamda, Bradley ve arkadaşlarının (2022) çalışmasında, Yazarların total ALP ile kemiğe özgü ALP’nin (BALP) yükselmesi arasında güçlü bir pozitif korelasyon tespit ettiklerini rapor etmek dikkat çekicidir; bu da farklı kökenli ALP izoenzimlerinin CBD tedavileri sırasında aşırı üretilebileceğini düşündürmektedir (89). Klinik çalışmaların yanı sıra, Epidiolex’in toksikolojisini değerlendirmek için sağlıklı Beagle cinsi köpeklerde klinik öncesi/ön ruhsatlandırma çalışması yürütülmüştür. Gavaj yoluyla 39 hafta boyunca 100 mg/kg’a kadar verilen CBD, sadece hafif gastrointestinal belirtiler, vücut ağırlığında doza bağlı bir düşüş, ALT’de (1,5 kata kadar) ve ALP’de (8 kata kadar) artış, karaciğer ağırlığında artış ve hepatosit hipertrofisi meydana getirmiştir (92) (Tablo 6). |
Tartışma ve sonuçYeterli farmakolojik yanıt elde etmek için belirli zaman aralıklarında uygun ilaç dozunun tatbik edilmesi gerekir. İlacın farmakokinetik profilinin bilinmesi, doz ayarının belirlenmesi için son derece önemlidir (99). Şu anda veteriner hekimlikte kullanılan CBD dozları değişken ve ampiriktir. Gerçekten de, köpeklerde CBD’nin farmakokinetiği üzerine birkaç çalışma yapılmış olmasına rağmen, CBD’nin kinetik profili, muhtemelen kullanılan farklı yağlı ajanlar (ayçiçeği lesitini, MCT ve susam yağı), farmasötik formlar (tabletler, çiğnemelik tabletler, mikrokapsüllenmiş yağ tabletleri veya damlalar), CBD türü (sentetik ve saflaştırılmış veya tam spektrumlu ekstrakt) ve uygulama yolu (oral, rektal, intranazal veya oral transmukozal) gibi çok farklı deneysel koşullar nedeniyle henüz tam olarak bilinmemektedir (Tablo 1). Ayrıca, bu çalışmalar örnekleme süreleri, geri çekme sayısı ve tedavi edilen hayvan sayısı (3 ila 8) bakımından farklılık göstermekte olup, bunların tümü farmakokinetik parametreleri etkilemektedir. Son olarak, tüm çalışmalarda gözlemlenen plazma konsantrasyonlarındaki büyük bireysel değişkenlik, elde edilen verilerin yorumlanmasını daha da güçleştirmektedir. Bu nedenle, rasyonel bir dozaj rejimi tanımlamak ve CBD’nin ampirik kullanımından kaçınmak için, bireyler arası CYPp450 ekspresyonu ve köpek popülasyonları arasında metabolizma farklılıklarına yol açan polimorfizmler ışığında CBD’nin farmakokinetiğini ve farmakodinamiğini aydınlatmak için daha fazla çalışmaya ihtiyaç vardır. Etkinlik açısından, çoğu çalışma CBD’nin osteoartritli köpeklerde ağrıyı hafifletme yeteneğini test etmek için yapılmıştır. Bir çalışmada, kaydedilen sonuç ölçümlerinden herhangi biri için gruplar arasında fark kaydedilmemiş olsa da (57), diğer tüm çalışmalarda elde edilen sonuçlara göre CBD’nin ağrıyı önemli ölçüde azaltabildiği ve köpeklerin aktivitesini artırabildiği, böylece yaşam kalitelerini iyileştirdiği görülmüştür (24, 25, 54- 56). TPLO sonrası akut postoperatif ağrıda CBD’nin rolünün araştırıldığı tek çalışma tatmin edici sonuçlar vermemiştir (58). Gelecekteki çalışmalar bu sonucu çürütebilecek olsa da, CBD’nin kronik ağrıda etkili olduğu ancak akut ağrıda etkili olmadığı hipotezini ortaya atmak mümkündür. CBD’nin epilepsi tedavisindeki olası etkinliği ile ilgili olarak, iki randomize kontrollü klinik çalışmada (67, 68) elde edilen sonuçlar umut vericidir, çünkü hem McGrath hem de Garcia verileri, tedavi edilen köpeklerin sırasıyla %33 ve %42’sinde nöbetlerde azalma olduğunu göstermektedir. Bununla birlikte, Mogi ve Fukuyama (2019) (69) tarafından yapılan çalışma, değerlendirilen üç köpekte farklı ve bazen çelişkili sonuçlar bildirmiştir. Davranış bozukluklarında CBD’nin etkinliği üzerine şu anda yayınlanan üç bilimsel çalışma, CBD’nin korku yaratan uyaranlara karşı davranışsal tepkiler üzerinde anksiyolitik etkisinin olmadığını (74), ancak insanlara karşı agresif davranışlarda azalma olduğunu (75) ve köpek stresinde azalma olduğunu (76) bildirmiştir. CBD’nin deri hastalıklarındaki etkinliğine gelince, yayınlanan üç çalışmadan, CBD’nin sağlıklı ve atopik köpeklerde kaşıntı oluşumunu azaltabileceği görülmektedir (82, 84). |
| Bu nedenle, CBD’nin köpeklerde OA, nöbetler, davranış ve cilt sorunları gibi istenmeyen durumlar için yararlı rolünü destekleyen bazı kanıtlar mevcuttur. Bununla birlikte, yayınlanan tüm çalışmalar göz önüne alındığında, sonuçlar her zaman tutarlı değildir. Kanıtlanan tutarsızlıkların birçok nedeni olabilir ve bunlar genellikle küçük örneklem büyüklüğü, kısa çalışma süresi, klinik belirtilerin heterojenliği, farklı sonuçlar, diğer ilaçların birlikte uygulanması, sahipler ve veteriner hekimler tarafından yapılan öznel değerlendirmeler, bakıcının plasebo etkileri gibi çalışmaların sınırlamaları şeklinde açıklanmaktadır. Ayrıca, Tablo 2-5’te gösterildiği gibi, köpeklerde kenevir bazlı ilaçlar üzerine yayınlanan bazı çalışmaların randomize, plasebo kontrollü, çift kör olmadığı ve doz, süre ve son olarak kullanılan ürün türü (saf CBD veya farklı miktarlarda diğer Kenevir bileşenlerini içeren kenevir özleri – daha sonra entourage etkisi hakkındaki tartışmaya bakınız) açısından farklılık gösterdiği vurgulanmalıdır. 2022 yılında Lima ve çalışma arkadaşları, bugüne kadar elde edilen hayvan hastalıklarının tedavisinde Kenevir kullanımının etkinlik ve güvenliğine ilişkin kanıtları özetlemek ve her bir çalışmadaki yanlılık riskini değerlendirmek için sistematik bir inceleme yayınlamıştır (100). Yanlılık değerlendirmesinde randomizasyon süreci, amaçlanan müdahalelerden sapma, sonuç verilerinin eksik olması, sonucun ölçümü, raporlanan sonuçların seçimi dikkate alınmış ve düşük risk, endişe verici ve yüksek risk şeklinde sınıflandırılmıştır. Bu derlemeye dahil edilme kriterlerini karşılayan ve doğal olarak hastalıklı hayvanlarda kenevirin monoterapide veya adjuvan olarak etkinliğini veya güvenliğini tanımlayan randomize klinik çalışmalar (RKÇ) olmak üzere altı çalışmadan (25, 55-57, 67, 75) dördü (25, 55, 57, 67), Randomize Çalışmalar için Gözden Geçirilmiş Cochrane Yanlılık Riski Aracı (RoB 2) kullanılarak yapılan genel yanlılık değerlendirmesinde biraz endişe verici olarak sınıflandırılmıştır. Tüm çalışmalar, “amaçlanan müdahalelerden sapmalar” ve ” sonuç verilerinin eksik olması” nedeniyle düşük yanlılık riskine ve “rapor edilen sonucun seçimi” nedeniyle bazı yanlılık riski taşıyan çalışmalar olarak değerlendirilmiştir. Beş çalışmanın (25, 55, 57, 67, 75) “sonucun ölçümü” nedeniyle düşük yanlılık riskine sahip olduğuna karar verilmiştir. İki çalışma (55, 56) “randomizasyon süreci”nden kaynaklanan bazı yanlılık riski taşırken, bir çalışma (75) aynı alanda yüksek yanlılık riski taşıdığı şeklinde değerlendirilmiştir. Son olarak, bir çalışma (56) “sonucun ölçümü” açısından yüksek yanlılık riski taşıdığı ve genel olarak yüksek yanlılık riski taşıdığı şeklinde değerlendirilmiştir. Genel olarak, bu sistematik derleme, randomize ve/veya çift kör ve/veya plasebo kontrollü olsa da, yayınlanmış çalışmaların sonuçlarının dikkatle yorumlanması gerektiğini ve köpeklerde CBD’nin terapötik kullanımının faydalarına ilişkin kanıtları güçlendirmek için gelecekteki çalışmalarda çalışma tasarımına ve sonuçların tanımlanmasına ve ölçülmesine daha fazla dikkat edilmesi gerektiğini göstermektedir. Tolerabilite bakımından, rapor edilen çalışmalar nispeten küçük örneklem büyüklüğü ve uzun dönemli çalışmaların azlığı gibi iki temel sınırın dikkate alınması gerektiğini ortaya koymuştur. ALP yüksekliği bakımından, erkeklerde sitokrom p450’nin bozulmasının birlikte uygulanan ilaçların (101), özellikle de antiepileptik olanların metabolizmasını etkilediğinden şüphelenildiği için CBD ve karaciğer fonksiyonu arasındaki ilişkiye dair daha fazla araştırma yapılması yerinde olacaktır.Bununla birlikte, sağlıklı köpeklere eş zamanlı olarak uygulandığında CBD ve fenobarbital arasında kayda değer herhangi bir farmakokinetik etkileşim bulunmamıştır (30). Son bir hususu daha belirtmek gerekir. Bu derlemede atıfta bulunulan çalışmalarda, kullanılan CBD formülasyonlarının hepsi farklıydı ve CBD kenevir yağı (88, 89), CBD baskın tam spektrumlu kenevir yağı (54, 69), kenevirden türetilmiş CBD yağı (55), CBD saflaştırılmış kenevir yağı (24), CBD saflaştırılmış Kenevir özü (35), CBD ile aşılanmış kenevir yağı (26, 67), CBD ile zenginleştirilmiş Kenevir özü (27), CBD bazlı yağ (75), CBD içeren geniş spektrumlu kenevir yağı (83), galenik CBD (29, 30, 56), CBD/CBDA baskın kenevir yağı (25, 34, 57), CBD/CBDA zengin kenevir ürünü (58, 68), ödül mamalarına dahil edilmiş CBD endüstriyel kenevir özü (74, 84), yumuşak ve çiğnemelik CBD/CBDA yağı (28), jelatin kapsüllerde CBD/CBDA bakımından zengin kenevir ekstresi (33, 82), kapsüllerde saf CBD (31), mikrokapsüllenmiş CBD yağı tabletleri (26), CBD ile aşılanmış yağ kremi (26) şeklinde tanımlanmıştır. Formülasyonların büyük ölçüde değişkenlik göstermesinin yanı sıra, bazı durumlarda eser miktarda diğer kannabinoidlerin bulunduğu belirtilirken, çoğu çalışmada diğer fitokannabinoidlerin (diğerlerinin yanı sıra kannabikromen, kannabigerol ve kannabinol gibi) veya kenevirin diğer kimyasal bileşenlerinin (terpenler, triterpenler ve flavonoidler gibi) mevcut olup olmadığı bildirilmemiştir. Entourage etkisi Kenevir bazlı ürünün farmakokinetik, etkinlik ve güvenliğini etkileyebileceğinden (102), dahil edilen çalışmalar arasında gözlemlenen CBD formülasyonundaki farklılıklar, elde edilen sonuçları etkilemiş olabilir ve bu da yine dikkatle yorumlanmalıdır. |
Katkıda bulunan yazarlarGD, MC ve AD makalenin bölümlerini yazmıştır. Tüm yazarlar makalenin revizyonuna katkıda bulunmuş, gönderilen versiyonu okumuş ve onaylamıştır. Çıkar çatışması beyanıYazarlar, araştırmanın herhangi bir ticari veya maddi ilişki kurulmaksızın yürütüldüğünü ve bu durumun herhangi bir çıkar çatışması oluşturmadığını beyan etmiştir. Yayıncının notuBu makalede ifade edilen tüm görüşler yalnızca yazarlara aittir ve bağlı oldukları kuruluşların veya yayıncının, editörlerin ve hakemlerin görüşlerini temsil etmemektedir. Bu makalede değerlendirilebilecek herhangi bir ürün veya üreticisi tarafından ileri sürülebilecek herhangi bir hak iddiası yayıncı tarafından teminat altına alınmamakta veya desteklenmemektedir. |
Kaynakça
|