Enrico P. Spugnini1,*, Bruno Vincenzi2, Bruno Amadio3 ve Alfonso Baldi4,5 1Biopulse srl, Napoli, İtalya
2Tıbbi Onkoloji Bölümü, Roma Bio-Medico Üniversitesi Kampüsü, Roma, İtalya
3SAFU servisi, Regina Elena Kanser Enstitüsü, Roma, İtalya
4Çevre, Biyoloji ve Eczacılık Bilimleri ve Teknolojileri Bölümü Campania Üniversitesi “Luigi Vanvitelli”, Caserta, İtalya
5Biyobilimler ve BiyoKaynaklar Enstitüsü, CNR, Napoli, İtalya
Özet
Elektrokemoterapi (EKT), elektrik darbelerinin verilmesiyle antikanser ilaçların hücre membranlarından geçişini kolaylaştırır ve böylece ilacın etkisini daha da artırır. Bu çalışmada, tam eksize edilmemiş köpek yumuşak doku sarkomu (YDS) tedavisinde EKT ajanı olarak sistemik bleomisin ve lokal sisplatin kombinasyonunun tolere edilebilirliği ve etkisi incelenmiştir. Tam eksize edilmemiş YDS’li otuz köpek çalışmaya dahil edilmiştir. Köpeklere intravenöz 20 mg/m2 bleomisin verildi ve tümör yatağı ile kenarları 0,5 mg/cm2 dozunda sisplatin ile infiltre edildi. Ardından, sedasyon altında permeabilize edici bifazik elektrik darbeleri uygulandı. Daha doğrusu, kemoterapi ajanlarının enjeksiyonundan 5 dakika sonra, her biri 50 + 50 µsn süren sekiz bifazik pulstan oluşan sekanslar, kaliper elektrotlar kullanılarak 1.300 V/cm’lik seri darbeler halinde uygulandı. İkinci seans 2 hafta sonra yapıldı. Tedavi iyi tolere edildi ve yan etkiler minimal düzeydeydi. Makalenin yazıldığı tarihte yirmi altı köpekte nüks belirtisi yoktu; dördünde nüks görüldü ve nüks eden dört köpekten biri akciğer metastazı nedeniyle öldü. Perivasküler duvar tümörlerinin tedaviye yanıtı diğer YDS vakalarıyla karşılaştırılmış, sonuç olarak önemli bir fark bulunmamıştır. Bleomisin ve sisplatin kombinasyonu kullanılarak yapılan EKT’nin, köpeklerde tam eksize edilmemiş YDS’lerin tedavisinde etkili olduğu görülmüştür. Bu terapötik yaklaşım, düşük maliyeti, toksisitesinin düşük olması ve uygulama kolaylığı göz önünde bulundurulduğunda mevcut seçeneklere eklenebilecek faydalı bir yöntem olabilir.
Anahtar kelimeler: Bleomisin, Sisplatin, Köpek, Elektrokemoterapi, Sarkom.
Giriş
Yumuşak doku sarkomları (YDS’ler), klinik ve histopatolojik özellikleri nedeniyle bir arada kategorize edilen solid tümörlerin oluşturduğu karma bir gruptur (Ehrhart, 2005; Bray ve ark., 2014). YDS’ler tüm köpek deri kanserlerinin yaklaşık %15’ini oluşturmaktadır ve yıllık insidansı risk altındaki 100.000 hasta başına 35 vakadır (Liptak ve Forrest, 2013). Bu tümörler genellikle yumuşak ya da sert kitleler olarak ortaya çıkar, sınırları iyi tanımlanmamıştır ve komşu dokulara sık sık infiltre olurlar (Dernell ve ark., 1998). Bu nedenle, konservatif cerrahi tümörü tamamen yok edemediğinden çoğu zaman nüks ile sonuçlanır (Mayer ve LaRue, 2005). Radikal eksizyona kıyasla tam rezeksiyon yapılmaması (Chase ve ark., 2009) veya tümör derecesi (Bray ve ark., 2014) gibi çeşitli prognostik faktörler nüks riskini artırmaktadır. Hematolojik yayılım yaygın bir olaydır ve vakaların %20’sine kadar görülebilir (Liptak ve Forrest, 2013). Kemoterapi ve radyasyon tedavisine alınan yanıt çoğunlukla çapı 5 cm’den küçük neoplazmlarla sınırlı kalmaktadır (Liptak ve Forrest, 2013). Lokal kontrolü artırmayı amaçlayan en yaygın stratejiler, cerrahininbazen hipertermi (Thrall vd., 2005), adjuvan kemoterapi (Selting vd., 2005) ve elektrokemoterapi (EKT) (Spugnini vd., 2007a, 2008a, 2011) ile birlikte radyasyon tedavisi (Forrest vd., 2000; McKnight vd., 2000) gibi adjuvan tedavilerle kombinasyonundan oluşmaktadır. EKT, belirli bir dalga yapısına sahip permeabilize edici elektrik darbelerinin verilmesi ile kemoterapi ajanlarının uygulanması şeklinde uygulanan anti-kanser bir tedavidir (Spugnini ve ark., 2014, 2016, 2017). Bu darbeler, hücre zarının geçici olarak pertürbasyonu ve yeniden düzenlenmesi ile sonuçlanır. Böylece, bleomisin ve sisplatin gibi düşük geçirgenlikli moleküller de dahil olmak üzere sitoplazmik membrandan maddenin çapraz akışı hızlanır (Silve ve Mir, 2011). Hücrelerin doğrudan elektriksel yıkımı, bazı hücrelerin sarkoplazmik retikulum içinde kalsiyumu tutamamasından kaynaklanır ve göz ardı edilebilir bir etkidir (Silve ve Mir, 2011). Kanser hücrelerinin kemoterapiye daha iyi uyum sağlaması tümörün apoptotik ölümüne sebep olur (Silve ve Mir, 2011). Lokal sisplatin, özellikle grade I ve II YDS tedavisinde lokal kontrolü artırmak için kullanılmış ve iyi sonuçlar elde edilmiştir (Bergman et al., 2016).
*İlgili Yazar: Enrico P. Spugnini. Biopulse srl, Napoli, İtalya. E-posta: info@enricospugnini.net
Bununla birlikte, ilk EKT çalışmalarından bu yana, elektroporasyonun sadece sisplatin ile tedavi edilen kontrol gruplarına kıyasla sisplatinin etkinliğini büyük ölçüde artırdığı görülmüştür (Sersa ve ark., 1998; Tozon ve ark., 2001). Evcil hayvanlarda YDS tedavisinde EKT’nin cerrahi tedaviye faydalı olduğunu gösteren çeşitli çalışmalar yapılmıştır (Spugnini ve ark., 2007b, 2008a, 2011). Bu çalışmada, tam eksize edilmemiş YDS hastası köpeklerde lokal ve sistemik kemoterapi ajanlarının (sırasıyla sisplatin ve bleomisin) uygulanmasını kapsayan kombine EKT protokolünün tolere edilebilirliği ve etkisi değerlendirilmiştir.
Materyal ve Metod
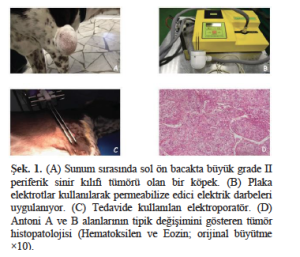
Histopatolojik olarak kesin teşhis konmuş, tam eksize edilmemiş sarkomları olan otuz üç köpek adjuvan EKT için sevk edildi. Şekil 1A’da sol ön bacakta büyük grade II periferik sinir kılıfı tümörü olan bir hasta gösterilmiştir. Dünya Sağlık Örgütü (DSÖ) derecelendirme sistemine göre evrelendirilen hastalar, şu kriterleri karşılamaları halinde tedavi edildi: i) neoplazm lokalizasyonunun erişilebilirliği; ii) uzak metastazların olmaması; iii) kalp hastalığı ve böbrek yetmezliği gibi hayatı tehdit eden diğer hastalıkların olmaması; ve iv) kemik tutulumunun olmaması. Hastalar cerrahi alanın ölçümü, tümörün histopatolojik incelemesi, bölgesel lenf nodu ince iğne aspirasyon biyopsisi (mümkün olduğunda), tam kan hücresi sayımı, kimya analizi, idrar tahlili, göğüs radyografileri ve abdominal ultrasonografi ile evrelendirilmiştir. Köpek hastalara 2 hafta arayla iki seans EKT uygulanmış ve bu seanslar dikişlerin alınmasından sonra (ameliyattan 10-14 gün sonra) başlatılmıştır. Köpeklere asepromazin, butorfanol ve medetomidin ile premedikasyon yapılmış, ardından propofol verilmiştir. Bleomisin intravenöz olarak 20 mg/m2 dozunda bolus şeklinde enjekte edildi. Ayrıca, lokal kontrolü daha iyi hale getirmek amacıyla, tümör yatağına (cerrahi skarın altında iki santimetre derinliğinde bir yüzey veya bacak lokalizasyonu olması durumunda, mümkün olduğunca derin ve her iki tarafta iki santimetre ek kenar) 0.5 mg/cm2 dozunda sisplatin infiltrasyonu yapıldı. Kemoterapi enjeksiyonlarından beş dakika sonra, her biri 50 + 50 µsn süren sekiz bifazik darbeden oluşan sekanslar, daha önce belirtildiği gibi gerekli tedavi kapsamı elde edilene kadar kaliper elektrotlar kullanılarak 1.300 V/cm’lik patlamalar halinde verilmiştir (Spugnini ve ark., 2011). Plaka elektrotlar kullanılarak bir hastanın tümör yatağına yapılan uygulama Şekil 1B’de gösterilmektedir. Pulslar veteriner kullanımı için onaylanmış bir elektroporatör (Onkodisruptor®) kullanılarak verilmiştir (. 1C). Hastalar ve elektrotlar arasındaki temas, elektro iletken bir jel kullanılarak optimize edilmiştir. Tedavi 2 hafta sonra tekrarlanmıştır. EKT seansları sırasında hastalar kardiyak monitör ve nabız oksimetresi ile takip edilmiştir.
Sonuç
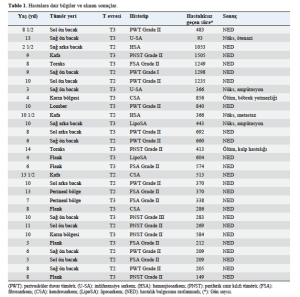
Otuz üç hasta 4 yıllık bir süre boyunca adjuvan tedavi görmek üzere sevk edilmiştir. Üç köpeğin takibi yarıda kesilmiş ve geriye istatistiksel analiz için 30 hasta kalmıştır. Kalan köpekler spesifik olarak şu ırklara aitti: 20 karışık ırk köpek, bir Rottweiler, bir Beagle, bir dobermann, bir bulldog, bir av köpeği, bir Alman çoban köpeği, iki dachshund ve iki Abruzzese çoban köpeği. Tümör histotipleri şöyleydi: dokuz perivasküler duvar tümörü, altı periferik sinir kılıfı tümörü, altı fibrosarkom, üç kondrosarkom, iki hemanjiosarkom, iki liposarkom ve iki indiferansiye sarkom. Periferik sinir kılıfı tümörünün histolojik özellikleri Şekil 1D’de gösterilmiştir. Histolojik derece ve tümör bölgesi dahil olmak üzere hasta özellikleri Tablo 1’de özetlenmiştir. Tedavi iyi tolere edilmiş ve yan etkiler üç köpekte lokal enflamasyonla sınırlı kalmış, bu da anti-inflamatuar ilacın (üreticinin talimatlarına göre firocoxib) uygulanmasıyla kontrol altına alınmıştır. Sistemik yan etkiler tespit edilmemiştir. Yanıt açısından, yirmi altı köpekte (%86,6) farklı zamanlarda nüks belirtisi görülmemiş (Tablo 1), dördünde nüks görülmüş ve nüks görülen dört köpekten biri (hemanjiosarkomdan etkilenen) akciğer metastazı nedeniyle ölmüştür (Tablo 1). Tedaviye yanıt veren yirmi altı köpekten ikisi farklı zamanlarda tedaviyle ilgisi olmayan nedenlerden ölmüştür. Ortalama hastalıksız geçen süreye makalenin yazıldığı sırada ulaşılamamıştır: tüm köpek popülasyonunun Kaplan-Meier yöntemiyle hastalıksız geçen süresi 857 gün olarak hesaplanmıştır (Şekil 2A). Prognostik faktörleri belirlemek amacıyla, daha geniş kapsamlı tümör kohortu (perivasküler duvar tümörleri) ile diğer tümör histotipleri arasında bir karşılaştırma yapıldı çünkü bunlar aynı zamanda tedaviye en iyi yanıt veren gruplar olarak kabul edildi (Stefanello ve ark., 2008; Avallone ve ark., 2014). Yine, ortalama hastalıksız geçen süreye ulaşılamamıştır ve hesaplanan tahmini hastalıksız geçen süre değerleri sırasıyla 1.162 güne karşı 992 gündü (p= 0,222) (Şekil 2B).
Tartışma
Elde ettiğimiz sonuçlar, adjuvan EKT kombinasyonu ile tedavi edilen YDS’li köpeklerin uzun vadeli sonuçları hakkında önemli bilgiler edinilmemize olanak tanımıştır. YDS cerrahisinde, rezeksiyon sınırlarının temiz olması hala altın standarttır ve yapılan birçok çalışmada cerrahi sınırların genişletilmesiyle genel ve hastalıksız sağkalım sürelerinin uzadığı iddia edilmektedir (Kuntz ve ark., 1997; Dernell ve ark., 1998; Ehrhart, 2005). Köpek YDS’leri için genel yaklaşım, 2-3 cm’lik lateral sınırlarla en-blok rezeksiyon ve tümör yatağının derininde bulunan fasiyal düzlemin dahil edilmesi yönündedir (Chase ve ark., 2009; Bray ve ark., 2014; Hohenhaus ve ark., 2016). Ancak, bu optimal cerrahi prosedür nadiren uygulanmakta ve köpek sarkomlarının çoğu hala marjinal olarak eksize edilmektedir (Kuntz ve ark., 1997; Dernell ve ark., 1998; Ehrhart, 2005; Bray ve ark., 2014). Elde edilen son klinik bulgular, cerrahi eksizyon sınırlarının genişletilmesinin tüm YDS vakalarında tedavinin başarısını artırmak için yeterli olmadığını göstermektedir (Bray ve ark., 2014). Ayrıca, cerrahi tekniğin agresifliğinin yanı sıra, boyut, histotip ve histolojik derece gibi diğer faktörler de YDS’lerin kontrolünde önemli bir rol oynamaktadır (McSporran, 2009; Bray ve ark., 2014). Diğer kontrol yöntemleri arasında cerrahi operasyon ile birlikte radyoterapi ve kemoterapi kombinasyonu yer almaktadır (Forrest ve ark., 2000; McKnight ve ark., 2000; Simon ve ark., 2007; Demetriou ve ark., 2012).

Radyoterapi günümüzde tam eksize edilmemiş solid tümörler için elektif adjuvan tedavi yöntemidir. Bununla birlikte, bazı sınırlamaları vardır. Bunlar: 1) radyasyon merkezinin ulaşılabilirliği, 2) tedavinin maliyeti ve 3) yaranın açılması, hastanın kendi kendine travma geçirmesi ve altta yatan kemiğin osteonekrozu gibi ciddi ancak hayatı tehdit etmeyen lokal komplikasyonların ortaya çıkma olasılığıdır (Demetriou ve ark., 2012). EKT, kemoterapi ajanlarının sistemik ve/veya lokal olarak uygulanmasını belli genlik, süre ve dalga biçimlerine sahip permeabilize edici elektrik darbelerinin verilmesiyle birleştiren anti-kanser bir tedavidir (Spugnini ve ark., 2016, 2017). Bu strateji, terapötik indeksi genellikle düşük olan lipofobik ilaçların etkinliğini artırmaya yardımcı olmakta, böylece antikanser etkiyi korurken hasta toksikozlarını en aza indirmektedir (Spugnini ve ark., 2014). EKT, hem kedi hem de köpek YDS’lerinin tedavisi için faydalı bir adjuvan tedavidir [Spugnini ve ark. (2016)’da incelenmiştir]. YDS vakalarında, EKT hemen hemen yalnızca adjuvan tedavi olarak kullanılmaktadır çünkü bu tip neoplazmlar sınırlı bir şekilde yalnızca EKT’ye yanıt vermektedir (Spugnini ve ark., 2016). Sonuç olarak, EKT çeşitli köpek ve kedi vakalarında YDS’lerin cerrahi eksizyonundan sonra adjuvan tedavi olarak kullanılmaktadır (Spugnini ve ark., 2007b, 2008a, 2011). Bu çalışmalarda, kemoterapi ajanı (bleomisin veya sisplatin) tümör yatağına enjekte edilmiştir. Tüm bu çalışmalarda, lokal kontrol açısından gözle görülür bir klinik kazanım elde edilmiştir. Tüm bu adjuvan çalışmalarda, daha önce radyasyon uygulanmış bir kedide radyasyona bağlı akut inflamatuar reaksiyon dışında yan etkiler lokal inflamasyon ve nadiren de olsa yaranın açılması şeklinde ortaya çıkmıştır (Spugnini ve ark., 2007a, 2008b, 2009, 2011). Bu, veteriner hekimlikte sisplatin ve bleomisin ile kombine edilmiş EKT yöntemine ilişkin yayınlanan ilk rapordur. Sistemik bleomisin uygulaması tümör yatağının daha derin katmanlarında ilacın dağıtılma şansını artırırken, sisplatinin lokal enjeksiyonu ile yüzeysel katmanlarda EKT’nin etkisinin artırılması amaçlanmıştır. Elde ettiğimiz sonuçlar, bu kombinasyonun agresif YDS’nin kontrolünü düşük yan etkilerle iyileştirebildiğini, hatta daha önce yayınladığımız köpek protokolünden bile daha iyi olduğunu göstermektedir. Yanıt açısından, tedavi edilen hastaların %86,6’sı, önceki çalışmadaki %50’lik orana kıyasla, bu makalenin yazıldığı sırada hala remisyondaydı (Spugnini ve ark., 2007a). Ayrıca, mevcut çalışmadaki tahmini hastalıktan arınma süresi 859 gündür (medyan süreye ulaşılamamıştır), önceki çalışmada ise bu süre 730 gündü (Spugnini ve ark., 2007a). Ayrıca, istatistiksel olarak anlam ifade etmese de, perivasküler duvar tümörlerinde diğer YDS’lere kıyasla hastalıksız geçen sürenin daha uzun olduğunu gözlemledik. Genel olarak, perivasküler duvar tümörleri, özellikle de ekstremitelerde yer alıyorlarsa, diğer histotiplere göre nüksetmeye daha az eğilimlidir (Stefanello ve ark., 2011). Özellikle, bu neoplazmlar için tümörün boyutu, derecesi (>I) ve yerinin önemli prognostik faktörler olduğu, bununla birlikte cerrahi sınırların ne durumda olduğunun risk faktörü olarak sadece klinik olarak anlamlı olduğu vurgulanmıştır (Stefanello ve ark., 2011). Hasta kohortumuzda, perivasküler duvar tümörlerinin (PWT’ler) çoğu ekstremitede bulunmasına rağmen, tedavi ettiğimiz tümörler çoğunlukla grade II veya daha yüksek tümörlerdi ve bunların boyutu ciddi büyüklükteydi (T2 veya T3). Bu da hastalarımızda uygulanan EKT’nin lokal kontrolü arttırdığını doğrulamaktadır. Cerrahi, YDS’lerin tedavisinde temel unsur olmaya devam etmektedir ve özellikle PWT’ler gibi belirli tipteki tümörler için çoğu zaman tek başına lokal kontrol sağlayabilir (Stefanello ve ark., 2008, 2011; Bray ve ark., 2014). Nüks etme ihtimali olan tümörlerin eksizyonu tam yapılmadığında, adjuvan tedaviler uygulanması önerilmektedir ve bunlar arasında yer alan EKT, mevcut literatürde de belirtildiği gibi maliyet ve verimlilik açısından makul bir performans sergilemektedir (Spugnini ve ark., 2007a, 2011). Gelecek çalışmalarda, sunulan verileri doğrulamak ve tedaviye yatkın olan alt grupları belirlemek için bu kombinasyon protokolü ile tedavi edilen vaka sayısını artırmayı ve analiz edilen tümör histotiplerini genişletmeyi planlamaktayız. Sonuç olarak, elde ettiğimiz bulgular EKT’nin köpek YDS’sinde lokal kontrolü artırmak için adjuvan tedavi olarak kullanılabileceğini göstermektedir. Bu tedavinin veteriner hekimlikte YDS vakalarının tedavisi için uygulanan mevcut antikanser yöntemlere dahil edilebilecek etkili bir yöntem olarak değerlendirilmesini öneriyoruz.
Kaynakça
Avallone, G., Boracchi, P., Stefanello, D., Ferrari, R., Rebughini, A. and Roccabianca, P. 2014. Canine perivascular wall tumors: high prognostic impact of site, depth, and completeness of margins. Vet. Pathol. 51, 713–721.
Bergman, N.S., Urie, B.K., Pardo, A.D. and Newman, R.G. 2016. Evaluation of local toxic effects and outcomes for dogs undergoing marginal tumor excision with intralesional cisplatin-impregnated bead placement for treatment of soft tissue sarcomas: 62 cases (2009–2012). J. Am. Vet. Med. Assoc. 248, 1148–1156.
Bray, J.P., Polton, G.A., McSporran, K.D., Bridges,and Whitbread, T.M. 2014. Canine soft tissue sarcoma managed in first opinion practice: outcome in 350 cases. Vet. Surg. 43, 74–82.
Chase, D., Bray, J., Ide, A. and Polton G. 2009. Outcome following removal of canine spindle cell tumours in first opinion practice: 104 cases. J. Small Anim. Pract. 50, 568–574.
Demetriou, J.L., Brearley, M.J., Constantino-Casas, F., Addington, C. and Dobson J. 2012. Intentional marginal excision of canine limb soft tissue sarcomas followed by radiotherapy. J. Small Anim. Pract. 53, 174–181.
Dernell, W.S., Withrow, S.J., Kuntz, C.A. and Powers,B.E. 1998. Principles of treatment for soft tissue sarcoma. Clin. Tech. Small Anim. Pract. 13, 59–64
Ehrhart, N. 2005. Soft-tissue sarcomas in dogs: a review. J. Am. Anim. Hosp. Assoc. 41, 241–246.
Forrest, L.J., Chun, R., Adams, W.M., Cooley, A.J. and Vail DM. 2000. Postoperative radiotherapy for canine soft tissue sarcoma. J. Vet. Intern. Med. 14, 578–582.
Hohenhaus, A.E., Kelsey, J.L., Haddad, J., Barber, L., Palmisano, M., Farrelly, J. and Soucy, A. 2016. Canine cutaneous and subcutaneous soft tissue sarcoma: an evidence-based review of case management. J. Am. Anim. Hosp. Assoc. 52, 77– 89.
Kuntz, C.A., Dernell, W.S., Powers, B.E., Devitt, C., Straw, R.C. and Withrow, S.J. 1997. Prognostic factors for surgical treatment of soft-tissue sarcomas in dogs: 75 cases (1986–1996). J. Am. Vet. Med. Assoc. 211, 1147–1151.
Liptak, J.M. and Forrest, L.J. 2013. Soft tissue sarcomas. In Small animal clinical oncology, 4th ed. Eds., Withrow, S.J., Vail, D.M. and Page, R.L., Elsevier, St Louis, Missouri, USA, pp: 356–380.
Mayer, M.N. and LaRue, S.M. 2005. Soft tissue sarcomas in dogs. Can. Vet. J. 46, 1048–1052.
McKnight, J.A., Mauldin, G.N., McEntee, M.C., Meleo,
K.A. and Patnaik, A.K. 2000. Radiation therapy for incompletely resected soft tissue sarcomas in dogs. J. Am. Vet. Med. Assoc. 217, 205–210.
McSporran, K.D. 2009. Histologic grade predicts recurrence for marginally excised canine subcutaneous soft tissue sarcomas. Vet. Pathol. 46, 928–933.
Selting, K.A., Powers, B.E., Thompson, L.J., Mittleman, E., Tyler, J.V., Lafferty. M.H. and Withrow, S. 2005. Outcome of dogs with high-grade soft tissue sarcomas treated with and without adjuvant doxorubicin chemotherapy: 39 cases (1996–2004). J. Am. Vet Med. Assoc. 227, 1442–1448.
Sersa, G., Stabuc, B., Cemazar, M., Jancar, B., Miklavcic, and Rudolf, Z. 1998. Electrochemotherapy with cisplatin: potentiation of local cisplatin antitumour effectiveness by application of electric pulses in cancer patients. Eur. J. Cancer 34, 1213–1218.
Silve, A. and Mir, L.M. 2011. Cell electropermeabilization and cellular uptake of small molecules: the electrochemotherapy concept. In Clinical aspects of electroporation, 1st ed. Eds., Kee, S.T., Gehl, J., Lee, E.W., Springer, New York,NY, USA, pp: 69–82.
Simon, D., Ruslander, D.M., Rassnick, K.M., Wood, C.A., Frimberger, A.E., Cotter, S.M., King, N.W. and Moore, A.S. 2007. Orthovoltage radiation and weekly low dose of doxorubicin for the treatment of incompletely excised soft-tissue sarcomas in 39 dogs. Vet. Rec. 160, 321–326.
Spugnini, E.P., Vincenzi, B., Citro, G., Santini, D., Dotsinsky, I., Mudrov, N., Montesarchio, V., Laieta, M.T., Esposito, V. and Baldi, A. 2007a. Adjuvant electrochemotherapy for the treatment of incompletely excised spontaneous canine sarcomas. In Vivo 21, 819–822.
Spugnini, E.P., Baldi, A., Vincenzi, B., Bongiorni, F., Bellelli, C., Citro, G. and Porrello, A. 2007b. Intraoperative versus postoperative electrochemotherapy in high grade soft tissue sarcomas: a preliminary study in a spontaneous feline model. Cancer Chemother. Pharmacol. 59, 375–381.
Spugnini, E.P., Vincenzi, B., Betti, G., Cordahi, F., Dotsinsky, I., Mudrov, N., Citro, G. and Baldi, A. 2008a. Surgery and electrochemotherapy of a high- grade soft tissue sarcoma in a dog. Vet. Rec. 162, 186–188.
Spugnini, E.P., Dotsinsky, I., Mudrov, N., Citro, G., Caruso, G., Cardelli, P. and Baldi, A. 2008b. Electrochemotherapy-induced radiation recall in a cat. In Vivo 22, 751–753.
Spugnini, E.P., Renaud, S.M., Buglioni, S., Carocci, F., Dragonetti, E., Murace, R., Cardelli, P., Vincenzi, B., Baldi, A. and Citro, G. 2011. Electrochemotherapy with cisplatin enhances local control after surgical ablation of fibrosarcoma in cats: an approach to improve the therapeutic index of highly toxic chemotherapy drugs. J. Transl. Med. 9, 152.
Spugnini, E.P., Melillo, A., Quagliuolo, L., Boccellino, M., Vincenzi, B., Pasquali, P. and Baldi, A. 2014. Definition of novel electrochemotherapy parameters and validation of their in vitro and in vivo effectiveness. J. Cell Physiol. 22, 1177–1181.
Spugnini, E.P., Azzarito, T., Fais, S., Fanciulli, M. and Baldi, A. 2016. Electrochemotherapy as first line cancer treatment: experiences from veterinary medicine in developing novel protocols. Curr.Cancer Drug Targets 16, 43–52.
Spugnini, E.P., Fais, S., Azzarito, T. and Baldi, A. 2017. Novel instruments for the implementation of electrochemotherapy protocols: from bench side to veterinary clinic. J. Cell Physiol. 232, 490–495.
Stefanello, D., Morello, E., Roccabianca, P., Iussich, S., Nassuato, C., Martano, M., Squassino, C., Avallone, G., Romussi, S. and Buracco, P. 2008. Marginal excision of low-grade spindle cell sarcoma of canine extremities: 35 dogs (1996–2006). Vet. Surg. 37, 461–465.
Thrall, D.E., LaRue, S.M., Daohai, Y., Samulski, T., Sander, L., Case, B., Rosner, G., Azuma, C., Poulson, J., Pruitt, A.F., Stanley, W., Hauck, M.L., Williams, L., Hess, P. and Dewhirst, M.W. 2005. Thermal dose is related to duration of local control in canine sarcomas treated with thermoradiotherapy. Clin. Cancer Res. 11, 5206–5214.
Tozon, N., Sersa, G. and Cemazar, M. 2001. Electrochemotherapy: potentiation of local antitumour effectiveness of cisplatin in dogs and cats. Anticancer Res. 21, 2483–2488.




