| Atıfta bulunmak için: Guimarães, T.G.; Cardoso, K.M.; Marto, C.M.; Teixo, R.; Serambeque, B.; Silva, F.C.e.; Alexandre, N.; Botelho, M.F.; Laranjo, Oncological Applications of Photodynamic Therapy in Dogs and Cats. Appl. Sci. 2022, 12, 12276. https://doi.org/10.3390/ app122312276 Akademik Editör: Chang Ming Charlie Ma Sunum Tarihi: 30 October 2022 Yayıncının Beyanı: MDPI, makalenin yayınlandığı coğrafi bölgeler ve kurumsal ilişkiler konusunda tarafsız kalacaktır. Telif Hakkı: © 2022 yazarlar. Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution (CC BY) lisansının hüküm ve koşulları altında dağıtılan açık erişimli bir makaledir (https:// creativecommons.org/licenses/by/ 4.0/). |
| 1 İleri Çalışmalar ve Araştırma Enstitüsü (IIFA), Évora Üniversitesi, 7002-554 Évora, Portekiz 2 Akdeniz Tarım, Çevre ve Kalkınma Enstitüsü (MED) ve Küresel Değişim ve Sürdürülebilirlik Enstitüsü (CHANGE), 7006-554 Évora, Portekiz 3 Biyofizik Enstitüsü, Tıp Fakültesi, Coimbra Üniversitesi, 3000-548 Coimbra, Portekiz 4 Klinik ve Biyomedikal Araştırma Enstitüsü (iCBR), Çevre, Genetik ve Onkobiyoloji Alanı (CIMAGO), Tıp Fakültesi, Coimbra Üniversitesi, 3000-548 Coimbra, Portekiz 5 İnovatif Biyotıp ve Biyoteknoloji Merkezi (CIBB), Coimbra Üniversitesi, 3000-548 Coimbra, Portekiz 6 Deneysel Patoloji Enstitüsü, Tıp Fakültesi, Coimbra Üniversitesi, 3000-548 Coimbra, Portekiz 7 Coimbra Klinik Akademi Merkezi (CACC), 3004-561 Coimbra, Portekiz 8 Tıp ve Sağlık Bilimleri Bölümü, Sağlık ve İnsan Gelişimi Fakültesi, Évora Üniversitesi, 7000-671 Évora, Portekiz 9 Veteriner Hekimliği Bölümü, Bilim ve Teknoloji Fakültesi, Évora Üniversitesi, 7004-516 Évora, Portekiz * İletişim: tarcisioguerra77@gmail.com (T.G.G.); mafaldalaranjo@gmail.com (M.L.) † Bu yazarlar bu çalışmaya eşit oranda katkıda bulunmuşlardır. |
| Özet: Küçük hayvan onkolojisinde fotodinamik terapi (PDT), yeni tedavi imkanlarına dikkat çekerek araştırma odağı olmuştur. Ayrıca, hayvanlar ve insan arasındaki tümör biyolojisinin benzerliği nedeniyle birçok hayvan çalışması deneysel insan hastalığı modeli oluşturmaktadır. PDT, kendi başına toksisitesi olmayan fotosensitize edici bileşikler kullanır. Belirli bir dalga boyuna maruz kaldığında, fotosensitizerler aktive olur ve hücre ölümüne yol açan reaktif oksijen türlerinin (ROS) üretimini tetikler. Ayrıca, antianjiyojenik etkiler ve immün stimülasyon da ortaya çıkabilmektedir. PDT minimal invazivdir, toksik değildir ve karsinojenik veya mutajenik yan etkilere neden olmaz. Bu nedenle, diğer neoplazm tedavi modaliteleriyle karşılaştırıldığında neoplastik olmayan dokular için güvenlidir. Bu çalışmada, FDT’nin küçük hayvanların, özellikle de köpek ve kedilerin kanser tedavisindeki kullanımı, bu tedavi yönteminin kullanıldığı çalışmalarda yer alan ilgili fotosensitizerlere ve tedavi protokollerine odaklanılarak ele alınmaktadır. Anahtar Kelimeler: fotodinamik tedavi; fotosensitizerler; veteriner onkolojisi |
GirişBirçok hayvan spontan olarak ortaya çıkan neoplazmlardan olumsuz etkilenmektedir [1-4]. Cerrahi, kemoterapi ve radyasyon veteriner hekimlikte en çok kullanılan yöntemler arasındadır [5,6]. Bununla birlikte, bu tedavilere alınan yanıtlardaki başarının değişken olması ve yan etkileri, bilim camiasını yeni, daha güvenli ve daha etkili tedaviler aramaya sevk etmiştir [7]. Dougherty ve meslektaşları, veteriner hekimlikte fotosensitizerler veya fotosensitize edici ajanlar olarak bilinen kimyasallarla birlikte ışık kullanan özel bir tedavi türü olan fotodinamik tedavinin (PDT) potansiyel faydalarını ilk kez fark etmiş ve hematoporfirin türevlerini köpek ve kedilerdeki solid tümörlerde araştırmışlardır [8]. Bununla birlikte, kemoterapi ve radyoterapinin kullanılabilirliği FDT’nin veteriner onkolojisinde uygulanmasını geciktirmiştir. Son zamanlarda, umut verici sonuçlar ve teknolojik gelişmeler PDT’ye olan ilginin yaygınlaşmasına katkıda bulunmuştur [9-12]. FDT’nin avantajları arasında minimal invazivliği, düşük toksisitesi ve karsinojenik veya mutajenik etkilerinin olmaması yer almaktadır [13-15]. Diğer tedavi yöntemleriyle karşılaştırıldığında, PDT tümör hücrelerinde seçici sitotoksisite oluşturarak neoplazmların uzağındaki ve yakınındaki neoplastik olmayan dokular için daha güvenlidir [16,17]. Tek bir uygulamada tatmin edici bir sonuç elde edilebilir, ancak PDT normal dokulara zarar vermeden veya ilaç direncini ortaya çıkarmadan tekrarlanabilir [18–20]. Diğer bir avantajı ise PDT’nin ilaç direnci yolaklarını değiştirip inhibe edebilmesi ve standart tedavilere dirençli hücreleri yeniden duyarlı hale getirebilmesidir [21]. Bunun yanı sıra, PDT çoğu durumda iyonize olmayan radyasyon kullanır ve DNA’da sınırlı sitotoksik hasara yol açar [22]. Fotosensitizer, görünür ışık ve oksijen, fotodinamik reaksiyonun toksik olmayan üç önemli bileşenidir [11,12,19,23]. FDT’yi başlatmak için fotosensitizer uygulanır ve prensip olarak esas olarak hedef dokularda birikir. Belirli bir dalga boyu ve enerji ışık kaynağı ile ışınlama, molekülü aktive ederek fotofiziksel ve fotokimyasal bir sürece yol açar ve reaktif oksijen türleri (ROS) üretir [24,25]. Fotosensitizer aktive edildiğinde, uyarılmış hale geçer. Bu yüksek enerji halinde, iki tür fotodinamik reaksiyon meydana gelir. Tip 1 reaksiyonda, fotosensitizer biyomoleküllerle etkileşime girerek radikaller ve diğer ROS’ları oluşturur. Tip 2 reaksiyonunda enerji oksijene aktarılır ve singlet oksijen oluşur [10,12,26]. Bu süreç, farklı sonuçları olabilen fotodinamik reaksiyonun temelini oluşturur ve Şekil 1’de gösterilmiştir. |
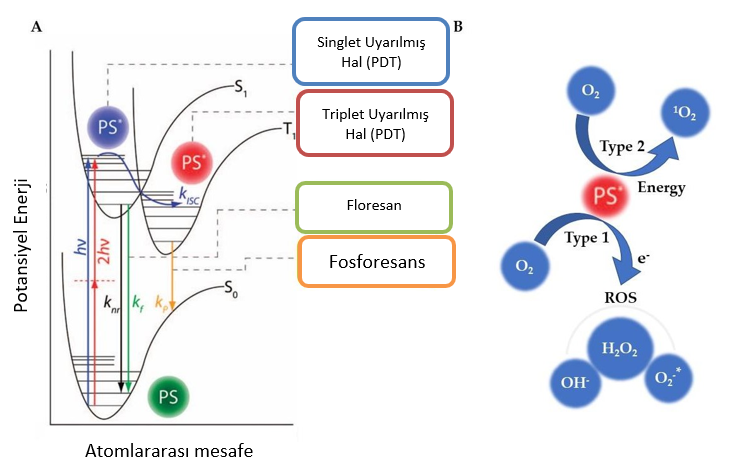
| Yüksek miktarda ROS üretimi neoplazm üzerinde terapötik etki gösterir. Geri dönüşümsüz oksidasyon apoptoz, nekroz ve otofajiyi içerebilen kanser hücresi ölümüne yol açar [24-28]. Ayrıca, tümör mikroçevresi de vasküler ve enflamatuar yanıtlar nedeniyle değişebilir. PDT, endotel hücre hasarını ve tümör damarlarının tıkanmasını indükleyerek besleyici kaynağı sınırlayabilir ve kanser hücresi ölümünü destekleyen ek bir mekanizma olan iskemiye neden olabilir [24-26]. PDT ayrıca interlökinler ve tümör nekroz faktörü α (TNF-α) gibi çeşitli pro-enflamatuar sitokinleri ve E-selektin ve hücreler arası adezyon molekülü 1 (ICAM-1) gibi adezyon moleküllerini de harekete geçirir [25,29,30]. İmmün modülatörlerin devreye girmesi, immünitenin potansiyel olarak aktivasyonuna işaret etmektedir. Teorik olarak, PDT mediatörleri neoplazm dokusunu yok edebilir ve bağışıklık sistemini aktive ederek vücuttaki kanser hücrelerinin ortadan kaldırılmasına katkıda bulunabilir ve potansiyel olarak muhtemel nüksleri veya metastazları önleyebilir [24,31]. Neoplazmların boyutları, konumu, tümör biyolojisi, doku oksijenasyonu ve dozimetri dahil olmak üzere çeşitli faktörler tedavi sonucunu etkileyebilir [32]. Aslında, fotosensitizer en önemli faktör olarak kabul edilir [11,13]. Bu nedenle, birçok yazar ideal fotosensitizörün özelliklerini incelemiştir [19,24,25,33-35]. Fotosensitizer kimyasal olarak saf bir bileşik olmalı, 600-800 nm terapötik pencere içinde fotoaktivasyonla uyumlu absorbans spektrumlarına sahip olmalı, ışık yokluğunda toksik olmamalı, yüksek singlet oksijen verimi sunmalı, tercihen tümörde birikmeli ve hızla atılmalıdır [24,25,35,36]. Ek olarak, formülasyon uygulama bakımından güvenli olmalı ve oral, topikal veya parenteral uygulamaya izin verecek şekilde çok yönlü olmalıdır [37]. Amerika Birleşik Devletleri Gıda ve İlaç Dairesi (FDA) ve Avrupa İlaç Ajansı (EMA), dermatoloji, oftalmoloji, üroloji ve pnömoloji dahil olmak üzere çeşitli tıbbi uzmanlık alanlarıyla ilişkili neoplazmları ve malign olmayan hastalıkları tedavi etmek için PDT’yi onaylamıştır [32,38-40]. Veteriner hekimlikte, sıklıkla cesaret verici sonuçlarla birkaç deneme gerçekleştirilmiştir. Yine de, PDT için özel bir onay veya öneri mevcut değildir. PDT, veteriner onkolojide az bilinen bir tedavi yöntemidir; ancak, kedi skuamöz hücreli karsinomu için endikedir [41]. Bununla birlikte, diğer neoplazmlar PDT ile tedavi edilebilir. Bu çalışma, klinik uygulamalardan köpek ve kedilere uygulanan en son gelişmelere kadar, veteriner hekimlik kapsamında PDT uygulamalarını özetlemeyi amaçlamaktadır. |
FotosensitizerlerÇoğu fotosensitizer tetrapirol yapısına dayalı çalışır ve benzersiz fotodinamik ve fotodiagnostik özellikler sergiler [10,11]. Diğer yaygın fotosensitizerler, fenotiyazin boyalarının (toluidin ve metilen mavisi gibi), siyaninlerin ve polisiklik aromatik bileşiklerin (hiperisin gibi) kimyasal özelliklerini taşır [11]. Tetrapiroller arasında, porfimer sodyum (Photofrin) klinik uygulamada kullanılan ilk fotosensitizerdir. Sentetik açıdan bakıldığında, yeni makrosiklikler oluşturabilecek periferal pirolik pozisyonlarda modifikasyonlara ve yapısal değişikliklere imkan vermektedir [42]. Bununla birlikte, 630 nm’deki düşük absorpsiyon katsayısı, yüksek akıcılık ihtiyacı (100 ila 200 J/cm2), uzun maruziyetler, polar çözücülerde düşük çözünürlük ve intravenöz uygulama ile sınırlıdır [10,19,42,43]. Bazı dokularda yüksek kalıcılık, uzun süreli hasta ışığa duyarlılığı ile ilişkilidir [44-46]. Porfimer sodyum ve diğer hematoporfirinler ilk nesil fotosensitizerlerdir. İkinci nesil, hiperisin ve benzoporfirin türevleri ve diğer porfirinler, klorinler, bakteriyoklorinler ve ftalosiyaninler gibi fotosensitizörleri içerir. Bunlar daha yüksek saflığa, terapötik pencerede (600-800 nm, Şekil 2B) daha yüksek absorpsiyona ve daha yüksek ROS verimine sahip daha optimize moleküllerdir [10]. Temoporfin (metatetra(hidroksifenil)klorin, mTHPC) Avrupa Birliği’nde 2001 yılında Foscan adı altında önceki tedavilere yanıt vermeyen ve kemoterapi ya da radyoterapi endikasyonu olmayan ileri evre baş ve boyun kanseri hastaları için palyatif ya da lokal bir tedavi olarak piyasaya sürülmüştür [47]. Daha derin nüfuz eden bir dalga uzunluğunda (652 nm) bir absorpsiyon bandı ve yüksek singlet oksijen verimi ile birinci nesil fotosensitizörlerden 100 kat daha etkili olduğu düşünülmüştür [48]. Fotokimyasal açıdan avantajlarına rağmen, klinik uygulamasıyla ilgili zayıflıklar vardı. Aşırı aydınlatma fibrozis, skarlaşma ve fistüllere neden olabilir ve ortadan kaldırılması altı haftaya kadar sürebilir [33,49]. Başlangıçta maküler dejenerasyonu tedavi etmek için geliştirilen benzoporfirin türevi monoasit halka A (BPD-MA, Verteporfin, Visudyne) kanser tedavisinde de avantajlar sunmaktadır. Kutanöz fotosensitizasyondan kaçınarak 690 nm’de absorpsiyona sahiptir ve hızla ortadan kaldırılır [50]. Mono-L-aspartil klorin e6 (NPe6, Talaporfin sodyum, Laserphyrin) suda çözünür, 664 nm’de absorpsiyon bandına sahiptir ve yüksek singlet oksijen verimine sahiptir. Neoplastik dokuda düşük birikim süresine rağmen, hastalar deride uzun süreli fotosensitivite yaşayabilir [33,51]. Bu fotosensitizer Japonya’da akciğerin yüzeysel skuamöz hücreli karsinomunu tedavi etmek için onaylanmıştır [33,51-53]. Protoporfirin IX’un öncüsü olan 5-ALA (5-aminolevulinik asit), hem yolu ile metabolize edilen bir pro-ilaçtır. Protoporfirin IX aktivasyon dalga boyu 630 nm’dedir. Hızlı bir şekilde 12 saat içinde temizlenmesi, kısa bir ışığa duyarlılık süresi ile sonuçlanır [10]. 5-ALA sıklıkla aktinik keratoz, bazaliomalar ve kutanöz T-hücreli lenfomaları tedavi etmek için topikal olarak uygulanmıştır [54-57]. Yine de, hidrofilik özellikleri nedeniyle, 5-ALA’nın cilde nüfuz etme yeteneği sınırlıdır [10]. 5-ALA’nın metil ve benzil esterleri bu sınırlamanın üstesinden gelir [58,59], aktinik keratoz ve bazaliyomların tedavisinde ve mesane neoplazmlarının fotodiyagnozunda kullanılır [10,60]. BODIPY’ler, potansiyel olarak ilginç fotosensitizerler ve ayrıca kanser teragnostiği için kullanılan oldukça fotoaktif ajanlardır [61]. Potansiyel olarak görüntülü PDT’ye olanak tanıyan yüksek floresanslarına ek olarak, yüksek ROS üretme kabiliyeti de göstermiştir [62,63]. Birinci ve ikinci nesil fotosensitizerlerin birikimleri neoplastik dokularda normal dokulara kıyasla 5:1’e ulaşabilir [64]. Bununla birlikte, bu etkinin arkasındaki mekanizmalar hala tartışma konusudur [10]. Sızdıran tümör neovaskülarizasyonuna bağlı olarak artan geçirgenlik ve retansiyon, lenfatik drenaj yokluğu, düşük yoğunluklu lipoprotein reseptörlerinde artış, tümörle ilişkili makrofajlar tarafından fagositoz ve fotosensitizer iyonizasyonuna ve retansiyonuna katkıda bulunan daha düşük bir pH ile ilişkili olup, tümörlerde daha yüksek birikimi açıklamaktadır [25,65,66]. Bununla birlikte, tümör hücreleri tarafından alımı artırarak FDT’yi iyileştirme ihtiyacı, üçüncü nesil fotosensitizerler olarak adlandırılan bir dizi gelişmeye yol açmıştır. Buna göre, iletim, seçicilik ve farmakokinetiği iyileştirmek için taşıyıcılar, antikorlar veya lipozomlar gibi biyolojik konjugatlar kullanılmaktadır [66]. Polimerik nanopartiküller, miseller ve metalik nanopartiküller dahil olmak üzere nanopartiküller, umut verici bir başka taşıma yöntemidir [67]. Fotosensitizerlerin bir başka ilgi çekici uygulaması da fotodinamik tanıdır. Fotodiyagnoz, in situ neoplazmları teşhis etmek için fotosensitizerlerin floresansını kullanır [10,68-70]. Fotodiyagnozda fotosensitizerler kullanıldığında daha düşük dalga boyunda floresans artışı sağlanır [71]. Bu uygulama, 5-ALA analoglarının tümör dokusunu tanımlamak için kullanıldığı glioma mikrocerrahisi ve mesane cerrahisinde özel bir öneme sahiptir [72,73]. Teşhis ile tedaviyi tek bir prosedürde birleştirme arzusu, teragnostik yeteneklere sahip çeşitli moleküllerin geliştirilmesini sağlamıştır [61-63,74,75]. Teragnostik özelliklere sahip fotosensitizerler dinamik bir araştırma alanı oluşturmaktadır [76,77]. |
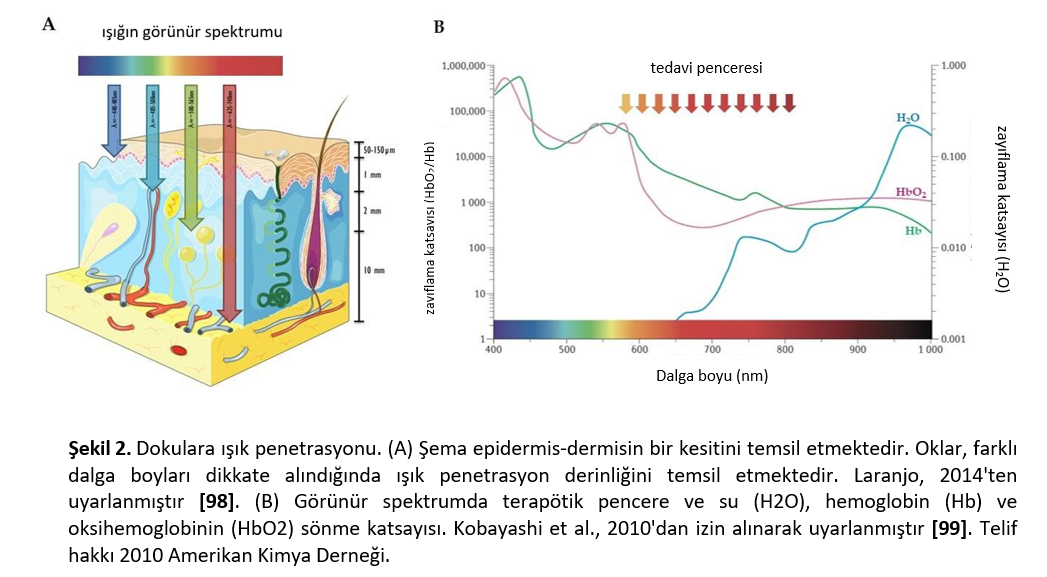
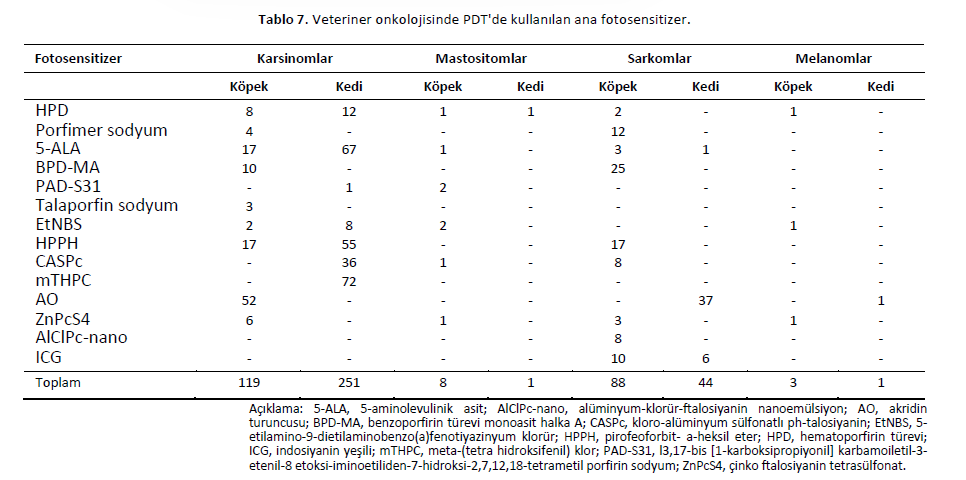
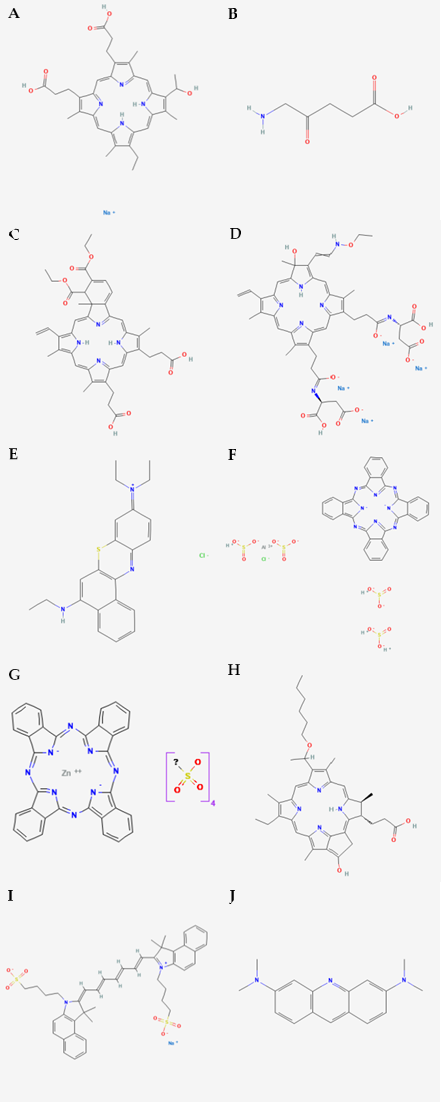
Veteriner Onkolojide PDTBugüne kadar, veteriner onkolojisinde porfimer sodyum [78-82], ftalosiyaninler [83,84] ve 5-ALA [85-87] dahil olmak üzere çeşitli fotosensitizerler kullanılmıştır. Üçüncü nesil yaklaşımların kullanımı da rapor edilmiştir [18]. 5-ALA, tedavinin yanı sıra tümörlerin fotodinamik tespiti için de kullanılmıştır [68,71]. Veteriner neoplazmlarını tedavi etmek için kullanılan fotosensitizerlerin ana kimyasal yapıları Şekil 3’te sunulmuştur. Fotosensitizerler çeşitli yollarla uygulanabilir. Sistemik [81,82] ve oral [82] uygulamalar köpek ve kedilerde yaygındır. Bununla birlikte, topikal uygulama genelleşmiş fotosensitizasyondan kaçınma avantajı sağlayabilir. İntralezyonel gibi diğer uygulama yolları daha az sıklıkla rapor edilmiştir [9]. Uygulama yolunun fotosensitizer biyodistribüsyonunu etkileyebileceği ve hedef dokudaki etkiyi değiştirebileceği göz önünde bulundurulmalıdır [88-90]. Fotosensitizerin kimyasal özellikleri ve konsantrasyonu, ışık dozimetrisi ve hedef doku yan etkileri etkileyebilir [91]. Bununla birlikte, sistemik uygulamada bile ciddi yan etkiler nadiren gözlenmiştir [89,92,93]. FDT topikal olarak uygulandığında en sık bildirilen yan etkiler kaşıntı ve lokal rahatsızlık olmuştur [91]. FDT sistemik olarak uygulandığında hapşırma, ödem, alopesi, kusma, trombositopeni, anoreksi, tedavi sırasında vücut ısısında yükselme ve uzun süreli fotosensitizasyon rapor edilmiştir [9,94-96]. Işık kaynakları da FDT’nin önemli bir bileşenidir. Kırmızı veya yakın kızılötesi ışık kaynakları daha uzun dalga boyları, daha yüksek doku penetrasyonu ve daha uygun enerji nedeniyle tercih edilmektedir (Şekil 2A). Bu nedenle, 600 ila 1200 nm arasındaki dalga boyları PDT için optik pencere olarak kabul edilir [97]. Birincil ışık kaynakları arasında lazerler, ışık yayan diyotlar (LED’ler) ve lambalar bulunmaktadır [33]. Lazerler ve ışık yayan diyotlar en yaygın kullanılanlardır [9,10]. Bununla birlikte, bazı raporlar güneş ışığının hayvanlarda yüzeysel cilt kanseri tedavisi için potansiyele sahip olduğunu göstermektedir [10]. Işık kaynağı seçimi, kullanılacak fotosensitizöre ve tedavi edilecek tümör dokusunun konumuna ve özelliklerine bağlıdır [32,71]. Yüzeysel neoplazmalar için ışık (yüzeysel PDT), düşük penetrasyon derinliğine sahip tedavileri içerir (örneğin, lazerler, LED’ler ve geniş bantlı lambaların kullanıldığı cilt, tipik olarak <2 mm). İnterstisyel PDT için ışık kaynakları, iğneler, kateterler ve optik fiberler kullanılarak desteklenen 1 cm’nin ötesindeki tümörleri tedavi edebilir, ancak geleneksel ışık kaynakları yüzeysel PDT’ye benzer ışık penetrasyonuna sahiptir. Derin PDT için geliştirilmekte olan ışık kaynakları, çok işlevli nanopartiküller (yakın kızılötesi ışıkla uyarılan nanomateryaller, X-ışını/Cherenkov ile uyarılan sintilasyon/sonradan parlama nanopartikülleri ve kendinden ışıklı nanokonjugatlar) dahil olmak üzere çok çeşitli teknolojileri içermektedir [22]. |
| PDT ile ilgili veteriner biyogüvenliği, profesyonel, hayvan türleri ve atık bertarafı ile ilgili önlemlerden meydana gelmektedir [9]. Hayvanlara her zaman sedasyon ve/veya anestezi uygulanır; bazı hastalarda antibiyotik tedavisi de verilir [64,100]. Tedavi edilen bölgeler bandajlarla korunmalıdır [9] ve Elizabeth yakalığın tedavi sonrası kullanımı yalama ve lokal mutilasyonu önlemek için gerekli olabilir [9]. Kişisel koruyucu donanım, ışık kaynaklarından korunmak için uygun giysi, eldiven, maske ve gözlükleri içermelidir [9]. Fotosensitizerler ışıktan korunmalı ve güvenli uygulama için steril şırıngalarla kullanılmalıdır [7]. Tedavi görmeyen alanlara koruyucu fiziksel bir bariyer yerleştirilmesi de önerilir (örn. gazlı bez veya benzeri). Işık kaynağıyla ilişkili tüm ekipman ve kablolar tedaviden önce ve sonra temizlenmeli ve dezenfekte edilmelidir [9]. FDT, Şekil 4’te gösterildiği gibi klinik uygulamada aktif olarak kullanılmamasına rağmen veteriner hekimlikte çeşitli neoplazmlarda incelenmiştir [9,10]. Bu çalışmaların birçoğu PDT’nin veteriner onkolojisinde kullanılma potansiyeline işaret etmektedir. Klinik çalışmalar, fotosensitizerlere, tedavi protokollerine ve ana sonuçlara odaklanarak kanser türüne göre aşağıdaki bölümlerde detaylandırılacaktır. |
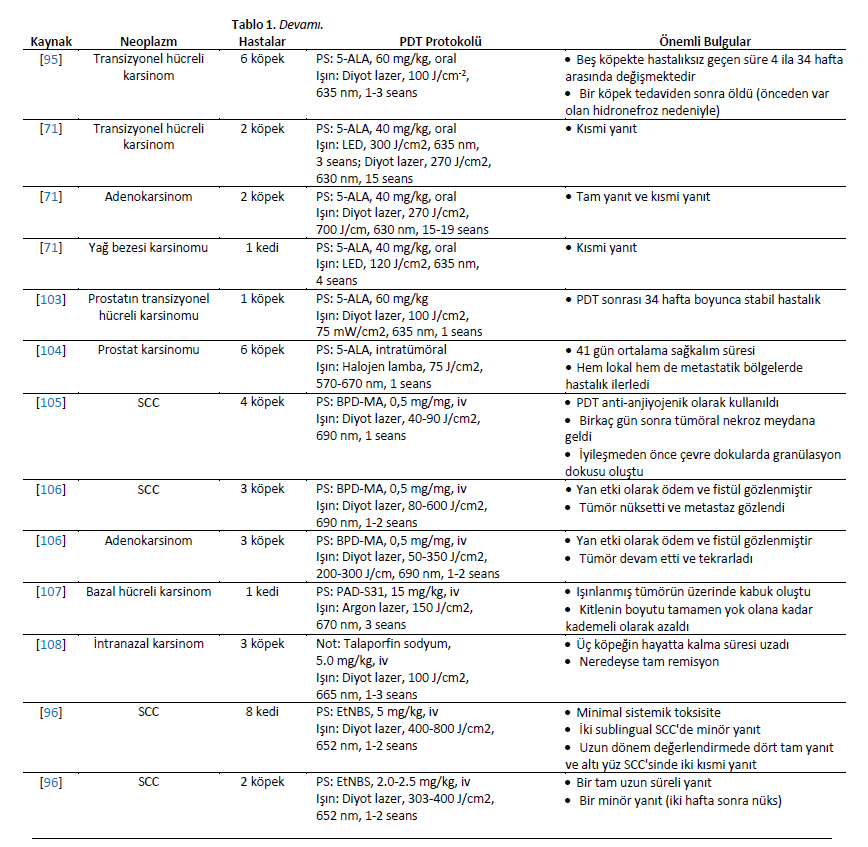
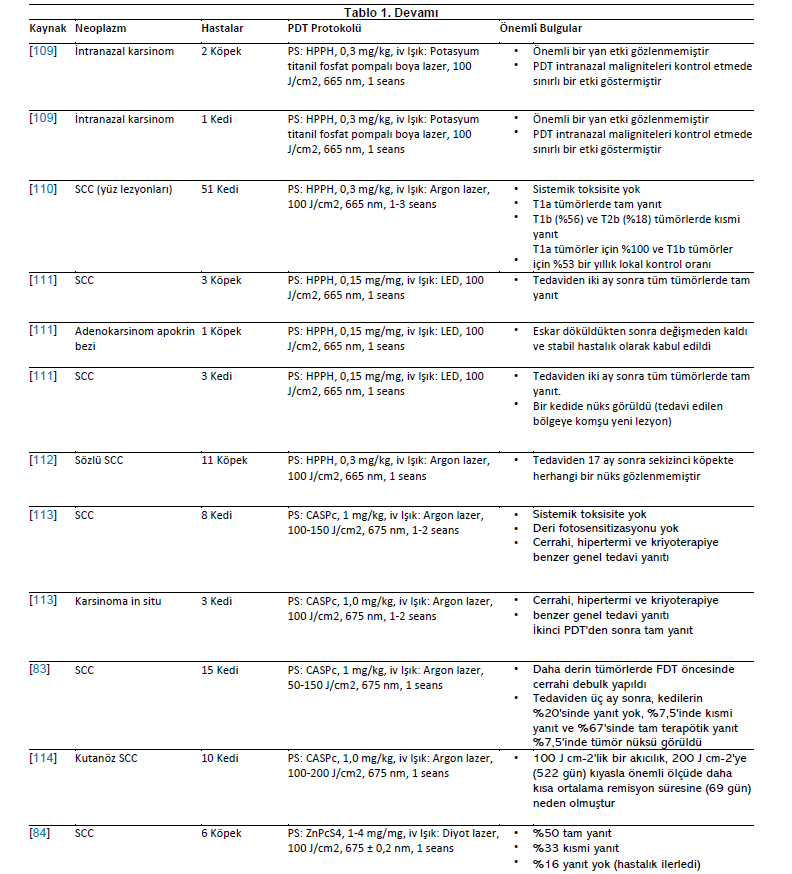
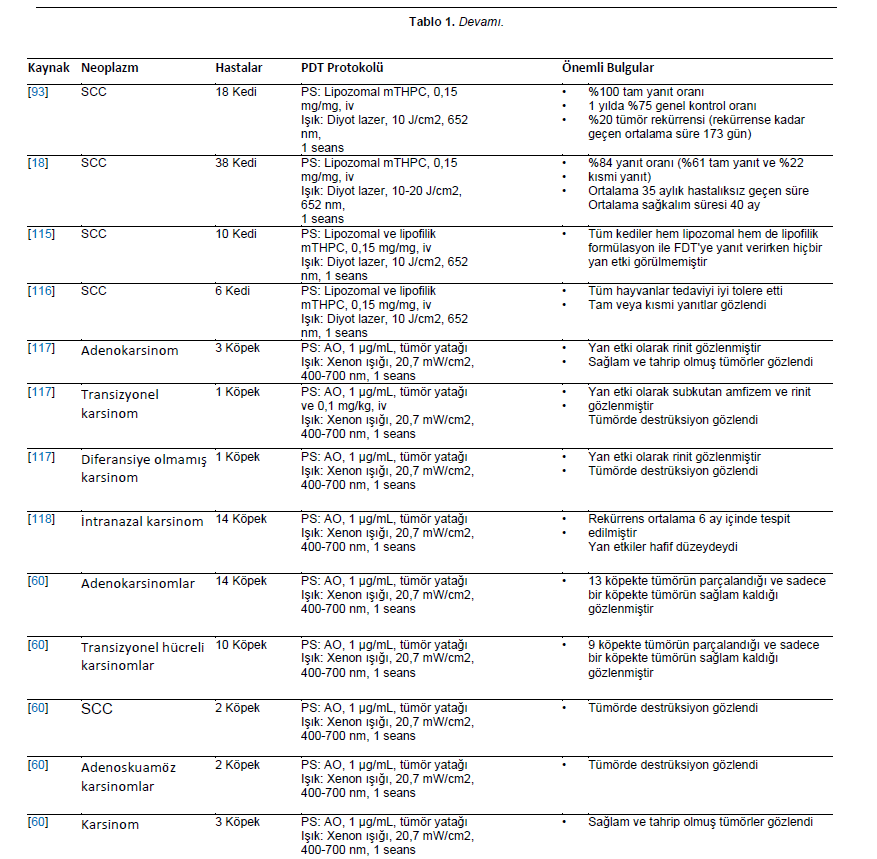
| Karsinomlar Karsinomlar deri, meme, mide ve prostat dahil olmak üzere çeşitli organlarda ortaya çıkan epitelyal ve glandüler kökenli kötü huylu tümörlerdir. Köpek ve kedilerde yapılan birkaç klinik çalışma, skuamöz hücreli karsinom tedavisinde FDT’nin sonuçlarını değerlendirmiştir [18,44,71,93]. Hematoporfirin türevi (HPD), kutanöz skuamöz hücreli karsinom tanısı konan 12 kediye intravenöz olarak uygulanmıştır. İnfiltrasyon göstermeyen küçük lezyonları olan kedilerde kısmi ve tam yanıtlar görülmüştür. Bununla birlikte, lokal ödem, kızarıklık, kaşıntı, eritem, fotosensitizasyon ve alopesi gibi çeşitli yan etkiler görülmüştür [44]. Farklı kökenlerden neoplazmları olan beş köpek hastayı içeren bir çalışmada, HPD 631 nm argon lazer ile aktive edilmiştir. İki ve dokuzuncu aylarda toplam %67’lik bir yanıt gözlenmiştir [101]. Burun skuamöz hücreli karsinomu olan bir köpek, oral kavite adenokarsinomu olan bir köpek ve gastrik mukoza skuamöz hücreli karsinomu olan bir köpeği tedavi etmek için benzer bir yöntem uygulanmıştır. Hastalar sırasıyla 12 ayda tam yanıt, altı ayda tam yanıt ve kısmi yanıt (%60/40 azalma) göstermiştir [79]. Özofagus karsinomlu bir köpek üç PDT seansı ile tedavi edildi. Porfimer sodyum 2,7 mg/kg intravenöz olarak uygulanmış, ilk seansta 200 J/cm3 ve sonraki seanslarda 250 J/cm3 kullanılmıştır. Hasta progresif anoreksi, kilo kaybı ve diğer belirtiler göstermiş ve ilk tedaviden 278 gün sonra ötenazi edilmiştir [102]. Porfimer sodyum bazlı PDT, akciğer karsinomlu üç köpeği tedavi etmek için elektromanyetik navigasyonel bronkoskopi yoluyla gerçekleştirilmiştir [82]. Tedavi başarılıydı ve yan etkiler tolere edilebilir ve yönetilebilirdi. PDT’den bir hafta sonra, ilgili akciğer lobları cerrahi olarak eksize edilmiş ve histolojik olarak değerlendirilmiş, PDT ile tedavi edilen tümörlerde nekroz, enflamatuar hücreler ve arteriyel tromboz görülmüştür [82]. %20 konsantrasyonda 5-ALA, on nazal planum lezyonu, iki pineal lezyon ve bir göz kapağı lezyonu olmak üzere yüzeysel skuamöz hücreli karsinomlu 11 kedide topikal olarak kullanılmıştır [86]. Bir sonraki çalışmada, 5-ALA bazlı PDT, yüzeysel nazal planum skuamöz hücreli karsinomlu 55 kedi tedavi edilmiştir [85]. PDT iyi tolere edilmiş ve etkili olmuştur. Bazı vakalarda kısmi yanıt ve nüksler görülmekle birlikte tam yanıt oranı yüksekti [85,86]. 55 hayvandan oluşan kohortta, %96’sı tedaviye yanıt vermiş ve %85’i tam yanıt göstermiştir [85]. Alt üriner sistemin transizyonel hücreli karsinomu teşhisi konulan altı köpek 5-ALA ile tedavi edilmiş ve beş köpekte 4 ila 34 haftalık neoplazmsız aralıklarla sonuçlanmıştır [95]. Daha yakın zamanda, 5-ALA (40 mg/kg) bazlı PDT, transizyonel hücreli karsinom veya adenokarsinom tanısı konan dört köpekte ve sebase bez karsinomu olan bir kedide diyot lazer veya LED kullanılarak gerçekleştirilmiştir. |
| Adenokarsinomlu köpeklerden biri tam lokal yanıt vermiştir; ancak hastalığın ilerlediği gözlenmiştir. Diğer hastalar kısmi yanıt göstermiştir [71]. Prostatın transizyonel hücreli karsinomu teşhisi konulan bir köpek 5-ALA bazlı FDT’ye tabi tutulmuştur. PDT’den sonraki 24 haftalık takip süresince, hastalık stabil kalmış ve hayvanın sağlık durumunda önemli bir değişiklik olmamıştır. Ancak, tedaviden 34 hafta sonra köpekte hematüri, idrar kaçırma ve tenesmusta ani bir artış görüldü. Köpek değerlendirmesinde pulmoner metastaz olmamasına rağmen tümör boyutunda artış görülmüştür. Köpek 35. haftada, uygulanan tedaviyle ilgisi olmayan nedenlerle ötenazi edildi [103]. Prostat karsinomu teşhisi konulan altı köpek 5-ALA bazlı PDT ile tedavi edilmiştir. Uygulama, periüretral ve subkapsüler prostatik dokuya enjeksiyon yoluyla prostat içine gerçekleştirilmiştir. Hastalık lokal olarak ilerleyerek üretral strangülasyon bulgularına ve uzak metastazlara neden olmuştur. Sağkalım süresi 10 ila 68 gün arasında değişmekte olup diğer tedavi yaklaşımlarıyla karşılaştırıldığında olumsuzdur [104]. BPD-MA (Verteporfin, 0.5 mg/kg) ve diyot lazer (690 nm), nazal planum (iki vaka), rostral mandibula ve nazal kaviteden kaynaklanan skuamöz hücreli karsinomlu dört köpeği tedavi etmek için kullanıldı. Tedaviden birkaç gün sonra tümör bölgesinde nekroz gözlenmiştir. Daha kısa ilaç-ışık aralığına sahip protokolün tümör vaskülatürünü hedeflemek için ilginç bir seçenek olabileceği düşünülmüştür [105]. Aynı yazar daha sonra aynı bileşiğe (BPD-MA, 0,5 mg/kg) ve 690 nm diyot lazer kullanımına dayanan antivasküler PDT’nin ne kadar etkili olduğuna dair bir çalışma yayınlamıştır. Tümör nüksüne rağmen, tedavi köpeklerin skuamöz hücreli karsinom ve adenokarsinom (oral ve nazal) tedavisinde umut verici bir yöntem olmuştur [106]. l3,17-bis [1-karboksipropiyonil] karbamoiletil-3-etenil-8 etoksiminoetiliden- 7-hidroksi-2,7,12,18-tetrametil porfirin sodyum (PAD-S31) bazal hücreli karsinomu olan bir kedide kullanılmıştır. PAD-S31 intravenöz olarak uygulandı ve bir argon lazer (670 nm, 150 J/cm2) ile radyasyona maruz bırakıldı. Üç seans PDT uygulanmış ve hiçbir lezyon nüksü bildirilmemiştir [107]. Radyoterapinin tümör nüksünden sonra, intranazal karsinomdan etkilenen üç köpek talaporfin sodyum ile tedavi edilmiştir. Bu raporda, PDT neredeyse tam remisyon ve uzun sağkalım süresi sağlayarak tekrarlayan intranazal karsinomlar için işlevsel bir terapötik yöntem olduğunu göstermiştir [108]. 5-ethylamino-9-diethylaminobenzo(a)phenothiazinium chloride (EtNBS) kullanımı köpekler ve kediler için güvenli kabul edilmiştir. İki kedi dil altı skuamöz hücreli karsinomu minör yanıt gösterdi; altı kedi yüz skuamöz hücreli karsinomu iki vakada kısmi yanıt ve dört vakada tam uzun süreli yanıt gösterdi. Göz kapağı skuamöz hücreli karsinomu olan bir kedi tedaviye kısmi yanıt vermiştir. İntraoral skuamöz hücreli karsinomlu iki köpekte bir vakada minör yanıt, diğerinde ise uzun süreli tam yanıt görülmüştür [96]. İntranazal adenokarsinom tanısı konulan iki köpek ve bir kedi bir PDT seansına tabi tutulmuştur. Genel olarak, tüm hayvanlarda pyropheophorbide- a-hexyl ether (HPPH) ile FDT sonrasında tedaviye gerek kalmadan yüzde şişme görülmüş ve fotosensitizerle ilişkili yan etki görülmemiştir. PDT, epistaksis, hapşırma ve nazal içerik salınımı gibi bazı klinik belirtilerin sıklığını ve şiddetini azaltarak hastalığı bir süre için kontrol altına alabildiğini göstermiştir [109]. Doğal olarak ortaya çıkan yüz derisi skuamöz hücreli karsinomları olan 51 kedide HPPH tabanlı FDT uygulanmıştır. Bir yıllık takip sonucunda neoplazmların %62’sinde lokal kontrol sağlanmış, hematolojik ve biyokimyasal toksisite veya klinik yan etkiler görülmemiştir [110]. HPPH tabanlı PDT dört köpekte araştırılmıştır. Üç köpekte rostral mandibula, ventral abdominal deri ve footpad’de skuamöz hücreli karsinomlar vardı. Diğer köpekte ise ağız derisinde apokrin bez adenokarsinomu vardı. FDT’den sonra eskar oluşumu meydana geldi. İki ay sonra, skuamöz hücreli karsinomlar tam yanıt olarak kabul edildi. Apokrin bezi adenokarsinomu olan köpek tedaviden sonra 56 hafta boyunca değişmeden kaldı. Bu çalışmada, 60 gün boyunca tam yanıt gösteren skuamöz hücreli karsinomlu üç kedi yer almıştır [111]. |
| Oral skuamöz hücreli karsinom tanısı konan on bir köpek, 0,3 mg/kg dozunda intravenöz olarak enjekte edilen HPPH ile tedavi edilmiştir. Tümörler 48 saat sonra 665 nm’de 100 J/cm2 ile ışınlandı. Sekiz köpek 17 ay boyunca nüks olmadan iyileşmiş olarak kabul edildi. PDT ile elde edilen sonuç cerrahi müdahale ile karşılaştırılabilir olmakla birlikte estetik sonuçlar açısından daha üstündü [112]. On kediye karsinom teşhisi konmuş, hayvanlardan birinde skuamöz hücreli karsinom ve karsinom in situ görülmüştür. Hastalar kloro-alüminyum sülfonatlı ftalosiyanin (CASPc, 1 mg/kg) ve 50-150 J/cm2 ışınlama ile tedavi edildi [113]. PDT’den önce 1,5 cm’den fazla olan tümörler cerrahi olarak seyreltildi. İlk üç hayvanda ödem oluştuğu için, çoğu hayvanın lazer ışınlamasından önce yaklaşık 10 dakika boyunca intravenöz infüzyon yoluyla deksametazon sodyum fosfat uygulandı. Planum nazal lezyonu olan iki kedi tam yanıt gösterdi ve alın lezyonu olan bir kedi nüksetti. Terapötik yanıtlar değişkendi, ancak önemli bir sistemik toksisite veya deri fotosensitizasyonu bildirilmedi [113]. CASPc tabanlı PDT’den üç ay sonra 15 kedideki skuamöz hücreli karsinom lezyonları takip edilmiştir. 3/15 kedide yanıt yoktu, 2/15 kedide kısmi yanıt (%50 azalma) vardı, 10/15 kedide tam yanıt vardı ve 2/15 kedide tam bir ilk yanıtın ardından nüks vardı [83]. Akışkanlıkta artış olmasının ileri skuamöz hücreli karsinom remisyon süresini iyileştirip iyileştirmeyeceğini belirlemek için 100 ve 200 J/cm2 ile aktive edilen CASPc kullanılmıştır. On kedi arasında, 100 J/cm2 ile tedavi edilen neoplazmlar, 151 ila 1057 günlük remisyona sahip olan 200 J/cm2 ile tedavi edilenlere kıyasla 0 ila 619 günlük neoplazmlardan arınmış daha düşük bir remisyon süresine sahipti [114]. Skuamöz hücreli karsinomlu altı köpeğe çinko ftalosiyanin tetrasülfonat (ZnPcS4) uygulandı. Işınlama 100 J/cm2 hızında diyot lazer ile gerçekleştirilmiştir. PDT iyi tolere edilmiş, toksisite belirtisi görülmemiş ve kısmi veya tam tümör yanıtı elde edilmiştir [84]. Meta-(tetra hidroksifenil) klorun (m-THPC) lipozomal formülasyonu, kutanöz skuamöz hücreli karsinomlu 18 kedide denenmiştir. Hastaların %15’inde hafif eritem gözlenirken, tüm hastalar tamamen yanıt vermiştir. Bununla birlikte, tümör nüks oranı %20 ve ortalama nüks süresi 172,25 (±87,1) gün olmuştur [93]. Aynı formülasyon baş ve boyundaki 63 tümörden etkilenen 38 kediye uygulanmıştır. İnvaziv tümörleri olan hastalar altı aya kadar ilerlemiştir. Genel yanıt oranı %84 (%61’inde tam remisyon ve %22’sinde kısmi remisyon), ortalama serbest hastalık aralığı 35 ay ve ortalama genel sağkalım süresi 40 ay olmuştur. Tümör yerleşiminin yanıtı etkilemediği, ancak daha büyük tümörlerin daha az yanıt verdiği görülmüştür [18]. mTHPC’nin lipozomal ve lipofilik formülasyonu skuamöz hücreli karsinomlu kedigillerde araştırılmıştır. Tümördeki biyoyararlanım, lipozomal formülasyon ile 2 ila 4 kat daha yüksekti. Tüm kediler her iki formülasyonla da tedaviye yanıt vermiştir [115]. Kedilerdeki skuamöz hücreli karsinomlarda FDT’nin vasküler etkileri power Doppler ultrasonografi ile araştırılmıştır. Lipozomal ve lipofilik mTHPC fotosensitizerler intravenöz olarak uygulanmış ve bir diyot lazer (652 nm) ile ışınlanmıştır. FDT sırasında vaskülarite ve kan hacminde belirgin bir azalma kaydedilmiştir. En düşük değerler FDT’den 24 saat sonra tespit edilmiştir [116]. Fotosensitizer akridin turuncusu (AO) ile FDT, üç adenokarsinom, bir transizyonel karsinom ve bir diferansiye olmamış karsinom olmak üzere intranazal tümörü olan beş köpeği içeren bir pilot çalışmada kullanılmıştır [117]. İntranazal karsinomlu on dört köpek çalışmanın devamlılığına dahil edilmiştir. Fotosensitizer, solüsyona (1 µg/mL) batırılmış bir gazlı bezin beş dakika süreyle yerleştirilmesi yoluyla tümör yatağına uygulanmıştır. İrradyasyon 400 ila 700 nm arasında ksenon ışığı ile gerçekleşmiştir. Tedavi sonrası ortalama progresyonsuz ve genel sağkalım süresi sırasıyla 13 ve 22 ay olmuştur [118]. Retrospektif çalışmada, intranazal köpek tümörlerinin tedavisinde diğer tedavilerle (cerrahi, kemoterapi ve radyoterapi) ilişkili FDT’nin etkileri değerlendirilmiştir. Genel sonuçlar, köpeklerin %54’ünde nüks görüldüğünü ve AO-PDT’den sonra hastalıksız progresyonun ortalama aralığının 12 ay olduğunu göstermiştir. Nüks vakaları yeniden tedavi edildi. Yeniden AO-PDT’den sonra, köpeklerde ortalama 27 aylık bir genel nüks görülürken, hiyofraksiyone radyoterapiye tabi tutulan köpeklerde ortalama 14 aylık bir nüks görüldü. Yan etkiler hafiftir ve subkutan amfizem ve rinit şeklindedir [60]. Karsinomları tedavi etmek için kullanılan PDT protokolleri Tablo 1’de sunulmuştur. |

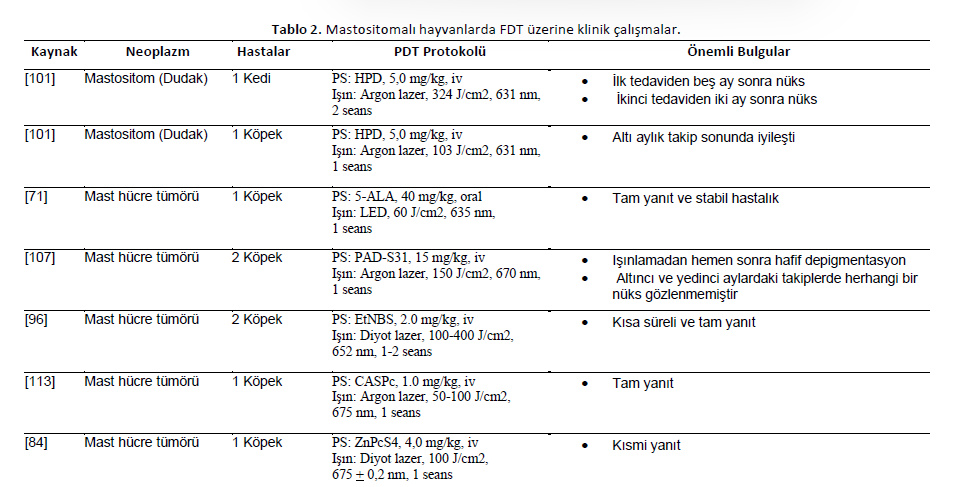
| Mastositomlar Neoplastik mast hücrelerinin proliferasyonu, sıklıkla deriyi ve daha nadiren sistemik organları etkileyen mast hücre tümörlerini karakterize eder. Dudak mastositoması olan bir kedi HPD tabanlı PDT’ye tabi tutulmuştur. İlk tedaviden sonra, on gün içinde tam tümör yanıtı ve 15-25 gün içinde tamamen yeniden epitelizasyon görüldü. Beş ay sonra nüks görüldü. İkinci bir tedavi uygulandı ve iki ay sonra nüks meydana geldi [101]. Aynı çalışmada, dudak mastositoması olan bir köpek cerrahi eksizyondan sonra FDT’ye tabi tutulmuştur. Hayvan altı aylık bir süre boyunca hastalıksız olarak kabul edilmiştir [101]. Kutanöz mast hücre tümörü olan bir köpeğe oral yoldan 5-ALA (40 mg/kg) verildi. LED ışığı (60 J/cm2) ile ışınlama yapıldı. Tam yanıt rapor edildi ve hastalık stabil kabul edildi [71]. PAD-S31, kutanöz mast hücre tümörü olan iki köpekte kullanılmıştır. Işınlama bölgesi lazer ışınlamasından hemen sonra hafif depigmentasyon gösterdi. Tedaviden iki gün sonra, yüzeyinde aşamalı olarak bir yara izi oluşmuş, ancak yedinci ila onuncu gün arasında boyut olarak %50’ye düşmüştür. PDT uygulanan tümörlerde altıncı ve yedinci aylardaki takiplerde lokal nüks gözlenmemiştir [107]. Göz neoplazmı olan iki köpekte subkonjonktival mast hücre tümörü ve göz kapağı mast hücre tümörü için fotosensitizer EtNBS intravenöz olarak (2.0 mg/kg) uygulandı. FDT sırasıyla 100 ve 400 J/cm2 ile tamamlanmıştır. Subkonjonktival mast hücre tümörü olan köpek tedaviye kısa bir süre yanıt verdi. Göz kapağı mast hücresi tümörü olan köpek tam yanıt verdi ancak dört ay boyunca diğer bölgelerdeki iki kutanöz mast hücresi tümörü için kemoterapiye başladı; bu nedenle, PDT etkinliğini tespit etmek zordu [96]. Ciltte sağ yan, deri altı servikal ve submandibular bölgeden etkilenen bir köpek CASPc tabanlı PDT’ye tabi tutulmuştur. Sağ yan tümör PDT’den önce cerrahi olarak küçültülmüş ve 1 cm’den küçük bir lezyon olarak kalmıştır. Tüm yaralanmalarda tam yanıt rapor edilmiştir [113]. Diş etinde mast hücre tümörü olan bir faz I klinik çalışma, ZnPcS4 (4 mg/kg) tabanlı PDT’den sonra kısmi yanıt göstermiştir [84]. Mastositomaları tedavi etmek için kullanılan PDT protokolleri Tablo 2’de sunulmuştur. |
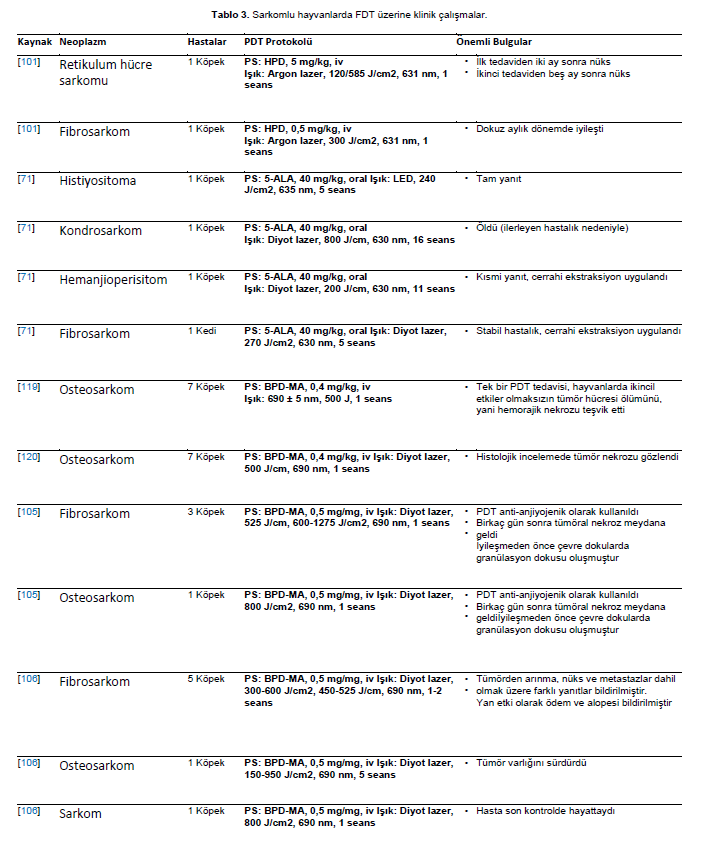
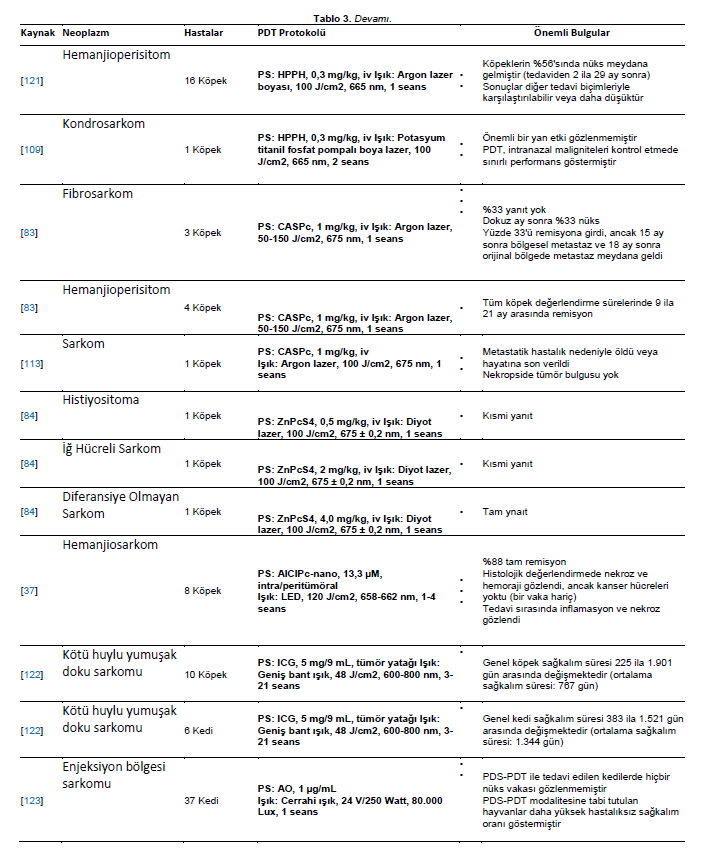
| Sarkomalar Sarkomlar kas, kemik, kıkırdak ve mezodermal kökenli diğer dokuları etkileyebilir. Sarkomlu iki köpek (bir dudak retikulum hücre sarkomu ve bir dişeti fibrosarkomu) HPD tabanlı FDT’ye tabi tutulmuştur. Retikulum hücreli sarkomlu hastaya PDT ile iki tedavi uygulandı; nüks ilk tedaviden iki ay sonra ve ikinci tedaviden beş ay sonra meydana geldi. Fibrosarkomlu köpekte dokuz aylık takip süresince hastalık görülmemiştir [101]. |
| Histiyositoma, kondrosarkom, hemanjiyoperisitoma tanısı konulan üç köpek ve fibrosarkomlu bir kedi 5-ALA bazlı FDT’ye tabi tutulmuştur. Fotosensitizer, diyot lazer veya LED ışınlamasından 4 saat önce 40 mg/kg dozunda uygulanmıştır. Işık akıları histiyositom için 240 J/cm2, kondrosarkom için 800 J/cm2, hemanjioperisitom için 200 J/cm2 ve fibrosarkom için 270 J/cm2 olmak üzere değişiklik göstermiştir. Kediye ayrıca cerrahi tedavi uygulanmış ve hastalığı stabil kalmıştır. Hemanjioperisitomlu köpek kısmi yanıt göstermiş ve cerrahi olarak çıkarılmıştır. Histiyositomlu köpek tam yanıt vermiş ve kondrosarkomlu köpek ilerleyen hastalık nedeniyle ölmüştür [71]. BPD-MA bazlı FDT’nin tek bir tedavisinin etkinliği, köpeklerde primer osteosarkom için terapötik bir seçenek olarak değerlendirilmiştir. Böylece, yedi köpeğe intravenöz olarak BPD-MA enjekte edilmiş, daha sonra 500 J akıcılıkta ve 200 mW/cm hızında lazer ışığı verilmiştir. PDT’den kırk sekiz saat sonra, manyetik rezonans görüntüleme (MRI) PDT’nin yan etki kanıtı olmaksızın tüm tümörlerde hemorajik nekroza neden olduğunu göstermiştir [119]. Osteosarkomdan etkilenen yedi köpek, PDT’nin büyük osseöz tümörlerde nekrozu indükleme yeteneğini araştırmak için BPD-MA tabanlı PDT ile pilot bir çalışmaya tabi tutulmuştur. Fotosensitizer intravenöz olarak uygulanmış ve 500 J/cm’lik toplam ışık dozuyla aktive edilmiştir. Hayvanlar tedaviden 48 saat sonra amputasyona tabi tutuldu. PDT, tedavi edilen tüm osteosarkomlarda nekroza neden olmuştur [120]. Fibrosarkomlu üç köpek ve osteosarkomlu bir köpek BPD-MA ile PDT’ye tabi tutulmamıştır. Tümör renk değişiklikleri ve tümör nekrozu gözlenmiştir [105]. Antivasküler PDT hedeflenerek, oral (dört fibrosarkom, bir osteosarkom, bir sarkom) ve nazal (bir fibrosarkom) sarkomlar BPD-MA tabanlı PDT ile tedavi edilmiştir. Oral ve nazal tümörlü köpekler için 1 yıllık genel sağkalım sırasıyla %71 ve %57 olmuştur [106]. HPPH tabanlı PDT, hemanjioperisitomlu 16 köpekte adjuvan tedavi olarak kullanılmıştır. Tedavi edilen 16 hayvanın çoğu nüksetmiştir (%56) [121]. HPPH ile PDT, intranazal kondrosarkomlu bir köpekte gerçekleştirilmiştir. Sağ ve sol nazal pasajlar PDT ile tedavi edilmiştir. İkinci bir PDT tedavisi uygulanmış; ancak köpek ilerleyen hastalık nedeniyle iki hafta sonra ötenazi edilmiştir [109]. CASPc tabanlı PDT, fibrosarkomlu üç ve hemanjiyoperisitomlu dört köpeğe uygulanmıştır. Fibrosarkomlu üç hayvandan birinde yanıt alınamamış, birinde dokuz ay sonra nüks görülmüş, diğerinde ise 15 ay içinde bölgesel metastaz ve 18 aylık tedaviden sonra nüks görülmüştür [83]. Hemanjioperisitom hastalarında kitleler cerrahi olarak çıkarılmış ve yedi gün sonra FDT uygulanmıştır. Ortalama 9 ila 21 aylık bir remisyon süresi (ortalama 15,25) gözlenmiştir [83]. Aynı yaklaşım, cerrahi ve adjuvan tedavi başarısızlığından sonra karın duvarında farklılaşmamış sarkomu olan bir köpeğe de uygulanmıştır. Ancak hasta metastatik hastalık nedeniyle kaybedilmiştir [113]. ZnPcS4 kullanılarak yapılan PDT, dirsekte malign fibröz histiyositoma, karpusta iğsi hücreli sarkom ve intranazal diferansiye olmamış sarkomu olan bir köpeğe uygulanmıştır. Dirsek ve karpusta lezyonları olan iki hayvan tedaviye kısmen yanıt vermiştir. Bununla birlikte, intranazal sarkomlu hasta tam yanıt vermiştir [84]. İntra ve peritümöral olarak uygulanan bir alüminyum-klorür-ftalosiyanin nanoemülsiyonu (AlClPc-nano) kullanılarak, kutanöz hemanjiyosarkomlu sekiz köpekte PDT uygulandı. İki ila dört PDT seansı her yedi günde bir tekrarlandı. Sekiz vakanın yedisinde neoplazide tam remisyon görüldü. Eksizyonel biyopsilerin mikroskobik analizinde nekroz ve hemoraji görüldü, bir vaka dışında kanser hücresi yoktu. Tedavi edilen bölgelerde makroskopik olarak inflamasyon ve nekroz gözlenmiştir [37]. Malign yumuşak doku sarkomu olan on köpek ve altı kedi kombine bir tedavi yaklaşımına tabi tutulmuştur. Tedavi, cerrahi rezeksiyonu takiben hipertermi ve indosiyanin yeşili (ICG) bazlı PDT, geniş bant ışıkla ışınlama ve kemoterapiden oluşuyordu. Hiçbir ciddi yan etki bildirilmemiştir. Yedi köpek ve üç kedide nüks görülmemiştir [122]. Kedi enjeksiyon bölgesi sarkomu (FISS) nüksünü önlemek için yeni yöntem olarak fotodinamik cerrahi (PDS) ve AO kullanılarak FDT kombinasyonu araştırılmıştır. Bu çalışmaya FISS’li otuz yedi kedi dahil edilmiştir. Yedi kediye FDT uygulandı, cerrahi alana AO uygulandı ve ardından 10 dakika boyunca görünür ışıkla ışınlandı. Bulgular, son takipte, PDS-PDT ile tedavi edilen yedi kediden beşinde nüks ve/veya metastatik hastalık olmadığını ortaya koymuştur. Bu kombine tedavi, PDS ile tedavi edilen kedilere kıyasla daha yüksek hastalıksız sağkalım oranı ile ilişkilendirilmiştir. PDS-PDT ile tedavi edilen iki kediye, tedaviyle ilişkili olmayan diğer sağlık sorunları nedeniyle takip sırasında ötenazi uygulanmıştır. Bununla birlikte, bu hayvanların hiçbirinde ölüm sırasında nüks görülmemiştir. Bu sonuçlar, FISS nüksünü önlemek için PDT’nin etkili bir adjuvan terapötik yöntem olabileceğini göstermiştir [123]. Fotodinamik eşiği belirlemek için yumuşak doku optik özellikleri değerlendirilmiştir. Üç fotosensitizör (porfimer sodyum, AlClPc ve SnET2) için eşik dozu spontan tümörlü köpeklerde değerlendirilmiştir. AlClPc, porfimer sodyum ve SnET2’ye göre daha fazla foton emilimine ihtiyaç duyarak en yüksek eşik değerini vermiştir [124]. Sarkomları tedavi etmek için kullanılan PDT protokolleri Tablo 3’te sunulmuştur. |
| Melanomlar Melanomlar melanositlerden veya melanositlerden veya melanoblastlardan gelişen diğer neoplastik hücrelerden kaynaklanır [15]. Köpek ve kedilerde primer melanomlar ağız boşluğu, tırnak dibi, pati yastığı, burun boşluğu, anal kese, mukokutanöz bileşke veya gözlerde ortaya çıkabilir [41]. HPD, sert damak melanomu olan bir köpeğe intravenöz enjeksiyon (2,5 mg/kg) yoluyla verilmiştir. İkinci seanstan sonra %60’ın üzerinde anlamlı bir azalma elde edilmiştir. Işınlama 528-960 J/cm2 (631 nm) argon lazer ile gerçekleştirilmiştir [79]. |

| Fotosensitizer EtNBS, gözünde skleral melanom bulunan bir köpeğe intravenöz olarak (2,0 mg/kg) uygulanmıştır. PDT 100 ila 200 J/cm2 ile tamamlanmıştır. Ne yazık ki tümör tedaviye yanıt vermedi [96]. Yumuşak damakta melanomu olan bir köpek, ZnPcS4 bazlı PDT’den sonra tam yanıt verdi. PDT protokolü, 0,25 mg/kg fotosensitizer uygulanması ve 100 J/cm2 (675 ± 0,2 nm) ile ışınlamadan oluşmaktaydı [84]. Göz kapağında melanom bulunan ve dört ameliyattan sonra nüks öyküsü olan bir kediye (9 yaşında) intraoperatif FDT ile ilişkili yeni bir cerrahi rezeksiyon uygulandı. Tümör yatağını 5 dakika boyunca doldurmak için AO kullanıldı. Işınlama 400-700 nm lamba ve 20.7 mW/cm2 akıcılık ile 10 dakika sürdü. Takip sırasında FDT’nin ameliyat bölgesinde herhangi bir yan etkisi görülmedi. Tümör nüksü 16 aya kadar tespit edilmemiştir [125]. Melanomları tedavi etmek için kullanılan PDT protokolleri Tablo 4’te sunulmuştur. |

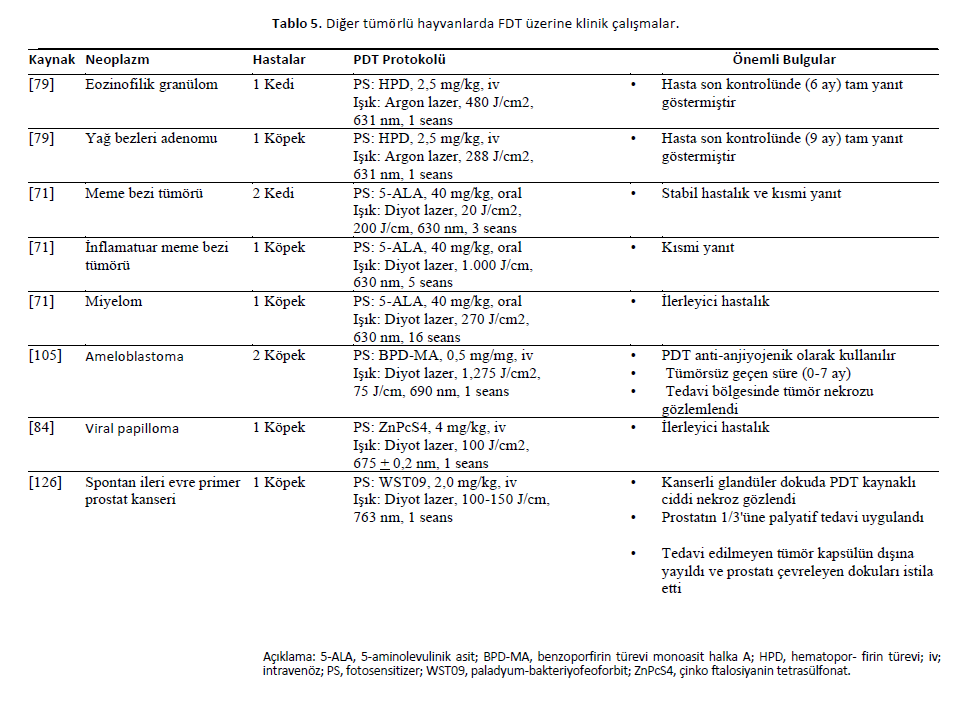
| Diğer Tümörler Diğer tümör tipleri ve ele alınan tümörlerin histolojik tipi konusunda net olmayan bazı raporlar bu bölüme dahil edilmiştir. HPD (2,5 mg/kg) bir kedinin dudak eozinofilik granülomunu tedavi etmek için kullanılmıştır. Tam terapötik yanıt alınmış, hayvan 6 aylık takibe kadar tam yanıt göstermiş ve sekiz ay sonra iyileşmiş sayılmıştır. |
| Aynı çalışmada, kulakta yağ bezleri adenomu olan bir köpeğe de tedavi uygulanmıştır. Bu vakada tam yanıt elde edilmiştir. Işınlama 288 J/cm2 (631 nm) Argon lazer ile gerçekleştirilmiştir [79]. Kedi ve köpeklerdeki meme bezi tümörleri 5-ALA bazlı PDT’ye tabi tutulmuştur. İki kedi kısmi yanıt ve stabil hastalık göstermiştir [71]. Lapatinib ile kombinasyon halinde tedavi edilen bir köpekte hastalık ilerlemiştir [71]. Melfalan ile eşzamanlı tedavi uygulanan miyelomlu bir köpekte de ilerleyici hastalık gözlenmiştir [71]. Ameloblastomlu iki köpek BPD-MA ile tedavi edilmiş ve PDT ile tedavi edilen hayvanlarda birkaç gün sonra tümör renginde bir değişiklik ve tümör nekrozu gözlenmiştir. Ayrıca, 7 aya kadar tümörsüz bir aralık gözlenmiş ve potansiyel bir anti-anjiyojenik etki ortaya çıkmıştır [105]. ZnPcS4, ağız ve vulvada viral papillomu olan bir köpekte kullanılmış ve FDT’ye kısmi yanıt ve nedeni bilinmeyen nötropeni göstermiştir [84]. Spontan ilerlemiş primer prostat kanseri olan bir köpek ameliyat ve palladyum-bakteriyofeoforbit (Tookad, WST09, 2 mg/kg, iv) ile FDT için hazırlanmıştır. Işık (diyot lazer, 763 nm) 100-150 J/cm toplam ışık dozuna uygulandı. Köpek cerrahi sonrası ve PDT prosedürlerinden bir hafta sonra hayatta kaldı. Değişiklikler nekrozu ve kısmen tedavi edilen alandaki kanserli nodüllerde %25 hacim azalmasını içeriyordu [126]. Diğer veteriner neoplazmlarını tedavi etmek için kullanılan PDT protokolleri Tablo 5’te sunulmuştur. |
Preklinik ÇalışmalarBu bölümde PDT’nin in vivo ve in vitro çalışmalarda kullanımı Şekil 5’te gösterildiği gibi özetlenmiştir. |
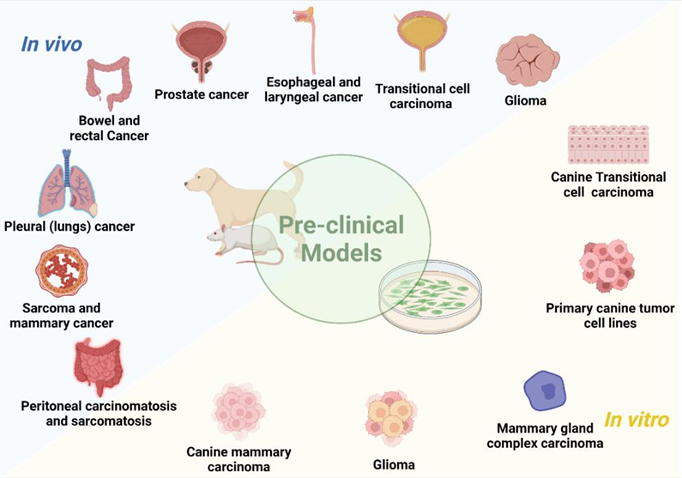
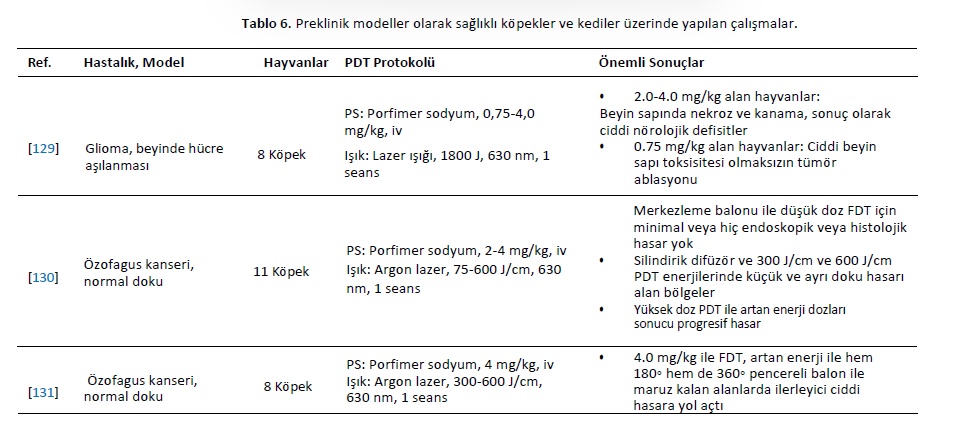
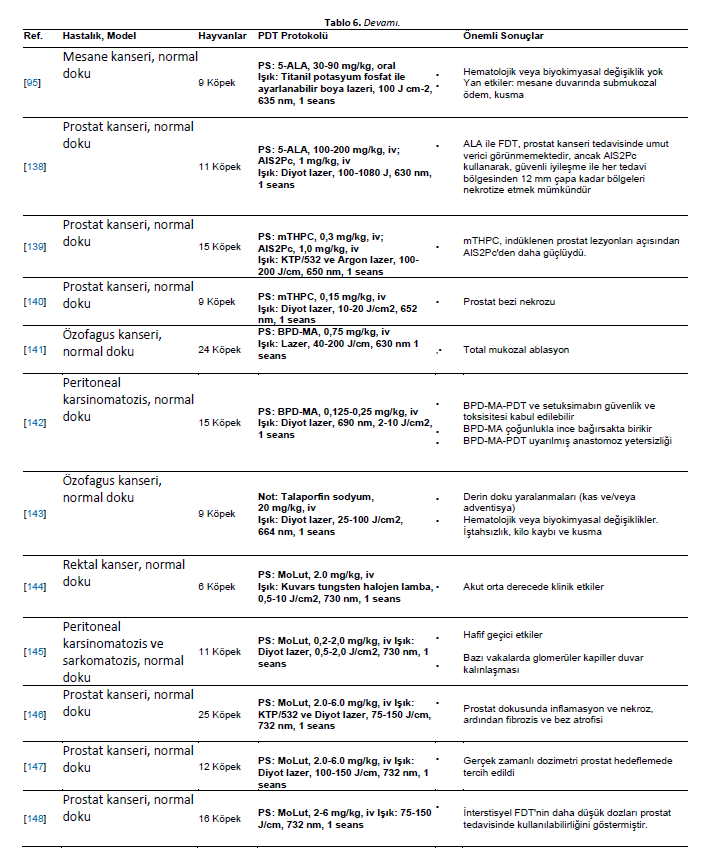
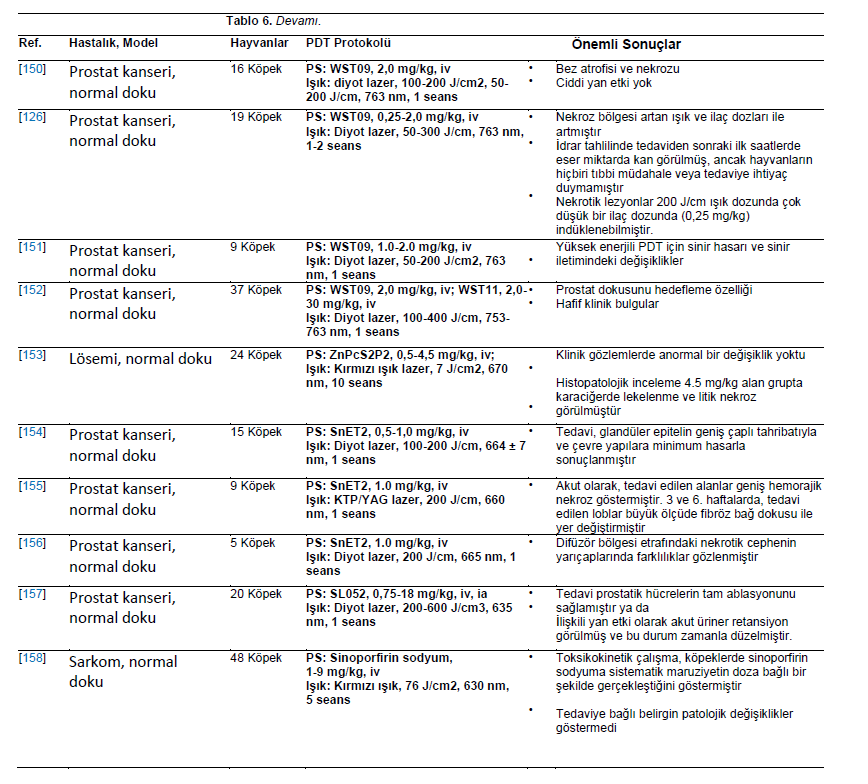
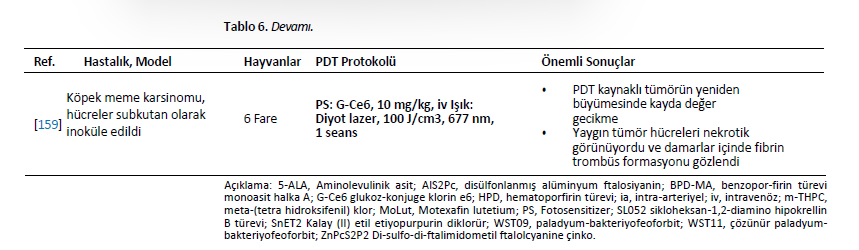
| İn Vivo Çalışmalar Yapılan klinik çalışmalara rağmen, köpekler ve kediler de hayvan modelleri olarak araştırmalarda kullanılmıştır. Küçük hayvanların dokularının ve neoplazmlarının insanlara klinik ve histopatolojik benzerliği, onları veteriner ve tıp alanındaki tedavileri incelemek için uygun modeller haline getirmektedir. Araştırmacılar, insan tıbbında [24,34,35,74,127,128] ve veteriner onkolojisinde uygulanabilecek ve klinik kullanıma uyarlanabilecek fotosensitizerler geliştirmeye kendilerini adamışlardır. Bu bölümde PDT’nin preklinik model olarak kullanılan sağlıklı hayvanlara uygulandığı çalışmalar ele alınmaktadır. Porfimer sodyum, glioma hücrelerinin beyne cerrahi implantasyonu ile elde edilen bir köpek glioma hayvan modelinde incelenmiştir. Hayvanlar fotosensitizörü intravenöz olarak almış ve 630 nm’de lazerle ışınlanmıştır. Tümör hücresi alımı normal beyin dokusundan dört kat daha fazla olmasına rağmen, şiddetli yan etkiler daha yüksek dozlarla ilişkilendirilmiştir. Bununla birlikte, daha düşük dozda (0,75 mg/kg) fotosensitizer, kalıcı beyin toksisitesi olmaksızın tümörü ortadan kaldırabilmiştir [129]. Özofagus kanserinin FDT’si için merkezleme balonunun geliştirilmesi üzerine bir köpek modelinde çalışılmıştır. PDT porfimer sodyum bazlı gerçekleştirilmiştir. Merkezleme balonu, artan fotosensitizer konsantrasyonu ve ışık enerjisi hasarın artmasına neden olduğundan, doza ve enerjiye bağlı bir şekilde normal özofagusta asgari hasara yol açmıştır [130]. Bununla birlikte, 180◦ pencereli özofagus balonuyla 600 J/cm’ye maruz kalındığında ışınlanmış alanlar ciddi şekilde hasar görmüştür [131]. 360◦ pencereli balonun boyutsal etkisi de bir köpek özofagus modelinde değerlendirilmiştir. Balon boyutunun artırılmasıyla PDT kaynaklı lezyonlar azalmıştır [132]. Sürekli dalga ve pulslu lazer ışığını karşılaştırmak için normal köpek özofagusundan da yararlanılmıştır. Hem pulslu hem de sürekli dalga lazerler proksimal ve distal bölgelerde kullanılmıştır. Lazer tipine bakılmaksızın, mukozal ülserasyon, akut enflamasyon, serozal ödem, ödem, hemoraji ve enflamasyonla birlikte vasküler dejenerasyon gözlenmiştir. Lezyonların kaba ve histolojik incelemesine dayanarak, sürekli ve darbeli lazer kaynaklı yaralanmalar ayırt edilememiştir [81]. Ardışık porfimer sodyum bazlı PDT seanslarının 13 köpekte güvenli olduğu gösterilmiştir. Bladder Çoğu vakada mesane kapasitesi tamamen iyileşmiştir. Ancak, ikinci seanstan sonra kalıcı mesane kapasitesi kaybı gözlenmiştir. Histopatolojik analiz, üç tedavi uygulanan bir köpekte yüzeysel fokal kas hasarı olduğunu ortaya koymuştur [133]. On beş köpek, torasik doku toleransını araştırmak için intratorasik HPD tabanlı PDT’ye tabi tutulmuştur. Fotosensitizer uygulamasının ardından hayvanlara torakotomi ve kırmızı ışık ışınlaması (5 ila 40 J/cm2) uygulandı. FDT’den bir hafta sonra, akciğerdeki hemorajik lezyonların uzantısı artan ışık akıcılığı oranıyla birlikte yükselmiştir. Daha yüksek ışık dozları kalp ve diyaframda yüzeysel hemorajik lezyonlara neden olmuştur. Altı ay sonra, akciğerlerde tam iyileşme sağlandı ve kalp ve diyaframda fibrotik plaklar gözlendi. En az etkilenen doku göğüs duvarı olmuştur [134]. FDT’nin malign tümörler ve normal dokular üzerindeki etkilerini araştırmak için bir köpek transmissible sarkom modeli kullanılmıştır. Tümörler köpek transmissible sarkom hücrelerinin subkutan implantasyonu yoluyla geliştirilmiştir. Tümör gelişiminden sonra (35 mm çapında), hayvanlara intravenöz olarak HPD (5 mg/kg) verildi. Işınlama 630 nm’de excimer boya lazer ile gerçekleştirilmiştir. Tümör nekrozunun ortalama çapı, toplam ışınlama enerjisindeki artışa paralel olarak hızla artmış ve yan etki olarak deri dokusu derin açık ülser göstermiştir [135]. In Larenks kanseri için bir hayvan modelinde, 11 köpeğe ameliyattan üç saat önce 3 mg/kg HPD verilmiştir. Ardından, eş zamanlı ve seri sıcaklık ölçümleri ile argon lazer (10 ila 150 J/cm2 630 nm) aracılığıyla değişen ışınlama miktarları verilmiştir. Beklendiği gibi, nihai sıcaklık verilen toplam enerjiyle orantılıydı [136]. Yedi köpeğe intravenöz olarak 2 mg/kg HPD verilmiştir. 24 saat sonra, 450 J/cm 630 nm dalga boyunda lazer ışığı prostata interstisyel olarak verildi. HPD kullanılarak köpek prostatında interstisyel FDT mütevazı hacimlerde doku nekrozu yaratmıştır [137]. 5-ALA dokuz sağlıklı köpekte alt üriner sistemin transizyonel hücre karsinomunu modellemek için kullanılmıştır [95]. Bileşiğin uygulanmasından sonra köpeklerin %70’inde kusma rapor edilmiş ve ultrason ile submukozal mesane duvarı ödemi tespit edilmiştir. Ancak, hematolojik veya biyokimyasal değişiklikler gözlenmemiştir [95]. 5-ALA ve disülfonatlı alüminyum ftalosiyanin (AlS2Pc) normal köpek prostatında çalışılmıştır. PDT, transrektal ultrason kılavuzluğunda yerleştirilen fiberler aracılığıyla interstisyel olarak 100 mW (100 J) gücünde kırmızı ışın uygulanarak gerçekleştirilmiştir. AlS2Pc’nin pik seviyeleri 5-24 saat ve ALA için 3 saatte ortaya çıkmıştır. Makroskopik PDT lezyonlarının çapı AlS2Pc ile 12 mm’ye kadar çıkarken ALA ile sadece 1-2 mm olmuştur. 300 mW (1080 J) ışık termal hasara neden olmuştur. 28 günde, hasarlı bezler atrofik kaldı, ancak interlobüler destekleyici stroma iyi korunmuştu. Üretral lezyonlar 28 gün içinde fonksiyonel bozulma olmadan iyileşmiştir [138]. mTHPC ve AlS2Pc tabanlı PDT’ye maruz bırakılan köpek prostatının biyolojik yanıtları, klinik çalışmalar için ön hazırlık amacıyla araştırılmıştır. mTHPC ve AlS2Pc ile PDT, büyük miktarda prostat dokusunu nekroze etmek için güvenli ve umut vericidir. Prostat PDT’sinin deney hayvanları tarafından iyi tolere edildiğini lütfen unutmayın [139]. mTHPC, ışık dozimetrisini araştırmak için köpeklere uygulanmıştır. Işın enerjisi doz-yanıt ilişkisi elde edileceği öngörülmüş ve prostat bezi nekrozunu indükleyen eşik değer 20 ila 30 J/cm2 çıkmıştır [140]. BPD-MA, köpek özofagus mukozasını etkili bir şekilde ablate etmek için gereken ışın miktarını ortaya çıkarmak amacıyla 24 sağlıklı köpeğe uygulanmıştır. İlaç enjeksiyonundan 15, 30, 60 ve 120 dakika sonra sırasıyla 60, 80, 145 ve 200 J/cm’lik ışın dozlarında arzu edilen sonuçlar elde edilmiştir [141]. PDT’nin bir epidermal büyüme faktörü reseptörü (EGFR) inhibitörü olan setuksimab ile birleştirilmesinin güvenliği bir köpek modelinde değerlendirilmiştir. Köpekler BPD-MA, ince bağırsak rezeksiyonu ve setuksimab temelinde farklı doz seviyelerinde intraperitoneal PDT’ye tabi tutulmuştur. Sonuçlar, köpeklerin akut veya ciddi yan etkiler gösterdiğini, bağırsak rezeksiyonu ve setuksimab olsun veya olmasın, deneyimlenen ışık dozuyla ilişkili kabul edilebilir güvenlik ve toksisite sergilediğini göstermiştir. En yüksek fotosensitizer konsantrasyonu ince bağırsakta bulunmuştur, bu da gözlenen anastomoz başarısızlığını açıklayabilir [142]. Köpeklerin normal dokusuna verilen zararı değerlendirmeyi amaçlayan bir çalışmada talaporfin sodyumun hedefi özofagus bölgesi olmuştur. 5 cm’lik alanlar 25, 50 ve 100 J/cm2 dozlarında ışınlanmıştır. Doku hasarı kas tabakasında veya daha derinlerde görülmüş ve radyasyon arttıkça daha şiddetli hale gelmiştir. Histolojik incelemede 100 J/cm2 dozunda nekroz ve ekstra-adventif inflamasyon tespit edilmiştir. Bununla birlikte, 25 J/cm2 dozunda ışınlama küçük doku lezyonları ile güvenli görünmektedir [143]. Moteksafin lutesyum altı köpekte preoperatif olarak çalışılmıştır. Köpeklere rektum 730 nm’de 0,5 ila 10 J/cm2 ile ışınlandı. Tüm köpekler sorunsuz bir şekilde iyileşmiştir. Önemli toksisite veya histolojik sekel oluşturmadan rektum ve pelvis yan duvarına belirgin ışık penetrasyonu açığa çıkmıştır [144]. Bu fotosensitizer ayrıca 11 köpekte intraperitoneal moteksafin lutesyum bazlı PDT için deneysel bir tedavi olarak kullanılmış, normal dokuların toksisitesi değerlendirilmiş ve peritoneal karsinomatozis ve sarkomatozis tedavisine yönelik uygulamalar hedeflenmiştir. Karaciğer fonksiyon testlerinde hafif geçici anormallikler gözlenmiş ve böbrek fonksiyonlarında herhangi bir anormallik bulunmamıştır. Laparoskopi veya nekropside FDT ile ilişkili ciddi anormallikler gözlenmemiştir; ancak yedi köpeğin böbreklerinde mikroskobik olarak glomerüler kapiller duvar ve mezangiumda kalınlaşma gözlenmiştir [145]. Köpek prostat tedavisinin canlılığını ve moteksafin lutesyumun toksisitesini belirlemek için, 25 köpeğe intravenöz olarak (2 veya 6 mg/kg) uygulandı ve 732 nm lazer ışığı (75-150 J/cm) ile ışınlandı. Işın, silindirik difüzör lifler aracılığıyla prostata transüretral olarak interstisyel olarak iletilmiştir. İnterstisyel FDT, başlangıçta inflamasyon ve nekroz, ardından fibroz ve glandüler epitelyal atrofi ile minör toksisite ile sonuçlanmıştır [146]. Başka bir çalışmada, normal köpek prostatında kullanılan izotropik interstisyel dedektörler, tek bir tedavi bölgesinde moteksafin lutesyum bazlı PDT öncesinde, sırasında ve sonrasında önemli bir değişiklik gözlemlememiştir; bu da tedavi sırasında ışık akışlarını takip etmek için gerçek zamanlı dozimetrik ölçüm ve sistem geri bildirimi yapılmasını zorunlu kılmaktadır [147]. Moteksafin lutesyum bazlı PDT başka bir grup köpek prostat modelinde araştırılmıştır. Prostat kanseri için interstisyel fotodinamik tedavinin fizibilitesi köpeklerde araştırılmıştır. Köpekler 6 mg/kg moteksafin lutesyum ile tedavi edilmiş ve farklı ışık dozları (75-150 J/cm) ile ışınlanmıştır. Çalışma, prostatın güvenli ve kapsamlı bir şekilde tedavi edildiğini göstermektedir. Bununla birlikte, doz dağılımında ve prostat boyunca müteakip doku nekrozunda ciddi değişkenlik söz konusudur [148]. 5-ALA’nın protoporfirin IX’a (PpIX) dönüşümünü belirlemek için dört sağlıklı kediye intravenöz olarak 100, 200 veya 400 mg/kg uygulandı. Uygulamadan 24 saat sonra kan ve deri biyopsileri yapılmıştır. PpIX, epitelde en yüksek yoğunlukta olmak üzere analiz edilen dokularda tespit edilmiştir. Hepatotoksisite nedeniyle, 100 mg/kg’dan daha yüksek dozlar güvenli kabul edilmemiştir [149]. Normal köpek prostatı, WST09 (Tookad) bileşiğini incelemek için bir model olarak kullanılmıştır. Tüm hayvanlar üretral komplikasyon olmaksızın iyi bir şekilde iyileşmiştir. Histopatolojik incelemeler nekroz, hemoraji ve glandüler doku atrofisi göstermiştir [150]. WST09’a dayalı FDT’nin, daha düşük bir fotosensitizör konsantrasyonu ve düşük ışık enerjileriyle bile normal prostat dokusunu tahrip ettiği görülmüştür [126]. Bununla birlikte, WST09 ve 100 J/cm2 ile tedavi lokalize sinir hasarı ve sinir iletim hızlarında azalma ile sonuçlanmıştır. 200 J/cm2 ile tedavi safen sinire ciddi hasar vermiştir [151]. Prostat vasküler dokusunu hedeflemek için çözünür (WST11) ve çözünmez (WST09) Tookad’ın güvenliği ve etkinliği karşılaştırılmıştır. WST11 ile vasküler PDT avantajlıydı. Hafif üriner klinik belirtiler 24 ila 48 saat içinde düzelmiştir. Bağırsak intussusepsiyonu gelişen bir hayvan dışında tüm köpekler iyi bir şekilde iyileşmiştir [152]. ZnPcP2S2 (Di-sulfo-di-ftalimidometil ftalosiyanin çinko) bazlı PDT, normal mononükleer hücrelerdeki kalıntı lösemik hücreleri ortadan kaldırmak için yeni bir antikanser yöntemi olarak geliştirilmiştir. ZnPcP2S2’nin toksisitesi 24 köpekte 0,5, 1,5 ve 4,5 mg/kg dozlarında değerlendirilmiştir. Tüm hayvanların enjeksiyon bölgeleri 670 nm’de lazer ile ışınlanmıştır. Işınlamalar 48 ve 72 saat içinde, her dört günde bir, art arda on kez gerçekleştirilmiştir. Gözlemler disfori ve hafif ödem olarak rapor edilmiştir. Oftalmoskopi, elektrokardiyografi, hematoloji, kan biyokimyası veya idrar tahlilinde herhangi bir yan etki gözlenmemiştir [153]. SnET2 kullanılarak prostat dokusunun tahrip edilmesinin teknik fizibilitesi de 15 köpekte değerlendirilmiştir. Prostat ve komşu dokularda emilim ve biyodağılım değerlendirilmiştir. SnET2 0,5 veya 1,0 mg/kg konsantrasyonda intravenöz olarak uygulanmış, doku 100-200 J/cm ile ışınlanmış ve prostatik dokunun tahrip edilmesi sağlanmıştır [154]. Köpek prostatı da SnET2 ile transperineal interstisyel PDT’nin etkilerini belirlemek için deneylere tabi tutulmuştur. Tedavi edilen alanlar geniş hemorajik nekroz ve fibröz bağ dokusu ile yer değiştirme göstermiştir [155]. SnET2’nin köpek prostatı içindeki konsantrasyonunun heterojen olduğu bulunmuştur. Bu nedenle, bilgisayarlı modelleme fotosensitizerin düzensiz sekestrasyonunu ve bunun sonucunda prostatın asimetrik nekrozunu dikkate almalıdır. Aslında, PDT ile tedavi edilen hayvanlar difüzör bölgesi etrafındaki nekrotik cephede farklılıklar göstermiştir [156]. Fotosensitizer siklohekzan-1,2-diamino-hipokrellin B (SL052) köpek prostat modellerinde araştırılmıştır. SL052 lipozomlar içinde formüle edilmiş veya dimetil-sülfoksit içinde çözülmüş ve intravenöz olarak veya prostat arterleri yoluyla uygulanmıştır. Işınlama 635 nm’de lazer diyot ile gerçekleştirilmiştir. İntra-arteriyel yol daha kapsamlı fotoablasyona ulaşılmasını sağlamıştır. İlişkili yan etkiler arasında zamanla düzelen akut üriner retansiyon yer almıştır [157]. Sinoporfirin sodyum toksisitesi köpeklerde değerlendirilmiştir. Hayvanlar, beş hafta boyunca her yedi günde bir, 10 dakika süreyle 630 nm dalga boyunda lazerle deriye ışınlanmıştır. Herhangi bir ölüm bildirilmemiştir; ancak FDT uygulanan hayvanlarda ödem ve deri ülserasyonları görülmüştür. Kan pıhtılaşma süresi, splenomegali ve organ pigmentasyonunda da değişiklikler gözlenmiştir [158]. Murin modeli elde etmek için köpek meme karsinomu hücreleri (SNP) kullanılmıştır. Bunun için hücreler dişi farelere deri altından inoküle edilmiştir. Glikoz konjuge klorin e6 (G-Ce6, 10 mg/kg) kullanılarak yapılan PDT, 677 nm diyot lazer ile ışınlama yoluyla gerçekleştirilmiştir. Hem 5 dakika hem de 3 saatlik ilaç ışını aralığında tümörde yeniden büyümede belirgin bir gecikme gözlenmiştir. Bununla birlikte, daha kısa ilaç ışın aralığı en etkili olanıydı [159]. Klinik öncesi model olarak kullanılan sağlıklı hayvanlara PDT’nin uygulandığı çalışmalar Tablo 6’da sistematize edilmiştir. |
| İn Vitro Çalışmalar Hayvan modelleri insan ve veteriner onkoloji çalışmaları için uygun olsa da, başlangıçta fotosensitizer sonuçlarını değerlendirmek için hayvanların yerine in vitro testler kullanılmıştır. Bu çalışmalarda çoğunlukla hücre kültürleri, ışığa duyarlı hale getirici moleküller ve ışık kaynakları kullanılmıştır. Bu bölümde, köpek ve kedi kökenli hücreler kullanılarak yapılan in vitro çalışmalar anlatılmaktadır. Köpek glioma hücreleri klonlanmış ve fotosensitizer BPD-MA’ya tabi tutulmuştur. Karanlıkta üç saatlik inkübasyonun ardından hücreler bir LED ışığına (100 J/cm2) maruz bırakılmıştır. PDT’den yaklaşık 24 saat sonra, hücre canlılığı DNA’ya 3H-timidin katılımı yoluyla değerlendirilmiştir. 10 ve 4 ng/mL ile %50 büyüme inhibisyonu elde edilmiştir [160]. Hematoporfirin monometil eter köpek meme karsinomu hücre hatlarına uygulanmıştır [161-163]. Apoptoz, köpek meme karsinom hücrelerinin canlılığında PDT (20 mg/mL; He-Ne lazer, 2,8 J/cm2, 632,8 nm) tarafından indüklenen azalmada önemli bir rol oynamaktadır [161]. Tedavi mitokondriyal membran potansiyelinin kaybına yol açmıştır [162]. Ek olarak, sitoplazmik vakuol oluşumu ve hücrelerin kademeli olarak yuvarlanması gibi hücre morfolojisinde önemli değişiklikler, boyutta azalma ve ayrılma ile birlikte gözlenmiştir [163]. Lipozomlarda kapsüllenmiş alüminyum-klorür-ftalosiyanin, dişi köpek meme bezi karsinom hücrelerinin birincil kültüründe sitotoksisiteye neden olmuştur. Bununla birlikte, foto-duyarlılaştırıcı veya lazer ışınlaması tek başına sitotoksisiteye veya morfolojik değişikliklere neden olmamış ve PDT’nin (2,5 M; LED, 10 J/cm2, 660 ± 40 nm) güvenliğini ve etkinliğini göstermiştir [164]. Köpek meme karsinomu hücreleri farklı konsantrasyonlarda (0.16, 0.80, 4.0 ve 20 µM) maltotrioz-klorin e6 konjugatı (Mal3-TEG-Ce6) ile tedavi edilmiştir. Hücreler 5 J/cm2 671 nm kırmızı ışığa maruz bırakıldığında bu fotosensitizerin antitümör aktivitesinin son derece yüksek olduğu görülmüştür. Hücre canlılığı 0,16 µM kullanıldığında %50’ye kadar azalmıştır [165]. Köpek meme karsinomu SNP hücrelerinin canlılığı, NPe6 ve bu fotosensitizerin glukoz konjugatı ile FDT’den sonra değerlendirilmiştir. NPe6’nın 1, 5 ve 15 J/cm2 (650 nm) ışık dozlarına maruz kalan SNP hücrelerine karşı yarı-maksimum inhibitör konsantrasyonu (IC50) sırasıyla 75,2, 30,4 ve 30,6 µg/mL olmuştur. Glukoz konjugatı sırasıyla 33,4, 10,4 ve 1,7 µg/mL IC50 değerleri ile daha da etkili olmuştur [159]. 5-ALA-PDT’nin köpek meme bezi tümörlerinin çeşitli alt tiplerindeki etkinliğini değerlendirmek için, sırasıyla karsinom, sarkom ve karsinosarkom tanısı konan üç köpekten meme bezi kanseri hücreleri elde edilmiştir. Kanser hücreleri daha sonra çoğaltılmış ve 0,5 ve 1 mM 5-ALA ile tedavi edilmiştir. 5-ALA’yı sürekli dalga veya puls radyasyon yoluyla aktive etmek için 6 ila 24 J/cm2 arasında çeşitli ışık dozları kullanılmıştır. Hücre içi PpIX floresan zirvesine 4 saatlik 1 mM 5-ALA uygulamasından sonra ulaşılmıştır. 5-ALA’nın sitotoksik etkisi doza bağlıydı. Nitekim, 12 J/cm2 sürekli dalga ile muamele edilen karsinoma ve karsinosarkom hücreleri hücre canlılığı ve DNA hasarında önemli bir azalma göstermiştir. Bununla birlikte, 1 mM 5-ALA, ışık dozundan bağımsız olarak tüm köpek meme bezi tümör hücrelerinde apoptozu arttırmıştır [166]. Köpek geçiş hücreli karsinom hücreleri, K9TCC, 635 nm ışığa maruz bırakıldığında PpIX üretiminin ölümcül fototoksik etkilere neden olup olamayacağını belirlemek için seri 5-ALA konsantrasyonlarına maruz bırakıldı. Fotositotoksisite 5-ALA konsantrasyonuna ve maruz kalma süresine bağlıydı. Ayrıca, artan lazer güç yoğunluğu ve enerji yoğunluğu hücre sağkalımını azaltmıştır [87]. Dokuzu karsinomlardan ve altısı sarkomlardan oluşturulan on beş primer köpek tümör hücre hattı 5-ALA’ya (0.03, 0.1, 0.3 ve 1 mM) maruz bırakılmıştır. Sonuçlar 5-ALA floresansının PDT’nin terapötik etkilerini belirleyebileceğini göstermiştir [64]. İki köpek primer akciğer adenokarsinom hücre dizisi (HDC ve LuBi) 5-ALA aracılı PDT’ye tabi tutulmuştur. Işınlamadan önce hücre içi PpIX seviyeleri HDC ve LuBi hücreleri arasında benzer olmasına rağmen, ilki daha yüksek oranda ROS-pozitif ve apoptotik hücre göstermiştir [167]. |
SonuçSon yıllarda veteriner hekimliği tedavi alanında birçok dönüm noktasına ulaşmıştır; ancak kanser, hastaların yaşam kalitesini düşüren ve hasta sahiplerinin çabalarını zorunlu kılan terapötik bir zorluk olmaya devam etmektedir. Bununla birlikte, evcil hayvanlar ailenin bir parçasıdır. Sahipleri, hayvanlarının sağlığı ve yaşam kalitesi konusunda son derece ilgili ve talepkârdır ve her zaman daha az invaziv tedavileri tercih etmektedir. PDT’nin veteriner onkolojisindeki uygulamaları çeşitli neoplazmları kapsamaktadır [10]. Bununla birlikte, araştırmaların seyrek olması nedeniyle, terapötik protokoller hala tartışılmaktadır ve PDT’nin veteriner hekimlikte kullanımı henüz klinik rutinin bir parçası değildir [10,90]. Bu durum, insan tıbbında çeşitli iyi huylu ve kötü huylu hastalıkların tedavisi için dünya çapında verilen yasal onayla tezat oluşturmaktadır [38,168]. Bu çalışma, farklı tümör türlerinde kullanılan fotodinamik tedavi protokollerini ve ana fotosensitizerleri (Tablo 7) vurgulayarak, köpek ve kedilerde onkolojik tedavide PDT uygulamalarını ortaya koymaktadır. |
| Ne yazık ki, mevcut kanıtlar çok çeşitli protokollerden ve az sayıda hayvanla yapılan çalışmalardan kaynaklanmaktadır. Karsinomlar, PS, ışık ve DLI ile ilgili FDT protokollerinin heterojenliğinin, hafif ila orta dereceli yan etkilerle ilişkili, sıfırdan tama kadar değişken yanıtlara yol açtığı, 12 hastaya kadar olan birkaç küçük çalışmaya dahil edilmiştir [88]. Sıklıkla, hastalık birkaç hafta boyunca stabilize olmuştur [85,86,95]. 5-ALA’nın iyi tolere edildiği ve %85 tam yanıt sağladığı 55 kedilik bir çalışmanın [85] ve %62 lokal kontrol ile 51 kedilik bir çalışmanın [110] üzerinde durduk. Çalışmalar ayrıca daha yüksek radyasyon enerjilerinin daha iyi sonuçlarla ilişkili olduğuna [114] ve daha büyük tümörlerin genellikle daha az yanıt verdiğine işaret etmektedir [18]. Mastositomlar ve melanomlarla ilgili olarak, birden fazla FDT protokolü kullanan 2 hastaya kadar olan çalışmalar herhangi bir sonuç çıkarmamıza izin vermemektedir [79,84,96]. Sarkomlarla ilgili olarak, az sayıda hayvanla yapılan çeşitli çalışmalar rapor edilmiştir; sadece 16 köpeği içeren daha büyük çalışma, HPPH tabanlı FDT’den sonra %56 rekürrens göstermiştir [121]. Ek olarak, bir çalışma AO’nun cerrahi adjuvan olarak ilginç olabileceğini göstermiştir [123]. PDT, köpek ve kedilerin farklı neoplazmlarında etkilidir. Ancak, bazen tam remisyon sağlanamamıştır. Çalışmalar arasındaki heterojenlik, histolojik köken, neoplazmın bölgesi, fotosensitizer tipi, fotosensitizer konsantrasyonu, ışık kaynağı, maruz kalma süresi, kullanılan enerjiler ve dozlar, değerlendirme şekilleri, değerlendirme süreleri ve takip süreleri açısından gözlemlenmiştir. Böylece, veteriner hekimlikte ideal bir PDT protokolünün sonuçlarına sınırlı bir şekilde ulaşılabilmekte ve tedaviler arasında net bir karşılaştırma yapılabilmektedir. Bununla birlikte, PDT veteriner onkolojisinde yeni bir perspektif açmaktadır. Neoplazmın çözünürlüğü tek bir PDT uygulaması ile elde edilebilir. Buna rağmen, tekrarlanan uygulamalar gerçekleştirilebilir ve diğer terapötik yaklaşımlarla birlikte kullanılabilir. Buna ek olarak, veteriner onkolojide PDT’nin sonuçları translasyonel bir şekilde uygulanabilir, çünkü hayvanlar ve insan arasındaki tümör biyolojisinin benzerliği nedeniyle hayvanlar insan hastalıklarının deneysel modellerini oluşturmaktadır. Yeni fotosensitizerlerin refakatçi hayvanların tümörleri üzerindeki potansiyel uygulamaları göz önünde bulundurulduğunda, yeni fotosensitizerler ve tedavi protokolleri üzerine araştırmalar son derece teşvik edilmektedir. Katkıda bulunan yazarlar: Kuram oluşturma: M.F.B. ve M.L.; veri düzenleme: T.G.G. ve K.M.C.; araştırma: T.G.G. ve K.M.C.; metodoloji: T.G.G., K.M.C. ve C.M.M.; proje yönetimi: N.A. ve M.L.; kaynaklar: M.F.B.; denetim; N.A., M.F.B. ve M.L.; doğrulama: C.M.M., R.T., B.S. ve F.C.e.S., M.L.; görselleştirme: T.G.G., R.T., B.S. ve C.M.M.; yazım-orijinal taslak: T.G.G. ve K.M.C.; yazım-inceleme ve düzenleme: C.M.M., F.C.e.S., N.A., M.F.B. ve M.L. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir. Finansman: Bu çalışma, Portekiz Bilim ve Teknoloji Vakfı (FCT) ve Avrupa Sosyal Fonu (FSE) tarafından T.G.G. (SFRH/BD/139319/2018), R.T. (SFRH/BD/116794/2016) ve B.S.’ye (2020.07672.BD) verilen doktora bursu aracılığıyla desteklenmiştir. CIBB, UID/NEU/04539/2019, UIDB/04539/2020, UIDP/04539/2020 Stratejik Projeleri ve COMPETE-FEDER (POCI-01-0145-FEDER-007440) aracılığıyla FCT (Bilim ve Teknoloji Vakfı) aracılığıyla Ulusal Fonlar tarafından finanse edilmektedir. Hastane Etik Kurulu Beyanı: Bilgi yok. |
Kaynakça
|