| 1Biyomedikal Bilimler Enstitüsü, Uberlândia Federal Üniversitesi-UFU, Uberlândia, MG, Brezilya, 2Diş Hekimliği Fakültesi, Uberlândia Federal Üniversitesi-UFU, Uberlândia, MG, Brezilya, 3Veteriner Hekimliği Fakültesi, Uberlândia Federal Üniversitesi-UFU, Uberlândia, MG, Brezilya [AÇIK ERİŞİM] EDİTÖRLER: İNCELEYENLER: *İLETİŞİM ADRESİ: SUNUM TARİHİ: 17 Mart 2023 BU MAKALEY ATIFTA BULUNMAK İÇİN: TELİF HAKKI: © 2023 Coelho, Soldi, Silva, Mesquita, Paranhos, Santos ve Silva. Bu makale Creative Commons Attribution License (CC BY) koşulları altında dağıtılan açık erişimli bir makaledir. Orijinal yazar(lar)a ve telif hakkı sahip(ler)ine atıfta bulunulması ve bu dergideki orijinal yayına atıfta bulunulması koşuluyla, kabul gören akademik uygulamalara uygun şekilde diğer forumlarda kullanılmasına, dağıtılmasına veya çoğaltılmasına izin verilir. Bu şartlara uymayan hiçbir kullanım, dağıtım veya çoğaltmaya izin verilmez. |
| Köpek mast hücreli tümörleri (MCT) için uygulanan güncel altın standart tedavide kemoterapi olarak vinblastin sülfat (VBL) kullanılmakla birlikte, son zamanlarda tirozin kinaz inhibitörlerinin (TKI) tedavi için dikkate değer bir seçenek olduğu görülmüştür. Bu sistematik çalışma, standart VBL tedavisine kıyasla TKI ile tedavi edilen MCT’li köpeklerde genel sağkalım (OS), progresyonsuz sağkalım (PFS), genel yanıt oranı (ORR) ve tam (CR) veya kısmi yanıtı (PR) analiz etmek üzere yapılmıştır. Sistematik inceleme, Open Science Framework (OSF) veri tabanına 10.17605/OSF.IO/WYPN4 kimlik numarasıyla kaydedilmiştir (https://osf.io/). Dokuz veri tabanında elektronik tarama yapılmıştır. Daha fazla kayıt bulmak için uygun çalışmalardan referanslar da seçilmiştir. Toplam 28 çalışma uygunluk kriterlerini karşılamış ve uygun çalışmaların referanslarından bir tane daha olmak üzere toplam 29 adet uygun çalışma seçilmiştir. Tirozin kinaz inhibitörleri ile tedavi edilen köpeklerde genel yanıt oranı, tam yanıt ve kısmi yanıt vinblastin ile tedavi edilen köpeklere göre daha yüksekti. Vinblastin ile tedavi edilen köpeklerde genel sağkalım ve progresyonsuz sağkalım tirozin kinaz inhibitörleri ile tedavi edilen köpeklere kıyasla daha yüksektir. Tirozin kinaz inhibitörleri ile tedavi edilen mutasyona uğramış KIT’li köpekler, vinblastin ile tedavi edilenlere kıyasla daha uzun genel sağkalım ve progresyonsuz sağkalıma sahiptir. Çalışmadaki sonuçların yorumlanmasını etkileyebilecek çeşitli kısıtlamaların göz önünde bulundurulması önemlidir; elde edilen veriler standart örnekleme yönteminden yoksundur ve hayvan özellikleri, mutasyon tespit yöntemleri, tümör özellikleri ve tedavi türleri gibi çalışmanın sonucunu etkilemiş olabilecek değişkenleri de içermektedir. Sistematik inceleme kaydı: https://osf.io/, kimlik numarası: 10.17605/OSF.IO/ WYPN4. ANAHTAR KELİMELER |
GirişKinazlar hücre proliferasyonu, hücre sağkalımı ve tümör anjiyogenezindeki rolleri (1-7) gibi üç ana karsinojenik faktör nedeniyle tümör gelişimiyle ilişkilidir. Bu karsinojenik faktörler kontrolsüz çoğalmayı teşvik eder ve tümör hücrelerini ölüme karşı daha duyarlı hale getirir (8). Kinaz aktivasyonu büyüme faktörlerine bağlıdır, ancak kinaz mutasyonu meydana geldiğinde bu bağımlılık ortadan kalkar ve reseptör otofosforilasyonu ve downstream sinyalizasyonun artması ile sonuçlanarak kontrolsüz hücre çoğalmasına ve hayatta kalmasına izin verir (2). Proto-onkogen c-kit, mast hücresi büyümesi ve diferansiyasyonu üzerinde önemli rol oynayan reseptör tirozin kinazı kodlar ve bu proto-onkogendeki mutasyon tipine bağlı olarak c-kit’in liganddan bağımsız aktivasyonuna neden olabilir. Köpek mast hücresi tümöründe proto-onkogen c-KIT’deki mutasyonların görülme sıklığı %14 ila %26,2 arasında değişmektedir ve esas olarak ekzon 8 ve 11’de tespit edilebilir. Mutasyonların çoğu %64’e varan bir insidansla ekzon 11’de meydana gelir ve mutasyonların ∼%50’si internal tandem duplikasyonlarla kendini gösterir (9-13). C-kit reseptörü ligandı, mast hücre büyüme faktörü (MGF) olarak da adlandırılan kök hücre faktörü (SCF) şeklinde tanımlanmaktadır (14, 15). SCF, primordial germ hücrelerinin hayatta kalmasını ve çoğalmasını regüle eder ve kemik iliği kültürlerinde dikkate değer bir biçimde sinerjik aktiviteye sahiptir (14). Mast hücre tümörleri köpekleri etkileyen başlıca deri kanseridir ve metastaz meydana geldiğinde sağkalım süresi düşmektedir. Toplanan veriler, hastalıktan etkilenen köpeklerin yaklaşık %76’sında bölgesel lenf düğümlerine metastaz görüldüğünü, tümörle ilişkili ölüm oranının ise sırasıyla %25-67 ile grade II ve grade III tümör sergileyen köpeklerde yaygın olarak görüldüğünü ortaya koymaktadır (16, 17). Mast hücreli tümörler proto-onkogen c-kit’te mutasyon geçirebilir ve bu nedenle bu hastalar için c-kit inhibitörlerinin kullanımı oldukça önemlidir. Köpek mast hücreli tümörlerinin tedavisi, lomustin ve siklofosfamid gibi diğer ilaçlara ek olarak genellikle prednizon ile birlikte vinblastin (VBL) içeren kemoterapidir. Mast hücreli tümör tedavisi olarak belirtilen diğer protokoller doksorubisin, vinkristin ve siklofosfamiddir (18-20). Standart kemoterapi protokolü 2 mg/m² intravenöz olarak uygulanan vinblastindir. Bu uygulamalar 4 hafta boyunca haftada bir, daha sonra iki haftada bir şeklinde tamamlanır (19). VBL uygulaması mast hücreli tümörü olan köpeklerde yüksek etki göstermiştir. Kanıtlar, ağır hastalığı olan köpeklerde %47’ye karşılık gelen genel yanıt oranını göstermektedir. Ayrıca, grade III tümör teşhisi konan köpeklerde genel sağkalım oranı 331 gün olup, deneklerin %45’i tedaviden 1-2 yıl sonra hala hayattadır (21). Bu tedaviyle ilişkili çeşitli yan etkilerin şiddeti farklıdır. Daha hafif yan etkiler kusma, letarji, diyare ve nötropeni gibi sepsisle sonuçlanmayan semptomları içerir. Öte yandan, ciddi yan etkiler arasında tedavinin kesilmesini gerektirebilecek refrakter kusma ve ateşle birlikte şiddetli nötropeni yer alır. Nötropeni, vinblastinin en önemli doz sınırlayıcı toksisitesidir ve vakaların %73’üne kadar görülür. Tedaviden 1 hafta sonra nötrofillerin en düşük seviyeye inmesi ile sonuçlanabilir (21, 22). Moleküler ve hedefe yönelik tedaviler kanser hücreleri bakımından daha yüksek özgüllüğe sahip olup, malign hücrelerde mevcut genetik değişiklikleri hedef alarak sağlıklı dokulara verilen zararı azaltmakta ve hastanın yaşam kalitesini iyileştirmektedir (23). Veteriner hekimlikte, toceranib, köpek mast hücre tümörü için endike olan, evcil hayvanlarda hedefe yönelik tedavi için onaylanan ilk ilaçtır (23-26). Vasküler endotelyal büyüme faktörü reseptörü (VEGFR), PDGFR, c-Kit, koloni uyarıcı faktör 1 reseptörü ve fms tipi tirozin kinaz 3 dahil olmak üzere aynı anda birden fazla reseptör tirozin kinazı hedefleyen bir ilaçtır. Masitinib mesilat, c-Kit e ve PDGFR’ler ve fibroblast büyüme faktörü reseptörü 3 (FGFR3) gibi diğer tirozin kinaz reseptörlerinin inhibitör aktivitesine sahip olan ve köpek mast hücre tümörünün tedavisi için onaylanmış bir başka TKI’dir (23, 27). Elde edilen kanıtlar, toceranib kullanımı sonucunda ortaya çıkan genel yanıt oranının %42,8’e karşılık geldiğini göstermiştir. Bu veriler, TKI’nin tek başına terapötik ajan olarak uygulanmasının optimum terapötik sonuç sağladığı ve köpek mast hücreli tümör tedavisinde kullanılan diğer terapötik modalitelerden daha üstün olduğu görüşünü desteklemektedir. TKI tedavisi, diğer protokollerde görüldüğü gibi toksisitelerin ortaya çıkmasını önlemek için terapötik süreç esnasında ara verilmesine gerek kalmadan alternatif günlerde uygulanabilmektedir. Ayrıca, TKI tedavisinin yan etkileri vinblastin ve prednizon içeren kemoterapiye bağlı yan etkilerden daha az görülmektedir. Veteriner hekimlikte, çoğu köpek neoplazmında bu hedefe yönelik tedavilerin klinik etkinliğine ilişkin sınırlı veri bulunmaktadır (8). Bu nedenle, bu çalışmanın amacı tirozin kinaz inhibitörleri ile tedavi edilen mast hücreli tümörlü köpeklerde standart vinblastin tedavisine kıyasla yanıt oranını, genel sağkalımı ve progresyonsuz sağkalımı değerlendirmektir. |
Metod |
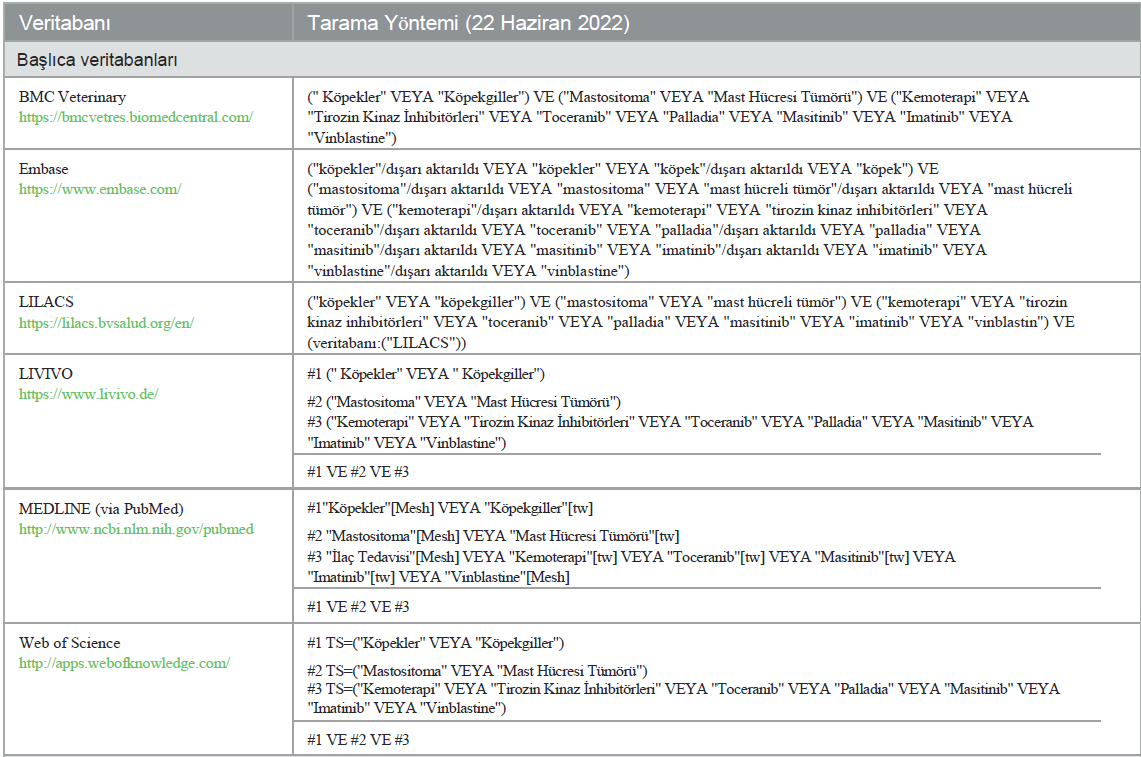
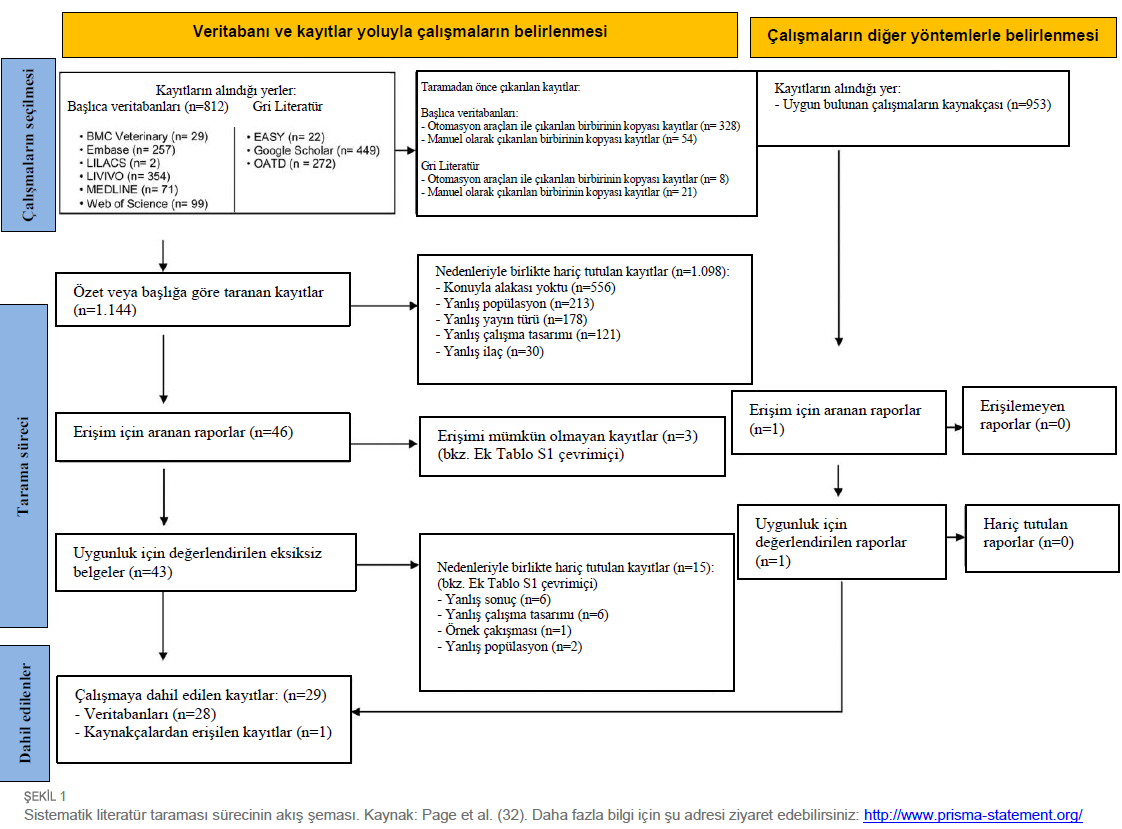
Bilgi kaynakları, araştırma ve çalışmaların seçimiBMC Veterinary, Embase, Latin American, and Caribbean Health Science Literature (LILACS), LIVIVO ve MedLine veritabanlarında (PubMed aracılığıyla) ve Web of Science kaynak veritabanında elektronik taramalar yapılmıştır. EASY, Google Scholar ve Open Access Thesis and Dissertations (OATD) “gri literatürü” kısmen yakalamak için kullanılmıştır. Bu stratejiler, yayın yanlılığını en aza indirmek için uygulanmıştır. MedLine taraması, Haziran 2022’ye kadar elektronik bildirimlerle sürekli olarak güncellenmiştir. Tarama için kullanılan tanımlayıcılar MeSH (Medical Subject Headings), DCS (Health Sciences Descriptors) ve Emtree (Embase Subject Headings) kaynaklarına göre seçilmiştir. Tanımlayıcılar arasında çeşitli kombinasyonlar, her bir veri tabanının sözdizimi kurallarına uyularak Boolean operatörleri ” VE” ve “VEYA” ile gerçekleştirilmiştir. Tablo 1’de tarama stratejileri ve veri tabanlarına ilişkin daha fazla ayrıntı yer almaktadır. Elde edilen sonuçlar EndNote WebTM yazılımına (ClarivateTM Analytics, Philadelphia, ABD) aktarılmış, burada kopyalar otomatik olarak kaldırılmış ve kalan kopyalar manuel olarak kaldırılmıştır. Kalan sonuçlar, çalışma seçimi için Rayyan QCRI’ye (Qatar Computing Research Institute, Doha, Katar) aktarılmıştır. Gri literatür, Microsoft WordTM 2010 (Microsoft Ltd., Washington, ABD) ile eş zamanlı ve eksiksiz olarak manuel şekilde analiz edilmiştir. Çalışmaları seçmeden önce, iki hakem, uygunluk kriterlerini tartışarak ve hakemler arası uyumu belirlemek için erişilen çalışmaların %20’sinden oluşan bir örneklem üzerinde uygulayarak kalibrasyon çalışması yapmıştır. Yeterli seviyede uyum sağlandıktan sonra (Kappa < 0.81) seçime başlanmıştır. İlk aşamada, iki uygunluk hakemi (YNBC ve LRS) çalışmaların başlıklarını ve özetlerini bağımsız şekilde metodik olarak analiz etmiştir. Hakemler arasındaki anlaşmazlıklar üçüncü bir hakem (PHRS) tarafından analiz edilmiş ve karara bağlanmıştır. Bu aşamada, konuyla ilgisi olmayan başlıklar ve uygunluk kriterlerini karşılamayan özetler hariç tutulmuştur. İkinci aşamada, uygun bulunan ön çalışmaların tam metinleri temin edilmiş ve değerlendirilmiştir. Daha fazla kayıt aramak için uygun çalışmaların referansları da seçilmiştir. Tam metinlerin bulunamaması halinde, kütüphane veri tabanına (COMUT) bibliyografik talepte bulunulmuş ve metinlerin elde edilmesi için ilgili yazarlara e-posta gönderilmiştir. |
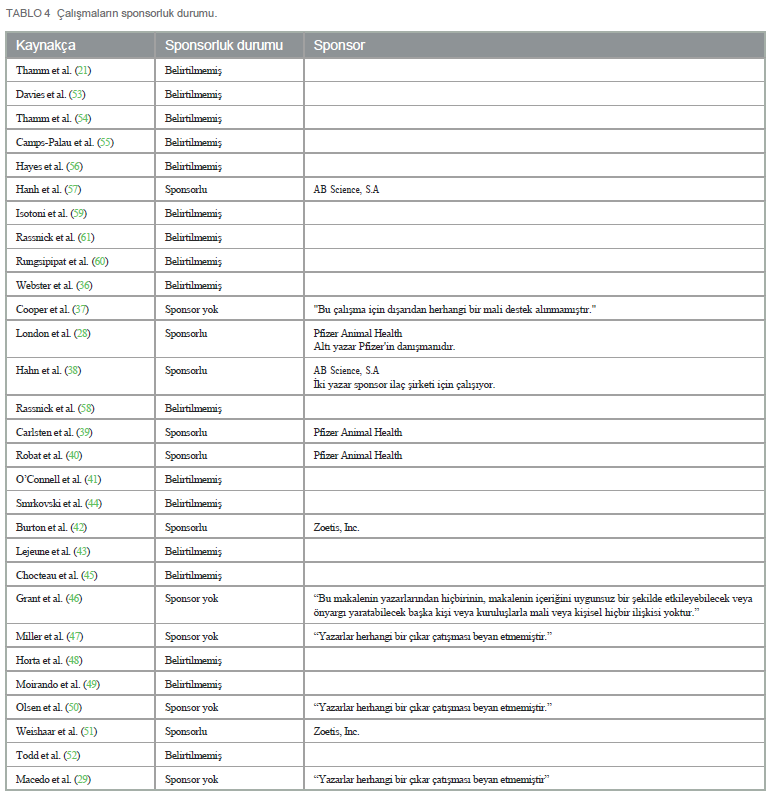
Sponsorluk durumunun değerlendirilmesiÇıkarılan çalışmaların finansman kaynağı değerlendirilmiştir. Bu veriler önemlidir, çünkü ilaç endüstrisi tarafından desteklenen çalışmalar, diğer sponsorluk kaynaklarına sahip çalışmalara kıyasla sponsorun ürünü lehine daha sıktır ve yanlılık riski taşımaktadır (32). Sponsorluk durumu aşağıdaki gibi sınıflandırılmıştır (33): Belirsiz: Sponsorluk beyanı sunmayan ve sponsorlu olup olmadığını belirtmenin mümkün olmadığı çalışmalar; Sponsorsuz: Yazarların ilaç endüstrilerinden finansal destek almadıklarını belirttikleri çalışmalar ve Sponsorlu: Yazarların ilaç endüstrilerinden her türlü finansal destek aldıklarını beyan ettikleri çalışmalar. (finansal destek, ekipman veya malzeme sağlanması, indirimler, vb.). |
Elde Edilen Sonuçlar |
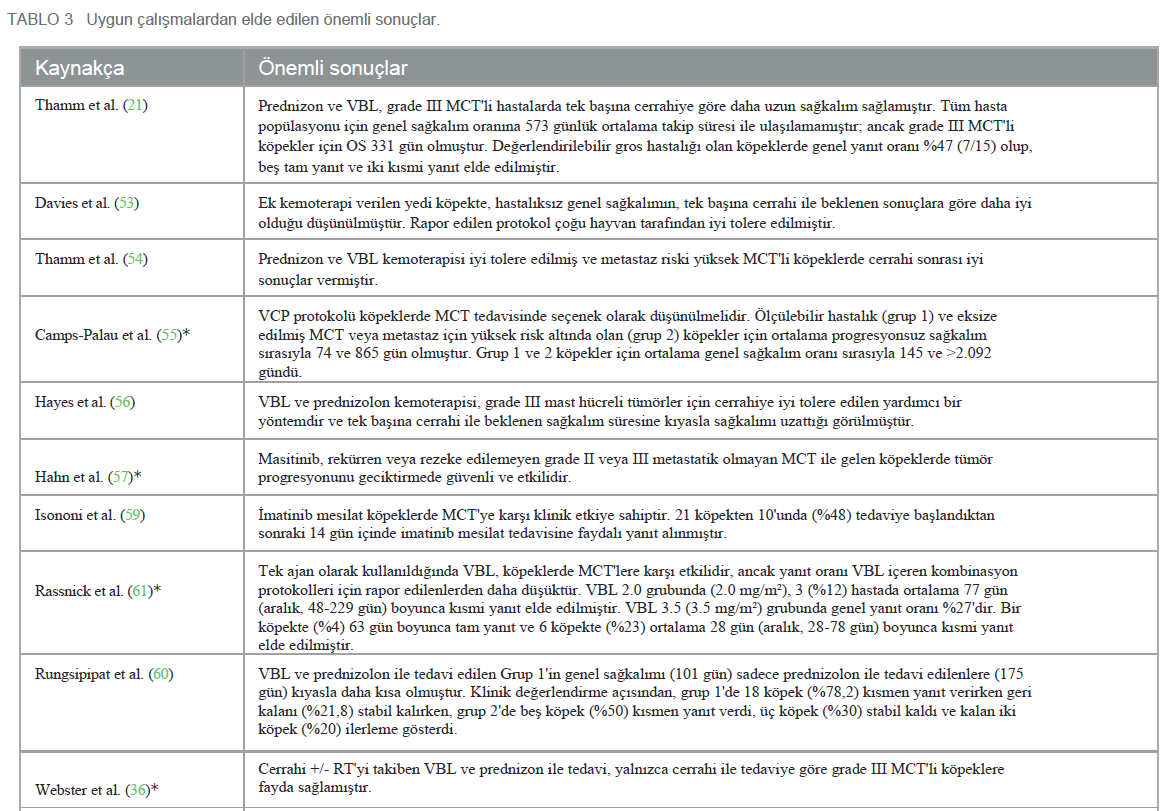
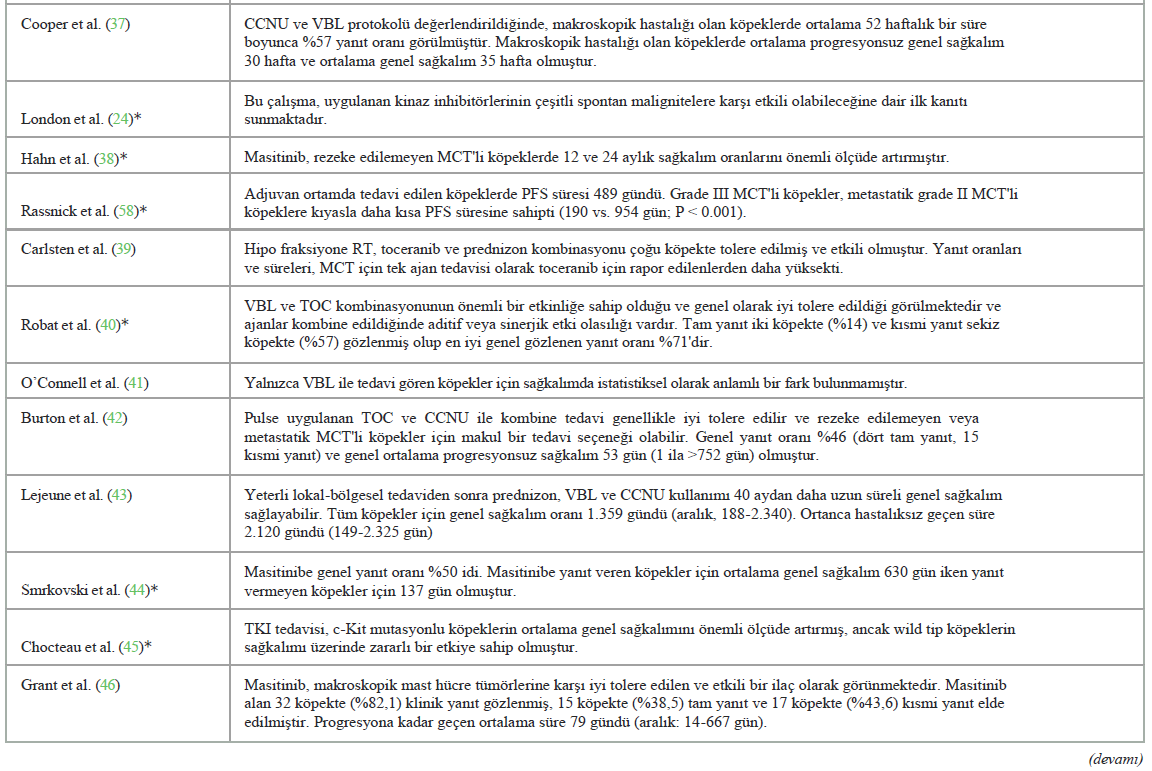
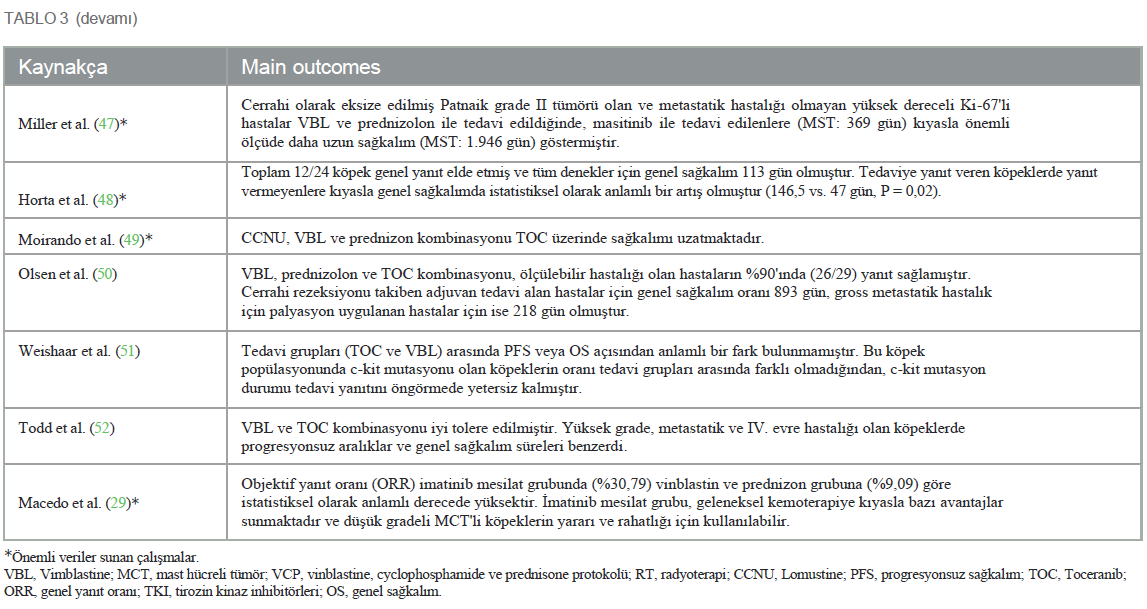
Çalışmaların bireysel sonuçlarıMevcut analize dahil edilen TKI grubunda sonuçlar pozitif, nötr ve negatif şeklinde sınıflandırılmış olup, her bir sınıflandırma ilgili araştırmaların temel hedeflerine ve hipotezlerine bağlı kalmıştır. Pozitif sonuçlar, dört grupta araştırılan ilaçlardan herhangi birinin kullanımı için destekleyici kanıtlar sunan ve mast hücreli tümörlerin tedavisinde tedavilerin etkinliğini fiilen kanıtlayan çalışmalar şeklinde tanımlanmıştır. Nötr sonuçlar, her bir çalışmada değerlendirilen bir veya daha fazla ilacın etkinliği karşılaştırıldığında ayırt edilebilir bir fark olmadığını ve bir ilacın diğerinden daha etkili olduğunu iddia etmek için bilimsel bir destek bulunmadığını ortaya koymuştur. Negatif sonuçlar, araştırmanın hipotezleriyle çelişen ve dört grup içinde değerlendirilen ana ilacın başka bir tedavi biçiminden daha düşük olduğunu gösteren sonuçlar anlamına gelmektedir. Seçilen çalışmaların başlıca bulguları Tablo 3’te sunulmuştur. Olumlu sonuçlar 21 makalede görülmüştür. VBL grubu, tek başına cerrahiye kıyasla daha iyi sonuçlar vermiş ve ayrıca cerrahiye ek olarak etkili olduğunu göstermiştir (21, 35, 36, 38, 42). TKI’nin olumlu etkileri olduğu görülmüş, dahil edilen yayınlarda güvenli, etkili olduğu ve köpeklerde mast hücre tümörlerine karşı klinik etkinliğe sahip olduğu belirtilmiştir (34, 39, 41, 44, 50-52, 59, 61). Diğer + VBL grubunda, siklofosfamid ve lomustinin iyi tolere edildiği kanıtlanmış ve tedavi yanıtı ile genel sağkalım açısından etkili olduğu gözlenmiştir (37, 40, 43, 49). Kemoterapi + TKI grubu iyi tolerans göstermiş ve tedaviye yanıt ile genel sağkalım açısından olumlu sonuçlar vermiştir; bu da bu ajanların kombinasyonunun aditif ve sinerjik etkisiyle açıklanabilir (45, 46, 48, 56, 58). Olumlu sonuçlarla ilgili olarak, çalışmaların %28,5’inde (n = 6) ilaç üreticileri veya bir sektörle bağlantılı yazarlar tarafından verilen sponsorluk beyanları bulunmaktadır: üçü Pfizer Animal Health’ten (34, 45, 46), ikisi AB Science, S.A.’dan (39, 44) ve biri Zoetis, Inc.’den (48) finansal destek almıştır. Çalışmaların yaklaşık %57’si (n = 12) herhangi bir sponsorluk beyanı sunmamış ve %19,0’ında (n = 4) yazarlar finansal destek olup olmadığını belirtmemiş ve sadece çıkar çatışması olmadığını beyan etmiştir. |
| İki çalışma, VBL tedavisi ile TKI arasında progresyonsuz aralık, genel sağkalım, tam yanıt, objektif yanıt oranı veya klinik fayda açısından fark olmadığını gösteren nötr sonuçlar ortaya koymuştur (47, 57). Ayrıca, bir çalışmada toceranib ile tedavi edilen metastaz açısından orta riskli grupta sonuç açısından herhangi bir fark bulunmamıştır (54). Negatif sonuçlara ilişkin olarak, VBL ve Diğer + VBL gruplarındaki tedavi etkinliği TKI grubuna kıyasla daha üstündü. Ancak TKI’ler yine de iyi tolere edilmiş ve mast hücreli tümörlerin tedavisinde etkinlik göstermiştir (53, 55) . VBL grubunda ve Diğer + VBL’de (prednizolon ile kombinasyon), sadece prednizolon ile tedavi edilen köpeklere kıyasla genel sağ kalım daha kısa bulunduğundan bir başka olumsuz sonuç daha görülmüştür (60). Tüm çalışmaların istatistiksel analiz sağlamadığını belirtmek önemlidir. Bazı çalışmalar plasebo kontrolü olmadan yalnızca ilaçların etkinliğini değerlendirmiş ve bu nedenle gruplar arası karşılaştırma yapmak için yeterli veri sağlamamıştır. Benzer şekilde, iki grubu karşılaştıran diğer çalışmalar istatistiksel analiz yapmak için gereken istatistiksel verilerden yoksun olabilir. |
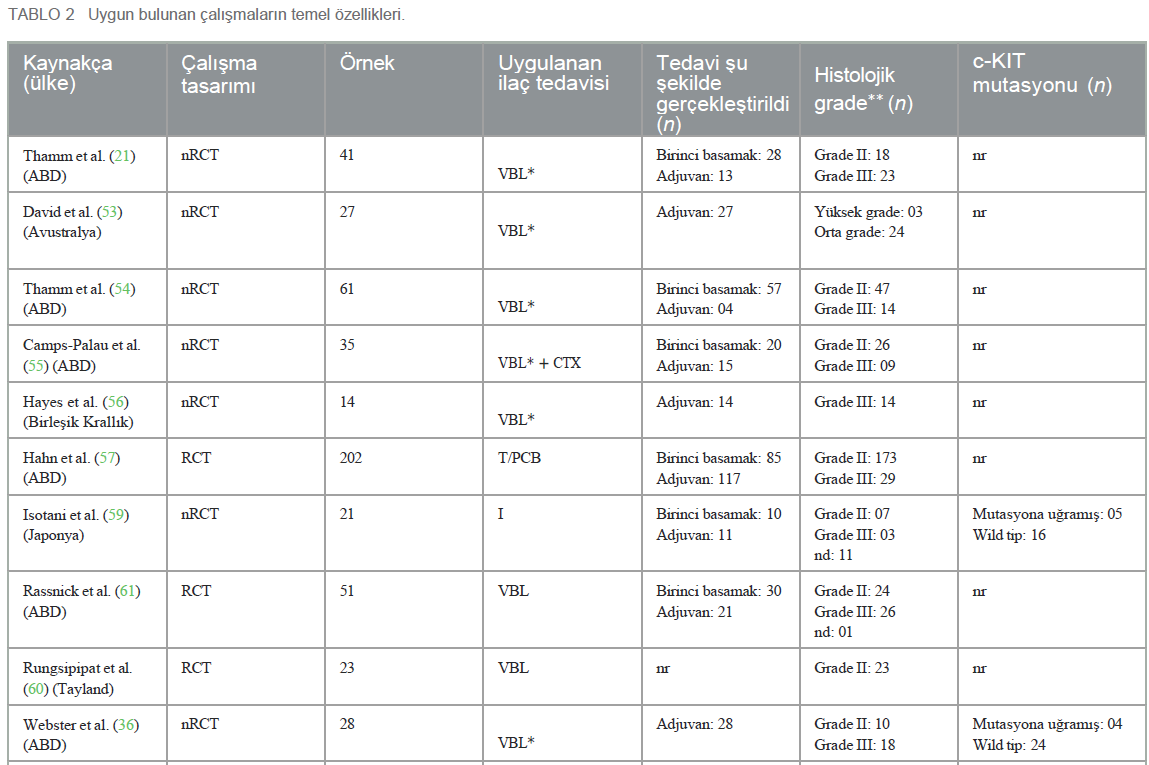
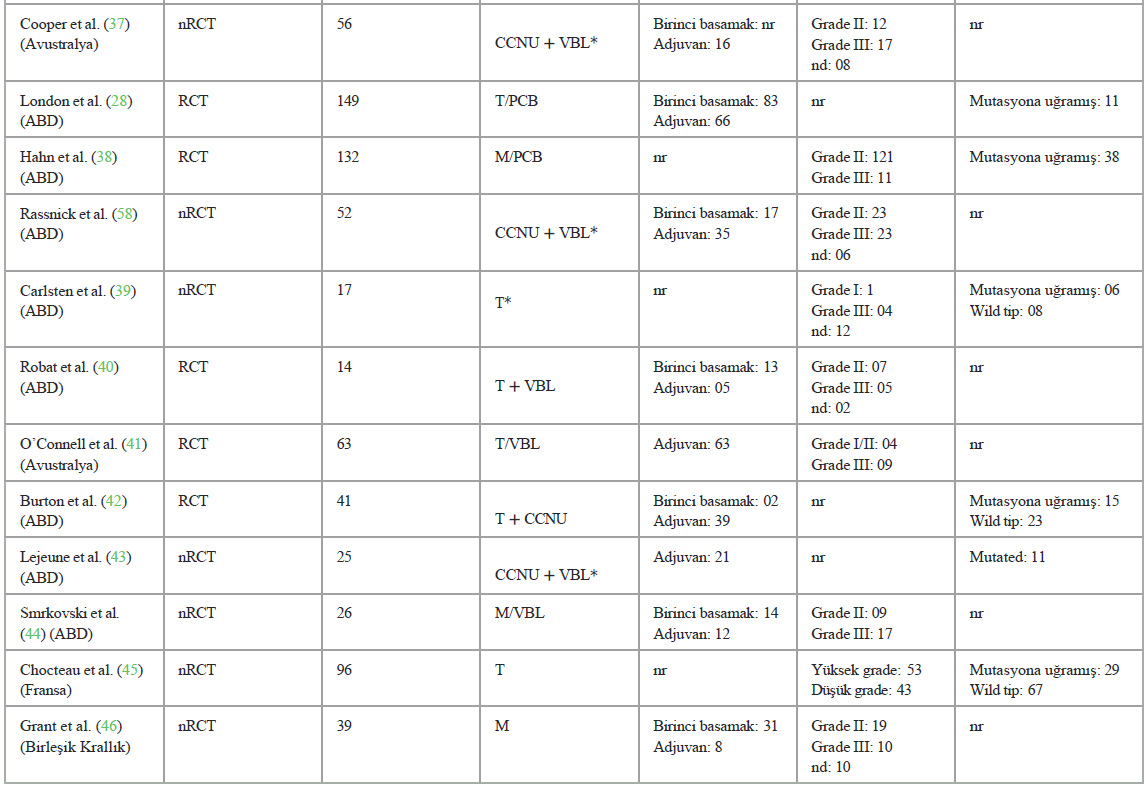
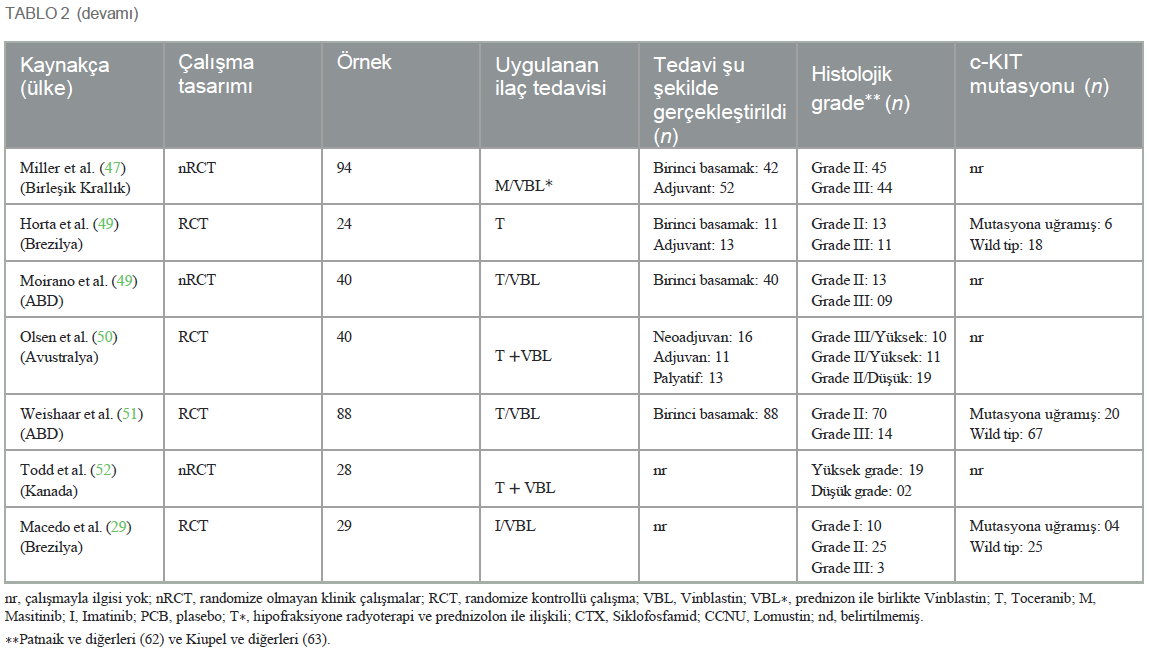
Veri senteziElde edilen sonuçlar, uygun çalışma gruplarındaki genel yanıt oranı, tam veya kısmi yanıt, genel sağkalım ve progresyonsuz sağkalımdan toplanmıştır. Çıkarılan değişkenler, hayvanın, tedavinin ve tümörün özelliklerine göre oluşturulan gruplar gibi toplanan çalışmanın türüne bağlıydı. Eğer bir çalışma grup ayrımı olmaksızın değerlendirilen değişkenlerin toplamlarını sunmuşsa, bu veriler çalışma örnekleminin diğer özellikleri dikkate alınmaksızın tüm hayvanlardan toplam olarak çıkarılmıştır. Ancak, çalışma her bir hastanın özelliklerine göre (c-kit mutasyonunun varlığı, histolojik derece, tedavi türü ve tümör ölçümü gibi) gruplara ayrılmış veriler sunmuşsa, toplam değeri elde etmek için ortalaması alınmıştır. Çalışmalarda değerlendirilen her gruptan ayrı ayrı çıkarılan değerler de sunulmuştur. Ek Tablolar 2-5 çevrimiçi ortamda elde edilen bu nicel verileri özetlemektedir. Onkogen c-kit’in duyarlılığında farklılık gösterebilecek farklı mutasyon saptama yöntemlerini kanıtlamak için, mutasyon durumunu değerlendiren her çalışmanın başlıca tespit yöntemlerinin yanı sıra mutasyon türünün (Dahili Tandem Duplikasyonları veya Nokta Mutasyonu) ve amplifiye edilen ve sekanslanan ekzonların sınıflandırması tanımlanmıştır. Bu veriler Ek Tablo 6’da açıklanmıştır.
|
Sektör sponsorluğuSponsorluk durumu Tablo 4’te gösterilmiştir. Yedi çalışma finansal destek sağlandığını beyan etmiş veya değerlendirilen ilaçları üreten ilaç sektörüyle ilişkisi olan yazarları içermiştir. Beş çalışmada yazarlar herhangi bir çıkar çatışması beyan etmemiştir. 17 çalışmada net olmayan bilgiler gözlenmiş ve çalışmanın sponsorluk durumunu teyit etmek mümkün olmamıştır. Genel ÖzelliklerTedaviye verilen yanıtların ortalama takibi 785 gündü. Önceki tedaviler hakkında bilgi içeren çalışmalarda, hayvanların %51,9’u ilk tedavi olarak tirozin kinaz inhibitörü veya vinblastin alırken, %48,03’ü daha önceden tedavi görmüştür. Önceki tedavinin türünü belirten çalışmalarda, %28,5’inin bir çeşit cerrahi eksizyon, %39,1’inin kemoterapi ve %32,2’sinin radyoterapi aldığı görülmüştür. TKI alan köpeklerde, bilgi sağlayan çalışmalarda, 257 köpek endikasyon kapsamında tedavi görmüş ve 261’i endikasyon dışı ilaç almıştır: 87 köpek, mutasyona uğramış c-kit tirozin kinaz olduğu doğrulanmış rezeke edilemeyen mast hücreli tümörler (Grade II veya III) sunduğu için Masitinib almıştır. Üç çalışmada c-kit mutasyon durumuna dair herhangi bir bilgi verilmediği için bu çalışmalardan bilgi toplanmamıştır; 170 köpek Patnaik grade II veya III histolojik sınıflandırmaya sahip, rekürren, bölgesel lenf nodu tutulumu olan veya olmayan mast hücreli tümörlere sahip oldukları için Toceranib almıştır. Bir çalışmada sadece dört hasta histopatolojik incelemeye tabi tutulmuştur, bu nedenle diğer köpeklerin ilacı endikasyona uygun şekilde alıp almadığı belirlenememiştir. Imatinib alan 34 hayvanın tamamı, bu ilacın köpeklerde kullanılmak üzere piyasaya sürülmediği göz önünde bulundurularak göz ardı edilmiştir; dolayısıyla bu ilacın köpeklerde kullanımı endikasyon dışıdır. Çalışmalara dahil edilen ve cinsiyeti bildirilen 1.134 köpeğin 499’u (%44) erkek, 635’i (%55,9) ise dişiydi. Seçilen çalışmalardaki köpeklerin ortalama yaşı 9,1 yıldı (7,6 ⊥ 16,6). Sadece 1.058 köpeğin histolojik derecesi Patnaik (62) kriterlerine göre belirlenmiştir. Köpeklerin çoğunda grade II tümör vardı (n = 714, %67,4), bunu grade III (n = 328, %31), grade I (n = 16, %1,5) ve son olarak derecesi belirlenmemiş tümörler (n = 24, %2,29) takip ediyordu. Bu bilgiler 25 çalışmada sunulmuştur. Diğer yayınlarda, histolojik olarak %50,5’i (n = 133) yüksek gradeli malignite şeklinde sınıflandırılmış ve Kiupel’in (63) kriterleri kullanılarak 136’sı (%49,4) orta/düşük gradeli malignite şeklinde derecelendirilmiştir. Ancak bu kriterler sadece dokuz çalışmada değerlendirilmiş ve tümörlerin %55,02’si mikroskobik, %44,7’si makroskobik hastalık olarak sınıflandırılmıştır. C-kit ile ilgili olarak, köpeklerin %29,7’sinde (n = 188) c-kit mutasyonu olan tümörler ve %71,2’sinde (n = 466) wild tip c-kit vardı. 67,5’inde (n = 77) ekzon 11’de mutasyon vardı ve %32,4’ünde (n = 37) ekzon 8’de mutasyona ilişkin ekzonlarda mutasyon prevalansı verileri sunan çalışmalar vardı. Standart kitin belirlenmesi ile ilgili olarak, %16,2’si kit tip I paternini (perimembranöz ekspresyon), %53,8’i standart kit II’yi (fokal sitoplazmik işaretleme) ve %29,9’u kit III paternini (diffüz sitoplazmik) eksprese etmiştir. Tespit metodolojisinin türü ile ilgili olarak, bu mutasyonlar biyopsi üzerinde yapılan ters transkriptaz-PCR testi ve KIT protein lokalizasyonunun değerlendirilmesi amacıyla immünohistokimyasal yöntemlerle gerçekleştirilmiştir. Çalışmalarda değerlendirilen mutant tümörlerin çoğu ITD’ye dayanmaktadır ve ekzon 11 veya 8’deki mutasyonları sekanslamıştır. Sadece bir çalışmada 8-13 ve 17-19 gibi daha nadir ekzonlar sekanslanmıştır. Her bir makalenin metodolojisi ve mutasyon saptama çeşitliliği Ek Tablo 6’da açıklanmıştır. |
Genel yanıt oranıTKI grubunda ortalama genel yanıt oranı (ORR) değeri %50,36 (138/274) (34, 41, 45, 50, 52, 54, 57, 59) olmuştur. VBL grubunda ise ortalama ORR değeri %28,75 (23/80) olmuştur (21, 57, 59, 61). Kemoterapi + TKI grubunda (CCNU veya vinblastin ile kombinasyon) ORR %65,47 (55/84) olmuştur (46, 48, 56). Diğer + VBL grubunda (lomustin ile birlikte) ORR %57,53 (42/73) olmuştur (40, 43). Sunulan veriler Ek Tablo 7’de açıklanmıştır. Tam ve kısmi yanıtTKI grubunun tam yanıt (CR) değeri %26,49’a (133/502) ulaşmıştır (34, 39, 41, 44, 45, 50, 52, 54, 57, 59). Kemoterapi + TKI (VBL veya CCNU ile birlikte) grubunun CR değeri VBL grubunda %23,21’e (26/112) varmıştır (21, 35, 40, 57, 59-61). CR’de bu oran %33,68’e (32/95) erişmiştir (46, 48, 56). Diğer + VBL grubunda (siklofosfamid ve CCNU ile birlikte) CR %29,23 (19/65) olmuştur (37, 40, 43). TKI grubunda elde edilen PR %39,46 (148/375) olmuştur (34, 39, 41, 45, 50, 52, 54, 59). Bununla birlikte, VBL grubunun PR yüzdesi %36’ya (27/75) ulaşmıştır. Kemoterapi + TKI grubunda (CCNU veya VBL ile birlikte) bulunan PR %29,1 (16/55) (46, 48) ve Diğer + VBL (CTX veya CCNU ile birlikte) %30,7 (20/65) PR’ye erişmiştir (37, 40, 43, 59). Sunulan veriler Ek Tablo 7’de açıklanmıştır. Genel sağkalımDahil edilen tüm çalışmalardan toplanan genel sağkalım verileri ortalama sağkalım (belirli tedavi grubundaki tüm dahil edilen çalışmaların ortalaması), tümör derecelendirmesine göre (I, II, III veya Düşük/Yüksek) ortalama sağkalım (62, 63) ve c-kit mutasyonlarının olup olmamasına göre (mutasyona uğramış veya uğramamış) analiz edilmiştir. TKI grubunda, tüm köpeklerin ortalama genel sağkalım süresi 308 gündü (113 ⊥ 1.018). Bu gruptaki grade II mast hücreli tümörlü köpeklerde ortalama genel sağkalım, grade III’e (278 gün) kıyasla daha yüksektir (369 gün) (53). Grade’e göre düzenlenmiş bir çalışmada, yüksek grade’li mast hücreli tümörlerin genel sağkalım süresi 432 gün olmuştur (51). KIT mutasyonu olan köpeklerde genel sağkalım 461 gün iken, mutasyon olmayan köpeklerde genel sağkalım 1.389 gün olmuştur (39, 51). VBL grubunda, dahil edilen çalışmaların ortalama genel sağkalımı 524 gündür (101 ⊥ 1.374) (21, 36, 42, 53, 55-57, 60). Bu grupta, grade II mast hücreli tümörlerde ortalama genel sağkalım 1.300 gün, grade III’te ise ortalama 234 gün olmuştur. Mutasyona uğramış c-kit’e sahip köpeklerde genel sağkalım 270 gün, mutasyona uğramamış olanlarda ise 529 gün olmuştur (42). Adjuvan tedavi için kemoterapi ajanı olarak VBL kullanılan Kemoterapi + TKI grubundaki köpeklerin genel sağkalım süresi 893 gündü ve palyatif tedavi gören köpekler 218 gün hayatta kaldı (toplam ortalama: 555 gün). Yüksek grade mast hücreli tümörü olan köpeklerin genel sağkalım süresi 563 gündü. Bu köpeklerden elde edilen toplam ortalama 559 gündü (555 ⊥ 563) (56, 58). Diğer + VBL grubunda ortalama genel sağkalım 728 gündü (209,5 ⊥ 1359). Ölçülebilir hastalığı olan köpeklerde ortalama genel sağkalım 195 gün, ölçülemeyen hastalığı olanlarda ise ortalama 1.214 gün olmuştur (37, 43, 49). Sunulan veriler Ek Tablo 8’de açıklanmıştır. |
Progresyonsuz sağkalımProgresif sağkalım dahil edilen tüm çalışmalardan toplanmış ve ortalama progresyonsuz sağkalıma (belirli bir tedavi grubundaki tüm dahil edilen çalışmaların ortalaması), tedavi basamağına (birinci basamak veya ikinci basamak), kemoterapi tedavisinin türüne (adjuvan veya palyatif), tümör sınıflandırmasına (I, II, III veya Düşük/Yüksek) (62, 63), ölçülebilir hastalığı olan köpeklere veya tam olarak eksize edilmemiş tümörü olan köpeklere ve c-kit mutasyonlarının olup olmamasına (mutasyona uğramış veya uğramamış) göre ortalama progresyonsuz sağkalım sonuçları analiz edilmiştir. TKI grubunda, ortalama 207 günlük (30 ⊥ 453) progresyonsuz aralık elde etmek mümkün olmuştur (39, 45, 47, 50, 52, 54). Masitinib, tedavinin ilk basamağı olarak verildiğinde, ortalama PFS 253 gün olmuştur (52). İkinci basamakta ve sonrasında masitinib ile tedavi edilen köpeklerin PFS’si 84 gün, mutasyona uğramış kiti olan köpekler ortalama 209 gün ve mutasyona uğramamış kiti olanlar ise 72 gün olmuştur (39, 45). VBL grubunun ortalama PFS’si 714 gün (45⊥1.305) olmuştur (36, 38, 47, 57). Kemoterapi + TKI grubunda ortalama 49 gün olmuştur (45 ⊥ 53) (palyatif tedavi için 45 gün; CCNU ve vinblastin ile ilişkili toceranib) (48, 56). Diğer + VBL (siklofosfamid ve CCNU ile kombinasyon) için PFS 861 gündü (227 ⊥ 2.120). Grade II tümörlerde PFS 954 gün ve grade III için 190 gün olmuştur (37, 40, 43, 49). Ölçülebilir hastalığı olan köpekler ortalama 142 güne ve tam olarak eksize edilmemiş tümörü olan köpekler ortalama 1.555 güne ulaşırken, adjuvan tedavi ile tedavi edilenler ortalama 489 güne ulaşmıştır (37, 40, 43). Sunulan veriler Ek Tablo 8’de açıklanmıştır. |
TartışmaKöpek mast hücre tümörleri için geleneksel tedavi yöntemi, sıklıkla prednizolon ile kombine edilen vinblastindir (64) (21, 36, 59). Bununla birlikte, insanlarda çeşitli malignite türlerinde etkili olan TKI’nin moleküler tedavi olarak kullanılması gibi iyi tolerans ve klinik faydaları olan yeni tedaviler değerlendirilmektedir ve köpek mast hücreli tümörlerinde etkili bir tedavi olduğu görülmüştür (36). Bu çalışmada, tek başına vinblastin ile tedavi edilen köpeklerin genel sağkalımı, tek başına TKI ile tedavi edilen köpeklerin genel sağkalımından daha yüksek bulunmuştur. TKI’ler mast hücreli tümör büyümesinde rol oynayan hücre sinyalizasyonunu engelleyebilen önemli terapötik kaynaklar olduğundan (65, 66) ve VBL ile karşılaştırılabilir etkinliğe sahip olmaları beklendiğinden bu durum oldukça ilgi çekicidir. Bununla birlikte, literatürde eoplastik mast hücrelerinin tedavisi sırasında imatinib gibi TKI’lere direnç sağlayan moleküler mekanizmaların varlığını gösteren çalışmalar vardır (66, 67)ve bu da VBL grubundaki daha yüksek sağkalım oranını açıklayabilir. VBL’nin mikrotübüllere bağlanarak mitozu inhibe eden sitotoksik etkisine ek olarak, bu sonuçla ilişkili olabilecek bir diğer faktör de sağkalım oranının analiz edildiği tüm çalışmalarda mevcut olan prednizon ile VBL’nin sık görülen birleşimidir. Prednizon, in vitro ve in vivo mast hücre tümör proliferasyonunu sınırlayabilen, fibroblastlar ve epitel hücreleri aracılığıyla kök hücre faktörü üretimini ve inflamasyonu azaltabilen bir glukokortikoiddir (68-71). Bu iki ilacın kombinasyonunun faydasını değerlendiren çalışmalarda, daha yüksek OS ve PFS gözlenmiştir ve bu da köpek mast hücreli tümörlerinde bu tedavinin etkinliğini göstermektedir (59). Bu sistematik çalışmanın kısıtlamalarından biri, Diğer + VBL grubu ile karşılaştırmak için yararlı olabilecek prednizon + TKI grubunun olmamasıdır. C-kit mutasyon testi önemli prognostik bilgiler sunmaktadır (8, 58). Bu çalışmada, c-kit mutasyonu olmayan köpeklerin mutasyona sahip köpeklere kıyasla daha yüksek OS’ye sahip olmasına rağmen, bu mutasyonun TKI tedavisi ile birlikte kullanılmasının, sadece vinblastin alanlara kıyasla bu köpeklerin yaşam sürelerini uzattığı açıktır. Bu, TKI’nin c-kit mutasyonu olan vakalarda yüksek terapötik etkiye sahip olduğunu ve c-kit’in mutasyona uğramış formunun inhibisyonunun neoplastik mastositlerin diferansiye olmasını ve hayatta kalmasını azaltabileceğini doğrulamaktadır (53). Vinblastin ve toceranib kullanılarak yapılan daha güncel bir çalışmada, mutasyonun varlığı ile tedaviye yanıt arasında pozitif bir korelasyon gözlenmemiştir, yani ilacın etkinliği mutasyon tarafından etkilenmemiştir. Ancak, bu çalışmada kullanılan metodolojiler yeterince hassas değildi (72) ve ekzon 8 ve 11’in ötesindeki yaygın mutasyonları içermiyordu. Ayrıca, TKI’lerin gerekçesiz kullanımına yol açabilecek toceranib üretiminden sorumlu olan ilaç endüstrisi ile çıkar çatışması yaşamaktadırlar (57). Bu nedenle, c-kit mutasyonu olmayan köpekler de TKI tabanlı tedavi ile iyi sonuçlar gösterebilir. Üstelik, hayvanda bulunan c-kit mutasyonunun türü genel sağkalımı etkilemektedir. |
| Mast hücresi malignitelerindeki ekson 8 ITD mutasyonları, köpeklerde ekson 11 ITD mutasyonlarına göre daha uzun genel sağkalımla sonuçlanmıştır (73). Elde edilen verilerin işaret ettiği bu sonuçlara rağmen, tüm çalışmaların köpek mast hücresi örneklerinde somatik mutasyonların tespiti amacıyla geleneksel polimeraz zincir reaksiyonu (PCR)/sekanslama yöntemlerini kullandığını belirtmek önemlidir. Elde edilen veriler bu metodolojinin sınırlı hassasiyete sahip olduğunu gösterdiğinden bu bir limitasyon olarak düşünülebilir (72, 74). Buna ek olarak, mutasyona uğramış tüm tümörler tek nokta mutasyonlarına değil yalnızca dahili tandem duplikasyonlarına (ITD) dayanmaktadır ve çoğu yalnızca 8 ve 11 numaralı ekzonların sekanslamasını gerçekleştirmiş, 9, 14 ve 17 numaralı ekzonlar gibi yapısal olarak aktive olabilen diğer ekzonlar hakkında bilgi sağlamamıştır (12, 13, 75). Bu nedenle, düşük hassasiyet ve mutant ve mutant olmayan köpek gruplarının rastgele ayrılması nedeniyle, mutant olmayan şeklinde sınıflandırılan köpekler mutasyona uğramış olabilir. Çalışmaların, COLD-PCR gibi c-kit mutasyonlarını daha yüksek hassasiyetle tespit edebilen daha yeni metodolojilerle yürütülmesi önerilmektedir (72). Mevcut çalışmada, VBL ile tedavi edilen köpeklerin TKI ile tedavi edilen köpeklere kıyasla daha yüksek OS’ye sahip olduğu daha önce sunulan verilere göre, tek başına vinblastin tedavisi uygulanan köpeklerin progresyonsuz sağkalımının TKI ile tedavi edilen köpeklere kıyasla daha uzun olduğu gösterilmiştir. Bu durum muhtemelen zaten yüksek bir PFS ile ilişkilendirilmiş olan prednizolonun eşlik etmesinden kaynaklanmaktadır. Bu, TKI tedavisi gören hayvanlar için daha uzun progresyonsuz sağkalım gösterdikleri inhibitörlerle yapılan diğer önceki çalışmalarla çelişmektedir (57). Yeni bir tedavinin piyasaya sürülmek üzere onaylanması için henüz karşılanmamış ihtiyaçları karşılaması veya mevcut tedavilerden daha iyi sonuçlar sağlaması gerektiğinden, bu durum oldukça düşündürücüdür. İyi bir objektif yanıt oranı ve sonuç olarak daha düşük yan etkiler gibi diğer klinik parametreler bu sağkalımı etkilemiş olabilir (8, 59). Vinblastin bazlı tedavi uygulanan hayvan gruplarını diğer kemoterapötiklerle değerlendiren bir çalışmada, bu protokol uygulanan hastaların daha uzun hastalıksız süreye sahip olduğu gözlemlenmiştir (49). Mevcut çalışmada, vinblastin grubu başka bir kemoterapi ajanı ile analiz edildiğinde, inhibitörler ve başka bir kemoterapi ajanı ile tedavi edilen hayvan grubundan daha uzun süreli progresyonsuz sağkalım olduğu görülmüştür (8, 59, 76). Ancak veriler sadece palyatif tedavi uygulanan bir grup köpekten elde edilmiştir, bu nedenle PFS’nin daha düşük çıkması beklenmiştir. Tümör boyutu veya tam remisyon ile belirlenen medyan genel yanıt oranı tedavi türüne göre değişiklik göstermiş, vinblastin tek başına kullanıldığında TKI tedavisine kıyasla daha düşük bir genel yanıt oranı gözlenmiştir. Bu değişkenlik muhtemelen mast hücreli tümörün tipi ve agresifliğinden kaynaklanmaktadır. Kemoterapi esas olarak hücre ablasyonu yoluyla, tirozin kinaz inhibitörleri ise VEGFR2 ve PDGFR’yi inhibe ederek büyüme limitasyonu yoluyla etki göstermekte, antianjiyojenik bir ajan olarak hareket etmekte ve sonuç olarak tümör rejeksiyonuna neden olmaktadır (77). Bu sebeple, agresif ve yüksek proliferatif profile sahip tümörlerde TKI’nin katkısı daha faydalı olabilir. Yine de, yanıt oranı hala rastgele elde edilen bir sonuçtur ve bu sistematik derlemede, genel yanıt oranını daha iyi prognoz faktörü olarak tartışmasız bir şekilde uygulamak için her çalışmada yeterli veri sağlanmamıştır. |
| Bu çalışmada, VBL grubunun TKI grubundan daha iyi OS’ye sahip olması ve TKI grubunun VBL grubuna kıyasla daha fazla ORR klinik faydaya sahip olması bakımından bir tezatlık söz konusudur. Yanıt oranı ve sağkalım arasındaki ilişki karmaşıktır. Bazı yazarlar, progresyon sonrası tedavi geçişi, sonraki tedavilerin sayısı, birinci basamak senaryoda progresyon sonrası uzun sağkalım ve kanserle ilişkili olmayan ölümler gibi karmaşık faktörler nedeniyle ORR ve OS arasında korelasyon olmadığını öne sürmektedir (78). Yeni hedefe yönelik tedavi ajanları, tümörün gerilemesiyle değil hastalığın stabilizasyonuyla sonuçlanabilir, bu nedenle yanıt oranları biyolojik aktivitenin doğru bir şekilde değerlendirilmesinde ve ilacın klinik faydasının öngörülmesinde daha az önemli olabilir. Dahası, yalnızca tümör yanıtı yoluyla sağkalımı tahmin etmek, yanıt oranlarının sayısını belirlemenin ötesine geçmekte, aynı zamanda yanıtların süresini, tam yanıtların sayısını ve yanıtların yerini de belirlemektedir (79). Bu çalışmanın kısıtlamaları arasında sponsor faktörü de yer almaktadır. İlaç kullanımına olumlu sonuç veren çalışmaların %28,5’i (n = 6) sponsorluk almış, %57’si (n = 12) ise herhangi bir çıkar çatışması beyanı sunmamıştır. Veriler, sektör tarafından finanse edilen çalışmaların, sektör tarafından desteklenmeyen çalışmalara kıyasla üretilen ürünün kullanımı lehine daha sık veri sunduğunu göstermektedir (odds oranı 4,05; %95; güven aralığı 2,98-5,51; 18 karşılaştırma) (32, 80). Bir diğer nokta ise, ilaç şirketlerinin finansal desteklerini çekerek olumsuz çalışmalar için sınırlı güç kullanabilmeleridir (81). Bu varsayımla, sonuçlar dikkatle yorumlanmalı ve bu ilaçların klinik etkinliği sektörden finansal destek alınmadan, hatta çoğu çalışmada bulunmayan sponsorluk durumu hakkında bilgi verilmeden daha fazla çalışma ile değerlendirilmelidir. Çalışmalardan elde edilen verilerin örnek standardizasyonu sunmadığını, yani genel verileri elde etmek için hastalar, tümör ve tedavi türü ile ilgili önemli özelliklerin dikkate alınmadığını ve bunun da bu çalışmanın sonucunu etkileyebileceğini vurgulamak önemlidir. |
SonuçSonuç olarak, vinblastin genel sağkalım ve progresyonsuz sağkalım açısından TKI’den daha fazla klinik fayda sağlamıştır. Bununla birlikte, TKI, c-kit mutasyonu olan mast hücreli tümörlerde daha etkilidir. Yine de, bu hastalarda daha fazla etkinlik sağlamak için daha sağlam sonuçlar olmadan, TKI’ler mast hücre tedavisi için ön basamak olarak düşünülmemelidir. |
Veri erişim beyanıÇalışmada sunulan orijinal katkılar makale / Ek materyalde yer almaktadır, daha fazla soru sormak için ilgili yazara başvurabilirsiniz. Katkıda bulunan yazarlarYC veri tabanı aramalarını gerçekleştirmiş ve LS, PS ve CM ile birlikte ana makale metnini yazmıştır. LP, TS ve MS, makalenin arama ve yazım sürecinin yürütülmesinden sorumluydu. Tüm yazarlar makaleye katkıda bulunmuş ve sunulan versiyonu onaylamıştır. FinansmanBu çalışma kısmen Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brezilya (CAPES)- Financial Code 001 tarafından finanse edilmiştir. Ayrıca Conselho Nacional de Desenvolvimento Científico e Tecnológico-Brezilya (CNPq) ve Fundação de Amparo à Pesquisa do Estado de Minas Gerais-Brezilya’nın (FAPEMIG) desteği için minnettarız. Çıkar çatışması beyanıYazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişki olmaksızın yürütüldüğünü beyan etmiştir. Yayıncının notuBu makalede ifade edilen tüm iddialar yalnızca yazarlara aittir ve bağlı oldukları kuruluşların veya yayıncının, editörlerin ve hakemlerin görüşlerini temsil etmek zorunda değildir. Bu makalede değerlendirilebilecek herhangi bir ürün veya üreticisi tarafından ileri sürülebilecek herhangi bir iddia, yayıncı tarafından onaylanmamış veya garanti edilmemiştir. Ek MateryallerBu makaleye ilişkin Ek Materyaller çevrimiçi olarak şu adresten incelenebilir : https://www.frontiersin.org/articles/10.3389/fvets.2023.1188795/full#supplementary-material |
|