Özet
Ağızdan uygulanan günlük kemoterapi, tolere edilebilir maksimum doz kemoterapiyi tolere edemeyen veya başarısız olan köpek popülasyonunda köpek lenfoması için yeni bir tedavi yaklaşımı sunmaktadır. Multisentrik lenfomalı 50 köpeğin minimal yan etkilerle tedavisi için çok ilaçlı bir oral kemoterapi protokolü tasarlanmış ve uygulanmıştır. Protokol, günlük olarak uygulanan oral prokarbazin, prednizolon ve siklofosfamidden (PPC) oluşuyordu. Etkinlik ve toksisite klinik ve laboratuvar verileri ile değerlendirilmiştir. PPC protokolü ile tedaviye kısmi ve tam yanıt veren köpeklerin sırasıyla %24 ve %46’sı ile %70’lik bir genel yanıt oranı elde edilmiştir. PPC protokolüne yanıt (tam veya kısmi) ve yaş, PPCkemoterapisinin başlamasından ölüme kadar geçen süre için prognostik olarak tanımlanan tek faktörlerdi. Genel olarak, protokol çok iyi tolere edilmiş ve yalnızca bir köpek grade 4 trombositopeni nedeniyle protokolün kesilmesini gerektirmiştir. Sekiz köpekte gastrointestinal toksisite kaydedilmiştir, yedisi grade I ve biri grade II toksisitedir. Bu bulgular, sürekli oral kombinasyon kemoterapisinin uygulanmasının, çok merkezli lenfomalı köpeklerde tedavi sürecinde minimum yan etki ile mukayese edilebilir sağkalım süreleri sağlayabileceğini göstermektedir.
ANAHTAR KELİMELER
1 | GİRİŞ
Lenfoma, köpeklerde teşhis edilen en yaygın hematopoetik malignitedir ve tüm neoplazmların %7-%24’ünü oluşturur.1,2 Kemoterapi, hastalığın sıklıkla sistemik seyretmesi nedeniyle tedavinin temel dayanağıdır. En başarılı protokoller genellikle siklofosfamid, doksorubisin, vinkristin ve prednizolon (CHOP)bazlı kombinasyonlardır ve köpeklerin yaklaşık %80’inde etkili bir şekilde tam klinik remisyon sağlar ve ortalama ilk remisyon süresi altı ila 10 aydır.3-6 CHOP bazlı protokollerle tedavi edilen yüksek gradeli lenfoma alt tiplerine sahip köpeklerin ortalama sağkalım süresinin 12-15 ay olduğu bildirilmiştir.3-6 Buköpeklerin çoğuna diffüz büyük B hücreli lenfoma (DLBCL) teşhisi konur.7 Daha yakın zamanlarda, LOPP (Lomustin, vinkristin, prokarbazin ve prednizolon) protokolü gibi alkilleyici zengin protokoller köpeklerde kullanılmıştır;
CHOP tabanlı protokollerde görülen daha düşük yanıt oranları nedeniyle ağırlıklı olarak T hücreli LSA teşhisi konulan köpeklerde, karşılaştırılabilir ortalama sağkalım süresi (MST) 323-507 gündür.8-10 Ne yazık ki, çoğu köpeğin hastalığı sonunda nüks etmekte ve tekrarlayan hastalığa yenik düşmektedir.1,2,11
İlaç direnci sıklıkla hastalığın nüksetmesine neden olur ve köpek lenfomasının tedavisinde karşılaşılan yaygın bir sorundur. ATP-bağlayıcı kaset (ABC) süper ailesinin taşıyıcı proteinlerinin, yani sitostatik ilaçların aktif akışında rol oynayan çoklu ilaç direnci proteinleri ABCB1 (Pglycoprotein, P-gp olarak da bilinir) ve ABCG2 gibi proteinlerin yukarı regülasyonu ile ilişkilendirilmiştir .12 Nükseden veya refrakter hastalık, kemoterapiye dirençli hastaları kurtarma protokolleri ile tedavi ederken klinik anlamda ciddi bir zorluk teşkil etmektedir.13-16 Veteriner literatüründe çeşitli kurtarma protokolleri bulunmaktadır ve nükseden, birinci basamak kemoterapi protokollerine yanıt vermeyen inatçı hastalığı olan veya önceki maksimum doz kemoterapi protokolünü tolere edemeyen hastalarda remisyonu yeniden sağlamak için uygulanmaktadır. Kurtarma protokollerinin çoğu %30-87 arasında genel yanıt oranı sağlamıştır.15-20 Bununla birlikte, kurtarma protokollerinin çoğu 1-3 ay gibi kısa remisyon sürelerine ve orta ila yüksek toksisite profiline sahiptir.11,13,15–25
Bu nedenle, birinci basamak tedavideki ilerlemelere rağmen, nükseden ve refrakter hastalık sorun teşkil etmeye devam etmektedir ve daha az yan etkiye sahip yeni bir kurtarma yöntemi gerekmektedir. PEP-C (Prednisolone, etoposide, procarbazine ve cyclophosphamide) protokolü, nükseden veya refrakter non-Hodgkin lenfoması olan insanlar için kurtarma kemoterapisi yöntemidir ve yanıt oranları oldukça yeterlidir.26-28 Bu çalışmalara dayanarak, PEP-C protokolünün modifiye edilmiş bir versiyonu refrakter veya nükseden lenfoması olan köpeklerde kullanılmak üzere uyarlanmıştır . Etoposid, köpeklerde gösterilen zayıf oral biyoyararlanım nedeniyle protokolümüzden çıkarılmıştır.14 Bu çalışmada kullanılan prokarbazin, prednizolon ve siklofosfamid kemoterapi protokolü (PPC), mikroçevre ve anjiyogenez yoluyla tümörün ortamını hedeflemek için siklofosfamidin metronomik kullanımına ek olarak ABC protein süper ailesinin dirence aracılık etmemiş olabileceği alkilleyici ajanları kullanmaktadır.28-30 Bu protokolün, daha düşük toksisite profiline ek olarak refrakter ve nükseden köpek lenfomasında etkili olacağı varsayılmıştır.
2.1 | Hasta Popülasyonu
2009 ve 2019 yılları arasında, PPC protokolü ile tedavi edilen köpeklerin tıbbi kayıtları üç özel veteriner uzman hastanesinden geriye dönük olacak şekilde toplanmıştır: Queensland Veterinary Specialists, Brisbane, Queensland, Avustralya, Veterinary Specialist Services, Brisbane, Queensland, Avustralya ve Animal Referral Hospital, Brisbane, Queensland, Avustralya. Köpekler, kayıtlarda sertifikalı bir patolog tarafından histolojik veya sitolojik olarak doğrulanmış lenfoma tanısı, hastalığın hızlı klinik progresyonu, yani 4 haftalık bir süre içinde periferik lenfadenopati ve aşağıdakilerden herhangi biri: önceki kemoterapi protokolünün tamamlanmasının ardından hastalığın nüksetmesi, mevcut kemoterapi tedavisi sırasında hastalığın nüksetmesi, mevcut yüksek doz kemoterapi protokolüne ciddi toksisite veya sahibinin enjekte edilebilir kemoterapi yerine oral kemoterapiyi tercih etmesi halinde çalışmaya dahil edildi. Hariç tutma kriterleri arasında epitelyotropik lenfoma, düşük gradeli veya indolent lenfoma tanısı olan köpekler yer almıştır. Ayrıca, tedaviden 4 haftadan daha uzun bir süre önce sevk eden veteriner hekim tarafından kaydedilen ve hastalığın yavaş klinik ilerlemesi olduğu belgelenen köpekler de indolent veya düşük gradeli hastalığı olduğu düşünülen köpeklerden çıkarılmıştır. Tedavi öncesi prednizolon, L-asparaginaz veya herhangi bir önceki kemoterapi protokolü veya ajanı kullanılmış olan köpekler hariç tutulmamıştır.
Kaydedilen veriler arasında belirtiler, ağırlık, lenfoma immünofenotipi, lenfoma evresi ve alt evresi (sınıflandırma Dünya Sağlık Örgütü evreleme kriterlerine göre yapılmıştır), sitoloji veya
histopatoloji sonuçları veya her ikisi ve akış sitometrisi sonuçları yer almıştır. Lenfomanın histolojik sınıflandırması Valli ve arkadaşlarına göre kurul onaylı patologlar tarafından yapılmıştır.31 Önceki kemoterapi protokolleri, önceki kemoterapi protokollerinin sayısı, önceki protokollere yanıt, PPC protokolüne yanıt, PPC protokolünde geçirilen süre, takibi kaybedilenler ile PPC protokolünün toksisitesi dahil olmak üzere diğer önemli klinik bilgiler de kaydedilmiştir.
2.2 | Evreleme
Lenfomanın ilk tanısında evreleme; fizik muayene, kan yayması ile birlikte tam kan sayımı (CBC), çoklu biyokimyasal analiz (MBA), lateral toraks grafisi, abdominal ultrason ve idrar tahlili ile yapılmıştır. Tüm sonografik incelemeler onkoloji veya tıp bölümünden klinisyenler tarafından gerçekleştirilmiştir. Ultrason görüntüleri değerlendirilmiş ve ilgili rapor hastanın dosyasına kaydedilmiştir. IV. evre hastalık ya önceki literatüre göre lenfoma için pozitif kabul edilen karaciğer ve dalağın homojenliği ve ekojenitesindeki değişiklikler şeklinde kaydedilen ultrasonografik sonuçlara ya da seçilmiş vakalarda karaciğer veya dalağın ince iğne aspirat biyopsisinden (İİAB) alınan sitoloji sonuçlarına göre belirlenmiştir.32,33 V. evre hastalık, sertifikalı bir patolog tarafından periferik kanda dolaşan anormal lenfositlerin doğrulanmasıyla belirlenmiştir. Klinisyen veya hasta sahibinin tercihi nedeniyle tüm hastalarda tam evreleme yapılmamıştır ve hastalara mevcut bilgilere göre bir evre atanmıştır.
PPC protokolünün başlangıcındaki temel değerlendirme fizik muayene, kan yayması ile CBC, Çoklu Biyokimya Analizi (MBA) ve idrar tahlili ile yapılmıştır. Periferik lenf nodları kaliperlerle ölçülmüştür. Tekrarlanan evreleme testlerinde torasik radyografiler ve abdominal ultrason vardı, ancak PPC protokolünün yeniden başlatılması sırasında tüm hastalarda tam evreleme yapılmamıştı.
2.3 | Tedavi Protokolü
PPC protokolünde aşağıdaki ilaçlar oral yolla uygulanmıştır: Siklofosfamid (sikloblastin, 24 saatte bir 12,5-15 mg/m2 oral), prokarbazin (Natulan, 24 saatte bir 50 mg/m2 oral) ve azalan dozda prednizolon (Makrolon) (7 gün boyunca 24 saatte bir 30 mg/m2 oral, daha sonra 7 gün boyunca 24 saatte bir 20 mg/m2 oral, ardından 24 saatte bir 10 mg/m2 oral). Daha önce kaydedilen vakalarda prokarbazin 50 mg kapsülle sınırlı olduğundan, sekiz vaka dışında tüm vakalarda en yakın 5 mg’a kadar bileşik prokarbazin kullanılmıştır. Siklofosfamid kapsülleri gerekli dozda bileşik haline getirilmiştir (BOVA bileşik).iv Doz azaltmaları, tipik olarak grade IV toksisite şeklinde görülen yan etkiler nedeniyle klinisyenin takdirine bağlı olarak gerçekleştirilmiştir. Hafif yan etkiler için genellikle yüzde on doz azaltımı yapılırken, orta ila şiddetli yan etkiler için yüzde 20 doz azaltımı yapılmıştır. Nötrofil sayısı 2000 hücre/μl’nin altına düştüğünde veya trombositler 75 000/μl’nin altına indiğinde 2-7 günlük doz ertelemesi yapılmıştır.
Köpekler, osteoartriti tedavi etmek için klinik olarak gerekli görülürse ve bunun yerine bir NSAİİ (nonsteroid antiinflamatuar) ilaç gerektirirse, protokol sırasında prednizolondan frusemide geçirilmiştir.
Tedaviye alınan yanıt, PPC protokolüne başlandığı sırada viseral hastalık kanıtı olan hastalarda ultrasona ek olarak periferik lenf düğümlerinin ölçüldüğü fizik muayene ile değerlendirilmiştir. Her bir lenf nodu kaliper ile ölçülmüş ve en büyük çapın büyüklüğü kaydedilmiştir. Tüm sonografik incelemeler PPC’ye başlamadan önce onkoloji bölümünden aynı iki klinisyen tarafından gerçekleştirilmiştir. Her gözlemci ultrason görüntülerini ve bir önceki değerlendirmenin yazılı raporunu değerlendirmiş ve önceki literatüre uygun olarak karaciğer ve dalağın homojenliği ve ekojenitesindeki değişiklikleri not etmiştir.32,33
Tedaviye yanıt üçüncü tekrar kontrolde veya 29. günde, daha sonra her 4 haftada bir, klinik ilerleme belirtileri belgelenmişse daha erken kaydedilmiştir. Yanıtlar, insanlarda kullanılan ve güncellenmiş RECIST kriterlerine göre, tam yanıt (CR), tüm ölçülebilir klinik hastalığın iyileşmesi; kısmi yanıt (PR), ölçülebilir klinik hastalığın en az %50 azalması, ancak %100’den daha az iyileşmesi; stabil hastalık (SD), hastalığın %50’den daha az azalması, aynı zamanda ölçülebilir hastalıkta %25’ten fazla artış olmaması veya klinik hastalık belirtisi olmaması; ve progresif hastalık (PD), ölçülebilir hastalıkta %25’ten fazla artış olması şeklinde kaydedilmiştir.34,35 Köpeklerde periferal nodal lenfoma için güncellenmiş yanıt değerlendirme kriterleri (v1.0), birçok vaka bu konsensüs belgesi yayınlanmadan önce başlatıldığı için kullanılmamıştır.36
2.5 | Toksisitenin değerlendirilmesi
Gastrointestinal ve hematolojik toksisiteler, Veteriner Onkoloji Grubu Yan Etkiler için Ortak Terminoloji Kriterleri (v1.0) ile uygulanan terminolojiye göre değerlendirilmiş ve derecelendirilmiştir.37 Hasta kayıtları ve kan sonuçları, gastrointestinal toksisite (bulantı, iştahsızlık, kusma veya ishal) ve miyelosupresyon (nötrofiller, trombositler ve kırmızı kan hücreleri) dahil olmak üzere yan etki bulguları açısından retrospektif olarak incelenmiştir.
2.6 | İstatiksel yöntemler
İlk lenfoma teşhisi ile PPC kemoterapi protokolünün başlaması arasında geçen süre birincil yanıt süresi (PRD) olarak tanımlanmıştır. PPC protokolündeki köpekler için progresyonsuz geçen süre (PFI), PPC protokolünün başlatılmasından PD kaydedilene kadar geçen süredir. PPC kemoterapisinin
başlamasından ölüme kadar geçen süre ikincil yanıt süresi (SRD) şeklinde tanımlanmıştır. Bu, klinik olarak ilerleyen hastalığı olanlar da dahil olmak üzere PPC protokolündeki köpeklerin toplam süresine eşittir. Sağkalım süresi (ST), lenfoma tanısından hastanın ölümüne kadar geçen süre olarak tanımlanmış ve çalışmanın sonlanım noktası olarak belirlenmiştir. Takibi kaybedilen vakalar, kaydedilen son ziyaretten sonra sağdan sansürlü veri olarak kabul edilmiştir.
Tek değişkenli analizde dikkate alınan hastayla ilgili değişkenler arasında yaş, cinsiyet (erkek vs dişi), kısırlık durumu (kısırlaştırılmamış vs kısırlaştırılmış), immünofenotip (B vs T) ve alt tip (a vs b) yer almıştır. Analizde dikkate alınan tedaviyle ilgili değişkenler arasında yanıt (CR vs. PR vs. SD vs. PD), toksisite ve PPC ve PRD’nin başlangıcında eş zamanlı L-asparaginaz kullanımı yer almaktadır.
PPC protokolüne önceden kemoterapi almadan başlayan köpekler istatistiksel analizden çıkarılmış, ancak tanımlayıcı sonuçlara dahil edilmiştir. Sağkalım fonksiyonları log-rank testi kullanılarak gruplar arasında karşılaştırılmıştır.38 Sağkalım süreleri %95 kesin binom güven aralıkları ile hesaplanmıştır.
İkincil yanıt süresi (SRD) ile ilişkili risk faktörlerini belirlemek için Cox regresyonu kullanılmıştır.38 Cox regresyonunun
kullanılmasında temel varsayım olan orantılı odds varsayımı her bir risk faktörü için değerlendirilmiştir. Tek değişkenli analizde p <.05 düzeyinde anlamlı olan risk faktörleri çok değişkenli cox regresyon modelinde dikkate alınmıştır. Çok değişkenli cox regresyon modelini oluşturmak için bir ileri seçim prosedürü kullanılmış ve p <.05 düzeyinde anlamlı olan risk faktörleri nihai modelde kalmıştır. İkiden fazla düzeyi olan kategorik risk faktörleri için p-değeri Wald testi kullanılarak hesaplanmıştır.38 İstatistiksel analiz Stata (Sürüm 16, StataCorp) kullanılarak gerçekleştirilmiştir.
3 | SONUÇLAR
3.1 | Hasta çalışma grubu
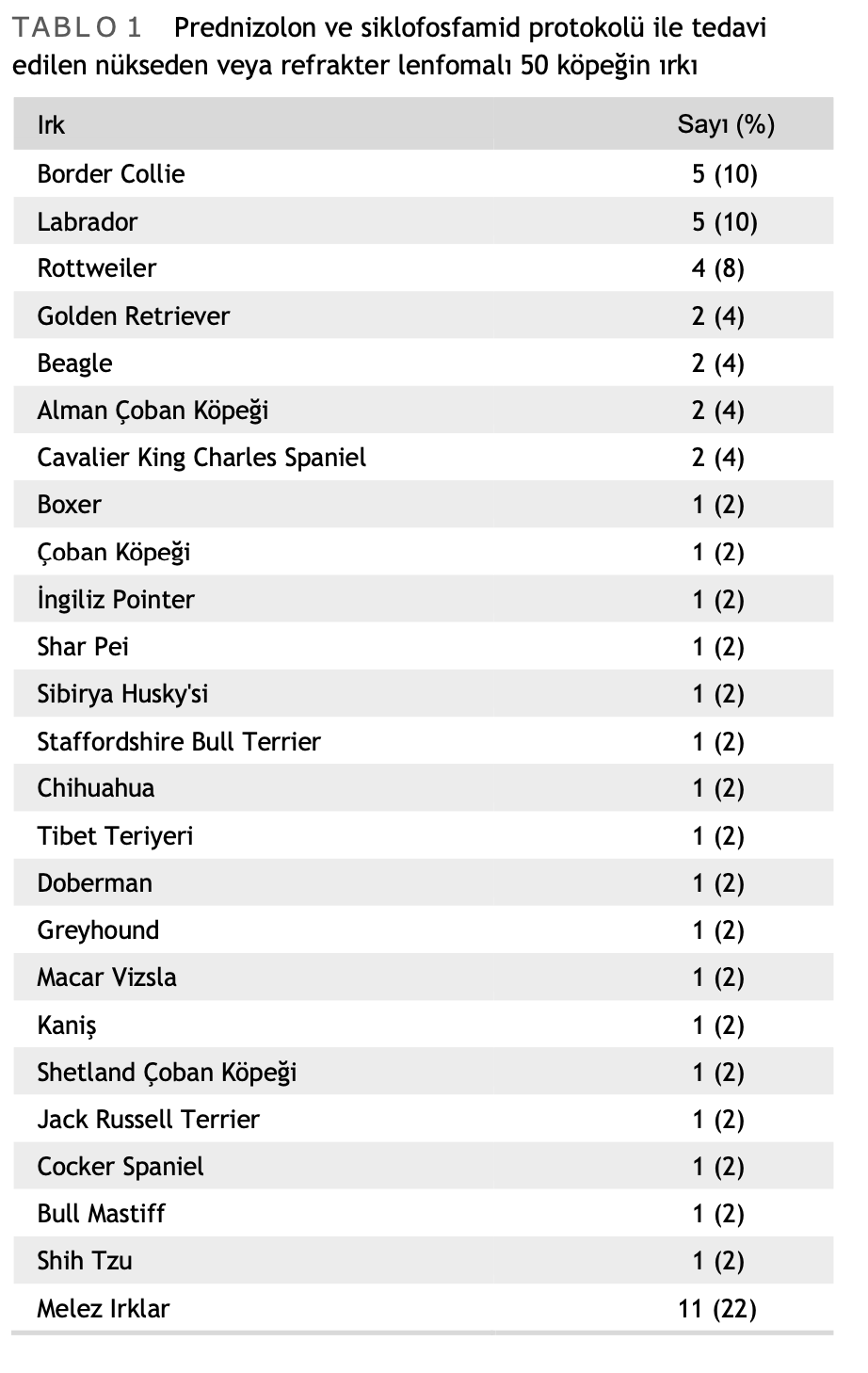
PPC oral kombinasyon kemoterapi protokolü ile tedavi gören doğrulanmış lenfomalı 50 köpek çalışmaya dahil edilmiştir. Ortalama yaş 8 yıl (2-16 yıl) olup köpeklerin 26’sı (%52) kısırlaştırılmış erkek, 20’si (%40) kısırlaştırılmış dişi, üçü (%6) kısırlaştırılmamış erkek ve biri (%2) kısırlaştırılmamış dişi idi. Lenfomanın ilk teşhisinde, bir köpek (%2) II. evre, 16 köpek (%32) III. evre, 24 köpek (%48) IV. evre ve dokuz köpek (%18) V. evre idi. Otuz dokuz köpek (%78) alt evre a ve 11 köpek (%22) alt evre b olarak kaydedilmiştir. 25 farklı ırk bulunmaktadır (Tablo 1), en yaygın olanları Border Collie, Labrador ve Rottweiler’dır.
Çalışmadaki 50 köpeğin 38’inde histopatoloji ile lenfoma tanısı konmuştur.31,39 On iki köpekte sitoloji ile büyük hücreli lenfoma tanısı konmuştur. Başlangıçta sitoloji ile tanı konulan bir köpeğe, başlangıçta görülen ciddi lösemi nedeniyle ek olarak kanda akış sitometrisi uygulanmıştır. Bu çalışma sırasında akış sitometrisine büyük ölçüde ulaşılamamıştır. İmmünofenotip 47 köpekte belirlenmiştir: 39 (%78) köpek B hücresi fenotipine ve sekiz (%16) köpek T hücresi fenotipine sahipti. İmmünofenotip 38 (%76) köpekte immünohistokimyasal boyalarla ve dokuz (%18) köpekte immünositokimya ile belirlenmiştir. Sitoloji ile tanı konulan üç köpeğin immünofenotipi bilinmiyordu. Bir köpekte ise teşhis immünositokimyanın mevcut olmasından önce konmuştur.
3.2 | Önceki tedaviler
Önceki kemoterapi protokolleri arasında CHOP tabanlı bir protokol; CEOP (Siklofosfamid, epirubisin, vinkristin ve prednizolon); LOPP tabanlı bir protokol; tek ajan doksorubisin; tek ajan CCNU; DMAC (Aktinomisin-D, melfalan, sitozin arabinosid) veya tek ajan temozolomid yer almıştır.8,9,18,19,22,40,41 Çalışmaya dahil edilen 37 köpek (%74) CHOP tabanlı bir protokol ile başlangıç tedavisi almıştır. Bu köpeklerden otuz beşinin B hücre fenotipine sahip olduğu doğrulanmıştır. Bir köpek CEOP protokolü ile tedavi edilmiştir. CHOP temelli protokole başlayan 37 köpekten 8’i (%49) protokolü tamamlamıştır. İlk CHOP tabanlı protokolü tamamlayan 18 köpekten dördü ikinci bir CHOP tabanlı protokole başlamıştır.
İkisi protokolü tamamlamıştır; biri üçüncü bir CHOP tabanlı protokol, diğeri ise tek ajan doksorubisin protokolü almıştır. İkinci CHOP temelli protokolde PD görülen bir köpek tek ajan CCNU ile kurtarılmıştır. İlk CHOP tabanlı protokolü tamamlayan üç köpek en az bir tane başka kurtarma protokolü ile kurtarılmıştır; birine LOPP tabanlı bir protokol ve ardından DMAC, ikisine ise tek ajan CCNU uygulanmıştır.
Köpeklerin yüzde elli biri (n = 19) başlangıç testini tamamlamamıştır. CHOP tabanlı protokol, başlangıçtan itibaren ortalama 9 hafta sonra ortaya çıkmıştır. Dört köpek, tolere edememe ve grade III-IV gastrointestinal toksisiteler nedeniyle CHOP protokolünden doğrudan PPC protokolüne geçirilmiştir. CHOP protokolüne başlayan bir köpek, T hücre fenotipinin doğrulanmasının ardından 1 hafta sonra LOPP protokolüne geçirilmiştir. İlk CHOP temelli protokolde PD görülen 19 köpekten yedisi ikinci bir kurtarma protokolü almıştır. Beşi LOPP tabanlı bir protokolle ve ikisi tek ajan CCNU ile kurtarılmıştır. Hiçbir köpek son kurtarma protokollerini tamamlamamış ve PPC kemoterapi protokolüne geçmemiştir.
Çalışmadaki beş köpek, T hücre fenotipinin doğrulanmasının ardından LOPP protokolü ile başlangıç tedavisi almıştır. İki köpek (%40) protokolü tamamlamıştır. Bir köpek grade IV nötropeniyi takiben tek ajan CCNU’ya değiştirildi ve bir köpek de grade IV trombositopeni nedeniyle protokolü bıraktı ve kemoterapiden 9 ay sonra düzeldi. Kalan köpek, iki haftalık sadece vinkristin uygulaması sırasında PD belgelendiğinde doğrudan PPC’ye değiştirilmiştir. CHOP’a başlayan ancak T hücre fenotipinin doğrulanmasıyla LOPP’ye değiştirilen köpek bu protokolü tamamlamıştır. Bu köpek ilerleyici hastalık doğrulandığında PPC’ye değiştirilmiştir.
İki köpek indüksiyon protokolü olarak tek ajan doksorubisin almıştır. Her iki köpek de PD kaydedildiğinde PPC’ye geçmeden önce protokolü tamamlamıştır. Altı köpek (%12) PPC kemoterapi protokolünden önce kemoterapi almamıştır. Bunlardan üçü B hücresi fenotipine ve üçü T hücresi fenotipine sahipti, kalan iki köpeğin immünofenotipi belirlenmemişti. PPC protokolünün başlangıcında, 50 köpekten 19’u (%38) klinik bulgulara veya başlangıçtaki kemik iliği hastalığına bağlı olarak bir doz L-asparaginaz almıştır.
3.3 | İstatiksel veriler
3.3.1 | Birincil tepki süresi
Birincil tepki süresi 44 köpekte değerlendirilmiştir; altı köpek tanı konulduğu gün PPC kemoterapisi almış ve değerlendirme dışı bırakılmıştır. Analiz edilen 44 köpekte daha önce uygulanan kemoterapi protokollerinin ortalama sayısı 1,45 ve PPC protokolünün başlamasına kadar geçen ortalama süre 197 gündü (%95 CI: 131-250). Köpeklerin %55’i (n = 24) PPC protokolüne ilk tanıdan sonraki 200 gün içinde başlarken, 300 günden fazla PRD’ye sahip köpeklerin oranı %27’dir. Birincil yanıt süresinin Kaplan Meier eğrisi Şekil S1’de gösterilmektedir.
3.3.2 | Tepki oranı
PPC protokolündeki tüm köpekler incelendiğinde, sırasıyla 12 köpek (%24) ve 23 köpekte (%46) PR ve CR olmak üzere %70’lik bir genel yanıt oranı elde edilmiştir. Yedi köpekte (%14) SD kaydedilerek %84’lük bir biyolojik yanıt oranı elde edilmiştir. Sekiz köpekte (%16) PPC protokolü ile tedaviye rağmen hastalığın ilerlediği belgelenmiştir. Daha önce kemoterapi tedavisi almış 44 köpek incelendiğinde, tanı anında PPC’ye başlayan köpekler hariç tutulduğunda, 12 köpekte (%27) PR ve 18 köpekte (%41) CR olmak üzere %84’lük bir biyolojik yanıt oranıyla benzer bir yanıt kaydedilmiştir. Daha önce kemoterapi almamış olan altı köpekten beşinin (%83) CR elde etmesiyle daha yüksek yanıt elde edilmiştir, ancak bu durum ileri değerlendirmede istatistiksel olarak anlamlı bulunmamıştır.
3.3.3 | Progresyonsuz geçen süre (PFI)
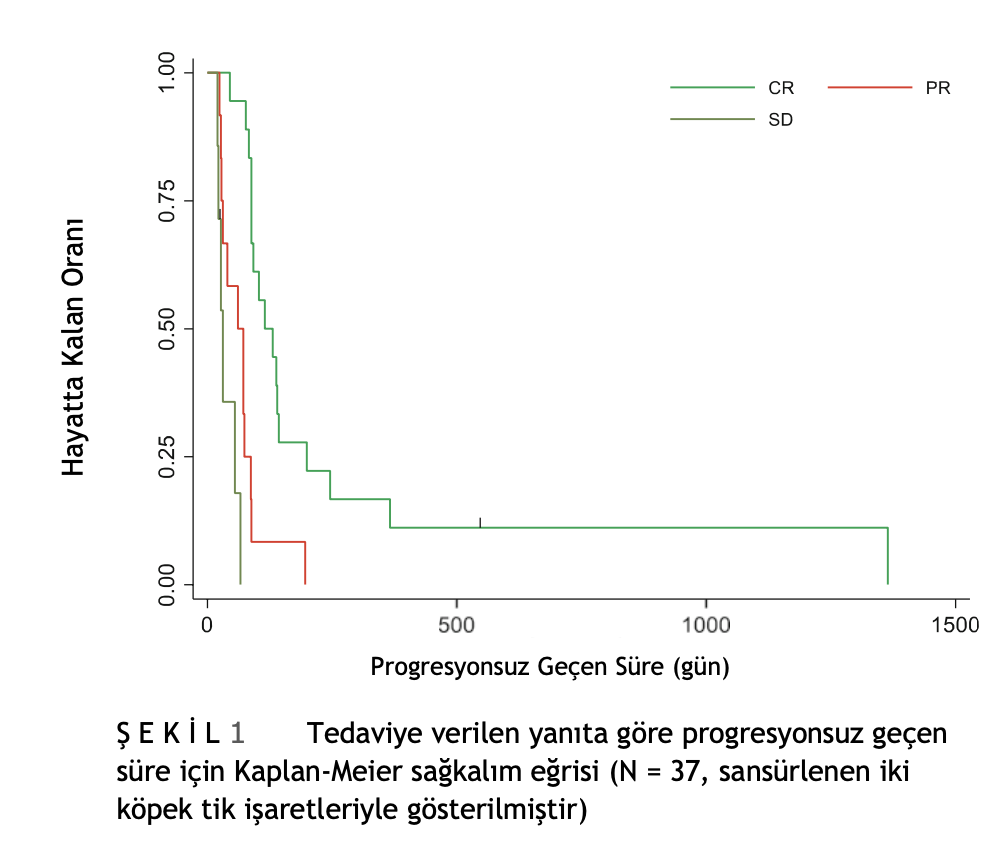
PPC protokolünde CR, PR veya SD elde eden 37 köpek için ortalama progresyonsuz geçen süre 87 gündü (%95 GA: 61-92). Yanıta bağlı olarak PFI’da istatistiksel olarak anlamlı bir fark vardı (Log rank testi p değeri <.001): ortalama progresyonsuz geçen süre CR için 115 gün (%95 GA: 88-143), PR için 61 gün (%95 GA: 27-87) ve SD için 31 gündü. Tedaviye CR ve PR yanıtlarının progresyonsuz geçen süre bakımından Kaplan Meier Eğrisi Şekil 1’de gösterilmiştir.
3.3.4 | İkincil tepki süresi
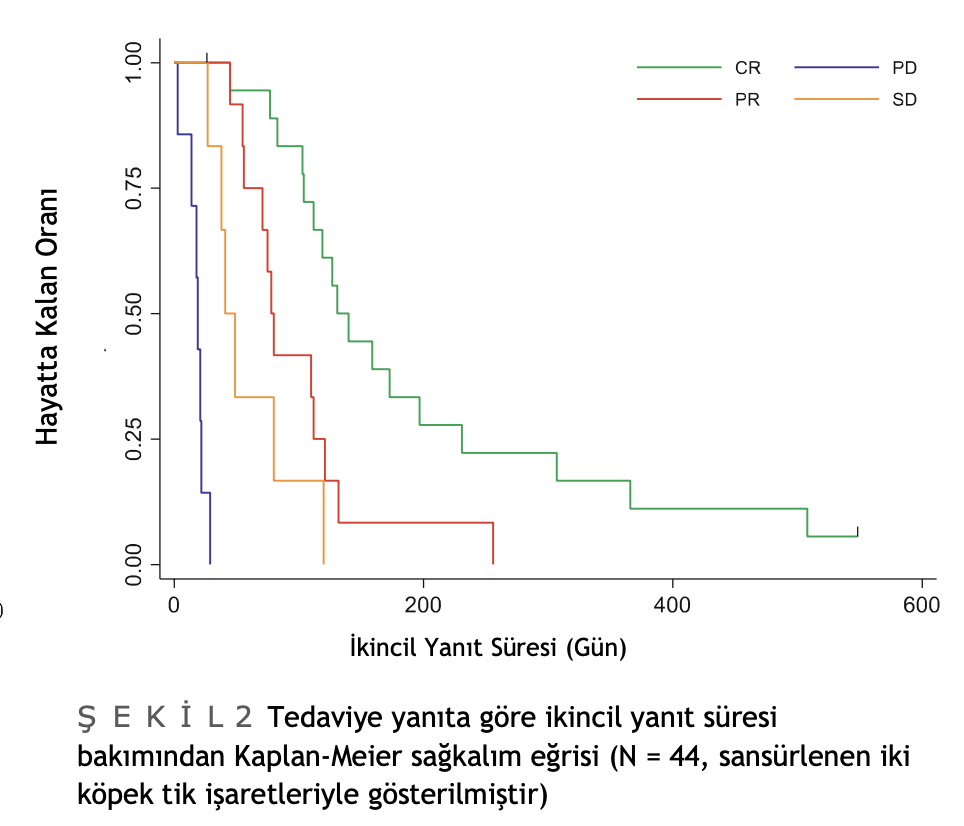
Diğer MTD protokollerini takiben PPC kemoterapisi alan 44 köpek için ortalama ikincil tepki süresi 83 gündü (%95 GA: 56-119) (Şekil S2). PPC protokolüne verilen tepkiye bağlı olarak SRD’de istatistiksel olarak anlamlı bir fark vardı (Log rank testi p değeri
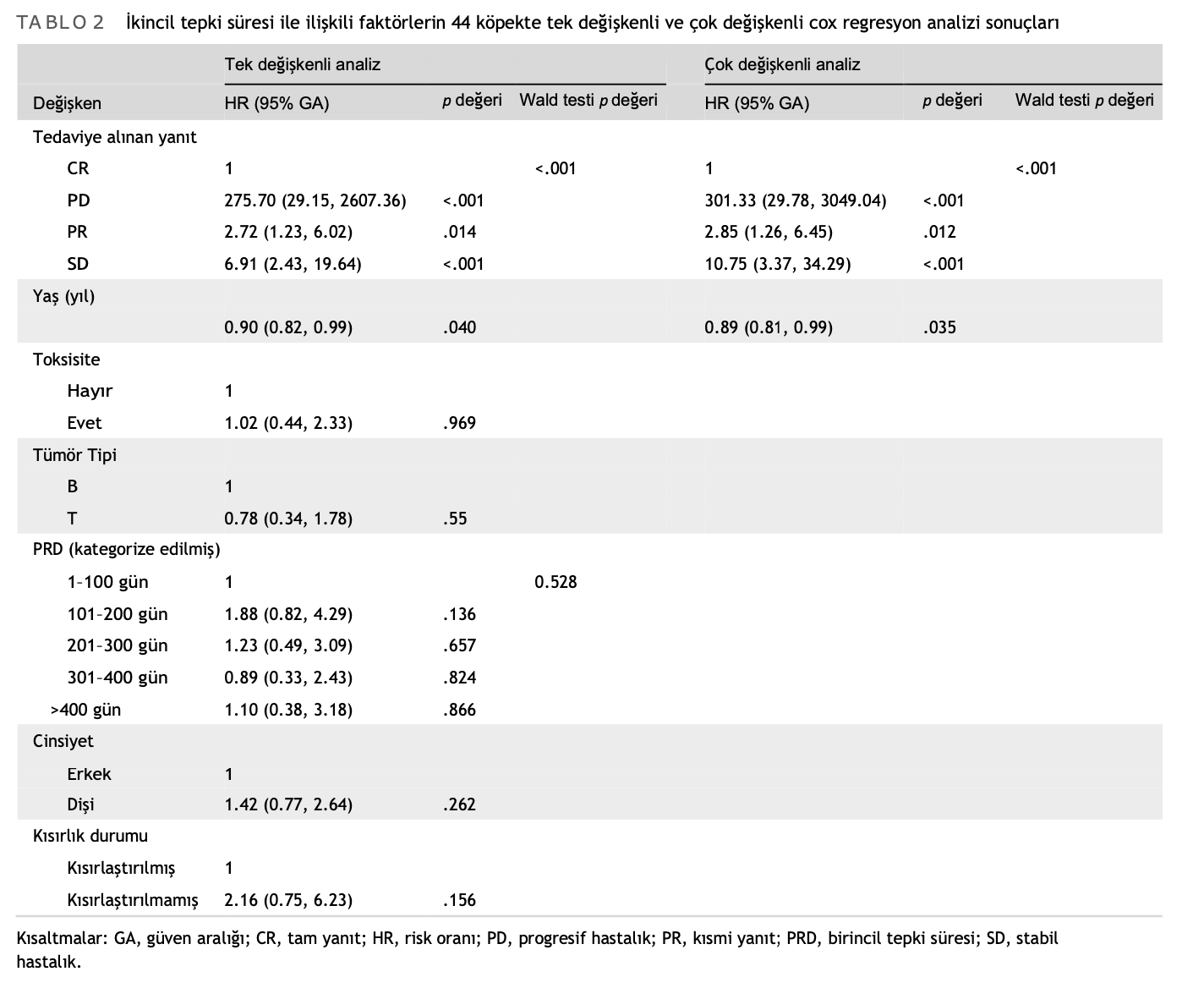
<.001): PD (n = 7), SD (n = 7), PR (n = 12) ve CR (n = 18) için ortalama SRD sırasıyla 19 gün (%95 GA: 3-22), 41 gün (%95 GA: 27, mevcut değil), 78 gün (%95 GA: 55-121) ve 131 gün (%95 GA: 104-197) idi. PPC’ye verilen tepkiye göre SRD açısından Kaplan Meier Eğrileri Şekil 2’de görülmektedir. Yaş ile SRD arasında da anlamlı bir korelasyon bulunmuştur (ρ = .3288, p = .0293) (Şekil S3). PRD ile SRD arasında korelasyon bulunmamıştır (ρ = .0034, p = .9826) (Şekil S4). PPC protokolünün başlangıcında eş zamanlı L-asparaginaz kullanımının SRD üzerinde hiçbir etkisi olmamıştır ve tedaviye yanıtı istatistiksel olarak etkilememiştir (sonuçlar gösterilmemiştir). Nihai çok değişkenli modelde sadece yaş ve PPC’ye yanıt SRD ile ilişkilendirilmiştir (Tablo 2).
3.3.5 | Sağkalım Süresi
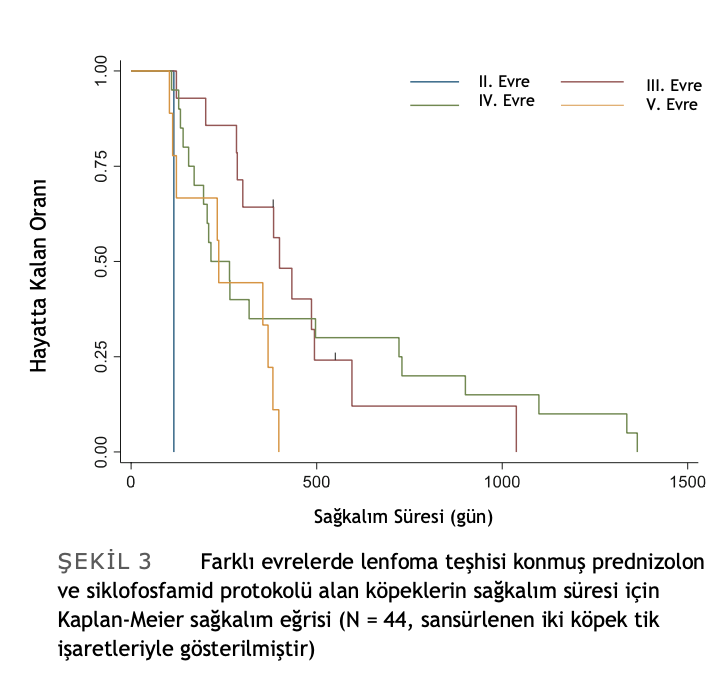
Önceden kemoterapi tedavisi görmüş 44 köpek için ortalama sağkalım süresi 286 gündü (%95 GA: 209-382). Başlangıçta IV. ve V. evre hastalık teşhisi konulan köpeklerin sağkalım süreleri III. evreye kıyasla istatistiksel olarak anlamlı derecede daha kısaydı (Log rank testi p değeri = .0038). III (n = 14), IV (n = 20) ve V (n = 9) evreleri için MST sırasıyla 400 gün (%95 GA: 284-494), 215 gün (155, 722) ve 236 gün (%95 GA: 103-382) idi. Sadece bir köpek II. evrede kaydedilmiş ve 115 gün hayatta kalmıştır. Bu köpeğe periferik T hücreli lenfoma teşhisi konmuş ve daha önce kemoterapi kullanmadan PPC protokolüne başlamıştır. Lenfomanın farklı evreleri için lenfoma tanısından hasta ölümüne kadar Kaplan-Meier sağkalım eğrileri Şekil 3’te gösterilmiştir.
MST, alt evre a veya b ile getirilen köpekler (Log rank testi p değeri = .1678) (Şekil S5) veya B veya T hücre immünofenotipine sahip köpekler (Log rank testi p değeri = .6873) (Şekil S6) arasında istatistiksel olarak anlamlı bir farklılık göstermemiştir. B hücresi (n = 36) ve T hücresi (n = 7) için MST sırasıyla 301 (%95 GA: 232-398) ve 140 (%95 GA: 112-1038) idi.
PPC’nin başlamasından önce alınan protokol sayısı için MST’nin istatistiksel olarak anlamlı bir farka sahip olmadığı bulunmuştur (Log rank testi p değeri = .7796 (Şekil S7). Bir protokol alan köpekler (n = 28) için MST 286 (%95 GA: 201-384) ve iki protokol alan köpekler (n = 10) için 215 (%95 GA: 109-398) idi. Üç (n = 3) ve dört (n = 2) protokol alan köpekler için MST sırasıyla 497 gün ve 232 gündü. İlerleyen hastalık nedeniyle klinik rahatsızlık belirtileri görüldüğünde, tüm vakalarda sahipleri ötenazi talebinde bulunmuştur. Takibi yapılamayan iki vakanın sonucu bilinmiyordu. Bir köpek 25. günde yeniden kontrol edilmiş ve bir sonraki planlanan yeniden kontrol için geri gelmemiştir, diğeri ise taşınma nedeniyle 547. günde PPC’yi bırakmıştır.
3.4 | Toksisite
PPC protokolü ile ilişkili 12 toksisite olayı kaydedilmiştir. Sekiz
gastrointestinal toksisite (tümü ishal) görülmüş olup bunların yedisi grade I ve biri grade II idi. Gastrointestinal toksisite, ishal için
klinisyenin tercihine göre metronidazol (Aventis, her 12 saatte bir 10 mg/kg oral) veya loperamid (Johnson & Johnson, her 12 saatte bir 0,1 mg/kg oral) ile tedavi edilmiştir. PPC protokolünün kesilmesini gerektiren bir grade IV trombositopeni vakası kaydedilmiştir. Bu hasta 8 hafta sonra hastalığın belirgin şekilde ilerlemesi, hematokezi ve anemi nedeniyle ötenazi ile uyutulmuştur. Bu köpek LOPP tabanlı bir protokolle ön tedaviye tabi tutulmuş ve LOPP tabanlı protokolün kesilmesini gerektiren grade IV nötropeni ve grade IV trombositopeni geçirmiştir. LOPP tabanlı protokolden kaynaklanan toksisiteler PH tanısı konmadan ve PPC protokolüne başlanmadan önce çözülmüştür. Hiçbir hematüri vakası kaydedilmemiştir, bu da protokol süresince hiçbir köpekte steril hemorajik sistit vakası olmadığını göstermektedir. PPC protokolü ile tedavi edilirken başka hiçbir tedavi gecikmesi veya kesilmesi kaydedilmemiştir.
4 | TARTIŞMA
Bu çalışmada, köpek (varsayılan) yüksek gradeli lenfomasının tedavisinde PPC kemoterapi protokolünün kullanımı araştırılmış ve özellikle nükseden veya refrakter hastalığa odaklanılmıştır. PPC protokolünü önceki köpek lenfoması kurtarma protokolleriyle karşılaştırmak, kontrol edilmeyen birçok değişken olduğu için zordur, ancak genel yanıt oranı ve yanıt süresi daha önce bildirilenlerle karşılaştırılabilir bulunduğundan, PPC protokolünün çok daha düşük toksisite profiline sahip alternatif bir kurtarma protokolü olabileceği düşünülmektedir.13,15-19,21,25,42 Elde edilen yanıt oranları, daha önce kemoterapi tedavisi görmemiş küçük köpek kohortu için de benzerdir ve enjekte edilebilir kemoterapiyi sürdürmek istemeyen sahipler için bir alternatif olabilir.
Bu çalışmada daha önce kemoterapi almış olan köpek popülasyonu indüksiyon protokollerine düşük yanıt vermiştir, 286 günlük MST literatürde bildirilen 12-15 aydan daha kısadır.3-9,43,44 Bu kısmen CHOP veya LOPP tabanlı protokollere karşı doğal direnci olan köpek popülasyonunu yansıtmaktadır.3-9,43,44 B hücreli LSA’lı köpeklerin sadece 18/35’i (%51) CHOP tabanlı protokole tam klinik yanıt vermiştir ve LOPP tabanlı protokolle tedavi edilen T hücreli LSA’lı altı köpekten üçü (%50) tam klinik yanıt vermiştir. Bu, CHOP tabanlı protokollerle tedavi edilen yüksek gradeli B hücreli lenfomalı köpeklerde veya LOPP tabanlı protokolle tedavi edilen yüksek gradeli T hücreli lenfomalı köpeklerde bildirilen klinik yanıttan daha azdır ve sırasıyla yaklaşık %85 ve %87’dir.3 -6,8,9,43,44 Bu durum, indüksiyon protokolü sırasında toksisite gelişmeyen köpeklerde doz yoğunluğundaki eksikliği yansıtıyor olabilir, ancak CHOP tabanlı bir protokole başlayan dört köpek (%11) ve LOPP tabanlı bir protokole başlayan iki köpek (%33) grade III ve IV toksisiteler nedeniyle doğrudan PPC protokolüne geçirilmiştir.
PPC protokolünde alkilleyici ajanların kullanımı ile, büyük olasılıkla çoklu ilaç direnci proteinleri ABCB1 ve ABCG2 veya diğer proteinlerin aşırı ekspresyonu yoluyla doğal dirence sahip olan bir köpek popülasyonunda direnci en aza indirmek amaçlanmıştır.45 Daha önce CHOP tabanlı bir protokol almış olan köpeklerin,
muhtemel O6-metilguanin-DNA metiltransferaz (MGMT) ekspresyonu nedeniyle daha önce LOPP tabanlı bir protokol veya CCNU ile tedavi görmüş köpeklere göre sağkalım avantajına sahip olacağı varsayılmıştır. MGMT ekspresyonu köpek lenfoma hücrelerinde lomustin direnci ve muhtemelen prokarbazin ile ilişkilidir.46,47 Bununla birlikte, B hücreli lenfomalı köpeklerde T hücreli lenfomalılara göre istatistiksel olarak anlamlı bir sağkalım avantajı bulunmamıştır. Bu durum, PPC protokolüne başlamak için daha dirençli bir B hücreli lenfoma popülasyonunun seçildiğini ya da T hücreli lenfomalı köpeklerin popülasyon büyüklüğünün, T hücreli LSA’lı köpeklerin çoğu PPC protokolünden önce zaten bir alkilleyici ajan aldığı için sağkalım dezavantajını tespit etmek için çok küçük olduğunu yansıtıyor olabilir.
PPC protokolü, lenfomalı köpeklerin tedavisi için metronomik siklofosfamid içermektedir. Metronomik kemoterapi, sitotoksik ilaçların MTD’den daha düşük bir dozda uzun bir süre boyunca düzenli olarak verilmesi şeklinde tanımlanmaktadır.48 İnsan literatüründe metronomik kemoterapi, refrakter veya tekrarlayan lenfoma tedavisinde varsayılan anti-anjiyojenik etkisi nedeniyle kullanılmıştır.26,48-51 Köpeklerde düşük doz sürekli oral metronomik kemoterapinin temel etki mekanizması, vasküler endotelyal büyüme faktörü salgılanması ve trombospondin-1’in modülasyonu yoluyla anti-anjiyojenik aktivitesi olabilir.52,53 Son yıllarda, tümör vaskülatürü, hemanjiyosarkom ve yumuşak doku sarkomları dahil olmak üzere köpek maligniteleri tedavisinde klinik açıdan önemli bir hedef olarak ortaya çıkmıştır.26,54,55 Siklofosfamidin ayrıca interferon y salgısını artırdığına ve düzenleyici T hücrelerinin etkisini değiştirerek bağışıklık sistemini uyardığına inanılmaktadır.56-58 PPC protokolü için başlangıç siklofosfamid dozu, köpeklerde metronomik siklofosfamid kullanılarak yapılan ilk çalışmalara dayanarak 12,5 mg/m2 olarak belirlenmiştir.55 Bu doz, günlük 15 mg/m2 dozunda mikrodamar yoğunluğu ve düzenleyici T hücresi sayıları üzerinde daha belirgin etkiler ortaya koyan çalışmaların yayınlanmasının ardından artırılmıştır.56
Tanis ve arkadaşları, SRD ile prokarbazin doz takvimi arasında bir ilişki bulmuş ve kurtarma tedavisinde lenfomanın PPC protokolünde görülen sürekli uygulama yerine aralıklı prokarbazin dozlarına daha iyi yanıt verebileceğini öne sürmüştür. Bu değişiklik gelecekteki çalışmalardan biri olarak araştırılabilir.20 L-asparaginaz bu protokolün başlangıcında aralıklı olarak kullanılmış ve köpeklerin %38’ine bir doz verilmiştir. Tercihimiz, klinik olarak iyi olmayan, iştahsızlık, kusma, ishal veya uyuşukluk belirtileri gösteren veya kemik iliği tutulumu olan köpeklerde kullanılması ve PPC protokolüne geçiş sırasında daha agresif bir biyolojik hastalığı veya daha ilerlemiş hastalığı olan köpeklerde kullanılmasıdır. Asparaginazın birincil tepki oranını etkileyebildiği ancak sağkalım süreleri üzerinde bir etkisi olmadığı daha önce gösterilmiştir.59 L-asparaginazın PPC protokolünün başlangıcında kullanıldığında SRD veya tedaviye yanıt üzerinde önemli bir etkisi olmamıştır.
Önceki veterinerlik çalışmalarıyla çelişkili olarak, tanı sırasında ‘alt evre’ b olarak getirilen köpeklerin, ‘alt evre’ a olarak getirilen köpeklere kıyasla daha kısa sağkalım sürelerine sahip olmadığı görülmüştür.1-4 Bu durum, incelenen popülasyondaki direnç derecesini yansıtıyor olabilir ve çoğu köpek genel olarak daha kısa sağkalım süresine sahiptir.
Önceki çalışmalarla uyumlu olarak, tanı sırasında IV. ve V. evre hastalığa sahip köpekler, lenfomanın daha sonraki evrelerinin daha kısa MST’ye sahip olabileceği prognostik etkisine uygun olarak, III. evre hastalığa kıyasla önemli ölçüde daha kısa sağkalım sürelerine sahipti. Bu çalışmada beklenmeyen bir bulgu, yaşı artan köpeklerin istatistiksel olarak daha iyi yanıt süresine sahip olmasıydı. Daha önceki literatürde artan yaş ve sağkalım süresi arasında pozitif bir ilişki bulunmadığı için bu muhtemelen istatistiksel bir anomalidir. Toksisite ile ilgili olarak, PPC protokolü sekiz köpekte (%16) grade I veya II gastrointestinal toksisite ve bir köpekte (%2) grade IV hematolojik (trombositopeni) toksisite ile çok iyi tolere edilmiştir. Bu durum, daha önce bildirilen ve çeşitli derecelerde toksisiteyi kapsayan diğer tüm veteriner kurtarma protokolleriyle tezat oluşturmaktadır. MOPP (Mekloretamin, vinkristin, prokarbazin ve prednizolon), BOPP (Karmustin, vinkristin, prokarbazin ve prednizolon), LOPP ve DMAC kurtarma protokollerinin kullanıldığı çalışmalarda hastaların %42’sine kadarında hematolojik toksisite orta ila şiddetli düzeydeydi.18,19,25 Diğer kombinasyon protokollerinin incelendiği çalışmalara kaydolan hastalarda hafif ila orta düzeyde hematolojik toksisite görüldü.16,17,22 Gastrointestinal toksisite de önceki çalışmalarda hastaların %50’sine kadar sık sık rapor edilmiştir ve bir çalışmada birden fazla gastrointestinal toksisiteye bağlı ölüm görülmüştür.13,16,18,19,25,42 Hastaların %5’inden azında görülen sepsis ve tedaviye bağlı nadir ölümler, yeni kemoterapi protokollerinin geliştirilmesi için kabul edilebilir olarak değerlendirilmektedir ve PPC protokolünde bunların hiçbiri dokümante edilmemiştir. Oral siklofosfamid kullanımının bilinen yan etkilerinden biri olan steril hemorajik sistit (SHC), frusemid veya prednizolonun birlikte kullanımı olmaksızın %36’ya varan bir insidansa sahiptir.52,60 PPC protokolündeki hiçbir köpekte SHC gelişmemiştir, bunun nedeni muhtemelen protokol boyunca prednizolon veya frusemidin birlikte kullanılmasıdır, bu da diürezi teşvik eder ve akrolein metaboliti ile mesanenin epitel tabakası arasındaki temas süresini en aza indirir.60
Çalışmanın kısıtlamaları arasında retrospektif olması, kontrol grubunun bulunmaması ve T hücreli LSA’lı köpeklerden oluşan örneklem sayısının nispeten küçük olması yer almaktadır. Çalışmada bildirilen farklı lenfoma formları olduğunu ve PPC protokolümüzde hızlı ilerleyen bir hastalığın klinik tablosuna göre grade varsayımlarının yapıldığını belirtmek önemlidir. Başlangıçta alınan MTD kemoterapisine kıyasla LDC’ye daha iyi yanıt vermiş olabilecek düşük gradeli veya indolent histolojiye sahip köpeklerin oranı dahil edilmiş olabilir. Çalışmaya dahil edilen on iki köpeğin sadece sitolojik lenfoma tanısı vardı ve daha düşük gradeli hastalığa sahip olabilirlerdi. Bu popülasyon içinde üç köpek birinci gün PPC aldıkları için istatistiklerden çıkarılmıştır. İki köpek MTD protokolünde ciddi toksisite göstermiş ve PPC protokolüne geçirilmiş, diğer iki köpek ise CHOP protokolünü tamamlamıştır. Düşük gradeli veya indolent hastalığı olan hastaların yanlışlıkla dahil edilmesi, bu çalışmadaki CHOP veya LOPP tabanlı protokollere daha düşük yanıt oranını da yansıtabilir.
PPC çalışmasına dahil edilen köpeklerin tam klinik evrelemesi tanı sırasında tutarlı değildi. Hiçbir köpekte kemik iliği değerlendirmesi yapılmadığı ve bunun yerine V. evre hastalığı tanımlamak için hematoloji incelemesine güvenildiği için evre düşük tahmin edilmiş olabilir. Alt evre a veya b’nin tedavi eden klinisyen tarafından değerlendirilmesi görecelidir ve tutarsız olabilir. Köpekler ayrıca dahil edilmeden önce ve dört haftalık takipler sırasında tümüyle yeniden değerlendirilmemiştir.
Bu durum, visseral hedef dışı lezyonlar değerlendirilmediğinde CR olarak bildirilen bazı köpeklerle yanıtların olduğundan fazla tahmin edilmesine neden olabilir. Bu hastalar için yeniden evreleme önerilmiş, ancak mali zorluklar nedeniyle reddedilmiş veya kötü prognoz göz önüne alındığında sahipleri tarafından gereksiz testler olarak görülmüştür. PPC protokolündeki süre, takipler yalnızca 4 haftada bir yapıldığı için fazla tahmin edilmiş olabilir.
Bulgular, sürekli oral kombinasyon kemoterapisi uygulamasının nüks veya dirençli hastalarda minimum yan etkiyle kullanılabileceğini göstermektedir. Uygulama kolaylığı ve daha düşük toksisite, bu protokolün eski kurtarma protokollerine kıyasla çekici özellikleridir. PPC protokolü köpeklerde tekrarlayan veya dirençli lenfoma tedavisinde yeni bir yaklaşım olup üzerinde daha fazla araştırma yapılmalıdır. Enjektabl yerine oral kemoterapiyi tercih eden hasta sahipleri için ilk MTD protokollerine belirgin bir direnç göstermeyen köpeklerde ve düşük gradeli veya indolent lenfomalı köpeklerde birincil tedavi hattı işlevi görüp görmediğini değerlendirmek için daha fazla çalışma yapılması gerekmektedir.
5 | SONUÇ
PPC protokolü, nükseden veya dirençli köpek multisentrik (yüksek gradeli olduğu varsayılan) lenfomasına karşı alternatif bir tedavi sağlarken yüksek tolere edilebilirlik profili sergilemektedir. PPC protokolünün etkinliği, burada sunulan sonuçların doğrulanması için prospektif bir çalışmada daha büyük bir hayvan grubu üzerinde değerlendirilmelidir. Düşük gradeli indolent lenfomalı köpekler de böyle bir tedavi yönteminden faydalanabilecek bir alt grubu temsil etmektedir.
ÇIKAR ÇATIŞMASI BEYANI
İsimleri listelenen yazarlar, bu makalede tartışılan konu veya materyallerde herhangi bir maddi çıkarı ( honoraria; eğitim hibesi; konuşmacı bürolarına katılım; üyelik, istihdam, danışmanlık, hisse sahipliği veya diğer öz sermaye hakları; ve bilirkişi tanıklığı veya patent lisanslama düzenlemeleri gibi) veya finansal olmayan çıkarı (kişisel veya profesyonel ilişkiler, bağlantılar, bilgi veya inançlar gibi) olan herhangi bir kuruluş veya kuruluşla hiçbir bağlantıları veya katılımları OLMADIĞINI beyan etmiştir.
SONNOTLAR
i Cyclophosphamide, Cycloblastin, Pfizer, West Ryde, NSW, Australia.
ii Procarbazine, Natulan, Link Medical Products, Mosman, NSW, Australia.
iii Prednisolone, Macrolone, Mavlab, Slacks Creek, QLD, Australia.
iv Cyclophosphamide, BOVA Aus, Caringbah, NSW, Australia.
VERİ ERİŞİM BEYANI
Bu çalışmanın bulgularını destekleyen veriler, talep edilmesi halinde ilgili yazardan temin edilebilir.
KAYNAKÇA
1. Dobson JM, Blackwood LB, McInnes EF. Prognostic variables in canine multicentric lymphosarcoma. J Sm Anim Pract. 2001;42: 377-384.
- Dhaliwal RS, Kitchell BE, Messick JB. Canine lymphosarcoma: clinical features. Compend Contin Educ Vet. 2003;25:572-582.
- Chun R, Garrett LD, Vail DM. Evaluation of a high-dose chemother- apy protocol with no maintenance therapy for dogs with lymphoma. J Vet Intern Med.2000;14:120-124.
- Garrett LD, Thamm DH, Chun R, Dudley R, Vail DM. Evaluation of a 6-month chemotherapy protocol with no maintenance therapy for dogs with lymphoma. J Vet Intern Med. 2002;16:704-709.
- Rassnick KM, Bailey DB, Malone EK, et al. Comparison between L- CHOP and an L-CHOP protocol with interposed treatments of CCNU and MOPP (L-CHOP-CCNU-MOPP) for lymphoma in dogs. Vet Comp Oncol. 2010;8(4):243-253.
- Hosoya K, Kisseberth WC, Lord LK, et al. Comparison of COAP and UW-19 protocols for dogs with multicentric lymphoma. J Vet Intern Med. 2007;21(6):1355-1363.
- Wolf-Ringwall A, Lopez L, Elmslie R, et al. Prospective evaluation of flow cytometric characteristics, histopathological diagnosis and clini- cal outcome in dogs with naïve B-cell lymphoma treated with a 19- week CHOP protocol. Vet Comp Oncol. 2020;18(3):342-352.
- Morgan E, O’Connell K, Thomson M, Griffin A. Canine T cell lymphoma treated with lomustine, vincristine, procarbazine, and prednisolone che- motherapy in 35 dogs. Vet Comp Oncol. 2018;16(4):622-629.
- Brown P, Tzannes S, Nguyen S, et al. LOPP chemotherapy as afirst- line treatment for dogs with T-cell lymphoma. Vet Comp Oncol. 2018; 16(1):108-113.
- Rebhun RB, Kent MS, Borrofka SA, Frazier S, Skorupski K, Rodriguez CO. CHOP chemotherapy for the treatment of canine mul- ticentric T-cell lymphoma. Vet Comp Oncol. 2011;9(1):38-44.
- Madewell BR. Diagnosis, assessment or prognosis, and treatment of dogs with lymphoma: the sentinel changes (1973–1999). J Vet Intern Med. 1999;13:393-394.
- Zandvliet M, Teske E, Schrickx JA, Mol JA. A longitudinal study of ABC transporter expression in canine multicentric lymphoma. Vet J. 2015;205(2):263-271.
- Saba CF, Haefman SD, Vail DM, et al. Combination chemotherapy with continuous L-asparaginase, lomustine and prednisolone for relapsed canine lymphoma. J Vet Intern Med. 2009;23:1058-1063.
- Flory AB, Rassnick KM, Balkman CE, et al. Oral bioavailability of etoposide after administration of a single dose to tumor-bearing dogs. Am J Vet Res.2008;69(10):1316-1322.
- Griessmayr PC, Payne SE, Winter JE, Barber LG, Shofer FS. Dacarbazine as a single agent therapy for relapsed lymphoma in dogs. J Vet Intern Med.2009;23:1227-1231.
- Dervisis NG, Dominquez PA, Sarbu L, et al. Efficacy of temozolomide or dacarbazine in combination with an anthracyline for rescue chemother- apy in dogs with lymphoma. J Am Vet Med Assoc. 2007;23:563-569.
- Saba CF, Thamm DH, Vail DM. Combination chemotherapy with L- asparaginase, lomustine and prednisolone for relapsed or refractory canine lymphoma. J Vet Intern Med. 2007;21:127-132.
- Alvarez FJ, Kisseberth WC, Gallant SL, Couto CG. Dexamethasone, melphalan, actinomycin D, cytosine arabinoside (DMAC) protocol for dogs with relapsed lymphoma. J Vet Intern Med. 2006;20:1178-1183.
- LeBlanc AK, Mauldin GE, Milner RJ, et al. Efficacy of BOPP and LOPP chemotherapy for the treatment of relapsed canine lymphoma. Vet Comp Oncol. 2006;4:21-32.
- Tanis JB, Mason SL, Maddox TW, et al. Evaluation of a multiagent chemotherapy protocol combining lomustine, procarbazine and pred- nisolone (LPP) for the treatment of relapsed canine non-Hodgkin high -grade lymphomas. Vet Comp Oncol. 2018;16(3):361-369.
- Van Vechten M, Helfond SC, Jeqlum FA. Treatment of relapsed canine lymphoma with doxorubicin and dacarbazine. J Vet Intern Med. 1990;4:187-191.
- Moore AS, London CA, Wood CA, et al. Lomustine (CCNU) for the treatment of resistant lymphoma in dogs. J Vet Intern Med. 1999;13: 395-398.
23. As M, Ogilvie GK, Vail DM. Actinomycin D for reinduction of remis- sion in dogs with resistant lymphoma. J Vet Intern Med. 1994;8: 343-344.
24. Lucroy MD, Phillips BS, Kraegel SA, Simonson ER, Madewell BR. Eval- uation of single agent mitoxantrone as chemotherapy for relapsing canine lymphoma. J Vet Intern Med. 1998;12:325-329.
25. Rassnick KM, Mauldin GE, Al-Sarraf R, et al. MOPP chemotherapy for treatment of resistant lymphoma in dogs: a retrospective study of 117 cases (1989-2000). J Vet Intern Med. 2002;16(5):576-580.
26. Coleman M, Martin P , Ruan J, et al. Prednisolone, etopiside, procarba- zine and cyclophosphamide (PEP-C) oral combinationchemotherapy regimen for recurring/ refractory lymphoma: low-dose metronomic, multidrug therapy. Cancer.2008;112:2228-2232.
27. Coleman M, Martin P , Ruan J, et al. Low-dose metronomic, multidrug therapy with the PEP-C oral combination chemotherapy regimen for mantle cell lymphoma. Leuk Lymphoma. 2008;49:447-450.
28. Ruan J, Martin P , Coleman M, et al. Durable responses with the met- ronomic regimen RT-PEP-C in elderly patients with recurrent mantle cell lymphoma. Cancer. 2010;116:2655-2664.
29. Kerbel RS, Kamen BA. The anti-angiogenic basis of metronomic che- motherapy. Nat Rev Cancer.2004;4:423-436.
30. Ruan J. Antiangiogenic therapies in non-Hodgkin’s lymphoma. Curr Cancer Drug Targets.2011;11(9):1030-1043.
31. Valli VE, San Myint M, Barthel A, et al. Classification of canine malig- nant lymphomas according to the World Health Organization criteria. Vet Pathol. 2011;48(1):198-211.
32. Crabtree AC, Spangler E, Beard D, Smith A. Diagnostic accuracy of gray-scale ultrasonography for the detection of hepatic and splenic lymphoma in dogs. Vet Radiol Ultrasound. 2010;51(6):661-664.
33. Eberhardt F, Kohler C, Krastel D, et al. Sonographically detectable splenic disorders in dogs with malignant lymphoma. Tierarztl Prax Ausg K Kleintiere Heimtiere. 2015;43(4):215-220.
34. Assouline S, Meyer RM, Infante-Rivard C, et al. Development of adapted RECIST criteria to assess response in lymphoma and their comparison to the international workshop criteria. Leuk Lymphoma. 2007;48(3):513-520.
35. Therasse P , Arbuck SG, Eisenhauer EA, et al. New guidelines to evalu- ate the response to treatment in solid tumors. J Natl Cancer Inst. 2000;92(3):205-216.
36. Vail DM, Michels GM, Khanna C, Selting KA, London CA, Veterinary Cooperative Oncology Group. Response evaluation criteria for periph- eral nodal lymphoma in dogs (v1.0)—a veterinary cooperative oncology group (VCOG) consensus document. Vet Comp Oncol. 2010;8(1):28-37.
37. Vail DM. Veterinary co-operative oncology group – common termi- nology criteria for adverse events (VCOG-CTCAE) following chemo- therapy or biological antineoplastic therapy in dogs and cats v1.0. Vet Comp Oncol. 2004;2:194-213.
38. Dohoo I, Martin S, Stryhn H. Veterinary Epidemiologic Research. 2nd ed. Charlottetown; 2009.
39. Valli VE, Kass PH, San Myint M, et al. Canine lymphomas: association of classification type, disease stage, tumor subtype, mitotic rate, and treatment with survival. Vet Pathol. 2013;50(5):738-748.
40. Elliott JW, Cripps P, Marrington AM, Grant IA, Blackwood L. Epi- rubicin as part of a multi-agent chemotherapy protocol for canine lymphoma. Vet Comp Oncol. 2013;11(3):185-198.
41. Al-Nadaf S, Rebhun RB, Curran KM, et al. Retrospective analysis of doxorubicin and prednisolone as first-line therapy for canine B-cell lymphoma. BMC Vet Res.2018;14(1):356.
42. Bannink EO, Sauerbrey MC, Mullins MN, et al. Actinomycin D as res- cue therapy in dogs with relapsed or resistant lymphoma: 49 cases (1999–2006). J Am Vet Med Assoc. 2008;233:446-451.
43. Sorenmo K, Overley B, Krick E, Ferrara T, LaBlanc A, Shofer F. Out- come and toxicity associated with a dose-intensified,maintenance- free CHOP-based chemotherapy protocol in canine lymphoma: 130 cases. Vet Comp Oncol. 2010;8(3):196-208.
- Flory AB, Rassnick KM, Erb HN, et al. Evaluation of factors associated with second remission in dogs with lymphoma undergoing retreatment with a cyclophosphamide, doxorubicin, vincristine and prednisone chemotherapy protocol: 93 cases (2000-2007). J Am Vet Med Assoc. 2011;238:501-506.
- Choi YH, Yu AM. ABC transporters in multidrug resistance and phar- macokinetics, and strategies for drug development. Curr Pharm Des. 2014;20(5):793-807.
- Tomiyyasu H, Goto-Koshino Y, Fujino Y, et al. Antitumour effect and modulation of expression of the ABCB1 gene by perifosin in canine lymphoid tumour cell lines. Vet J. 2014;201:83-90.
- Massoud J, Armand P , Ribrag V . Procarbazine in haematology: an old drug with a new life? Eur J Cancer. 2004;40(13):1924-1927.
- Browder T, Butterfield CE, Kräling BM, et al. Antiangiogenic schedul- ing of chemotherapy improves efficacy against experimental drug- resistant cancer . Cancer Res. 2000;60(7):1878-1886.
- Buskstein R, Kerbel RS, Shaked Y , et al. High dose celecoxib and met- ronomic ‘low-dose’ cyclophosphamide is an effective and safe ther- apy in patients with relapsed and refractory aggressive histology non- Hodgkin’s lymphoma. Clin Cancer Res. 2006;12(17):5190-5198.
- Ruan J, Martin P , Coleman M, et al. Durable responses with the met- ronomic rituximab and thalidomide plus prednisolone, etoposide, pro- carbazine and cyclophosphamide regimen in elderly patients with recurrent mantle cell lymphoma. Cancer. 2010;16(11):2655-2664.
- Emmenger U, Morton GC, Francia G, et al. A comparative analysis of low dose metronomic cyclophosphamide reveals absent or low grade toxicity on tissues highly sensitive to the toxic effects of maximum tolerated dose regimen. Cancer Res. 2002;62:2731-2735.
- Charney SC, Bergman PJ, Hohenhaus AE, McKnight JA. Risk factors for sterile hemorrhagic cystitis in dogs with lymphoma receiving cyclophosphamide with or without concurrent administration of furo- semide: 216 cases (1990–1996). J Am Vet Med Assoc. 2003;222: 1388-1393.
- Shaked Y, Emmengger U, Man S. Optimal biologic dose of metro- nomic chemotherapy regimen is associated with maximum anti- angiogenic activity. Blood. 2005;106:3058-3061.
- Elmslie RE, Glawe P, Dow SW. Metronomic chemotherapy with cyclophosphamide and piroxicam effectively delays tumour recurrence in dogs with incompletely resected soft tissue sarcomas.J Vet Intern Med. 2008;22(6):1373-1379.
- 55. Lana S, U’ren L, Plaza S, et al. Continuous low-dose oral chemother- apy for adjuvant therapy of splenic haemangiosarcoma in dogs. J Vet Intern Med. 2007;21(4):764-769.
56. Burton J, M itchell L, Thamm D , et al. Low dose cyclophos- phamide selectively decreases regulatory T cells and inhibits angiogene- sis in dogs with soft tissue sarcoma. J Vet Intern Med. 2011;25:920-926. 57. Mitchell L, Thamm DH, Biller BJ. Clinical and immunomodulatory effects of toceranib combined with low-dose cyclophosphamide in dogs with cancer. J Vet Intern Med. 2012;26:355-362.
58. Denies S, Cicchelero L, de Rooster H, et al. Immunological and angiogenic markers during metronomic temozolomide and cyclophos- phamide in canine cancer patients. Vet Comp Oncol. 2017;15(2):594-605. 59. Valerius KD, Ogilvie GK, Mallinckrodt CH, Getzy DM. Doxorubicin alone or in combination with asparaginase, followed by cyclophos- phamide, vincristine, and prednisone for treatment of multicentric lymphoma in dogs: 121 cases (1987-1995). J Am Vet Med Assoc.1997;210(4):512-516.
60. Chan CM, Frimberger AE, Moore AS. Incidence of sterile hemorrhagiccystitis in tumor-bearing dogs concurrently treated with oral metro- nomic cyclophosphamide chemotherapy and furosemide: 55 cases (2009-2015). J Am Vet Med Assoc. 2016;249(12):1408-1414.
EK BİLGİLER
Ek bilgiler, makalenin çevrimiçi versiyonunda, yayıncının web sitesinde bulunabilir.
Bu makaleye atıfta bulunmak için: O’Connell K, Thomson M, Morgan E, Henning J. Procarbazine, prednisolone and cyclophosphamide oral combination chemotherapy protocol for canine lymphoma. Vet Comp Oncol. 2022;20(3):613‐622. doi:10.1111/vco.12814