Bu makaleye atıfta bulunmak için:
Wong, H.; Byrne, S.; Rasotto, R.; Drees, R.; Taylor, A.; Priestnall, S.L.; Leo, C. A Retrospective Study of Clinical and Histopathological Features of 81 Cases of Canine Apocrine Gland Adenocarcinoma of the Anal Sac: Independent Clinical and Histopathological Risk Factors Associated with Outcome. Animals 2021, 11, 3327.https://doi.org/ 10.3390/ani11113327
Akademik Editor: Stanislaw Dzimira
Sunum Tarihi: 24 Ekim 2021 Kabul Tarihi: 19 Kasım 2021 Yayın Tarihi: 22 Kasım 2021
Yayıncının Beyanı: MDPI, makalenin yayınlandığı bölgelerdeki yasal hak iddiaları ve kurumsal bağlantılar konusunda tarafsız kalmaktadır.
Telif Hakkı: © 2021 by the authors. Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution (CC BY) lisansının hüküm ve koşulları altında dağıtılan açık erişimli bir makaledir. (https:// creativecommons.org/licenses/by/
4.0/).
1Patobiyoloji ve Nüfus Bilimleri Bölümü, Kraliyet Veteriner Koleji, Hertfordshire AL9 7TA, Birleşik Krallık; spriestnall@rvc.ac.uk
2 Klinik Bilimler ve Hizmetler Bölümü, Kraliyet Veteriner Koleji, Hertfordshire AL9 7TA, Birleşik Krallık; sbyrne@lvvsc.com (S.B.); rdrees@rvc.ac.uk (R.D.); ataylor@rvc.ac.uk (A.T.); chiara.leo@anicura.it (C.L.)
3 Dick White Hastanesi, Station Farm, Six Mile Bottom, Cambridgeshire CB8 OUH, Birleşik Krallık; rr@dwr.co.uk * İletişim: hew28@cam.ac.uk; Tel.:+44-(0)-1223-337701
† Byrne ve H Wong müşterek birinci yazar olarak kabul edilecektir.
‡ C Leo ve S Priestnall müşterek kıdemli yazar olarak kabul edilecektir.
Kısa Bilgiler: Köpekler anal kese bezlerinden kaynaklanan tümör nedeniyle zarar görebilir. Bu tümörler agresif bir şekilde büyüyebilir ve diğer organlara yayılarak bağırsak hareketlerinin ve/veya organ fonksiyonlarının bozulmasına neden olabilir ve sonuçta ölüme veya ötenaziye yol açabilir. Bazı tümörlerin neden daha hızlı büyüdüğü veya yayıldığı tam olarak anlaşılamamıştır ve veteriner hekimler ilk tanı anında hangi köpeklerin daha iyi veya daha kötü hayatta kalma süresine sahip olacağını ayırt edememektedir. Bu çalışmada anal kese tümörü olan köpeklerin klinik, muayene ve tümör özellikleri değerlendirilmiş ve hangi özelliklerin daha iyi sağkalım süresi sağlayacağı incelenmiştir. Tümör boyutunun daha küçük olması, lenf nodu boyutunun daha küçük olması, cerrahi olarak çıkarılması ve radyoterapi ile tedavi edilmesi sağkalım sürelerinin daha uzun olmasını sağlamıştır. Tümör dokusu incelendiğinde, yakın yerleşimli tümör hücrelerinin varlığı, ölü tümör dokusu ve damarların tümör hücreleri tarafından istila edilmesi sağkalım süresinin daha kötü seyretmesiyle ilişkilendirilmiştir. Sağkalımı etkileyen özellikler, tek bir vakaya uygulandığında prognozu gösterebilecek ve dolayısıyla klinisyenlerin ve hasta sahiplerinin daha bilinçli klinik kararlar almasına yardımcı olabilecek iki kontrol listesi oluşturmak için kullanılmıştır.
Özet: Köpek apokrin bezi anal kese adenokarsinomu (AGASAC) değişken klinik progresyona sahip malign bir tümördür. Bu çalışmanın amacı, kötü sağkalımın klinik ve histopatolojik risk faktörlerini belirlemek için insan tıbbi onkolojisinde kullanılan modellere dayanan sağlam çok değişkenli modeller kullanmaktı. AGASAC’lı 81 vakanın klinik verileri ve görüntüleme sonuçları incelenmiştir. Doku, 49 vakada histolojik inceleme ve immünohistokimya için mevcuttu. Tümör ve lenf nodu boyutu, solid tümörlerde yanıt değerlendirme kriterleri sistemi (RECIST) kullanılarak belirlenmiştir. Modelleme, 2 cm üzerindeki tümör boyutunun, 1,6 cm ve 5 cm’lik iki eşik değerine göre üç kademede gruplandırılan lenf nodu boyutunun, cerrahi yönetimin ve radyoterapinin, tümör evresinden bağımsız olarak sağkalımla ilişkili bağımsız klinik değişkenler olduğunu ortaya koymuştur. Tümör boyutunun 1,3 cm’nin üzerinde olması ve uzak metastaz varlığı ilk progresyonsuz aralık ile ilişkili bağımsız klinik değişkenlerdir. Primer tümörde tümör nekrozu, solid histolojik patern ve vasküler invazyon gibi histopatolojik değişkenlerin varlığı kötü sağkalım bakımından risk faktörleriydi. Bu bağımsız risk faktörlerine göre, Apokrin gland anal kese adenokarsinomu (AGASAC) hastalarında sağkalımı tahmin etmek için skorlama algoritmaları sunulmuştur.
Anahtar Kelimeler: anal kese adenokarsinomu; apokrin bez; histoloji; hiperkalsemi; nekroz; prognoz; radyoterapi; cerrahi; vasküler invazyon
1. Giriş
Köpeklerde anal kese apokrin denokarsinomu (AGASAC) anal kese bezlerinden kaynaklanan malign epitelyal bir tümördür [1,2]. İngiliz Cocker Spanieller arasında genetik ve ırka özgü bir eğilim olduğu tespit edilmiştir; ancak hastalık tüm ırklarda sporadik seyretmektedir [3,4]. Metastaz sık görülür ve genellikle lokorejyonel lenf düğümlerini etkilemektedir. Uzak yayılım yaygın olarak görülür ve abdominal ve torasik iç organları ve kemiği tutabilir [2,5-7]. Tümör tarafından üretilen paratiroid hormonuyla ilişkili polipeptidin [8-10] etkisiyle oluşan paraneoplastik hiperkalsemi, tanı sırasında köpeklerin %25-51’inde mevcuttur ve yaşamı tehdit eden komplikasyonlara neden olabilmektedir [5]. Tanı anında rapor edilen metastatik oranlar ve genel sağkalım süreleri değişkenlik göstermektedir; klinik evreye ve uygulanan tedaviye bağlı olarak sırasıyla %26 [11] ila %79 [5] ve 212 gün [2] ila 1237 gün [11] arasında değişmektedir [2,5,12-19]. Cerrahi, radyoterapi ve/veya medikal tedavi dahil olmak üzere genellikle iki veya daha fazla tedavi yöntemini içeren multimodal tedavi yöntemi önerilmektedir. Cerrahi, metastatik olmayan AGASAC ve bölgesel lenf nodu metastazı olan AGASAC için tedavinin temeli olarak kabul edilmektedir [2,12,20,21]. Radyoterapi ve bir dizi tıbbi ajan hem adjuvan hem de palyatif tedavi olarak kullanılmıştır [2,13-15,20,22-28].
Çeşitli klinik ve histolojik faktörler, sağ kalımın kötü olması veya progresyonsuz geçen sürenin (PFI) kısalması bakımından belirleyici faktörler olarak öne sürülmüştür. Primer tümör boyutu en büyük kanıt hacmine sahiptir ve daha büyük tümörlerde sağkalım süreleri daha kısadır [2,7,15]. Lenf nodu tutulumu ve uzak metastazın da prognostik önemi olduğu rapor edilmiştir [2,5,7,15,19]. Hiperkalseminin sağkalım üzerindeki etkisi belirsiz olmakla birlikte, hem olumlu hem de olumsuz kanıtlar mevcuttur [2,5,7,29]. PFI göstergesi olarak klinik faktörleri araştıran çalışmalar daha az sayıdadır; ancak tümör boyutu, lenf nodu metastazı [15], sublumbar lenfadenopati [19] ve hiperkalsemi [29] medyan PFI’de (MPFI) azalmayla bağlantılı bulunmuştur. Nekroz, solid tümör paterni, vasküler invazyon ve periferik infiltrasyon gibi histolojik değişkenler tek başlarına ele alındığında genel sağkalımda azalma saptanmıştır [11,16,30]. Önceki çalışmalarda mitotik sayı ile sağkalım ve/veya başlangıçtaki metastaz arasında herhangi bir ilişki bulunmamıştır [16,31]. Proliferasyon belirteci Ki67’nin AGASAC vakalarının progresyonu tahmin edilmesindeki rolü net olarak belirlenmemiştir; ancak şimdiye kadar yapılan çalışmalarda primer tümör ve metastatik lenf nodları içindeki Ki67 immünolabelling yüzdesi ile genel medyan sağkalım süresi (MST) arasında herhangi bir bağlantı bulunmamıştır [17,30].
Bu çalışmada, AGASAC hastalarında düşük sağkalım ve PFI’nin klinik ve histopatolojik risk faktörlerini belirlemek amacıyla stabilite için optimize edilmiş çok değişkenli modeller kullanılmıştır. Amacımız, AGASAC’lı köpekleri tedavi eden klinisyenlere, tedavi kararı verirken bilgi sağlamak amacıyla tahmini sağkalım süreleri ve göreceli prognoz belirlemek için kolayca elde edilebilen klinik ve patolojik verileri kullanarak tekrarlanabilir algoritmalar sunmaktı. Bu amaca rehberlik eden iki hipotez vardı. İlk olarak, vaka popülasyonumuzda primer ve metastatik hastalık için hassas cerrahi planlamaya izin veren hasta evrelemesinde ağırlıklı olarak BT görüntüleme kullanıldığından, klinik olarak belirlenen hastalık evresine bakılmaksızın cerrahinin AGASAC hastalarına fayda sağlayacağını varsaydık. İkinci olarak, düşük sağkalımla ilişkili histolojik özelliklerin herhangi bir ek risk taşımadığını ve bu özelliklerden birden fazlasının mevcut olması halinde, düşük sağkalım için tek bir değişkenden daha fazla belirleyici güce sahip olduğunu varsaydık.
2. Materyal ve Metod
2.1. Vaka Seçim Kriterleri
Tek bir veteriner hastanesi olan Royal Veterinary College’ın tıbbi kayıtları 2006-2015 yılları arasında AGASAC teşhisi konulan köpekleri tespit etmek için taranmıştır. Sitoloji veya histopatoloji ile tanı konulan, tanısal görüntüleme yöntemleri ile klinik evreleme yapılan ve en az bir hastane ziyareti ile takip edilen veya sevk eden veterinerlik muayenehanesi tarafından kayıt altına alınan vakalar dahil edilmiştir.
2.2. Verilerin Toplanması
Konuyla ilgili klinik bilgiler, hastanın cinsi, yaşı, cinsiyeti, başlıca klinik belirtisi, kitlenin yeri, palpe edilebilen sublumbar lenfadenopati olup olmadığı, tedavi ve komplikasyonlar da dahil olmak üzere Royal Veterinary College’daki Queen Mother Hastanesi veri tabanından alınmıştır. Her vakanın tanısal görüntüleme verileri, sertifikalı bir radyolog tarafından gözden geçirilmiştir. Tanısal görüntüleme, torakoabdominal bilgisayarlı tomografi (BT), torasik radyografiler ve abdominal ultrason veya klinisyenin takdiri ve hasta sahibinin onayı ile belirlenmiş ve bunların kombinasyonunu kapsıyordu. Tümör ve lenf nodu ölçümleri solid tümörlerde yanıt değerlendirme kriterleri (RECIST) sistemi kullanılarak yapılmış ve sertifikalı bir radyolog olan RD tarafından gözden geçirilmiştir [32]. Uzak metastaz, bölgesel lenf nodu bölgesi dışında yer alan herhangi bir lezyon şeklinde tanımlanmıştır. Metastatik lezyonlar mümkün olduğunda sitoloji veya histoloji ile teyit edilmiştir. Numune alma işlemi yapılmadıysa, seri görüntülemede boyutları büyüyen veya persiste eden, sayıca çok olan (karaciğer veya dalak içinde) veya lezyonun görüntüsü itibariyle sertifikalı bir radyolog tarafından metastaz olasılığının daha yüksek olduğu saptanan lezyonlar metastatik olarak kabul edilmiştir. Hiperkalsemi, referans aralıktan (1,12-1,40 mmol/L) daha yüksek iyonize kalsiyum veya hiperkalseminin klinik belirtileriyle birlikte yüksek total kalsiyum (referans aralık 2,18-2,79 mmol/L) şeklinde tanımlanmıştır. Veri kaynağı (https://doi.org/10.5061/dryad.x95x69pgx).
2.3. Histolojik Analiz
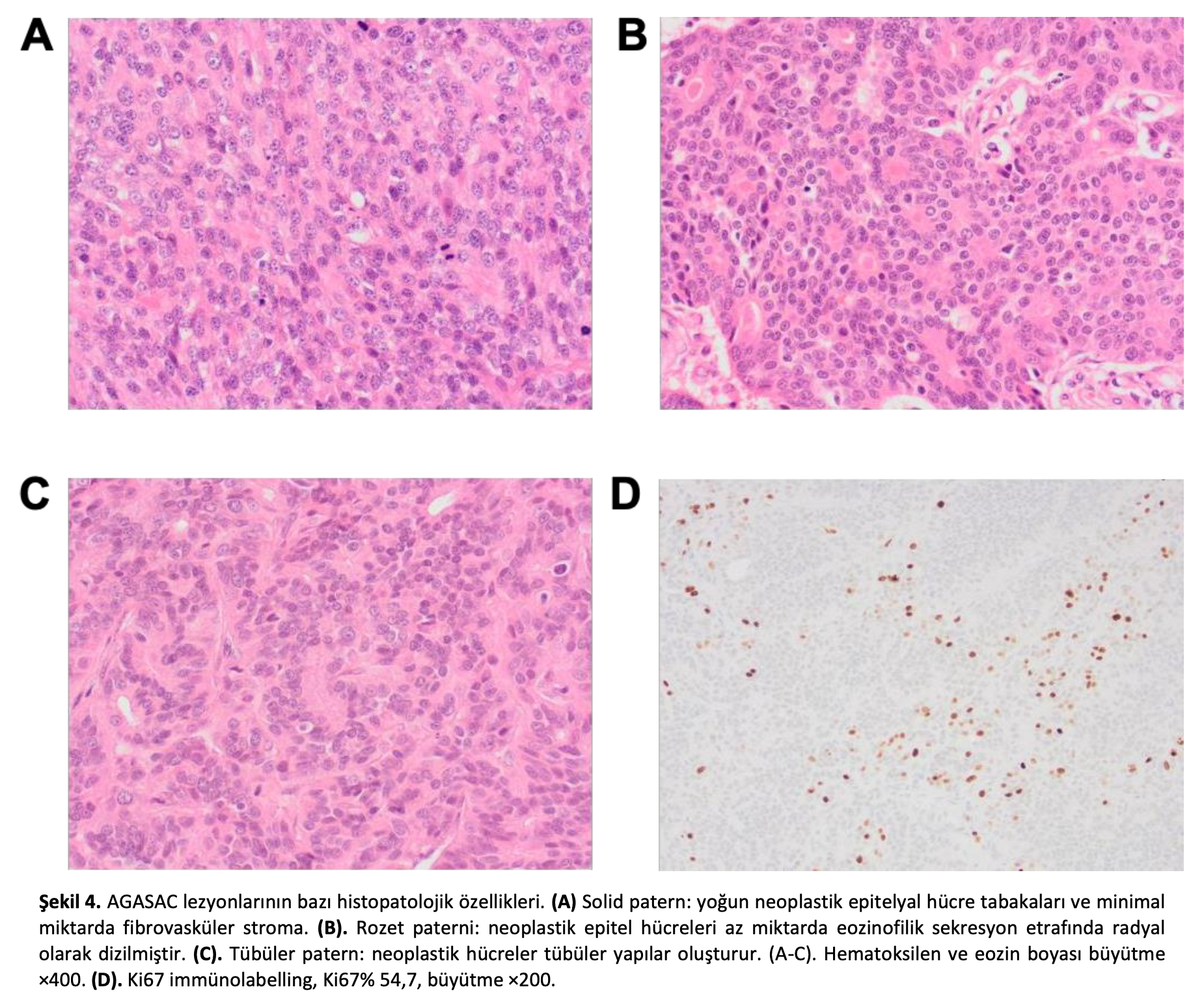
Biyopsi örnekleri, dokunun mevcut olduğu durumlarda, kurul sertifikalı patologlar tarafından ikincil kör histolojik incelemeye tabi tutulmuştur. HW ve SP hematoksilen ve eozin boyalı lamları incelemiş ve skorlama oy birliği ile yapılmıştır. RR, klinik ve histolojik verilere kör immünohistokimya skorlamasını yapmıştır. Patern tipi, nekroz olup olmadığı ve primer tümörde vasküler invazyon olup olmadığı gibi histolojik parametreler veya herhangi bir dokuda metastaz olduğuna dair histolojik kanıtlar kayıt altına alınmıştır. Primer tümörün mitotik sayısı, en yüksek mitotik aktivite alanındaki 2,37 mm2 ardışık alan boyunca kaydedilmiştir. Histolojik patern baskın patern şeklinde tanımlanmış ve rozet, tübüler veya solid olarak kategorize edilmiştir. Histolojik nekroz varsa bu, vücudun herhangi bir yerindeki tümör içi nekroz şeklinde tanımlanmıştır.
2.4. İmmünohistokimya
Ki67 immünohistokimyasal etiketleme, BondMax Autostainer Leica, Milton Keynes) üzerinde 1:150 konsantrasyonda monoklonal anti-Ki67 antikoru (MIB-1; Dako, Ely, UK) kullanılarak taze kesilmiş doku kesitleri üzerinde gerçekleştirilmiştir. Antijen geri kazanımı Ph 9’da (Bond ER2, Leica, Milton Keynes, Birleşik Krallık) ve 90 ◦C’de 10 dakika süreyle gerçekleştirilmiştir. Antikor görüntülemesi için Bond Polymer Redefine Detection kiti (Leica) kullanılmıştır. Pozitif reaksiyon, spesifik kahverengi intranükleer immünoreaktivite bulunması şeklinde belirlenmiştir. Pozitif kontrol olarak bir köpek kutanöz mast hücre tümörü kullanılmış ve Ki67 antikoru bulunmayan bu doku negatif kontrol olarak kullanılmıştır. X400 büyütmede, 2,37 mm2’lik bir alan üzerinde, pozitif immüno-etiketli Ki67 hücrelerinin sayısı her örnek için en az 1000 hücreden sayılmıştır. Her numunedeki Ki67 ekspresyonu, sayılan toplam hücre sayısına göre pozitif hücrelerin yüzdesi şeklinde tanımlanmıştır.
2.5. İstatiksel Veriler
Genel sağkalım, AGASAC hastalığı ile ilişkilendirilebilen herhangi bir nedenden dolayı ölüme kadar geçen süre şeklinde tanımlanmıştır. Veri analizinin yapıldığı tarihte köpek hayattaysa, takipten çıkmışsa veya AGASAC hastalığıyla ilişkilendirilemeyen ve belirli bir nedenden dolayı ölmüşse vakalar sansürlenmiştir. Progresyonsuz geçen süre, tanıdan hastanedeki görüntüleme veya klinik muayenede doğrulanmış hastalık progresyonuna kadar geçen ilk süre şeklinde tanımlanmıştır. Hastalığın ilerlediği belgelenmeyen vakalar hastanedeki en son muayenede sansürlenmiştir. İlerleyen hastalığı değerlendirmek için hastaneyi tekrar ziyaret etmeyen vakalar PFI verilerine dahil edilmemiştir. Model değişkenleri literatür taramasından tespit edilmiş ve global modele daha yüksek dereceli değişkenler dahil edilerek etkiye ilişkin kanıtlar dikkate alınmıştır [33]. Orantılı tehlike varsayımları ve eksik verilerin rastgeleliği kontrol edilmiştir. Sürekli değişkenler için optimum cut-off değerleri, en yüksek Youden indeksine sahip alıcı işletim karakteristik eğrisi (ROC) değerleri şeklinde tanımlanmıştır [34]. Varyans büyütme faktörleri hesaplanmış ve çoklu doğrusal bağlantı olmadığı teyit edilmiştir. Optimize edilmiş bir model üretmek için α değeri Akaike bilgi kriteri olan 0,157’ye [35] eşit olan çok değişkenli Cox regresyonu kullanılarak geriye doğru eleme yapılmıştır [33]. B katsayıları ve p değerleri 1000 bootstrap örneğinin sonuçlarıdır.
3. Sonuçlar
3.1. Fizik Muayene, Klinik Bulgular, ve Klinik Evreleme
Seksen bir vaka çalışmaya dahil edilme kriterlerini karşılamıştır ve hasta grubu Tablo1’de ayrıntılı şekilde gösterilmiştir.
Tablo 1. Hasta grubunun fizik muayenesine dair bilgiler ve klinik bulgular. Parametre
Cinsiyet
Yaş
En çok etkilenen ırk
Primer klinik bulgu
Tümörün bulunduğu yer
Rektal muayenede sublumbar lenfadenopati
Hasta sayısı
54 erkek 27 dişi 2:1 erkek:dişi
Ortalama 9,7 yıl
5-15 yıl çeyrekler arası aralık Cocker spaniel: n = 30
Labrador retriever: n = 12 Melez: n = 11
Sahibi tarafından tespit edilen perianal kitle n = 40 Perianal kitlenin tesadüfen bulunması n = 17
Dizüri/tenesmus n = 13 Klinik hiperkalsemi belirtileri
Sağ anal kese: n = 41 Sol anal kese: n = 34 Bilateral: n = 6
Tespit edildi: n = 30 Tespit edilmedi: n = 51
61 vakada (61/81; %75) torakoabdominal BT uygulanmıştır. Toraks radyografileri ile birlikte abdominal ultrason veya abdominal BT 18 vakada (18/81; %22) çekildi. İki vakaya sadece abdominal ultrasonografi yapıldı (2/81; %2).
Tek başına primer hastalık 19 vakada (19/81; %23) mevcuttu, 37 vakada (37/81; %46) nodal metastaz vardı ve 25 vakada (25/81; %31) uzak metastaz vardı. Altmış beş vakada en sık medial iliak düğümde (n = 49) olmak üzere lenfadenopati (65/81) görülmüş, bunu hipogastrik düğüm (n = 30) ve sakral/sublumbar düğümler (n = 27) izlemiştir. Üç vakada lenfadenopati nedeni olarak metastatik hastalık sitolojik inceleme sonucunda ekarte edilmiş, metastatik lezyon olduğu düşünülen beş vakada ise hasta sahipleri daha fazla araştırma yapılmasını reddetmiştir. İleri inceleme yapılan metastaz şüphesi taşıyan 46 vakada (46/57; %81) metastaz sitolojik veya histolojik inceleme ile doğrulanmıştır. Lenf nodu boyutu hiperkalsemi varlığı bakımından düşük korelasyon göstermiştir (Pearson korelasyon katsayısı: 0.313, p = 0.006 **). Uzak metastazlar karaciğer (n = 5), dalak (n = 3), pankreas (n = 1), adrenal bezler (n = 2) ve idrar kesesinde (n = 1) histoloji veya sitoloji yoluyla doğrulanmıştır. Akciğer metastazı (n = 15), nekropsi yapılan 1 vaka dışında, BT görüntülemesine dayanarak tahmin edilmiştir. Diğer metastatik yerler arasında adrenal bezler (n = 4), kemik (n = 3), vertebral kanal (n = 1), kas içi (n = 3), rektal duvar (n = 1) ve retroperitoneal (n = 1) yer almıştır.
3.2. Prognostik Klinik Değişkenler ve Hasta Sağkalım Süresi
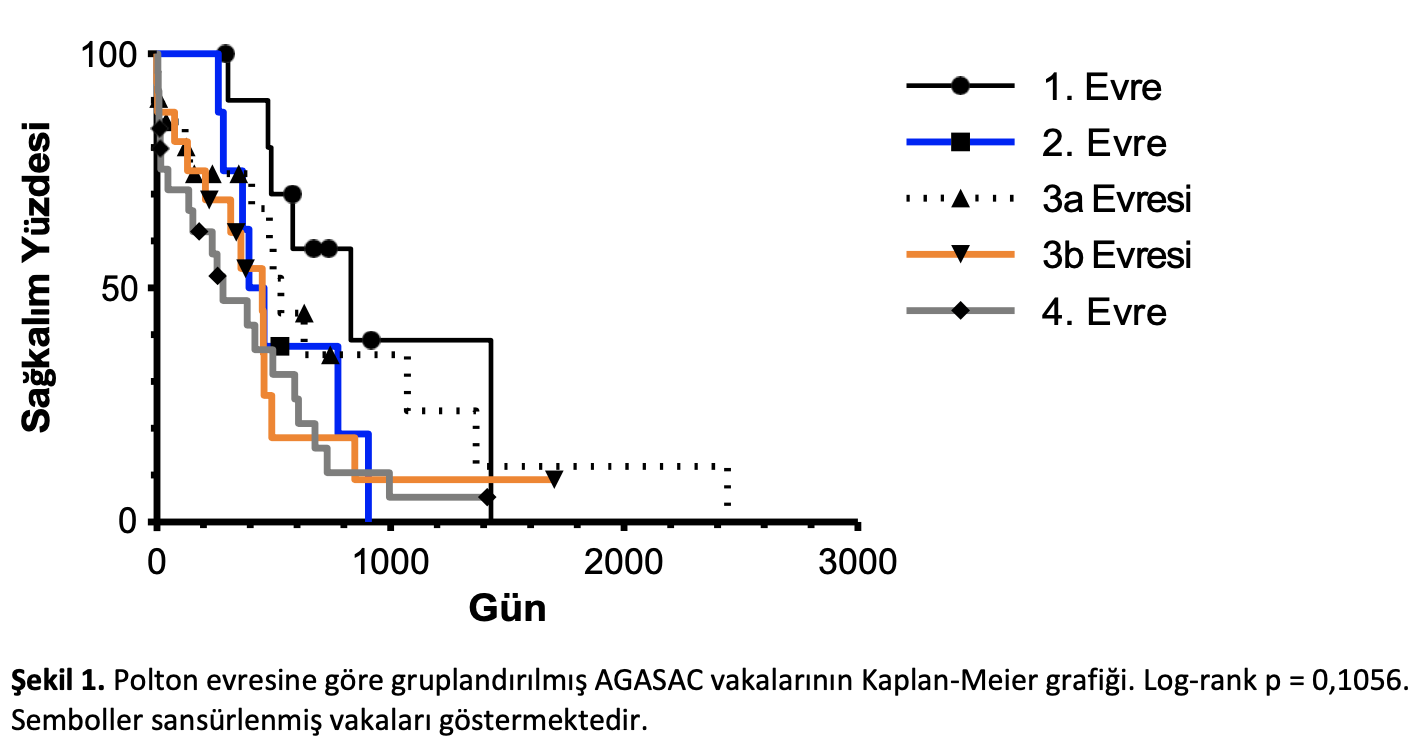
Veri analizi sırasında 1 köpek hayatta, 57’si ölmüş ve 23’ünün takibi yarıda kalmıştır. Bir vakada nekropsi yapılmıştır. Genel MST 461 gün (zaman aralığı: 0-2442 gün) ve medyan sansür süresi 346 gündü (zaman aralığı: 9-2442 gün). PFI verisi olan 37 köpekten 27’sinde hastalık ilerlemiş, 10’unda ise remisyon görülmüştür. Medyan PFI süresi 243 gün (zaman aralığı: 57-686 gün) ve medyan sansür süresi 206 gündü. Ortanca en uzun tümör çapı 2,5 cm (zaman aralığı: 0,2- 10 cm) idi. Ortanca en uzun lenf nodu çapı 2,2 cm (zaman aralığı: 0,1-9,6 cm) idi. Özellikle, dizüri veya tenesmus şikayetiyle getirilen on iki köpeğin tümünde ya >2 cm (n = 10, medyan 3,8 cm) primer tümör ya da >5 cm (n = 6, medyan 7,5 cm) lenf nodu vardı. AGASAC [7] için daha önce önerilen klinik derecelendirme şemasına göre, 12 vakada 1. Evre hastalık, 9’unda 2. Evre hastalık, 24’ünde 3a Evresi, 11’inde 3b Evresi ve 26’sında 4. Evre hastalık vardı. Farklı hastalık evrelerinde sınıflandırılan vakaların sağkalım sürelerinde istatiksel olarak anlamlı bir farklılık görülmemiştir (Şekil1).
Altmış üç köpeğe cerrahi tedavi uygulandı (63/81; %78); 37 köpeğe sadece cerrahi tedavi (37/81; %46), 19 köpeğe cerrahi ve medikal tedavi (19/81; %23), bir köpeğe cerrahi ve radyoterapi (1/81; %1) ve altı köpeğe cerrahi, medikal tedavi ve radyoterapi (6/81; %7) uygulandı. Yedi köpek ameliyat olmadan medikal tedavi almıştır (7/81; %9) ve buna medikal tedavinin yanı sıra radyoterapi alan bir köpek de dahildir. On bir köpek (11/81; %14) tanı konulduktan sonra başka bir tedavi görmemiştir.
Cerrahi yöntemler anal sakkülektomi, lenfadenektomi ve/veya uzak metastazektomiden oluşmaktaydı. Cerrahi komplikasyonlar 14 köpekte görülmüştür (14/81; %17; tüm ayrıntılar için bkz. EkA). Adjuvan ve palyatif tedavi olarak kullanılan radyoterapi, EkB’de açıklanan hiperfraksiyone ve hipofraksiyone protokollerden meydana gelmekteydi. Medikal tedavi klinisyenin takdirine bağlı olduğundan, farklı protokoller kullanılmıştır. Primer tedavide ağırlıklı şekilde tek ajan olarak veya kombinasyon halinde karboplatin, melfalan, siklofosfamid ve/veya toceranib kullanılmıştır (29/32; %91). İki köpek klorambusil ve bir köpek mitoksantron almıştır. Kurtarıcı medikal tedavi 17 köpekte uygulanmış ve doksorubisin, masitinib, pamidronat ve artemisinin gibi ek ajanlar kullanılmıştır (kemoterapinin ayrıntılarına dair ek bilgiler için bkz. EkC). Hiperkalsemik hastaların çoğunluğu tek başına (7/19; %37) ya da radyasyon (2/19; %10) veya kemoterapi (8/19; %42) ile birlikte cerrahi (14/19; %74) tedavi almıştır.
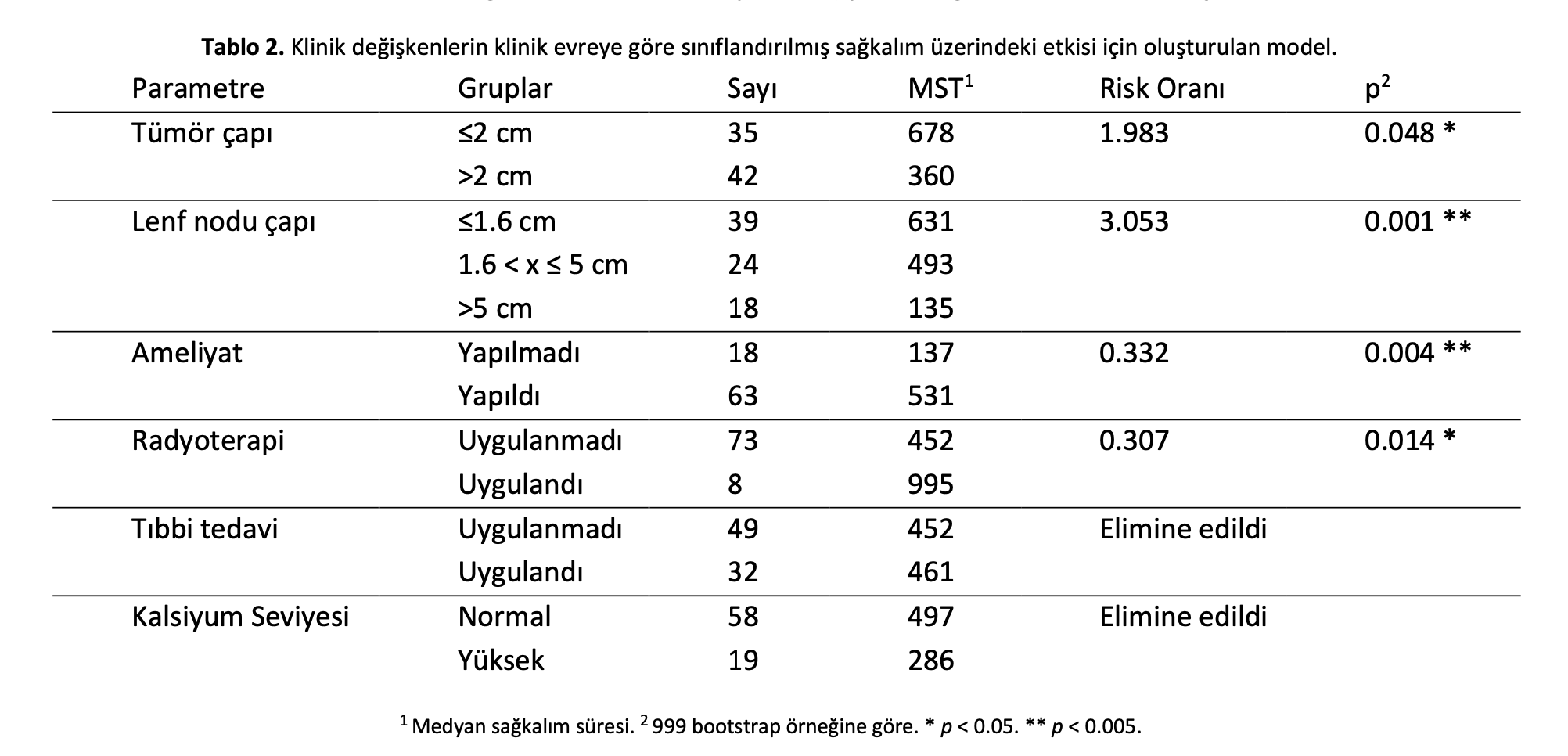
AGASAC vakalarında sağkalım üzerindeki prognostik önemi araştırmak için çok değişkenli modele dahil edilen klinik değişkenler şunlardır: tümör boyutu, lenf nodu boyutu, cerrahi tedavi, radyoterapi, medikal tedavi ve kandaki kalsiyum seviyesi. Sürekli değişkenler, ROC eğrileri ve Youden İndeksi analizi ile tanımlandığı şekilde en yüksek tahmin gücüne sahip değer kullanılarak ikili değişkenlere dönüştürülmüştür. Sağkalımla ilişkili optimum eşikler 2 cm’den büyük tümör çapı ve 1,65 cm ve 5 cm kullanılarak katmanlandırılmış lenf nodu çapı olmuştur. Klinik evrenin olası değişkenler üzerindeki etkisini kontrol etmek için model, başlangıçtaki tehlike faktörlerindeki evreye bağlı değişiklikleri kontrol etmek amacıyla klinik evreye göre sınıflandırılmıştır. Geriye doğru eliminasyonun ardından, klinik evreden bağımsız şekilde genel sağkalım üzerinde bağımsız ve anlamlı etkileri olduğu tespit edilen değişkenler tümör çapı >2 cm, 1,65 cm ve 5 cm kullanılarak sınıflandırılmış Tümör ve lenf nodu boyutlarının daha büyük olması ölüm riski bakımından pozitif risk faktörüyken, cerrahi tedavi ve radyoterapi (tek başına veya herhangi bir tedavi kombinasyonunda) pozitif sağkalım faktörleri olmuştur.
Hem nodal hem de uzak metastaz dahil olmak üzere metastatik hastalığı olan vakalarda, tek başına veya birlikte kullanılan cerrahi tedavi ve radyoterapi uygulaması, hiçbir tedavi yapılmaması veya tek başına medikal tedavi uygulanmasına kıyasla MST’yi ciddi şekilde uzatmıştır (Şekil2ve Tablo3). Tümör boyutu ve lenf nodu boyutu cerrahi veya radyoterapi ile tedavi uygulama kararını etkilememiştir (Ek Kaynaklar Şekil S1).
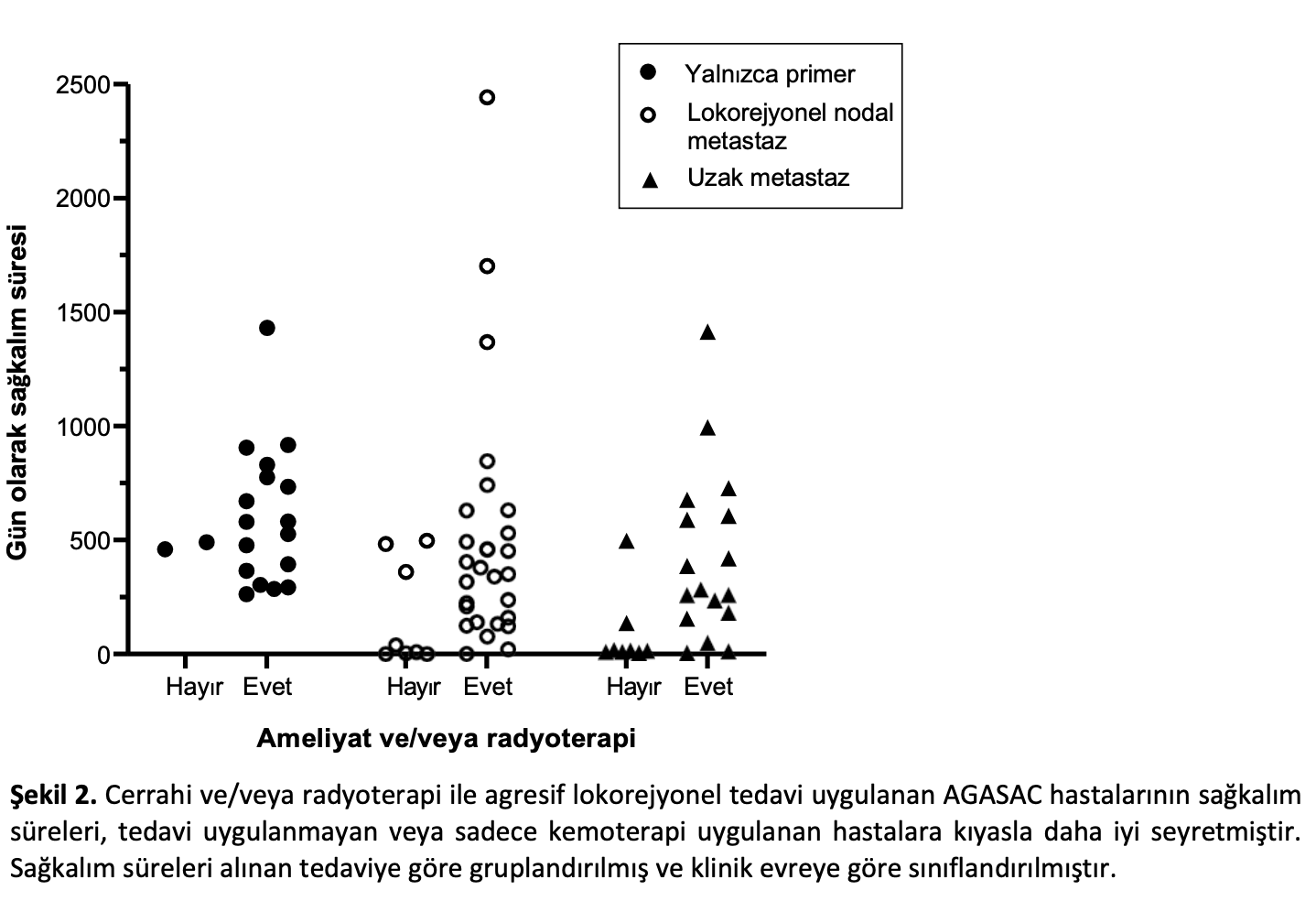
Çok değişkenli modelde sağkalım üzerinde önemli bağımsız etkiye sahip faktörler, AGASAC’ın klinik teşhisi aşamasında uygulanmak üzere geliştirilerek, söz konusu vakanın klinik özelliklerine dayanan ve gelecekteki potansiyel tedavi seçeneklerini de içeren tahmini sağkalım süreleri üreten bir algoritma oluşturmak üzere bir araya getirilmiştir (Tablo4).
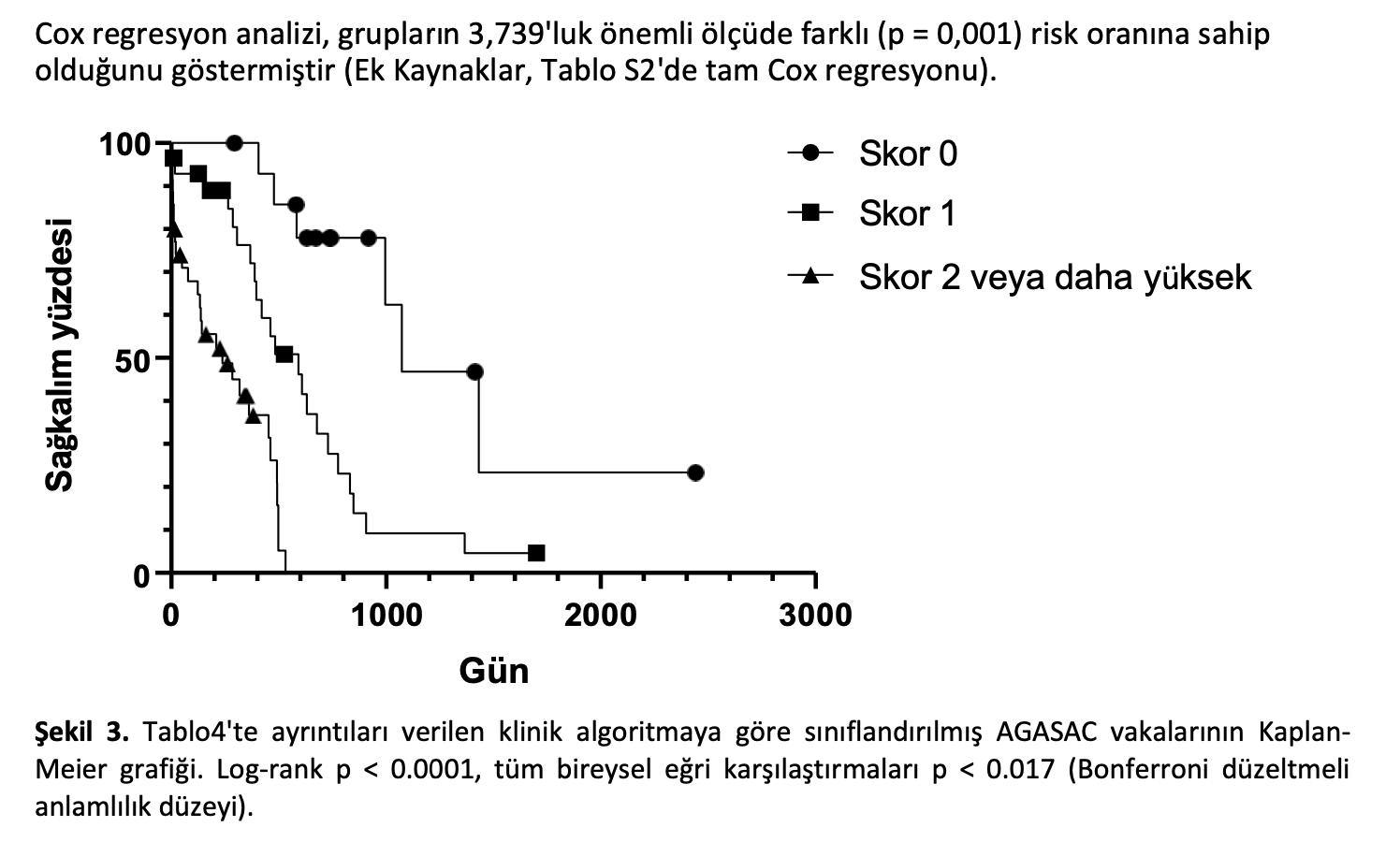
Klinik algoritmanın çalışmaya dahil edilen hasta popülasyonuna uygulanması sonucunda istatiksel açıdan anlamlı derecede farklı MST’ye sahip üç grup ortaya çıkmıştır (Log-rank p < 0,0001, tüm bireysel eğri karşılaştırmaları p < 0,017 Bonferroni düzeltmeli istatistiksel anlamlılık düzeyi; Şekil3). 0 puan alan vakaların (15/77 %19) MST’si 1072 gündü (%95 CI 666-1659). 1 puan alan vakaların (%29/77 38) MST’si 590 gün (%95 GA 231-859) ve 2 veya daha fazla puan alan vakaların (%33/77 43) MST’si 237 gün (%95 GA 10-464) olmuştur.
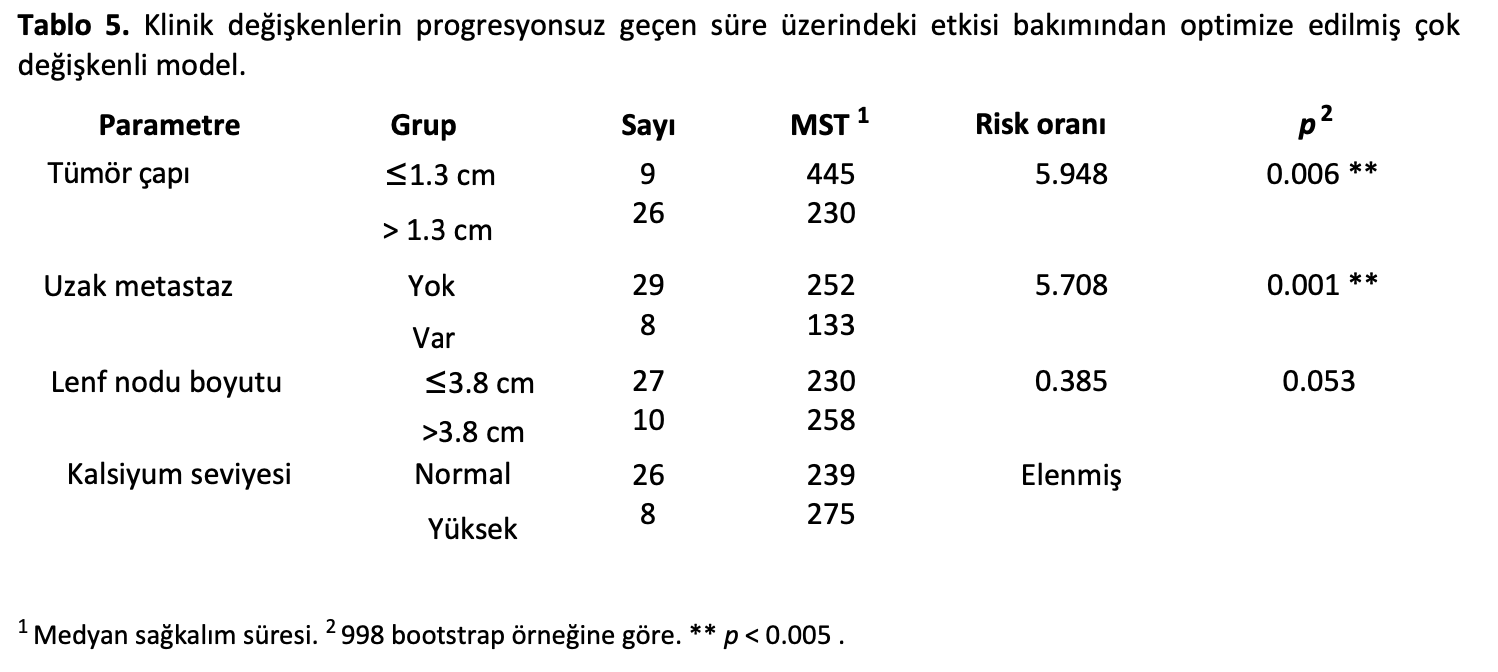
Genel sağkalım ile önemli ölçüde bağlantılı klinik değişkenlerin belirlenmesinin ardından, klinik değişkenlerin AGASAC vakalarının PFI’si üzerindeki etkisi de araştırılmıştır. PFI için global modeli şu değişkenler oluşturmuştur: tümör boyutu, lenf nodu boyutu, uzak metastaz ve hiperkalsemi. PFI prediktörleri olarak tümör ve lenf nodu çapı bakımından optimize edilmiş eşikler tümör çapı için 1,3 cm ve lenf nodu çapı için 3,8 cm şeklinde hesaplanmıştır. Optimize edilmiş model, tümör boyutunun > 1,3 cm ve uzak metastaz varsa her ikisinin de bağımsız olarak daha düşük PFI riski ile ilişkili olduğunu ortaya koymuştur (Tablo5; Ek Kaynaklar Tablo S3).
3.3. Prognostik Histopatolojik Parametreler
Kırk dokuz vakada ikincil kör histolojik inceleme yapılabilmesi için doku mevcuttu ve tüm vakalar eksizyonel biyopsilerdi. Diğer çalışmalarda tek değişkenli analizden elde edilen yayınlanmış bulgular nekroz, vasküler invazyon ve solid patern bulunup bulunmamasının sağkalım süresinde kısalma ile bağlantılı olduğunu göstermektedir, ancak bu faktörler henüz çok değişkenli analiz kullanılarak test edilmemiştir. Ek olarak, mitotik indeksin sağkalımla ilişkisinin zayıf olduğu göz önüne alındığında [16], Ki67’nin primer AGASAC’deki proliferatif aktiviteyi daha iyi ölçebileceğini öngördük.
Baskın histolojik patern değerlendirilmiş [36] ve 23’ünde (23/49; %47) solid patern, 17’sinde (17/49; %35) rozet paterni ve 9’unda (9/49; %18) tübüler patern görülmüştür (Şekil4). Tümör içi nekroz 21 vakada (21/49; %43) mevcuttu ve 18 vakada (18/49; %37) lenfovasküler invazyonun histolojik kanıtı vardı.
Ki67 immünolabelling değerlendirmesi kırk altı vakada yapıldı; kalan üç vakada değerlendirmeyi engelleyen teknik sorunlar vardı. Medyan Ki67% oranı %7,75 olup, dağılımı %0-54,7 arasındadır (Ek Kaynaklar, Şekil S2A). Ki67% için optimal prognostik eşik %6,1 şeklinde belirlenmiştir. Ki67% ve mitotik sayı verilerimizde herhangi bir korelasyon göstermemiştir (Ek Kaynaklar, Şekil S2B).
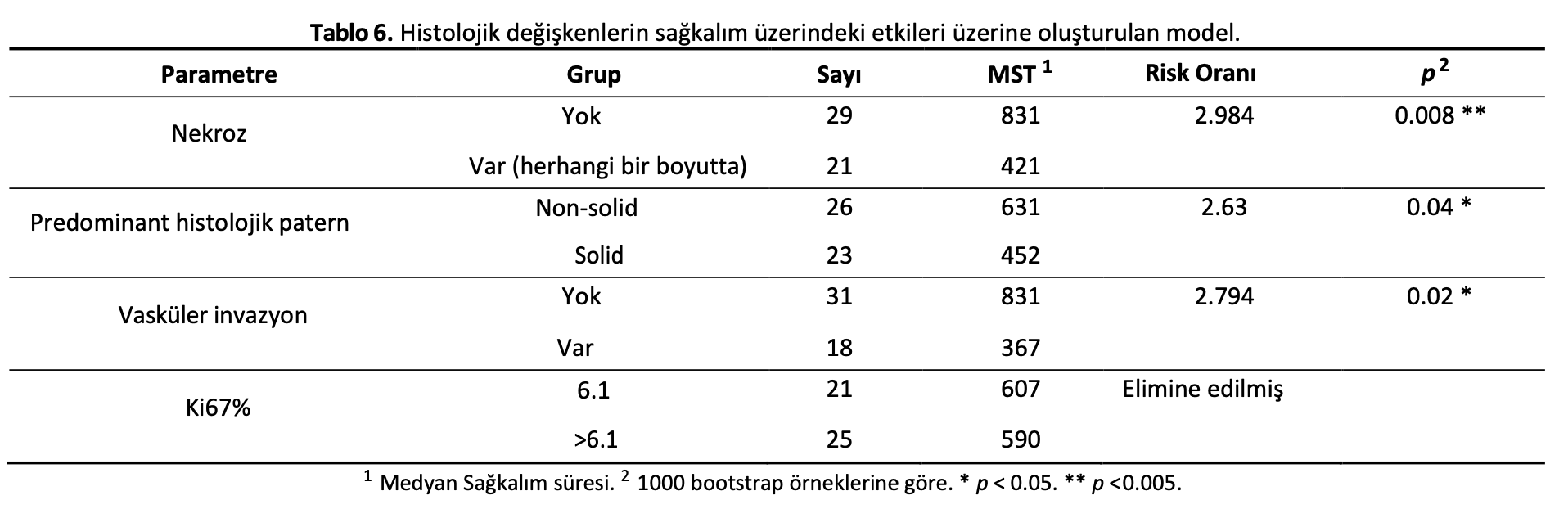
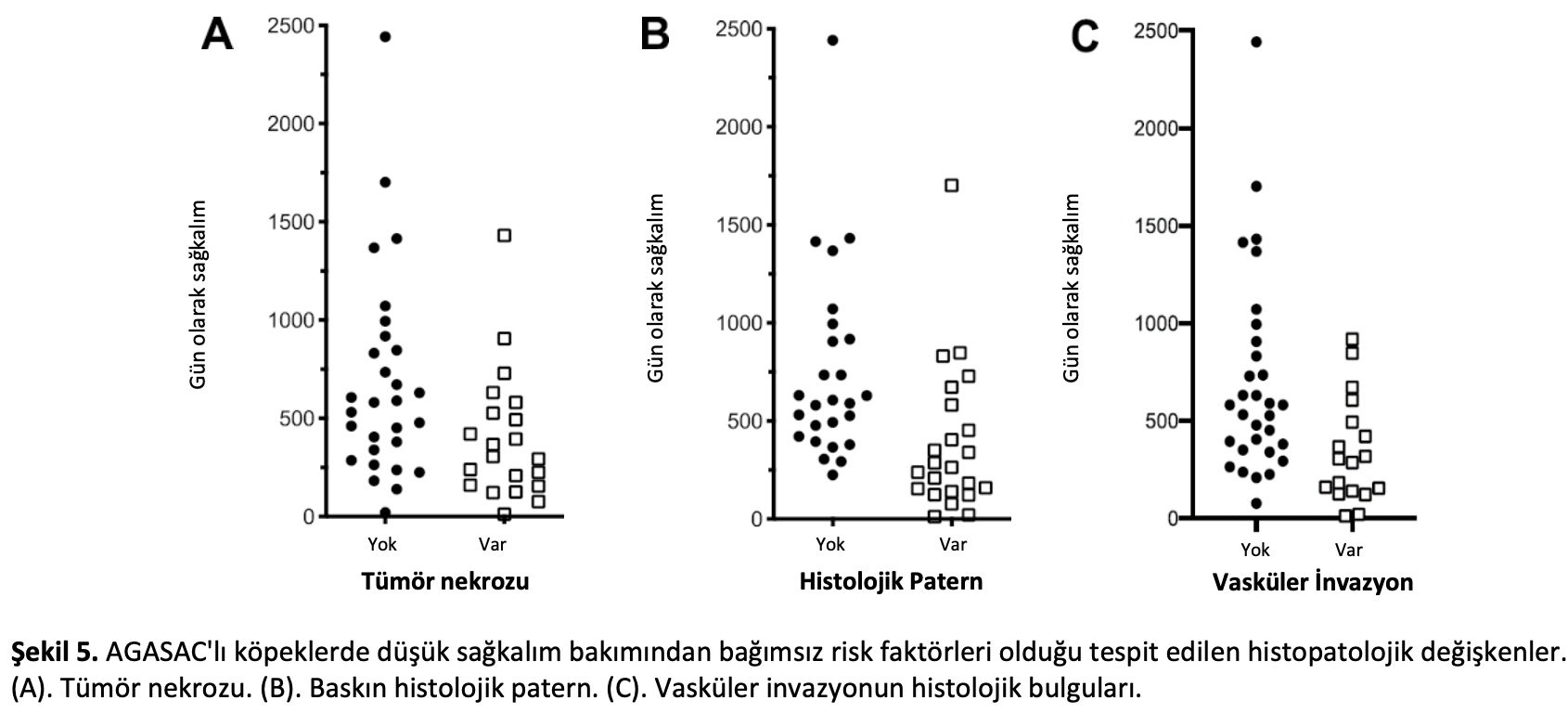
Global modele Ki67’nin yanı sıra primer tümörün aşağıdaki histolojik parametreleri de dahil edilmiştir: tümör nekrozu, tümör histolojik paterni ve vasküler invazyon bulguları. Ki67%, optimizasyon sırasında modelden çıkarılmıştır. Optimize edilmiş model, solid histolojik patern, nekroz (her ikisi de primer tümörde) ve vasküler invazyonun kötü sağkalım bakımından önemli bağımsız risk faktörleri olduğunu ortaya koymuştur (Tablo6ve Şekil5, Ek Kaynaklar Tablo S4).
Tümör nekrozu, histolojik patern ve vasküler invazyon parametreleri birleştirilerek histopatolojik bir algoritma oluşturulmuş ve AGASAC’lı köpekler için tahmini sağkalım süreleri belirlenmiştir (Tablo7).
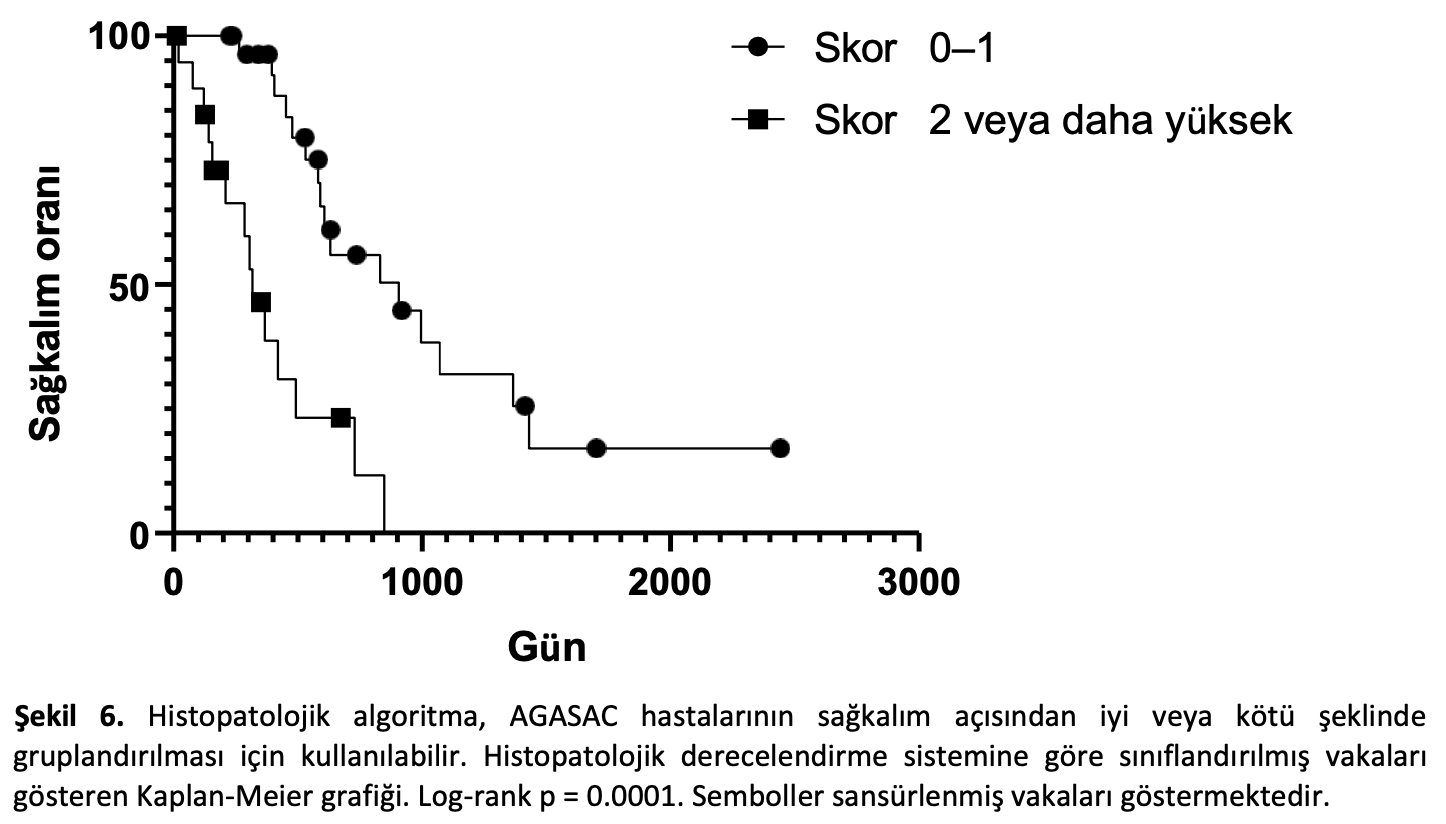
0-1 arası skor alan vakaların (29/49; %59) MST süresi 906 gün olup, bu süre 2 veya daha fazla skor alan vakaların (20/49; %41) 318 gün olan MST süresinden belirgin şekilde daha uzundur (p < 0,0001 Log-rank; Şekil6). 2 veya daha fazla skor, 0-1 skora kıyasla ölüm tehlikesinde önemli artış anlamına gelen 4,792 tehlike oranı olarak değerlendirilmiştir (p = 0,001 Cox regresyonu; Ek Kaynaklar Tablo S5). Dolayısıyla algoritma, AGASAC vakalarını istatistiki olarak anlamlı derecede farklı MST ve ölüm riskine sahip iki grup halinde sınıflandırabilmiştir.
4. Tartışma
Bu araştırmada, 81 AGASAC hastasının düşük sağkalım veya PFI bakımından bağımsız risk faktörleri teşkil eden klinik ve histopatolojik özellikleri ele alınmıştır. Bu makalede, insan onkolojisinde kullanılana benzer nitelikte titizlikle hazırlanmış istatistiksel bir metodoloji oluşturarak, translasyonel uygunluğu en üst düzeye çıkaran sağlam sonuçlar elde etmeye odaklandık [37]. Verilerle doğru bir şekilde değerlendirilebilecek değişkenlerin sayısına dikkat edilmiş ve değişken seçiminde beşeri tıp alanındaki tavsiyelere uyulmuştur [38].
Tümör çapı 2 cm’nin üzerinde, lenf nodu çapı 1,6 cm ve 5 cm eşiklerine göre üç kademede gruplandırılmış ve cerrahi tedavi ve/veya radyoterapi kullanımı, tümör evresinden bağımsız olarak sağkalımla ilişkili bağımsız klinik değişkenler şeklinde tanımlanmıştır. Tümör çapının 1,3 cm’nin üzerinde olması ve uzak metastaz bulunması, progresyonsuz geçen sürenin kısalmasıyla bağlantılı bağımsız klinik değişkenler şeklinde tanımlanmıştır. Histolojik nekroz bulguları, solid histolojik patern ve vasküler invazyon sağkalımla ilişkili bağımsız histolojik değişkenlerdir. Bu veriler, bireysel sağkalım sürelerine ilişkin daha doğru tahminler sunmak amacıyla sağkalımı önemli ölçüde etkileyen klinik özelliklere ve tedavi seçeneklerine veya histolojik özelliklere dayalı algoritmalar oluşturmak için kullanılmıştır. Klinik algoritma evreleme bilgilerini kullanırken,histolojik algoritma birincil tümör dokusundan elde edilen bilgileri değerlendirmeye almıştır. Bu ayrım, bazı AGASAC vakalarının başlangıçta sitolojik olarak teşhis edildiğini, bunun da cerrahi eksizyondan önce klinik evreleme yapılmasına neden olduğunu veya cerrahi ile tedavi edilmeyenvakalarda histopatoloji yapılamadığını göstermektedir. Buna karşılık, bazı durumlarda, tam klinik evreleme yapılmaksızın histopatoloji ile birlikte cerrahi eksizyon/örnekleme yapılabilir.
Bu çalışma, klinik parametrelerin sağkalım üzerindeki etkisini araştırmak için klinik evreye göre sınıflandırılmış çok değişkenli bir model kullanan ilk çalışmadır. Tümör boyutu ve lenf nodu boyutunun sağkalım üzerindeki etkisinin genellikle kısmen, tümör veya lenf nodu boyutunun daha büyük olması ile hastalığın evresinin artması ile bağlantılı olabileceği varsayılmıştır [7,17]. Ancak bu çalışmada, tümör ve lenf nodu boyutu, tümör evresinden bağımsız olarak sağkalımın düşmesinde tutarlı bağımsız risk faktörleri olarak değerlendirilmiştir. Bu çalışmada 2 cm’lik tümör çapı optimum eşik olarak belirlenmiştir. Daha önce bildirilen prognostik değere sahip tümör boyutu eşikleri 2,5 cm çap [7,23] ve 10 cm2 hacim (yaklaşık 3,6 cm çap) idi [2]. Eşik noktalarının belirlenmesinde standardize edilmemiş yöntemler kullanan çalışmalar için bu uyum düzeyi oldukça umut vericidir. Lenf nodu boyutu için, 1,6 cm ve 5 cm’lik iki kademeli eşik bu verilerde en ayırt edici olanıydı. Daha yüksek olan 5 cm’lik eşik, daha önce bildirilen 4,5 cm’lik eşiğe benzerdir [7], ancak verilerimiz ayrıca, vakaların uzun sağkalım süresi yönünde belli bir eğilim sergilediği 1,6 cm’lik ek olarak başka bir eşik daha belirlemiştir.
Uzak metastatik hastalıktan bağımsız olarak, büyük primer veya lenf nodu tümör hacmine sahip köpeklerde, ölüm veya ötenaziye kadar ilerleyebilen ürofaekal obstrüksiyon görülebilir [5]. Bu çalışmada, urofacial obstrüksiyon semptomları olan vakaların çoğunda tümör çapı sırasıyla 2 cm’nin üzerinde ve/veya lenf nodu çapı 5 cm’nin üzerindeydi. Lokorejyonel hastalığın kitle etkisinin ve sekellerinin, çalışmamızda tümör ve lenf nodu boyutu ile sağkalım arasındaki ilişkiyi etkilediğini düşünüyoruz.
Primer tümörün ve metastatik lezyonların, öncelikle cerrahi yoluyla başarılı bir şekilde yönetilmesi, sağkalımda iyileşmeyi sağlayabilir [2,12,20,21]. Çalışmamız, cerrahi ve/veya radyoterapi ile lokorejyonel tedavinin, nodal veya uzak metastazı olan hastalarda, sadece medikal tedavi uygulanan veya hiç tedavi uygulanmayan hastalara kıyasla önemli ölçüde daha uzun MST ile sonuçlanabileceğini göstermektedir. Çalışmanın yapıldığı kurumda cerrahi, agresif lokorejyonel tedavinin başlıca yöntemiydi ve radyoterapiye erişimin sınırlı olması nedeniyle hastalara yaygın olarak önerilmekteydi. Bu durum, cerrahinin erken debulking tedavisi için bir araç olarak değerlendirilmesi ve radyoterapinin kolaylıkla erişilebilir olması halinde daha konservatif cerrahi dışı tedavi uygulanabilecek ileri evre hastaların girişimsel palyasyonu için eşsiz bir fırsat sağlamıştır. Ayrıca, medikal tedavinin obstrüktif semptomları akut olarak hafifletmekte yetersiz kaldığı uzak metastazı olan hastalarda lokorejyonel tedavinin sağkalım üzerindeki etkisi de araştırılmıştır. BT görüntülemeyi yaygın olarak kullanmamız cerrahi planlamayı desteklemiş ve hastalarımızda cerrahinin düşük cerrahi mortalite oranıyla (%3) güvenli ve etkili olduğu görülmüştür. Tümör veya lenf nodu boyutu alınan tedavi türüyle bağlantılı değildi ve bu nedenle lokal hastalık hacmi hasta yönetimini etkilemedi.
Tümör ve lenf nodu boyutunun mevcut klinik derecelendirme sistemi [7] ile prognostik önemi açıkça kabul edilmektedir, ancak önerilen tedavi seçenekleri hastalığın evresine bağlıdır. Uzak metastaza daha az odaklanan ve bunun yerine boyutla ölçülen lokorejyonel hastalığın boyutuna ve tavsiye edilen tedavisine yoğunlaşan alternatif bir algoritma öneriyoruz. Algoritma, kümülatif bir skor kullanarak, tedavi türünün mevcut tümör ve lenf nodu boyutunun etkilerini azaltmasına da olanak tanıyarak, orijinal tümör ve lenf nodu boyutundan bağımsız olarak lokorejyonel kontrolün faydalarının altını çizmektedir.
Çalışma popülasyonumuzda hiperkalsemi insidansı %23’tür. Bu çalışmada hiperkalsemi ile lenf nodu boyutu arasında pozitif yönlü bir ilişki tespit edilmiştir; bu da hiperkalsemi varlığının metastatik hacimle ilişkili olabileceğini düşündürmektedir. Paratiroid hormonuyla ilişkili polipeptidin primer ve metastatik lezyonlar arasındaki diferansiyel ekspresyonu insan meme karsinomunda da belgelenmiştir [41,42] ve AGASAC vakalarındaki bu durum için potansiyel bir mekanizma önerebilir. Hiperkalsemi böbrek hasarı ve diğer komplikasyonlara yol açarak potansiyel olarak mortaliteyi etkileyebilir. Ancak, daha önceki bir çalışmaya [15] benzer şekilde, sağkalım ile anlamlı bir ilişki bulamadık. Genel olarak tümör remisyonunun paraneoplastik hiperkalseminin çözülmesiyle sonuçlanması beklenmektedir ve bu çalışmadaki hiperkalsemik hastaların çoğu ya tek başına ya da ek tedavilerle cerrahi olarak tedavi edilmiştir. Bu çalışmadaki agresif lokorejyonel yönetimin hiperkalsemiyi ve sekellerini azaltmaya katkıda bulunduğunu ve hiperkalseminin bu çalışmada neden önemli bir risk faktörü olarak yer almadığını açıklayabileceğini düşünüyoruz. Çalışmamızda tümör boyutu ve uzak metastaz bulunması ilk PFI’de bağımsız önemli risk faktörleri şeklinde tanımlanmıştır. 1,3 cm’den büyük tümörlerde, 1,3 cm’ye eşit veya daha küçük tümörlere kıyasla, düşük PFI rölatif riski neredeyse altı kat artmıştır. Bu veriler, tümör boyutunun ilk PFI’yi etkilediği daha önce yayınlanan sonuçları desteklemektedir [15]. Uzak metastazın düşük ilk PFI için bağımsız bir risk faktörü olarak etkisi, neoplastik hücrelerin dolaşımdaki ve metastatik öncesi varlığına bağlı olabilir. Ayrıca, uzak metastazı olan vakaların yeniden muayene sıklığı daha sık olabilir ve bu nedenle hastalık progresyonu daha erken tespit edilebilir.
Histopatolojik özelliklerle ilgili olarak, çok değişkenli analizde nekroz, solid histolojik patern ve vasküler invazyonu kötü sağkalım için bağımsız risk faktörleri olarak belirledik. Solid histolojik paternin daha önce tek değişkenli analizde kötü sağkalım ile ilişkili olduğu bulunmuştur. [11,16,30] Bulgularımız, orijinal glandüler doku mimarisinin kaybının hücresel farklılaşma kaybına ve daha agresif biyolojik davranışa işaret ettiği hipotezini desteklemektedir. Önceki kanıtlar da düşük sağkalım ile nekroz veya vasküler invazyon varlığı arasındaki bağlantıyı desteklemektedir [16,30]. Bu faktörlerden iki veya daha fazlasının daha az olumlu ve olumlu sağkalım süreleri arasında ayrım yapmak için daha ayırt edici bir eşik olduğu hipotezimizi inceledik. Bunu başarmak için, bağımsız olarak anlamlı değişkenleri, bağımsız olarak anlamlı değişkenlerden iki veya daha fazlasının varlığına dayalı bir algoritmada birleştirdik. Hipotezimizi doğrulayan algoritma, vakaları önemli ölçüde farklı MST ve tehlike oranına sahip iki gruba ayırmayı başardı. Burada uygulanan metodoloji kullanıldığında, Ki67%’nin genel sağkalımı tahmin etmede yararlı olmadığı görülmüştür; bu da diğer çalışmalarla uyumlu bir bulgudur [17,30]. Ayrıca, Ki67% ve mitotik sayı verilerimizde korelasyon göstermemiştir.
Çalışmamızın sınırlamalarından biri, retrospektif yapısının, farklı klinik, mali ve etik hususların sonucu olarak hasta yönetiminde değişikliklere yol açmış olmasıdır. İstatistiksel yaklaşım bu değişkenliği kapsayacak şekilde tasarlanmıştır, ancak burada sunulan bulguları daha fazla araştırmak için standart protokoller kullanan müteakip çok merkezli bir çalışma yararlı olacaktır.
5. Sonuç
Bu makalede, AGASAC’lı 81 köpekten oluşan hasta popülasyonunun klinik ve histolojik verileri retrospektif olarak incelenmiştir. Tümör ve lenf nodu boyutu, cerrahi tedavi ve/veya radyoterapi sağkalımla ilişkili bağımsız klinik değişkenler şeklinde tanımlanmıştır. Tümör boyutu ve uzak metastaz bulunması, ilk progresyonsuz geçen süre ile ilişkili bağımsız klinik değişkenler şeklinde tanımlanmıştır. Histolojik verilere göre, nekroz olması, solid histolojik patern ve vasküler invazyon düşük sağkalımla ilişkili bağımsız histolojik değişkenlerdir. Prognozla ilişkili bağımsız değişkenler, AGASAC hastalarının klinik evrelemesinde ya da sağkalımı tahmin etmek için histolojik tanıda kullanılmak üzere prognostik algoritmalara dahil edilmiştir. Bu algoritmaların vakaya özgü uyarlamalarla birlikte kullanılması, klinik evreleme veya histolojik tanı sırasında klinisyenlere ve hasta sahiplerine terapötik karar verme ve bireysel sonuçları öngörme konusunda yardımcı olacaktır.
Ek Kaynaklar: Aşağıdakiler online olarak şu adreste mevcuttur:https://www.mdpi.com/article/ 10.3390/ani11113327/s1, Tablo S1: Klinik değişkenlerin klinik evreye göre sınıflandırılmış sağkalım üzerindeki etkisi için oluşturulan model, Şekil S1: Alınan tedaviye göre sınıflandırılmış tümör ve lenf nodu boyutu, Tablo S2: Sağkalım için klinik algoritmanın Log-rank ve Cox tek değişkenli analizi, Tablo S3: Klinik değişkenlerin progresyonsuz geçen süre üzerindeki etkisi için oluşturulan model, Şekil S2: (a) 46 köpekten alınan primer AGASAC tümörlerinin Ki67% pozitif hücreleri, (b) Ki67% ile bireysel primer tümörlerin mitotik sayısı arasındaki ilişki, Tablo S4: Histolojik değişkenlerin sağkalım üzerindeki etkisi için oluşturulan model, Tablo S5: Prognostik histopatolojik algoritmanın Log-rank ve Cox tek değişkenli analizi.
Katkıda bulunan yazarlar: Konsept Geliştirme, C.L.; Metodoloji, S.B. ve H.W.; Doğrulama, S.B., H.W., R.R., R.D., S.L.P. ve C.L.; Biçimsel Analiz, H.W.; Araştırma, S.B., H.W., R.R, R.D. ve S.L.P.; Kaynaklar, C.L., R.R., R.D. ve S.L.P.; Veri Toplama, S.B. ve H.W.; Yazım-Orijinal Taslak Hazırlama, S.B. ve H.W.; Yazım-İnceleme ve Düzenleme, H.W., S.B., R.R., R.D., A.T., S.L.P. ve C.L.; Görselleştirme, S.B., H.W. ve C.L.; Süpervizyon, C.L., S.L.P. ve A.T.; Proje Yönetimi, C.L.; Fon Sağlama, C.L. ve S.L.P. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir.
Finansman: Bu çalışma, Kraliyet Veteriner Koleji tarafından Kıdemli Klinik Eğitim Bursiyeri Uzmanlık Programı kapsamında sağlanan araştırma ödeneği ile desteklenmiştir. H. Wong Wellcome Trust tarafından finanse edilmiştir. Bu araştırmanın tamamı veya bir kısmı Wellcome Trust tarafından finanse edilmiştir (Hibe numarası 096413/Z/11/Z). Açık erişim sağlamak amacıyla yazar, bu yayından doğan ve yazar tarafından kabul edilen tüm makale versiyonlarına CC BY kamu telif hakkı lisansı uygulamıştır.
Hastane Etik Kurulu Beyanı: Bu çalışma için etik onay alınmamıştır çünkü veriler, 1966 tarihli Veteriner Hekimler Yasası’nın yetkisi altında veteriner tedavisi gören doğal hastalık vakalarından geriye dönük olarak analiz edilmiş ve bu araştırmanın amaçları doğrultusunda klinik yaklaşımda herhangi bir değişiklik yapılmamıştır.
Veri Erişim Beyanı: Bu çalışmanın bulgularını destekleyen veriler Dryad’da mevcuttur [veri alıntısı, doi:10.5061/dryad.x95x69pgx].
Teşekkürler: Bu çalışmaya katkıda bulunan veteriner hekimlere ve histoloji teknisyenlerine teşekkür ederiz. Raporlanan verilerin bazı bölümleri ESVONC Yıllık Kongresi, Gran Canaria, Mayıs 2018 ve ACVP Yıllık Toplantısı, sanal, Ekim 2020’de özet olarak sunulmuştur.
Çıkar Çatışması Beyanı: Yazarlar herhangi bir çıkar çatışması beyan etmemişlerdir. Finansman sağlayanların çalışmanın tasarımında; verilerin toplanmasında, analiz edilmesinde veya yorumlanmasında; makalenin yazılmasında veya sonuçların yayınlanması sürecinde hiçbir rolü olmamıştır.
Ek A
AGASAC ile ilişkili hastalık için cerrahi tedaviyi takiben köpeklerde görülen cerrahi komplikasyonlar
Cerrahi komplikasyonlar arasında hematom oluşumu, rektal yırtılma, açılma, ameliyat sonrası enfeksiyon, kan transfüzyonu gerektiren kanama, septik peritonit, ameliyat sonrası piyelonefrite bağlı akut böbrek yetmezliği, hipokalsemi, nörolojik belirtiler (siyatik nöropraksi, paraparezi, üriner inkontinans) ve ameliyat sırasında ameliyat edilemez hastalığın tespit edilmesi yer almıştır. Biri kaudal vena kava ve aortaya rezeke edilemeyen tümör invazyonu ve mesane nekrozu, diğeri ise şüpheli sistemik enflamatuar reaksiyon sendromuna (SIRS) sekonder kardiyorespiratuar arrest nedeniyle olmak üzere iki köpek hayatını kaybetmiştir.
Ek B
Köpek AGASAC vakaları için radyoterapi
Radyoterapi sekiz köpekte (%10), çoğunlukla cerrahiye adjuvan tedavi olarak ve bir vakada palyatif tedavi olarak kullanılmıştır. Dört köpek anal sakkülektomi ve lenfadenektomi sonrasında hiper fraksiyonlu tedavi gördü. Öngörülen doz, ardışık 5 günde verilen 16 ila 20 günlük fraksiyonlar arasında verilen 45-48 Gy idi. Radyasyon onkoloğu tarafından belirlenen Quad Shot protokolü kullanılarak hipofraksiyone radyoterapi, rezeke edilemeyen primer tümörü olan bir köpek de dahil olmak üzere üç köpekte kullanılmıştır. Protokol, iki gün boyunca dört fraksiyonda verilen ve 12 fraksiyon için 21-28 gün aralıklarla tekrarlanan 3,75 ila 4 Gy’lik öngörülen bir doz kullanmıştır. İlk Quad Shot döngüsü sırasında bir köpekte kabul edilemez yan etkiler (şiddetli ishal, bulantı, anoreksi, grade 4 nötropeni) meydana gelmiş ve protokol daha sonra değiştirilmiştir (beş günlük fraksiyon, 28 günde bir tekrarlanan); bu vakada eş zamanlı olarak mitoksantron verilmiştir. Bir köpek anal sakkülektomiyi takiben radyoterapi almıştır (protokol listelenmemiştir).
Ek C
Köpek AGASAC vakalarının tedavisinde kullanılan tıbbi tedavi
Otuz iki köpek (%40) sistemik medikal tedavi almıştır; bu vakaların 20’si daha önce ameliyat geçirmiştir. Altı köpek, ya ilk ameliyat sonrası tümör yönetiminin bir parçası olarak (dört köpek) ya da bir kurtarma tedavisi olarak (iki köpek) tıbbi tedaviyle eş zamanlı radyoterapi almıştır.
Ek olarak, 17 köpekte kurtarma amaçlı tıbbi tedavi kullanılmıştır. Medikal tedavinin türü ilgili klinisyenin takdirine bağlıydı ve karboplatin (n = 12), melfalan (n = 10), metronomik siklofos- famid (n = 10), mitoksantron (n = 4), toceranib (n = 16), karboplatin + toceranib (n = 2) , metronomik klorambusil (n = 6), metronomik siklofosfamid + toceranib (n = 6), doksorubisin (n = 1), masitinib (n = 1), metronomik siklofosfamid + pamidronat (n = 1), masitinib + metronomik klorambusil (n = 1) ve melfalan + artemisinin (n = 1) kullanıldı. Elli dört köpek (%67) COX-2 inhibitörü almıştır. Kemoterapiye bağlı toksisite 18 köpekte (%56) rapor edilmiş ve 14’ünde (%44) tedavi değişikliğine yol açmıştır; bunlar arasında trombositopeni (n = 9), nötropeni (n = 6), kusma/ishal (n = 11) ve anoreksi/bulantı (n = 5) yer almıştır. Grade III veya IV hematolojik toksisiteler melfalan (trombositopeni, n = 2), karboplatin (nötropeni, n = 1) ve mitoksantron (nötropeni, n = 1) kullanımı ile ilişkilendirilmiştir. Palladia kullanımı grade 2 ALT artışı (n = 1), hipertansiyon (n = 1) ve grade 3 proteinüri (n = 3) ile ilişkilendirilmiştir. Siklofosfamid kullanımını takiben steril hemorajik sistit, uyumlu klinik bulgular ve negatif idrar kültürü ile dört köpekte belgelenmiştir. Kullanılan medyan tıbbi ajan sayısı ikiydi (IQ aralığı 0-6).
KAYNAKÇA
- Berrocal, A.; Vos, J.H.; Van Den Ingh, T.S.; Molenbeek, R.F.; van Sluijs, F.J. Canine Perineal Tumours. J. Vet. Med. Ser. A 1989, 36, 739–749. [CrossRef] [PubMed]
- Williams, L.E.; Gliatto, J.M.; Dodge, R.K.; Johnson, J.L.; Gamblin, R.M.; Thamm, D.; Lana, S.E.; Szymkowski, M.; Moore, A.; Veterinary Cooperative Oncology Group. Carcinoma of the apocrine glands of the anal sac in dogs: 113 cases (1985–1995). J. Am. Vet. Med Assoc. 2003, 223, 825–831. [CrossRef]
- Polton, G.A.; Mowat, V.; Lee, H.C.; McKee, K.A.; Scase, T.J. Breed, gender and neutering status of British dogs with anal sac gland carcinoma. Vet. Comp. Oncol. 2006, 4, 125–131. [CrossRef] [PubMed]
- Aguirre-Hernández, J.; Polton, G.; Kennedy, L.J.; Sargan, D.R. Association between anal sac gland carcinoma and dog leukocyte antigen-DQB1 in the English Cocker Spaniel. Tissue Antigens 2010, 76, 476–481. [CrossRef] [PubMed]
- Bennett, P.F.; DeNicola, D.B.; Bonney, P.L.; Glickman, N.W.; Knapp, D.W. Clinical Anal Sac Adenocarcinomas: Clinical Presentation and Response to Therapy. J. Vet. Intern. Med. 2002, 16, 100–104. [CrossRef]
- Brisson, B.A.; Whiteside, D.P.; Holmberg, D.L. Metastatic Anal Sac Adenocarcinoma in a Dog Presenting for Acute Paralysis. Can. Vet. J. 2004, 45, 678–681. [PubMed]
- Polton, G.A.; Brearley, M.J. Clinical Stage, Therapy, and Prognosis in Canine Anal Sac Gland Carcinoma. J. Vet. Intern. Med. 2007, 21, 274–280. [CrossRef]
- Meuten, D.J.; Cooper, B.J.; Capen, C.C.; Chew, D.J.; Kociba, G.J. Hypercalcemia Associated with an Adenocarcinoma Derived from the Apocrine Glands of the Anal Sac. Vet. Pathol. 1981, 18, 454–471. [CrossRef]
- Rosol, T.J.; Capen, C.C.; Danks, J.A.; Suva, L.J.; Steinmeyer, C.L.; Hayman, J.; Ebeling, P.R.; Martin, T.J. Identification of Parathyroid Hormone- Related Protein in Canine Apocrine Adenocarcinoma of the Anal Sac. Vet. Pathol. 1990, 27, 89–95. [CrossRef]
- Messinger, J.S.; Windham, W.R.; Ward, C.R. Ionized Hypercalcemia in Dogs: A Retrospective Study of 109 Cases (1998–2003). J. Vet. Intern. Med. 2009, 23, 514–519. [CrossRef]
- Suzuki, K.; Morita, R.; Hojo, Y.; Nomura, K.; Shibutani, M.; Mitsumori, K. Immunohistochemical Characterization of Neuroen- docrine Differentiation of Canine Anal Sac Glandular Tumours. J. Comp. Pathol. 2013, 149, 199–207. [CrossRef] [PubMed]
- Bowlt, K.; Friend, E.; Delisser, P.; Murphy, S.; Polton, G. Temporally Separated Bilateral Anal Sac Gland Carcinomas in Four Dogs. J. Small Anim. Pr. 2013, 54, 432–436. [CrossRef] [PubMed]
- Tripp, C.D.; Fidel, J.; Anderson, C.L.; Patrick, M.; Pratt, C.; Sellon, R.; Bryan, J.N. Tolerability of Metronomic Administration of Lomustine in Dogs with Cancer. J. Vet. Intern. Med. 2011, 25, 278–284. [CrossRef]
- Urie, B.K.; Russell, D.S.; Kisseberth, W.C.; London, C.A. Evaluation of Expression and Function of Vascular Endothelial Growth Factor Receptor 2, Platelet Derived Growth Factor Receptors-Alpha and -Beta, KIT, and RET in Canine Apocrine Gland Anal Sac Adenocarcinoma and Thyroid Carcinoma. BMC Vet. Res. 2012, 8, 1. [CrossRef]
- Wouda, R.M.; Borrego, J.; Keuler, N.S.; Stein, T. Evaluation of Adjuvant Carboplatin Chemotherapy in the Management of Surgically Excised Anal Sac Apocrine Gland Adenocarcinoma in Dogs. Vet. Comp. Oncol. 2016, 14, 139–148. [CrossRef]
- Pradel, J.; Berlato, D.; Dobromylskyj, M.; Rasotto, R. Prognostic Significance of Histopathology in Canine Anal Sac Gland Adenocarcinomas: Preliminary Results in a Retrospective Study of 39 Cases. Vet. Comp. Oncol. 2018, 16, 518–528. [CrossRef]
- Skorupski, K.; Alarcón, C.; de Lorimier, L.; LaDouceur, E.; Rodriguez, C.; Rebhun, R. Outcome and Clinical, Pathological, and Immunohistochemical Factors Associated with Prognosis for Dogs with Early-Stage Anal Sac Adenocarcinoma Treated with
Surgery Alone: 34 Cases (2002–2013). J. Am. Vet. Med. Assoc. 2018, 253, 84–91. [CrossRef]
- Barnes, D.C.; Demetriou, J.L. Surgical Management of Primary, Metastatic and Recurrent Anal Sac Adenocarcinoma in the Dog: 52 Cases. J.
Small Anim. Pract. 2017, 58, 263–268. [CrossRef]
- Potanas, C.; Padgett, S.; Gamblin, R. Surgical Excision of Anal Sac Apocrine Gland Adenocarcinomas with and without Adjunctive
Chemotherapy in Dogs: 42 Cases (2005–2011). J. Am. Vet. Med. Assoc. 2015, 246, 877–884. [CrossRef] [PubMed]
20.Emms, S. Anal Sac Tumours of the Dog and Their Response to Cytoreductive Surgery and Chemotherapy. Aust. Vet. J. 2008, 83, 340–343.
[CrossRef]
- Hobson, H.; Brown, M.; Rogers, K. Surgery of Metastatic Anal Sac Adenocarcinoma in Five Dogs. Vet. Surg. 2006, 35, 267–270. [CrossRef]
- Meier, V.; Polton, G.; Cancedda, S.; Roos, M.; Laganga, P.; Emmerson, T.; Rohrer Bley, C. Outcome in Dogs with Advanced (Stage 3b) Anal
Sac Gland Carcinoma Treated with Surgery or Hypofractionated Radiation Therapy. Vet. Comp. Oncol. 2017, 15, 1073–1086. [CrossRef]
[PubMed]
- McQuown, B.; Keyerleber, M.; Rosen, K.; McEntee, M.; Burgess, K. Treatment of Advanced Canine Anal Sac Adenocarcinoma with
Hypofractionated Radiation Therapy: 77 Cases (1999–2013). Vet. Comp. Oncol. 2017, 15, 840–851. [CrossRef]
- Hammer, A.S.; Couto, C.G.; Ayl, R.D.; Shank, K.A. Treatment of Tumor-Bearing Dogs With Actinomycin D. J. Vet. Intern. Med. 1994, 8, 236–239. [CrossRef] [PubMed]
- Poirier, V.J.; Burgess, K.E.; Adams, W.M.; Vail, D.M. Toxicity, Dosage, and Efficacy of Vinorelbine (Navelbine) in Dogs with Spontaneous Neoplasia. J. Vet. Intern. Med. 2004, 18, 536–539. [CrossRef]
- Dominguez, P.; Dervisis, N.; Cadile, C.; Sarbu, L.; Kitchell, B. Combined Gemcitabine and Carboplatin Therapy for Carcinomas in Dogs. J. Vet. Intern. Med. 2009, 23, 130–137. [CrossRef]
- London, C.; Mathie, T.; Stingle, N.; Clifford, C.; Haney, S.; Mary, K.; Beaver, L.; Vickery, K.; Vail, D.M.; Hershey, B.; et al. Preliminary Evidence for Biologic Activity of Toceranib Phosphate (Palladia®) in Solid Tumors. Vet. Comp. Oncol. 2012, 10, 194–205. [CrossRef] [PubMed]
- Leach, T.N.; Childress, M.O.; Greene, S.N.; Mohamed, A.S.; Moore, G.E.; Schrempp, D.R.; Lahrman, S.R.; Knapp, D.W. Prospective Trial of Metronomic Chlorambucil Chemotherapy in Dogs with Naturally Occurring Cancer. Vet. Comp. Oncol. 2012, 10, 102–112. [CrossRef]
- Heaton, C.M.; Fernandes, A.F.A.; Jark, P.C.; Pan, X. Evaluation of Toceranib for Treatment of Apocrine Gland Anal Sac Adenocar- cinoma in Dogs. J. Vet. Intern. Med., 2020, 34, 873–881. [CrossRef]
- Morello, E.M.; Cino, M.; Giacobino, D.; Nicoletti, A.; Iussich, S.; Buracco, P.; Martano, M. Prognostic Value of Ki67 and Other Clinical and Histopathological Factors in Canine Apocrine Gland Anal Sac Adenocarcinoma. Animals 2021, 11, 1–17. [CrossRef]
- Schlag, A.; Johnson, T.; Vinayak, A.; Kuvaldina, A.; Skinner, O.; Wustefeld-Janssens, B. Comparison of Methods to Determine Primary Tumour Size in Canine Apocrine Gland Anal Sac Adenocarcinoma. J. Small Anim. Pr. 2020, 61, 185–189. [CrossRef]
- Nguyen, S.; Thamm, D.; Vail, D.; London, C. Response Evaluation Criteria for Solid Tumours in Dogs (v1.0): A Veterinary Cooperative Oncology Group (VCOG) Consensus Document. Vet. Comp. Oncol. 2015, 13, 176–183. [CrossRef]
- Heinze, G.; Wallisch, C.; Dunkler, D. Variable Selection—A Review and Recommendations for the Practicing Statistician. Biom. J. 2018, 60, 431–449. [CrossRef]
34.Youden, W.J. Index for Rating Diagnostic Tests. Cancer 1950, 3, 32–35. [CrossRef]
- Akaike, H. New Look at the Statistical Model Identification. In Selected Papers of Hirotugu Akaike; Parazen, E., Tanabe, K., Kitagawa, G., Eds.;
Springer: New York, NY, USA, 1974.
- Goldschmidt, M.H.; Goldschmidt, K.H. Epithelial and Melanocytic Tumors of the Skin. In Tumors in Domestic Animals, 5th ed.; Meuten,
D.J., Ed.; Wiley-Blackwell: Ames, IA, USA, 2017; pp. 120–122.
- Moik, F.; Zöchbauer-Müller, S.; Posch, F.; Pabinger, I.; Ay, C. Systemic Inflammation and Activation of Haemostasis Predict Poor Prognosis
and Response to Chemotherapy in Patients with Advanced Lung Cancer. Cancers 2020, 12, 1–17. [CrossRef]
38.Heinze, G.; Dunkler, D. Five Myths about Variable Selection. Transpl. Int. 2017, 30, 6–10. [CrossRef]
- Nadeau, M.E.; Kitchell, B.E. Evaluation of the Use of Chemotherapy and Other Prognostic Variables for Surgically Excised Canine Thyroid
Carcinoma with and without Metastasis. Can. Vet. J. 2011, 52, 994–998. [PubMed]
- Campos, M.; Ducatelle, R.; Rutteman, G.; Kooistra, H.S.; Duchateau, L.; de Rooster, H.; Peremans, K.; Daminet, S. Clinical, Pathologic, and
Immunohistochemical Prognostic Factors in Dogs with Thyroid Carcinoma. J. Vet. Intern. Med. 2014, 28, 1805–1813. [CrossRef] [PubMed]
- Bundred, N.J.; Ratcliffe, W.A.; Walker, R.A.; Coley, S.; Morrison, J.M.; Ratcliffe, J.G. Parathyroid Hormone Related Protein and
Hypercalcaemia in Breast Cancer. Br. Med. J. 1991, 303, 1506–1509. [CrossRef] [PubMed]
- Powell, G.J.; Southby, J.; Danks, J.A.; Stillwell, R.G.; Hayman, J.A.; Henderson, M.A.; Bennett, R.C.; Martin, T.J. Localization of Parathyroid
Hormone-Related Protein in Breast Cancer Metastases: Increased Incidence in Bone Compared with Other Sites. Cancer Res. 1991, 51, 3059–3061.