| Nicolas Diop [1] | David Sayag [2] | Grégoire Bernardo Marques [1] | Gabriel Chamel [1] | Thomas Chavalle [1] | Jean-Bapiste Eon [1] | Franck Floch [3] | Mathilde Lajoinie [1] | Frédérique Ponce [1] | Laura E. Barrett [1] Université de Lyon, VetAgro Sup, Service de cancérologie, UR ICE, Marcy l’Etoile, Fransa | 2ONCOnseil—Unité d’expertise en oncologie vétérinaire, Toulouse, Fransa | 3AniCura TRIOVet, Rennes, Fransa İletişim: Nicolas Diop (nicolas.diop@vetagro-sup.fr) |
| ÖZET İntravenöz (IV) ve/veya intratümöral (IT) bleomisin ile elektrokemoterapi (ECT), rezeke edilemeyen kedi kutanöz skuamöz hücreli karsinomunun (cSCC) tedavisinde %95’e varan yanıt oranlarıyla önemli ölçüde etkinlik göstermiştir, ancak diğer kemoterapi protokolleri henüz araştırılmamıştır. Bu prospektif çok merkezli çalışmanın amacı, IT ve IV karboplatin (IV + IT), IV karboplatin (IV) veya IV bleomisin (IV) kullanılarak ECT ile tedavi edilen cSCC’li kediler arasındaki genel yanıt oranını (ORR) ve progresyonsuz geçen süreyi (PFI) karşılaştırmaktır. Üç merkezde rezeke edilemeyen cSCC’li toplam 44 kedi kaydedilmiş ve karboplatin IV + IT (n = 10), karboplatin IV (n = 11) veya bleomisin IV (n = 23) kullanılarak EKT ile tedavi edilmiştir. RECIST kriterlerine göre tedavi yanıtı tedaviden 2 ve 4 hafta sonra kaydedilmiş ve hastalar hastalık ilerleyene ve/veya ölene kadar takip edilmiştir. Her üç grup da yaş, cinsiyet, kilo ve lezyon boyutu açısından karşılaştırılabilirdi. Yan etkiler genellikle hafif, lokalize ve gruplar arasında benzerdi. ORR’ler %90,0 (karboplatin IV + IT), %90,9 (karboplatin IV) ve %95,6 (bleomisin IV) olup istatistiksel olarak anlamlı farklılık göstermemiştir (p = 0,79). Ortalama PFI’ye karboplatin IV + IT veya karboplatin IV için ulaşılamamış ve bleomisin IV için 566 gün olmuştur ve üç grup arasında anlamlı bir fark bulunmamıştır (p = 0.81). Bu çalışma, IV veya IV + IT karboplatin kullanılarak yapılan EKT’nin cSCC’nin tedavisinde uygun bir alternatif tedavi seçeneği olduğunu ve tedavi protokolleri arasındaki sonuçları karşılaştırmak için daha fazla çalışma yapılması gerektiğini göstermektedir. |
| GİRİŞ Kutanöz skuamöz hücreli karsinom (cSCC) kedilerdeki deri tümörlerinin yaklaşık %10-15’ini [1] oluşturur ve gelişimi ultraviyole radyasyona kronik maruziyetle ilişkilendirilmiştir. Geri dönüşümlü, tümöral olmayan aktinik keratinöz lezyonlar ile malign, geri dönüşümsüz skuamöz hücreli karsinom arasında bir süreklilik vardır. cSCC’ler genellikle pigmentsiz veya hafif pigmentli deride görülür ve en sık nazal planumda (%80-90) [2], kulak kepçesinde (özellikle kenarlarda) (%50), göz kapaklarında (%20) ve dudaklarda yerleşir. Klinik prezentasyon değişkendir ancak sıklıkla ülseratif veya kabuklu plak benzeri bir lezyon olarak ortaya çıkar. Çeşitli terapötik seçenekler cSCC’nin tedavisinde etkinlik göstermiştir ve cerrahi altın standart olarak 19,8 ayın üzerinde hastalıksız geçen süreler (DFI) sunmaktadır [3–5]. Bununla birlikte, nazal planum veya medial kantus gibi zorlu bölgelerdeki tümörler için cerrahi her zaman mümkün olmayabilir. Radyoterapi (eksternal ışın radyoterapisi ve brakiterapi), 692-1071 güne kadar progresyonsuz geçen süreler (PFI) sunan inoperabl cSCC tedavisi için düşünülebilir [6–9]. Bununla birlikte, bu tür modalitelerin bulunabilirliği veya kabul edilebilirliği evcil hayvan sahipleri için sınırlı olabilir. İntravenöz (IV) kemoterapi cSCC tedavisi amacıyla araştırılmıştır, ancak tek bir ajan olarak etkinliği genellikle hayal kırıklığı yaratmakta ve düşük yanıt oranları ile ilişkilendirilmektedir [10–12]. İntratümöral (IT) karboplatin enjeksiyonu, ortalama 16 aylık progresyonsuz sağkalım ile umut verici sonuçlar göstermiştir [10]. Bununla birlikte, kemoterapinin IT uygulaması sağlık personelinin maruziyetini önemli ölçüde artırmaktadır. Elektrokemoterapinin (ECT) ortaya çıkışı, kedi cSCC’sinin yönetimi için yeni olanaklar yaratmıştır. EKT, aksi takdirde plazma zarını geçemeyecek olan moleküllere karşı hücreleri geçirgen hale getirmek için elektrik akımı uygulamasıyla kolaylaştırılan elektroporasyon olgusuna dayanır. Bu süreç, geçirgen olmayan veya zayıf geçirgen sitotoksik ajanların hedef hücrelerin sitozollerine içselleştirilmesini kolaylaştırır [13]. Ayrıca tümör vaskülarizasyonunu azalttığı ve tümör antijenine yönelik bir immün yanıtı aktive ettiği görülmüştür [14–16]. IV bleomisin ile EKT’nin, %65-83 tam yanıt (CR) dahil olmak üzere %70-95 oranında yayınlanan yanıt oranlarıyla kedi cSCC’si için etkili bir tedavi olduğu kanıtlanmıştır [2, 17, 18]. Platin ajanlar da EKT ajanları olarak araştırılmıştır. Karboplatin, elektroporasyonla birleştirildiğinde hücre penetrasyonunda 1,6-13 kat artış olduğunu gösteren mevcut in vitro verilere ek olarak IT [10] ve IV kemoterapi ajanı olarak iyi yapılandırılmış güvenlik profili göz önüne alındığında EKT için ilginç bir alternatiftir [19, 20]. Birkaç çalışma, kedilerde EKT ile birlikte sisplatin kullanma potansiyelini vurgulamıştır [21, 22]. Bununla birlikte, sisplatinin IV uygulama ile ciddi pulmoner sistemik toksisitesi [23] kedi hastalarında kullanımını sınırlamakta ve karboplatini cazip bir seçenek haline getirmektedir. Yazarların bilgisi dahilinde, kedi popülasyonunda cSCC tedavisi için IT ve/veya IV karboplatin uygulaması ile birlikte EKT’nin güvenliği ve etkinliğine ilişkin yayınlanmış herhangi bir veri bulunmamaktadır. Bu çalışmanın amaçları (1) IV karboplatinli EKT veya IV + IT karboplatinli EKT ile tedavi edilen cSCC’li kedilerin sonuçlarını prospektif olarak değerlendirmek ve (2) bu sonuçları IV bleomisinli EKT ile tedavi edilen kedi popülasyonu ile retrospektif olarak karşılaştırmaktır. Yanıt oranları, nüks oranları ve uzun vadeli sonuçların üç grup arasında benzer olacağı varsayılmıştır. Materyal ve Yöntem Hücre Hattı Onay Beyanı Hücre hattı kullanılmamıştır. Çalışma Tasarımı Çok merkezli, prospektif, randomize olmayan bu çalışma Eylül 2021 – Aralık 2023 tarihleri arasında gerçekleştirilmiş ve Hayvan Kullanımı Etik Kurulu tarafından onaylanmıştır (protokol numarası RECH-ETIC-P003-E01). Vakalar iki Fransız veterinerlik kurumundan (VetAgro Sup Veteriner Eğitim Hastanesi, Campus Vétérinaire de Lyon, Fransa; ve ONCOnseil, Fransa) alınmıştır. Sahiplerinin bakım standardı tedaviyi (cerrahi veya radyoterapi) reddettiği, ölçülebilir hastalığı olan sitolojik veya histolojik cSCC tanısı olan kediler bu çalışma için uygun bulunmuştur. Mevcut lezyon için daha önce cerrahi, radyoterapi veya EKT ile tedavi edilmiş kediler çalışma dışı bırakılmıştır. Daha önce imiquimod ile tedavi edilen kedilere, imiquimod alırken nüks veya hastalık ilerlemesi göstermiş olmaları ve yaygın görülen ve gerçek dünyadaki klinik senaryoları yansıtan çalışma kaydı öncesinde tedavinin kesilmiş olması koşuluyla izin verilmiştir [24]. Fiziksel muayene ve ince iğne aspirasyonu ile lokal lenf nodu değerlendirmesi ve büyümüş lenf nodlarının sitolojisi çalışmaya dahil edilmek için gerekliydi, ancak torasik radyo grafiler veya torasik bilgisayarlı tomografi (BT) taraması ile uzak evreleme gerekli değildi. Prospektif çalışmaya dahil edilen tüm kedilerin sahiplerinden yazılı bilgilendirilmiş onam alınmıştır. Kediler, çalışmaya dahil edildikleri merkeze bağlı olarak IV + IT karboplatin veya IV karboplatin ile tedavi edilmiştir; VetAgroSup’ta tedavi edilen kediler karboplatin IV + IT grubuna, ONCOnseil’de tedavi edilen kediler ise karboplatin IV grubuna dahil edilmiştir. Tedavi sonrası takip, tedaviden sonraki ilk 3 ay içinde her 2-4 haftada bir, daha sonra ilk 6 ay içinde her 2-3 ayda bir ve sonrasında her 6 ayda bir telefon görüşmeleri ve yeniden kontrol muayenelerinden oluşmuştur. Yanıt 4. haftada değerlendirilmiştir. Belirtiler, yan etkiler, yanıt ve sağkalım dahil olmak üzere klinik veriler tüm kediler için prospektif olarak kaydedilmiştir. Retrospektif kontrol grubu için, iki Fransız veterinerlik kurumunun (ONCOnseil, Fransa; AniCura TRIOVet, Fransa) elektronik tıbbi veri tabanlarında sitolojik veya histolojik olarak teşhis edilmiş, ölçülebilir, tedavi edilmemiş, IV bleomisinli EKT ile tedavi edilmiş kedi cSCC vakaları araştırılmıştır. Tüm kediler için sinyal ve klinik sunum, yapılmışsa evreleme testlerinin sonuçları, advers olaylar, yanıt ve sağkalım dahil olmak üzere klinik veriler kaydedilmiştir. Veri Toplama Her kedi için kaydedilen arka plan bilgileri arasında belirtiler, vücut ağırlığı, primer tümör tanımı (anatomik yerleşim, en büyük çap), primer cSCC’nin ilk gözlem tarihi, önceki veya eşzamanlı hastalıklar, klinik belirtilerin varlığı, evreleme testlerinin sonuçları ve tanı yöntemi yer almıştır. Toplanan tedavi ve takip verileri arasında protokol tipi, tedavi öncesi lezyonun boyutu ve yeri, kemoterapiye başlama tarihi, CR elde etmek için seans sayısı, yanıt tipi ve süresi, EKT sonrası advers olaylar, 2 ve 4. haftalarda yanıt, nüks ve/veya metastaza kadar geçen süre ve ölüm tarihi ve nedeni yer almıştır. Tüm vakalar, primer tümör boyutu (T), bölgesel lenf nodu tutulumu (N) ve uzak metastazı (M) değerlendiren kedi deri tümörleri için DSÖ sınıflandırmasına göre evrelendirilmiştir (Tablo 1) [25]. Advers olaylar Veteriner Kooperatif Onkoloji Grubu (VCOG)- Advers Olaylar için Ortak Terminoloji Kriterleri v2.0 [26] ve ACVR ve ECVDI konsensüs beyanı: veteriner radyoterapi onkoloji grubu v2.0 (VRTOG) toksisite kriterleri için raporlama kriterleri [27] uyarınca kaydedilmiş ve derecelendirilmiştir. Radyoterapide yan etkiler için sınıflandırma yapma kararı, beklenen advers reaksiyonların, özellikle de kutanöz etkilerin EKT ve radyoterapi arasındaki benzerliğine dayandırılmıştır. Tedaviye lokal yanıt 4. haftada değerlendirildi ve VCOG- Solid Tümörlerde Yanıt Değerlendirme Kriterleri v1.0 (RECIST) kriterlerine [28] göre şu şekilde değerlendirildi: CR (tüm hedef ve hedef dışı lezyonların rezolüsyonu ve yeni lezyonların olmaması), kısmi yanıt (PR, hedef lezyonların en uzun çapında %30 veya daha fazla azalma, hedef dışı lezyonlarda ilerleme olmaması ve yeni lezyonların olmaması), stabil hastalık (SD, hedef lezyonlarda %30’dan az azalma veya hedef lezyonlarda %20’den az artış, hedef dışı lezyonlarda ilerleme olmaması ve yeni lezyon olmaması) ve progresif hastalık (PD) (hedef lezyonlarda %20’den fazla artış gelişmesi veya yeni lezyonların belgelenmesi). Şüpheli bir lezyon ortaya çıktığında sitolojik veya histopatolojik inceleme yapılmıştır. Tedaviye kadar geçen süre, lezyonun hasta sahibi tarafından tanımlanmasından tedaviye başlanmasına kadar geçen süre olarak belirlenmiştir. PFI, ilk tedavi tarihi ile sitolojik/histolojik inceleme yoluyla PH’nin gösterilmesi arasındaki gün sayısı olarak tanımlanmıştır. Kediler, son takip tarihlerinde, takip için kaybedilmişlerse, çalışma tamamlandığında belgelenmiş ilerleme olmaksızın hayattalarsa veya PH belirtisi olmaksızın herhangi bir nedenden ölmüşlerse PFI analizinden sansürlenmiştir. Genel sağkalım süresi, sitolojik/histolojik tanı ile herhangi bir nedenden ölüm arasındaki gün sayısı olarak tanımlanmıştır. Kediler, takibi kaybedilmiş veya çalışma tamamlandığında hala hayattaysa, son takip tarihlerinde OST analizinden sansürlenmiştir.
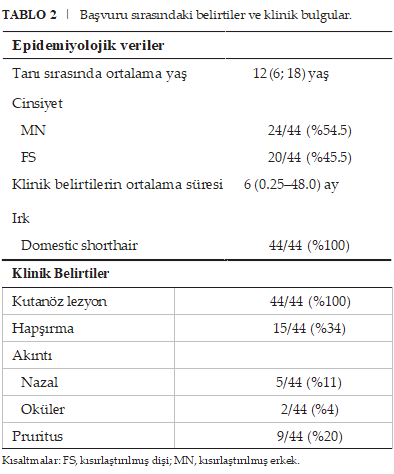
Tedavi Protokolleri Tedavi öncesinde tüm kedilerde tam kan sayımı ve serum biyokimya analizi (total protein ve albümin, kan üre nitrojeni, kreatinin, alkalin fosfataz, alanin transferaz ve glukoz) yapılmıştır. EKT, Veteriner Hekimliği için uyarlanmış Avrupa Standart Çalışma Prosedürüne uygun olarak gerçekleştirilmiştir [29-31]. Elektrik darbeleri (100 μs darbe süreli 8 darbe, 1000-1300 V/cm genlik-elektrot mesafesi oranı ve 5 KHz frekans) bir elektrik darbe jeneratörü (ELECTROvetEZ, Saint-Orens-de-Gameville, Fransa) tarafından üretildi ve ya iki paralel L-şekilli elektrot (birbirinden 10 mm aralıklı 1 cm paslanmaz çelik elektrotlar) ya da iğne elektrotlar (birbirinden 4 mm aralıklı, 10 mm uzunluğunda iki paslanmaz çelik iğneden oluşan iki paralel sıra) aracılığıyla verildi (Tablo S1). Yüzeysel lezyonlar L şeklindeki elektrotlarla, daha derin veya kalın lezyonlar ise iğne elektrotlarla tedavi edildi; kullanılan elektrot tipinin seçimine operatör karar verdi. Elektrik darbeleri IV kemoterapi enjeksiyonundan 8 dakika sonra uygulanmıştır. IV ve IT karboplatin alan grup için, IT karboplatin enjeksiyonu elektrik darbesinin uygulanmasından hemen önce gerçekleştirilmiştir. Tüm tümör alanını elektroporlamak için elektrik atım grupları uygulandı ve uygulanabilir olduğunda (yani, sağlıklı organları etkilemeden erişilebilir olduğunda), tümörün etrafına 5 mm’lik bir marj uygulandı. Üç grup aşağıdaki gibi tanımlandı: Tedavi öncesi kan üre nitrojen ve kreatinin değerlerine bağlı olarak %15-%20 oranında karboplatin dozu azaltımına izin verilmiş ve tedavi eden klinisyenin takdirine bırakılmıştır. 40-50 mg/m2’lik IT karboplatin dozu, kedilerde 100 mg/m2’ye kadar IT enjeksiyonun iyi tolere edildiğini gösteren önceki verilere [10] ve ilaç sızıntısını en aza indirirken enjeksiyon hacminin uygulanabilirliğine dayanarak seçilmiştir. Karboplatinin IV dozu tedaviyi yürüten klinisyen tarafından belirlenmiş ve kedilerde 200 ila 240 mg/m2 arasında değişen maksimum tolere edilen karboplatin dozlarına ilişkin mevcut literatüre dayanmıştır [32, 33]. Tüm tedaviler yeterli analjezi ile birlikte genel anestezi altında uygulanmıştır (Ek Veri S2). Ülkeye özgü yerel mevzuatın gerektirdiği şekilde, tüm kediler kemoterapiden sonra 24 saat süreyle hastaneye yatırılmıştır. Yanıtın 4. haftada değerlendirilmesinden sonra, CR’ye ulaşılamazsa, klinisyenin görüşüne göre sahibine başka bir EKT seansı önerildi. Bir kedide takip süresi boyunca ikinci, belirgin bir lezyon ortaya çıkarsa, bu ikinci lezyon yanıt değerlendirmesi için dikkate alınmamıştır. İstatiksel Analiz Tanımlayıcı İstatistikler Sürekli veriler normallik açısından görsel olarak değerlendirilmiş ve normal bir dağılım izliyorsa ortalama ve standart sapma kullanılarak tanımlanmıştır. Veriler normal dağılım göstermiyorsa, tanımlama için ortalama ve çeyrekler arası aralık kullanılmıştır. Yanıt Analizi Genel yanıt oranı (ORR), CR + PR elde eden kedilerin yüzdesi olarak tanımlanmıştır. Normal dağılıma sahip sürekli değişkenler için ANOVA testi kullanılırken, diğer sürekli değişkenler için Kruskal-Wallis testi kullanılmıştır. Kategorik değişkenler için, varsayımlar karşılandığında (yani, tüm beklenen değerler sıfır hipotezi altında ≥5 olduğunda) ki-kare testi uygulanmıştır. Aksi takdirde Fisher’in kesin testi kullanılmıştır. Tek Değişkenli Sağkalım Analizi Farklı gruplar içindeki PFI ve OST fonksiyonlarını tahmin etmek için Kaplan-Meier yöntemi kullanılmıştır. Bu gruplar arasındaki sonuçları karşılaştırmak için Log-rank testleri kullanılmıştır. P-değerinin 0.05’ten küçük olması istatistiksel olarak anlamlı kabul edilmiştir. İstatistiksel analiz XLSTAT yazılımı kullanılarak gerçekleştirilmiştir. Sonuçlar Çalışma Grubu Toplam 44 cSCC’li kedi dahil edilme kriterlerini karşılamıştır. Başvuru sırasındaki sinyal ve klinik bulgulara ilişkin veriler tüm kediler için mevcuttu (Tablo 2). Tüm hastalar evcil shorthair kedileriydi (44/44) ve her iki cinsiyet de dengeli bir şekilde mevcuttu (erkekler 24/44; dişiler 20/44). Tüm hastalar kısırlaştırılmıştı. Tanı konulduğunda ortanca yaş 12 idi (aralık: 6-18 yıl). Tanıdan önceki klinik bulguların ortalama süresi 6 aydı (aralık: 0,25-48 ay). İlk başvuruda, tüm kedilerde deri lezyonu vardı. Bazıları ek klinik belirtilerle başvurdu: 34’ünde (15/44) hapşırma, %16’sında (7/44) burun veya göz akıntısı ve %20’sinde (9/44) kaşıntı vardı. Sonuçta, 10 kedi karboplatin IV + IT grubuna, 11 kedi karboplatin IV grubuna ve 23 kedi bleo-misin grubuna dahil edildi.
Teşhis ve Evreleme Kesin tanı popülasyonun %34’ünde (15/44) sitoloji, %61’inde (27/44) histoloji ve %5’inde (2/44) hem sitoloji hem de histoloji ile elde edilmiştir. Kedilerin %89’unda (39/44) ya radyografi (31/39, %79) ya da baş ve toraks BT taraması (8/39, %21) yoluyla torasik görüntüleme yapılmıştır; hiçbirinde iki yöntem bir arada kullanılmamıştır. Göğüs radyografilerinde bir kedide kardiyomegali ve başka bir kedide tek bir şüpheli pulmoner nodül görüldü. Baş ve toraks BT taramalarında bir kedide hafif lokorejyonel lenf nodu büyümesi görüldü. Kedilerin %7’sine (3/44) abdominal ultrason uygulandı ve kayda değer bir bulguya rastlanmadı. Kedilerin %23’üne (10/44) lokorejyonel lenf nodu aspirasyonu uygulandı, BT taramasında lokorejyonel lenf nodu büyümesi olan kedi de dahil olmak üzere hiçbirinde metastaz pozitif çıkmadı. Biri hariç tüm kediler I. evredeydi (T1N0M0). Kalan kedide pulmoner nodül şüphesi vardı ve T1N0Mx evresi için daha fazla araştırılmadı. Başvuru sırasındaki lezyonların ortalama boyutu 10 mm (aralık: 2-35 mm) olup, 36 lezyon nazal planumda, 6 lezyon medial oküler kantusta ve 6 lezyon kulakta görülmüştür. Altı kedi (%14) birden fazla lezyonla başvurdu. Lezyonun boyutu farklı gruplar arasında anlamlı bir farklılık göstermemiştir (p = 0.186). Toksisite ve Yan Etkiler Karboplatin IV + IT, karboplatin IV ve bleomisin IV gruplarındaki kedilerin sırasıyla 3/10’unda (%30), 3/11’inde (%27) ve 3/23’ünde (%13) sistemik toksisite gözlenmiştir. Sistemik toksisiteler grade I kusma (6/9 kedi) veya grade I hiporeksi (3/9) idi. Kuru veya nemli deskuamasyon, ülserasyon, burun ödemi/tıkanıklığı ve hapşırma gibi lokal yan etkiler (n = 35) kedilerin 35/44’ünde (%80) gözlenmiştir. Tüm lokal yan etkiler grade I veya II idi (VCOG ve VRTOG). Karboplatin IV + IT grubunda, kedilerin %70’inde (7/10) 6/10’unda kuru deskuamasyon, 3/10’unda eritem, 2/10’unda ödem ve 1/10’unda hapşırma dahil olmak üzere en az bir lokal yan etki görülmüştür. Karboplatin IV grubunda, kedilerin %73’ü (8/11) 8/11’inde kuru deskuamasyon dahil olmak üzere en az bir lokal yan etki yaşamıştır. Son olarak, bleomisin IV grubundaki kedilerin %82’si (19/23) 13/23’ünde hapşırma, 7/23’ünde ödem ve 7/23’ünde kuru deskuamasyon dahil olmak üzere en az bir lokal yan etki deneyimlemiştir. Üç grup arasında lokal veya sistemik yan etkilerin oluşumu açısından istatistiksel bir fark bulunmamıştır (p = 0.71). Tedavi ve Sonuçlar Ortalama tedavi süresi karboplatin IV + IT, karboplatin IV ve bleomisin IV grupları için sırasıyla 12 (0; 26.4), 6 (1.5; 11.5) ve 6 (0; 17.2) aydı. Gruplar arasında istatistiksel fark bulunmamıştır (p = 0.108). Dört kedide tedavi öncesi böbrek değerlerinin yüksek olması nedeniyle doz azaltılması gerekmiştir; hepsi karboplatin IV + IT grubundaydı. Üç kedi derin lezyonlar nedeniyle iğne elektrotlarla tedavi edildi; ikisi bleomisin IV grubuna ve biri karboplatin IV grubuna dahil edildi; diğer tüm kediler paralel L şekilli elektrotlarla tedavi edildi. 44 kedinin tamamı 4. haftada yanıt analizi için kullanılabilir durumdaydı. Karboplatin IV + IT grubunda, 8/10 kedide (%80) CR kaydedilmiş (Resim 1), 1/10 kedide (%10) PR gözlenmiş ve 1/10 kedide (%10) EKT sonrası 4. haftada yanıt (PD) elde edilememiş, sonuç olarak ORR %90,0 olmuştur (Resim 1). İki kedide daha sonra 68 ve 477. günlerde hastalık nüksü gelişmiştir. Bu gruptaki kediler için ortalama PFI değerine ulaşılamamıştır (aralık: 298-572 gün) (Şekil 2). PD yaşayan kediye 98. günde ötenazi uygulanmıştır. Ortalama OST 669 gündü (aralık: 90-1034 gün) (Şekil 3).
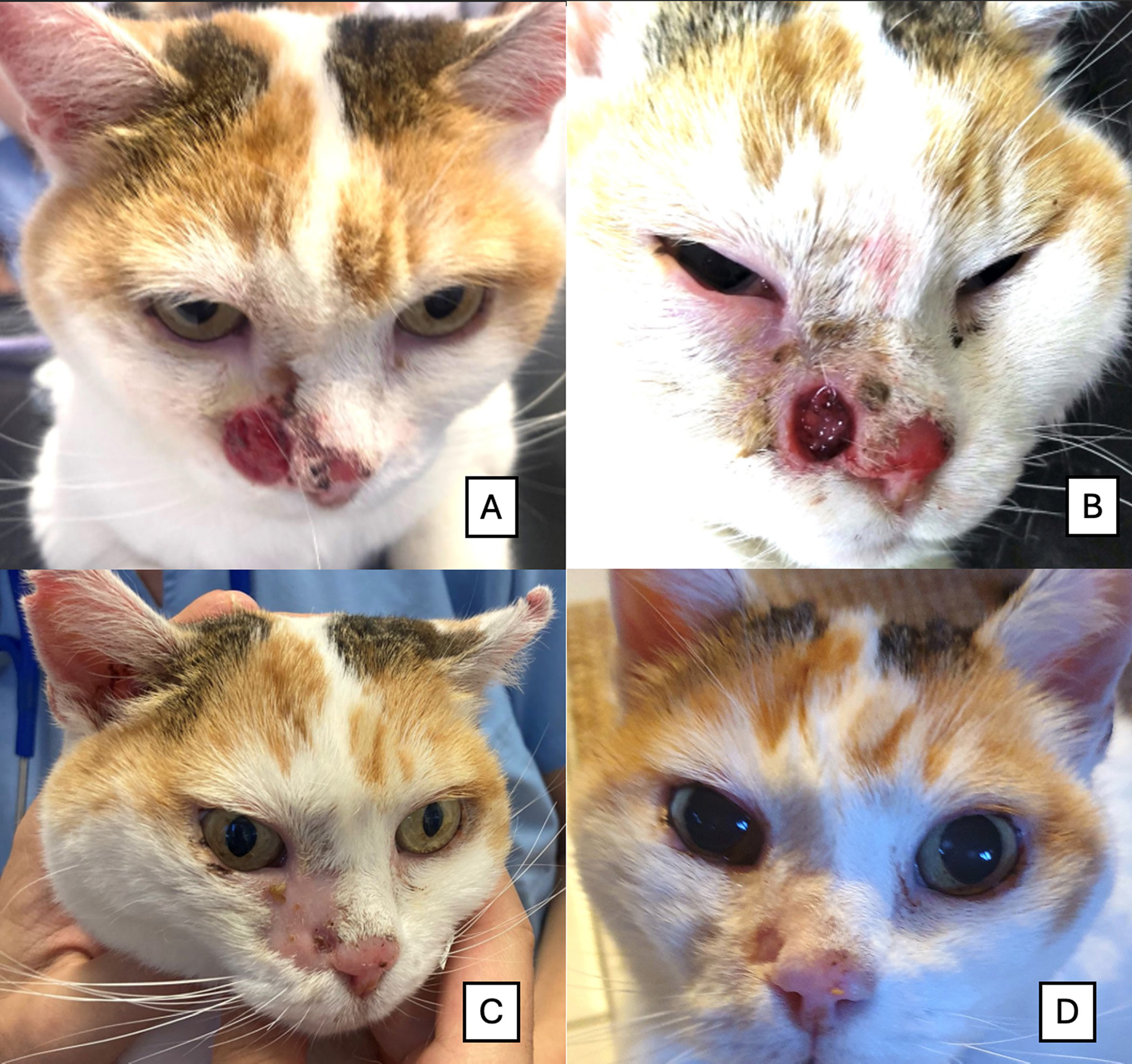
RESİM 1 | Karboplatin IV + IT elektrokemoterapi ile tedavi edilen hastanın fotografik evrimi, 4. haftada yapılan değerlendirme tam yanıtı doğrulamıştır. (A) İlk presentasyon: Sağ gözün sağ medial kantusunda geniş bir ülseratif lezyon ve nazal planumda ikinci bir ülseratif lezyonun varlığı. (B) Tedaviden bir hafta sonra: Hafif bir eritem ( grade II) ve merkezi bir ülserasyon ile nemli bir deskuamasyon (grade II) varlığı. (C) Tedaviden üç hafta sonra: Ülserasyonun kaybolması ancak medial kantus lezyonunda kuru bir deskuamasyonun ( grade I) devam etmesi. Nazal planumda bulunan lezyon için tam yanıt gözlenmiştir. (D) Tedaviden dört hafta sonra: Lezyonlarda tam rezolüsyon. 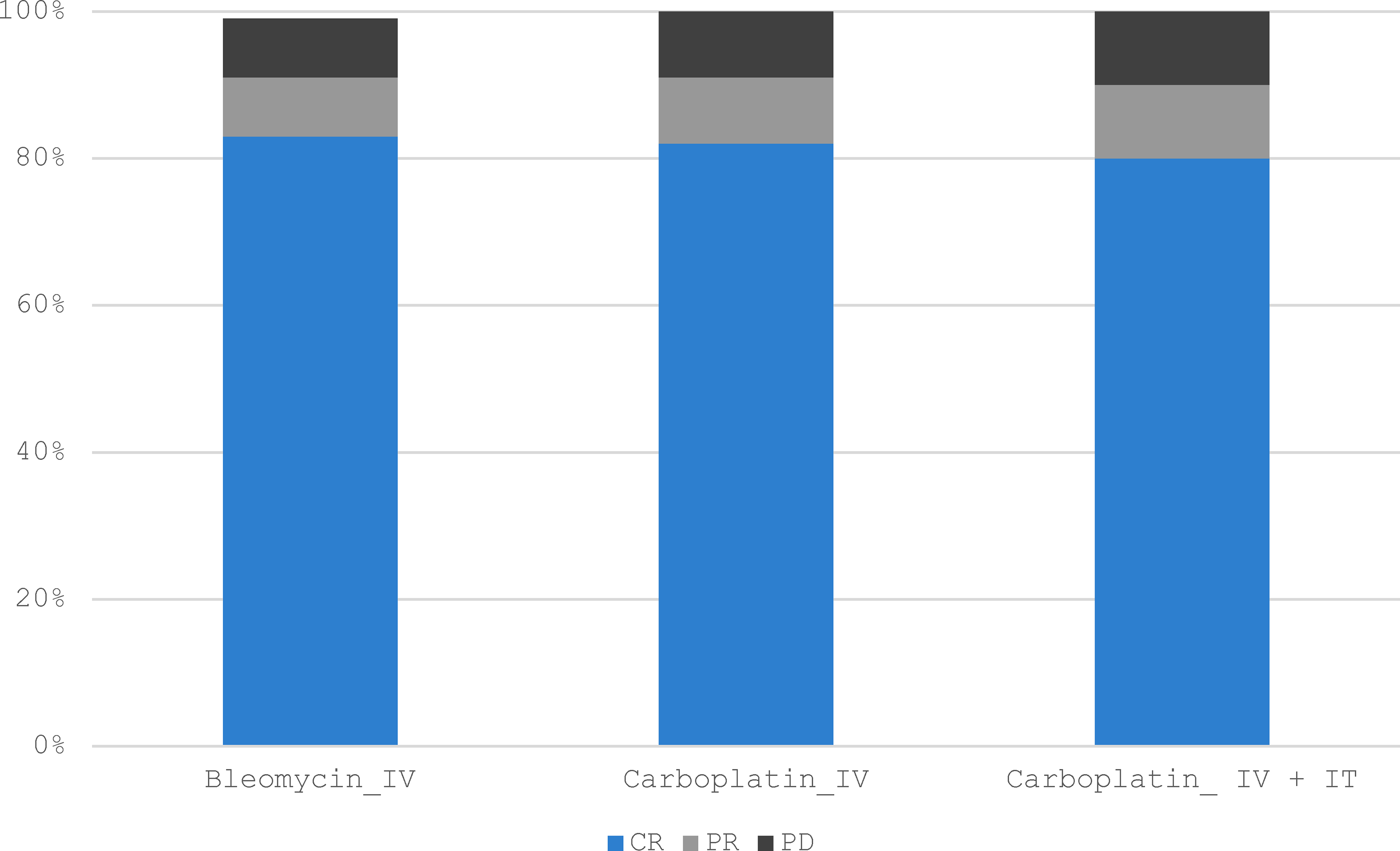
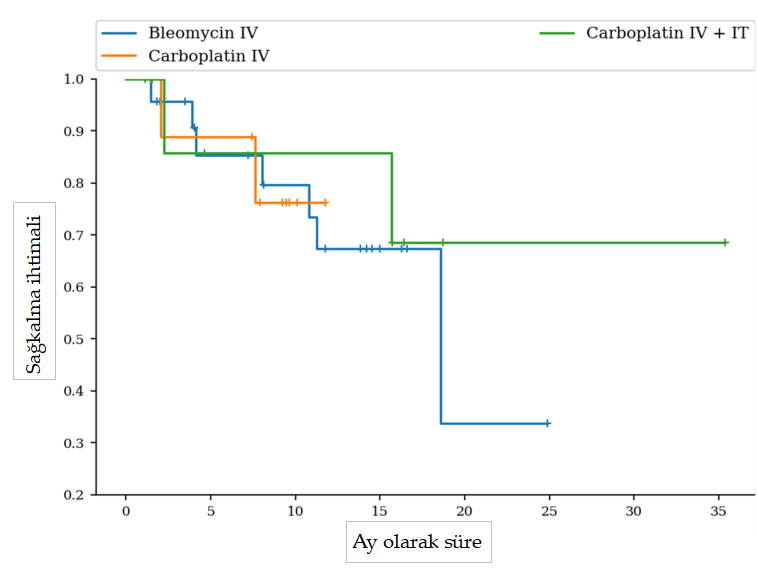
Çalışma tamamlandığında dört kedi hala hayattaydı ve tam remisyondaydı; PFI sırasıyla 141, 478, 500 ve 1077 gündü ve iki kedi ilgisiz nedenlerle ötenazi edildikten sonra sağkalım analizinden çıkarıldı. Üç kedi tedavi edildikten 99, 206 ve 665 gün sonra PH nedeniyle ötenazi edilmiştir. Bu gruptaki nüks oranı 2/10 (%20) kediydi. Karboplatin IV grubunda, 9/11 kedide (%82) CR kaydedilmiş, 1/11 kedide (%9) PR gözlenmiş ve 1/11 kedi (%9) EKT sonrası 4. haftada bir yanıt (PD) elde edememiş, sonuç olarak ORR %90,9 olmuştur (Şekil 1). Bu gruptaki kediler için ortalama PFI değerine ulaşılamamıştır (aralık: 88-308 gün) (Şekil 2). Çalışma tamamlandığında 11 kediden sekizi hala hayattaydı ve tam remisyondaydı; PFI sırasıyla 118, 158, 165, 171, 179, 185, 228 ve 235 gündü. Bu grupta ortalama OST’ye ulaşılamamıştır (aralık: 45-356 gün) (Şekil 3). PD yaşayan kedi, tedaviden 46 gün sonra takipten kaybedilmiştir. Üç kedi, ilk tedavilerinden sonra sırasıyla 63, 94 ve 232 gün sonra hastalık nüksü yaşamıştır. İki kediye tedaviden 70 ve 227 gün sonra ötenazi uygulandı; bir kedinin takibi kaybedildi. Karboplatin IV grubundaki nüks oranı 2/11 (%18) kediydi. 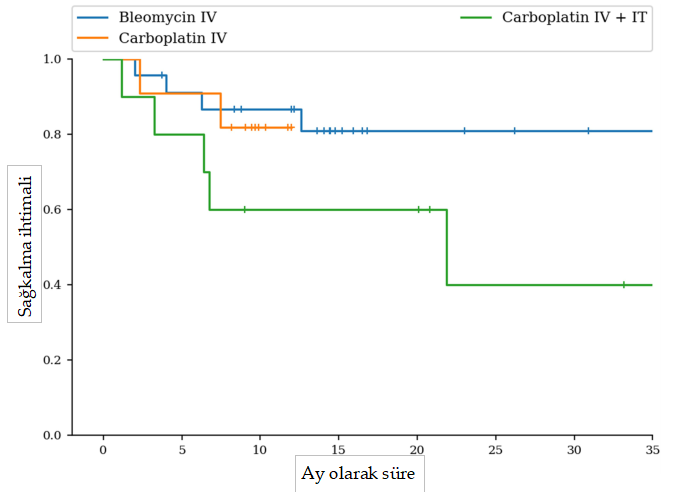
Bleomisin IV grubunda, 20/23 kedide (%86,9) CR, 2/23 kedide (%8,7) PR ve 1/23 kedide (%4,3) PD gözlenmiş ve %95,6 ORR elde edilmiştir (Şekil 1). Bu gruptaki kediler için ortalama PFI 566 gündü (aralık: 325-532 gün) (Şekil 2). Kedilerin yüzde altmış biri (14/23) çalışma tamamlandığında hala hayattaydı ve tam remisyondaydı ve PFI 124 ila 811 gün arasında değişiyordu. Bu nedenle, bu grupta ortalama OST’ye ulaşılamamıştır (aralık: 60-760 gün) (Şekil 3). İki kediye cSCC ile ilgisi olmayan nedenlerle ötenazi uygulandı: oral tümör (histolojik tipi belirlenemedi) ve şüpheli meningioma. Bleomisin IV grubunda nüks oranı 6/23 (%26) kediydi. Toplam beş kedi kontrol vizitinde PR veya PD nedeniyle birden fazla EKT seansı ile tedavi edilmiştir: Karboplatin IV + IT grubunda 2/10 (%20), karboplatin IV grubunda 0/11 (%0) ve bleomisin grubunda 3/23 (%13). Bu kedilerden üçü PR’de kaldı ve her grupta birer tane olmak üzere ikisinde PD vardı. İkinci bir EKT tedavisi gerektiren kediler arasında tüm lezyonlar nazal planum üzerindeydi. Lezyon ölçümleri karboplatin grubu için 13,8 ve 15 mm, bleomisin grubu için 10, 10 ve 12 mm idi. Tartışma Bu çalışma, cSCC’li kedilerin tedavisi için elektroporasyon ile kombine edildiğinde karboplatin (IV veya IV + IT) ve bleomisinin benzer etkinliğini göstermektedir. Spesifik olarak, gruplar arasında yanıt oranı, PFI ve genel sağkalım açısından anlamlı bir fark bulunmamıştır. Çalışmamızdaki ECT, yanıt değerlendirmesinde karboplatin IV + IT, karboplatin IV ve bleomisin IV grupları için sırasıyla %90, %90,9 ve %95,6 ORR ile sonuçlanmıştır. Tüm gruplar arasında yan etki profillerinde önemli bir fark kaydedilmemiştir ve nüks oranları ve uzun vadeli sağkalımlar benzer ve daha önce yayınlanan verilerle tutarlıdır [17]. Bu sonuçlar, karboplatin IV + IT, karboplatin IV veya bleomisin IV ile EKT’nin kedi cSCC tedavisinde uygun seçenekleri temsil ettiğini göstermektedir, ancak bu çalışmanın sonuçlarını doğrulamak için daha büyük kedi gruplarında daha fazla çalışma yapılması gerekmektedir. Bleomisin, olumlu sistemik güvenlik profili ve elektroporasyon ile birleştirildiğinde sitotoksisitede önemli bir artış sağlaması nedeniyle diğer kemoterapi moleküllerine kıyasla tüm türlerde EKT için yaygın olarak kullanılmaktadır. Bununla birlikte, EKT için alternatif kemoterapi ajanlarına ilişkin bilgi yetersizdir. Platin ajanlarının da elektroporasyon ile birlikte sitotoksisiteyi artırdığı gösterilmiştir ve sisplatin de zaman zaman insanlarda, köpeklerde ve atlarda etkinliği gösterilmiş bir EKT ajanı olarak kullanılmaktadır. Bununla birlikte, sisplatinin akut ve potansiyel olarak ölümcül pulmoner toksisitesi, kedilerde sistemik kullanımını engellemekte ve karboplatini bu tür için cazip bir seçenek haline getirmektedir. Théon ve arkadaşları [10] tarafından yapılan bir çalışma, cSCC’li kedilerde IT karboplatin uygulamasının etkinliğini ve güvenliğini göstermiştir, ancak o zamandan beri herhangi bir veri yayınlanmamıştır. Çalışmamızın sonuçları, elektroporasyon ile birlikte karboplatinin bleomisine potansiyel bir alternatif sunabileceğini, ancak iki molekül arasında seçim yaparken yan etki profillerindeki farklılıkların da göz önünde bulundurulması gerektiğini göstermektedir. Bu çalışmada, karboplatin ile tedavi edilen kediler bleomisin ile tedavi edilenlere göre sayısal olarak daha fazla sistemik yan etki yaşamıştır, ancak bu fark istatistiksel olarak anlamlı değildir. Bleomisin, karboplatin ile karşılaştırıldığında nadiren hematolojik veya sistemik yan etkilerle ilişkilidir (yayınlanmış literatürde sistemik yan etkiler yaşayan kedilerin %10’undan azı) [34, 35]. Ayrıca, karboplatinin sistemik toksisiteleri önceden böbrek fonksiyon bozukluğu olan hayvanlarda daha da kötüleşebilir ve tümör taşıyan yaşlı kedilerde doğru dozlamayı zorlaştırabilir [37, 38]. Bu çalışmada üç grupta kaydedilen tüm sistemik toksisiteler grade 1 ve kendi kendini sınırlayıcıdır, ancak kemoterapi ajanları arasındaki toksisite farklılıkları potansiyeli göz önünde bulundurulmalıdır. Şu anda bleomisin, daha elverişli güvenlik profili ve birçok tür ve tümör tipinde kanıtlanmış etkinliği nedeniyle EKT protokolleri için tercih edilen kemoterapi ajanı olmaya devam etmektedir. Bu çalışmanın sonuçları, karboplatinin bleomisine ilginç bir alternatif veya ikinci basamak ajan olabileceğini düşündürmektedir, ancak bu kemoterapi protokollerinin etkinliğini ve toleransını karşılaştırmak için daha büyük kohortlarla daha fazla çalışma yapılması gerekmektedir. İnsan onkolojisinde EKT kullanımı için mevcut standart çalışma prosedürleri, çapı <3 cm olan tümörlü hastalarda IV yerine IT kemoterapi kullanımını önermektedir, ancak nispeten az sayıda çalışma iki uygulama yönteminin etkinliğini ve sonuçlarını doğrudan değerlendirmiştir [31]. Cerrahi için uygun olmayan cSCC’li insan hastalarda IT veya IV bleomisin ile tek seans EKT’yi değerlendiren prospektif bir çalışmada %83 ORR bulunmuş ve IV bleomisin için IT’ye göre daha üstün bir yanıt oranı kaydedilmiştir [39]. BT kemoterapisi uygulayan sağlık personelinin karşılaştığı potansiyel mesleki sağlık tehlikelerini kabul etmek zorunludur [40–42]. Kemoterapi ajanlarına maruziyeti en aza indirmek için güvenlik önlemlerinde ilerlemeler kaydedilmiş olsa da, IT kemoterapi uygulaması maruziyeti kesinlikle artırmaktadır ve riski en aza indirmek için çaba gösterilmelidir. Özellikle cSCC ile ilgili olarak, IT kemoterapisi, birçok lezyonun ülseratif ve kötü tanımlanmış doğası göz önüne alındığında teknik olarak zor olabilir, bu da IV uygulamayı bu endikasyon için daha da çekici bir seçenek haline getirir. Bu çalışmada, IV ve IV + IT tedavi grupları arasında anlamlı bir fark kaydedilmemiştir, bu da sağlık çalışanlarının kemoterapiye maruz kalma riskini önemli ölçüde sınırlandırdığı için elektroporasyon ile tek başına IV uygulamanın düşünülebileceğini göstermektedir. Bu çalışmada araştırılan bir konu olmamasına rağmen, elektrot tipi seçimi de EKT’nin toleransı ve sonuçları üzerinde bir rol oynayabilir. Yakın zamanda yapılan bir çalışmada, daha ince iğne elektrotlarla tedavi edilen nazal planum cSCC’li kedilerde benzer yanıt oranları ve gelişmiş tolerans bulunmuştur [43]. Kemoterapi dozajı ve uygulama yolu, elektroporasyon stratejileri ve elektrot tipleri dikkate alınarak kedilerde optimum EKT protokolleri oluşturmak için ek araştırmalar yapılması gerekmektedir. EKT için en uygun tedavi sayısı veya tedaviler arasındaki potansiyel aralık konusunda bir fikir birliği yoktur. EKT ile kedi SCC tedavisine ilişkin ilk çalışmaların çoğu, genellikle yanıt değerlendirilmeden önce gerçekleştirilen birkaç seans kullanan protokoller bildirmiştir. Bu önceki çalışmalarda yanıt oranları %68,8 ile %96,7 arasında değişmekte olup, PFI’ler 26 ile 526 gün arasında değişmektedir [17, 18, 34]. Bu oran, bu çalışmada bildirdiğimizden veya önceki bir çalışmada bildirilen bleomisin ile tek bir EKT seansından sonraki %81,8’lik CR’den daha iyi değildir [2]. Çalışmamız tek bir tedavinin etkinliğini değerlendirmek üzere tasarlanmış olup, yanıtın değerlendirilmesinden önce lokal yan etkilerin ortadan kalkmasına izin vermek için yanıt değerlendirmesi tedaviden 4 hafta sonrasına planlanmıştır. Sadece beş kedi ikinci bir tedaviye ihtiyaç duydu ve ikinci bir tedavi alanların %25’inde PR ve %75’inde PD görüldü. Nüks oranları ve nükse kadar geçen süre gruplar arasında farklı değildi ve birden fazla tedaviyi değerlendiren önceki verilerle olumlu bir şekilde karşılaştırıldığında, cSCC’nin yönetimi için tek bir tedavinin yeterli olabileceğini göstermektedir. Bu farklılıkların, çalışmamızda sınırlı olan ortalama takip süresindeki farklılıkla açıklanabileceğini kabul ediyoruz: Karboplatin IV + IT, karboplatin IV ve bleomisin IV için sırasıyla 478, 261 ve 446 gün. Bu çalışmanın çeşitli kısıtlamaları vardır; en önemlisi, her gruptaki vaka sayısının az olmasıdır; bu da tedavi grupları arasındaki sonuçlarda küçük farklılıkları tespit etmek için istatistiksel gücü sınırlamaktadır. Tüm hastalarda tam evreleme yapılmaması, bazı kedilerde klinik evrenin düşük tahmin edilmesine yol açmış ve uzun vadeli sonuçları etkilemiş olabilir. Gruplar arasında randomizasyonun olmaması, popülasyonumuzdaki bir başka yanlılık kaynağıdır, çünkü muayenenin yapıldığı yer kedilerin hangi gruba dahil edileceğini belirlemiştir. Çağdaş bir kontrol grubunun aksine retrospektif bir bleomisin kontrol grubunun kullanılması da gruplar arasındaki ortalama takip süresini etkilemekte ve gruplar arasındaki toksisitenin karşılaştırılmasını zorlaştırmaktadır. Son olarak, sadece elektroporasyonun kullanıldığı kontrol grupları, tedaviye yanıt ve uzun vadeli sonuçlar üzerinde tam olarak hangi faktörlerin rol oynadığını daha iyi aydınlatmak açısından ilginç olacaktır. Sonuç olarak, bu çalışma karboplatin IV + IT, karboplatin IV veya bleomisin IV ile EKT ile tedavi edilen tedaviye naif cSCC’li kediler için benzer yanıt oranları ve PFI’ler göstermiştir. EKT’de bleomisine alternatif olarak karboplatinin etkinliğini ve tolere edilebilirliğini tam olarak doğrulamak için daha uzun bir süre boyunca takip edilen daha geniş bir kedi kohortu ile ek çalışmalar yapılması gerekmektedir. Teşekkürler Yazarlar Dans les Yeux d’Hulk Derneği’ne EKT cihazının satın alınmasındaki mali destekleri için teşekkür eder. Çıkar Çatışması Beyanı Yazarlar herhangi bir çıkar çatışması beyan etmemişlerdir. Veri Erişim Beyanı Bu çalışmanın bulgularını destekleyen veriler, makul bir talep üzerine ilgili yazardan temin edilebilir. |
| Kaynakça 1. S. Murphy, “Cutaneous Squamous Cell Carcinoma in the Cat: Cur- rent Understanding and Treatment Approaches,” Journal of Feline Med- icine and Surgery 15, no. 5 (2013): 401–407. 2. N. Tozon, D. Pavlin, G. Sersa, T. Dolinsek, and M. Cemazar, “Elec- trochemotherapy With Intravenous Bleomycin Injection: An Observa- tional Study in Superficial Squamous Cell Carcinoma in Cats,” Journal of Feline Medicine and Surgery 16, no. 4 (2014): 291–299. 3. G. B. Hunt, “Use of the Lip-to-Lid Flap for Replacement of the Lower Eyelid in Five Cats,” Veterinary Surgery 35, no. 3 (2006): 284–286. 4. K. Schmidt, C. Bertani, M. Martano, E. Morello, and P. Buracco, “Re- construction of the Lower Eyelid by Third Eyelid Lateral Advancement and Local Transposition Cutaneous Flap After “en bloc” Resection of Squamous Cell Carcinoma in 5 Cats,” Veterinary Surgery 34, no. 1 (2005): 78–82. 5. S. E. Lana, G. K. Ogilvie, S. J. Withrow, R. C. Straw, and K. S. Rogers, “Feline Cutaneous Squamous Cell Carcinoma of the Nasal Planum and the Pinnae: 61 Cases,” Journal of the American Animal Hospital Associ- ation 33, no. 4 (1997): 329–332. 6. E. Gasymova, V. Meier, F. Guscetti, S. Cancedda, M. Roos, and B. C. Rohrer, “Retrospective Clinical Study on Outcome in Cats With Nasal Planum Squamous Cell Carcinoma Treated With an Accelerated Radia- tion Protocol,” BMC Veterinary Research 13 (2017): 86. 7. M. Lino, D. Lanore, M. Lajoinie, A. Jimenez, F. Crouzet, and F. L. Queiroga, “Prognostic Factors for Cats With Squamous Cell Carcinoma of the Nasal Planum Following High-Dose Rate Brachytherapy,” Jour- nal of Feline Medicine and Surgery 21, no. 12 (2019): 1157–1164. 8. M. Goodfellow, A. Hayes, S. Murphy, and M. Brearley, “A Retrospec- tive Study of (90)Strontium Plesiotherapy for Feline Squamous Cell Car- cinoma of the Nasal Planum,” Journal of Feline Medicine and Surgery 8, no. 3 (2006): 169–176. 9. G. M. Hammond, I. K. Gordon, A. P. Theon, and M. S. Kent, “Evalua- tion of Strontium Sr 90 for the Treatment of Superficial Squamous Cell Carcinoma of the Nasal Planum in Cats: 49 Cases (1990–2006),” Jour- nal of the American Veterinary Medical Association 231, no. 5 (2007): 736–741. 10. A. Théon, M. VanVechten, and B. Madewell, “Intratumoral Admin- istration of Carboplatin for Treatment of Squamous Cell Carcinomas of the Nasal Plane in Cats,” American Journal of Veterinary Research 57, no. 2 (1996): 205–210. 11. C. A. Himsel, R. C. Richardson, and J. A. Craig, “Cisplatin Chemo- therapy for Metastatic Squamous Cell Carcinoma in Two Dogs,” Jour- nal of the American Veterinary Medical Association 189, no. 12 (1986): 1575–1578. 12. W. C. Buhles and G. H. Theilen, “Preliminary Evaluation of Bleomy- cin in Feline and Canine Squamous Cell Carcinoma,” American Journal of Veterinary Research 34, no. 2 (1973): 289–291. 13. J. Impellizeri, L. Aurisicchio, P. Forde, and D. M. Soden, “Electropo- ration in Veterinary Oncology,” Veterinary Journal 2016, no. 217 (1997): 18–25. 14. G. Sersa, T. Jarm, T. Kotnik, et al., “Vascular Disrupting Action of Electroporation and Electrochemotherapy With Bleomycin in Murine Sarcoma,” British Journal of Cancer 98, no. 2 (2008): 388–398. 15. B. Markelc, G. Sersa, and M. Cemazar, “Differential Mechanisms Associated With Vascular Disrupting Action of Electrochemotherapy: Intravital Microscopy on the Level of Single Normal and Tumor Blood Vessels,” PLoS One 8, no. 3 (2013): e59557. 16. G. Gerlini, S. Sestini, P. Di Gennaro, C. Urso, N. Pimpinelli, and L. Borgognoni, “Dendritic Cells Recruitment in Melanoma Metastasis Treated by Electrochemotherapy,” Clinical & Experimental Metastasis 30, no. 1 (2013): 37–45. 17. P. Simčič, A. Pierini, G. Lubas, et al., “A Retrospective Multicentric Study of Electrochemotherapy in the Treatment of Feline Nasal Planum Squamous Cell Carcinoma,” Veterinary Sciences 8, no. 3 (2021): 53. 18. E. P. Spugnini, B. Vincenzi, G. Citro, et al., “Electrochemotherapy for the Treatment of Squamous Cell Carcinoma in Cats: A Preliminary Report,” Veterinary Journal 179, no. 1 (2009): 117–120. 19. D. Miklavčič, B. Mali, B. Kos, R. Heller, and G. Serša, “Electrochem- otherapy: From the Drawing Board Into Medical Practice,” Biomedical Engineering Online 13, no. 1 (2014): 29. 20. C. Souza, N. F. Villarino, K. Farnsworth, and M. E. Black, “En- hanced Cytotoxicity of Bleomycin, Cisplatin, and Carboplatin on Equine Sarcoid Cells Following Electroporation-Mediated Delivery in Vitro,” Journal of Veterinary Pharmacology and Therapeutics 40, no. 1 (2017): 97–100. 21. E. P. Spugnini, B. Vincenzi, F. Carocci, C. Bonichi, F. Menicagli, and A. Baldi, “Combination of Bleomycin and Cisplatin as Adjuvant Elec- trochemotherapy Protocol for the Treatment of Incompletely Excised Feline Injection-Site Sarcomas: A Retrospective Study,” Open Veterinary Journal 10, no. 3 (2020): 267–271. 22. E. P. Spugnini, S. M. Renaud, S. Buglioni, et al., “Electrochemother- apy With Cisplatin Enhances Local Control After Surgical Ablation of Fibrosarcoma in Cats: An Approach to Improve the Therapeutic Index of Highly Toxic Chemotherapy Drugs,” Journal of Translational Medi- cine 9 (2011): 152. 23. K. Barabas, R. Milner, D. Lurie, and C. Adin, “Cisplatin: A Review of Toxicities and Therapeutic Applications,” Veterinary and Comparative Oncology 6, no. 1 (2008): 1–18. 24. V. L. Gill, P. J. Bergman, K. E. Baer, D. Craft, and C. Leung, “Use of Imiquimod 5% Cream (Aldara™) in Cats With Multicentric Squamous Cell Carcinoma in Situ: 12 Cases (2002–2005)*,” Veterinary and Com- parative Oncology 6, no. 1 (2008): 55–64. 25. L. N. Owen, Unit WHOVPH, Oncology WCC for C. TNM Classifica- tion of Tumours in Domestic Animals/Edited by L.N. Owen. 26. A. K. LeBlanc, M. Atherton, R. T. Bentley, et al., “Veterinary Co- operative Oncology Group-Common Terminology Criteria for Adverse Events (VCOG-CTCAE v2) Following Investigational Therapy in Dogs and Cats,” Veterinary and Comparative Oncology 19, no. 2 (2021): 311–352. 27. V. J. Poirier, M. Keyerleber, I. K. Gordon, et al., “ACVR and ECVDI Consensus Statement: Reporting Elements for Toxicity Criteria of the Veterinary Radiation Therapy Oncology Group v2.0,” Veterinary Ra- diology & Ultrasound 64 (2023): 789–797. 28. S. M. Nguyen, D. H. Thamm, D. M. Vail, and C. A. London, “Re- sponse Evaluation Criteria for Solid Tumours in Dogs (v1.0): A Veter- inary Cooperative Oncology Group (VCOG) Consensus Document,” Veterinary and Comparative Oncology 13, no. 3 (2015): 176–183. 29. L. M. Mir, “Bases and Rationale of the Electrochemotherapy,” Euro- pean Journal of Cancer Supplements 4, no. 11 (2006): 38–44. 30. M. Marty, G. Sersa, J. R. Garbay, et al., “Electrochemotherapy: An Easy, Highly Effective and Safe Treatment of Cutaneous and Subcu- taneous Metastases: Results of ESOPE (European Standard Operating Procedures for Electrochemotherapy) Study,” European Journal of Can- cer 4, no. 11 (2006): 3–13. 31. J. Gehl, G. Sersa, L. W. Matthiessen, et al., “Updated Standard Oper- ating Procedures for Electrochemotherapy of Cutaneous Tumours and Skin Metastases,” Acta Oncologica 57, no. 7 (2018): 874–882. 32. W. C. Kisseberth, D. M. Vail, J. Yaissle, et al., “Phase I Clinical Eval- uation of Carboplatin in Tumor-Bearing Cats: A Veterinary Cooperative Oncology Group Study,” Journal of Veterinary Internal Medicine 22, no. 1 (2008): 83–88. 33. K. A. Hahn, M. F. McEntee, G. B. Daniel, A. M. Legendre, and M. L. Nolan, “Hematologic and Systemic Toxicoses Associated With Car- boplatin Administration in Cats,” American Journal of Veterinary Re- search 58, no. 6 (1997): 677–679. 34. E. P. Spugnini, M. Pizzuto, M. Filipponi, et al., “Electroporation Enhances Bleomycin Efficacy in Cats With Periocular Carcinoma and Advanced Squamous Cell Carcinoma of the Head,” Journal of Veterinary Internal Medicine 29, no. 5 (2015): 1368–1375. 35. D. S. Dos Anjos, O. R. Sierra, E. P. Spugnini, A. B. De Nardi, and C. E. Fonseca-Alves, “Comparison of Two Different Doses of Bleomycin in Electrochemotherapy Protocols for Feline Cutaneous Squamous Cell Carcinoma Nonsegregated From Ultraviolet Light Exposure,” Scientific Reports 10 (2020): 18362. 36. D. B. Bowles, M. C. Robson, P. E. Galloway, and L. Walker, “Owner’s Perception of Carboplatin in Conjunction With Other Palliative Treat- ments for Cancer Therapy,” The Journal of Small Animal Practice 51, no. 2 (2010): 104–112. 37. D. B. Bailey, K. M. Rassnick, N. L. Dykes, and L. Pendyala, “Phase I Evaluation of Carboplatin by Use of a Dosing Strategy Based on a Tar- geted Area Under the Platinum Concentration-Versus-Time Curve and Individual Glomerular Filtration Rate in Cats With Tumors,” American Journal of Veterinary Research 70, no. 6 (2009): 770–776. 38. D. B. Bailey, K. M. Rassnick, H. N. Erb, N. L. Dykes, P. J. Hoopes, and R. L. Page, “Effect of Glomerular Filtration Rate on Clearance and Myelotoxicity of Carboplatin in Cats With Tumors,” American Journal of Veterinary Research 65, no. 11 (2004): 1502–1507. 39. G. Bertino, A. Groselj, L. G. Campana, et al., “Electrochemotherapy for the Treatment of Cutaneous Squamous Cell Carcinoma: The IN- SPECT Experience (2008-2020),” Frontiers in Oncology 12 (2022): 12. 40. A. Acramel, S. Blondeel-Gomes, C. Matta, et al., “Reporting Envi- ronmental Contamination Results to Healthcare Workers Could Play a Crucial Role in Decreasing the Risk of Occupational Exposure to Anti- neoplastic Drugs,” Frontiers in Public Health 10 (2022): 989977. 41. V. Gianfredi, D. Nucci, C. Fatigoni, T. Salvatori, M. Villarini, and M. Moretti, “Extent of Primary DNA Damage Measured by the Comet Assay in Health Professionals Exposed to Antineoplastic Drugs: A Sys- tematic Review and Meta-Analysis,” International Journal of Environ- mental Research and Public Health 17, no. 2 (2020): 523. 42. T. H. Connor and M. A. McDiarmid, “Preventing Occupational Ex- posures to Antineoplastic Drugs in Health Care Settings,” CA: A Cancer Journal for Clinicians 56, no. 6 (2006): 354–365. 43. M. Tellado, S. Michinski, J. Impellizeri, G. Marshall, E. Signori, and F. Maglietti, “Electrochemotherapy Using Thin-Needle Electrode Im- proves Recovery in Feline Nasal Planum Squamous Cell Carcinoma—A Translational Model,” Cancer Drug Resistance 5, no. 3 (2022): 595–611. Destekleyici Bilgiler Ek destekleyici bilgiler Destekleyici Bilgiler bölümünde çevrimiçi olarak bulunabilir. |