PetCancerVet, 61 Wetherby Road, Knaresborough, North Yorkshire HG5 8LH, Birleşik Krallık; expetcancervet@gmail.com (R.L.); valentinagranziera89@gmail.com (V.G.)
Meranese Veterinerlik Merkezi, Via J. Speckbacher, 15/B, 39012 Merano, İtalya; raimondotornago@gmail.com
Via Marco Cornelio Cetego 20, 00177 Roma, İtalya; f.valentini@oncovet.it (F.V.); g.alterio@oncovet.it (G.A.); m.cochi@oncovet.it (M.C.)
Vet Câncer—Hayvan Onkolojisi ve Patolojisi, AL Jauaperi, 732 Moema, São Paulo, SP 04523-013, Brezilya; vetcancerbrasil@gmail.com (M.M.M.R.); krishnaoliveira@yahoo.com.br (K.D.d.O.); contato@vetcancer.com.br (J.O.F.); priscilaq54@gmail.com (P.G.Q.)
Veteriner Hekimlik Fakültesi Dr. Enrico Sponza, Via Pra’ 39/r, 16157 Genova, İtalya; sponzaenrico@gmail.com (E.S.); francesca.gattino@unito.it (F.G.)
Veteriner Onkoloji Hizmetleri, PLLC at Guardian Veteriner Uzmanları, Brewster, NY 10509, ABD; oncologyvet@yahoo.com
Karşılaştırmalı Biyotıp ve Gıda Bilimi Bölümü, Padova Üniversitesi, Viale dell’Università 16,
35020 Legnaro, İtalya; filippo.torrigiani@unipd.it
İlgili kişi: petra.simcic@vet.unipi.it; Tel.: +38-640191335
1
İtalya; pierini.alessio2004@gmail.com (A.P.); george.lubas@unipi.it (G.L.)
Veteriner Bilimleri Bölümü, Pisa Üniversitesi, Via Livornese Lato Monte, San Piero a Grado, 56122 Pisa,
Makaleye atıfta bulunmak için: Simcˇicˇ, P.; Pierini, A.; Lubas, G.; Lowe, R.; Granziera, V.; Tornago, R.; Valentini, F.; Alterio, G.; Cochi, M.; Rangel, M.M.M.; et al. A Retrospective Multicentric Study of Electrochemotherapy in the Treatment of Feline Nasal Planum Squamous Cell Carcinoma. Vet. Sci. 2021, 8, 53.https://doi.org/10.3390/ vetsci8030053
Sunum Tarihi: 15 Şubat 2021 Kabul Tarihi: 17 Mart 2021 Yayın Tarihi: 22 Mart 2021
Yayıncının Notu: MDPI,
coğrafi bölgelerdeki yasal hak iddiaları ve kurumsal bağlantılar konusunda tarafsız kalmaktadır.
ONCOVET (Veteriner Onkoloji Servisi:https://www.oncovet.it/index.php).
Özet: Kedi skuamöz hücreli karsinomu (SCC) günümüzde cerrahi, radyoterapi ve elektrokemoterapi (ECT) ile tedavi edilmektedir. ECT’nin etkinliği ve/veya güvenilirliği, kedi nazal planum SCC (npSCC) tedavisinde bleomisin ile birlikte tek tedavi olarak değerlendirilmiştir. Altmış bir kedi çalışmaya dahil edilmiştir. Lokal tedavi yanıtı tam remisyon (CR), kısmi remisyon (PR) veya stabil hastalık (SD) şeklinde değerlendirildi. Nüks oranı (RR), hastalıksız geçen süre (DFI) ve progresyonsuz sağkalım (PFS) hesaplanmıştır. EKT toksisitesi için altı puanlık bir ölçek kullanılmıştır. Medyan tümör boyutu 1,5 cm idi. Vakaların %65,6’sında CR, %31,1’inde PR ve %3,3’ünde SD elde edildi. Genel yanıt oranı %96,7, RR %22,5, medyan DFI 136 gün ve medyan PFS 65,5 gündü. Kedilerin %51’inde EKT toksisitesi ≤2 idi. Tümör rekürrensi/progresyonu (p = 0.014) ve lokal tedavi yanıtı (PR: p < 0.001; SD: p < 0.001) sağkalım süresini etkilemiştir. Toksisitesi >2 olan kedilerde tümör nüksü/progresyonu olasılığı daha yüksekti. PR (p < 0.001) ve nüks/progresyon (p = 0.002) olan kedilerde, 1 Hz (p = 0.035) ve 1200 V/cm (p = 0.011) veya 1300 V/cm (p = 0.016) ile EKT tedavisinde tümöre bağlı ölüm daha yüksekti. Tümör boyutu lokal tedavi yanıtını (p = 0.008) ve toksisiteyi (p < 0.001) etkilemiştir. EKT, kedi npSCC’leri için son derece etkili bir tedavi yöntemidir ve düşük evreli tümörler için ilk basamak tedavi yöntemi olarak düşünülmelidir.
Anahtar Kelimeler: kedi; skuamöz hücreli karsinom; nazal planum; elektrokemoterapi; bleomisin; toksisite; retrospektif; çok merkezli
1. Giriş
Skuamöz hücreli karsinom (SCC), keratinositlere (skuamöz hücreler) dönüşen epidermal hücrelerden kaynaklanan kötü huylu bir tümördür. Deride skuamöz hücreler epidermis, dermis, tırnak yatakları ve ayak yastıklarının yanı sıra ağız boşluğu ve özofagusta da bulunabilir.
SCC’ler kedilerde en sık görülen tümörlerdir ve kedi deri tümörlerinin yaklaşık %10,4’ünü oluştururlar, özellikle nazal planum, kulak kepçesi ve göz kapakları etkilenmektedir [1-3]. Genellikle 10-12 yaşından büyük kediler daha yüksek risk altındadır [2,4].
Kedilerde, kutanöz SCC’ler çoğunlukla güneşe kronik şekilde maruz kalma (UV ışığı)- daha doğrusu ultraviyole B radyasyonu nedeniyle ortaya çıkmaktadır. Açık pigmentli, beyaz bölgeleri olan veya renkli kediler daha fazla risk altındayken, uzun tüylü kedilerde SCC görülme olasılığı daha düşüktür. Lezyonlar genellikle kulaklar, göz kapakları, nazal planum ve temporal bölgeler gibi alopesik alanlarda ortaya çıkar [2]. Kronik güneş maruziyeti genellikle aktinik değişikliklerden in-situ SCC’ye ve daha sonra invaziv SCC’ye doğru ilerler [4]. Histolojik olarak, bazal membranın neoplastik skuamöz hücreler tarafından istila edilmesi, belirgin SCC’yi preneoplastik değişikliklerden (yani aktinik değişiklikler) ayıran temel özelliktir. Neoplastik hücreler, hücresel pleomorfizm, karyomegali ve mitotik figürler gibi çok çeşitli malign histolojik özellikler gösterir; bunlar genellikle kötü differansiye neoplazmlarda daha belirginken, iyi differansiye SCC’lerde yaygın olarak “keratin taneleri” oluşur [5]. SCC’li kedilerin %50’sinden fazlasında TP53 geninde mutasyonlar ve P53 proteininin aşırı ekspresyonu görülmüştür [6,7].
Klinik olarak, SCC’ler plak benzeri, papiller, krateriform ve fungiform lezyonlar şeklinde görülebilir ve bu lezyonlar ülserli ve eritematöz kabuklu olabilir [4,6]. SCC’li kediler için klinik evreleme için DSÖ tümör-nod-metastaz evreleme sistemi (TNM) kullanılmaktadır [6]. Kedi SCC’leri genellikle lokal olarak agresiftir ancak metastaz yavaş gerçekleşir [4]. Eğer metastaz olursa, bölgesel lenf düğümleri ve akciğerler büyük olasılıkla bundan etkilenir [2].
Tedavinin başarılı olması klinik evreye, tümörün invazivliğine, yerleşim yerine ve lezyonların boyutuna bağlıdır. Tedavi, yaklaşımdan bağımsız olarak hastalığın ilk başlangıcında daha etkilidir. Radikal cerrahi eksizyon, nazal planum SCC (npSCC) tedavisinde mümkün olan en iyi kür oranını sağlar; ancak lokal tümör kontrolünü sağlamak için cerrahi sınırların düzgün olması çok önemlidir. Özellikle yüksek evreli lezyonlarda (yani T3 ve T4) bu hedefe her zaman ulaşılamamaktadır [2,4,8,9]. Ayrıca, geniş marjinli nosektomi ile agresif ekstirpasyon yapılmaya çalışıldığında kozmetik, kısa ve uzun vadeli fonksiyonel defektler büyük endişe kaynağıdır. Bu nedenlerle, npSCC tedavisinde kriyocerrahi, radyoterapi, fotodinamik terapi, intralezyonel kemoterapi ve elektrokemoterapiyi içeren çok sayıda lokal antitümör teknik uygulanmıştır. Sistemik kemoterapi de kullanılmıştır; ancak, genellikle ileri evre vakalarla sınırlıdır ve sonuçlar yetersiz kalmıştır [2,4,10-21].
Bu makale, ilk olarak 1991 yılında tanımlanan ve veteriner onkolojisinde umut verici sonuçlar gösteren elektrokemoterapiyi (ECT) incelemektedir [22,23]. Bu tedavide geri dönüşümlü elektroporasyon (kısa yüksek voltajlı elektrik darbeleri) ile sitotoksik ilaçlar bir arada kullanılmaktadır [9,24]. En çok çalışılan ve etkili olan iki ajan bleomisin ve sisplatindir [25]. Bu iki ilaç hidrofiliktir ve hücre zarına kolayca nüfuz etmezler; ancak hücrelere girdiklerinde oldukça sitotoksiktirler. Geçirgenleştirici elektrik darbelerinin uygulanması, normalde geçirgen olmayan veya zayıf geçirgen sitotoksik ilaçların hücre içine alımında artış sağlamaktadır [22,24].
Hedeflenen hücrelerde ilaç birikimi, membran geçirgenliğinin artmasından kaynaklanır ve bu da nihayetinde hücre ölümüne neden olur [26]. Hücre ölümünde rol oynayan diğer iki mekanizma, vazokonstriksiyona ve tümöre kan akışının azalmasına neden olan vasküler kilit ve vasküler endotelyal hücrelerin ölümünü tetikleyen vasküler bozucu mekanizmadır [26]. Bazı çalışmalar, tedavi edilen bölgeden masif antijen saçılımı nedeniyle EKT’nin hastanın bağışıklık sistemi üzerinde uyarıcı bir etkisi olduğunu göstermiştir. Bazı vakalarda immün yanıt, uzak, tedavi edilmemiş nodüller üzerinde abscopal yanıt olarak bilinen sistemik bir etkiye de yol açabilmektedir [27,28].
EKT çoğunlukla histolojik olarak farklı, lokal invaziv, yüzeysel tümörlerin tedavisinde kullanılmakla birlikte, insan hastalarda karaciğer metastazı ve kolorektal kanser gibi viseral tümörlerin tedavisinde de kullanılmıştır [22]. Küçük hayvan klinik onkolojisinde, EKT çoğunlukla köpeklerde mast hücre tümörleri, yumuşak doku sarkomları, perianal neoplazmlar, oral skuamöz hücreli karsinomlar, melanomlar ve nazal tümörler gibi lokal invaziv yüzeysel tümörleri tedavi etmek için kullanılmıştır. Kedi literatürü çoğunlukla kutanöz SCC’ler ve yumuşak doku sarkomları ile sınırlıdır [29-35].
EKT minimal invazivdir, çok az yan etkisi vardır ya da hiç yoktur. Birkaç kez tekrarlanabilir, genel anestezi gerektirir ve radyaterapi gibi diğer tedavi yöntemlerine göre maliyeti daha düşüktür [21]. EKT ayrıca cerrahi, radyoterapi ve gen terapisi gibi diğer bazı tedavi yaklaşımlarıyla birlikte de kullanılabilir [30,36,37]. EKT, tek tedavi yaklaşımı olarak [9,38] veya nazal planum SCC (npSCC) tedavisi için cerrahi gibi mevcut standart tedavi yöntemleriyle kombine edilerek kullanılmıştır [33,39]. Ayrıca bir raporda radyoterapi ile kombine edildiği ve bazı lokal komplikasyonların görüldüğü bir vaka da sunulmuştur [40].
Bu çok merkezli ve retrospektif çalışmanın amacı, bir vaka serisinde kedi npSCC tedavisinde EKT’nin etkinliğini ve güvenliğini değerlendirmektir.
2. Materyal ve Metot
2.1. Hastaların seçilmesi
Bu çok merkezli çalışmaya npSCC tanısı konmuş 61 özel kedi dahil edilmiştir. Çalışma popülasyonu, Ağustos 2005’ten Mayıs 2020’ye kadar olan dönemde, aşağıdaki altı farklı veteriner hekimliğinden alınmış ve retrospektif şekilde kaydedilmiştir:
“Vet Câncer”, Sao Paolo, Brezilya (VCB), 26 hasta (%42,6); “Veterinary Facility Dr. Enrico Sponza”, Genova, İtalya (SVG), 12 hasta (%19,7); “Ashleigh Vet Clinic”, Knares- borough, Birleşik Krallık (AVC), 10 hasta (%16,4); “Oncovet Group”, Roma, İtalya (OVG), 10 hasta (%16,4);”Meranese Veterinary Center”, Bolzano, İtalya (CVM), 2 hasta (%3,3); ve “Vet- erinary Oncology Services, PLLC at Guardian Veterinary Specialists”, New York, ABD (GVS), 1 hasta (%1,6).
Her tesiste bulunan klinik kayıtlardan, çalışma popülasyonuna ilişkin ayrıntılar (ırk, yaş ve cinsiyet) ve tümör boyutuna ilişkin bilgiler (kaliper ölçümleri) toplanmıştır. EKT, cerrahi ve/veya radyoterapi gibi standart tedavi yöntemlerinin yanı sıra hasta sahiplerine alternatif bir seçenek olarak sunulmuştur. EKT prosedürünün tamamını gösteren bilgilendirilmiş onam tüm hayvan sahipleri tarafından imzalanmıştır. Bu çalışmaya dahil edilebilmek için EKT’nin tek tedavi yöntemi olması gerekmekteydi.
2.2. Evreleme
Hastalara npSCC tanısı sitoloji (17/61) veya histoloji (34/61) ve bazı vakalarda her ikisi (10/61) kullanılarak konulmuştur. Hasta evrelemesi, klinik muayene, büyümüşse bölgesel lenf düğümlerinin ince iğne aspiratları ve üç boyutlu toraks radyografileri hakkında tıbbi kayıtları eksiksiz olan kedilerde gerçekleştirilmiştir. Kafatası radyografileri, tanısal çalışma sırasında sorumlu klinisyene bağlı olarak gerçekleştirilmiştir.
Sadece bölgesel lenf düğümlerinde veya akciğerlerde metastatik hastalığı olmayan kediler çalışmaya dahil edilmiştir.
EKT genel anestezi altında uygulandığından, klinisyenin takdirine bağlı olarak altta yatan hastalıkları ekarte etmek için tam kan sayımı, pıhtılaşma analizi ve biyokimya analizi yapıldı. Kronik böbrek hastalığı (KBH, IRIS II) bulunan iki kedi dışında tüm kedilerin kan kimyası parametrelerinde herhangi bir sorun yoktu.
2.3. Elektroporatörler, Elektriksel Parametreler ve Anestezi Protokolü
Tedavi edilen her vaka için kullanılan ekipman ve bunların elektriksel özellikleri (frekans ve genlik-elektrot mesafesi oranı) Tablo1’de listelenmiştir. Bu çok merkezli çalışmada farklı puls jeneratörleri kullanılmış olsa da hepsi her biri 100 μs’lik 8 monofazik kare puls vermiştir. Genel anestezi için kullanılan farklı protokoller veterinerlik kuruluşuna ve sorumlu klinisyene bağlıydı (bkz. Tablo1).
2.4. Tedavi (EKT) Protokolü
EKT, GVS’de tedavi edilen ve daha düşük doz kullanılan (10.000 UI/m2) bir kedi dışında standart bleomisin dozu (15.000 UI/m2, European Farmacopeia) ile kombine edilmiştir. Son yayınlara dayanarak, daha düşük bleomisin dozlarının (15.000 UI/m2 yerine 10.000 IU/m2) klinik yanıtta eşit derecede etkili olduğu gösterilmiştir. Bir araştırmacı (JAI) daha düşük doz rejimini EKT ile standart bir yöntem şeklinde kullanmıştır [41,42]. Tüm vakalarda bleomisin intravenöz olarak uygulanmıştır. İlaç uygulamasından sekiz dakika sonra klinisyen elektrik pulslarının uygulanmasına geçmiştir.
Tüm kediler sadece EKT ile tedavi edildi. 39/61 (%63,9) kediye tek bir EKT tedavisi uygulandı. Geri kalan 22/61 (%36,1) kediye nüks, stabil hastalık (SD) bulunması veya tedavi etkisini güçlendirmek için birden fazla EKT uygulanmıştır (Tablo2).
EKT’den sonra kedilere gerektiğinde ek tedavi uygulanmıştır. Tedavi sonrası plan her klinikte farklılık göstermiştir (Tablo2).
2.5. Takip ve Tedavi Sonuçları
EKT hastaları ilk dört hafta boyunca haftada bir veya iki kez takip edilmiş, ardından üç ay boyunca ayda bir ve daha sonra her 3-4 ayda bir kontrol edilmiştir. Takip muayenesi sevk eden veteriner hekim tarafından gerçekleştirilmiştir. Bazı klinisyenler iyileşme sürecini ve hastaların ilerlemesini de fotoğraflamıştır.
Tedaviye verilen lokal yanıt şu şekilde değerlendirilmiştir: (CR) tam remisyon yani primer tümörden eser kalmaması; (PR) kısmi remisyon yani tümörde en az %30 küçülme ancak kitlenin kaybolmaması ve (SD) stabil hastalık yani tümör boyutunda küçülme veya büyüme olmaması (boyutta %30’dan az küçülme (PR) veya boyutta %20’den az artış (PD)-progresif hastalık) [43].
Tedaviye yanıt oranı, sağkalım süresi (ilk tedaviden son kontrol gününe veya ölüme kadar geçen süre) ve medyan sağkalım süresi (MST) hesaplanmıştır. CR ve sonrasında lokal nüks görülen kedilerde nüks oranı (RR) ve hastalıksız geçen süre (DFI) hesaplanmıştır. DFI, ilk tedaviden lokal nüks veya metastaz bulgusuna kadar geçen süre şeklinde tanımlanmıştır. PR veya SD görülen kedilerde progresyonsuz sağkalım (PFS) ilk tedaviden hastalığın lokal progresyonu veya metastaz bulgusu görüldüğü güne kadar geçen süre şeklinde tanımlanmıştır. Son olarak, hastaların tedavi sonuçları değerlendirilmiştir: tümörsüz ve hayatta, tümörlü ve hayatta, tümörsüz veya tümörlü ölü. Ölen kediler için MST hesaplanmış ve çalışma süresinin sonunda hala hayatta olan kediler için medyan takip süresi hesaplanmıştır.
Lokal toksisite, ilk EKT tedavisinden sonra, Lowe ve arkadaşları tarafından geliştirilen ve 0- toksisite yok, 1-hafif şişlik, 2-şişlik/nekroz <1 cm, 3-şiddetli şişlik, 4-derin nekroz ve 5-şiddetli şişlik ve doku kaybı olmak üzere 6 puanlık bir toksisite skoru kullanılarak retrospektif şekilde değerlendirilmiştir [29].
2.6. İstatistik
Veriler başlangıçta tanımlayıcı istatistikler şeklinde analiz edilmiştir. Boyut, yaş, DFI, PFS ve sağkalım süreleri parametrik olmayan, sürekli değişkenler şeklinde analiz edilmiş ve medyan ve aralık şeklinde sunulmuştur. Kategorik değişkenler (cinsiyet, cins ve tedavi sayısı) ve sürekli değişkenler (nabız frekansı, nabız-elektrik mesafesi oranı, lokal tedavi yanıtı ve toksisite skoru) mutlak ve göreceli sıklıklar şeklinde sunulmuştur. Lokal tedavi yanıtı başlangıçta şu şekilde üç kategoriye ayrılmıştır: CR, PR ve SD. Ancak, sadece birkaç vakada SD görülmesi nedeniyle, EKT’yelokal tedavi yanıtı araştırılırken PR ve SD tek bir kategori olarak değerlendirildi. Her kedi için toksisite skoru <2 ve >2 olmak üzere iki gruba ayrılmıştır. Ne tümör ilerlemesi/nüksü ne de metastazı olan canlı kediler ve tümöre bağlı olmayan nedenlerle ölen kediler son takipte sansürlenmiştir. GVS’de tedavi edilen tek kedi, özel bir EKT protokolü uygulandığı için aşağıdaki istatistiksel analize dahil edilmemiştir (Tablo1).
Veriler çıkarımsal istatistikler ile değerlendirilmiştir. Kategorik ve sürekli değişkenler arasında sağkalım sürelerini ve nüks/progresyon görülme sürelerini karşılaştırmak için tek değişkenli analiz olarak Kaplan-Meier eğrileri ve iki taraflı log-rank testleri kullanılmıştır. Sürekli değişkenler (yaş ve boyut) için Cox regresyon (orantılı tehlike regresyonu) analizi kullanılmış ve p < 0,05 ile anlamlı olması halinde çok değişkenli analize (Cox regresyonu, orantılı tehlike regresyonu) dahil edilmiştir.
Cinsiyet, nabız frekansı, amplitüd/elektrot mesafesi oranı, nüks/progresyon olup olmaması, yaş ve tümör boyutu ile tümöre özgü sağkalım, lokal tedavi yanıtı ve toksisite skoru arasındaki ilişkiyi belirlemek için tek değişkenli bir analiz (ikili lojistik regresyon analizi) kullanılmıştır. Tek değişkenli analizde p < 0.05 olan değişkenler çok değişkenli analize (ikili lojistik regresyon analizi) dahil edilmiştir.
Sağkalım, lokal tedavi yanıtı ve toksisite ile anlamlı şekilde ilişkili her bir sürekli değişken için alıcı işletim karakteristiği (ROC) analizi yapılmış ve eğri altındaki alan (AUC) hesaplanmıştır. Maksimum Youden indeksine göre tanısal cut-off’lar ve bunların duyarlılık ve özgüllükleri belirlenmiştir.
Tüm istatistikler IBM SPSS® Statistics ile analiz edilmiştir.
3. Sonuçlar
Toplam 61 kediden oluşan çalışma popülasyonu çoğunlukla evcil kısa tüylü (DSH) (56/61, %91,8) ve sadece beş kedi (%8,2) evcil uzun tüylü (DLH) kedilerden oluşmuştur. Çalışma popülasyonunun ortalama yaşı 11’dir ve 5 ila 17 arasında değişmektedir. Çalışmaya dahil edilen tüm kediler kısırlaştırılmıştı ve dişiler (31/61, %50,8) ile erkekler (30/61, %49,2) arasında neredeyse eşit olarak dağılmışlardı. Medyan tümör boyutu 1,5 cm (aralık 0,2-6,0 cm) idi.
61 kediden 40’ında (%65,6) CR ve 19/61’inde (%31,1) PR görüldü. Çalışma popülasyonunda tedaviye genel yanıt oranı %96,72 (59/61) olmuştur. Sadece iki kedide SD (2/61, %3,3) görülmüştür.
Tüm çalışma popülasyonunun sağkalım süresi 13 ila 2929 gün arasında değişmiş ve MST 286 gün olmuştur. Genel olarak, CR (40/61, %65,6) olan kediler için RR %22,5 (9/40) idi. CR sonrası lokal tümör nüksü olan kedilerin medyan DFI süresi 136 gündü (aralık 29-302 gün). PR (9/10) ve SD (1/10) elde eden 61 kediden 10’unda (%16,4) medyan PFS 65,5 gün (aralık 16-264 gün) ile lokal progresyon görülmüştür.
Çalışma süresinin sonunda, 14/61 (%23) kedi hala hayattaydı ve 47/61 (%77) kedi ölmüştü. Çalışma süresinin sonunda hala hayatta olan kedilerden 12’si (12/14, %19,7) CR’deydi ve 2/14’ünde (%3,3) tedaviden sonra hala tümör vardı. Çalışma süresi boyunca ölen kedi grubunda (%47/61,8), yirmi dört kedi (24/47, %39,3) CR ile tümörsüz olarak ve yirmi üç kedi (23/47, %37,7) PR veya SD ile tümörlü şekilde ölmüştür. Tümörsüz ölen kediler için MST 872 gün (22-2.929 gün) ve tümörlü ölenler için 193 gün (13-362 gün) olmuştur. Çalışma döneminin sonunda hala hayatta olan kediler için medyan takip süresi 394 gündü (aralık 29-2798 gün).
Lokal tedavi toksisite skoru 31/61 (%51,0) hastada <2 idi. Bunların 14/61’inde (%23,0) hiçbir toksisite ( grade 0) görülmezken, 2/61’inde (%3,3) grade 1 ve 15/61’inde (%24,6) grade 2 toksisite görüldü. Kedilerin geri kalanı (30/61, %49,0) aşağıdaki gibi >2 toksisite skoru sergilemiştir: 4/61 (%6,6) grade 3, 16/61 (%23,0) grade 4 ve 12/61 (%19,7) grade 5 (Tablo2).
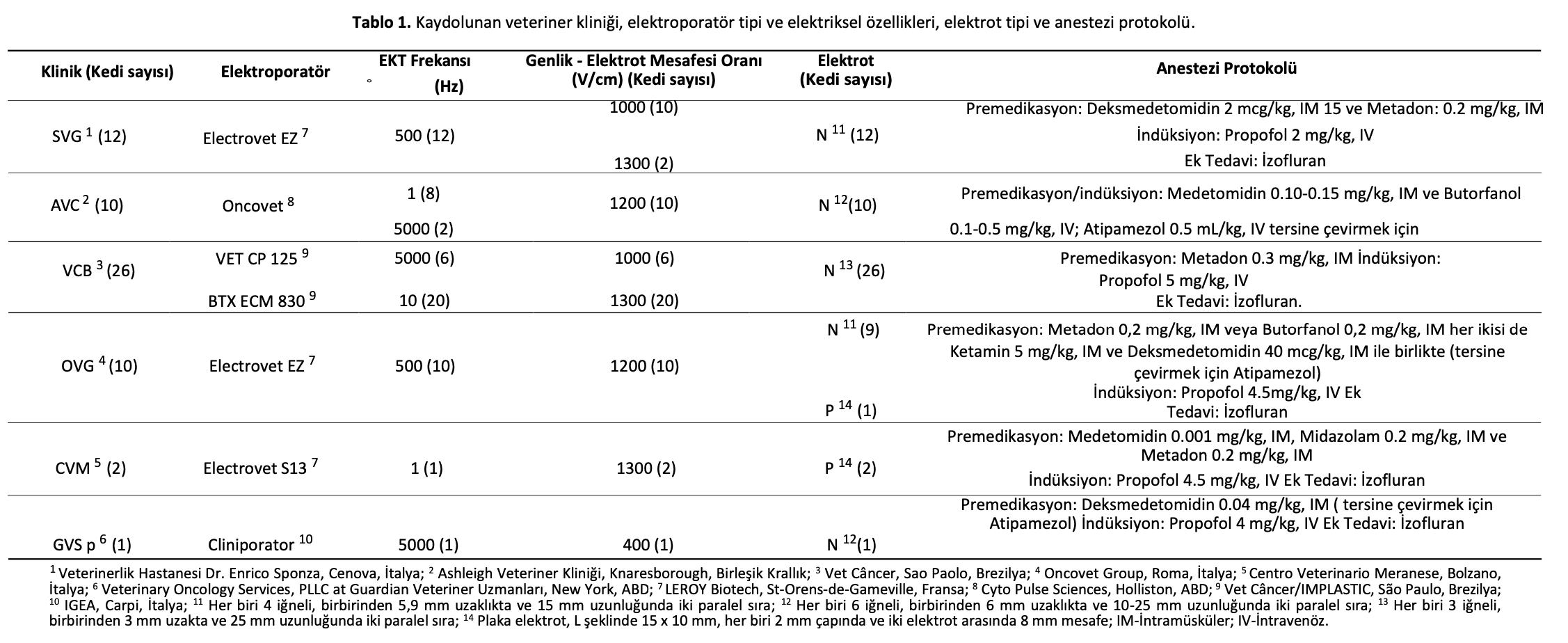
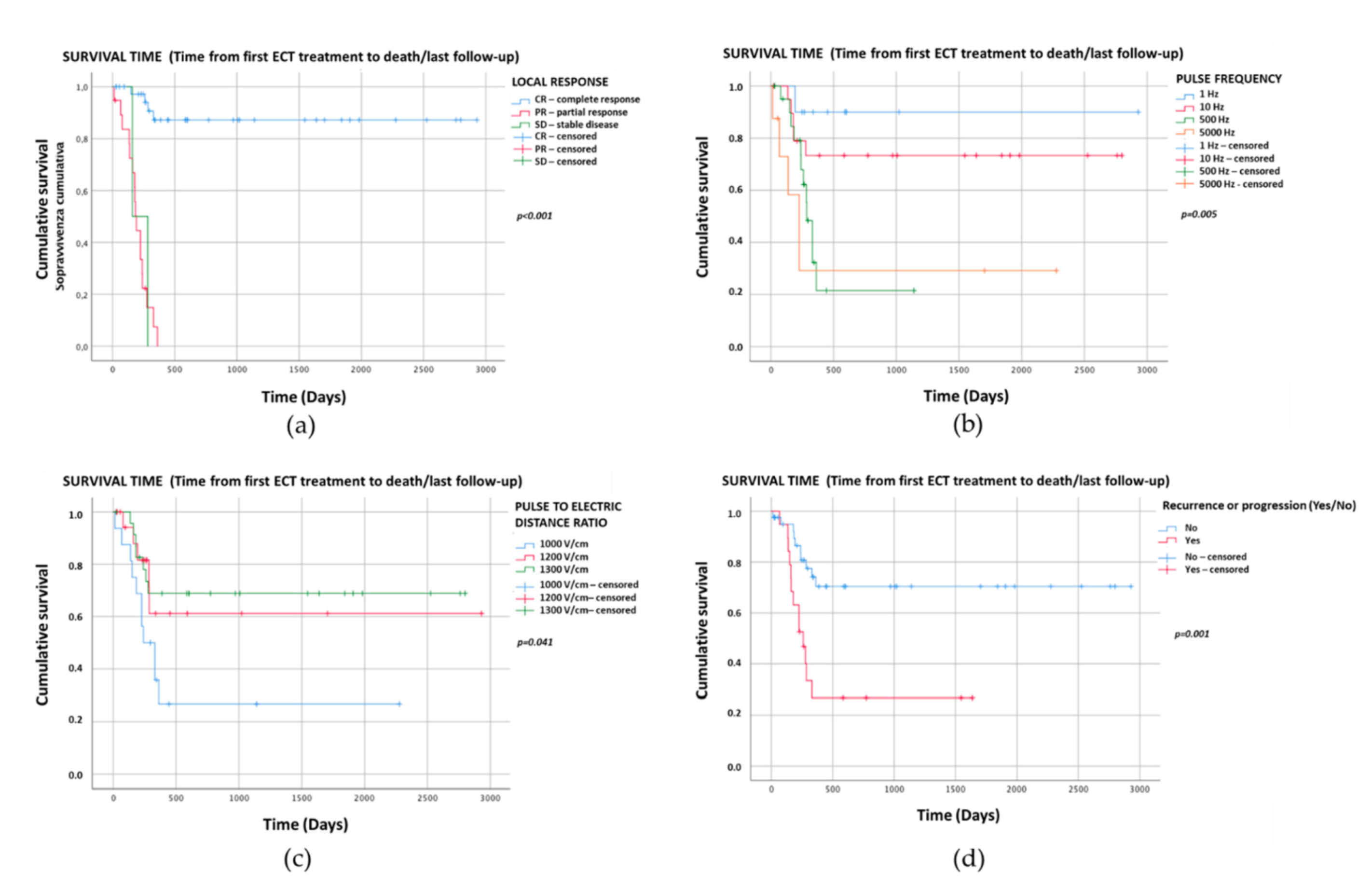
Sağkalım süresi (gün) için Kaplan-Meier grafikleri Şekil1a-d’de sunulmuştur. Kaplan-Meier sağkalım eğrilerinin log-rank analizi ile sadece anlamlı istatistiksel karşılaştırmalar sunulmuştur: lokal tedavi yanıtı (p < 0.001) (Şekil1a), puls frekansı (p = 0.005) (Şekil1b), amplitüd/elektrot mesafesi oranı ( p = 0.041) (Şekil1c) ve rekürrens/progresyon (p = 0.001) (Şekil1d).
Şekil 1. Sağkalım sürelerini (gün) gösteren p < 0.05 olan dört kategorik değişkenin Kaplan-Meier grafikleri. Sağkalım eğrilerinin (a) lokal tedavi yanıtı için log-rank testi ile karşılaştırılması p < 0,001 (CR: medyan NR, %95CI NR; PR: medyan 193, %95CI 168-218; SD: medyan 160, %95CI NR); (b) puls frekansı p = 0,005 (1 Hz: medyan NR, %95CI NR; 10 Hz: medyan NR, %95CI NR; 500 Hz: medyan 286, %95CI 238-334; 5000 Hz: medyan 225, %95CI 124-326); (c) genlik/elektrot mesafesi oranı p = 0,041 (1000 V/cm: medyan 240, %95CI 115-365; 1200 V/cm: medyan NR, %95CI NR; 1300 V/cm: medyan NR, %95CI NR); (d) nüks/progresyon p = 0,001 (nüks/progresyon: medyan 260, %95CI 165-355; nüks/progresyon yok: medyan NR, %95CI NR). NR-Ulaşılamadı.
Sürekli değişkenler için Cox regresyon analizi sadece tümör boyutu için istatistiksel olarak anlamlı sonuçlar göstermiştir (p = 0.005, OR 1.48, %95CI 1.12-1.94).
Sağkalım süresi için çok değişkenli analiz yalnızca nüks/progresyon (p = 0.014, OR 3.18, %95CI 1.26-8.02) ve lokal tedavi yanıtı için istatistiksel olarak anlamlıydı (karşılaştırma terimi olarak CR: PR, p < 0.001, OR 23.97, %95CI 7.3-78.8; SD, p < 0.001, OR 29.42, %95CI 4.72-183.15).
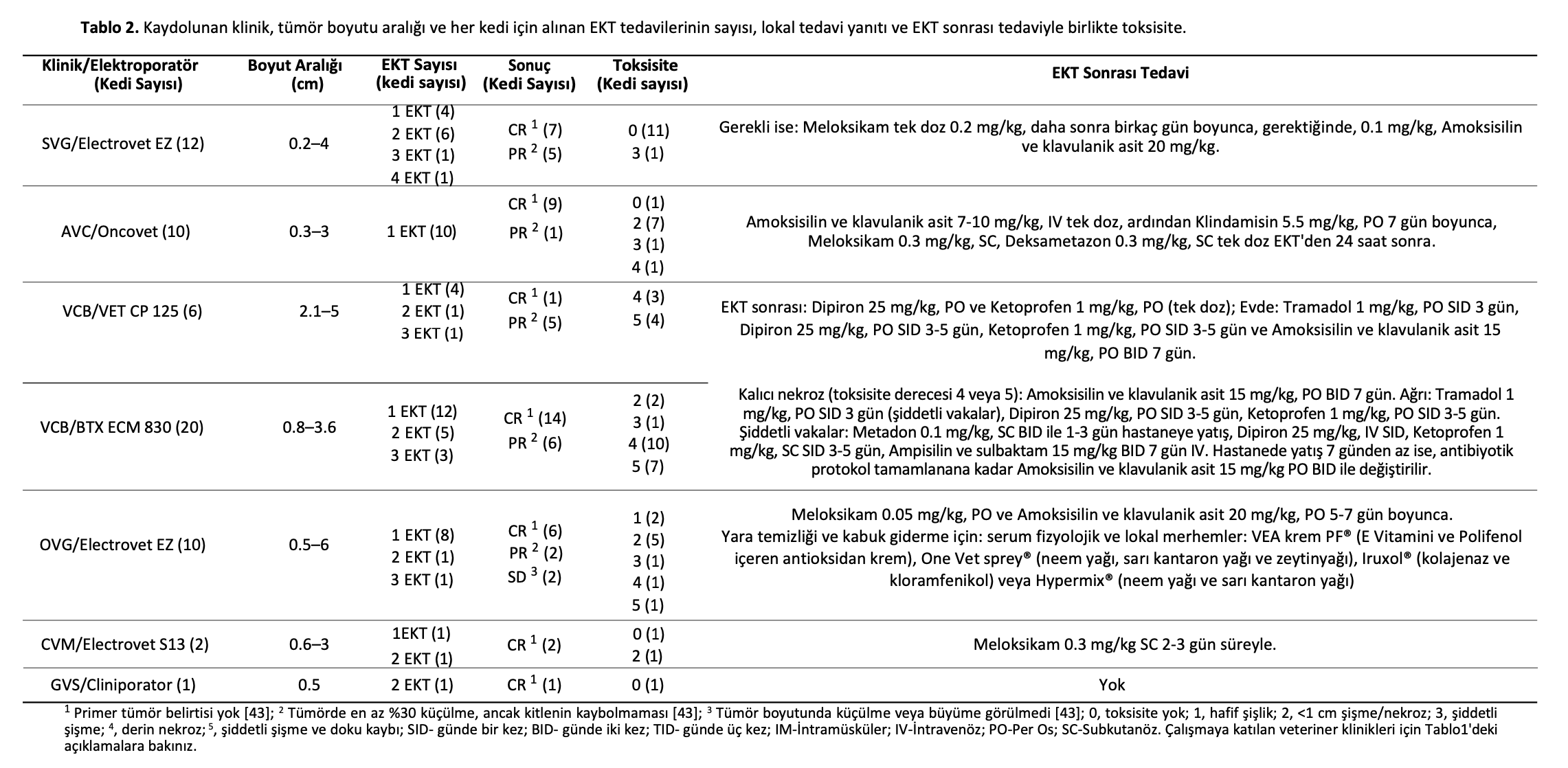
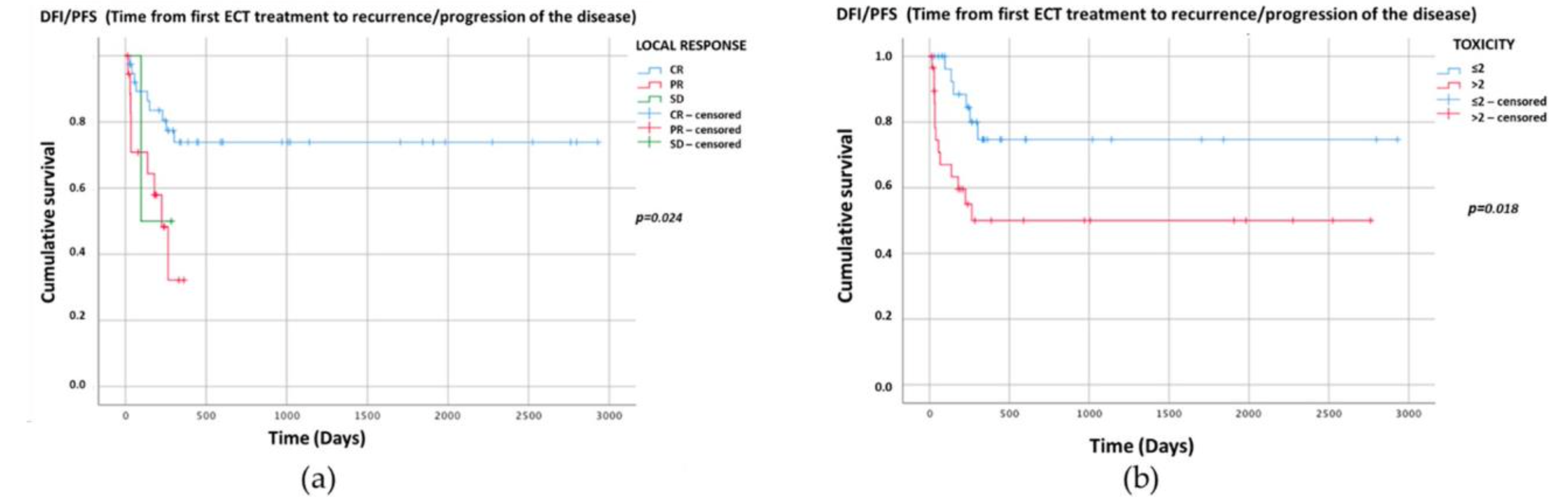
Nüks/progresyon (DFI/PFS) (gün) için Kaplan-Meier grafikleri Şekil2a,b’de sunulmuştur. Kaplan- Meier sağkalım eğrilerinin log-rank analizi ile sadece anlamlı istatistiksel karşılaştırmalar sunulmuştur: bunlar lokal tedavi yanıtı (p = 0.024) (Şekil2a) ve toksisite skoruydu (p = 0.018) (Şekil2b).
Sürekli değişkenler için Cox regresyon analizi yalnızca tümör boyutu için istatistiksel olarak anlamlı sonuçlar göstermiştir (p = 0.004, OR 1.47, %95CI 1.13-1.92). DFI/PFS için çok değişkenli analiz yalnızca toksisite skoru için anlamlıydı (referans kategori olarak toksisite <2: p = 0.025; toksisite >2 OR 3.03, %95CI 1.15-7.99).
Değişkenler arasındaki ilişkiyi belirlemek için kullanılan tek değişkenli analiz ve çok değişkenli analizden elde edilen veriler tümöre özgü sağkalım için Tablo3’te, lokal tedavi yanıtı için Tablo4’te ve toksisite için Tablo5’te sunulmuştur. Lokal tedavi yanıtı ve nüks/progresyon bağımsız olarak tümöre özgü sağkalım ile ilişkiliydi. Tümör boyutu lokal tedavi yanıtı ile ilişkiliydi. Tümör boyutu >1,7 cm yüksek PR/SD riski ile ilişkiliydi (AUC 0,79, %95CI 0,67-0,91, p < 0,001, duyarlılık %76, özgüllük %72). Tümör boyutu >1,1 cm, yüksek toksisite skoru >2 riski ile ilişkiliydi (AUC 0,88, %95CI 0,78-0,98, p < 0,001, duyarlılık %93, özgüllük %83).
Şekil 2. DFI/PFS’yi (gün) gösteren ve p < 0.05 olan iki kategorik değişkenin Kaplan-Meier grafikleri. Sağkalım eğrilerinin log-rank testi ile karşılaştırılması (a) lokal tedavi yanıtı p = 0.024 (CR: medyan NR, %95CI NR; PR: medyan 225, %95CI 139-311; SD: medyan 97, %95CI NR); ve (b) toksisite p = 0.018 (≤2: medyan NR, %95CI NR, >2: medyan NR, %95CI NR). NR-Ulaşılamadı.
4. Tartışma
Bu retrospektif çalışma, 61 kediden oluşan bir grupta kedi npSCC tedavisinde EKT’nin etkinliğini ve güvenliğini değerlendirmiştir. Bugüne kadar, çok az sayıda çalışma bu konuda yayımlanmıştır ve çalışma popülasyonu son derece sınırlıdır [9,32,38,44].
Tüm yüz SCC’lerinde olduğu gibi, npSCC de lokal olarak invaziv olabilir ve tedavi yöntemlerinin sonucu tümörün evresinden ve invazivliğinden etkilenmektedir; düşük evreli lezyonlarda (Tis ve T1 gibi) daha iyi sonuçlar elde edilmektedir [9]. Ameliyattan sonraki önemli kozmetik ve fonksiyonel kusurlar nedeniyle, köpek npSCC’lerinin tedavisinde standart prosedür olarak kabul edilen nosektomi, EKT mevcut olduğunda kedilerde bu tümörlerin tedavisinde ilk seçenek olarak düşünülmemelidir [2]. Kriyocerrahi kullanımını değerlendiren çalışmalar, oldukça uzun yanıt süreleri ile %84’e varan CR oranları rapor etmiştir [10]. Bununla birlikte, diğer raporlar, kriyocerrahi sonrası cerrahi sınırların değerlendirilmesinin imkansızlığı nedeniyle düşük evreli tümörler için bile yüksek nüks oranları (%73’e kadar) rapor etmiştir [4,10,11]. Kedi npSCC’leri için kriyocerrahinin bir diğer önemli kısıtlaması da çoğu vakada birden fazla tedaviye ihtiyaç duyulmasıdır [4,10,11].
Radyoterapi, ortovoltaj, megavoltaj ve proton ışını radyasyonunu da içeren birçok farklı protokol aracılığıyla kedilerdeki npSCC’leri tedavi etmek için kullanılmıştır. Radyoterapinin başlıca kısıtlamaları arasında tedavi planlaması ve uygulaması için gereken çoklu anestezi, tedavi sonrası erken ve geç yan etkilerin ortaya çıkması ve yüksek maliyet yer almaktadır [2,4,11,12,15,21].
Stronsiyum-90 ile brakiterapi, iki çalışmada olumlu CR oranları ile çok iyi sonuçlar göstermiştir [13,14]. Ancak, tedavi daha geniş bir popülasyonda değerlendirildiğinde, hastaların %33’ünde radyasyon alanı penumbrası dışında yeni lezyonların ortaya çıktığı bildirilmiştir [14]. Yakın zamanda yapılan bir çalışmada, tedaviye yanıt %100 olmuş ve medyan DFI 916 gün olarak saptanmıştır [21].
Fotodinamik tedavi kedi npSCC’lerinde de mükemmel sonuçlar vermiştir. Güvenli bir şekilde tekrarlanabilmesine rağmen, derin yerleşimli tümörlere uygulandığında nüks oranı yüksektir [16,17]. Bu tedavi ile fotosensitizer hem topikal hem de sistemik olarak uygulanabilir. Kedi SCC’lerinde topikal olarak uygulandığında, çalışmadaki kedilerin %85’i CR elde etmiştir; ancak bunların %51’inde medyan 157 günün ardından tümör nüksü görülmüştür [16]. Bunun aksine, fotosensitizer intravenöz olarak uygulandığında, yanıt oranı %20 ile nüks oranı %100 olmuştur. Tedaviden bir yıl sonra, popülasyonun %75’i lokal kontrolü korumuştur [17].
Bu makalenin konusu olan EKT, hem anti-tümör hem de pozitif kozmetik etkileri makul bir maliyetle birleştiren yeni bir tedavidir ve veteriner onkolojisinde giderek daha fazla kullanılmaktadır [9,22].
Spugnini ve ark. tarafından hazırlanan ve intratümöral bleomisin uygulaması ile birlikte EKT ile tedavi edilen çoğunlukla npSCC’li dokuz kediyi içeren bir raporda, kedilerin %77,7’sinde üç yıl süren tam lokal kontrol elde edilmiştir. Çalışmada sadece iki kedi lokal tümör nüksü nedeniyle ölmüştür [38].
Tozon ve ark. 11 kediden oluşan bir popülasyonda kafada bulunan SCC’lerin tedavisi için sistemik bleomisin ile birlikte tek bir EKT seansı uygulamıştır. Yazarlar, popülasyonun %81,8’inde CR elde edildiğini ve CR elde edildikten sırasıyla iki ve sekiz ay sonra sadece iki kedide tümör nüksü görüldüğünü bildirmişlerdir [9].
Başka bir çalışmada, Spugnini ve ark. kedi perioküler SCC ve kafadaki ilerlemiş SCC’nin tedavisi için sistemik bleomisin ile birlikte EKT uyguladıklarını bildirmişlerdir. Bu raporda, genel yanıt oranı %89 (21/47 CR ve 2/47 PR) ve medyan PFS 30,5 ay olmuştur [32].
Dos Anjos ve arkadaşları, sadece EKT ile tedavi edilen kutanöz SCC’li kedilerde standart bleomisin dozu (15.000 UI/m2) ve azaltılmış doz (10.000 UI/m2) kullanarak iki EKT protokolünü karşılaştırmıştır. Çalışmaya 56 kediden oluşan bir grup dahil edilmiş ve iki gruba ayrılmıştır: 22’si standart dozla ve 34’ü daha düşük bleomisin dozuyla tedavi edilmiştir. Yanıt oranı ve medyan DFI sırasıyla %87,4, 240 gün ve %100, 210 gün olmuştur [44].
Bildiğimiz kadarıyla, bizim çalışmamız sadece nazal planumda bulunan SCC’den etkilenen geniş bir kedi popülasyonunda tek başına EKT kullanımına ilişkin yapılan ilk çalışmadır.
EKT’yi sistemik bleomisin uygulaması ile birleştirdik ve böylece hastalığın düşük RR veya progresyonu ile çok iyi bir yanıt oranı elde ettik. Popülasyon, medyan tümör boyutu 1,5 cm olan, metastatik olmayan npSCC’li 61 kediden oluşuyordu. Tümör boyutuna ilişkin benzer veriler, kedi SCC’lerinde EKT ile ilgili diğer çalışmalarda da bildirilmiştir [9,32,38].
EKT 61 kedinin tamamında tek tedavi yöntemi olarak uygulanmış, kedilerin %96,7’si tedaviye yanıt vermiş ve %3,3’ü SD olarak kalmıştır. Çalışmaya dahil edilen kedilerin %65,5’inde CR ve %31,1’inde PR elde edilmiştir. Tedaviye yanıt oranına ilişkin verilerimiz, kedi SCC’lerinde EKT’yi ele alan ve RR’nin %77 ila %100 arasında değiştiği önceki çalışmalara benzer, hatta onlardan biraz daha iyidir. Yanıtın derecesi ve tamlığı da çalışmalar arasında farklılık göstermektedir ve büyük ölçüde klinik evreye ve tümör boyutuna bağlıdır [9,32,38,44]. Spugnini ve arkadaşları (2015) %44,6’lık bir CR oranı elde etmiştir ancak bu çalışmaya perioküler ve kafadaki ileri evre SCC’ler dahil edilmiştir. Bununla birlikte, daha düşük evre tümörler dahil edildiğinde, %81,8’e varan CR’ler bildirilmiştir. Verilerimiz önceki literatürle karşılaştırılırken dikkatli olunmalıdır, çünkü bu çalışma sadece nazal planum yerleşimli kedi SCC’lerinin EKT ile tedavi edildiği ilk çalışmadır. Çalışmamızda, hastaların çoğu (%63,9) sadece bir EKT seansına ihtiyaç duymuştur, bu da daha önce yayınlanan çalışmalarla tutarlılık göstermektedir [9,32,38,44]. Ancak 22 kedi (%36,1) birden fazla kez tedavi edilmiştir (Tablo2). Çoklu EKT seansları çoğunlukla ilk EKT’ye PR veya SD ile yanıt veren kedilerde ve bir tedaviden sonra CR ile sonuçlanan ancak daha sonra nüks eden kedilerde uygulandı. Birden fazla EKT seansı ile tedavi edilen kediler arasında, beş hasta ilk seanstan sonra CR elde edilmiş olsa bile, CR’yi güçlendirmek için birden fazla EKT almıştır. Bu karar, tümörün görünümüne bağlı olarak hastalığın olası nüksünden şüphelenildiğinde sorumlu klinisyenler tarafından alınmıştır. Bu çalışmada, genel MST 286 gün (aralık 13-2929 gün) ve CR’deki kediler için genel RR oldukça düşüktü (%22,5) ve medyan DFI 136 gündü (aralık 29-302 gün). Lokal hastalık progresyonu olan kedilerin (10/61) medyan PFS’si 65,5 gün (aralık 16-264 gün) olmuştur.
Lokal tedavi toksisitesi daha önce yayınlanmış, subjektif altı puanlık bir ölçek kullanılarak değerlendirilmiştir [29]. Bu, EKT’ye bağlı lokal tedavi toksisitesinin değerlendirilmesi için bu derecelendirme sisteminin kedilerde uygulandığı ilk çalışmadır, çünkü şimdiye kadar sadece EKT ile tedavi edilen köpek tümörlerinde rapor edilmiştir [29-31]. Bu çalışmada, tedavi sonrası lokal tedavi toksisitesi hastaların %51’inde yoktu veya hafifti (skor <2). Bununla birlikte, çalışma popülasyonumuzun geri kalan %49’unda toksisite skoru >2 idi. Bu toksisite skorlama sisteminin subjektif doğası nedeniyle literatürle objektif bir karşılaştırma yapmak zor olsa da, lokal tedavi toksisitesine ilişkin verilerimiz daha önce kedi SCC’leri üzerine yapılan diğer çalışmalarda tanımlanan bulgularla tutarlılık göstermektedir [9,32,38].
Kaplan-Meier eğrileri lokal tedavi yanıtının (p < 0.001) (Şekil1a), puls frekansının (p = 0.005) (Şekil1b), amplitüdün elektrot mesafesine oranının ( p = 0.041) (Şekil1c), nüks veya progresyon varlığının ( p = 0.001) (Şekil1d) ve tümör boyutunun (p = 0.005) sağkalım süresini önemli ölçüde etkilediğini göstermiştir.
Çok değişkenli analizde, sağkalım süresi üzerinde en yüksek etkiye sahip olan ve kedilerin tümörden ölme olasılığını artıran iki değişken, tümör nüksü veya hastalığın ilerlemesi (p = 0.014) ve lokal tedavi yanıtıydı. PR (p < 0.001) veya SD (p < 0.001) olan kedilerin tümörle ilişkili nedenlerden ölme olasılığı CR olan kedilere kıyasla sırasıyla 23.97 ve 29.42 kat daha yüksekti. Bu şaşırtıcı değildir çünkü hastalığın nüks ettiği veya ilerlediği kediler, yayınlanan çalışmaların çoğunda daha kötü prognoz gösterme eğilimindedir [44].
Hastalığın nüksetmesi veya ilerlemesi lokal tedavi yanıtı (p = 0,024) (Şekil2a), tümör boyutu ( p = 0,004) ve toksisite skoru (p = 0,018) (Şekil2b) faktörlerinden önemli ölçüde etkilenmiştir. Lokal tedavi yanıtı ve tümör boyutu ile hastalığın nüksetmesi veya ilerlemesi arasındaki korelasyon mantıklı görünmekle birlikte literatürde diğer tedavi yöntemleri de dikkate alınarak doğrulanmış olsa da tedavi sonucu ile lokal toksisite arasındaki bağlantı şaşırtıcıdır.
Aslında, çok değişkenli istatistiksel analiz, toksisite skoru >2 olan kedilerin, toksisite skoru <2 olan kedilere göre tümör nüksü veya hastalığın ilerlemesi olasılığının üç kat daha yüksek olduğunu göstermiştir [9,32,44-46]. Bildiğimiz kadarıyla, bugüne kadar EKT ile tedavi edilen tümörlerde daha fazla lokal yan etki ile hastalığın nüksetmesi veya ilerlemesi arasında herhangi bir bağlantı tespit edilmemiştir. Bu veriler, yüksek toksisitenin tedavinin etkinliğini etkileyebileceği ve gelecekteki çalışmalarda dikkate alınması gerektiğini vurgulamaktadır.
Tümör varlığına bağlı ölüm, PR’li kedilerde CR elde eden kedilere kıyasla istatistiksel olarak anlamlı derecede daha yüksekti (p < 0.001). Ayrıca, 1 Hz (p = 0,035) ile tedavi edilen kedilerin tümörden ölme ihtimali (OR 0,07) 5000 Hz ile tedavi edilen kedilere kıyasla daha düşüktü. Benzer şekilde, 1000 V/cm ile tedavi edilen kedilere kıyasla 1200 V/cm (p = 0,011) ve 1300 V/cm (p = 0,016) ile tedavi edilen kedilerde tümöre bağlı ölüm olasılığı daha yüksekti. Son olarak, nüks veya progresyon gösteren kediler (p = 0.002) mantıksal olarak tümöre bağlı ölüme daha yatkındı. Lokal tedavi yanıtının ve nüks veya progresyonun etkisi çok değişkenli lojistik ikili regresyonda da doğrulanmıştır (Tablo3).
Lokal tedavi yanıtı nabız frekansından etkilenmiştir (p = 0,035), yani 1 Hz ile tedavi edilen kedilerin CR elde etme olasılığı 5000 Hz ile tedavi edilen kedilere göre daha yüksektir. Hem insan hem de veterinerlik hastaları üzerinde yapılan çalışmalar 1 Hz veya 5000 Hz’lik atımların uygulanmasının klinik sonucu etkilemediğini kanıtladığı için bu oldukça şaşırtıcıdır. Bulgularımız ışığında, veriler dikkatle değerlendirilmeli ve ideal olarak prospektif, karşılaştırmalı bir çalışma ile doğrulanmalıdır [26,47]. Toksisite skoru <2 olan kedilerin CR elde etme olasılığı, toksisite skoru >2 olan kedilere kıyasla daha yüksektir. Lokal tedavi yanıtı boyuttan da etkilenmiştir (p = 0.001). Çok değişkenli analiz, lokal tedavi yanıtının tümör boyutundan yüksek oranda etkilendiğini doğrulamıştır (p = 0.008) (Tablo4).
Lokal tedavi toksisitesi, 500 Hz frekans ile 5000 Hz’e kıyasla daha düşük toksisiteye yol açan puls frekansından etkilenmiştir (p = 0,008). Bu bulgu literatürde daha önce hiç rapor edilmemiştir ve muhtemelen çalışmamızın çok merkezli doğasından etkilenmiştir. Klinik öncesi modellerde, nabız frekansının kas kasılmalarının sayısını ve yoğunluğunu ve dolayısıyla veteriner hastalarda değerlendirilmesi zor olan tedaviye bağlı olası ağrıyı etkilediği bildirilmiştir [48,49]. Buna ek olarak, genlik/elektrot mesafesi oranının da tedavinin toksisitesi üzerinde bir etkisi olmuş ve 1300 V/cm ile tedavi edilen tümörlerin 1000 V/cm ile tedavi edilenlere göre daha yüksek toksisite gösterdiğini ortaya koymuştur (p = 0,01). Bu sonuç Torrigiani ve arkadaşları (2019) tarafından da tespit edilmiştir; ancak başka bir yerde rapor edilmemiştir. Tümör boyutu da toksisite skorunu önemli ölçüde etkilemiştir (p < 0,001) (Tablo5), bu da insanlarla ilgili literatürle uyumludur. Aslında, çeşitli kanserlerin kutanöz metastazlarının EKT tedavisine bağlı ağrı risk faktörlerini tanımlayan bir çalışmada, metastaz boyutunun daha yüksek ağrı skoru ile bağlantılı olduğu bulunmuştur. Yazarlar, büyük ve muhtemelen nekrotik metastazların iyileşmesinin de daha fazla zaman alacağını tahmin etmişlerdir. Sonuçlarımız ışığında, daha büyük npSCC’leri olan kedilerin sahipleri daha ciddi yan etki riski konusunda uyarılmalıdır [48].
Son olarak, diğer tümör tiplerinde daha önce bildirildiği gibi, boyut tedavi sonucuyla yakından ilişkiliydi. Bizim vakamızda, yüksek CR olasılığını garanti eden cut-off değeri <1,7 cm idi [31,50]. EKT apoptoz ve doku nekrozuna neden olduğundan, tümör boyutu >1 cm olduğunda tümör boyutu ile >2 toksisite skoru riski arasındaki bağlantı şaşırtıcı görünmemektedir. EKT ile tedavi edilen tümör ne kadar büyükse, doku nekrozuna uğrayan alan o kadar büyük olur ve lokal toksisitenin 2’nin üzerinde skorlara ulaşma olasılığı o kadar yüksek olur. Ancak yukarıda bildirildiği gibi, bu hipotezi doğrulamak için daha fazla çalışma yapılmalıdır.
Mevcut çalışmanın temel kısıtlaması, toplanan verilerin retrospektif niteliğidir. Ayrıca, çalışmanın çok merkezli doğası nedeniyle farklı elektroporatör tiplerinin yanı sıra farklı elektroporasyon protokollerinin kullanılması, npSCC’li kediler için ideal EKT protokolü hakkında kesin sonuçlara varılmasını engellemektedir. Sadece tek tip elektroporatör ve tek bir protokol kullanılarak daha geniş bir popülasyon üzerinde çalışılması daha ideal olacaktır.
Bununla birlikte, kedilerde npSCC’ler için standart EKT protokolünün geliştirilmesi bu çalışmanın amaçları dahilinde değildi ancak cihazların ve protokollerin değişken olmasının klinik uygulamanın realitesini yansıttığına inanıyoruz. Bununla birlikte, hasta için en iyi sonucu garanti edecek ideal bir EKT prosedürü oluşturmak amacıyla kullanılan farklı elektroporatörlerin ve protokollerin karşılaştırılmasını içeren prospektif bir çalışma yürütmek ilginç olacaktır. Ayrıca, lokal toksisite skorlama sistemi önceki çalışmalarda etkili bir şekilde uygulanmış olsa da, sübjektif doğası bu çalışmanın bir başka kısıtlamasıdır.
5. Sonuç
Çalışmamızın sonuçları, EKT’nin kedi npSCC’leri için etkili ve güvenli bir tedavi olduğunu ve bu nedenle özellikle düşük evreli tümörlerde tercih edilen tedavilerden biri olarak kabul edilebileceğini doğrulamaktadır. Çalışma popülasyonumuzda, istatistiksel analiz tümör boyutu ve lokal tedavi yanıtının sağkalım süresini ve tümör nüksü veya progresyonunu en çok etkileyen değişkenler olduğunu belirlemiştir. Bu da nazal planum yerleşimli bu lokal invaziv karsinomlarda erken tanının son derece önemli olduğunu ve ilk tedavi sonuçlarının hastanın başarılı bir şekilde tedavi edilmesi için hayati önem taşıdığını doğrulamaktadır.
Katkıda bulunan yazarlar: Kavram geliştirme, P.S., G.L. ve A.P.; metodoloji, P.S., G.L. ve A.P.; veri düzenleme, P.S., G.L. ve A.P.; yazım-orijinal taslak hazırlama, P.S., G.L., A.P. ve F.T.; yazım- inceleme ve düzenleme, P.S., G.L., A.P., F.T., J.A.I., R.L., V.G., R.T., E.S., F.G., F.V., G.A., M.C., M.M.M.R.,
K.D.d.O., J.O.F. ve P.G.Q. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir.
Finansman: Bu araştırma herhangi bir dış finansman almamıştır.
Etik Kurul Beyanı: Araştırmanın retrospektif olması nedeniyle bu çalışma için etik inceleme ve onay alınmamıştır. Hayvanlara deneysel bir çalışmanın parçası olarak değil, gereklilikten dolayı muamele edilmiş ve yalnızca veriler daha sonra seçilerek bu çalışmaya dahil edilmiştir.
Bilgilendirilmiş Onam Beyanı: Mevcut değildir. Hasta sahipleri, dahil edilen sağlık tesislerinde standart prosedür olarak bilgilendirilmiş onam imzalamışlardır. Bu retrospektif çalışmaya dahil edilmek için özel bir bilgilendirilmiş onam beyanı imzalanmamıştır.
Veri Erişim Beyanı: Gizlilik veya etik gibi kısıtlamalar nedeniyle veriler talep üzerine temin edilebilir. Bu çalışmada sunulan veriler ilgili yazardan talep üzerine temin edilebilir. Çalışmanın çok merkezli doğası ve dünyanın her yerinden çeşitli sağlık tesislerinin dahil edilmesi nedeniyle ve sunulan verilerin gizliliğini garanti altına almak için veriler kamuya açık değildir.
Çıkar Çatışmaları: Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
KAYNAKÇA
- Bertino, G.; Sersa, G.; De Terlizzi, F.; Occhini, A.; Plaschke, C.C.; Groselj, A.; Langdon, C.; Grau, J.J.; McCaul, J.A.; Heuveling, D.; et al. European Research on Electrochemotherapy in Head and Neck Cancer (EURECA) project: Results of the treatment of skin cancer. Eur. J. Cancer 2016, 63, 41–52. [CrossRef]
- Murphy, S. Cutaneous Squamous Cell Carcinoma in the Cat: Current understanding and treatment approaches. J. Feline Med. Surg. 2013, 15, 401–407. [CrossRef]
- Hauck, M.L. Tumors of the Skin and Subcutaneous Tissues. In Withrow & MacEwen’s Small Animal Clinical Oncology, 5th ed.; Elsevier: St. Louis, MI, USA, 2013; pp. 305–320.
- Thomson, M. Squamous Cell Carcinoma of the Nasal Planum in Cats and Dogs. Clin. Tech. Small Anim. Pr. 2007, 22, 42–45. [CrossRef]
- Goldschmidt, M.H.; Goldschmidt, K.H. Epithelial and Melanocytic Tumors of the Skin. In Tumors in Domestic Animals; Wiley: Ames, IA,USA, 2016; Volume 2017, pp. 88–141.
- Hauck, M.L.; Oblak, M.L. Tumors of the Skin and Subcutaneous Tissues. In Withrow and MacEwen’s Small Animal Clinical Oncology; Elsevier:Amsterdam, The Netherlands, 2020; pp. 352–366.
- Munday, J.S.; Gwyther, S.; Thomson, N.A.; Malik, R. Bilateral pre-auricular papillary squamous cell carcinomas associated withpapillomavirus infection in a domestic cat. Vet. Dermatol. 2016, 28, 232-e58. [CrossRef]
8.Withrow, S.; Straw, R. Resection of the nasal planum in nine cats and five dogs. J. Am. Anim. Hosp. Assoc. 1990, 26, 219–222.
9. Tozon, N.; Pavlin, D.; Sersa, G.; Dolinsek, T.; Cemazar, M. Electrochemotherapy with intravenous bleomycin injection: An observational
study in superficial squamous cell carcinoma in cats. J. Feline Med. Surg. 2014, 16, 291–299. [CrossRef] [PubMed] 10.Clarke, R. Cryosurgical treatment of feline cutaneous squamous cell carcinoma. Aust. Vet. Pr. 1991, 21, 148–153.
- Lana, S.E.; Ogilvie, G.K.; Withrow, S.J.; Straw, R.C.; Rogers, K.S. Feline cutaneous squamous cell carcinoma of the nasal planum and the pinnae: 61 cases. J. Am. Anim. Hosp. Assoc. 1997, 33, 329–332. [CrossRef]
- Théon, A.P.; Madewell, B.R.; Shearn, V.I.; Moulton, J.E. Prognostic factors associated with radiotherapy of squamous cell car-cinoma of the nasal plane in cats. J. Am. Vet. Med. Assoc. 1995, 206, 991–996. [PubMed]
- Goodfellow, M.; Hayes, A.; Murphy, S.; Brearley, M. A retrospective study of 90Strontium plesiotherapy for feline squamous cell carcinoma of the nasal planum. J. Feline Med. Surg. 2006, 8, 169–176. [CrossRef] [PubMed]
- Hammond, G.M.; Gordon, I.K.; Theon, A.P.; Kent, M.S. Evaluation of strontium Sr 90 for the treatment of superficial squamous cell carcinoma of the nasal planum in cats: 49 cases (1990–2006). J. Am. Veter. Med. Assoc. 2007, 231, 736–741. [CrossRef] [PubMed]
- Van Vechten, M.K.; Théon, A.P. Strontium-90 plesiotherapy for treatment of early squamous cell carcinoma of the nasal planum in 25 cats. Proc. Vet. Can. Soc. 1993, 107, 108.
- Bexfield, N.H.; Stell, A.J.; Gear, R.N.; Dobson, J.M. Photodynamic Therapy of Superficial Nasal Planum Squamous Cell Carci- nomas in Cats: 55 Cases. J. Vet. Intern. Med. 2008, 22, 1385–1389. [CrossRef]
- Buchholz, J.; Wergin, M.; Walt, H.; Gräfe, S.; Bley, C.R.; Kaser-Hotz, B. Photodynamic therapy of feline cutaneous squamous cell carcinoma using a newly developed liposomal photosensitizes: Preliminary results concerning drug safety and efficacy. J. Vet. Intern. Med. 2007, 21, 770–775. [CrossRef] [PubMed]
- Théon, A.P.; VanVechten, M.K.; Madewell, B.R. Intratumoral administration of carboplatin for treatment of squamous cell carcinomas of the nasal plane in cats. Am. J. Vet. Res. 1996, 57, 205–210.
- Ogilvie, G.K.; Moore, A.S.; Obradovich, J.E.; Elmslie, R.E.; Vail, D.M.; Straw, R.C.; Salmon, M.D.; Klein, M.K.; Atwater, S.W.; Ciekot, P.E. Toxicoses and efficacy associated with administration of mitoxantrone to cats with malignant tumors. J. Am. Vet. Med. Assoc. 1993, 202, 1839–1844.
- De Vos, J.P.; Burm, A.G.O.; Focker, B.P. Results from the treatment of advanced stage squamous cell carcinoma of the nasal planum in cats, using a combination of intralesional carboplatin and superficial radiotherapy: A pilot study. Vet. Comp. Oncol. 2004, 2, 75–81. [CrossRef]
- Gasymova, E.; Meier, V.; Guscetti, F.; Cancedda, S.; Roos, M.; Bley, C.R. Retrospective clinical study on outcome in cats with nasal planum squamous cell carcinoma treated with an accelerated radiation protocol. BMC Vet. Res. 2017, 13, 86. [CrossRef]
22.Cemazar, M.; Sersa, G. Recent Advances in Electrochemotherapy. Bioelectricity 2019, 1, 204–213. [CrossRef]
- Rangel, M.M.; Luz, J.C.; Oliveira, K.D.; Ojeda, J.; Freytag, J.O.; Suzuki, D.O. Electrochemotherapy in the treatment of neoplasms in dogs andcats. Austral. J. Vet. Sci. 2019, 51, 45–51. [CrossRef]
- Spugnini, E.P.; Azzarito, T.; Fais, S.; Fanciulli, M.; Baldi, A. Electrochemotherapy as First Line Cancer Treatment: Experiences fromVeterinary Medicine in Developing Novel Protocols. Curr. Cancer Drug Targets 2015, 16, 43–52. [CrossRef]
- Miklavcˇicˇ, D.; Mali, B.; Kos, B.; Heller, R.; Serša, G. Electrochemotherapy: From the drawing board into medical practice. Biomed. Eng. Online2014, 13, 29. [CrossRef] [PubMed]
- Tozon, N.; Tratar, U.L.; Znidar, K.; Sersa, G.; Teissie, J.; Cemazar, M. Operating Procedures of the Electrochemotherapy for Treatment of
Tumor in Dogs and Cats. J. Vis. Exp. 2016, 2016, e54760. [CrossRef] ˇ
27. Serša, G.; Miklavcˇicˇ, D.; Cemazarm, M.; Belehradek, J.; Jarm, T.; Mir, L.M. Electrochemotherapy with CDDP on LPB sarcoma: Comparison of the anti-tumor effectiveness in immunocompotent and immunodeficient mice. Bioelectrochem. Bioenerg. 1997, 43, 279– 283. [CrossRef]
- Sersa, G.; Teissie, J.; Cemazar, M.; Signori, E.; Kamensek, U.; Marshall, G.; Miklavcic, D. Electrochemotherapy of tumors as in situ vaccination boosted by immunogene electrotransfer. Cancer Immunol. Immunother. 2015, 64, 1315–1327. [CrossRef] [PubMed]
- Lowe, R.; Gavazza, A.; Impellizeri, J.A.; Soden, D.M.; Lubas, G. The treatment of canine mast cell tumours with electrochemother- apy with or without surgical excision. Vet. Comp. Oncol. 2016, 15, 775–784. [CrossRef]
- Torrigiani, F.; Pierini, A.; Lowe, R.; Simcˇicˇ, P.; Lubas, G. Soft tissue sarcoma in dogs: A treatment review and a novel approach using electrochemotherapy in a case series. Vet. Comp. Oncol. 2019, 17, 234–241. [CrossRef] [PubMed]
- Simcˇicˇ,P.;Lowe,R.;Granziera,V.;Pierini,A.;Torrigiani,F.;Lubas,G.Electrochemotherapyintreatmentofcanineoralnon-tonsillar squamous cell carcinoma. A case series report. Vet. Comp. Oncol. 2019, 18, 428–432. [CrossRef]
- Spugnini, E.P.; Pizzuto, M.; Filipponi, M.; Romani, L.; Vincenzi, B.; Menicagli, F.; Lanza, A.; De Girolamo, R.; Lomonaco, R.; Fanciulli, M.; et al. Electroporation Enhances Bleomycin Efficacy in Cats with Periocular Carcinoma and Advanced Squamous Cell Carcinoma of the Head. J. Vet. Intern. Med. 2015, 29, 1368–1375. [CrossRef] [PubMed]
- Spugnini, E.P.; Renaud, S.M.; Buglioni, S.; Carocci, F.; Dragonetti, E.; Murace, R.; Cardelli, P.; Vincenzi, B.; Baldi, A.; Citro, G. Electrochemotherapy with cisplatin enhances local control after surgical ablation of fibrosarcoma in cats: An approach to improve the therapeutic index of highly toxic chemotherapy drugs. J. Transl. Med. 2011, 9, 152. [CrossRef]ˇ
- Tozon, N.; Kodre, V.; Serša, G.; Cemažar, M. Effective treatment of perianal tumors in dogs with electrochemothera-py. AnticancerRes. 2005, 25, 839–845. [PubMed]
- Maglietti, F.; Tellado, M.; Olaiz, N.; Michinski, S.; Marshall, G. Minimally invasive electrochemotherapy procedure for treating nasal ducttumors in dogs using a single needle electrode. Radiol. Oncol. 2017, 51, 422–430. [CrossRef] [PubMed]
- Kranjc, S.; Kamensek, U.; Cemazar, M.; Sersa, G. Combined Treatment of Electrochemotherapy with Irradiation. In Handbook ofElectroporation; Springer Nature: Cham, Switzerland, 2016; pp. 1–17.
- Milevoj, N.; Tratar, U.L.; Nemec, A.; Brožicˇ, A.; Žnidar, K.; Serša, G.; Cemažar, M.; Tozon, N. A combination of electrochemother- apy, geneelectrotransfer of plasmid encoding canine IL-12 and cytoreductive surgery in the treatment of canine oral malignant melanoma. Res. Vet.
Sci. 2019, 122, 40–49. [CrossRef]
- Spugnini, E.P.; Vincenzi, B.; Citro, G.; Tonini, G.; Dotsinsky, I.; Mudrov, N.; Baldi, A. Electrochemotherapy for the treatment of squamouscell carcinoma in cats: A preliminary report. Vet. J. 2009, 179, 117–120. [CrossRef]
- Spugnini, E.P.; Baldi, A.; Vincenzi, B.; Bongiorni, F.; Bellelli, C.; Citro, G.; Porrello, A. Intraoperative versus postoperativeelectrochemotherapy in high grade soft tissue sarcomas: A preliminary study in a spontaneous feline model. Cancer Chemother.
Pharmacol. 2006, 59, 375–381. [CrossRef] [PubMed]
- Spugnini, E.P.; Dotsinsky, I.; Mudrov, N.; Citro, G.; Caruso, G.; Cardelli, P.; Baldi, A. Electrochemotherapy-induced radiation recall in a cat. InVivo 2009, 22, 751–754.
- Palareti, G.; Legnani, C.; Cosmi, B.; Antonucci, E.; Erba, N.; Poli, D.; Testa, S.; Tosetto, A.; De Micheli, V.; Ghirarduzzi, A.; et al. Comparisonbetween different D – D imer cutoff values to assess the individual risk of recurrent venous thromboembolism: Analysis of results
obtained in the DULCIS study. Int. J. Lab. Hematol. 2015, 38, 42–49. [CrossRef]
- Groselj, A.; Bosnjak, M.; Strojan, P.; Krzan, M.; Cemazar, M.; Sersa, G. Efficiency of electrochemotherapy with reduced bleomycin dose in thetreatment of nonmelanoma head and neck skin cancer: Preliminary results. Head Neck 2018, 40,120–125. [CrossRef]
- Nguyen, S.M.; Thamm, D.H.; Vail, D.M.; London, C.A. Response evaluation criteria for solid tumours in dogs (v1.0): A Veterinary CooperativeOncology Group (VCOG) consensus document. Vet. Comp. Oncol. 2013, 13, 176–183. [CrossRef]
- Dos Anjos, D.S.; Sierra, O.R.; Spugnini, E.P.; De Nardi, A.B.; Fonseca-Alves, C.E. Comparison of two different doses of bleomycin inelectrochemotherapy protocols for feline cutaneous squamous cell carcinoma nonsegregated from ultraviolet light exposure. Sci. Rep.
2020, 10, 1–9. [CrossRef]
- Cunha, S.C.; Carvalho, L.A.V.; Canary, P.C.; Reisner, M.; Corgozinho, K.B.; Souza, H.J.; Ferreira, A.M.R. Radiation therapy for felinecutaneous squamous cell carcinoma using a hypofractionated protocol. J. Feline Med. Surg. 2010, 12, 306–313. [CrossRef]
- Magne, M.L.; Rodriguez, C.O.; Autry, S.A.; Edwards, B.F.; Theon, A.P.; Madewell, B.R. Photodynamic therapy of facial squamous cellcarcinoma in cats using a new photosensitizer. Lasers Surg Med. 1997, 20, 202–209. [CrossRef]
- Mir, L.M.; Gehl, J.; Sersa, G.; Collins, C.G.; Garbay, J.-R.; Billard, V.; Geertsen, P.F.; Rudolf, Z.; O’Sullivan, G.C.; Marty, M. Standard operatingprocedures of the electrochemotherapy: Instructions for the use of bleomycin or cisplatin administered either systemically or locally and electric pulses delivered by the CliniporatorTM by means of invasive or non-invasive electrodes. Eur.
J. Cancer Suppl. 2006, 4, 14–25. [CrossRef]
48.Quaglino, P.; Matthiessen, L.W.; Curatolo, P.; Muir, T.; Bertino, G.; Kunte, C.; Odili, J.; Rotunno, R.; Humphreys, A.C.; Letul é, V.; et al. Predicting
patients at risk for pain associated with electrochemotherapy. Acta Oncol. 2015, 54, 298–306. [CrossRef] [PubMed]
ˇ
- Miklavcˇicˇ, D.; Pucihar, G.; Pavlovec, M.; Ribaricˇ, S.; Mali, M.; Macˇek-Lebar, A.; Petkovšek, M.; Nastran, J.; Kranjc, S.; Cemažar, M.;et al. The effect of high frequency electric pulses on muscle contractions and antitumor efficiency in vivo for a potential use in clinical
electrochemotherapy. Bioelectrochemistry 2005, 65, 121–128. [CrossRef] [PubMed]
- Mali, B.; Miklavcic, D.; Campana, L.G.; Cemazar, M.; Sersa, G.; Snoj, M.; Jarm, T. Tumor size and effectiveness of electrochemother- apy. Radiol.Oncol. 2013, 47, 32–41. [CrossRef] [PubMed]
- Milevoj, N.; Tratar, U.L.; Nemec, A.; Brožicˇ, A.; Žnidar, K.; Serša, G.; Cemažar, M.; Tozon, N. A combination of electrochemother- apy, geneelectrotransfer of plasmid encoding canine IL-12 and cytoreductive surgery in the treatment of canine oral malignant melanoma. Res. Vet.