| Santiago Peralta sp888@cornell.edu Cornell Üniversitesi https://orcid.org/0000-0002-4167-6272 William Katt Cheryl Balkman Scott Butler Patrick Carney Amy Todd-Donato Matthew Drozd Gerald Duhamel Nadine Fiani Jordan Ford JENNIFER GRENIER Jessica Hayward Kristiina Heikinheimo Kelly Hume Elizabeth Moore Rishi Puri Skylar Sylvester Sydney Warshaw Suzin Webb Andrew White Alexandra Wright Richard Cerione MAKALE |
| Özet Oral tümörler köpeklerde nispeten yaygındır ve köpek oral skuamöz hücreli karsinomu (COSCC) epitelyal kökenli en yaygın oral malignitedir. COSCC lokal olarak agresiftir ve hastaların %20’si tanı anında bölgesel veya uzak metastaz gösterir. Tercih edilen tedavi en tipik olarak geniş cerrahi eksizyondur. Uzun süreli remisyon mümkün olsa dahi, tedaviler ciddi morbidite yaratmakta ve işlevsellik ile yaşam kalitesini olumsuz yönde etkileyebilmektedir. OSCC’lerde RAS-RAF-MEK-MAPK sinyal ekseni belirgin şekilde upregüle edilmiştir ve daha önce RAS sinyalini hedef alan küçük moleküllü inhibitörlerin tümör büyümesini ve ilerlemesini etkin bir şekilde inhibe edebileceğini ileri sürmüştük. Bu çalışmada, insan kanserleri için Amerikan Gıda ve İlaç Dairesi (FDA) onaylı bir ilaç olan MEK inhibitörü trametinibin, mevcut hasta tümör örneklerinden oluşturulan çeşitli COSCC hücre hatlarının büyümesini belirgin şekilde engellediğini ortaya koymaktayız. Ayrıca, ilacın spontan olarak ortaya çıkan COSCC’li bazı hastalarda önemli oranda tümör regresyonu sağlayabildiğine dair klinik kanıtlar sunuyoruz. Mevcut sınırlı tedavi seçenekleri ve hasta sahiplerinin bu seçenekleri büyük ölçüde reddetmesi göz önüne alındığında, bu bulgular daha kabul edilebilir tedavi seçeneklerinin yakında veteriner kliniğine girebileceğine dair yeni bir umut vermektedir. |
Giriş Oral tümörler, köpeklerdeki tüm neoplazmların yaklaşık %6’sını oluşturmaktadır. Köpek oral skuamöz hücreli karsinomu (COSCC), epitelyal kökenli en yaygın oral maligniteyi temsil eder 1 ve özellikle epitelyal kökenli bir diğer yaygın ve lokal invaziv oral neoplazm olan köpek akantomatöz ameloblastomu (CAA) ile karşılaştırıldığında Ki67 immün boyamasına dayalı nispeten yüksek proliferasyon aktivitesi sergiler 2,3. Daha da önemlisi, COSCC ile gelen köpeklerin %20 kadarında ilk tanı anında bölgesel veya uzak metastaz vardır ve bu da tedavide zorluklara yol açmaktadır 1,4,5. Lokal olarak, primer tümör altta yatan kemik yapılar da dahil olmak üzere çoklu anatomik düzlemleri hızla istila ederek şiddetli ağrı, fonksiyon kaybı ve bazı durumlarda patolojik kırığa neden olur 6. Bölgesel veya uzak metastaz yokluğunda, COSCC için tercih edilen tedavi mandibula veya maksilladaki etkilenen bölgenin en bloc eksizyonudur (yani mandibulektomi veya maksillektomi) 1,7,8. Tam eksizyon yüksek remisyon oranı sağlar, ancak teknik olarak karmaşık ve pahalıdır ve ciddi şekil bozukluğu ve işlev bozukluğu ile sonuçlanabilir 1,7,9,10. Potansiyel cerrahi sekeller arasında oronazal fistül, kronik ptyalizm, dil protrüzyonu ve oklüzal travma yer almaktadır 1,7,11. Tersine, inkomplet eksizyon sıklıkla tümör rekürrensi ve hastalığın ilerlemesi ile sonuçlanır 1. Şaşırtıcı olmayan bir şekilde, yüksek iyileşme olasılığına rağmen, birçok hasta sahibi maliyeti, morbiditesi veya her ikisi nedeniyle cerrahi tedaviye devam etmemeyi seçmektedir. Palyatif radyoterapi ve kemoterapi kürleri bildirilmiştir, ancak bunlar genellikle tümör boyutu veya ilgili anatomik yapılar nedeniyle ameliyat edilemeyeceği düşünülen vakalar, tam olarak çıkarılmamış tümörler veya bölgesel ya da uzak metastazı olan hastalar için kullanılmaktadır 12–14. Ayrıca, radyoterapi ve kemoterapi de önemli yan etkiler ve karışık sonuçlar doğurmaktadır 15,16. Bu nedenle, yan etkileri azaltılmış gelişmiş tedavi seçeneklerine ihtiyaç duyulmaktadır. Küçük moleküllü inhibitörlere dayanan modern onkolojik hedefli müdahaleler, geleneksel tedavi seçeneklerinin yerini alma veya bunları tamamlama ve sonuçları iyileştirirken hasta morbiditesini azaltmaya yardımcı olma potansiyeline sahiptir 17,18. Epitel kökenli köpek oral tümörlerinin çoğunun RAS-RAF-MEK-MAPK (bundan sonra: RAS) yolağında önemli aktivasyon sergilediğini daha önce göstermiştik 19–21. Bu durum, RAS yolağı bileşenlerini sıklıkla hiperaktive eden insan baş ve boyun kanserleri ile benzerlik göstermektedir 22,23. RAS yolu, insan ve köpeklerdeki kanserlerin büyük bir yüzdesinde mutasyona uğradığı için onkolojide büyük ilgi görmektedir 24–27. RAS yolağı birçok kanserde itici faktör olarak kabul edilmektedir ve RAS ile sinyal eşlerinin hiperaktivasyonu yüksek ve sınırsız tümör büyümesine yol açmaktadır 28–30. Bu nedenle RAS yolağının hedeflenmesi dünya çapında önemli bir hedef olmuştur. RAS’ın kendisinin doğrudan inhibe edilmesi geleneksel olarak zor olsa da, aşağı akış efektörlerinin birçoğu çeşitli inhibitörlerle başarılı bir şekilde hedeflenmiştir. Bu hedeflerden biri, RAS ve ortağı RAF tarafından aktive edilen bir serin/treonin kinaz olan MEK’tir ve sırayla gen transkripsiyonunu ve hücre proliferasyonunu teşvik etmek için MAPK ve ERK’yi aktive eder. Trametinib, MEK’in iyi araştırılmış küçük moleküllü bir inhibitörüdür 31, insanlarda çeşitli endikasyonlarda kullanım için onaylanmıştır 32,33 ve etkinliğini daha da artırmak için çeşitli diğer inhibitörlerle kombinasyon halinde incelenmektedir 32,34–37. Ayrıca, trametinib özellikle BRAF p.V600E veya p.V600K mutasyonuna sahip insan melanomunda kullanım için onaylanmıştır 33. Benzer BRAF p.V595E mutasyonları COSCC’de, özellikle de tümörün çok hızlı çoğalma eğiliminde olan papiller histolojik alt tipinde oldukça yaygındır 21. Daha az sıklıkta olmakla birlikte, RAS ve aşağı akış sinyalini yapısal olarak aktive eden somatik HRAS p.Q61L mutasyonları da COSCC’de tanımlanmıştır 2,19,20. Trametinibin çeşitli köpek kanserlerinin tedavisinde etkili olduğu gösterilmiş olsa da 38–41, bu çalışma COSCC’deki etkinliğini gösteren ilk çalışmadır. Ayrıca, trametinib köpek histiyositik sarkomu için “endikasyon dışı” olarak kullanılmıştır 42. Birlikte ele alındığında, bu sonuçlar trametinibin köpeklerdeki neoplazmların gelecekteki tedavisinde etkili bir hedefe yönelik tedavi seçeneği olabileceğini düşündürmektedir. |
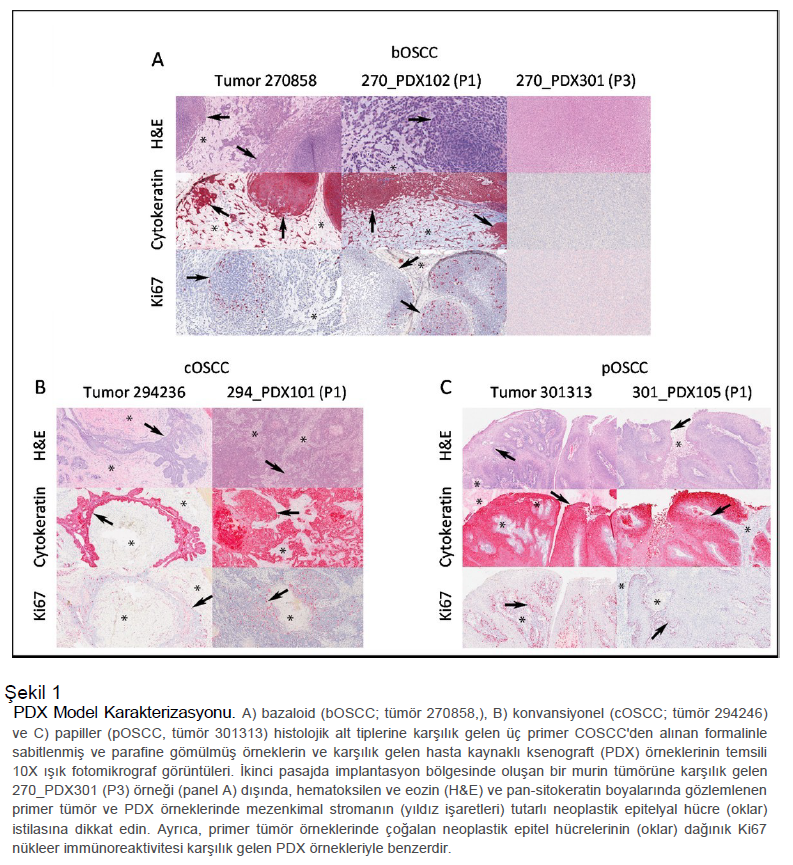
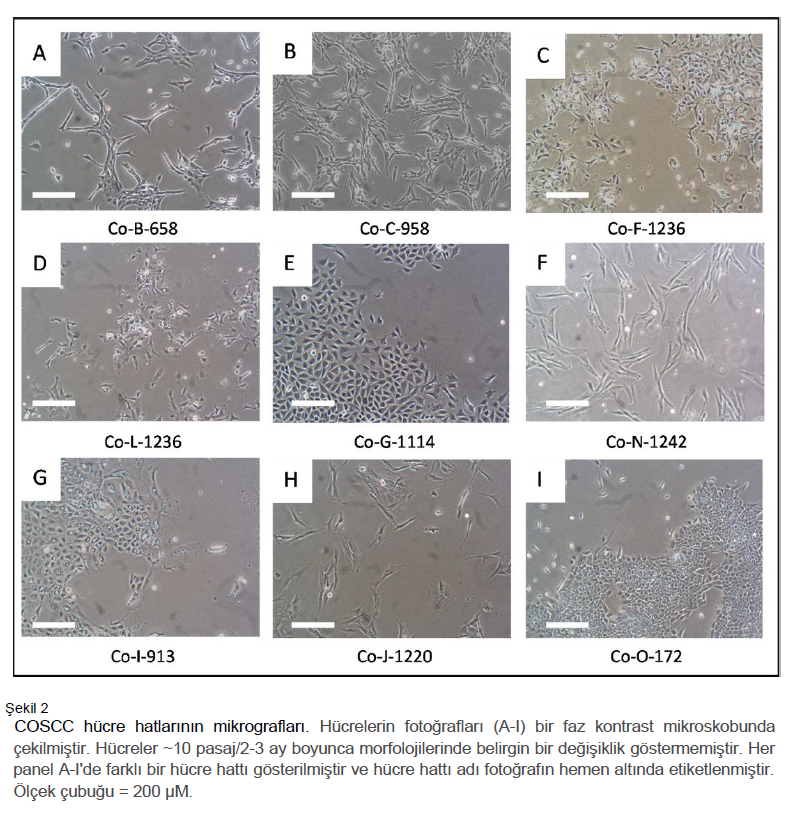
Sonuçlar COSCC model sistemlerinin gelişimi Genel hedefimiz, yeni tedavi stratejileri geliştirmemize ve bunları klinik uygulamaya dönüştürmemize olanak tanıyacak model sistemler geliştirmekti. NOD scid gamma (NSG) farelerinde hasta kaynaklı ksenograft (PDX) modelleri oluşturarak işe başladık. PDX modelleri, bir tümörün içerdiği tüm farklı hücre tiplerini içerdikleri ve aynı zamanda bir tümörün hücre dışı ortamını korudukları için bir tümörün en doğru modelleri arasında kabul edilmektedir 43–46. Spontan olarak ortaya çıkan OSCC tümörlerine sahip köpeklerden örnekler topladık (Tablo 1). Kıyılmış tümör segmentleri (ortalama çap 2-3 mm) toplandıktan sonraki 6 saat içinde NSG farelerinin sol yan tarafına implante edilmiştir. Fareler hiçbir sıkıntı belirtisi göstermemiş ve tümörler genellikle ~24-28 hafta içinde palpe edilebilir hale gelmiştir. Tümörler daha sonra ~ 36-40 haftada yeni farelere pasajlanmıştır. Her pasajda/nesilde, tümör kesitleri histolojik olarak orijinal tümörden alınan örneklerle karşılaştırılmıştır (Şekil 1). Bir ksenogreft tümörün (270858, Şekil 1A) farelerdeki ikinci pasajında fenotipinin önemli ölçüde değiştiği görülürken, diğer PDX modelleri ana tümörün özelliklerini büyük ölçüde korumuştur (Şekil 1B, 1C). Daha sonra COSCC’nin stabil 2D hücre kültürü modellerini geliştirmeye yöneldik. Tümör örnekleri ya PDX taşıyan farelerimizden (n = 5) ya da doğrudan hastalardan (n = 2, Tablo 1) alındı. PDX tümör 270858’in iki ardışık pasajı, Co-B-658 ve Co-C-958 hücre hatlarını oluşturmak için kullanılmıştır. PDX tümör 294236’nın iki ardışık pasajı Co-F-1236 ve Co-L-1236 hücre hatlarını oluşturmak için kullanılmıştır. Diğer tümör örneklerinin her birinden tek bir hücre hattı türetilmiştir. Her vakada tümör dokusu kolajenaz II ve tripsin ile sindirilmiş ve epitelyal hücreler gravimetrik olarak zenginleştirilmiştir47. Hücreler doku kültürüyle muamele edilmiş plakalara yerleştirilmiş ve plastiğe yapışan hücreler daha sonra %10 fetal sığır serumu (FBS) ile desteklenmiş RPMI 1640 ortamında kültürlenmiştir. Şekil 2, hücrelerin çeşitli farklı morfolojilere sahip olduğunu, ancak genetik olarak aynı PDX modellerinden alınan farklı koleksiyonların beklendiği gibi çok benzer göründüğünü ortaya koymaktadır. COSCC epitel kökenli bir hastalıktır ve amacımız infiltrasyon yapan fibroblastları atarken epitel hücrelerini zenginleştirmekti. Ancak, bu durumda epitelyal ve fibroblastik hücreler arasında ayrım yapmak zordur. Gen seti zenginleştirme analizi daha önce COSCC tümörlerinin epitelden mezenkime geçişi destekleyen genleri yüksek oranda eksprese ettiğini göstermiştir 19,22, bu da epitel hücrelerinin fibroblast benzeri bir morfoloji benimsemesine ve geleneksel olarak fibroblastları tanımlamak için kullanılabilecek aynı protein belirteçlerinin çoğunu eksprese etmesine neden olabilir (örn. SNAIL veya vimentin 48–51). Hücre morfolojilerimizin incelenmesi (Şekil 2) bunu doğrulamaktadır. Hücre hatları Co-G-1114, Co-I-913 ve Co-O-172 (Şekil 2E, 2G, 2I) bilinen diğer epitel hücrelerine büyük ölçüde benzeyen blok benzeri morfolojilere sahiptir. Co-L-1236 ve Co-F- 1236 (genetik olarak aynı PDX model örneklerinden, Şekil 2C, 2D) epitelyal ve fibroblastik hücre şekilleri arasında bir yerde görünen cılız, üçgen hücrelerdir ve MDA-MB-231 insan meme kanseri hücre hattı gibi bazı oldukça agresif epitelyal hücre kanserlerine benzemektedir. Co-B-658 ve Co-C-958 (genetik olarak aynı PDX model örneklerinden, Şekil 2A, 2B), Co-N-1242 (Şekil 2F) ve Co-J-1220 (Şekil 2H) ise ağırlıklı olarak fibroblastik görünen uzun, ince hücrelerdir. Bu nedenle, bu hücre kültürü modellerini tanımlamaya yardımcı olmak için morfoloji analizinden daha gelişmiş karakterizasyon teknikleri gerekmiştir. |
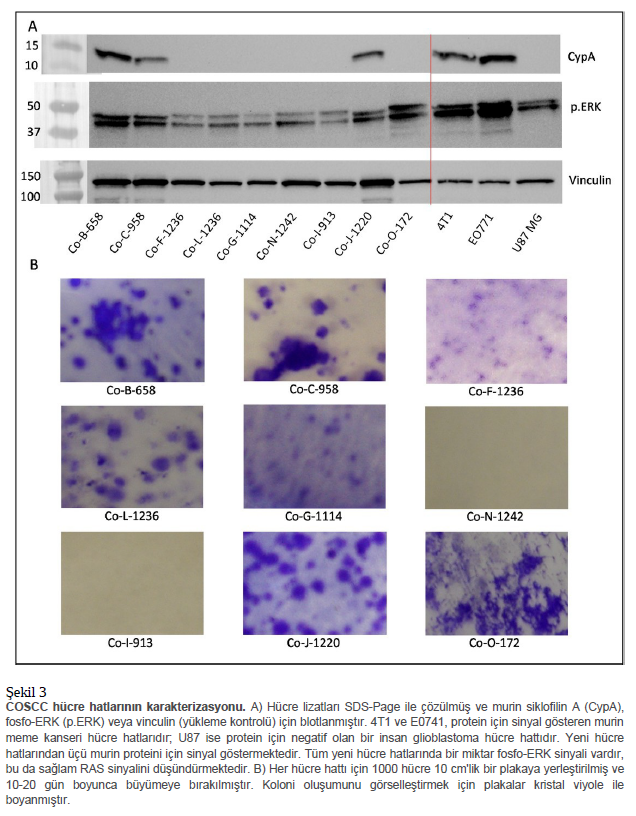
Model Sistem Karakterizasyonu Dikkatimizi her bir model sistemin karakterizasyonuna yönelttiğimizde, en büyük endişemiz her bir modelin köpek mi yoksa murin kökenli mi olduğunu belirlemekti. Her hücre hattı için, özellikle murin proteinini bağladığı bilinen bir siklofilin A (CyPA, bol miktarda ve her yerde bulunan bir sitozolik protein) antikoruna karşı Western blotları yaparak başladık. Bu antikorun daha önce farelerde insan hücrelerinin ksenograft modellerini istila eden murin hücrelerini selektif olarak boyadığı gösterilmişti 52. Köpek CyPA’sı, murin CyPA ile insan proteininden daha da düşük bir dizi özdeşliğine sahiptir (Ek Şekil S1). Şekil 3A, izole ettiğimiz hücre hatlarından üçünde (Co- B-658, Co-C-958 ve Co-J-1220) tespit edilebilir fare proteini olduğunu, diğerlerinde ise olmadığını göstermektedir. İki murin kanseri (4T1 ve EO771 meme kanseri hücreleri) ve bir insan kanseri (U87 MG glioma hücreleri) karşılaştırma için blota dahil edilmiştir. Daha önce köpek ağız kanserlerinin RAS-RAF-MEK-ERK sinyalizasyonunda geniş bir yukarı regülasyona sahip olduğunu tespit etmiştik 19–21 ve bu nedenle ERK fosforilasyonunu RAS aktivasyonunun bir belirteci olarak inceledik. Fosfo-ERK boyanması her hücre hattında farklı olsa da (Şekil 3A), tüm hücrelerde genellikle aktive RAS sinyalizasyonuna sahip olduğu düşünülen U87 hücrelerine benzer ölçüde tespit edilebilirdi 53, böylece RAS sinyalizasyonunun hücre hatlarımızda sağlam olduğunu gösterdi. Bunu takiben, hücrelerin sağlıklı veya tümörlü dokudan elde edilip edilmediği konusunu ele aldık. Her hücre hattı, bir dereceye kadar immortalite sağlamak için en az 10 hafta/15-20 pasaj boyunca kültürlendi ve birkaç hücre hattı en az 50 pasaj/6 ay boyunca kültürlendi. Sağlıklı epitel hücreleri 3-4 pasaj 54 içinde yaşlanma eğiliminde olduğundan, bu durum hücrelerimizde önemli derecede immortalizasyon olduğunu göstermiş ve tümör dokusundan türetildiklerini kuvvetle düşündürmüştür. Özellikle, Co-I-913 ve Co-N-1242 hücre hatlarını 10 haftalık süre boyunca pasajlayabilsek de, her ikisinin de kültürünün zor olduğu ve her zaman nispeten yüksek konfluensin korunmasını gerektirdiği veya hücrelerin bölünmesinin durduğu kanıtlanmıştır. Diğer hücre dizileri genellikle %70-80 konfluens 1:10’dan bölünmüş ve 3-5 gün içinde konfluensi yeniden kazanmıştır. Daha sonra, çoğu (ancak hepsi değil) kanser hücresi temas inhibisyonunu takiben bile büyümeyi sürdürebildiğinden, hücrelerin büyümenin temas inhibisyonundan kaçınma kabiliyetini inceledik. Hücreler düşük yoğunlukta yerleştirilmiş ve koloni oluşturmalarına izin verilmiştir (Şekil 3B). Hücre hatlarının çoğu bu koşullar altında yoğun koloniler oluşturarak kanser fenotipini güçlü bir şekilde desteklemiştir. Co-I-913 ve Co-N-1242 hücre hatları tespit edilebilir koloniler oluşturmamıştır, ancak çoğalmak için nispeten yüksek yoğunlukta tutulmaları gerektiğine dair önceki gözlem göz önüne alındığında bu şaşırtıcı olmamıştır. Bu noktada, hücrelerimizin türetildikleri orijinal tümörlerle ilişkili olduğunu pozitif olarak tanımlamak için basit bir mekanizma istedik ve genotip analizine yöneldik. CanineHD beadchip (Illumina Inc.) köpek genomu 55 boyunca yaklaşık 220.000 tek nükleotid polimorfizmi (SNP) içermektedir. Tümör örneklerinden, PDX örneklerinden ve hücre hattı örneklerinden DNA topladık ve DNA’yı genotipleme için gönderdik. Co- B-658, Co-C-958 ve Co-J-1220 hücre hatları yüksek SNP eksiklik seviyeleri nedeniyle başarısız olmuştur. Bu durum, bunların köpek hücreleri olmadığını ve bunun yerine immortalize fare hücreleri olduğunu kuvvetle düşündürmektedir. İlginç bir şekilde, Co-B-658 ve Co-C-958 hücre hatlarını oluşturan PDX tümörün (270858) üç farklı neslini inceledik. Tümörün ilk nesli başarılı bir şekilde genotiplendirildi, ancak ikinci ve üçüncü nesillerde (hücre hatlarının izole edildiği) de yüksek oranda SNP eksikliğine rastlandı. Bu durum, orijinal PDX tümöründen sonraki pasajlara kadar tümör morfolojisinde dramatik bir değişim olduğunu gösteren histolojik analizimizle birleştirildiğinde, ikinci pasajdan itibaren bir murin tümörünün büyüdüğü hipotezini güçlü bir şekilde desteklemektedir. Co-J-1220 hücre hattına (tümör 303520) yol açan tümör ve PDX örnekleri başarısız olmamıştır, bu da hücre izolasyonunun kendiliğinden immortalize olan murin fibroblastlarını yakalamış olabileceğini düşündürmektedir. Köpek türü olan örneklerden elde edilen genotip verilerini analiz etmeye devam ettik. Veri setini budayarak başladık – bazı verilerde eksik olan veya yüksek korelasyon gösteren SNP’leri çıkardık ve veri setinde 13.178 SNP bıraktık. Daha sonra her bir köpek tümörü, PDX modeli (tümör başına 1-3) ve hücre hattı (tümör başına 1-2) için veriler, iki örnek arasında 0, 1 veya 2 alelin paylaşılma olasılıklarını dikkate alan bir özdeşlik metriği olan ^π (pi-hat) hesaplanarak karşılaştırılmıştır56. İki örnek genetik olarak özdeş ise ^π değerleri ~ 1’dir. Tablo 2, aynı numuneden alınan çoğu tümör, PDX veya hücre hattı çiftinin 0,97’nin üzerinde ^π değerlerine sahip olduğunu göstermektedir, bu da birbirleriyle yakın özdeşliğe işaret etmektedir. Kayda değer bir istisna, türetilmiş PDX modeline kıyasla 0,82 ve türetilmiş hücre hattı Co-G-1114’e kıyasla 0,76 ^π gösteren Tümör 301814 olmuştur. PDX modeli ve hücre hattı 0,94’lük ^π değeri ile birbirleriyle daha yakından ilişkiliydi; bu da PDX modeli oluşturulurken hücre kültürü modelinden daha önemli genetik mutasyon meydana gelmiş olabileceğini göstermektedir. Bu analizin ardından, her hücre hattı için bir ‘parmak izi’ oluşturmak üzere 168 SNP seçtik (Şekil 4A, Ek Şekil S1); bu SNP’ler gelecekte pasajlama veya kontamine hücrelerin varlığından kaynaklanan genetik sürüklenmenin boyutunu belirlemek için kimlik doğrulama olarak kullanılabilir. Mevcut çalışmadaki örnekler ile daha önce genotiplendirilmiş köpekler (n = 880) arasında hesaplanan 168 parmak izi SNP’sini kullanan çift yönlü soydan gelen kimlik (IBD) ölçümleri, başka hiçbir örneğin yakından ilişkili olmadığını göstermektedir (tüm ^π değerleri < 0,25) (Ek Tablo S2) . Co-L-1236 hücre hattı iki kez genotiplenmiştir: 14. geçişte ve 42. geçişte ve bunlar 13.178 SNP kullanılarak çift yönlü ^π değeri 0,979’dur ve 168 SNP parmak izimiz kullanılarak aynı bulunmuştur. Son bir test olarak, hücre kültürü modellerimizin farelerde tümörleri yeniden oluşturup oluşturamayacağını belirlemek istedik. NSG farelerine Co-F-1236 veya Co-G-1114 hücre hatları (Matrigel içinde süspanse edilmiş 2 X 106 hücre) implante edildi ve tümörlerin büyümesine izin verildi. Her iki hat için de büyüme başlangıçta yavaştı; Co-F-1236’nın palpe edilebilir tümörler oluşturması ~ 4 ay, Co-G-1114’ün ise ~ 12 ay sürdü. Ancak, bir Co-F-1236 tümörünü PDX modeli gibi yeni farelere naklettiğimizde, konağa adapte olmuş tümörün hızla büyüdüğünü ve ~ 2-3 ay içinde ötenaziyi zorunlu kılan bir boyuta (~ 2000 mm3) ulaştığını gördük (Şekil 4B). |
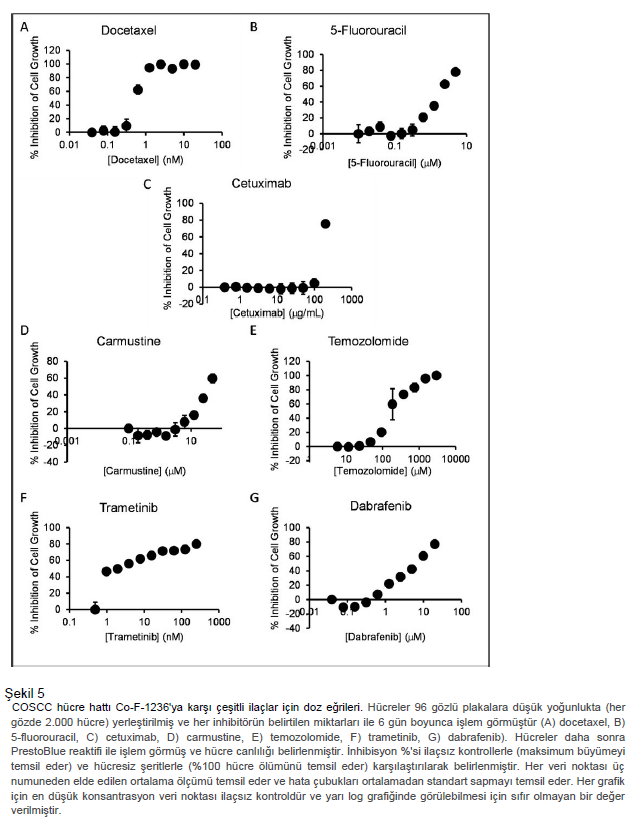
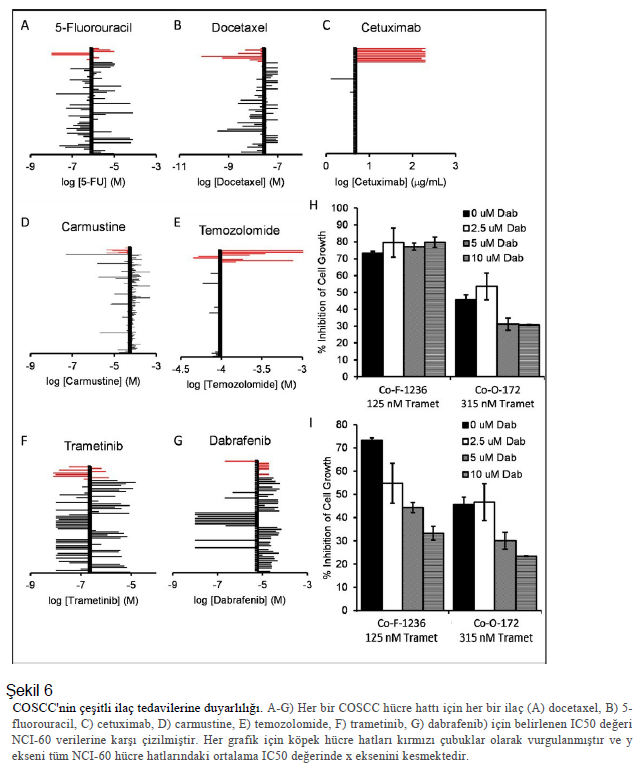
COSCC büyümesini inhibe etmek için yeni yöntemler Model sistemlerimiz elimizdeyken, dikkatimizi yeni terapötik yaklaşımları test etmeye yönelttik. COSCC için nispeten az sayıda tedavi yöntemi gösterildiğinden, işe insanlarda çeşitli kanserlere karşı etkili olan tedavi yöntemlerini test ederek başladık. İnsanlarda OSCC için mevcut kimyasal tedavi standardı üç kemoterapötiğe dayanmaktadır: docetaxel, cisplatin ve 5-fluorouracil (5-FU) 18. Sisplatinin DMSO gibi çözücü ajanlardaki kimyasal dengesizliği ve kullanımdan önce taze olarak hazırlanması gerekliliği nedeniyle kullanımı nispeten zordur ve bu nedenle docetaxel ve 5-FU üzerinde çalışarak başladık. Her bir hücre hattı düşük yoğunlukta 96 gözlü plakalara dağıtıldı ve her bir ilacın farklı konsantrasyonları ile işlem gördü. Murin hücreleri olarak tanımlanmış olmalarına rağmen, kanin olmayan kontroller olarak Co-B-658, Co-C-958 ve Co-J-1220 hücre hatları üzerinde deneyler gerçekleştirdik. Şekil 5, Co-F-1236 hücre hattı için belirlenen her bir ilacın doz eğrilerini göstermektedir ve tüm hücre hatları için IC50 verileri Ek Tablo S3’te derlenmiştir. Bu doz yanıtları, 60 insan kanser hücre hattından oluşan NCI-60’tan elde edilen her iki ilaç için ortalama IC50 ile karşılaştırılmıştır (Şekil 6). Her iki ilaç için de dozlar NCI-60 ortalamaları ile karşılaştırılabilirdi ve köpek kanseri ile murin hücreleri arasında kapsamlı bir fark yoktu. İnsan oral kanserlerinde 57-59 bazı kullanımları görülen EGF-reseptör hedefleme antikoru cetuximab’ı incelemeye devam ettik. Bu, COSCC hücre hatlarımızda NCI-60 ortalamasına kıyasla çok az etki gösterdi, ancak bunun EGF-reseptör inhibisyonuna direnç, antikorun tür spesifikliği veya sadece NCI-60 hücre hatlarının test edildiği maksimum konsantrasyonun istatistiksel ortalama etkinliği etkilemesinden kaynaklanıp kaynaklanmadığı belirsizdir. Daha sonra bazı insan kanserlerinde yaygın olarak kullanılan diğer iki kemoterapötik ajan olan karmustin ve temozolomidi inceledik. Hücre hatları genel olarak karmustine karşı hassas iken, temozolomide karşı nispeten dirençliydi. Ve yine her iki durumda da köpek ve murin hücre hatlarının duyarlılığı arasında net bir fark yoktu. İncelediğimiz kemoterapötiklerin her birinin kullanımı sınırlayıcı yan etkileri olduğu bilinmektedir. Daha hedefe yönelik ajanların COSCC büyümesini azaltmada benzer etkilere sahip olup olamayacağını merak ediyorduk. Bunun için FDA onaylı bir ilaç olan ve MEK1 ve MEK2’yi, RAS ve RAF’ın aşağı akışını ve MAPK’ın yukarı akışını inhibe eden trametinib’i seçtik. Hücreler trametinibe maruz bırakıldı (Şekil 5F) ve IC50 değerleri NCI-60’ın ortalamasıyla karşılaştırıldı. İlginç bir şekilde, hücre hatları diğer duyarlı kanser hücre hatlarına kıyasla trametinibe karşı genel olarak oldukça duyarlıydı (Şekil 6F). Özellikle, trametinib Co-I-913 hücreleri üzerinde güçlü bir etkiye sahip olan tek test edilmiş inhibitördü ve üç murin hücre hattı üzerinde en az etkiye sahipti. Trametinib, özellikle BRAF p.V600E mutant kanserlerinde, genellikle BRAF inhibitörü dabrafenib ile birlikte verilmektedir 31,32,37,60. Hücre dizilerimizin birçoğu BRAF p.V595E papiller COSCC tümörlerinden türetilmişti ve iki ilacın bu hücre dizilerinde sinerjik bir etki sağlamak üzere birleşip birleşemeyeceğini merak ediyorduk. Her hücre hattını tek başına dabrafenib ile tedavi ederek başladık ve monoterapi olarak ilaca karşı karışık bir duyarlılık bulduk (Şekil 5G, 6G), sadece bir hat (Co- O-172) NCI-60 ortalamasından önemli ölçüde daha duyarlıydı ve dört hücre hattı 20 µM dabrafenib’de %50’den az büyüme inhibisyonu ile çok düşük duyarlılığa sahipti. Daha sonra iki hücre hattını, BRAF-mutant hücre hattı Co- O-172 ve BRAF-vahşi tip hücre hattı Co-F-1236’yı aynı anda trametinib ve dabrafenib ile tedavi ettik. Kontrol DMSO ile muamele edilen hücrelerle karşılaştırıldığında, trametinib ve dabrafenib kombinasyonunun Co-F-1236’da çok hafif bir katkı etkisine sahip olduğu görülmüştür, ancak beklenmedik bir şekilde Co-O-172 hücrelerinde eksiltici bir etki göstermiştir; burada kombine ilaçlarla hücre büyümesinde tek başına trametinib’e göre daha az inhibisyon gözlenmiştir (Şekil 6H). Bununla birlikte, dabrafenib ile tedavi edilen hücreler tam büyüme kontrolleri olarak kullanıldığında ve tek başına trametinibin etkisi hesaplandığında, kombinasyonun her iki hücre hattında da antagonistik olduğu ve dabrafenib konsantrasyonu arttıkça trametinibe bağlı etkinin azaldığı ortaya çıkmıştır (Şekil 6I). |
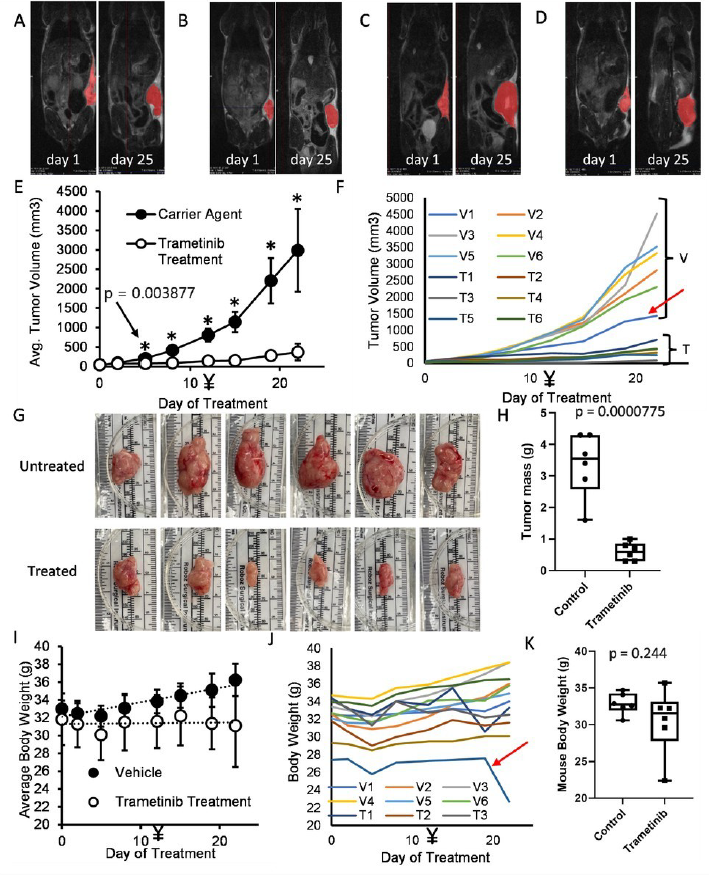
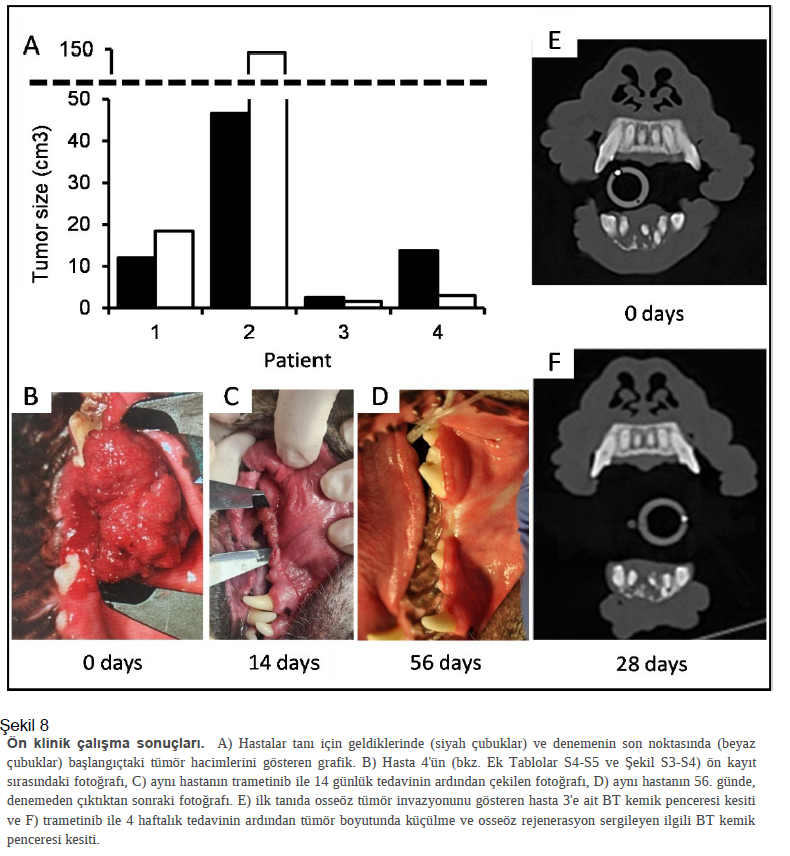
İn vivo COSCC’nin Trametinib ile tedavisi Trametinib tek bir tedavi olarak neredeyse tüm COSCC hücre kültürü modellerimiz üzerinde önemli bir etkiye sahipken, dabrafenib ile birleştirilmesi sadece minimal iyileşme ile sonuçlandı. Bu nedenle, tek başına trametinibin farelerde COSCC tümörlerinin büyüme hızını azaltıp azaltamayacağını görmek istedik. PDX-tümörlerimiz çok yavaş büyüdüğünden, agresif ve hızla büyüyen Co-F-1236 ksenograft modeli üzerinde test yapmayı seçtik. Hücreler (2 X 106) Matrigel içinde süspanse edildi ve ardından NSG farelerinin sol yan tarafına enjekte edildi. Tümörler palpe edilebilir hale geldiğinde, fareler rastgele iki gruba ayrılmıştır (grup başına N = 6). Bir kohort trametinib (oral gavaj yoluyla günde 0,5 mg/kg, 0,125 mg/mL ilaç stok konsantrasyonu, Şekil S2 ) ile tedavi edilirken, diğeri daha önce tanımlanan protokollere benzer şekilde eşdeğer hacimde tek başına araç (%10 Cremophor EL, %10 PEG400, %80 PBS) ile tedavi edilmiştir60,61 . Uygulanan ilaç miktarı 12. günde 0,75 mg/kg’a çıkarılmış ve fareler 25. günde tümör yükü nedeniyle feda edilmiştir. Tümörler haftada 3 kez kaliper ile ölçülmüştür. Temsili fareler ilaç tedavisi başlamadan önce ve feda edilmeden hemen önce MRG’ye tabi tutulmuştur. Fareler feda edilmeden önceki akşam, muhtemelen sıvı ilacın aspirasyonu nedeniyle tek bir fare ölmüştür. Ölümü ile nihai tümör ölçümü arasındaki kısa süre sebebiyle tüm verilerimize dahil edilmiştir. Tedaviden önce ve feda edilmeden hemen önce temsili fareler üzerinde gerçekleştirilen MRI görüntülemesi, trametinib tedavisinin tümör büyümesini neredeyse tamamen durdurduğunu göstermektedir (tek kesit görüntüleri Şekil 7A-7D’de gösterilmektedir). Kaliperlerle tümör uzunluğu ve genişliğinin ölçümü ve tümör hacminin tahmini (0,5 * genişlik * genişlik * uzunluk), tedavinin 5. gününde kontrol ve tedavi edilen tümörler arasında istatistiksel olarak anlamlı bir fark olduğunu ve ilaçla tedavi edilen tümörlerin bu zaman diliminde çok az büyüme gösterdiğini veya hiç büyüme göstermediğini ortaya koymuştur. Ancak, 12. günde ilaç dozunun artırılması bile tümörlerin küçülmesine neden olmamıştır (Şekil 7E). Bireysel tümör boyutları da daha yavaş büyüyen tümöre sahip tek bir araç kontrol faresi haricinde nispeten iyi kümelenmiştir (Şekil 7F, kırmızı ok). MRG ve kaliper ölçümleri tümör görünümü ve ağırlığı ile yansıtılmıştır (Şekil 7G, 7H). Fareler ilaç tedavisi nedeniyle herhangi bir sıkıntı belirtisi göstermemiş ve erken ölen bir fare dışında (Şekil 7J, kırmızı ok) vücut ağırlığında herhangi bir değişiklik görülmemiştir (Şekil 7I-7K). Genel olarak, bu sonuçlar trametinibin agresif COSCC tümörünün büyümesini, tümöre ev sahipliği yapan fareler üzerinde herhangi bir akut, olumsuz etkiye yol açmadan önemli ölçüde engelleyebildiğini göstermektedir. Trametinib fare CDX modelimizde etkinlik göstermiştir ve FDA onaylı bir ilaçtır ve halihazırda önemli güvenlik testleri yapılmıştır32. Bu nedenle, kendiliğinden oluşan oral tümörleri olan köpeklere yardımcı olup olamayacağını belirlemek istedik. Devam etmekte olan klinik çalışmamızın tam sonuçlarını henüz sunamasak da ön sonuçlarımız cesaret vericidir ve burada tam olarak sunulmaktadır. Bunun için, 1 yaşından büyük, hamile veya emzirmeyen, daha önce kemoterapi veya radyasyon görmemiş ve metastatik hastalık veya başka bir kronik hastalık belirtisi olmayan COSCC teşhisi konmuş sahipli köpekler kayıt altına alınmıştır. Uygun köpeklere günde bir kez ağızdan uygulanmak üzere 0.015 mg/kg veya 0.020 mg/kg trametinib reçete edilmiştir. Köpekler ~ 56. günde veya ~ 4. haftada tam tümör evrelemesi de dahil olmak üzere iki haftada bir yapılan tıbbi muayeneye göre hastalığın ilerlemesi durumunda çalışmadan çıkartılmıştır. Bugüne kadar dört hastayı tedavi ettik (Ek Tablo S4 ve Şekil S3), bunlardan ikisi tümörlerin önemli ölçüde küçülmesiyle ilaca dikkate değer bir yanıt verirken (Şekil 8, Ek Tablo S3 ec Şekil 4), diğer ikisinde tümör büyümesi görüldü ve çalışmadan çıkartıldı. Güçlü istatistiksel argümanlar oluşturmak ve mutasyonel profiller de dahil olmak üzere klinik ve moleküler fenotipler arasındaki farklılıkları araştırmak için daha fazla köpek çalışmaya dahil etmemiz gerekecek olsa da, COSCC’li iki hastanın iyi yanıt vermesi ve herhangi bir toksisite gözlenmemesi cesaret vericidir. |
Metodlar Kültür ortamı, FBS ve Tryp-LE Invitrogen’den alınmıştır. Kolajenaz tip II ve tripsin Worthington Biochemical Corporation’dan alınmıştır. Trametinib Cayman Chemicals’dan alınmıştır. Diğer tüm kimyasallar aksi belirtilmedikçe Fisher’dan temin edilmiştir. Tüm hayvan uygulamaları Cornell Üniversitesi Kurumsal Hayvan Bakım ve Kullanım Komitesi (IACUC), 2005 – 0151 (klinik numune toplama), 2017-0035 (deneysel fare çalışması) ve 2023-0034 (klinik çalışma) protokolleri tarafından onaylanmıştır. Tümör örneklerinin alınması Sahipleri örnek alınmasına rıza gösterdikten sonra köpekler genel anestezi altına alındı. Tanı amaçlı kullanım için 4 mm’lik bir punch cihazı ile ve Cornell Veteriner Biyobankasına (CVB) yatırılmak üzere 2 mm’lik bir punch cihazı ile iki tümör örneği toplanmıştır. Tümör daha sonra köpeğin tedavisinin bir parçası olarak cerrahi yolla çıkarıldığında, PDX modelleri oluşturmak üzere Cornell Üniversitesi Progresif Tedavi Geliştirme (PATh) merkezine teslim edilmiştir. Köpekler üzerinde gerçekleştirilen tüm müdahaleler kabul edilmiş en iyi uygulamalara ve AVMA kılavuzlarına ve Cornell Üniversitesi IACUC (protokol 2005 – 0151) onaylı prosedürlere uygun olarak gerçekleştirilmiş ve bu deneylerde kullanılmak üzere numune elde etmek için hiçbir olağanüstü adım atılmamıştır. Histoloji Tümör örnekleri formalin içine gömülmüş ve 4 µm’lik dilimler alınmıştır. Bu dilimler yüklü lamlara monte edilmiş ve ardından örnekler büyük ölçüde daha önce tarif edildiği gibi otomatik bir IHC boyayıcısı ile işlenmiştir 62. Parafin Bond dewax solüsyonu (Leica) ile çıkarılmış ve ardından örnekler 30-40 dakika boyunca Bond epitop retrieval solüsyonuna (Leica) maruz bırakılmıştır. Örnekler daha sonra anti AE1/AE3 (DakoCytomation, #M3515, sitokeratin 2’yi tespit etmek için) veya anti-MIB-1 (DakoCytomation, #M7240, Ki67’yi tespit etmek için), ardından alkalin fosfataz konjuge anti-fare IgG (Leica, #PV6110) ve RedDetection CM (Leica, #DS9390) ile inkübe edilmiştir. Örnekler dönüşümlü olarak hematoksilen ve eozin boyası ile boyanmıştır. Slaytlar bir Aperio CS2 ScanScope (Vista) ile taranmıştır. Tüm histolojik analizler, incelenen duruma tarafsız olan kurul sertifikalı patologlar tarafından gerçekleştirilmiştir. Hasta kaynaklı ksenograft gelişimi NOD.Cg-PrkdcscidIl2rgtm1Wjl/SzJ (NSG) fareleri Cornell PATh tesisi tarafından kurum içinde yetiştirilmiş ve böylece deneyler başlamadan önce tamamen alıştırılmıştır. Tümör örnekleri yukarıda açıklandığı gibi köpeklerden toplanmıştır. |
2-3 cm3’lük örnekler taşınmak üzere penisilin ve streptomisin içeren DMEM’e yerleştirilmiştir. Örnekler 2-3 saat içinde 2-3 mm3’lük parçalar halinde kıyılmıştır. Birkaç örnek kriyoprezerve edildi ve kalan örnekler eşit olarak bölünerek beş NSG faresine (dişi, 6-8 haftalık) implante edildi. Fareler %2,5 izofloran ile anestezi altına alınmış ve parçalar sol böğüre implante edilmiştir. Farelere ağrı için gerektiği kadar analjezik uygulandı ve ameliyattan sonraki iki saat boyunca dikkatle izlendi. Tümörler ~100 mm3’e ulaştığında, implantasyondan yaklaşık 36 hafta sonra, fare karbondioksit ötenazisi (3,5 L/dk) kullanılarak feda edilmiş, tümör çıkarılmış, parçalara ayrılmış ve parçalar yeni farelere (mevcut olan erkek veya dişi, en fazla 10 haftalık) implante edilmiştir. Örnekler ayrıca dondurularak saklanmış ve diğer örnekler aşağıda açıklandığı gibi hücre kültürü modelleri geliştirmek için kullanılmıştır. Hüce hattı geliştirme Hücre hatları, meme kanserleri üzerine yapılan bir çalışmadan uyarlanan prosedürle tümörlerden izole edilmiştir47. Kısaca, tümör örnekleri PDX taşıyan farelerden veya doğrudan köpeklerden toplanmıştır. Tümörler ~30 saniye boyunca %70 etanolde bekletilmiş ve ardından steril bıçaklarla kıyılmıştır. Tümörler kanı uzaklaştırmak için iki kez PBS ile yıkandı ve ardından steril konik bir tüpe aktarıldı. Tümör örneklerine 5 mL sindirim tamponu (2,5 mg/mL tripsin, 5 mg/mL albümin, PBS içinde 850 ünite/mL kolajenaz tip II) eklenmiştir. Tüp kapatılmış ve 37°C’lik bir çalkalayıcıya yerleştirilmiş ve 20 dakika boyunca 550 RPM’de çalkalanmıştır. Karışım daha sonra bir hücre süzgecinden süzülmüş ve süzgeç tarafından yakalanan tümör parçaları temiz bir tüpe aktarılmış, 5 mL taze sindirim tamponu içinde süspanse edilmiş ve 20 dakika daha çalkalanmıştır. Bu çözeltiye 10 mL yıkama ortamı (%5 FBS ve 250 ng/mL gentamisin ile desteklenmiş F12 ortamı) eklenmiştir. Tüp döndürülmüş (10 dakika boyunca 250 X g) ve 10 mL ortam (esas olarak fibroblast içermesi beklenen) çıkarılmıştır. Kalan 5 mL ortamın ve tümör parçalarının öncelikle epitel hücreleri içermesi beklenmiştir. Epitel hücreleri gravimetrik zenginleştirme yoluyla toplanmıştır. 5 mL ortam ve tümör parçaları içeren tüpe 10 mL yıkama ortamı eklenmiştir. Hücreleri askıya almak için tüp birkaç kez ters çevrilmiş ve hücrelerin 20 dakika boyunca çökmesi beklenmiştir. 10 mL ortam çıkarılmış ve hücre peletini toplamak için döndürülmüştür; bu pelet %10 FBS ile desteklenmiş RPMI-1640 içinde süspanse edilmiş ve 6 kuyucuklu bir plakanın tek bir kuyucuğuna dağıtılmıştır. Bu ‘yıkama + toplama + döndürme’ prosedürü, 13 kültür örneği oluşturmak için tümör parçalarının bulunduğu tüpte 12 kez daha tekrarlanmıştır. Tümör parçaları daha sonra RPMI 1640 + %10 FBS içinde süspanse edilmiş ve bir kuyucuklu plakaya dağıtılmıştır. Hücreler 1-2 hafta boyunca yüksek oranda konfluent tutuldu, ardından onları daha fazla seyreltme ile pasajlamaya başladık. Genel olarak, sonraki her yıkamanın daha homojen görünümlü hücrelerle sonuçlandığını, ancak yüksek yıkama kuyucuklarındaki hücrelerin bazen başarılı bir şekilde büyümek için yeterince birleşmediğini gördük. Daha ileri deneyler gerçekleştirmek için sağlam büyüme gösteren en yüksek yıkama sayısı örneğini kullandık. Klonojenik koloni oluşum deneyi: Hücreler ~%70 konfluens seviyesine kadar büyütülmüş ve ardından Tryp LE kullanılarak pasajlanmıştır. Süspansiyondaki hücreler sayılmış ve 1000 hücre 10 cm’lik bir kaba dağıtılmıştır. Hücreler 4 hafta boyunca ya da önemli koloniler kolayca görülebilir hale gelene kadar (hangisi önce gerçekleşirse) büyütülmüştür. Hücreler daha sonra üç kez PBS ile yıkandı, PBS içinde %3,7 formaldehit ile plakalara sabitlendi ve 5 dakika boyunca metanol içinde %4 kristal viyole ile boyandı. Kristal viyole çıkarılmış ve hücreler üç kez suyla (her yıkamada 5 dakika) yıkandıktan sonra son bir kez suyla yıkanmıştır (2 saat). Plakalanan koloniler daha sonra fotoğraflanmıştır. Hücre ilaç dozu çalışmaları % 70 konfluensdeki hücreler PBS ile yıkandı ve ~5 dakika Tryp-LE solüsyonuna maruz bırakıldı. Hücreler daha sonra %10 FBS ile desteklenmiş RPMI-1640 içinde süspanse edilmiş ve steril bir konik tüpe aktarılmıştır. Hücreler sayılmış, ardından 96 gözlü plakalara her gözde 1000 hücre yoğunluğunda dağıtılmıştır. Hücrelerin gece boyunca çökelmesine izin verilmiş ve ertesi gün ortam çıkarılmış ve çeşitli konsantrasyonlarda belirtilen DMSO ile çözülmüş ilaçları içeren ortamla veya kontrol olarak yalnızca DMSO ile değiştirilmiştir. Kültürün dördüncü gününde ortam tekrar değiştirilmiştir. Kültürün altıncı gününde ortam çıkarılmış, taze ortamla değiştirilmiş ve hücre canlılığı Presto Blue reaktifi (Thermo) ile belirlenmiştir. Canlılık, reaktif ile ~ 1-2 saatlik inkübasyonun ardından Tecan Spark mikroplaka okuyucuda kolorimetrik olarak belirlenmiştir. IC50 değerleri GraphPad Prism’de iki parametreli, değişken eğimli lojistik eğri kullanılarak belirlenmiştir. Western Blotlama: Hücreler ~%70 oranında büyütüldü, PBS ile 3 kez yıkandı ve ardından lizis tamponunda (20 mM HEPES pH 7.6, 150 mM NaCl, 1 mM EDTA ve %1 NP-40) lize edildi. Lizattaki protein konsantrasyonu üreticinin talimatlarına göre BioRad Protein Assay Dye ile belirlenmiştir. Laemmli tamponundaki 30 µg protein daha sonra %4-20 Tris-glisin jellerine yüklendi ve SDS-PAGE ile çözüldü. Protein PVDF membrana aktarılmış ve membran gece boyunca sütte bloke edilmiştir. Membran TBST ile durulanmış ve CypA antikoru (TBST’de 1:1000 dilüsyon, Cell Signaling #51418), fosfor-ERK antikoru (1:2000 dilüsyon, Cell Signaling #9106) veya vinculin antikoru (1:2000 dilüsyon, Cell Signaling #13901) ile bir saat boyanmıştır. Membran TBST ile 4X yıkanmış ve ardından HRP bağlantılı anti-tavşan IgG (Cell Signaling #7074, TBST’de 1:5000 dilüsyon) veya anti-fare IgG’ye (Cell Signaling #7076, 1:5000 dilüsyon) iki saat boyunca maruz bırakılmıştır. Membran TBST ile 4 kat yıkandı, Western Lighting Plus Kemilüminesans reaktifine (Perkin Elmer) maruz bırakıldı ve Bio-Rad ChemiDoc’ta görüntülendi. Bant yoğunluğu ImageJ 63 kullanılarak ölçülmüştür. Genotipleme Analizi: DNA, üreticinin talimatlarına göre Zymo DNA mikro-prep kiti kullanılarak köpek tümörü, PDX tümörü ve hücre hattı örneklerinden toplanmıştır. DNA daha sonra CanineHD 220k boncuk dizisinin EMBARK versiyonunda genotipleme için Illumina’ya gönderilmiştir. Genotip verileri üzerinde kalite kontrolü PLINK 1.9 (www.cog-genomics.org/plink/1.9/) 56’da gerçekleştirilmiştir. Eksiklik değerleri >%3 olan örnekler başarısız olarak kabul edilmiş ve çıkarılmıştır. Kalan örnekler için, herhangi bir eksikliğe sahip SNP’ler çıkarılmış ve ardından bağlantılı SNP’ler çıkarılmış ve sonuçta 13.178 bilgilendirici SNP korunmuştur. Her örnek çifti için IBD, iki örneğin 0, 1 veya 2 aleli paylaşma olasılığının bir ölçüsü olan pi-hat (^π) adı verilen bir metrik kullanılarak hesaplanmıştır. Her hücre hattı için bir ‘parmak izi’ oluşturmak amacıyla, hücre hatlarını birbirinden ayırmak için genom boyunca 168 SNP seçtik. SNP seçimi için kriterler şunları içeriyordu: kayıp olmaması, > 10Mb aralıklı olması, mevcut çalışma için örneklerde minör alel frekansının (MAF) >%30 olması ve diğer çalışmalar için aynı 220k dizisinde genotiplenen 880 köpeklik bir grupta MAF >%30 olması. Hücre hatları arasındaki genotip farklılıklarını en üst düzeye çıkarmak için daha fazla manuel seçim yapılmıştır. Bu 168 SNP için örneklerin her biri arasındaki ilişkiyi göstermek üzere R 65’te pheatmap v 1.0.12 64 paketi kullanılarak bir ısı haritası oluşturulmuştur. Parmak izi için seçilen SNP’lerin benzersizliğini belirlemek amacıyla, bu çalışmadaki tüm örnekler ve daha önce genotiplendirilmiş 880 köpek için yalnızca 168 SNP kullanılarak çift yönlü IBD hesaplanmıştır. İn vivo ilaç çalışması Trametinib araç içinde çözülmüştür (%10 Cremophor EL, %10 PEG400, %80 PBS). Co-F-1236 hücreleri (2 X 106) Matrigel içinde süspanse edilmiş ve ardından erkek NSG farelerinin (8-10 haftalık) sol yan tarafına enjekte edilmiştir. Farelerin çoğunda palpe edilebilir tümörler oluştuğunda ilaç tedavilerine başlanmıştır. Fareler rastgele ilaç tedavisi veya araç tedavisi gruplarına ayrılmıştır. Uygun tedavi hacmini belirlemek için fareler günlük olarak tartıldı. Altı fare oral gavaj yoluyla günlük olarak belirtilen miktarda trametinib ile tedavi edilirken, altı fareye eşdeğer hacimde tek başına araç uygulandı. Tümörler haftada 3 kez kumpas ile ölçülmüştür. Tümör hacmi 0,5 * uzunluk * genişlik * genişlik olarak hesaplanmıştır. Temsili fareler ilaç tedavisi başlamadan önce ve feda edilmeden hemen önce MRG’ye tabi tutulmuştur. MR görüntüleri Invicro tarafından sunulan VivoQuant Imaging Software v3.5 kullanılarak analiz edilmiştir. Deneysel son noktada, farelere karbondioksit (3,5 L/dk) ile ötenazi uygulandı, ardından tümörler toplandı, fotoğraflandı ve önemli bir kuruma meydana gelmeden hemen tartıldı. Tümör büyümesine ilişkin veriler iki kuyruklu Student’s t-testi kullanılarak istatistiksel anlamlılık açısından analiz edilmiştir. Devam eden klinik çalışma Oral mukozal yüzeyden kaynaklanan doğrulanmış COSCC tanısı olan sahipli köpekler, trametinibin yanıtını ve tolere edilebilirliğini değerlendirmek için 8 haftalık bir çalışmaya kaydedilmiştir. Uygunluk koşulları, bölgesel veya uzak metastaz kanıtı olmayan, oral tümör için daha önce tedavi görmemiş (yani cerrahi eksizyon, kemoterapi veya radyoterapi), genel anestezi almak için uygun adaylar olarak kabul edilen, diğer zayıflatıcı veya kronik sistemik hastalıkların teşhisi konmayan, hamile veya emziren olmayan ve sahiplerinin çalışma sırasında gerekli takip randevularına uyabilecekleri tamamen evrelenmiş hastaları kapsamaktadır. Kaydedilen tüm hastalar çalışma sırasında oral dozda trametinib (günde bir kez 0,015-0,02 mg/kg) almıştır. Tedaviye yanıt şu şekilde takip edilmiştir: hasta sahibi tarafından evde gözlemlenen olası yan etkileri belgelemek için haftalık telefon görüşmesi, görünür oral kitlenin kaliper ile ölçümü ve rutin kan tahlili dahil olmak üzere iki haftada bir fiziksel ve oral muayene (örn, tam kan hücresi sayımı ve serum biyokimya paneli) ve ~ 28 ve ~ 56. günlerde genel anestezi altında kontrastlı (2ml/kg Iohexol 350mg iyot/ml) bilgisayarlı tomografi (BT) kafa muayenesi (16 kesitli Aquilion LB; Canon Medical Systems USA, Inc, Tustin, CA), karın boşluğunun (BT veya ultrason) ve toraksın (BT veya 3 görünümlü radyografiler) tanı amaçlı görüntülenmesi ve bölgesel lenf düğümlerinin sitolojik veya histolojik değerlendirmesi. Kafa BT incelemeleri, dilim kalınlığı 0,5 mm ila 2,0 mm arasında değişen sürekli helikal eksenel dilimler halinde elde edilir ve volümler halinde yeniden yapılandırılır (etkili dilim kalınlığı 0,3 mm ila 1,0 mm). BT çalışmaları, kurul sertifikalı bir veteriner radyolog tarafından hastanenin Görüntü Arşivleme ve İletişim sisteminde [PACS] (Carestream VuePACS; Rochester, NY, ABD) DICOM çalışmaları şeklinde tıbbi tanı kalitesinde monitörlerde (Dell U3219Q; Dell Technologies, Round Rock, TX, ABD) incelenir. Tümör hacmi (cm3), her bir aksiyal kesitteki anormal [tümör] dokunun elle çizilmiş kesit alanının (cm2) toplamının etkin kesit kalınlığıyla çarpılmasıyla hesaplanır. Tümör hacmi her kafa BT incelemesinde (zaman noktaları: kayıt, d. 28 ve d.56) belirlenir ve her zaman noktası arasındaki değişiklikleri belgelemek için karşılaştırılır. Tüm klinik prosedürler Cornell Üniversitesi IACUC tarafından incelenen ve onaylanan bir protokole (2023- 0034) uygun olarak gerçekleştirilmiştir. Tartışma Veteriner hastalar için yeni tedavilerin belirlenmesinde karşılaşılan en büyük zorluklardan biri, hayvan kaynaklı hücre kültürü model sistemlerine erişimin göreceli olarak yetersiz olmasıdır. COSCC söz konusu olduğunda, ATCC gibi popüler veri depoları son derece sınırlıdır ve Canis familiaris’ten (evcil köpek) sadece 19 hücre kültürü modeli mevcuttur. Bunlardan sadece 1 hücre hattı kafadan türetilmiştir (trakea, CF52.Tr hücreleri) ve bu bir kanser hücre hattı değildir. Köpek hücrelerinden altısı ‘normal’, sekizi bir çeşit kanser olarak tanımlanmış ve geri kalanında bir hastalık tanımı bulunmamaktadır66. İlaç yanıtları aynı kanser türünden örneklerde bile aynı olmadığından bu özel bir sorundur ve bu nedenle ideal olarak herhangi bir ilaç tedavisinin belirli bir hastalık için uygun olup olmadığını belirlemek için çok sayıda model sistem kullanılacaktır. Bu sorunu ele almak için, farklı COSCC’leri temsil eden birkaç yeni model sistem geliştirdik. PDX modellerimiz, köken aldıkları tümörlerin fenolojisini büyük ölçüde kopyalamaktadır ve hücre hatlarımız genellikle epitelyal hücrelerin fibroblast benzeri özellikler geliştirmesine neden olan epitelyal-mezenkimal geçiş sinyallerinin yüksek ekspresyonu ile epitelyal hücrelerle eşleşen morfolojiye sahiptir. Aslında, hücrelerimiz MDA-MB-231 hücreleri 67 veya yumurtalık epitel hücreleri 68 gibi bazı agresif epitel meme kanserlerinden önemli ölçüde farklı görünmemektedir. Çeşitli ilaçların COSCC’de ne kadar iyi çalışacağını nispeten net bir şekilde anlamak için birden fazla hücre hattı geliştirdik. Hiçbir ilaç tüm hücre hatlarında aynı etkinliğe sahip olmadığı için bu yaklaşımın önemli olduğu kanıtlandı. Eşleştirilmiş iki hücre hattının (Co-B-658 ve Co-C-958 ve Co-F-1236 ve Co-L-1236) her bir üyesi arasında ilaç etkinliğinde bazı farklılıklar olduğunu da fark ettik, ancak bu IC50 değerleri diğer hücre hatlarıyla karşılaştırıldığında hala genel olarak benzerdi, bu da her iki izolasyondan hücreler arasında sadece küçük farklılıklar olduğunu düşündürmektedir. Benzersiz tümör türevli hücre hatları arasındaki farkların genellikle aynı tümörden türetilen hücre hatları arasındaki farklardan daha büyük olması, bunun gibi yaklaşımların sonunda kişiselleştirilmiş tıp için kullanılabileceğini de göstermektedir. Bu çalışmada insanlarda oral kanserler için mevcut standart bakım ajanları, diğer yaygın kemoterapötik ajanlar ve özellikle RAS yolunu hedef alan ajanlar olmak üzere üç farklı ilaç grubunu araştırdık. Cesaret verici bir şekilde, COSCC hücre hatlarımız MEK1 ve MEK2 inhibitörü olan trametinibe karşı genel olarak oldukça duyarlıydı. Dahası, COSCC hücre hatları test ettiğimiz üç fare hücre hattından daha duyarlıydı ve NCI-60’taki ortalama insan kanser hücre hattından da benzer şekilde daha duyarlıydı. Test edilen hücre hatlarının çoğu için trametinib doz eğrisinin çok geniş bir eğime sahip olduğunu ve ilacın nispeten düşük konsantrasyonlarında iyi bir etki elde edilebilirken, daha eksiksiz bir etki elde etmenin önemli ölçüde daha fazla ilaç gerektireceğini bulduk (Şekil 5F). Bu durum bizi, insanlarda genellikle trametinib ile birlikte uygulanan ve yakın zamanda oral ameloblastomlarda test edilen dabrafenib ile bir kombinasyon tedavisi denemeye yöneltti37. Ne yazık ki, COSCC hücre hatlarımızda tedavi etkinliğindeki iyileşme en iyi ihtimalle marjinaldi (Şekil 6H, 6I). Bunun, her iki inhibitörün de aynı sinyal yolunu hedeflediğini yansıtabileceğinden ve heterojen bir hücre popülasyonunun bulunduğu ve tek ilaç direncinin etkilerini artıran tüm tümörde daha sinerjik sonuçların ortaya çıkabileceğinden şüpheleniyoruz. Ancak ne mutlu ki, 3D murin tümör grefti modellerimizde tek başına trametinib yanıtı önemliydi. Ayrıca bu in vivo deneylerde fareler herhangi bir kötü etkiye maruz kalmadan dozu 0,5 mg/kg’dan 0,75 mg/kg’a yükseltebildik. Bu artırılmış dozun da tümör büyümesini azaltmada belirgin bir etkisi olmamasına rağmen, bu durum hastada herhangi bir olumsuz yan etkiye neden olmadan COSCC büyümesini engellemek için önemli bir terapötik pencerenin mevcut olabileceğini düşündürmektedir. Trametinib, çeşitli endikasyonlarda FDA onaylı bir ilaçtır ve veteriner hekimler tarafından çok az ek düzenleme yükü ile endikasyon dışı kullanılabilir. İlaç, ksenogreft tümörlerin gerçekten küçülmesine neden olmadı ve bunun yerine sadece büyümeyi engelledi. Bununla birlikte, ksenograft modelimiz PDX modellerimizden çok daha hızlı büyümüştür ve muhtemelen en hızlı büyüyen hücreler için seçilmiş bir hücre kültürü modelinden türetilmiştir, bu da tümörün tamamında daha büyük genel etkilerin gözlemlenebileceğini düşündürmektedir. Gerçekten de, ön klinik çalışma sonuçlarımız dört tümörden ikisinin sadece birkaç haftalık trametinib tedavisinden sonra küçüldüğünü ve büyük bir tümörün neredeyse tamamen yok olduğunu göstermektedir (Şekil 8B-8D). Hangi COSCC’li köpeklerin trametinib tedavisinden en fazla fayda sağlayacağını değerlendirmek için daha fazla veriye ihtiyaç duyulsa da, bugüne kadarki sonuçlardan heyecan duymaya devam ediyoruz ve çalışmamızın devam etmesinin klinikte köpek hastalara önemli fayda sağlayacağını umuyoruz. Sonuç COSCC tümörlerinden türetilen, ya doğrudan kendiliğinden gelişen tümörleri olan köpeklerden alınan ya da ilk olarak farelerde PDX modelleri olarak pasajlanan birkaç yeni hücre hattı geliştirdik. Bu hücre hatları, epitelden mezenkimal sinyali güçlü bir şekilde ifade eden kanser hücrelerinin fenotipik özelliklerini taşımaktadır. Hücreler genellikle çeşitli kemoterapötik ajanlara duyarlı olmakla birlikte, in vivo ortamda bile bazı RAS-bağımlı kanserlerde kullanılan bir MEK inhibitörü olan trametinib’e karşı güçlü bir duyarlılık göstermektedir. Ön klinik sonuçlar, inhibitörün köpek hastalar için de önemli fayda sağlayabileceği umudunu artırmaktadır. Hedefe yönelik terapötik ajanlar genellikle geleneksel kemoterapötiklerden daha az yan etkiye sahip olduğundan, bu sonuçların COSCC’ler için etkili ve iyi tolere edilen bir tedavinin uygulanmasında ilk adım olacağını umuyoruz. Beyannameler Teşekkürler Cornell Richard P. Riney Köpek Sağlığı Merkezi’nden WPK ve SP’ye, Ulusal Kanser Enstitüsü’nden (5R01CA201402-09) RAC’ye ve Maritza ve Reino Salonen Vakfı’ndan KH’ye sağlanan fonlara teşekkür ederiz. Biyolojik materyal ve ilgili veriler, NIH hibesi R24 GM082910 ve Cornell Üniversitesi Veteriner Fakültesi desteği ile oluşturulan bir kaynak olan Cornell Veteriner Biyobankası ve Cornell Hayvan Sağlığı Teşhis Merkezi tarafından sağlanmıştır. Deneysel numunelerin toplanması ve işlenmesinin yanı sıra müşteriye ait köpeklerin klinik çalışmaya kaydı, Bayan Carol E. Frederick, LVT, VTS (ECC) ve Bayan Andrea L. King, LVT liderliğindeki Cornell Üniversitesi Hayvan Hastanesi Klinik Denemeler grubu tarafından nezaketle yapılmıştır. King, LVT; Bay Michael Byron ve Bayan Lisa M. Mitchell, LVT liderliğindeki Cornell’in İnovasyon laboratuvarı; ve Bayan Kalli Anderson, LVT, Bayan Laura M. Barlow, LVT ve Bayan Kaitlin Perez, LVT dahil olmak üzere Diş Hekimliği ve Ağız Cerrahisi ve Tıbbi Onkoloji personeli tarafından desteklenmiştir. SP, hasta tümör örneklerinin orijinal olarak toplanması için tüm klinik çalışmaları yönetmiştir. CEB, ABT, NF, KRH ve SRS klinik görevlerde yardımcı olmuştur. GED tüm histolojik incelemeleri gerçekleştirmiştir. WPK hücre hatlarını izole etmiş ve hücre kültürü modelleri üzerinde testler yapmıştır. RP ve SB fare modellerindeki tüm çalışmaları yürütmüştür. SMW doku örneklerinden DNA izole etmiştir. JJH, Embark verilerini yorumlamış ve ilgili hesaplamaları yapmıştır. PCC tüm istatistiksel çalışmalara yardımcı olmuştur. JKG, KH, ESM, ACW ve RAC, çeşitli deneylerin tasarımını bilgilendiren önemli ve değerli girdiler sağlamıştır. WPK ve SP makaleyi yazmıştır. Tüm yazarlar, makalenin son taslağına gönderilmeden önce girdi sağlamıştır. Veri erişim beyanı Bu çalışma için üretilen genotip verileri ve hücre hattı parmak izi için seçilen 168 SNP, datadryad.org adresinde ikili PLINK dosyaları şeklinde kamuya açıktır (doi:10.5061/dryad.zs7h44jh9). Tablo Tablo 2 Ek Dosyalar bölümünde mevcuttur. Şekiller |
| Kaynakça 1. Fulton, A. J., Nemec, A., Murphy, B. G., Kass, P. H. & Verstraete, F. J. Risk factors associated with survival in dogs 2. Peralta, S., Grenier, J. K., McCleary-Wheeler, A. L. & Duhamel, G. E. Ki67 Labelling Index of Neoplastic Epithelial 3. Mestrinho, L. A. et al. Comparison of histological and proliferation features of canine oral squamous cell 4. Grimes, J. A. et al. Histologic evaluation of mandibular and medial retropharyngeal lymph nodes during staging 5. Mestrinho, L. A. Current status and future perspectives in canine oral squamous cell carcinoma. Vet Pathol 55, 6. Amory, J. T. et al. Computed tomographic characteristics of odontogenic neoplasms in dogs. Veterinary 7. Verstraete, F. J. Mandibulectomy and maxillectomy. Vet Clin North Am Small Anim Pract 35, 1009-1039, viii 8. Wright, A. L., Peralta, S. & Fiani, N. Case report: Spontaneous mandibular body regeneration following unilateral 9. Fiani, N. & Peralta, S. Extended Subtotal Mandibulectomy for the Treatment of Oral Tumors Invading the 10. Warshaw, S. L., Carney, P. C., Peralta, S. & Fiani, N. Piezosurgical bone-cutting technology reduces risk of maxillectomy and mandibulectomy complications in dogs. Journal of the American Veterinary Medical 11. Bar-Am, Y. & Verstraete, F. J. Elastic training for the prevention of mandibular drift following mandibulectomy in dogs: 18 cases (2005-2008). Vet Surg 39, 574-580 (2010). https://doi.org:10.1111/j.1532-950X.2010.00703.x 12. LaDue‐Miller, T., Price, G. S., Page, R. L. & Thrall, D. E. Radiotherapy of canine non‐tonsillar squamous cell 13. Evans, S. & Shofer, F. Canine oral nontonsillar squamous cell carcinoma: prognostic factors for recurrence and 14. Brooks, M. B., Matus, R. E., Leifer, C. E., Alfieri, A. A. & Patnaik, A. K. Chemotherapy versus chemotherapy plus 15. Nemec, A. et al. Osteonecrosis of the jaws in dogs in previously irradiated fields: 13 cases (1989–2014). 16. Mayer, M. N. & Anthony, J. M. Radiation therapy for oral tumors: canine acanthomatous ameloblastoma. Can Vet 17. Martin, D. et al. The head and neck cancer cell oncogenome: a platform for the development of precision 18. Devaraja, K. Current Prospects of Molecular Therapeutics in Head and Neck Squamous Cell Carcinoma. 19. Peralta, S. et al. Comparative transcriptional profiling of canine acanthomatous ameloblastoma and homology 20. Peralta, S., McCleary-Wheeler, A. L., Duhamel, G. E., Heikinheimo, K. & Grenier, J. K. Ultra-frequent HRAS p.Q61R 21. Peralta, S., Webb, S. M., Katt, W. P., Grenier, J. K. & Duhamel, G. E. Highly recurrent BRAF p.V595E mutation in 22. Guscetti, F. et al. Molecular homology between canine spontaneous oral squamous cell carcinomas and human 23. Ngan, H.-L., Law, C.-H., Choi, Y. C. Y., Chan, J. Y.-S. & Lui, V. W. Y. Precision drugging of the MAPK pathway in head 24. Barault, L., Lamba, S. & Di Nicolantonio, F. Ras Mutations in Cancer. eLS (2013). 25. Mochizuki, H. & Breen, M. Sequence analysis of RAS and RAF mutation hot spots in canine carcinoma. Vet Comp 26. Mochizuki, H., Kennedy, K., Shapiro, S. G. & Breen, M. BRAF mutations in canine cancers. PloS one 10, e0129534 27. Vogelstein, B. et al. Cancer genome landscapes. Science 339, 1546-1558 (2013). 28. Chang, W.-H. et al. KRAS-dependent cancer cells promote survival by producing exosomes enriched in Survivin. 29. Drosten, M. & Barbacid, M. Targeting the MAPK Pathway in KRAS-Driven Tumors. Cancer Cell 37, 543-550 (2020). 30. Tan, A. C. et al. Management of glioblastoma: State of the art and future directions. CA: A Cancer Journal for 31. Lugowska, I., Kosela-Paterczyk, H., Kozak, K. & Rutkowski, P. Trametinib: a MEK inhibitor for management of 32. Odogwu, L. et al. FDA Approval Summary: Dabrafenib and Trametinib for the Treatment of Metastatic Non-Small 33. Wright, C. J. M. & McCormack, P. L. Trametinib: First Global Approval. Drugs 73, 1245-1254 (2013). 34. Wang, Z. Y., He, D., Chen, C., Liu, X. B. & Ke, N. W. Vemurafenib Combined With Trametinib Significantly Benefits 35. Hanft, K. M. et al. Combinatorial effects of azacitidine and trametinib on NRAS-mutated melanoma. Pediatr 36. Alshammari, K. et al. Phase II Trial of Trametinib and Panitumumab in RAS/RAF Wild Type Metastatic Colorectal 37. Grynberg, S. et al. Neoadjuvant BRAF-targeted therapy for ameloblastoma of the mandible: an organ preservation 38. Wei, B. R. et al. Efficacy, Tolerability, and Pharmacokinetics of Combined Targeted MEK and Dual mTORC1/2 39. Cronise, K. E., Hernandez, B. G., Gustafson, D. L. & Duval, D. L. Identifying the ErbB/MAPK Signaling Cascade as a 40. Takada, M. et al. Targeting MEK in a Translational Model of Histiocytic Sarcoma. Molecular Cancer Therapeutics 41. Wei, B. R. et al. Synergistic targeted inhibition of MEK and dual PI3K/mTOR diminishes viability and inhibits 42. Tufts Cummings Veterinary Medical Center. Pilot study of a MEK inhibitor in dogs with histiocytic sarcoma, 43. Dobrolecki, L. E. et al. Patient-derived xenograft (PDX) models in basic and translational breast cancer research. 44. Hidalgo, M. et al. Patient-derived xenograft models: an emerging platform for translational cancer research. 45. Jung, J., Seol, H. S. & Chang, S. The Generation and Application of Patient-Derived Xenograft Model for Cancer 46. Karamboulas, C. et al. Patient-Derived Xenografts for Prognostication and Personalized Treatment for Head and 47. Kazerounian, S. Isolation of Mammary Epithelial Cells and Fibroblasts From Mouse Tumor. Bio-protocol 4, e1050- 48. Cheng, F. et al. Vimentin coordinates fibroblast proliferation and keratinocyte differentiation in wound healing via 49. Stanisavljevic, J. et al. Snail1-Expressing Fibroblasts in the Tumor Microenvironment Display Mechanical 50. Nishioka, R. et al. SNAIL induces epithelial-to-mesenchymal transition in a human pancreatic cancer cell line 51. Medici, D., Hay, E. D. & Olsen, B. R. Snail and Slug Promote Epithelial-Mesenchymal Transition through β-Catenin– 52. Hengstschlager, M. & Rosner, M. An antibody-based approach for the in situ evaluation of mouse contribution in 53. Blum, R., Jacob-Hirsch, J., Amariglio, N., Rechavi, G. & Kloog, Y. Ras Inhibition in Glioblastoma Down-regulates 54. Dimri, G., Band, H. & Band, V. Mammary epithelial cell transformation: insights from cell culture and mouse 55. Kawakami, T. et al. Early onset adult deafness in the Rhodesian Ridgeback dog is associated with an in-frame 56. Purcell, S. et al. PLINK: A Tool Set for Whole-Genome Association and Population-Based Linkage Analyses. The 57. Banisadr, A., Safdari, Y., Kianmehr, A. & Pourafshar, M. Production of a germline-humanized cetuximab scFv and 58. Cai, W.-Q. et al. The Latest Battles Between EGFR Monoclonal Antibodies and Resistant Tumor Cells. Frontiers in 59. Kim, H. R. et al. Mouse–human co-clinical trials demonstrate superior anti-tumour effects of buparlisib 60. Corcoran, R. B. et al. Combined BRAF and MEK Inhibition With Dabrafenib and Trametinib in BRAF V600–Mutant 61. Kobayashi, M. et al. Establishment of a BRAF V595E-mutant canine prostate cancer cell line and the antitumor 62. Malatos, J. M., Kurpios, N. A. & Duhamel, G. E. Small Intestinal Lymphatic Hypoplasia in Three Dogs with Clinical 63. Schindelin, J. et al. Fiji: an open-source platform for biological-image analysis. Nature Methods 9, 676-682 64. pheatmap: Pretty Heatmaps (R package version 1.0.12, 2019). 65. R: A language and environment for statistical computing (R Foundation for Statistical Computing, Vienna, 66. American Type Culture Collection, <https://www.atcc.org/> ( 67. Paramanantham, A. et al. Activated ERK Signaling Is One of the Major Hub Signals Related to the Acquisition of 68. Li, N. F. et al. A modified medium that significantly improves the growth of human normal ovarian surface |