Bu makaleye atıfta bulunmak için:
Bennett, P.; Williamson, P.; Taylor, R. Review of Canine Lymphoma Treated with Chemotherapy—Outcomes and Prognostic Factors. Vet. Sci. 2023, 10, 342.https://doi.org/10.3390/ vetsci10050342
Akademik Editör: Louise van der Weyden
Sunum Tarihi: 5 Nisan 2023 Revizyon Tarihi: 9 Mayıs 2023 Kabul Tarihi: 9 Mayıs 2023 Yayınlanma Tarihi: 11 Mayıs 2023
Telif Hakkı: © 2023 Yazarlar.
Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution (CC BY) lisansının hüküm ve koşulları altında dağıtılan açık erişimli bir makaledir
1
Camperdown, NSW 2006, Avustralya
Sydney Veteriner Hekimlik Yüksekokulu, Fen Bilimleri Fakültesi, Sydney Üniversitesi,
Sydney Üniversitesi Nano Enstitüsü, Sydney Üniversitesi, Camperdown, NSW 2006, Avustralya
2
* İletişim: peter.bennett@sydney.edu.au
Kısa Bilgiler: Köpek lenfoması, genellikle kemoterapi ile tedavi edilen ve beyaz kan hücrelerinde görülen yaygın bir kanserdir. Bu hastalık ve tedavisi hakkında birçok makale yayınlanmıştır, ancak kemoterapi sonrası bildirilen sonuçlar ve sonuçları etkileyen prognostik faktörler hakkında çok az kapsamlı inceleme yayınlanmıştır. Bu hastalığın potansiyel sonuçlarının bilinmesi, veteriner hekimler için köpek sahiplerinin tedaviye karar verme sürecinde yol göstermesi bakımından önemlidir. Bu incelemede, bu konuda yayınlanan makaleler değerlendirilmiş ve rapor edilen sonuçların yanı sıra genel durumu etkileyen faktörlerde de oldukça geniş çaplı varyasyonlar olduğu görülmüştür. Buna ek olarak, bazı makalelerde sağkalım oranının çok daha iyi olduğu görülse de son 40 yılda elde edilen sonuçlardaki genel iyileşme oldukça düşük seviyede kalmıştır. Çalışmalarda tek tip raporlama yapılması gerekmektedir ve bu hastalığa sahip köpeklerin genel durumunu ciddi şekilde daha iyi hale getirmek için yeni yaklaşımlara ihtiyaç duyulmaktadır.
Özet: Köpek lenfoması veteriner hekimlerin sık karşılaştığı ve önemli bir hastalıktır. Ancak buna rağmen, kemoterapi sonrası remisyon ve sağkalım süreleri ile ilişkili prognostik faktörler hakkında yapılan kapsamlı literatür incelemesi çok azdır. Bu kapsamlı inceleme, tedavi sonuçlarını ve belirlenen prognostik faktörleri ele alan mevcut veteriner literatürünü kapsamaktadır. Tedaviye alınan yanıtların süresini haftalar veya bazen aylar içinde değiştirebilecek faktörler de dahil olmak üzere, sonuçları değerlendirmek ve raporlamak için standardize edilmiş yöntemlerin eksik olduğu tespit edilmiştir. Önerilen raporlama kriterlerinin yayınlanmasından sonra, bu durum daha iyiye gitmiştir ancak hala standart şekilde uygulanmamaktadır. Değerlendirmeye dahil edilen prognostik faktörler üç ila on yedi arasında değişmektedir ve 50’den fazla çalışmada sadece tek değişkenli analiz kullanılmıştır. Bazı makaleler diğerlerine göre çok daha uzun sonuçlar bildirmiştir, ancak sonuçlar genel olarak değerlendirildiğinde, son 40 yılda çok az değişiklik görülmüştür. Bu durum, sonuçları daha iyi hale getirmek için lenfoma tedavisinde yeni yöntemlere ihtiyaç duyulduğunu göstermektedir.
Anahtar Kelimeler: köpek; kanser; lenfoma; kemoterapi; prognostik faktörler; remisyon; sağkalım
1. Giriş
Köpek lenfoması klinik tedavide sık rastlanan bir hastalıktır ve yaklaşık 20/100.000 köpekte görüldüğü tahmin edilmektedir [1]; ancak sonuçları ve prognostik faktörleri hakkında çok az eleştirel inceleme yapılmıştır. Hastalık köpeklerde çoğunlukla lenfoid olmayan bölgeleri ve kemik iliğini de içerebilen nodal, karaciğer ve dalak tutulumu ile sistemik bir hastalık şeklinde görülür. İnsanlarda, beklenen sonuçları ve tercih edilen tedavi seçeneklerini etkileyebilecek bir dizi lenfoma alt tipi rapor edilmiştir [2]. Bu alt tiplerin çoğu köpeklerde de tespit edilmiştir, ancak sonuç ve tedavi seçenekleri üzerindeki etkisi hakkında çok az bilgi bulunmaktadır [3,4]. Köpek hastalar için tedavinin temel dayanağı kemoterapidir ve kombinasyon protokolleri kullanıldığında daha iyi sonuçlar alındığı belirtilmiştir.
Veterinerlik alanında en sık kullanılan protokoller CHOP (siklofosfamid, doksorubisin (hidroksidaunorubisin), vinkristin (Oncovin) ve prednizon/prednizolon) protokolüne dayanmaktadır [5]. Bunlar, farklı ilaç farmakolojisine ve yan etki riskinin kabul edilebilir olmasına bağlı yapılan değişikliklerle birlikte insan tıbbından uyarlanmıştır. Veteriner hekimin, müşterileriyle tedavi seçeneklerini daha iyi tartışabilmesi için, prognostik değişkenlerin etkisi de dahil olmak üzere, tedavi sonrası olası sonuçlara ait kanıtlara ihtiyacı vardır.
Köpek lenfoması üzerine 1000’den fazla makale yayınlanmış olsa da, hasta ve lenfoma ile ilgili ayrıntıların yanı sıra çalışmaya dahil etme/hariç tutma kriterlerinde farklılıklar ve potansiyel prognostik faktörlerin çalışmaya dahil edilmesinde tutarsızlıklar söz konusudur. Ders kitaplarında ve derleme makalelerinde birçok özet yayınlanmıştır, ancak çok azı çalışmaların eleştirel bir incelemesini sunmaktadır [6], bunun yerine çalışma sonuçları veya prognostik kriterler, çalışmalar arasındaki metodoloji ve raporlama kriterlerindeki farklılıklar dikkate alınmadan raporlanmaktadır. 2010 yılına kadar tedaviye alınan yanıtların, sonuçların, remisyon ve sağkalım sürelerinin raporlanmasında kullanılacak tanımlar konusunda herhangi bir fikir birliği bulunmamaktaydı ve bu da sonuçların raporlanma biçiminde farklılıklara yol açmaktaydı. Veteriner Onkoloji Grubu’nun (VCOG) 2010 yılında nodal lenfoma için yanıt değerlendirme kriterlerini yayınlamasından bu yana [7], tüm çalışmalarda olmasa da tekdüzelik artmıştır.
Veterinerlik alanında yapılan çalışmalarda lenfoma türlerinin tam olarak sınıflandırılması, hastalığı immünofenotipin ötesinde sınıflandırmayan birçok yeni çalışma da dahil olmak üzere, genellikle yetersizdir. Bu durum, histolojik ve genomik sınıflandırmaların tedavi çalışmalarına dahil edilme kriteri olarak sıklıkla kullanıldığı insanlardaki lenfoma çalışmalarıyla çelişmektedir [8]. Lenfomalı insanlar rutin olarak yüksek riskli B hücreli lenfomalı anti-CD20 monoklonal antikorlarla immünoterapi ile tedavi edilmektedir [8]; benzer seçeneklerin kullanımını doğrulamak için benzer yüksek riskli köpek gruplarını açıkça tespit edebilmek gerekir. Veteriner hekimler bu yöntemlerden bazılarını benimsedikçe, uygun vakaların seçilmesinin yanı sıra daha fazla veya daha az agresif müdahalelerden en fazla fayda sağlayacak hem histolojik hem de moleküler alt tiplerin belirlenmesini sağlayacak daha iyi bilgiler elde edilecektir.
Yazarların bu derlemedeki amacı, veteriner literatürünü incelemek ve mevcut bilgilerin ne kadar değişken olduğunu belirtmek, ortaya çıkan boşlukları tespit etmek ve veteriner literatüründe lenfoma çalışmalarının raporlanmasında olabilecek en iyi uygulamalara duyulan ihtiyacı vurgulamaktır. Bu bilgiler, köpek lenfoması tedavi çalışmalarının raporlanmasındaki eksiklikleri ortaya koyacaktır.
2. Materyal ve Metod
Web of Sciences’ta (tüm veri tabanları) 2021’in sonuna kadar olan bütün yıllar için (köpek veya kanin) ve (lenfoma veya lenfosarkom) terimleri kullanılarak arama yapıldı. Elektronik ya da basılı formatta mevcut olan tüm makalelere erişildi. İngilizce dışındaki dillerdeki makalelerin çoğu inceleme yapmak için erişilebilir değildi. Makaleler, kemoterapi kullanımından sonraki sonuçlar, ek tedavilerin kullanılıp kullanılmadığı, çalışmaya dahil edilme/hariç tutulma kriterleri ve istatistiksel analizin ayrıntıları bakımından incelenmiştir. Çıkarılan veriler, vaka seçiminin prospektif mi yoksa retrospektif mi olduğunu; vakaların naif mi (önceden kemoterapi almamış), nüks mü, yoksa bunların karışımı mı olduğunu veya spesifik olarak belirtilmediğini; vakaların immünofenotipinin bilinip bilinmediğini; histolojik sınıflandırmanın dahil edilip edilmediğini; spesifik anatomik konumların dahil edilip edilmediğini; kullanılan kemoterapi protokol(ler)ini ve erken nüks/ölüm vakalarının hariç tutulup tutulmadığını kapsamaktadır. Yukarıdaki bilgiler mevcut olmadığında, bu durum kayıt altına alınmıştır.
Kemoterapi protokolleri CHOP benzeri, COP benzeri (siklofosfamid, vinkristin ve prednizon/prednizolon), MOPP benzeri (Mekloretamin, vinkristin, prokarbazin ve prednizon), diğer kombinasyonlar ve tek ajanlar şeklinde ayrılmıştır. CHOP benzeri protokol siklofosfamid veya klorambusil, bir vinka alkaloidi, bir antitümör antibiyotik (doksorubisin, mitoksantron, aktinomisin-D, epirubisin) ve L-asparaginaz ile birlikte veya tek başına genellikle prednizon/ prednizolon içeriyordu. COP benzeri protokoller siklofosfamid veya klorambusil, bir vinka alkaloidi ve L-asparajinaz eşliğinde veya olmaksızın prednizon/prednizolon içermekteydi.
MOPP benzeri protokoller mustarjenler/CCNU/bleomisin, vinkristin/vinblastin, prokarbazin ve genellikle prednizon/prednizolon içermekteydi. Diğer kombinasyonlar, yukarıdaki kriterlere uymayan iki veya daha fazla ilacın kombinasyonlarıydı. Çoğunlukla doksorubisin olmak üzere kullanılan birçok tek ajan vardı. Prednizolon/prednizon kullanımı bu protokoller arasında değişkenlik göstermiş ve standart bir doz veya süre kullanılıp kullanılmadığı net olarak belirtilmemiş, bu da grup dağılımını etkilememiştir. Bazı çalışmalar çeşitli tedavileri içermekte ve yalnızca genel sonucu rapor etmekte olup bunlar karma olarak adlandırılan bir tedavi grubuna dahil edilmiştir.
Yapılan çalışmalarda tedaviye alınan yanıt tanımlanmışsa bu tanımlar kaydedilmiştir. Tam remisyon (CR), kısmi remisyon (PR) oranları, progresyonsuz geçen süre veya remisyon süresi, sağkalım süresi ve varsa bir, iki ve üç yıllık sağkalım yüzdeleri kaydedilmiştir. Hem CR hem de PR oranı veya CR oranı %100 olduğunda, rapor edilmemişse genel yanıt oranı (ORR) hesaplanmıştır. CR veya PR gösteren köpekler için sonuçlar ayrı ayrı rapor edilmişse, bu durum dokümante edilmiştir. Farklı protokolleri karşılaştıran bazı makalelerde, sonuç verileri genele ek olarak her bir protokol için de belirtilmiştir. Protokoller benzer olduğunda, sadece süre açısından farklılık gösterdiğinde veya ilaç değişikliği olduğunda ancak daha önce verilen tanımlar dahilinde kaldığı takdirde, sonuçlarda anlamlı bir fark yoksa tek bir protokol şeklinde dahil edilmiştir. Tedavi protokolleri arasında istatistiksel olarak anlamlı bir sonuç farkı olduğunda, bu protokoller ayrı ayrı dahil edilmiştir.
Lenfomanın spesifik anatomik lokalizasyonları multisentrik veya nodal lenfomadan ayrılmıştır. Anatomik lokalizasyonun belirtilmediği çalışmalarda, vakalar karışık olarak tanımlanmış olup, çoğunluğun çok merkezli veya nodal olması muhtemeldir. Nükseden veya dirençli lenfoma bildiren çalışmalar naif vakalardan ayrı olarak değerlendirilmiştir.
Çalışmaya dahil edilen prognostik faktörler değerlendirilmiştir. Hangi faktörlerin analize dahil edildiğini belirlemek için her bir makale gözden geçirilmiş ve tek değişkenli mi yoksa çok değişkenli mi analiz yapıldığına dair ayrıntılar kaydedilmiştir. Alt evre, kayıtlarda yer aldığında veya öykü ve muayene bulgularına göre ilgili veteriner hekim tarafından belirtildiği şekilde kaydedilmiştir. Bu derlemede bildirilen bazı değişkenler birleştirilmiştir. Prednizolon ve prednizon, çalışmada önceden kullanım veya protokole dahil edilme durumu değerlendirilmişse eşdeğer kabul edilmiştir. Prognostik bir değişken olarak tedavi, kullanılan ilaçlar veya ilaçların süresi/dozajı gibi farklı protokollere dayandırılmıştır. Pıhtılaşma, pıhtılaşma parametreleri veya tromboelastografi değişiklikleri dahil edilmiştir. Nötrofiller ve monositler için hem sitofili hem de oranlar birleştirilmiştir. Genetik/moleküler belirteçler grubu genotip analizi, spesifik moleküler belirteçler ve karyotip değerlendirmeyi kapsamaktadır. Bölüm2’de istatistiksel analize dahil edilen tüm faktörler açıkça listelenmemişse, sonuçlar ve tartışma bölümleri taranarak mümkün olduğunca çok sayıda faktör belirlenmiştir.
Makalelerde kullanılan istatistiksel yöntemler çeşitlilik göstermektedir. Prognostik faktörler değerlendirilirken, yalnızca çok değişkenli analiz ile değerlendirilen çalışmalar bu makaleye dahil edilmiştir. Bir faktörün çok değişkenli analize dahil edilmesi için gereken kriterler kaydedilmiştir.Makaleye yalnızca tek değişkenli analiz dahil edildiğinde, bilgiler bu makaledeki Ek Materyallerde tablo şeklinde sunulmuştur.
Tüm sonuçlar Excel elektronik tablolarında tablolaştırılmış ve istatistiksel analiz tanımlayıcı istatistiklerle (medyan, ortalama, aralık) sınırlandırılmıştır. Bu makaledeki tartışmayı basitleştirmek için remisyon, remisyon ve progresyonsuz sağkalımın tüm varyasyonlarını belirtmek için kullanılırken, sağkalım lenfomaya özgü sağkalım da dahil olmak üzere genel sağkalımın çeşitli tanımlarını belirtmek için kullanılmıştır. Korelasyon değerlendirmeleri IBM SPSS versiyon 26’da Pearson katsayısı kullanılarak yapılmıştır.
Her bir dergi makalesi bir bildiri olarak kabul edildi; her bir bildiri içinde, ayrı ayrı değerlendirilebilen her bir vaka popülasyonu bir grup olarak nitelendirildi. Her bir gruba dahil edilen köpekler vaka olarak adlandırılmıştır.
3. Sonuç
İlk veri tabanı taramasında mükerrerler dahil 5882 makale bulunmuştur. Bunlar, köpeklerde klinik hastalığı tanımlayanlar olarak gözden geçirilmiş ve 1179 ayrı makaleye indirgenmiştir. Bu makalelerin değerlendirilmesi sonucunda, 211 grup ve toplam 10.567 vakayı içeren, lenfoma
tedavisi sonuç bilgilerinin mevcut olduğu 156 makale tespit edilmiştir. Sonuç açısından prognostik değişkenlerin rapor edildiği 112 makale tespit edilmiştir.
Aşı veya diğer immünoterapi ile tedavi yedi makalede rapor edilmiş ve sadece kemoterapi ile tedavi edilen, plasebo içeren veya içermeyen kontrol grubunun sonuçları immünoterapi içermeyen gruplarla birlikte rapor edilmiştir [9-15]. On bir makale radyoterapi, hipertermi veya kemik iliği ya da kök hücre transplantasyonu ile tedavi edilen 13 grubu içeriyordu ve bu gruplar inceleme dışında bırakıldı [16-26]. İki makale dalak lenfoması tedavisinde sadece cerrahi sonrası sonuçları bildirdiği için değerlendirme dışı bırakılmıştır [27,28].
3.1. Tedaviye Alınan Yanıt, Remisyon Süresi ve Sağkalım Özellikleri
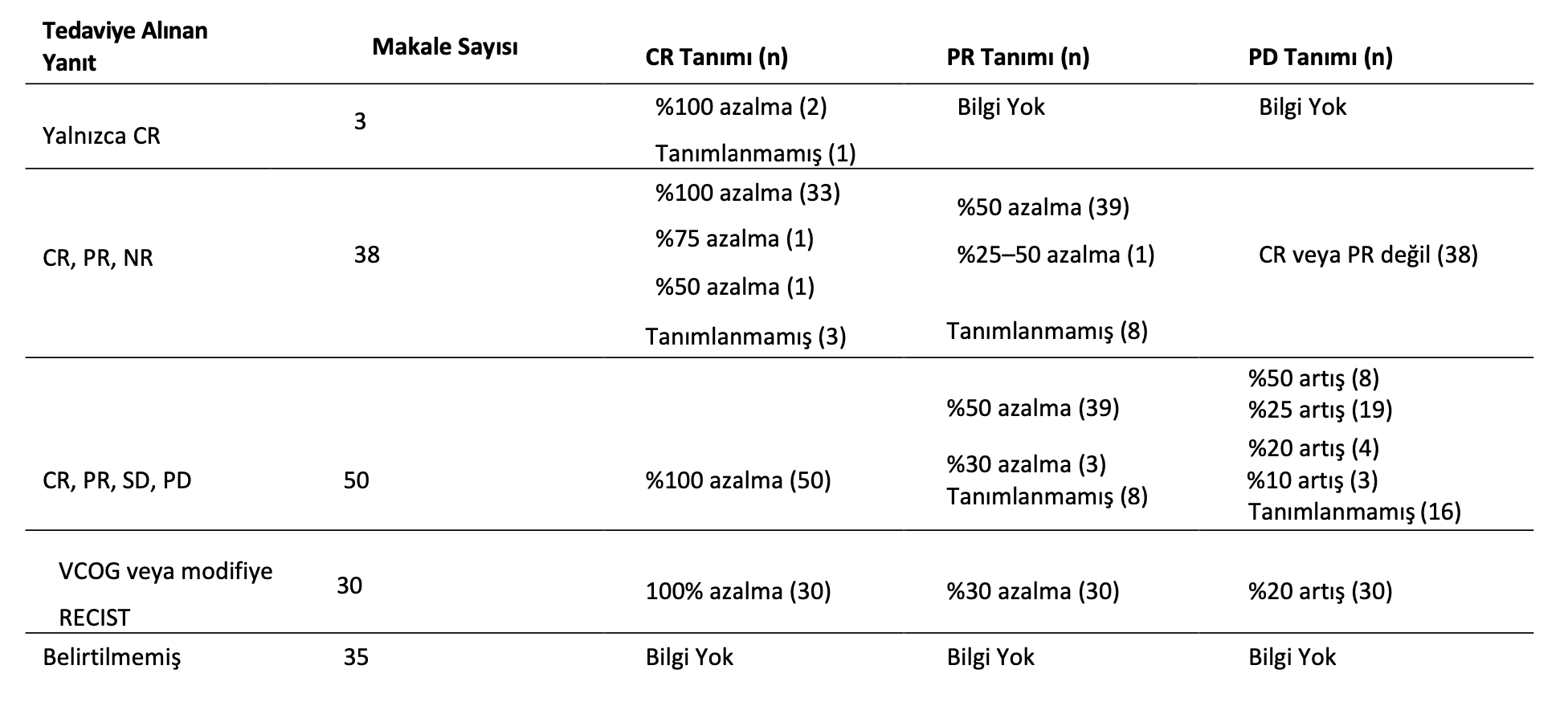
Tedaviye alınan yanıt, hepsi olmasa da çoğu makalenin 2. Bölümünde belirtilmiş ve çoğunluğunda, görüntüleme yöntemleri değişkenlik göstermekle birlikte fizik muayeneye göre tanımlanmıştır. Çoğu makalede tam remisyon (CR) görünür hastalığın tamamen yokluğu olarak tanımlanırken, iki çalışmada [29,30] >%75 ve bir diğerinde [31] >%50 azalma olarak değerlendirildiği için farklılıklar tespit edilmiştir. Kısmi remisyon (PR) çoğunlukla tümör hacminde >%50 azalma olarak tanımlanmıştır, ancak bunun nasıl belirlendiği genellikle belirtilmemiştir, stabil hastalık (SD) tümör hacminde <%50 azalma ile <%20-30 artış arasında ve progresif hastalık (PD) yeni lezyonlar veya tümör hacminde %20-30’dan fazla artış olarak tanımlanmıştır. 2010 yılından sonra, hedef lezyonların tanımlandığı ve en uzun çapın toplamının ölçü olarak kullanıldığı modifiye RECIST (solid tümörlerde yanıt değerlendirme kriterleri) ölçümlerinin kullanımında bir artış olmuştur. En sık kullanılan sistemin ayrıntıları VCOG konsensüs bildirisinde açıklanmıştır [7], ancak bazı çalışmalar çok benzer tanımlar kullanmış ama VCOG bildirisine atıfta bulunmamıştır. Tedaviye alınan yanıtı tanımlayan ifadelerin özeti Tablo1’de yer almaktadır..
Tablo 1. Makalelerde kullanılan ve tedaviye alınan yanıt kriterleri için yapılan tanımlar.
CR = tam remisyon, PR = kısmi remisyon, SD = stabil hastalık, PD = progresif hastalık, NR = tedaviye yanıt yok, VCOG = veteriner onkoloji grubu, RECIST = solid tümörlerde yanıt değerlendirme kriterleri.
Köpeklerin değerlendirilme zamanı ve bu kapsamda sınıflandırılmaları için gereken minimum yanıt süresi makaleler arasında farklılık göstermiştir. Birçok makalede, yanıtın ne zamanlaması ne de süresi belirtilmiştir ve en güçlü yanıt kaydedilmiş ve kullanılmıştır veya bir tedavi döngüsünden sonra protokoldeki belirli günde alınan yanıt (22. gün) [32] kullanılmıştır [33]. Yanıtın 7 ila 28 gün arasında sürmesi gerekiyordu (bir makalede yedi gün [34], üç makalede 14 gün [35-37], 19 makalede 21 gün [5,33,38-54] ve dört makalede 28 gün [12,55-57]). Belirtilen yanıtı doğrulamak için tek tip evrelemenin yapıldığı çok az sayıda makale vardı.
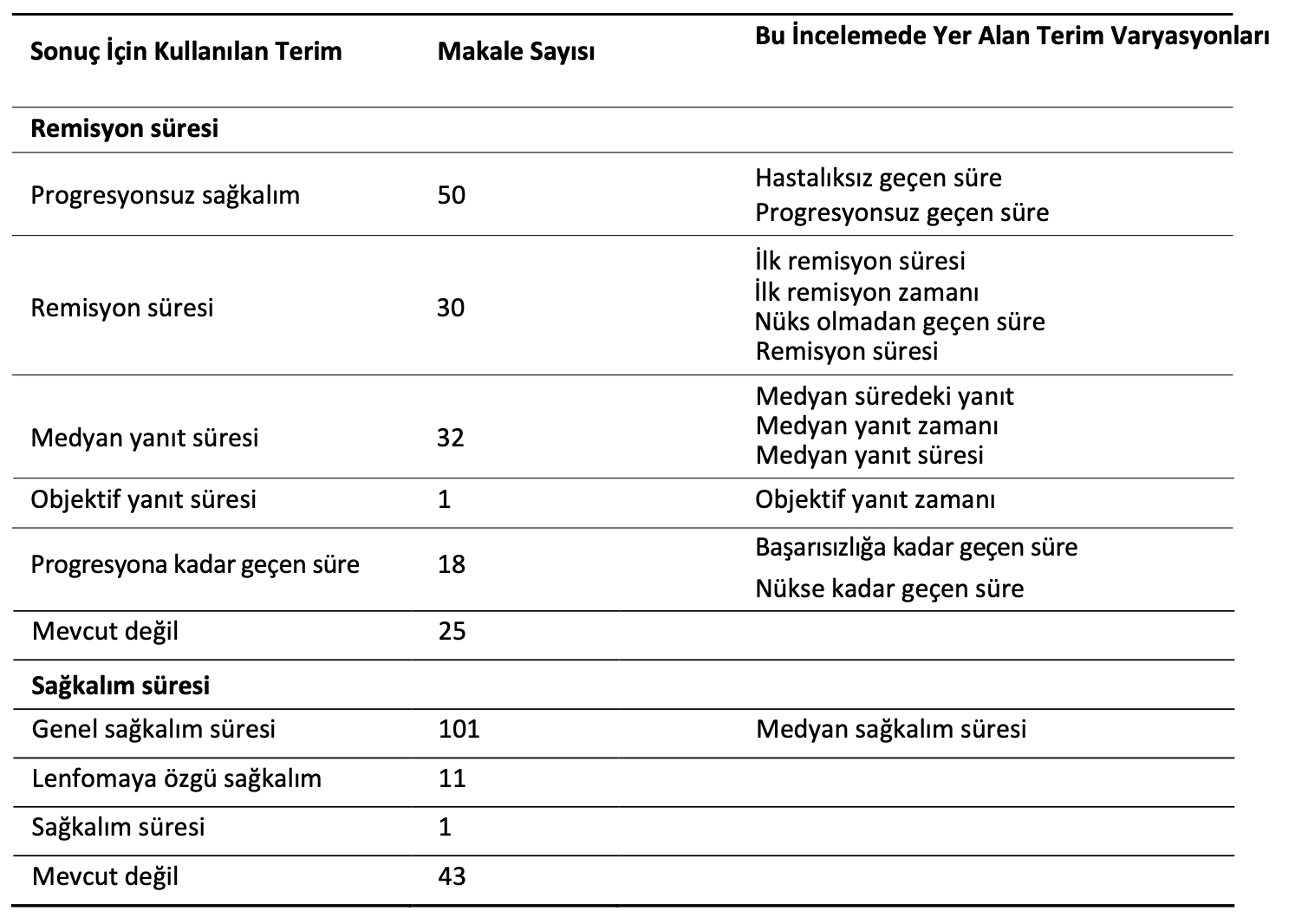
Remisyon süresinin başlangıç noktası konusunda literatürde tutarsızlık söz konusudur. Bu, tanı tarihi, tedavinin başladığı tarih, en güçlü yanıtın elde edildiği tarih, indüksiyonun sonu, ilk kürün sonu, kemoterapi protokolünün sonu gibi değişkenlik göstermiş veya açıkça belirtilmemiştir. Buna ek olarak, ilk remisyon süresini tanımlamak için standart terminoloji kullanılmamış ve benzer ölçümler için birden fazla terim kullanılmıştır. Terimlerin listesi ve bunları kullanan çalışmaların sayısı Tablo2’de yer almaktadır. Hayatta olan veya takibi bırakılan hayvanların sansürlenip sansürlenmediği makalelerde tutarlı bir şekilde belirtilmemiştir.
Tablo 2. Makalelerde kullanılan remisyon ve sağkalım terimleri. VCOG [5] tarafından tercih edilen terimler progresyonsuz sağkalım ve lenfomaya özgü sağkalımdır.
Nüks ve progresyon tutarlı bir şekilde tanımlanmamıştır. Birçok makalede belirli bir tanım yapılmamış, diğerleri ise ilerleyen hastalığın tanımını nüks anlamına gelecek şekilde kullanmıştır. Çok az sayıda makalede bir hastanın nüks etmiş sayılması için teşhis anındaki nodal boyuta geri dönülmesi ve/veya yeni nodal genişleme görülmesi şart koşulmuştur.
Sağkalım süresi tanımları değişkendi ve birçoğu başlangıç tarihini belirtmiyordu. Tanımlandığında ise tanı tarihi, kemoterapiye başlama tarihi ve en güçlü remisyon tarihi arasında değişiklik göstermiştir. Çoğunluk tüm ölüm nedenlerini içerirken, lenfomaya özgü sağkalım daha az sayıda kullanılmıştır. Çoğu makale hem remisyon hem de sağkalım süresi bildirmiştir (88 makale); 43’ü sadece remisyon süresi ve 25’i sadece sağkalım süresi bildirmiştir.
3.2. Kemoterapi Tedavisinin Sonuçları
Kemoterapi tedavisinin sonuçları 197 grup ve 10.301 vaka içeren 173 makalede rapor edilmiştir. Bunlardan 151 grup ve 9191 vakayı içeren 136 makale kombine protokolü, geri kalanı ise tek ajan protokolünü içeriyordu. Sadece prednizon veya prednizolon ile tedavi edilen iki makalede iki grup vardı [58,59]. Kemoterapi sonuçlarını bildiren makalelerin 81 grup içeren 65’inde hastaların prospektif olarak alındığı, 110 grup içeren 91’inde retrospektif olduğu ve altı grup içeren dört makalede [36,59-61] bu durumun açıkça belirtilmediği görülmüştür.
Dört makale hem prospektif hem de retrospektif grupları içeriyordu [22,62-64]. Hem epitelyotropik hem de epitelyotropik olmayan kutanöz lenfoma için sonuçlar dokuz gruplu altı makalede rapor edilmiştir [34,42,65-68]. Kemoterapi ile tedavi edilen gastrointestinal sistem lenfoması olan dört gruplu dört makale vardı [41,54,69,70] ve kemoterapi ile tedavi edilen nazal lenfoma hakkında bir makaleden bir grup rapor edilmişti [18].
Kemoterapi kullanımından önceki tedaviye ilişkin hariç tutma kriterlerinde değişkenlik söz konusuydu. Sadece daha önce kemoterapi almamış hastalar, 5269 vakayı içeren 107 gruplu 85 makaleye dahil edilmiştir [5,9,10,12,15,18,30,36,38,43,49,54-57,60,62,63,69,71-136]; 27 grup ve 1116 vakayı içeren 25 makale sadece nükseden lenfomayı içermektedir [33,37,39,44- 48,50,53,115,137-150], 10 grupta 292 vakayı içeren sekiz makale naif ve nükseden vakaların karışımını içeriyordu [67,122,151-156], ve 53 grup ve 3461 vakayı içeren geri kalan 39 makale[11,13,14,22,29,31,32,34,35,40,42,51,52,58,59,61,65,66,68,70,157-173] önceki tedavinin hariç tutulup tutulmadığını özellikle belirtmemiştir; bu da dahil edilen vakaların naif veya ağırlıklı olarak naif olduğunu düşündürmektedir.
Anatomik lokasyonun hariç tutma kriteri olarak belirlenmesi literatürde farklılık göstermiştir. Kemik iliği [30,102], kutanöz [116,118,126,168], gastrointestinal [40,126] veya merkezi sinir sistemi [168] tutulumu olan vakaları özellikle hariç tutan makaleler varken, diğerlerinde bunlar hariç tutma kriteri olarak özellikle belirtilmemiştir. İki makalede [102,132] V. evre hastalık hariç tutulmuş, üç makalede [113,117,170] sadece V. evre dahil edilmiş, 11 makalede [13,15,30,63,77,102,114,126,152,163] I. ve II. evre hariç tutulmuştur. Hiperkalsemisi olan vakalar iki makalede hariç tutulmuştur [111,167]. Bazı makalelerde, yalnızca remisyon elde eden hastalar, bazen tam remisyonla sınırlı olmak üzere, sonuç analizine dahil edilmiştir [9,22,43,81,114].
3.3. Multisentrik/Nodal Lenfomada Remisyon Süreleri, Sağkalım Süreleri ve Yanıt Oranları
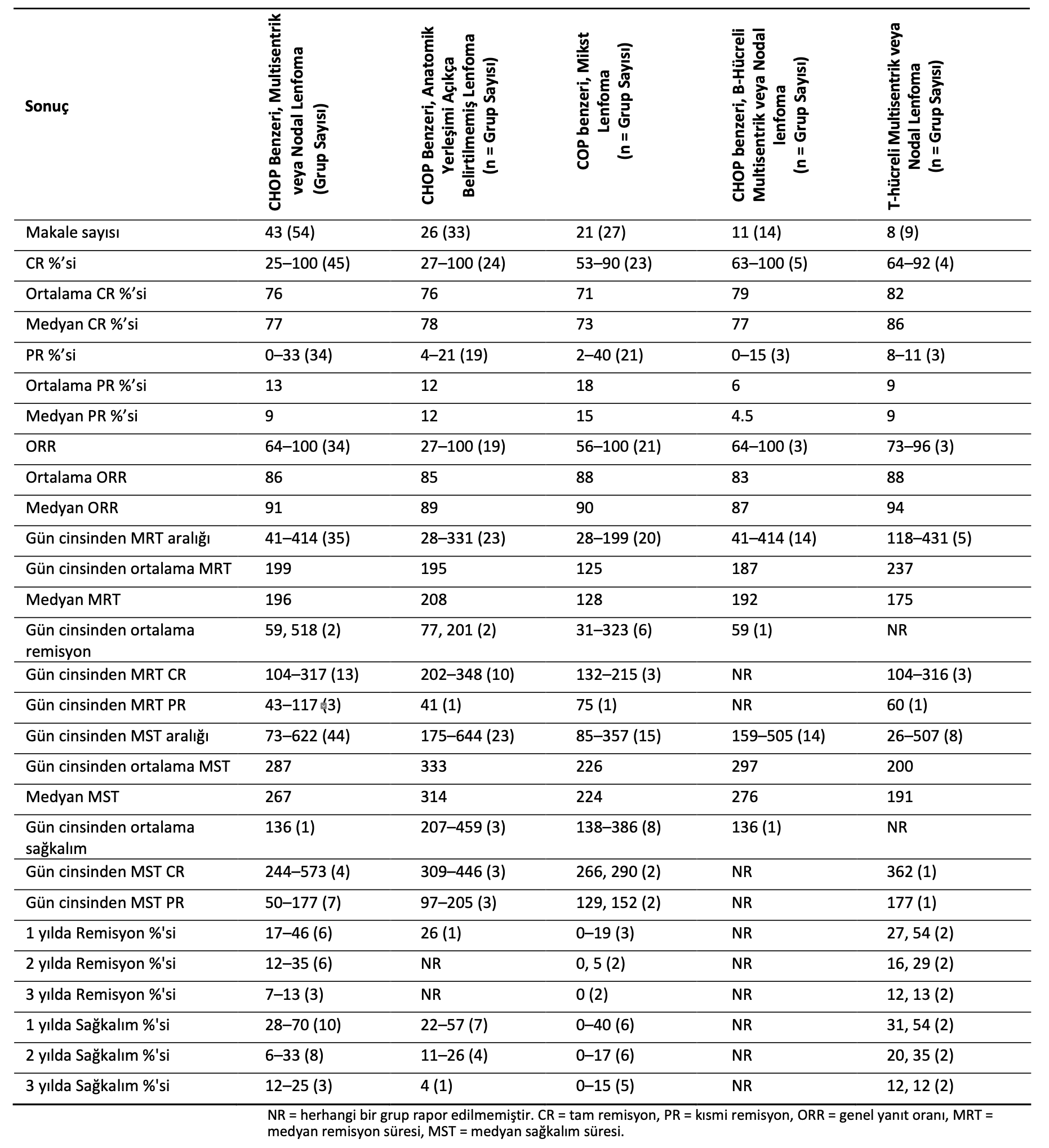
CHOP benzeri protokolle tedavi edilen multisentrik veya jeneralize nodal lenfoma sonuçları 54 grup ve 4382 vakayı içeren 43 makalede bildirilmiştir [5,12,13,15,22,38,40,43,55,56, 58,64,76,83,85,88,90,92,95,97-100,102,107,110-113,118,120,123,124,126,132,134,136,166,168,169, 172,174,175]. Dokuz makale yalnızca B hücreli lenfomalı köpekleri [12,13,15,55,56,76,88, 102,124], üçü yalnızca T hücreli lenfomayı [100,123,126] ve geri kalanı her iki immünofenotipin karışımını içermekteydi. Grup büyüklükleri 7 ila 775 vaka arasında değişmektedir. Vakalar, 39 grup ve 2493 vaka içeren 33 makalede naif olarak tanımlanmış, geri kalanında ise bu durum metod kısmında açıkça belirtilmemiştir. Altı makalede sadece remisyon [38,43,64,123,136,172], beş makalede sadece sağkalım [58,85,97,98,111] ve geri kalanında her ikisi de rapor edilmiştir. Bildirilen sonuçlar Tablo3’te verilmiştir.
Lenfomanın yeri veya dağılımının açıkça belirtilmediği CHOP benzeri protokolle tedavi edilen 33 grup ve 1606 vakayı [11,32,35, 36,52,57,62,78,82,84,86,87,95,96,101,104- 106,119,128,129,133,136,151,161,171] içeren 26 makale daha vardı. İki makale yalnızca B hücreli lenfomayı [84,161] içermekteyken, geri kalanı ya immünotipi belirtmemiş ya da bunların bir karışımını dahil etmiştir. Grup büyüklükleri 8 ila 134 vaka arasında değişmektedir. Bu makalelerdeki vakaların çoğunun multisentrik veya nodal olması mümkündür. Bir makale yalnızca sağkalım süresini [78], dördü yalnızca remisyon süresini [32,86,133,136] ve biri yalnızca remisyon oranlarını [82], geri kalanı ise hem remisyon hem de sağkalım sürelerini bildirmiştir. Sonuçlar Tablo 3’te listelenmiştir.
COP benzeri bir protokolle tedavi edilen hastaları içeren 27 gruplu 21 makale vardı [5,9,10,14,29,59,60,75,80,81,93,109,114,148,157,158,163-165,167]. Lenfomanın dağılımı makalelerin yaklaşık yarısında multisentrik olarak belirtilmiş, geri kalanında ise açıkça belirtilmemiştir. Grup büyüklükleri 7 ila 147 vaka arasında değişmektedir. Bir çalışma sadece B hücreli lenfomalı köpekleri içerirken [10], geri kalanlar her iki immünofenotipin karışımını içeriyordu. Dört makalede [86,148,158,165] sadece remisyon, bir makalede [93] sadece sağkalım ve geri kalanında her ikisi de rapor edilmiştir. Sonuçlar Tablo3’te listelenmiştir.
On bir çalışma, CHOP benzeri protokolle tedavi edilen multisentrik veya nodal B hücreli lenfomalı 14 grup ve 481 vakayı içermektedir [12,13,15,55,56,76,84,88,102,124,161]. Grup büyüklükleri yedi ile 104 arasında değişmektedir. Tüm çalışmalar remisyon ve sağkalım sürelerini bildirmiştir. Sonuçlar Tablo3’te listelenmiştir.
Tablo 3. CHOP benzeri kemoterapi ile tedavi edilen multisentrik veya nodal lenfomalı köpekler için bildirilen sonuçlar.
Kemoterapi ile tedavi edilen T-hücreli multisentrik veya nodal lenfoma, 9 grup ve 476 olgu içeren 8 makalede rapor edilmiştir. Bunlardan 3 gruplu 3 makale CHOP benzeri protokolle tedavi edilen 107 vakayı içermektedir [100,123,126]. 2 gruplu ve 102 vakalı iki makalede MOPP tipi bir protokol kullanılmış [79,100] ve geri kalanında farklı protokoller kullanılmıştır [91,159,176]. Grup büyüklükleri 13 ila 127 arasında değişmektedir.
Yedi gruplu makalelerin yedisi remisyon bildirmiş, sekiz gruplu yedi makale ise sağkalım süresi belirtmiştir. Sonuçlar Tablo3’te listelenmiştir.
Tek ajan kemoterapi, 39 grup ve 1230 generalize lenfomalı köpek vakasını içeren 35 makalede rapor edilmiştir. Bunlardan 16 grup ve 466 vakadan oluşan 13 makale naif lenfoma tedavisini tanımlarken [30,49,63,74,77,103,108,115,121,125,127,131,177], 13 grup ve 455 vakadan oluşan 13 makale nüks eden lenfoma vakalarını tanımlamış [39,44,46,53,115,138,139,141,143–145,147,149], 4 makaleden 4 grup ve 135 vaka naif ve nüks eden lenfoma vakalarının karışımını içeriyordu [152,155,177,178], geri kalanı ise önceki tedaviyi hariç tutma kriteri olarak açıkça belirtmiyordu [35,59,61,157,162,163]. Doksorubisin en çok kullanılan ajan olmuş ve 16 makaleden 19 grupta kullanılmıştır [30,35,49,61,63,74,77,103,108,122,125, 139,157,162,163,178]. Mitoksantron üç makaleden dört grupta [115,144,177], CCNU üç makaleden üç grupta [39,46,127], aktinomisin-D iki makaleden iki grupta [53,138], siklofosfamid iki makaleden iki grupta [59,131], etoposid iki makaleden iki grupta [152,155] ve bleomisin [149], karboplatin [141], DTIC [44], L-asparaginaz [121], melfalan [145], rabakfosadin [147] ve vinblastin [143] tekli gruplarda kullanılmıştır. Kullanılan ilaçların çeşitliliği ve naif ve nükseden lenfoma vakalarında kullanım kombinasyonu göz önüne alındığında, özet veriler yalnızca doksorubisin için sunulmuştur.
Doksorubisin ile tedavi edilen köpekler için tam remisyon oranı 14 grup için bildirilmiştir ve oranlar medyan %65,5 ve ortalama %61 olmak üzere %22 ila %82 arasında değişmektedir. Sekiz grupta bildirilen kısmi remisyon oranları %0 ila %56 arasında değişmekte olup, medyan %12,5 veortalama %17’dir. Genel yanıt oranı %33 ile %94 arasında değişmekte olup medyan %79,5 ve ortalama %73’tür. Medyan remisyon süresi 15 grup için 14 ila 246 gün arasında değişmekte olup medyan 147 ve ortalama 140 gün olarak bildirilmiştir. Dört grupta bildirilen ortalama remisyon süresi 156 ila 203 gün arasında değişmekte olup, medyan 180 ve ortalama 180 gündür. Medyan sağkalım süreleri 13 grup için 100 ila 423 gün arasında değişmekte olup medyan 230 ve ortalama 237 gündür. Ortalama sağkalım süreleri beş grup için bildirilmiştir ve 198 ila 351 gün arasında değişmektedir. Bir makaledeki bir grupta nükseden lenfoma vakaları vardı [139]; geri kalanlar ya naifti ya da önceki tedavi açıkça belirtilmemişti.
Kemoterapi tedavisi sonuçlarının bildirildiği 27 grup ve 1116 nüks generalize lenfoma vakası içeren 25 makale bulunmaktadır [33,37,39,44-48,50,53,115,137-150.] Bunlar kombinasyon ve tek ajan tedavileri dahil olmak üzere çeşitli yöntemlerle tedavi edilmiştir. Bir çalışma B hücreli lenfoma ile sınırlı kalmıştı [147], bir tanesi sadece ikinci nüks vakaları içeriyordu [143] ve geri kalanlar immünofenotiplerin ve tedavilerin bir karışımıydı. Tam remisyon oranı 25 grup için belirtilmiştir ve medyan %27 ve ortalama %27 olmak üzere %0 ile %65 arasında değişmektedir. Kısmi remisyon oranı 23 grup için bildirilmiş olup medyan %20 ve ortalama %19 olmak üzere %0 ila %39 arasında değişmektedir. Genel yanıt oranının mevcut olduğu 23 grup için bu oran %0 ile %77 arasında değişmekte olup medyan %43 ve ortalama %44’tür.
3.4. Kemoterapi ile Tedavi Edilen Diğer Lenfoma Türlerinde Remisyon Süresi, Sağkalım Süresi ve Yanıt Oranları
On bir makale ne multisentrik ne de nodal olarak tanımlanan ve kemoterapi ile tedavi edilen lenfoma hakkında rapor vermiştir; bunların altısı kutanöz lenfoma [34,42,65-68,179], ağırlıklı olarak kutanöz epitelyotropik T-hücreli lenfoma (CETL), dördü gastrointestinal lenfoma [41,54,69,70], biri hepatik [89] ve biri nazal [18] için sonuç bildirmiştir.
Kutanöz lenfoma hakkında rapor veren altı makalede, ikisi CCNU, biri masitinib, biri deneysel bir ilaç olan VDC-1101, biri ek alkilleyici ajanlar veya CCNU ile CHOP benzeri bir protokole dayanan VELCAP-EL kombinasyonu ve biri de tedavi protokolllerinin bir karışımını kullanmıştır. Tüm makalelerde remisyon oranları bildirilmiştir. CR oranı %0 ile %64 arasında değişmekte olup medyan %17 ve ortalama %22’dir. PR oranı %50 medyan ve %51 ortalama ile %27 ile %100 arasında değişmektedir. ORR, medyan %78 ve ortalama %73 olmak üzere %44 ile %100 arasında değişmiştir.
Beş makalede bildirilen MRT’ler 38 ila 106 gün arasında değişmekte olup medyan 85 ve ortalama 72 gündür. Sağkalım süreleri, bunun rapor edildiği iki makalede 130 ila 281 arasında değişmekte olup medyan 207 ve ortalama 205 gündür.
Gastrointestinal lenfoma ile ilgili dört çalışmadan biri kolorektal hastalıkla sınırlı kalırken, biri intestinal ve son ikisi de ağırlıklı olarak gastrointestinal tutuluma sahipti. Birinde tedavi VELCAP-SC idi, birinde tek ajan L-asparaginaz kullanılmıştı ve diğer ikisi birkaç farklı protokol içeriyordu. İki çalışmada remisyon oranları bildirilmiştir; bir çalışmada CR oranı %50 ve PR oranı %6 iken diğerinde CR oranı %47 ve PR oranı %9’dur. MRT 50 ila 1318 gün arasında ve MST 77 ila 1845 gün arasında değişmektedir. En uzun remisyon ve sağkalım sonuçları kolorektal lenfoma çalışmalarında elde edilmiştir (sırasıyla 1318 gün ve 1845 gün); bu makaleyi hariç tutarsak, remisyon ve sağkalım aralığı sırasıyla 50 ila 86 gün ve 77 ila 147 gün olmuştur.
3.5. Zaman İçinde Remisyon ve Sağkalım Sürelerindeki Değişimler
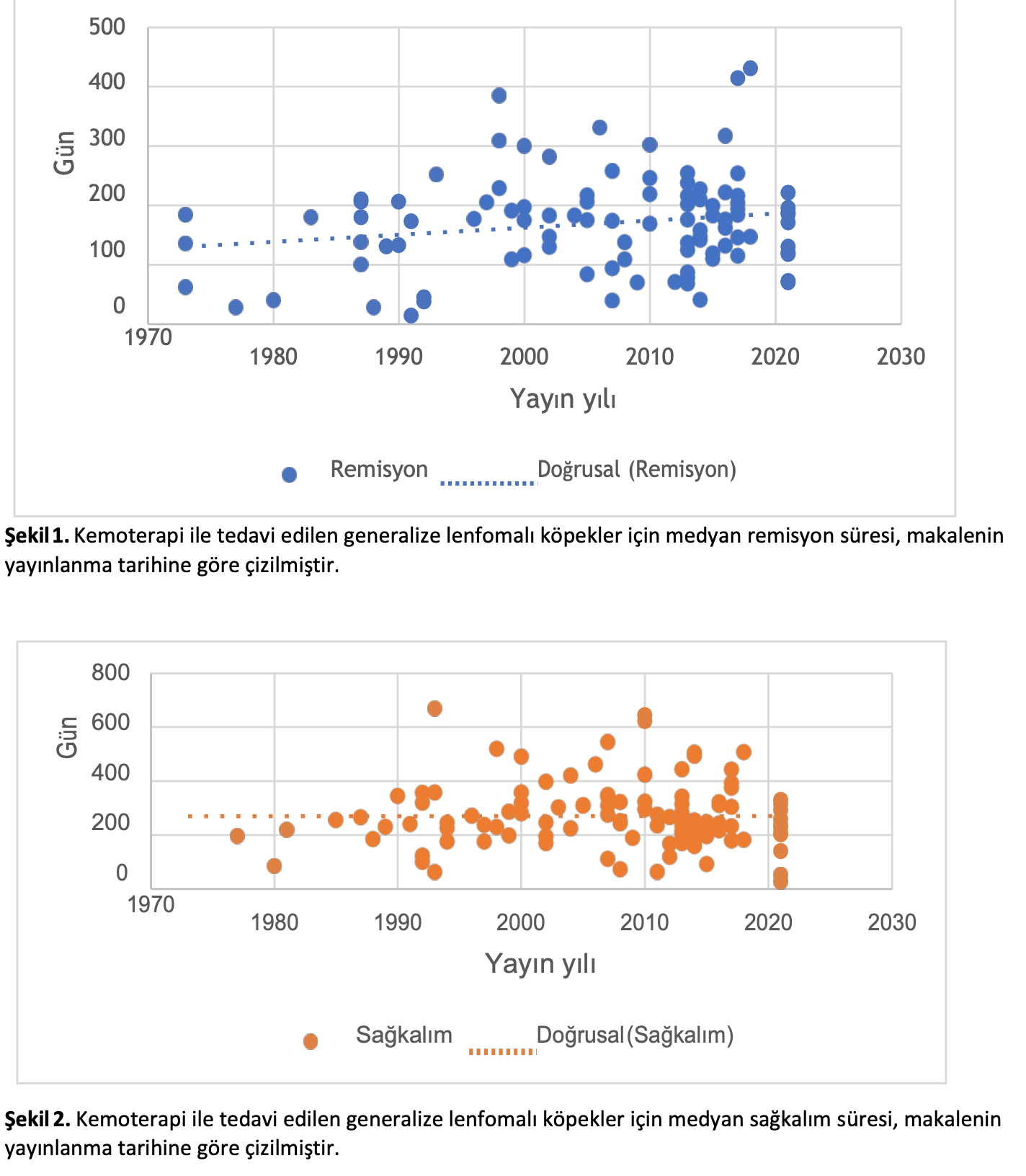
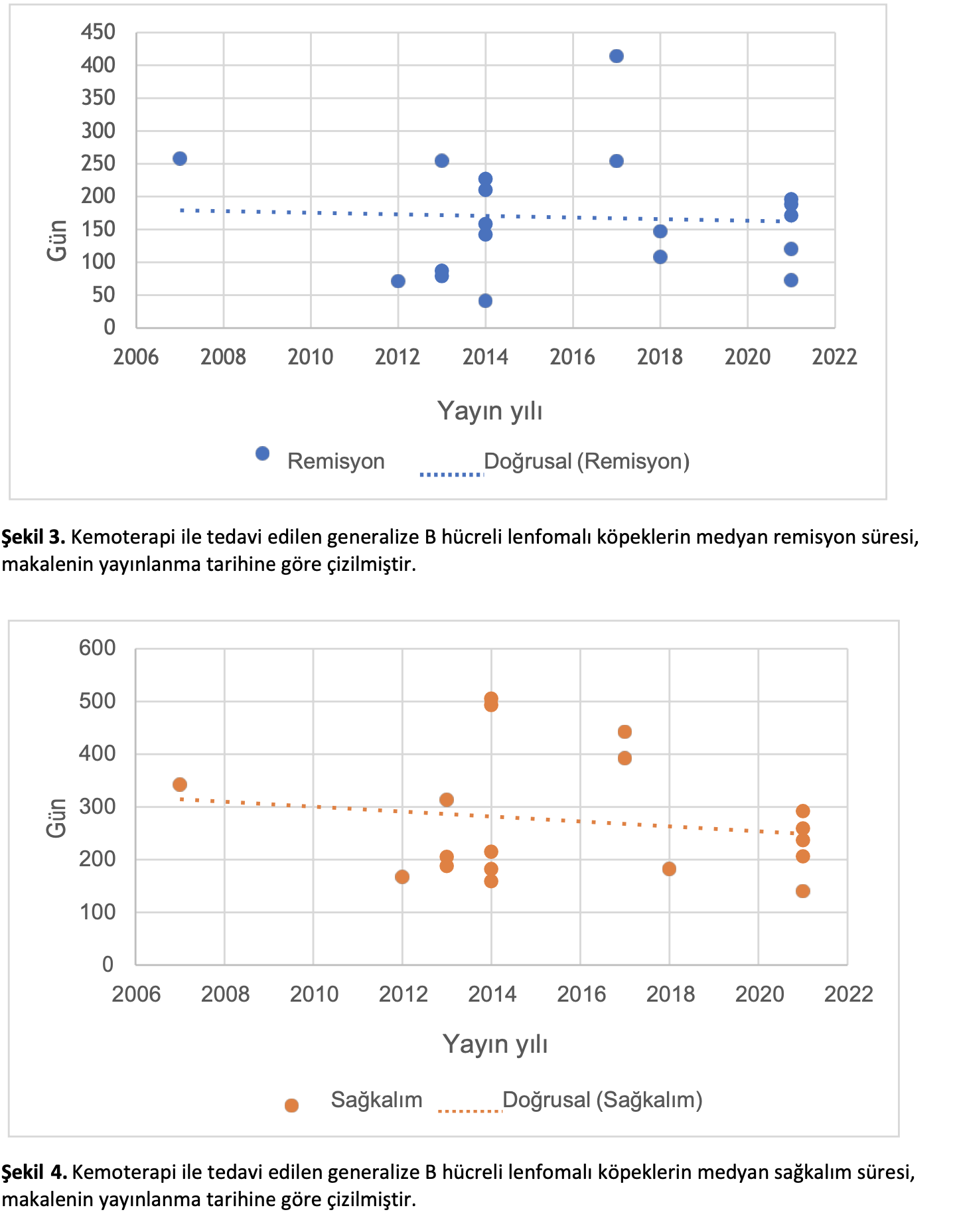
İnceleme için kullanılabilir makaleler 1973’ten 2021’e kadar yaklaşık elli yılı kapsadığından, yazarlar bildirilen remisyon ve sağkalım sürelerindeki zaman içindeki değişime bakmışlardır. Generalize lenfoma, lenfomanın en sık görülen prezentasyonunu temsil ettiği için seçilmiştir. T- hücreli lenfoma gruplarının sayısı az olduğu için B-hücreli lenfoma için de benzer bir değerlendirme yapılmıştır. Sonuçlar Şekil 1-4’te grafiksel olarak gösterilmiştir.
Generalize lenfoma için 99 makaleden medyan ilk remisyon süresi ve 109 makaleden medyan genel sağkalım verisi elde edilmiştir. B hücreli lenfoma ile sınırlandırıldığında, 19 makale için medyan ilk remisyon süresi ve 18 makale için medyan genel sağkalım mevcuttu. Eğilim çizgileri, zaman içinde medyan ilk remisyon süresinde hafif bir artış (r = 0.183, p = 0.070) ve tüm genel lenfoma türleri dahil edildiğinde sabit medyan genel sağkalım süresi (r = 0.002, p = 0.982) göstermektedir. Sonuçlar B hücreli lenfoma sonuçlarını bildiren makalelerle sınırlandırıldığında, hem medyan ilk remisyon süresi (r = -0.053, p = 0.829) hem de medyan genel sağkalım (r = – 0.161, p = 0.523) zaman içinde hafif bir azalma eğilimi göstermiştir. Her iki veri seti için de remisyon ve sağkalım arasında istatistiksel olarak anlamlı bir korelasyon vardı (generalize lenfoma için 0.809, p < 0.001; B-hücresi için 0.788, p < 0.001).
3.6. Prognostik Faktörler
Remisyon süreleri, sağkalım süreleri veya her ikisi için prognostik faktörler 8933 vakayı içeren 112 makalede değerlendirilmiştir. Her makale bir ila 13 faktörün etkisini rapor etmiştir. Hem remisyon hem de sağkalım faktörlerini değerlendiren 73 makale, sadece remisyon süresini değerlendiren 16 makale ve sadece sağkalım süresini değerlendiren 22 makale vardı. Bir makalede iki yıldan daha uzun süreli sağkalımla ilişkili faktörler rapor edilmiştir. İstatistiksel analiz 52 makalede tek değişkenli, 60 makalede ise çok değişkenli olarak yapılmıştır. Makalelerde yer alan vaka sayısı 11 ile 775 arasında değişmekte olup ortalama 80 +/-8,7 ve medyan 58’dir.
Çok değişkenli analiz sonuçlarının mevcut olduğu 60 makale vardı ve bunlar 5975 vakayı içeriyordu. Bu makalelerden dördü lenfomanın belirli bölgeleri [28,65,89,180] ya da bir makalede ilerlemiş indolent lenfoma [181] hakkında rapor vermiştir; bunlar farklı prognostik faktörlere sahip olabileceğinden tartışmanın dışında bırakılmıştır.
Generalize lenfoma için çok değişkenli analize dayalı prognostik faktörleri rapor eden 55 makale, 5706 vaka dahil olmak üzere 1981-2021 yılları arasında yayınlanmıştır. Her birine dahil edilen vaka sayısı 18 ila 775 arasında değişmekte olup, medyan 73 ve ortalama 103,75 +/ – 16,32’dir. Analize dahil edilen faktör sayısı 3 ila 17 arasında değişmekte olup, medyan 8 ve ortalama 8,49 +/- 0,36’dır. En az bir makalede yer alan faktörlerin her biri için, dahil edildikleri makale sayısı bir ile 47 arasında değişmekte olup, medyan altı ve ortalama 12,29 +/-2,28’dir. Remisyon ve sağkalım 40 makalede, sadece remisyon yedi makalede, sadece sağkalım yedi makalede ve 2 yıllık sağkalım bir makalede değerlendirilmiştir [182]. Beş makalede [55,72,102,183,184] yalnızca B hücreli lenfoma ve dört makalede [79,91,100,116] yalnızca T hücreli lenfoma vakaları dahil edilmiştir.
Ondan daha az olmak üzere makalelerde yer alan değişkenlere ilişkin bilgiler Ek Materyallerde sunulmuştur (Tablo S1). Moleküler, genetik, sitokimyasal veya benzer faktörleri içeren 14 makale [72,77,91,97,98,124,185-192] vardı. Değişkenler en fazla iki makalede değerlendirildiğinden, sonuçlar Ek Materyallerde mevcuttur (Tablo S2). Tedavi 18 makalede prognostik bir değişken olarak değerlendirilmiştir. Protokol varyasyonları ve ilaç değişimleri de dahil olmak üzere değişiklikler çeşitlilik gösterdiğinden grup olarak analiz edilememiştir. Analiz edilen tedavi parametrelerinin tablosu Ek Materyallerde yer almaktadır (Tablo S3). Yalnızca tek değişkenli analiz bildiren makalelerden elde edilen bulgular Ek Materyallere dahil edilmiştir (Tablo S4).
Değişkenleri çok değişkenli analize dahil etmek için kullanılan kriterlerde tutarsızlık olduğu veya bazı makalelerin materyal ve yöntemlerinde bunun eksik olduğu görülmüştür. Tanımlandığında, bazı makaleler tek değişkenli analizde p < 0,05 düzeyinde istatistiksel olarak anlamlı olan değişkenleri dahil ederken, diğerleri tek değişkenli analizde p değeri <0,25 olan değişkenleri dahil etmiştir.
3.6.1. Hastalara Dair Bilgiler
Yaş, 3615 olguyu içeren 40 makalede prognostik bir değişken olarak değerlendirilmiştir. Yaş bazı makalelerde sürekli bir değişken olarak veya yaş aralıkları şeklinde dahil edilmiştir. Hem remisyon hem de sağkalım 28 makalede, sadece remisyon beş makalede, sadece sağkalım altı makalede ve iki yıldan fazla sağkalım bir makalede sonuç ölçütü olarak değerlendirilmiştir. Yaşın bir makalede hem remisyon hem de sağkalım süreleri için prognostik olduğu, üç makalede remisyon, altı makalede sağkalım olduğu ve 30 makalede prognostik olmadığı görülmüştür. Sadece değerlendirildiği makaleler dahil edildiğinde, yaş, makalelerin %12,1’inde remisyon için ve %20’sinde sağkalım için prognostiktir.
Hastanın ağırlığı 3978 vakayı içeren 38 makalede prognostik değişken olarak yer almıştır. Hem remisyon hem de sağkalım 27 makalede, remisyon beş makalede, sağkalım beş makalede ve 2 yıllık sağkalım bir makalede değerlendirilmiştir. Kilo, beş makalede her iki sonuç için, ikisinde remisyon ve ikisinde sağkalım için prognostiktir ve vücut ağırlığı yerine vücut kondisyon skoruna bakan bir makale de dahil olmak üzere 30 makalede prognostik değildir. Ağırlığın değişken olarak dahil edildiği makalelerin %18,8’inde remisyon için, %24,2’sinde ise sağkalım için prognostiktir.
Hastanın cinsiyeti 43 makalede 4283 vaka için değişken olarak değerlendirilmiştir. Bunların 32’sinde remisyon ve sağkalım, beşinde remisyon, beşinde sağkalım ve birinde 2 yıllık sağkalım değerlendirilmiştir. Cinsiyet, iki makalede hem remisyon hem de sağkalım için prognostik, dört makalede sağkalım için prognostik olarak tanımlanmış ve geri kalan 37 makalede sonuç ölçümleriyle önemli bir bağı bulunmamıştır. Bu, cinsiyetin dahil edildiği makalelerin %5,4’ünde remisyon ve %15,8’inde sağkalım için prognostik olduğu anlamına gelmektedir.
Kısırlık durumu, 681 vaka ile 10 makalede prognostik bir değişken olarak değerlendirilmiştir. Sekiz makale hem remisyon hem de sağkalımı değerlendirirken, kalan iki makale sadece sağkalımı değerlendirmiştir. Makalelerin hiçbirinde kısırlaştırmanın değerlendirilen sonuçlar için prognostik olduğu belirtilmemiştir.
Irk, 1194 vaka içeren 17 makalede değerlendirilmiştir. Boxer gibi belirli ırklara ilişkin değerlendirmeler karışık şekilde yer alırken, diğerleri safkan ve melez köpekleri karşılaştırmıştır. Hem remisyon hem de sağkalım 13 makalede, sadece remisyon iki makalede ve sağkalım iki makalede değerlendirilmiştir. Irk, bir makalede remisyon ve bir makalede sağkalım için prognostiktir; bu da değişken olarak dahil edildiği makalelerin %6,7’sine tekabül etmektedir.
Alt evre, 4524 vakayı içeren 44 makaleye değişken olarak dahil edilmiştir. Hem remisyon hem de sağkalım üzerindeki etkilerin değerlendirilmesi 32 makalede, sadece remisyon yedi makalede ve sadece sağkalım beş makalede yer almıştır. Alt evre sekiz makalede her ikisi de sonuç için, yedisinde remisyon için ve beşinde sağkalım için prognostik bulunmuştur. Bunun değerlendirildiği makalelerin %38,5’inde remisyon için, %35,1’inde ise sağkalım için prognostik olduğu saptanmıştır.
Kemoterapi öncesinde prednizon/prednizolona maruz kalma 2538 vakayı içeren 17 makalede değerlendirilmiştir. Bu durum 12 makalede her ikisinin sonucunu, dört makalede remisyonu ve bir makalede sağkalımı etkilediği şeklinde değerlendirilmiştir. Önceki prednizon/prednizolon maruziyeti dahil edildiği makalelerin sırasıyla %12,5’inde ve %15,4’ünde olmak üzere iki makalede remisyon ve iki makalede sağkalım için prognostiktir.
3.6.2. Lenfoma Özellikleri
Sadece klinik evre, anatomik yerleşim ve immünofenotip ondan fazla makaleye dahil edilmiştir. Diğer ilgili parametreler: grade, histolojik sınıflandırma, hücre boyutu ve mitotik sayı Ek Materyaldeki Tablolar S1-S4’te yer almaktadır.
Klinik evre, 5030 vakayı içeren 47 makalede yer alan değişkenler arasındaydı. Değerlendirmede makaleler arasında tutarsızlık vardı; bazıları V. evreyi diğer evrelerle karşılaştırıyor, bazıları diğerlerine kıyasla daha düşük evrelere (I +/-II) bakıyor ve bazı makaleler belirli evreleri içeriyordu. Değerlendirme 34 makalede hem remisyon hem de sağkalım, yedisinde sadece remisyon ve altısında sadece sağkalım için yapılmıştır. Her ikisinin sonuçları üzerinde istatistiksel olarak anlamlı bir etkisi olup olmadığı üç makalede remisyon, sekiz makalede ise sağkalım açısından incelenmiştir. Klinik evre, makalelerin %14,6’sında remisyon için ve dahil edilen makalelerin %27,5’inde sağkalım için prognostiktir.
Anatomik yerleşim 1139 olguyu içeren 13 makalede prognostik bir değişken olarak değerlendirilmiştir. Tutulumun bildirildiği en yaygın anatomik lokalizasyonlar anterior mediasten veya kemik iliğiydi. Sekiz makalede hem remisyon hem de sağkalım, üç makalede sadece remisyon, iki makalede ise sağkalım değerlendirilmiştir. Üç makalede her ikisinin sonucu için, birinde ise sağkalım için prognostik bulunmuştur. Bu, remisyon için dahil edildiğinde makalelerin %27,3’ünü ve sağkalım için %40’ını temsil etmektedir.
Lenfomanın immünofenotipinin prognostik etkileri 3926 vaka ile 28 makalede yer almıştır. Hem remisyon hem de sağkalım sonuçları 21 makalede, sadece remisyon dört makalede ve sağkalım dört makalede değerlendirilmiştir. İmmünofenotip yedi makalede her iki sonuç için, altı makalede remisyon ve üç makalede sağkalım için prognostikti. Bu sonuçları içeren makalelerin %52’sinde remisyon ve %41,7’sinde sağkalım için prognostikti.
3.6.3. Laboratuvar Bulguları
Anemi, hiperkalsemi ve trombositopeni 10’dan fazla makalede değerlendirilen tek parametrelerdi. Kalan parametreler Ek Materyaller’de yer almaktadır.
Anemi, 1874 vakayı içeren 22 makalede değişken olarak yer almıştır. Anemi çoğunlukla var veya yok şeklinde kategorik veri olarak rapor edilmiştir. Anemi 14 makalede hem remisyon hem de sağkalım için, üç makalede sadece remisyon için ve beş makalede sağkalım için prognostik bir değişken olarak değerlendirilmiştir. Anemi iki makalede remisyon ve altı makalede sağkalım için prognostik değişken olarak değerlendirilmiş ve değerlendirilen makalelerin sırasıyla %11,8 ve %31,6’sını oluşturmuştur.
Hiperkalsemi olup olmadığı 2838 vaka ile 28 makalede değerlendirilmiştir. Hem remisyon hem de sağkalım üzerindeki etkiler 22 makalede, sadece remisyon dört makalede ve sağkalım iki makalede yer almıştır. Üç makalede her ikisinin sonucu için, bir makalede remisyon için ve iki makalede sağkalım için önemli ölçüde prognostik olduğu bulunmuştur. Bu, dahil edilen makalelerin %11,8’inde remisyon ve %31,6’sında sağkalım için prognostik olduğunu göstermektedir.
Trombositopeni 1323 vaka ile 13 makalede prognostik bir değişken olarak yer almıştır. Dokuz makalede hem remisyon hem de sağkalım, üç makalede tek başına remisyon ve bir makalede sağkalım dahil edilmiştir. İki makalede remisyon ve üç makalede sağkalım için prognostik olduğu bulunmuştur. Trombositopeni bir makalede sağkalım için pozitif bir prognostik faktör olarak tanımlanmıştır [193]. Dahil edildiği takdirde, remisyon için makalelerin %16,7’sinde ve sağkalım için makalelerin %30’unda prognostik faktör olmuştur.
3.6.4. Tedavi Parametreleri
Çoğunlukla hastanın tam remisyona ulaşması şeklinde ifade edilen tedaviye alınan yanıt, 1211 vakayı içeren 10 makaleye dahil edilmiştir. Hem remisyon hem de sağkalım sekiz makalede, sadece remisyon bir makalede ve sadece sağkalım bir makalede yer almıştır. Beş makalede her ikisinin sonucu için, üç makalede ise sağkalım için prognostik faktör olarak tanımlanmıştır. Çalışmaların %62,5’inde remisyon için, %88,9’unda ise sağkalım için prognostik olduğu belirtilmiştir.
4. Tartışma
Bu inceleme, lenfoma tedvisinde sonuçlar ve prognostik değişkenler açısından literatürde büyük ölçüde farklılık olduğunu göstermektedir. Makalelerin sonuçlarındaki farklılıklar, değişken dahil edilme/hariç tutulma kriterlerinden, kullanılan tanımların çeşitliliğinden, yapılan analizlerden ve potansiyel olarak dahil edilen vaka sayısından kaynaklanmaktadır. Literatürde çok sayıda makale olmasına rağmen, en iyi uygulamayı ortaya koymak için konuyla ilgili net bir görüş veya kanıt elde etmek oldukça zordur.
Kemoterapi ile tedavi edilen lenfomalı köpeklerde temel ölçüt tedaviye alınan yanıttır. Bu temel özelliği değerlendirmek için kullanılan kriterlerin, ne zaman değerlendirildiği ve yanıt olarak kabul edilmesi için gereken süre de dahil olmak üzere birbiriyle tutarsız olduğuna dair literatür bilgilerini sunduk. 2010’dan önce, nodal lenfomada yanıtları tanımlamak için veterinerlik alanında mevcut bir şema yoktu ve bu konu VCOG çalışmasında ele alınmıştı. Bununla birlikte, VCOG makalesinin [7] yayınlanmasından bu yana, önerilen tek tip yaklaşım tutarlı bir şekilde uygulanmamıştır. CHOP benzeri protokolle tedavi edilen nodal lenfoma için CR oranları %25 ila %100 arasında değişmekle birlikte, bildirilen yanıt oranları büyük farklılıklar göstermektedir. Yalnızca yanıt kriterleri ve bu yanıtın sürdürülmesi gereken süre dahil olmak üzere karşılaştırılabilir yanıt sınıflandırma şemaları kullanan makaleleri seçtiğimizde bile büyük değişkenlik devam etmiştir (veriler gösterilmemiştir), bu da yanıt kriterleri tanımı dışındaki faktörlerin varyasyonda bir rolü olduğunu düşündürmektedir.
Lenfomada karar vermede kilit özellik, genel sağkalımdan ziyade ilk remisyon süresidir. Sağkalım, hayvan sahiplerinin maddi veya lojistik nedenlerle tekrarlanan kemoterapi seanslarına devam etme isteği ve veteriner hastalara ötenazinin bir seçenek olarak sunulması gibi diğer faktörlerden de etkilenmektedir. Remisyon süresini rapor etmek için kullanılan terminoloji ve metodoloji çeşitlilik göstermektedir. Bunun için kullanılan başlangıç tarihi, teşhis tarihinden protokolün belirli bir kısmının tamamlanmasına kadar değişmektedir. Çalışmalarda rapor edilen ortalama ve medyan MRT yaklaşık 200 gün iken arada 60 günlük bir fark olabilir. Bu, sonuçlardaki değişkenliğin bir kısmına katkıda bulunabilir, ancak CHOP benzeri kemoterapi ile tedavi edilen nodal lenfoma için 73 ila 622 gün arasında değişen geniş bir medyan remisyon süresi aralığı söz konusu olduğunda, buna katkıda bulunan başka faktörler de olması muhtemeldir. VCOG raporunda [7] bu aralıkların tedavinin başlangıcından itibaren alınması önerilmektedir, bu da bu değişkenliği ortadan kaldıracaktır.
Ortak görüşe göre, hastalığın progresyonunu belirlemek için tedavi sırasında ve sonrasında tekrar yapılacak kontrollerin zamanlamasına yönelik bir tavsiyede bulunulmuştur [7]; bu durum, çoğu retrospektif nitelikteki önceki çalışmalarda kaydedilmemiştir.
Bildirilen sağkalım sürelerindeki değişkenlik, sürenin başlangıç noktasının belirlenmesi gibi remisyonla ilgili etkenlere yakın faktörlerden kaynaklanmaktadır. Sağkalım süresi remisyon süresinden yaklaşık %50 daha uzun olmakla birlikte, farklı bir başlangıç noktası söz konusu sonucun yaklaşık %10’unu teşkil etmektedir. Yukarıda belirtildiği gibi, sağkalım, hasta sahibinin tedavi veya ötenazi kararlarından etkilenmiştir.
Açıkça tanımlanmış spesifik alt tipler veya anatomik lokasyonlar göz önünde bulundurulduğunda ki bu bilgiler insanlardan elde edilen bilgilerle daha iyi eşleşecektir, makale ve dahil edilen vaka sayısı azalmıştır. Köpeklerde en sık görülen lenfoma türü nodal veya multisentrik DLBCL’dir. B hücreli lenfoma ile sınırlı grupları kapsayan yalnızca 11 makale vardır ve bunların yalnızca beşi DLBCL ile sınırlıdır. Tablo3’te gösterildiği gibi, hem B-hücreli hem de T- hücreli lenfoma için, çalışmalara dahil edilen farklı alt tiplerden kaynaklanabilecek çok çeşitli sonuçlar bildirilmiştir.
Şekil1-4’te gösterildiği gibi, remisyon süresi veya sağkalım ile ölçülen zaman içinde sonuçlardaki değişim klinik olarak kayda değer şekilde etkilenmemiştir. Temelde, B-hücreli lenfoma sonuçlarında azalma eğilimi vardır; bu durum, kullanılan tedaviler nispeten aynı kaldığı için hayvan sahipleri ve veteriner hekimlerin daha kötü durumda olan veya daha fazla negatif prognostik faktörü olan hastaları tedavi etmek istemesi gibi çeşitli nedenlere bağlı olabilir.
Köpeklerde lenfoma için prognostik indikatör olarak değerlendirilen değişkenleri inceleyen kabul edilebilir sayıda literatür bulunmaktadır. Ancak, çalışma tasarımında ve faktörlerin nasıl değerlendirildiği konusunda değişkenlik tespit ettik. Bazı ilgili faktörleri birlikte gruplandırdığımız için en az bir makalede yer alan 45’ten fazla faktör vardı, ancak herhangi bir makalede değerlendirilen en fazla faktör 17 idi ve bazıları üç taneye kadar düşüyordu. Bu durum, değişkenlerin çok değişkenli analize dahil edilmesi için kullanılan farklı kriterlerle karıştırılmaktadır. Çalışmaların çoğunda prognostik faktörlerin sınırlı derecede dahil edilmesi, karışıklığa neden olan başka bir değişken dahil edilmediği takdirde analiz sonuçlarını saptırma potansiyeline sahiptir. Tek değişkenli analiz sonuçlarını makalede detaylandırmadık, çünkü bunlar çok değişkenli analiz makul bir sıklıkta yapıldığında istatistiksel olarak anlamlı bulunmamıştır ve bunun eksikliği analizi yorumlamayı güçleştirmektedir.
İlginç bulduğumuz şey, yaygın olarak atıfta bulunulan prognostik faktörlerin çoğunun, değerlendirildikleri makalelerin %50’sinden azında, birçoğunda ise %20’sinden azında prognostik olduğudur. Farklı gruplar olarak tedavi şekli ve moleküler/genetik belirteçleri ve 10’dan az makalede değerlendirilen faktörleri hariç tutarsak, sadece immünofenotip ve tedaviye alınan yanıtın değerlendirildiği makalelerin %50’sinden fazlasında prognostik olduğu ve immünofenotipin sadece remisyon için ve %41,7’sinin sağkalım için prognostik olduğu görülmüştür.
Hiperkalsemi ve alt evre genellikle lenfomalı köpekler için önemli sonuç belirleyiciler olarak gösterilmektedir, ancak bunlar remisyon için sırasıyla makalelerin %38,5’inde ve %11,8’inde ve sağkalım için sırasıyla makalelerin %35,1’inde ve %31,6’sında prognostik olarak tanımlanmıştır. Bu durumun az sayıda çalışma yapılmasından mı, yoksa bunların prognostik göstergeler olduğunu belirtmeyen çalışmaların yöntemlerindeki zayıflıktan mı kaynaklandığını tartışmalıyız. Veteriner hekimlerin alt evreye ilişkin değerlendirmelerinde farklılıklar söz konusudur [194] ve bunlar bu incelemede dikkate alınamamıştır. Anatomik yerleşim, ağırlıklı olarak anterior mediastinal hastalığın varlığıyla bağlantılı olarak, daha sık kullanılan prognostik faktörlerden bir diğeridir. Daha önceki çalışmaların çoğu, köpeklerde anterior mediastinal hastalıkla bağlantılı olan immünofenotipi dahil etmemiştir ve her ikisi de dahil edilirse, immünofenotip prognostik gösterge olabilir. Gastrointestinal hastalık değerlendirildiğinde, bu hastalığın multisentrik veya nodal hastalıktan daha kötü prognoza sahip olduğu rapor edilmiştir [41], bu da diğer sınıflandırmalara ek olarak anatomik prezentasyonun da dikkate alınması gerektiğini göstermektedir.
Prognostik göstergelerin değerlendirilme şekli tutarlılık göstermemiştir. Lenfomanın klinik evresi, makalelerin %14,6’sında remisyon için ve %27,5’inde sağkalım için prognostikti. Bazı makaleler I. evre hastalığı da içeriyordu ve tahmin edileceği üzere bu köpekler daha iyi sonuçlar elde etti, bu nedenle genel olarak evre prognostik faktör şeklinde rapor edildi.
Diğerleri yüksek grade hastalığı, V. evreyi hariç tutmuş ve muhtemelen V. evrenin daha kötü bir görünüme sahip olabileceği gerçeğini gözden kaçırarak evreyi prognostik faktör olarak görmemiştir. V. evre lenfomanın nasıl teşhis edildiğine ilişkin farklılıklar göz önünde bulundurulduğunda sonuçlar üzerindeki etkisi hakkında bilgi bulunmamaktadır. Kemik iliği tutulumu lenfoid olmayan herhangi bir organın tutulumundan farklı olabilir veya kemik iliği tutulumunun şiddeti sonucu etkileyebilir.
Hayal kırıklığı yaratan husus, potansiyel prognoz değişkenleri çok az çalışmada değerlendirilmiştir. Toksisite görülen köpekler veya doz modifikasyonu gibi bazıları sıklıkla prognostik faktörler şeklinde belirtilmektedir, ancak bunlar sırasıyla sadece beş ve altı makalede yer almıştır. Histolojik sınıflandırma yalnızca sekiz makalede değerlendirilmiş, ancak dahil edildiği makalelerin %42,9’unda sağkalım için prognostik faktör olmuştur. Histoloji, hastaları teşhis etmek ve sınıflandırmak için sitoloji, immünositokimya ve akış sitometrisinin daha sık kullanılmasıyla daha az yapılmaktadır. Prognozu değerlendirirken çeşitli faktörlerin dikkate alınmaması, atlandıklarında tedavi seçimlerini ve kararlarını etkileyebilecek önemli bilgileri gözden kaçırabilir veya istatistiksel analizleri saptırabilir.
5. Sonuç
Yazarlar, remisyon ve sağkalım tanımına ilişkin öneriler de dahil olmak üzere, nodal lenfoma için yanıtın sınıflandırılmasına yönelik VCOG [7] kılavuzunun gelecekteki tüm çalışmalarda kullanılmasını önermektedir. Ayrıca, hem pratikte hem de tüm prospektif çalışmalarda kullanılmak üzere standart bir takip protokolü kullanılması önerilmektedir [7]. Hasta kayıtlarındaki bilgilerin tutarlılığı, Avrupa Köpek Lenfoma Ağı [6] tarafından yapılan incelemede önerildiği gibi, lenfomalı hastaların sonuçlarını etkileyen faktörlerin daha iyi anlaşılması için çalışmalar arası metanaliz yapılmasına olanak tanıyabilir.
Lenfoma çalışmalarına dahil edilmesi gereken prognostik göstergeler ve mevcut evreleme sisteminin sonuç çalışmalarında kullanılmak üzere düzeltilmesi gerekip gerekmediği konusunda fikir birliği sağlamak için daha fazla çalışma yapılması gerekmektedir. İstatistiksel analize dahil edilen yanlış sınıflandırmanın etkisi bilinmediğinden, lenfomalı köpekler için alt evre sınıflandırması üzerinde fikir birliğine varılması gerekmektedir. Prognostik faktörleri değerlendirirken, gelecekteki çalışmalar makul sayıda faktörü analize dahil etmeye ve potansiyel olarak karışıklığa yol açan faktörleri hariç tutmamaya gayret gösterilmelidir.
Ek Materyaller: Aşağıdaki ek bilgiler şu adresten erişilebilir: https:// www.mdpi.com/article/10.3390/vetsci10050342/s1, Tablo S1: 10’dan daha az makalede bildirilen prognostik değişkenler, Tablo S2: Çok değişkenli analizle incelenen ve prognostik bir faktör olarak moleküler, genetik, immünohistokimyasal veya başka türden biyobelirteç kullanan makaleler, Tablo S3: Tedavi protokolü varyasyonlarını değerlendiren makaleler, Tablo S4, Sadece tek değişkenli analiz dahil eden makalelerden özet bulgular [195-197].
Katkıda bulunan yazarlar: P.B., P.W. ve R.T. tasarım ve makalenin hazırlanmasına katkıda bulunmuştur; veri toplama ve analizi P.B. tarafından yapılmıştır. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir.
Finansman: Bu araştırma herhangi bir dış finansman almamıştır. Etik Kurul Beyanı: Mevcut değil.
Aydınlatılmış Onam Beyanı: Mevcut değil.
Veri Erişim Beyanı: Bu incelemede, matbu olmayan veya ek materyallerde sunulmayan başka herhangi bir
yeni veri bulunmamıştır.
Çıkar Çatışması Beyanı: Yazarlar herhangi bir çıkar çatışması beyan etmemiştir.
Kaynakça
- Merlo, D.F.; Rossi, L.; Pellegrino, C.; Ceppi, M.; Cardellino, U.; Capurro, C.; Ratto, A.; Sambucco, P.L.; Sestito, V.; Tanara, G.; et al. Cancer Incidence in Pet Dogs: Findings of the Animal Tumor Registry of Genoa, Italy. J. Vet. Intern. Med. 2008, 22, 976–984. [CrossRef] [PubMed]
- Sheikh, I.N.; Elgehiny, A.; Ragoonanan, D.; Mahadeo, K.M.; Nieto, Y.; Khazal, S. Management of Aggressive Non-Hodgkin Lymphomas in the Pediatric, Adolescent, and Young Adult Population: An Adult vs. Pediatric Perspective. Cancers 2022, 14, 2912. [CrossRef] [PubMed]
- Valli, V.E.; San Myint, M.; Barthel, A.; Bienzle, D.; Caswell, J.; Colbatzky, F.; Durham, A.; Ehrhart, E.J.; Johnson, Y.; Jones, C.; et al. Classification of Canine Malignant Lymphomas According to the World Health Organization Criteria. Vet. Pathol. 2011, 48, 198–211. [CrossRef] [PubMed]
- Valli, V.E.; Kass, P.H.; San Myint, M.; Scott, F. Canine Lymphomas: Association of Classification Type, Disease Stage, Tumor Subtype, Mitotic Rate, and Treatment with Survival. Vet. Pathol. 2013, 50, 738–748. [CrossRef]
- Hosoya, K.; Kisseberth, W.C.; Lord, L.K.; Alvarez, F.J.; Lara-Garcia, A.; Kosarek, C.E.; London, C.A.; Couto, C.G. Comparison of COAP and UW- 19 Protocols for dogs with multicentric lymphoma. J. Vet. Intern. Med. 2007, 21, 1355–1363. [CrossRef]
- Marconato, L.; Polton, G.A.; Sabattini, S.; Dacasto, M.; Garden, O.A.; Grant, I.; Hendrickx, T.; Henriques, J.; Lubas, G.; Morello, E.; et al. Conformity and controversies in the diagnosis, staging and follow-up evaluation of canine nodal lymphoma: A systematic review of the last 15 years of published literature. Vet. Comp. Oncol. 2017, 15, 1029–1040. [CrossRef] [PubMed]
- Vail, D.M.; Michels, G.M.; Khanna, C.; Selting, K.A.; London, C.A.; Group, V.C.O. Response evaluation criteria for peripheral nodal lymphoma in dogs (v1.0)—A veterinary cooperative oncology group (VCOG) consensus document. Vet. Comp. Oncol. 2010, 8, 28–37. [CrossRef]
- Alabdaljabar, M.S.; Durani, U.; Thompson, C.A.; Constine, L.S.; Hashmi, S.K. The forgotten survivor: A comprehensive review on Non-Hodgkin lymphoma survivorship. Am. J. Hematol. 2022, 97, 1627–1637. [CrossRef]
- Crow, S.E.; Theilen, G.H.; Benjamini, E.; Torten, M.; Henness, A.M.; Buhles, W.C. Chemoimmunotherapy for canine lymphosar- coma. Cancer 1977, 40, 2102–2108. [CrossRef]
- Gavazza, A.; Lubas, G.; Fridman, A.; Peruzzi, D.; Impellizeri, J.A.; Luberto, L.; Marra, E.; Roscilli, G.; Ciliberto, G.; Aurisicchio, L. Safety and Efficacy of a Genetic Vaccine Targeting Telomerase Plus Chemotherapy for the Therapy of Canine B-Cell Lymphoma. Hum. Gene Ther. 2013, 24, 728–738. [CrossRef]
- Jeglum, K.A.; Young, K.M.; Barnsley, K.; Whereat, A. Chemotherapy versus chemotherapy with intralymphatic tumor-cell vaccine in canine lymphoma. Cancer 1988, 61, 2042–2050. [CrossRef] [PubMed]
- Marconato, L.; Frayssinet, P.; Rouquet, N.; Comazzi, S.; Leone, V.F.; Laganga, P.; Rossi, F.; Vignoli, M.; Pezzoli, L.; Aresu, L. Randomized, Placebo-Controlled, Double-Blinded Chemoimmunotherapy Clinical Trial in a Pet Dog Model of Diffuse Large B-cell Lymphoma. Clin. Cancer Res. 2014, 20, 668–677. [CrossRef] [PubMed]
- O’Connor, C.M.; Sheppard, S.; Hartline, C.A.; Huls, H.; Johnson, M.; Palla, S.L.; Maiti, S.; Ma, W.; Davis, R.E.; Craig, S.; et al. Adoptive T-cell therapy improves treatment of canine non-Hodgkin lymphoma post chemotherapy. Sci. Rep. 2012, 2, 249. [CrossRef] [PubMed]
- Theilen, G.H.; Worley, M.; Benjamini, E. Chemoimmunotherapy for canine lymphosarcoma. J. Am. Vet. Med. Assoc. 1977, 170, 607–610. [PubMed]
- Turek, M.M.; Thamm, D.H.; Mitzey, A.; Kurzman, I.D.; Huelsmeyer, M.K.; Dubielzig, R.R.; Vail, D.M. Human granulocyte- macrophage colony-stimulating factor DNA cationic-lipid complexed autologous tumour cell vaccination in the treatment of canine B-cell multicentric lymphoma. Vet. Comp. Oncol. 2007, 5, 219–231. [CrossRef]
- Berlato, D.; Schrempp, D.; Van den Steen, N.; Murphy, S. Radiotherapy in the management of localized mucocutaneous oral lymphoma in dogs: 14 cases. Vet. Comp. Oncol. 2012, 10, 16–23. [CrossRef] [PubMed]
- Epstein, R.B.; Graham, T.C.; Storb, R.; Thomas, E.D. Studies of marrow transplantation, chemotherapy and cross-circulation in canine lymphosarcoma. Blood 1971, 37, 349–359. [CrossRef]
- George, R.; Smith, A.; Schleis, S.; Brawner, W.; Almond, G.; Kent, M.; Wypij, J.; Borrego, J.; Moore, A.; Keyerleber, M.; et al. Outcome of dogs with intranasal lymphoma treated with various radiation and chemotherapy protocols: 24 cases. Vet. Radiol. Ultrasound 2016, 57, 306–312. [CrossRef]
- Gustafson, N.R.; Lana, S.E.; Mayer, M.N.; LaRue, S.M. A preliminary assessment of whole-body radiotherapy interposed within a chemotherapy protocol for canine lymphoma. Vet. Comp. Oncol. 2004, 2, 125–131. [CrossRef] [PubMed]
- Lurie, D.M.; Gordon, I.K.; Theon, A.P.; Rodriguez, C.O.; Suter, S.E.; Kent, M.S. Sequential Low-Dose Rate Half-Body Irradiation and Chemotherapy for the Treatment of Canine Multicentric Lymphoma. J. Vet. Intern. Med. 2009, 23, 1064–1070. [CrossRef]
- Novotney, C.A.; Page, R.L.; Macy, D.W.; Dewhirst, M.W.; Ogilvie, G.K.; Withrow, S.J.; McEntee, M.C.; Heidner, G.L.; Allen, S.A.; Thrall, D.E.; et al. Phase I evaluation of doxorubicin and whole-body hyperthermia in dogs with lymphoma. J. Vet. Intern. Med. 1992, 6, 245–249. [CrossRef]
- Rassnick, K.M.; McEntee, M.C.; Erb, H.N.; Burke, B.P.; Balkman, C.E.; Flory, A.B.; Kiselow, M.A.; Autio, K.; Gieger, T.L. Comparison of 3 protocols for treatment after induction of remission in dogs with lymphoma. J. Vet. Intern. Med. 2007, 21, 1364–1373. [CrossRef]
- Vaughan, A.; Johnson, J.L.; Williams, L.E. Impact of chemotherapeutic dose intensity and hematologic toxicity on first remission duration in dogs with lymphoma treated with a chemoradiotherapy protocol. J. Vet. Intern. Med. 2007, 21, 1332–1339. [CrossRef] [PubMed]
- Willcox, J.L.; Pruitt, A.; Suter, S.E. Autologous Peripheral Blood Hematopoietic Cell Transplantation in Dogs with B-cell Lymphoma. J. Vet. Intern. Med. 2012, 26, 1155–1163. [CrossRef] [PubMed]
- Williams, L.E.; Johnson, J.L.; Hauck, M.L.; Ruslander, D.M.; Price, G.S.; Thrall, D.E. Chemotherapy followed by half-body radiation therapy for canine lymphoma. J. Vet. Intern. Med. 2004, 18, 703–709. [CrossRef] [PubMed]
- Frimberger, A.E.; Moore, A.S.; Rassnick, K.M.; Cotter, S.M.; O’Sullivan, J.L.; Quesenberry, P.J. A combination chemotherapy protocol with dose intensification and autologous bone marrow transplant (VELCAP-HDC) for canine lymphoma. J. Vet. Intern. Med. 2006, 20, 355–364. [CrossRef] [PubMed]
- O’Brien, D.; Moore, P.F.; Vernau, W.; Peauroi, J.R.; Rebhun, R.B.; Rodriguez, C.O., Jr.; Skorupski, K.A. Clinical Characteristics and Outcome in Dogs with Splenic Marginal Zone Lymphoma. J. Vet. Intern. Med. 2013, 27, 949–954. [CrossRef] [PubMed]
- van Stee, L.L.; Boston, S.E.; Singh, A.; Romanelli, G.; Rubio-Guzman, A.; Scase, T.J. Outcome and Prognostic Factors for Canine Splenic Lymphoma Treated by Splenectomy (1995–2011). Vet. Surg. 2015, 44, 976–982. [CrossRef]
- Macewen, E.G.; Brown, N.O.; Patnaik, A.K.; Hayes, A.A.; Passe, S. Cyclic combination chemotherapy of canine lymphosarcoma. J. Am. Vet. Med. Assoc. 1981, 178, 1178–1181.
- Valerius, K.D.; Olgilvie, G.K.; Fettman, M.J.; Walton, J.A.; Richardson, K.; Powers, B.E.; McNiel, E.A.; Rogers, Q.R. Comparison of the effects of asparinginase administered subcutaneously versus intramuscularly for treatment of multicentric lymphoma in dogs receiving doxorubicin. J. Am. Vet. Med. Assoc. 1999, 214, 353–356.
- Kliczkowska-Klarowicz, K.; Jagielski, D.; Czopowicz, M.; Sapierzyn ́ski, R. Prognostic role of clinical presentation, cytological picture and response to treatment in canine centroblastic lymphoma. Pol. J. Vet. Sci. 2021, 24, 101–107. [PubMed]
- Stone, M.S.; Goldstein, M.A.; Cotter, S.M. Comparison of two protocols for induction of remission in dogs with lymphoma. J. Am. Anim. Hosp. Assoc. 1991, 27, 315–321.
- Dervisis, N.G.; Dominguez, P.A.; Sarbu, L.; Newman, R.G.; Cadile, C.D.; Swanson, C.N.; Kitchell, B.E. Efficacy of temozolomide or dacarbazine in combination with an anthracycline for rescue chemotherapy in dogs with lymphoma. J. Am. Vet. Med. Assoc. 2007, 231, 563–569. [CrossRef] [PubMed]
- Azuma, K.; Ohmi, A.; Goto-Koshino, Y.; Tomiyasu, H.; Ohno, K.; Chambers, J.K.; Uchida, K.; Namba, H.; Nagata, M.; Nagamine, E.; et al. Outcomes and prognostic factors in canine epitheliotropic and nonepitheliotropic cutaneous T-cell lym- phomas. Vet. Comp. Oncol. 2021, 20, 118–126. [CrossRef] [PubMed]
- Simon, D.; Moreno, S.N.; Hirschberger, J.; Moritz, A.; Kohn, B.; Neumann, S.; Jurina, K.; Scharvogel, S.; Schwedes, C.; Reinacher, M.; et al. Efficacy of a continuous, multiagent chemotherapeutic protocol versus a short-term single-agent protocol in dogs with lymphoma. J. Am. Vet. Med. Assoc. 2008, 232, 879–885. [CrossRef] [PubMed]
- Simon, D.; Nolte, I.; Eberle, N.; Abbrederis, N.; Killich, M.; Hirschberger, J. Treatment of dogs with lymphoma using a 12-week, maintenance-free combination chemotherapy protocol. J. Vet. Intern. Med. 2006, 20, 948–954. [CrossRef] [PubMed]
- Smallwood, K.; Tanis, J.B.; Grant, I.A.; Blackwood, L.; Killick, D.R.; Amores-Fuster, I.; Elliott, J.; Mas, A.; Harper, A.; Marrington,
M. Evaluation of a multi-agent chemotherapy protocol combining dexamethasone, melphalan, actinomycin D, and cytarabine for the treatment of resistant canine non-Hodgkin high-grade lymphomas: A single centre’s experience. Vet. Comp. Oncol. 2019, 17, 165–173. [CrossRef] - Zemann, B.I.; Moore, A.S.; Rand, W.M.; Mason, G.; Ruslander, D.M.; Frimberger, A.E.; Wood, C.A.; L’Heureux, D.A.; Gliatto, J.; Cotter, S.M. A combination chemotherapy protocol (VELCAP-L) for dogs with lymphoma. J. Vet. Intern. Med. 1998, 12, 465–470. [CrossRef]
- Moore, A.S.; London, C.A.; Wood, C.A.; Williams, J.E.; Cotter, S.M.; L’Heureux, D.A.; Frimberger, A.E. Lomustine (CCNU) for the treatment of resistant lymphoma in dogs. J. Vet. Intern. Med. 1999, 13, 395–398. [CrossRef]
- Morrison-Collister, K.E.; Rassnick, K.M.; Northrup, N.C.; Kristal, O.; Chretin, J.D.; Williams, L.E.; Cotter, S.M.; Moore, A.S. A combination chemotherapy protocol with MOPP and CCNU consolidation (Tufts VELCAP-SC) for the treatment of canine lymphoma. Vet. Comp. Oncol. 2003, 1, 180–190. [CrossRef]
- Rassnick, K.M.; Moore, A.S.; Collister, K.E.; Northrup, N.C.; Kristal, O.; Chretin, J.D.; Bailey, D.B. Efficacy of Combination Chemotherapy for Treatment of Gastrointestinal Lymphoma in Dogs. J. Vet. Intern. Med. 2009, 23, 317–322. [CrossRef] [PubMed]
- Williams, L.E.; Rassnick, K.M.; Power, H.T.; Lana, S.E.; Morrison-Collister, K.E.; Hansen, K.; Johnson, J.L. CCNU in the treatment of canine epitheliotropic lymphoma. J. Vet. Intern. Med. 2006, 20, 136–143. [CrossRef] [PubMed]
- Flory, A.B.; Rassnick, K.M.; Erb, H.N.; Garrett, L.D.; Northrup, N.C.; Selting, K.A.; Phillips, B.S.; Locke, J.E.; Chretin, J.D. Evaluation of factors associated with second remission in dogs with lymphoma undergoing retreatment with a cyclophosphamide, doxorubicin, vincristine, and prednisone chemotherapy protocol: 95 cases (2000–2007). J. Am. Vet. Med. Assoc. 2011, 238, 501–506. [CrossRef] [PubMed]
- Griessmayr, P.C.; Payne, S.E.; Winter, J.E.; Barber, L.G.; Shofer, F.S. Dacarbazine as single-agent therapy for relapsed lymphoma in dogs. J. Vet. Intern. Med. 2009, 23, 1227–1231. [CrossRef]
- Northrup, N.C.; Gieger, T.L.; Kosarek, C.E.; Saba, C.F.; LeRoy, B.E.; Wall, T.M.; Hume, K.R.; Childress, M.O.; Keys, D.A. Mechlorethamine, procarbazine and prednisone for the treatment of resistant lymphoma in dogs. Vet. Comp. Oncol. 2009, 7, 38–44. [CrossRef] [PubMed]
- Flory, A.B.; Rassnick, K.M.; Al-Sarraf, R.; Bailey, D.B.; Balkman, C.E.; Kiselow, M.A.; Autio, K. Combination of CCNU and DTIC chemotherapy for treatment of resistant lymphoma in dogs. J. Vet. Intern. Med. 2008, 22, 164–171. [CrossRef]
- Back, A.R.; Schleis, S.E.; Smrkovski, O.A.; Lee, J.; Smith, A.N.; Phillips, J.C. Mechlorethamine, vincristine, melphalan and prednisone (MOMP) for the treatment of relapsed lymphoma in dogs. Vet. Comp. Oncol. 2015, 13, 398–408. [CrossRef]
- Intile, J.L.; Rassnick, K.M.; Al-Sarraf, R.; Chretin, J.D. Evaluation of the Tolerability of Combination Chemotherapy with Mitoxantrone and Dacarbazine in Dogs with Lymphoma. J. Am. Anim. Hosp. Assoc. 2019, 55, 101–109. [CrossRef]
- Al-Nadaf, S.; Rebhun, R.B.; Curran, K.M.; Venable, R.O.; Skorupski, K.A.; Willcox, J.L.; Burton, J.H. Retrospective analysis of doxorubicin and prednisone as first-line therapy for canine B-cell lymphoma. BMC Vet. Res. 2018, 14, 356. [CrossRef]
- Tanis, J.B.; Mason, S.; Maddox, T.; Blackwood, L.; Killick, D.; Amores-Fuster, I.; Harper, A.; Finotello, R. Evaluation of a multi- agent chemotherapy protocol combining lomustine, procarbazine and prednisolone (LPP) for the treatment of relapsed canine non-Hodgkin high-grade lymphomas. Vet. Comp. Oncol. 2018, 16, 361–369. [CrossRef]
- Hughes, K.L.; Ehrhart, E.; Rout, E.D.; Harris, L.J.; Fernandez, M.; Yoshimoto, J.A.; Dossey, J.; Kuzmik, A.R.; Avery, P.R.; Avery, A.C. Diffuse Small B- Cell Lymphoma: A High-Grade Malignancy. Vet. Pathol. 2021, 58, 912–922. [CrossRef] [PubMed]
- Meyer, A.; Eberle, N.; Bullerdiek, J.; Nolte, I.; Simon, D. High-mobility group B1 proteins in canine lymphoma: Prognostic value of initial and sequential serum levels in treatment outcome following combination chemotherapy. Vet. Comp. Oncol. 2010, 8, 127–137. [CrossRef] [PubMed]
- Moore, A.S.; Ogilvie, G.K.; Vail, D.M. Actinomycin-D for reinduction of remission in dogs with resistant lymphoma. J. Vet. Intern. Med. 1994, 8, 343–344. [CrossRef] [PubMed]
- Nakagawa, T.; Kojima, M.; Ohno, K.; Chambers, J.K.; Uchida, K.; Ohmi, A.; Goto-Koshino, Y.; Tomiyasu, H.; Tsujimoto, H. Efficacy and adverse events of continuous l-asparaginase administration for canine large cell lymphoma of presumed gastrointestinal origin. Vet. Comp. Oncol. 2021, 20, 102–108. [CrossRef] [PubMed]
- Marconato, L.; Martini, V.; Aresu, L.; Sampaolo, M.; Valentini, F.; Rinaldi, V.; Comazzi, S. Assessment of bone marrow infiltration diagnosed by flow cytometry in canine large B cell lymphoma: Prognostic significance and proposal of a cut-off value. Vet. J. 2013, 197, 776–781. [CrossRef]
- Škor, O.; Bicanová, L.; Wolfesberger, B.; Fuchs-Baumgartinger, A.; Ruetgen, B.; Šteˇrbová, M.; Schwendenwein, I.; Kleiter, M. Are B- symptoms more reliable prognostic indicators than substage in canine nodal diffuse large B-cell lymphoma. Vet. Comp. Oncol. 2021, 19, 201–208. [CrossRef]
- Aresu, L.; Martini, V.; Rossi, F.; Vignoli, M.; Sampaolo, M.; Arico, A.; Laganga, P.; Pierini, A.; Frayssinet, P.; Mantovani, R.; et al. Canine indolent and aggressive lymphoma: Clinical spectrum with histologic correlation. Vet. Comp. Oncol. 2015, 13, 348–362. [CrossRef]
- Mortier, F.; Daminet, S.; Vandenabeele, S.; Van de Maele, I. Canine lymphoma: A retrospective study (2009–2010). Vlaams Diergeneeskd. Tijdschr. 2012, 81, 341–351. [CrossRef]
- Squire, R.A.; Bush, R.M.; Melby, E.C.; Neeley, L.M.; Yarbrough, B. Clinical and pathologic study of canine lymphoma: Clinical staging, cell classification, and therapy. J. Natl. Cancer Inst. 1973, 51, 565–574.
- Lucas, S.R.R.; Coelho, B.M.P.; Marquezi, M.L.; Franchini, M.L.; Miyashiro, S.I.; Pozzi, D.H.D. Carmustine, vincristine, and prednisone in the treatment of canine lymphosarcoma. J. Am. Anim. Hosp. Assoc. 2004, 40, 292–299. [CrossRef]
- Price, G.S.; Page, R.L.; Fischer, B.M.; Levine, J.F.; Gerig, T.M. Efficicacy and toxicity of doxorubicin cyclophosphamide maintenance therapy in dogs with multicentric lymphosarcoma. J. Vet. Intern. Med. 1991, 5, 259–262. [CrossRef] [PubMed]
- Chun, R.; Garrett, L.D.; Vail, D.M. Evaluation of a high-dose chemotherapy protocol with no maintenance therapy for dogs with lymphosarcoma. J. Vet. Intern. Med. 2000, 14, 120–124. [CrossRef] [PubMed]
- Mutsaers, A.J.; Glickman, N.W.; DeNicola, D.B.; Widmer, W.R.; Bonney, P.L.; Hahn, K.A.; Knapp, D.W. Evaluation of treatment with doxorubicin and piroxicam or doxorubicin alone for multicentric lymphoma in dogs. J. Am. Vet. Med. Assoc. 2002, 220, 1813–1817. [CrossRef]
- Rassnick, K.M.; Bailey, D.B.; Malone, E.K.; Intile, J.L.; Kiselow, M.A.; Flory, A.B.; Barlow, L.L.; Balkman, C.E.; Barnard, S.M.; Waite, A.H. Comparison between L-CHOP and an L-CHOP protocol with interposed treatments of CCNU and MOPP (L-CHOP- CCNU-MOPP) for lymphoma in dogs. Vet. Comp. Oncol. 2010, 8, 243–253. [CrossRef]
- Chan, C.M.; Frimberger, A.E.; Moore, A.S. Clinical outcome and prognosis of dogs with histopathological features consistent with epitheliotropic lymphoma: A retrospective study of 148 cases (2003–2015). Vet. Dermatol. 2018, 29, e154–e159. [CrossRef] [PubMed]
- Holtermann, N.; Kiupel, M.; Kessler, M.; Teske, E.; Betz, D.; Hirschberger, J. Masitinib monotherapy in canine epitheliotropic lymphoma. Vet. Comp. Oncol. 2016, 14, 127–135. [CrossRef]
- Morges, M.A.; Burton, J.H.; Saba, C.F.; Vail, D.M.; Burgess, K.E.; Thamm, D.H. Phase II Evaluation of VDC-1101 in Canine Cutaneous T-Cell Lymphoma. J. Vet. Intern. Med. 2014, 28, 1569–1574. [CrossRef]
- Risbon, R.E.; de Lorimier, L.P.; Skorupski, K.; Burgess, K.E.; Bergman, P.J.; Carreras, J.; Hahn, K.; LeBlanc, A.; Turek, M.; Impellizeri, J.; et al. Response of canine cutaneous epitheliotropic lymphoma to lomustine (CCNU): A retrospective study of 46 cases (1999–2004). J. Vet. Intern. Med. 2006, 20, 1389–1397. [CrossRef]
- Desmas, I.; Burton, J.H.; Post, G.; Kristal, O.; Gauthier, M.; Borrego, J.F.; Di Bella, A.; Lara-Garcia, A. Clinical presentation, treatment and outcome in 31 dogs with presumed primary colorectal lymphoma (2001–2013). Vet. Comp. Oncol. 2017, 15, 504–517. [CrossRef]
- Sogame, N.; Risbon, R.; Burgess, K.E. Intestinal lymphoma in dogs: 84 cases (1997–2012). J. Am. Vet. Med. Assoc. 2018, 252, 440–447. [CrossRef]
- Aresu, L.; Agnoli, C.; Nicoletti, A.; Fanelli, A.; Martini, V.; Bertoni, F.; Marconato, L. Phenotypical Characterization and Clinical Outcome of Canine Burkitt-Like Lymphoma. Front. Vet. Sci. 2021, 8, 647009. [CrossRef] [PubMed]
- Aresu, L.; Marconato, L.; Martini, V.; Fanelli, A.; Licenziato, L.; Foiani, G.; Melchiotti, E.; Nicoletti, A.; Vascellari, M. Prognostic Value of PD- L1, PD-1 and CD8A in Canine Diffuse Large B-Cell Lymphoma Detected by RNAscope. Vet. Sci. 2021, 8, 120. [CrossRef]
- Avery, P.R.; Burton, J.; Bromberek, J.L.; Seelig, D.M.; Elmslie, R.; Correa, S.; Ehrhart, E.J.; Morley, P.S.; Avery, A.C. Flow Cytometric Characterization and Clinical Outcome of CD4+ T-Cell Lymphoma in Dogs: 67 Cases. J. Vet. Intern. Med. 2014, 28, 538–546. [CrossRef] [PubMed]
- Barnard, R.A.; Wittenburg, L.A.; Amaravadi, R.K.; Gustafson, D.L.; Thorburn, A.; Thamm, D.H. Phase I clinical trial and pharma- codynamic evaluation of combination hydroxychloroquine and doxorubicin treatment in pet dogs treated for spontaneously occurring lymphoma. Autophagy 2014, 10, 1415–1425. [CrossRef] [PubMed]
- Baskin, C.R.; Couto, C.G.; Wittum, T.E. Factors influencing the first remission and survival in 145 dogs with lymphoma: A retrospective study. J. Am. Anim. Hosp. Assoc. 2000, 36, 404–409. [CrossRef]
- Benjamin, S.E.; Sorenmo, K.U.; Krick, E.L.; Salah, P.; Walsh, K.A.; Weinstein, N.M.; Keuler, N.S.; Avery, A.C.; Atherton, M.J.; Lenz, J.A. Response-based modification of CHOP chemotherapy for canine B-cell lymphoma. Vet. Comp. Oncol. 2021, 19, 541–550. [CrossRef]
- Bergman, P.J.; Ogilvie, G.K.; Powers, B.E. Monoclonal antibody C219 immunohistochemistry against P-glycoprotein: Sequential analysis and predictive ability in dogs with lymphoma. J. Vet. Intern. Med. 1996, 10, 354–359. [CrossRef]
- Bergmann, M.; Sauter-Louis, C.; Hirschberger, J. Chemotherapy in dogs with lymphoma-efficacy and adverse effects from the veterinarian’s and owner’s perspective. Kleintierpraxis 2011, 56, 573–584.
- Blaxill, J.; Buzzacott, P.; Finlay, J. Prognostic indicators for naïve canine non-indolent T-cell lymphoma treated with combination lomustine, vincristine, procarbazine and prednisolone chemotherapy. Vet. Comp. Oncol. 2021, 20, 215–226. [CrossRef]
- Bowles, C.A.; Lucas, D. Clinical and immunological response of lymphoma dogs following chemotherapy and irradiation. Comp. Immunol. Microbiol. Infect. Dis. 1980, 3, 317–326. [CrossRef]
- Boyce, K.L.; Kitchell, B.E. Treatment of canine lymphoma with COPLA/LVP. J. Am. Anim. Hosp. Assoc. 2000, 36, 395–403. [CrossRef] [PubMed]
- Buffo de Capua, M.L.; Dela Coleta, F.E.; Massae Nakage Canesin, A.P.; Godoy, A.V.; Calazans, S.G.; Miotto, M.R.; Daleck, C.R.; Santana, A.E. Canine lymphoma: Clinical and hematological aspects and treatment with the Madison-Wisconsin protocol. Cienc. Rural 2011, 41, 1245– 1251. [CrossRef]
- Burton, J.H.; Garrett-Mayer, E.; Thamm, D.H. Evaluation of a 15-week CHOP protocol for the treatment of canine multicentric lymphoma. Vet. Comp. Oncol. 2013, 11, 306–315. [CrossRef] [PubMed]
- Chen, H.-W.; Small, G.W.; Motsinger-Reif, A.; Suter, S.E.; Richards, K.L. VH1-44 gene usage defines a subset of canine B-cell lymphomas associated with better patient survival. Vet. Immunol. Immunopathol. 2014, 157, 125–130. [CrossRef]
- Chikazawa, S.; Hori, Y.; Hoshi, F.; Kanai, K.; Ito, N. Hyperferritinemia is associated with short survival time in dogs with multicentric lymphoma. J. Vet. Med. Sci. 2015, 77, 843–846. [CrossRef] [PubMed]
- Cotter, S.M.; Goldstein, M.A. Comparison of 2 protocols for maintenance of remission in dogs with lymphoma. J. Am. Anim. Hosp. Assoc. 1987, 23, 495–499.
- Curran, K.; Thamm, D.H. Retrospective analysis for treatment of naive canine multicentric lymphoma with a 15-week, maintenance-free CHOP protocol. Vet. Comp. Oncol. 2016, 14, 147–155. [CrossRef]
- Curran, K.M.; Schaffer, P.A.; Frank, C.B.; Lana, S.E.; Hamil, L.E.; Burton, J.H.; Labadie, J.; Ehrhart, E.J.; Avery, P.R. BCL2 and MYC are expressed at high levels in canine diffuse large B-cell lymphoma but are not predictive for outcome in dogs treated with CHOP chemotherapy. Vet. Comp. Oncol. 2017, 15, 1269–1279. [CrossRef]
- Dank, G.; Rassnick, K.M.; Kristal, O.; Rodriguez, C.O., Jr.; Clifford, C.A.; Ward, R.; Mallett, C.L.; Gieger, T.; Segev, G. Clinical characteristics, treatment, and outcome of dogs with presumed primary hepatic lymphoma: 18 cases (1992–2008). J. Am. Vet. Med. Assoc. 2011, 239, 966– 971. [CrossRef]
- Daters, A.T.; Mauldin, G.E.; Mauldin, G.N.; Brodsky, E.M.; Post, G.S. Evaluation of a multidrug chemotherapy protocol with mitoxantrone based maintenance (CHOP-MA) for the treatment of canine lymphoma. Vet. Comp. Oncol. 2010, 8, 11–22. [CrossRef]
- Deravi, N.; Berke, O.; Woods, J.P.; Bienzle, D. Specific immunotypes of canine T cell lymphoma are associated with different outcomes. Vet. Immunol. Immunopathol. 2017, 191, 5–13. [CrossRef] [PubMed]
- Dhaliwal, R.S.; Kitchell, B.E.; Ehrhart, E.J.; Valli, V.E.; Dervisis, N.G. Clinicopathologic Significance of Histologic Grade, Pgp, and P53 Expression in Canine Lymphoma. J. Am. Anim. Hosp. Assoc. 2013, 49, 175–184. [CrossRef] [PubMed]
- Dobson, J.M.; Gorman, N.T. Canine multicentric lymphoma-2—Comparison of response to 2 chemotherapeutic protocols. J. Small Anim. Pract. 1994, 35, 9–15. [CrossRef]
- Elliott, J.W.; Cripps, P.; Blackwood, L. Thymidine kinase assay in canine lymphoma. Vet. Comp. Oncol. 2013, 11, 1–13. [CrossRef]
- 95.Elliott, J.W.; Cripps, P.; Marrington, A.M.; Grant, I.A.; Blackwood, L. Epirubicin as part of a multi-agent chemotherapy protocol
for canine lymphoma. Vet. Comp. Oncol. 2013, 11, 185–198. [CrossRef] [PubMed]
- Fontaine, S.J.; McCulloch, E.; Eckersall, P.D.; Haining, H.; Patterson Kane, J.C.; Morris, J.S. Evaluation of the modified Glasgow Prognostic Score to predict outcome in dogs with newly diagnosed lymphoma. Vet. Comp. Oncol. 2017, 15, 1513–1526. [CrossRef] [PubMed]
- Fujiwara-Igarashi, A.; Goto-Koshino, Y.; Sato, M.; Maeda, S.; Igarashi, H.; Takahashi, M.; Fujino, Y.; Ohno, K.; Tsujimoto, H. Prognostic significance of the expression levels of the p16, p15, and p14 genes in dogs with high-grade lymphoma. Vet. J. 2014, 199, 236–244. [CrossRef]
- Garnica, T.K.; Lesbon, J.C.C.; Avila, A.C.F.C.M.; Rochetti, A.L.; Matiz, O.R.S.; Ribeiro, R.C.S.; Zoppa, A.; Nishiya, A.T.; Costa, M.T.; de Nardi, A.B.; et al. Liquid biopsy based on small extracellular vesicles predicts chemotherapy response of canine multicentric lymphomas. Sci. Rep. 2020, 10, 1–11. [CrossRef]
- Garrett, L.D.; Thamm, D.H.; Chun, R.; Dudley, R.; Vail, D.M. Evaluation of a 6-month chemotherapy protocol with no maintenance therapy for dogs with lymphoma. J. Vet. Intern. Med. 2002, 16, 704–709. [CrossRef]
- Goodman, I.H.; Moore, A.S.; Frimberger, A.E. Treatment of canine non-indolent T cell lymphoma using the VELCAP-TSC protocol: A retrospective evaluation of 70 dogs (2003–2013). Vet. J. 2016, 211, 39–44. [CrossRef]
- Greenlee, P.G.; Filippa, D.A.; Quimby, F.W.; Patnaik, A.K.; Calvano, S.E.; Matus, R.E.; Kimmel, M.; Hurvitz, A.I.; Lieberman, P.H. Lymphoma in dogs. A morphologic, immunologic and clinical study. Cancer 1990, 66, 480–490. [CrossRef] [PubMed]
- Henriques, J.; Felisberto, R.; Constantino-Casas, F.; Cabecadas, J.; Dobson, J. Peripheral blood cell ratios as prognostic factors in canine diffuse large B-cell lymphoma treated with CHOP protocol. Vet. Comp. Oncol. 2021, 19, 242–252. [CrossRef] [PubMed]
- Higginbotham, M.L.; McCaw, D.L.; Roush, J.K.; Nietfeld, J.C.; Wilkerson, M.J.; Reeds, K.; Burr, D. Intermittent Single-Agent Doxorubicin for the Treatment of Canine B-Cell Lymphoma. J. Am. Anim. Hosp. Assoc. 2013, 49, 357–362. [CrossRef]
- Keller, E.T.; Macewen, E.G.; Rosenthal, R.C.; Helfand, S.C.; Fox, L.E. Evaluation of prognostic factors and sequential combination chemotherapy with doxorubicin for canine lymphoma. J. Vet. Intern. Med. 1993, 7, 289–295. [CrossRef]
- Kessler, M.; Kandel, B. Chemotherapy of malignant lymphoma in dogs. Results and experiences with the “Hofheim”-protocol in 57 cases. Kleintierpraxis 2004, 49, 349–358.
- Khanna, C.; Lund, E.M.; Redic, K.A.; Hayden, D.W.; Bell, F.W.; Goulland, E.L.; Klausner, J.S. Randomized controlled trial of doxorubicin versus dactinomycin in a multiagent protocol for treatment of dogs with malignant lymphoma. J. Am. Vet. Med. Assoc. 1998, 213, 985– 990. [PubMed]
- Lee, J.-J.; Liao, A.T.; Wang, S.-L. L-Asparaginase, Doxorubicin, Vincristine, and Prednisolone (LHOP) Chemotherapy as a First-Line Treatment for Dogs with Multicentric Lymphoma. Animals 2021, 11, 2199. [CrossRef]
- Lori, J.C.; Stein, T.J.; Thamm, D.H. Doxorubicin and cyclophosphamide for the treatment of canine lymphoma: A randomized, placebo- controlled study. Vet. Comp. Oncol. 2010, 8, 188–195. [CrossRef]
- Lucas, S.R.R.; Maranhao, R.C.; Guerra, J.L.; Coelho, B.M.P.; Barboza, R.; Pozzi, D.H.B. Pilot clinical study of carmustine associated with a lipid nanoemulsion in combination with vincristine and prednisone for the treatment of canine lymphoma. Vet. Comp. Oncol. 2015, 13, 184– 193. [CrossRef]
- MacDonald, V.S.; Thamm, D.H.; Kurzman, I.D.; Turek, M.M.; Vail, D.M. Does L-asparaginase influence efficacy or toxicity when added to a standard CHOP protocol for dogs with lymphoma? J. Vet. Intern. Med. 2005, 19, 732–736. [CrossRef]
- Macewen, E.G.; Hayes, A.A.; Mooney, S.; Patnaik, A.; Kurzman, I.; Hardy, W.D. Levamisole as adjuvant to chemotherapy for canine lymphosarcoma. J. Biol. Response Modif. 1985, 4, 427–433.
- Macewen, E.G.; Rosenthal, R.C.; Fox, L.E.; Loar, A.S.; Kurzman, I.D. Evaluation of L-asparaginase:Polyethylene glycol conjugate versus native L-asparaginase combined with chemotherapy. A randomized double-blind study in canine lymphoma. J. Vet. Intern. Med. 1992, 6, 230– 234. [CrossRef] [PubMed]
- Marconato, L.; Bonfanti, U.; Stefanello, D.; Lorenzo, M.R.; Romanelli, G.; Comazzi, S.; Zini, E. Cytosine arabinoside in addition to VCAA-based protocols for the treatment of canine lymphoma with bone marrow involvement: Does it make the difference? Vet. Comp. Oncol. 2008, 6, 80–89. [CrossRef] [PubMed]
- Merlo, A.; Gagliano Rezende, B.C.; Franchini, M.L.; Nunes Simoes, D.M.; Ricci Lucas, S.R. Serum C-reactive protein concentrations in dogs with multicentric lymphoma undergoing chemotherapy. J. Am. Vet. Med. Assoc. 2007, 230, 522–526. [CrossRef] [PubMed]
- Moore, A.S.; Ogilvie, G.K.; Ruslander, D.; Rand, W.S.; Cotter, S.M.; Getzy, D.M.; Lheureux, D.A.; Dennis, R.A. Evaluation of mitoxantrone for the treatment of lymphoma in dogs. J. Am. Vet. Med. Assoc. 1994, 204, 1903–1905. [PubMed]
- Morgan, E.; O’Connell, K.; Thomson, M.; Griffin, A. Canine T cell lymphoma treated with lomustine, vincristine, procarbazine, and prednisolone chemotherapy in 35 dogs. Vet. Comp. Oncol. 2018, 16, 622–629. [CrossRef] [PubMed]
- Morris, J.S.; Dunn, J.K.; Dobson, J.M. Canine lymphoid leukaemia and lymphoma with bone marrow involvement: A review of 24 cases. J. Small Anim. Pract. 1993, 34, 72–79. [CrossRef]
- Mutz, M.; Boudreaux, B.; Kearney, M.; Stroda, K.; Gaunt, S.; Shiomitsu, K. Prognostic value of baseline absolute lymphocyte concentration and neutrophil/lymphocyte ratio in dogs with newly diagnosed multi-centric lymphoma. Vet. Comp. Oncol. 2015, 13, 337–347. [CrossRef]
- Myers, N.C.; Moore, A.S.; Rand, W.M.; Gliatto, J.; Cotter, S.M. Evaluation of a multidrug chemotherapy protocol (ACOPA III) in dogs with lymphoma. J. Vet. Intern. Med. 1997, 11, 333–339.
- Nerschbach, V.; Eberle, N.; Joetzke, A.E.; Hoeinghaus, R.; Hungerbuehler, S.; Mischke, R.; Nolte, I.; Betz, D. Splenic and hepatic ultrasound and cytology in canine lymphoma: Effects of findings on stage migration and assessment of prognosis. Vet. Comp. Oncol. 2016, 14, 82–93. [CrossRef]
- Ogilvie, G.K.; Atwater, S.W.; Ciekot, P.A.; Bergman, P.J.; Henkel, S.; Walters, L.M. Prevalence of anaphylaxis associated with the intramuscular administration of L-asparaginase to 81 dogs with cancer: 1989–1991. J. Am. Anim. Hosp. Assoc. 1994, 30, 62–65.
- Olgilvie, G.K.; Vail, D.M.; Klain, M.K.; Powers, B.E.; Dickinson, K. Weekly adminstration of low-dose doxorubicin for treatment of malignant lymphoma in dogs. J. Am. Vet. Med. Assoc. 1991, 198, 1762–1764.
- Ossowska, M.; Teske, E.; Beirens-van Kuijk, L.; Zandvliet, M.; de Vos, J.P. Treatment of multicentric or cranial mediastinal high-grade T-cell lymphoma in dogs with a first-line CCNU-L(-chlorambucil)-CHOP protocol. Vlaams Diergeneeskd. Tijdschr. 2016, 85, 275–284. [CrossRef]
- Poggi, A.; Miniscalco, B.; Morello, E.; Gattino, F.; Delaude, A.; Poschetto, L.F.; Aresu, L.; Gelain, M.E.; Martini, V.; Comazzi, S.; et al. Prognostic
significance of Ki67 evaluated by flow cytometry in dogs with high-grade B-cell lymphoma. Vet. Comp. Oncol. 2017, 15, 431–440.
[CrossRef] [PubMed]
- Postorino, N.C.; Susaneck, S.J.; Withrow, S.J.; Macy, D.W.; Harris, C. Single agent therapy with adriamycin for canine lymphosar- coma. J. Am.
Anim. Hosp. Assoc. 1989, 25, 221–225.
- Rebhun, R.B.; Kent, M.S.; Borrofka, S.A.E.B.; Frazier, S.; Skorupski, K.; Rodriguez, C.O. CHOP chemotherapy for the treatment of canine
multicentric T-cell lymphoma. Vet. Comp. Oncol. 2011, 9, 38–44. [CrossRef]
- Sauerbrey, M.L.; Mullins, M.N.; Bannink, E.O.; Van Dorp, T.E.R.; Kaneene, J.B.; Obradovich, J.E. Lomustine and prednisone as a first-line
treatment for dogs with multicentric lymphoma: 17 cases (2004–2005). J. Am. Vet. Med. Assoc. 2007, 230, 1866–1869. [CrossRef]
- Siedlecki, C.T.; Kass, P.H.; Jakubiak, M.J.; Dank, G.; Lyons, J.; Kent, M.S. Evaluation of an actinomycin-D-containing combination
chemotherapy protocol with extended maintenance therapy for canine lymphoma. Can. Vet. J. -Rev. Vet. Can. 2006, 47, 52–59.
- Teske, E.; Rutteman, G.R.; Vanheerde, P.; Misdorp, W. Polyethylene glycol-L-asparaginase versus native L-asparaginase in canine non-
Hodgkins-lymphoma. Eur. J. Cancer 1990, 26, 891–895. [CrossRef]
- Thamm, D.H.; Vail, D.M.; Post, G.S.; Fan, T.M.; Phillips, B.S.; Axiak-Bechtel, S.; Elmslie, R.S.; Klein, M.K.; Ruslander, D.A. Alternating
Rabacfosadine/Doxorubicin: Efficacy and Tolerability in Naive Canine Multicentric Lymphoma. J. Vet. Intern. Med. 2017, 31, 872–878.
[CrossRef]
- Todd, J.; Thomas, P.; Nguyen, S. Cyclophosphamide and prednisolone for chemotherapy naive B cell multicentric lymphoma in dogs: 32
cases (2017–2021). J. Small Anim. Pract. 2021, 63, 52–55. [CrossRef] [PubMed]
- Valerius, K.D.; Ogilvie, G.K.; Mallinckrodt, C.H.; Getzy, D.M. Doxorubicin alone or in combination with asparaginase, followed by
cyclophosphamide, vincristine, and prednisone for treatment of multicentric lymphoma in dogs: 121 cases (1987–1995). J. Am. Vet. Med.
Assoc. 1997, 210, 512–516. [PubMed]
- Veluvolu, S.; Pellin, M.; Vos, N. Evaluation of neutrophilia as a prognostic factor in dogs with multicentric lymphoma treated with a
cyclophosphamide, doxorubicin, vincristine, and prednisone based chemotherapy protocol. J. Am. Vet. Med. Assoc. 2021, 259, 494–502.
[CrossRef] [PubMed]
- Wang, S.L.; Lee, J.J.; Liao, A.T. Comparison of efficacy and toxicity of doxorubicin and mitoxantrone in combination chemotherapy for canine
lymphoma. Can. Vet. J.-Rev. Vet. Can. 2016, 57, 271–276.
- Zandvliet, M.; Rutteman, G.R.; Teske, E. Prednisolone inclusion in a first-line multidrug cytostatic protocol for the treatment of canine
lymphoma does not affect therapy results. Vet. J. 2013, 197, 656–661. [CrossRef]
- Zenker, I.; Meichner, K.; Steinle, K.; Kessler, M.; Hirschberger, J. Thirteen-week dose-intensifying simultaneous combination
chemotherapy protocol for malignant lymphoma in dogs. Vet. Rec. 2010, 167, 744–748. [CrossRef]
- Alvarez, F.J.; Kisseberth, W.C.; Gallant, S.L.; Couto, C.G. Dexamethasone, melphalan, actinomycin D, cytosine arabinoside (DMAC) protocol
for dogs with relapsed lymphoma. J. Vet. Intern. Med. 2006, 20, 1178–1183. [CrossRef]
- Bannink, E.O.; Sauerbrey, M.L.; Mullins, M.N.; Hauptman, J.G.; Obradovich, J.E. Actinomycin D as rescue therapy in dogs with relapsed or
resistant lymphoma: 49 cases (1999–2006). J. Am. Vet. Med. Assoc. 2008, 233, 446–451. [CrossRef]
- Calvert, C.A.; Leifer, C.E. Doxorubicin for treatment of canine lymphosarcoma after development of resistance to combination
chemotherapy. J. Am. Vet. Med. Assoc. 1981, 179, 1011–1012.
- Fahey, C.E.; Milner, R.J.; Barabas, K.; Lurie, D.; Kow, K.; Parfitt, S.; Lyles, S.; Clemente, M. Evaluation of the University of Florida lomustine,
vincristine, procarbazine, and prednisone chemotherapy protocol for the treatment of relapsed lymphoma in dogs: 33 cases (2003–2009). J.
Am. Vet. Med. Assoc. 2011, 239, 209–215. [CrossRef]
- Gillem, J.; Giuffrida, M.; Krick, E. Efficacy and toxicity of carboplatin and cytarabine chemotherapy for dogs with relapsed or refractory
lymphoma (2000–2013). Vet. Comp. Oncol. 2017, 15, 400–410. [CrossRef] [PubMed]
- LeBlanc, A.K.; Mauldin, G.E.; Milner, R.J.; LaDue, T.A.; Mauldin, G.N.; Bartges, J.W. Efficacy and toxicity of BOPP and LOPP chemotherapy
for the treatment of relapsed canine lymphoma. Vet. Comp. Oncol. 2006, 4, 21–32. [CrossRef] [PubMed]
- Lenz, J.A.; Robat, C.S.; Stein, T.J. Vinblastine as a second rescue for the treatment of canine multicentric lymphoma in 39 cases (2005 to
2014). J. Small Anim. Pract. 2016, 57, 429–434. [CrossRef] [PubMed]
- Lucroy, M.D.; Phillips, B.S.; Kraegel, S.A.; Simonson, E.R.; Madewell, B.R. Evaluation of single-agent mitoxantrone as chemother- apy for
relapsing canine lymphoma. J. Vet. Intern. Med. 1998, 12, 325–329. [CrossRef]
- Mastromauro, M.; Suter, S.; Hauck, M.; Hess, P. Oral melphalan for the treatment of relapsed canine lymphoma. Vet. Comp. Oncol.
2018, 16, E123–E129. [CrossRef]
- Parsons-Doherty, M.; Poirier, V.J.; Monteith, G. The efficacy and adverse event profile of dexamethasone, melphalan, actinomycin D, and
cytosine arabinoside (DMAC) chemotherapy in relapsed canine lymphoma. Can. Vet. J.-Rev. Vet. Can. 2014, 55, 175–180.
- Saba, C.; Vickery, K.; Clifford, C.; Burgess, K.; Phillips, B.; Vail, D.; Wright, Z.; Morges, M.; Fan, T.; Thamm, D. Rabacfosadine for relapsed canine B-cell lymphoma: Efficacy and adverse event profiles of 2 different doses. Vet. Comp. Oncol. 2018, 16, E76–E82. [CrossRef]
- Saba, C.F.; Hafeman, S.D.; Vail, D.M.; Thamm, D.H. Combination Chemotherapy with Continuous l-Asparaginase, Lomustine, and Prednisone for Relapsed Canine Lymphoma. J. Vet. Intern. Med. 2009, 23, 1058–1063. [CrossRef]
- Smith, A.A.; Lejeune, A.; Kow, K.; Milner, R.J.; Souza, C.H.M. Clinical Response and Adverse Event Profile of Bleomycin Chemotherapy for Canine Multicentric Lymphoma. J. Am. Anim. Hosp. Assoc. 2017, 53, 128–134. [CrossRef]
150.van Vechten, M.; Helfand, S.C.; Jeglum, K.A. Treatment of relapsed canine lymphoma with doxorubicin and dacarbazine. J. Vet. Intern. Med. 1990, 4, 187–191. [CrossRef]
- Alexandrakis, I.; Tuli, R.; Ractliffe, S.C.; Tappin, S.W.; Foale, R.D.; Roos, A.; Slater, K.J. Utility of a multiple serum biomarker test to monitor remission status and relapse in dogs with lymphoma undergoing treatment with chemotherapy. Vet. Comp. Oncol. 2017, 15, 6–17. [CrossRef] [PubMed]
- Boye, P.; Serres, F.; Marescaux, L.; Hordeaux, J.; Bouchaert, E.; Gomes, B.; Tierny, D. Dose escalation study to evaluate safety, tolerability and efficacy of intravenous etoposide phosphate administration in 27 dogs with multicentric lymphoma. PLoS ONE 2017, 12, e0177486. [CrossRef] [PubMed]
- Brodsky, E.M.; Maudlin, G.N.; Lachowicz, J.L.; Post, G.S. Asparaginase and MOPP Treatment of Dogs with Lymphoma. J. Vet. Intern. Med. 2009, 23, 578–584. [CrossRef] [PubMed]
- Childress, M.O.; Fulkerson, C.M.; Lahrman, S.A.; Weng, H.Y. Inter- and intra-rater reliability of calliper-based lymph node measurement in dogs with peripheral nodal lymphomas. Vet. Comp. Oncol. 2016, 14, 74–81. [CrossRef] [PubMed]
- Hohenhaus, A.E.; Matus, R.E. Etoposide (VP-16). Retrospective analysis of treatment in 13 dogs with lymphoma. J. Vet. Intern. Med. 1990, 4, 239–241. [CrossRef]
- Ogilvie, G.K.; Richardson, R.C.; Curtis, C.R.; Withrow, S.J.; Reynolds, H.A.; Norris, A.M.; Henderson, R.A.; Klausner, J.S.; Fowler, J.D.; McCaw, D. Acute and short-term toxicoses associated with the administration of doxorubicin to dogs with malignant tumors. J. Am. Vet. Med. Assoc. 1989, 195, 1584–1587. [PubMed]
- Carter, R.F.; Harris, C.K.; Withrow, S.J.; Valli, V.E.O.; Susaneck, S.J. Chemotherapy of canine lymphoma wiht histopathological correlation- doxorubicin alone compared to COP as 1st treatment regimen. J. Am. Anim. Hosp. Assoc. 1987, 23, 587–598.
- Cotter, S.M. Treatment of lymphoma and leukemia with cyclophosphamide, vincristine, and prednisone. 1. Treatment of dogs. J. Am. Anim. Hosp. Assoc. 1983, 19, 159–165.
- Frankhouse, K.A.; Rout, E.D.; Hughes, K.L.; Labadie, J.D.; Yoshimoto, J.A.; Lana, S.E.; Avery, P.R.; Avery, A.C. An Aggressive CD4−CD8− T-cell Neoplasm in Young English Bulldogs. Vet. Comp. Oncol. 2021, 20, 416–426. [CrossRef]
- Gavazza, A.; Sacchini, F.; Lubas, G.; Gugliucci, B.; Valori, E. Clinical, laboratory, diagnostic and prognostic aspects of canine lymphoma: A retrospective study. Comp. Clin. Pathol. 2009, 18, 291–299. [CrossRef]
- Gentilini, F.; Turba, M.E.; Forni, M. Retrospective monitoring of minimal residual disease using hairpin-shaped clone specific primers in B- cell lymphoma affected dogs. Vet. Immunol. Immunopathol. 2013, 153, 279–288. [CrossRef] [PubMed]
- Gray, K.N.; Raulston, G.L.; Gleiser, C.A.; Jardine, J.H. Histologic classificatoin as an indication of therapeutic response in malignant- lymphoma of dogs. J. Am. Vet. Med. Assoc. 1984, 184, 814–817. [PubMed]
- Hahn, K.A.; Richardson, R.C.; Teclaw, R.F.; Cline, J.M.; Carlton, W.W.; Denicola, D.B.; Bonney, P.L. Is maintenance chemotherapy appropriate for the management of canine malignant-lymphoma? J. Vet. Intern. Med. 1992, 6, 3–10. [CrossRef] [PubMed]
- Jagielski, D.; Lechowski, R.; Hoffmann-Jagielska, M.; Winiarczyk, S. A Retrospective Study of the Incidence and Prognostic Factors of Multicentric Lymphoma in Dogs (1998–2000). J. Vet. Med. Ser. A 2002, 49, 419–424. [CrossRef] [PubMed]
- Jeffreys, A.B.; Knapp, D.W.; Carlton, W.W.; Thomas, R.M.; Bonney, P.L.; Lucroy, M.D. Influence of asparaginase on a combination chemotherapy protocol for canine multicentric lymphoma. J. Am. Anim. Hosp. Assoc. 2005, 41, 221–226. [CrossRef] [PubMed]
- Lautscham, E.M.; Kessler, M.; Ernst, T.; Willimzig, L.; Neiger, R. Comparison of a CHOP-LAsp-based protocol with and without maintenance for canine multicentric lymphoma. Vet. Rec. 2017, 180, 303. [CrossRef]
- Macewen, E.G.; Hayes, A.A.; Matus, R.E.; Kurzman, I. Evaluation of some prognostic factors for advanced multicentric lymphosarcoma in the dog—147 cases (1978–1981). J. Am. Vet. Med. Assoc. 1987, 190, 564–568.
- Maddison, J.E.; Peaston, A.; Church, D.B. Treatment of 42 cases of canine lymphosarcoma with combination chemotherapy— 1987–1993. Aust. Vet. Pract. 1994, 24, 94–101.
- Romano, F.R.; Heinze, C.R.; Barber, L.G.; Mason, J.B.; Freeman, L.M. Association between Body Condition Score and Cancer Prognosis in Dogs with Lymphoma and Osteosarcoma. J. Vet. Intern. Med. 2016, 30, 1179–1186. [CrossRef]
- Rout, E.D.; Labadie, J.D.; Yoshimoto, J.A.; Avery, P.R.; Curran, K.M.; Avery, A.C. Clinical outcome and prognostic factors in dogs with B-cell chronic lymphocytic leukemia: A retrospective study. J. Vet. Intern. Med. 2021, 35, 1918–1928. [CrossRef]
- Sorenmo, K.; Overley, B.; Krick, E.; Ferrara, T.; LaBlanc, A.; Shofer, F. Outcome and toxicity associated with a dose-intensified, maintenance-free CHOP-based chemotherapy protocol in canine lymphoma: 130 cases. Vet. Comp. Oncol. 2010, 8, 196–208. [CrossRef] [PubMed]
- Wilson-Robles, H.; Budke, C.M.; Miller, T.; Dervisis, N.; Novosad, A.; Wright, Z.; Thamm, D.H.; Vickery, K.; Burgess, K.; Childress, M.; et al. Geographical differences in survival of dogs with non-Hodgkin lymphoma treated with a CHOP based chemotherapy protocol. Vet. Comp. Oncol. 2017, 15, 1564–1571. [CrossRef] [PubMed]
Vet. Sci. 2023, 10, 342 23 of 24
- Wolfesberger, B.; Tonar, Z.; Fuchs-Baumgartinger, A.; Walter, I.; Skalicky, M.; Witter, K.; Thalhammer, J.G.; Pagitz, M.; Kleiter, M. Angiogenic markers in canine lymphoma tissues do not predict survival times in chemotherapy treated dogs. Res. Vet. Sci. 2012, 92, 444–450. [CrossRef] [PubMed]
- Childress, M.O.; Ramos-Vara, J.A.; Ruple, A. A randomized controlled trial of the effect of prednisone omission from a multidrug chemotherapy protocol on treatment outcome in dogs with peripheral nodal lymphomas. J. Am. Vet. Med. Assoc. 2016, 249, 1067–1078. [CrossRef] [PubMed]
- Zandvliet, M.; Teske, E.; Chapuis, T.; Fink-Gremmels, J.; Schrickx, J.A. Masitinib reverses doxorubicin resistance in canine lymphoid cells by inhibiting the function of P-glycoprotein. J. Vet. Pharmacol. Ther. 2013, 36, 583–587. [CrossRef]
- Avery, P.R.; Burton, J.; Bromberek, J.L.; Seelig, D.M.; Elmslie, R.; Correa, S.; Ehrhart, E.J.; Morley, P.S.; Avery, A.C. Flow Cytometric Characterization and Clinical Outcome of CD4 T Cell Lymphoma in Dogs. J. Vet. Intern. Med. 2014, 28, 538–546. [CrossRef]
- Ogilvie, G.K.; Obradovich, J.E.; Elmslie, R.E.; Vail, D.M.; Moore, A.S.; Straw, R.C.; Dickinson, K.; Cooper, M.F.; Withrow, S.J. Efficacy of mitoxantrone against various neoplasms in dogs. J. Am. Vet. Med. Assoc. 1991, 198, 1618–1621. [PubMed]
- Ogilvie, G.K.; A Reynolds, H.; Richardson, R.C.; Withrow, S.J.; Norris, A.M.; Henderson, R.A.; Klausner, J.S.; Fowler, J.D.; McCaw,
D. Phase II evaluation of doxorubicin for treatment of various canine neoplasms. J. Am. Vet. Med. Assoc. 1989, 195, 1580–1582. - Chan, C.M.; Frimberger, A.E.; Moore, A.S. Incidence of sterile hemorrhagic cystitis in tumor-bearing dogs concurrently treated with oral metronomic cyclophosphamide chemotherapy and furosemide: 55 cases (2009–2015). J. Am. Vet. Med. Assoc. 2016, 249, 1408–1414. [CrossRef]
- Frank, J.D.; Reimer, S.B.; Kass, P.H.; Kiupel, M. Clinical outcomes of 30 cases (1997–2004) of canine gastrointestinal lymphoma. J. Am. Anim. Hosp. Assoc. 2007, 43, 313–321. [CrossRef]
- Marconato, L.; Stefanello, D.; Sabattini, S.; Comazzi, S.; Riondato, F.; Laganga, P.; Frayssinet, P.; Pizzoni, S.; Rouquet, N.; Aresu, L. Enhanced therapeutic effect of APAVAC immunotherapy in combination with dose-intense chemotherapy in dogs with advanced indolent B-cell lymphoma. Vaccine 2015, 33, 5080–5086. [CrossRef] [PubMed]
- Marconato, L.; Stefanello, D.; Valenti, P.; Bonfanti, U.; Comazzi, S.; Roccabianca, P.; Caniatti, M.; Romanelli, G.; Massari, F.; Zini, E. Predictors of long-term survival in dogs with high-grade multicentric lymphoma. J. Am. Vet. Med. Assoc. 2011, 238, 480–485. [CrossRef] [PubMed]
- Marconato, L.; Martini, V.; Stefanello, D.; Moretti, P.; Ferrari, R.; Comazzi, S.; Laganga, P.; Riondato, F.; Aresu, L. Periph- eral blood lymphocyte/monocyte ratio as a useful prognostic factor in dogs with diffuse large B-cell lymphoma receiving chemoimmunotherapy. Vet. J. 2015, 206, 226–230. [CrossRef] [PubMed]
- Sato, M.; Yamzaki, J.; Goto-Koshino, Y.; Takahashi, M.; Fujino, Y.; Ohno, K.; Tsujimoto, H. The prognostic significance of minimal residual disease in the early phases of chemotherapy in dogs with high-grade B-cell lymphoma. Vet. J. 2013, 195, 319–324. [CrossRef]
- Hahn, K.A.; Chan, T.C.K.; Morrison, W.B.; Hahn, E.A. High-performance liquid chromatographic analysis of doxorubicin and its metabolites in canine urine. J. Am. Anim. Hosp. Assoc. 1994, 30, 276–280.
- Kiupel, M.; Teske, E.; Bostock, D. Prognostic factors for treated canine malignant lymphoma. Vet. Pathol. 1999, 36, 292–300. [CrossRef]
- Lee, J.J.; Hughes, C.S.; Fine, R.L.; Page, R.L. P-glycoprotein expression in canine lymphoma—A relevant, intermediate model of multidrug
resistance. Cancer 1996, 77, 1892–1898. [CrossRef]
- Pinheiro, D.; Chang, Y.-M.; Bryant, H.; Sziadovits, B.; Daiessandri, T.; Davison, L.J.; Yallop, E.; Mills, E.; Leo, C.; Lara, A.; et al. Dissecting the
Regulatory Microenvironment of a Large Animal Model of Non-Hodgkin Lymphoma: Evidence of a Negative Prognostic Impact of
FOXP3(+) T Cells in Canine B Cell Lymphoma. PLoS ONE 2014, 9, e105027. [CrossRef]
- Rao, S.; Lana, S.; Eickhoff, J.; Marcus, E.; Avery, P.R.; Morley, P.S.; Avery, A.C. Class II Major Histocompatibility Complex Expression and Cell
Size Independently Predict Survival in Canine B-Cell Lymphoma. J. Vet. Intern. Med. 2011, 25, 1097–1105. [CrossRef]
- Vail, D.M.; Kisseberth, W.C.; Obradovich, J.E.; Moore, F.M.; London, C.A.; MacEwen, E.G.; Ritter, M.A. Assessment of potential doubling time (T-pot), argyrophilic nucleolar organizer regions (AgNOR), and proliferating cell nuclear antigen (PCNA) as predictors of therapy
response in canine non-Hodgkin’s lymphoma. Exp. Hematol. 1996, 24, 807–815.
- von Euler, H.; Einarsson, R.; Olsson, U.; Lagerstedt, A.S.; Eriksson, S. Serum thymidine kinase activity in dogs with malignant lymphoma: A
potent marker for prognosis and monitoring the disease. J. Vet. Intern. Med. 2004, 18, 696–702. [CrossRef] [PubMed]
- Williams, M.; Avery, A.; Lana, S.; Hillers, K.; Bachand, A.; Avery, P. Canine lymphoproliferative disease characterized by lymphocytosis:
Immunophenotypic markers of prognosis. J. Vet. Intern. Med. 2008, 22, 596–601. [CrossRef] [PubMed]
- Huang, W.H.; Lee, J.J.; Liao, A.T.; Wang, S.L. Paraneoplastic Syndrome as a Prognostic Factor in Dogs with Multicentric Lymphoma. Int. J.
Appl. Res. Vet. Med. 2020, 18, 131–141.
- Barber, L.G.; Weishaar, K.M. Criteria for designation of clinical substage in canine lymphoma: A survey of veterinary oncologists.
Vet. Comp. Oncol. 2016, 14, 32–39. [CrossRef] [PubMed]
- Hahn, K.A.; Richardson, R.C.; Hahn, E.A.; Chrisman, C.L. Diagnostic and prognostic importance of chromosomal aberrations identified in
61 dogs with lymphosarcoma. Vet. Pathol. 1994, 31, 528–540. [CrossRef]
Vet. Sci. 2023, 10, 342 24 of 24
- Boyé, P.; Serres, F.; Floch, F.; Fournel-Fleury, C.; Tierny, D. Prognostic value of pretreatment plasma D-dimer level in dogs with intermediate to high-grade non-Hodgkin lymphoma. Vet. Comp. Oncol. 2021, 19, 44–52. [CrossRef]
- Miller, A.G.; Morley, P.S.; Rao, S.; Avery, A.C.; Lana, S.E.; Olver, C.S. Anemia Is Associated with Decreased Survival Time in Dogs with Lymphoma. J. Vet. Intern. Med. 2009, 23, 116–122. [CrossRef]
Sorumluluk Reddi/Yayıncının Notu: Tüm yayınlarda yer alan ifadeler, görüşler ve veriler yalnızca yazar(lar)a ve katkıda bulunan(lar)a aittir, MDPI ve/veya editör(ler)e ait değildir. MDPI ve/veya editör(ler), içerikte atıfta bulunulan herhangi bir fikir, yöntem, talimat veya üründen kaynaklanan insanlara veya mallara gelebilecek herhangi bir zarar konusunda sorumluluk kabul etmeyecektir.