| Kedi Tıbbı ve Cerrahisi Dergisi Erişime Açık Raporlar 1–7 © Yazar(lar) 2023 Makale yeniden kullanıma ilişkin yönergeler: sagepub.com/journals-permissions DOI: 10.1177/20551169231160227 journals.sagepub.com/home/jfmsopenreports Bu makale JFMS Erişime Açık Raporlar’da yayınlanmak üzere Avrupa Editörlük Ofisi (ISFM) tarafından değerlendirilmiş ve işleme alınmıştır. 1Fitzpatrick Ortopedi ve Nöroloji Sevk Merkezi, Eashing, Birleşik Krallık İletişim: Jordina Caldero Carrete MRCVS, Küçük Hayvan Eğitim Hastanesi, Veteriner Bilimleri Enstitüsü, Liverpool Üniversitesi, Leahurst Kampüsü, Chester High Road, Neston CH64 7TE, Birleşik Krallık Email: jordina.caldero@hotmail.com Creative Commons Ticari Olmayan CC BY-NC: Bu makale, orijinal çalışmanın SAGE ve Açık Erişim sayfalarında (https://us.sagepub.com/en-us/nam/open-access-at-sage) belirtildiği şekilde atfedilmesi koşuluyla, çalışmanın ticari olmayan kullanımına, çoğaltılmasına ve dağıtılmasına izin veren Creative Commons Attribution-NonCommercial 4.0 Lisansı (https://creativecommons.org/licenses/by-nc/4.0/) koşulları altında dağıtılmaktadır.). |
ÖzetVaka Raporu 10 yaşında kısırlaştırılmış erkek domestic shorthair kedi 5 aylık ilerleyici non-ambulatuar (yürüyemeyen) paraparezi öyküsü ile getirildi. İlk vertebral kolon radyografilerinde L2-L3 ekspansil osteolitik lezyon saptandı. Spinal MRG’de ikinci lomber vertebranın kaudal laminasını, kaudal artiküler proseslerini ve sağ pedikülünü etkileyen iyi sınırlı, kompresif ekspansil ekstradural kitle lezyonu görüldü. Kitle T2 ağırlıklı görüntülerde hipointens/izointens, T1 ağırlıklı görüntülerde izointens ve gadolinyum uygulamasından sonra hafif homojen kontrastlanma gösterdi. Kalan nöroaksisin MRG’si ve ioversol kontrastlı boyun, toraks ve batın BT’sinde ek neoplastik odak saptanmadı. Lezyon, dorsal L2-L3 laminektomi yoluyla, artiküler proses eklemleri ve pediküller de dahil olmak üzere en bloc rezeksiyonla çıkarıldı. Vertebral stabilizasyon L1, L2, L3 ve L4 pedikülleri içine yerleştirilen titanyum vidalar ve polimetilmetakrilat kemik çimentosu ile gerçekleştirildi. Histopatolojide, saptanabilir hücresel atipi veya mitotik aktivite olmaksızın iğsi ve çok çekirdekli dev hücrelerden oluşan osteoprodüktif bir neoplazm görüldü. İmmünohistokimyasal değerlendirmede, osterix, iyonize kalsiyum bağlayıcı adaptör molekül 1 ve vimentin işaretlemesi gözlenmiştir. Klinik ve histolojik özelliklere dayanarak, büyük olasılıkla dev hücreli kemik tümörü olduğu düşünülmüştür. Ameliyat sonrası 3 ve 24. haftalarda yapılan kontrollerde belirgin nörolojik iyileşme görüldü. Ameliyat sonrası 6. ayda çekilen tüm vücut BT ile stabilizasyon yapısının instabil olduğu ancak lokal nüks veya metastaz olmadığı görüldü. Vakanın klinik önemi ve yeni bilgiler Bu nadir neoplazmın görüntüleme bulguları, cerrahi tedavisi, histopatolojisi, immünohistokimyası ve sonucu sunulmuştur. Anahtar Kelimeler: Dev hücreli kemik tümörü; nöroloji; cerrahi tedavi; histopatoloji; immünohistokimya; dev hücreli osteosarkom Kabul Tarihi: 9 Şubat 2023 |
Vakaya ilişkin bilgiler10 yaşında kısırlaştırılmış erkek evcil shorthair kedi, 5 aylık ambulatuar paraparezi öyküsü ile getirildi ve sevkten 2 hafta önce non-ambulatuar parapareziye ilerledi. Sevk eden veteriner hekim tarafından çekilen vertebral kolon radyografilerinde L2-L3 eklem faset ekleminde ekspansil osteolitik lezyon tespit edildi (Şekil 1a). Kedi spinal artrit şüphesiyle meloksikam (0,05 mg/kg q24h PO [Loxicom; Norbrook]) ve frunevetmab (1 mg/kg SC q28 gün [Solensia; Zoetis]) ile tedavi edildi ve kedinin aktivite seviyesi başlangıçta arttı. Sevk merkezimizde yapılan genel muayenede herhangi bir bulgu yoktu. Nörolojik muayenede hastanın mental ve kraniyal sinir muayenesi normaldi. Kedide postüral reaksiyonlarda gecikme, normal geri çekilme ve her iki pelvik ekstremitede hiperaktif patellar refleksler ile ambulatuvar olmayan paraparetik bir durum vardı. Lomber hiperestezi tespit edildi. Nörolojik bulgular T3-L3 miyelopati ile uyumluydu. Radyografik bulgulara dayanarak, vertebral neoplazm (primer veya metastatik) en olası ayırıcı tanı olarak kabul edildi. Hematolojik parametrelerde herhangi bir bulgu yoktu. Serum biyokimyasında sadece hafif hiperglisemi (9,66 mmol/l; referans aralığı [RI] 3,95-8,84) saptandı. İleri görüntüleme endikasyonu vardı. Genel anestezi altında 1,5 Tesla MRI ünitesi (Siemens Symphony Tim sistemi) kullanılarak torakolomber omurga MRI’ı çekildi. L2 laminasının kaudal yarısını, kaudal eklem çıkıntılarını ve sağ pedikülü etkileyen, abaksiyel olarak genişleyen, iyi tanımlanmış, ekspansil ekstradural tek bir kitle lezyonu (1,2 yükseklik × 1,4 uzunluk × 1 cm genişlik) vardı. Kitle vertebral kanala uzanarak şiddetli sağ dorsolateral spinal kord basısına yol açıyordu. Bu seviyede fokal, kötü tanımlanmış intramedüller T2 ağırlıklı hiperintensite vardı. Kitle heterojen bir görünüme sahipti ve T2 ağırlıklı görüntülerde hipointens/izointens ve T1 ağırlıklı sekanslarda izointens idi ve gadolinyum enjeksiyonu (0,1 mmol/kg [Dotarem; Guerbet Laboratories]) sonrası hafif homojen kontrast artışı vardı (Şekil 1b,c). Diğer nöroaksis görüntülerinde başka anormallik saptanmadı. |
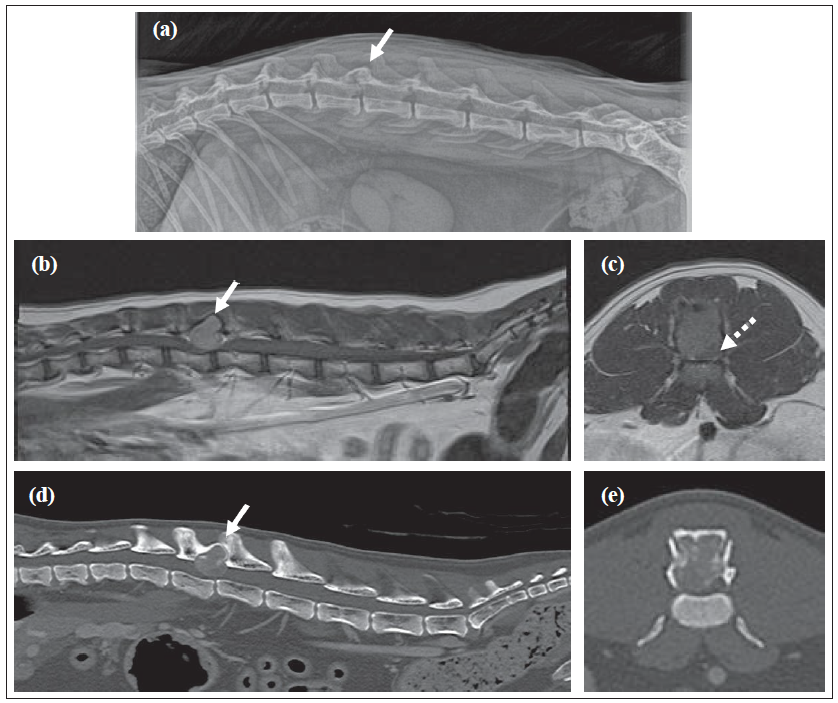
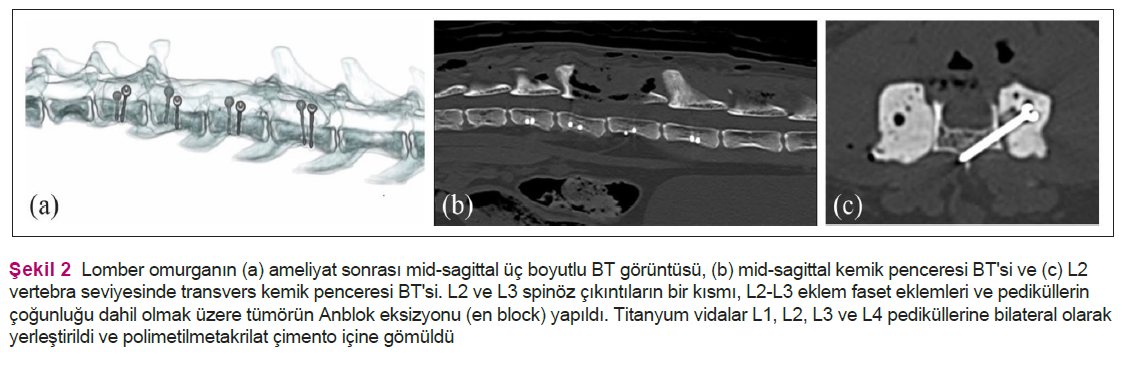
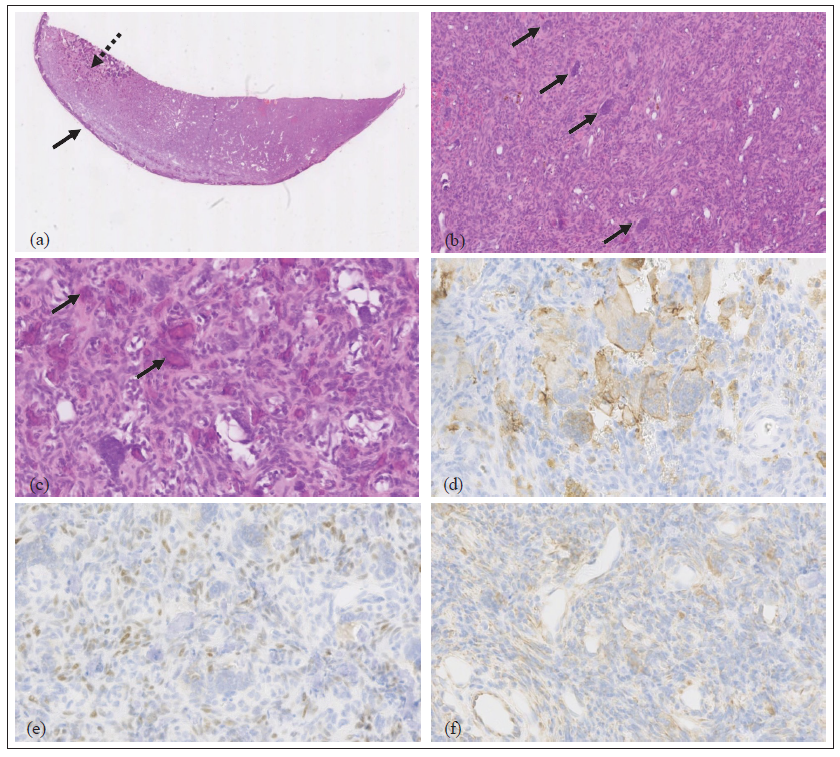
Evreleme amacıyla boyun, toraks ve karın bölgesine ioversol kontrastlı (2 ml/kg [Optiray 300; Guerbet Laboratories]) BT (160 kesitli Aquilion Prime; Toshiba) uygulandı. MRG bulgularıyla uyumlu olarak BT, L2’de güçlü ioversol kontrast tutulumu gösteren agresif bir osteolitik lezyon tespit etti (Şekil 1d,e). L1 ve L2 vertebraları arasında hafif spondiloz deformans mevcuttu. Klinik olarak anlamlı olmadığı düşünülen diğer BT bulguları arasında multifokal anesteziye bağlı atelektazi, benign bir süreçle uyumlu dalak parankim değişiklikleri ve bilateral dirsek osteoartrozu vardı. Başka neoplastik odak yoktu. Vertebral neoplazmların ayırıcı tanısı arasında osteosarkom (OSA), fibrosarkom, kondrosarkom, hemanjiyosarkom, plazma hücreli tümörler (multipl miyelom, plazmasitom), histiyositik sarkom ve lenfoma yer almıştır. Soliter veya anevrizmal kemik kistleri gibi iyi huylu bir kemik tümörü tamamen ihtimal dışı bırakılamamıştır. Hasta sahibi cerrahi tedaviyi seçmiştir. Ameliyat öncesi cerrahi planlama, üç boyutlu slicer yazılımı (Surgical Planning Lab, Harvard Medical School, Harvard University; www.slicer.org) kullanılarak kemik koridorları içinde vida oryantasyonu ve yerleştirilmesi belirlenerek yapıldı. L1-L4 vertebralarına orta hat dorsal yaklaşımı yapıldı. Kitle en bloc rezeksiyon ile çıkarıldı. L2 spinöz prosesin kaudal kısmından L3 spinöz prosesin kaudaline, L2-L3 eklem faset eklemlerinin ventrolateraline uzanan bir dorsal laminektomi yapıldı.1 Vertebral stabilizasyon, L1, L2, L3 ve L4 pediküllerine bilateral olarak yerleştirilen ve polimetilmetakrilat (PMMA) çimento içine gömülen 1,5 mm titanyum vidalar kullanılarak gerçekleştirildi. İmplant giriş noktaları, üç boyutlu rekonstrüksiyonun ameliyat öncesi cerrahi planlama video kaydından görsel yaklaşımla tahmin edildi ve delme yönü, eğim açılarının önceden ölçülmüş sayısal değerleri ve osteotomi kama göstergeleri ile yönlendirildi. Hemostaz Surgicel SNoW (Original Absorbable Hemostat; Ethicon) kullanılarak kontrol edildi. Açıkta kalan omurilik lokal hemostatik ajan (Lyostypt; Braun) ile korunmuş ve rutin kapatma işlemi gerçekleştirilmiştir. Ameliyat sonrası BT, implantların doğru yerleştirildiğini ve tümörün makroskopik rezeksiyonunu gösterdi (Şekil 2). Kedi ameliyattan 5 gün sonra taburcu edildi ve taburcu edildiğinde orta derecede proprioseptif ataksi ile ambulatuvar paraparetikti. Kitlenin histopatolojik incelemesinde vertebral kemiği genişleten yoğun hücresel bir neoplazm görüldü. Çevresinde ince bir reaktif dokuma kemik örtüsü vardı ve neoplazma bunun içinde yer alıyordu. Neoplazma iki hücre popülasyonundan oluşuyordu: iğsi hücreler ve çok çekirdekli dev hücreler (Şekil 3a,b). İİğsi hücreler baskındı ve küçük damarları çevreleyen interwoven (sıkıca iç içe geçmiş) storiform bir paternde düzenlenmişti ve woven (lameller yapısı olmayan, iyi gelişmemiş, keçe tarzında kemik) mineralize kemiğin adaları ve ince trabekülleri ile multifokal olarak ilişkiliydi (Şekil 3c). İğsi hücreler belirgin nükleer atipi olmaksızın sadece hafif pleomorfizm göstermiştir. Çok çekirdekli dev hücreler seyrek veya yoğun bir şekilde dağılmıştı ve önemli atipi içermeyen çok sayıda (50’ye kadar) çekirdek içeriyordu. Her iki popülasyonda da 2,37 mm2’de (10 yüksek güçlü alana eşdeğer) birden az mitoz tespit edilmiştir. Vasküler invazyon tespit edilmemiştir. Bir histiyositik belirteç (iyonize kalsiyum bağlayıcı adaptör molekül 1 [Iba1]; monoklonal AIF19mouse anti-Iba1 [Merck Millipore]), genel bir mezenkimal belirteç (vimentin [monoklonal fare anti-vimentin, Klon V9; Dako]) ve osteo-blast spesifik bir transkripsiyon faktörü belirteci (osterix [poliklonal tavşan anti-Sp7/osterix; Abcam]) ile immünohistokimya yapılmıştır.2–7 Çok çekirdekli dev hücreler, monosit/makrofaj soyunu düşündüren Iba1 ile zayıf sito plazmik etiketlenme sergilemiştir (Şekil 3d). İğsi hücrelerin çoğu osterix ile nükleer etiketlenme göstermiş ve her iki hücre popülasyonu da vimentin ile sitoplazmik etiketlenme göstermiştir (Şekil 3e,f). Kombine histolojik ve immünohistokimyasal bulgulara dayanarak, ayırıcı teşhiste kemiğin dev hücreli tümörü (GHTTB) ve dev hücreli zengin OSA yer almıştır. Hücrelerin yumuşak morfolojisi, saptanabilir mitotik aktivitenin olmaması ve infiltratif büyümeden ziyade belirgin ekspansil büyüme paterni göz önüne alındığında, GHTB tercih edildi. |
Ameliyattan 3 hafta sonra yapılan tekrar muayenede, kedinin pelvik ekstremite ataksisi ile birlikte ambulatuvar paraparetik olduğu görülmüştür. Ameliyattan altı ay sonra, kedi açık hava aktivitelerine geri döndü ve zıplama yeteneği azalmış olsa da yaşam kalitesi iyiydi. Hasta hafif paraparezi ile ambulatuvar durumdaydı. Ameliyat sonrası tüm vücut BT, çok odaklı PMMA kırılması ve L2 implant gevşemesi ile gösterilen L1-L4 spinal stabilizasyon yapısının instabilitesini ortaya koydu. L2-L3’ün ventral/ventrolateral kenarları boyunca orta derecede periost reaksiyonu mevcuttu. Hastalık nüksü veya metastaz kanıtı yoktu. TartışmaBu makalede bir kedinin vertebrasında görülen bir GCTB bildirilmektedir. Diğer primer kemik tümörlerinin aksine, GKTB’ler genellikle uzun kemiklerin epifiz bölgesinden kaynaklanmaktadır.8 İnsanlarda, GKTB tüm primer kemik tümörlerinin yaklaşık %5’inden sorumludur ve tipik olarak femur, tibia ve radiusta yerleşir.9–13 Pelvik, sakral ve spinal GKTB’ler nadirdir.10,12,13 |

Dünya Sağlık Örgütü’nün 2020 tarihli yumuşak doku ve kemik tümörleri sınıflandırmasına göre GHTB, insanlarda lokal agresif davranış gösteren ve yüksek nüks oranına sahip iyi huylu bir tümörden orta derecede kötü huylu bir tümör sınıfına geçmiştir.14 Histolojik olarak iyi huylu pulmoner metastazlar insanlarda nadiren görülür (%1-9).13,15,16 Nadiren GHTB malign transformasyona uğrayabilir.11,17 GCTB’ler hayvanlarda nadiren görülür.18 Kedilerde GCTB’ler radius ve tibianın orta diyafizinde,4,19 distal ulna ve femurda,20–22 kaburgada,23 tibia24 ve parmaklarda bildirilmiştir.25 Metastatik lezyonlar akciğerlerde, böbreklerde ve deri altı böğürde görülmüştür. 4,21 Tüm kediler iskeletsel olarak olgunlaşmıştır ve klinik belirtilerin süresi 2 ila 20 hafta arasında değişmektedir. Bulgularımız bu özelliklerle örtüşmektedir. Köpek GCTB’leri humerus,26 aksesuar karpal kemik,27 skapula28 ve proksimal tibia kaynaklı olarak teşhis edilmiştir.29 Bölgesel lenf düğümleri, akciğerler, karaciğer ve diğer kemiklerde metastazlar bildirilmiştir.28,30 GCTB’ler ayrıca atlarda, laboratuvar kemirgenlerinde ve kuş türlerinde de rapor edilmiştir.31–35 Radyografik olarak, GCTB’ler genellikle ince bir kemik kabuğu ile çevrili, coğrafi kemik yıkım paternine sahip, geniş, osteolitik lezyonlarla karakterize edilir. Skleroz ve periosteal yeni kemik oluşumu tipik olarak saptanmaz. Patolojik kırık meydana gelebilir.18,36 GCTB’ler insan tıbbında klinik, histolojik ve radyolojik özelliklere göre farklı evrelerde sınıflandırılmıştır. Bunlar I. evre (latent), II. evre (aktif) ve III. evredir (agresif; Tablo 1).37,38 Bu sınıflandırma sistemini takiben, bu vakada II. evre GCTB olduğu kabul edilebilirdi. Histolojik olarak GKTB’lerin üç ana bileşeni vardır: monoton bir görünüme sahip ovalden iğsi şekle kadar mononükleer stromal hücreler; osteoklast benzeri çok çekirdekli dev hücreler ve monosit/makrofaj soyundan mononükleer hücreler.11,14,39 Mononükleer stromal hücrelerin osteoblast soyundan türediğine ve tümörün neoplastik bileşeni olduğuna inanılmaktadır.18,40,41 Bu tümördeki dev hücreler Iba1 ile işaretlenmiştir. Bir kedi uterus karsinosarkomunda tartrat dirençli asit fosfataz (TRAP)-pozitif osteoklast benzeri çok çekirdekli dev hücrelerin Iba1 ekspresyonu dışında,7 osteoklastların Iba1 ile etiketlenmesi yaygın olarak bildirilmemiştir. Ancak, bu olguda TRAP mevcut değildi. Olgumuzdaki histopatolojik analiz, önceki kedi GCTB raporlarıyla karşılaştırılabilir.4,19,20,22,23 Ana ayırıcı tanı, dev hücrelerin proliferasyonunu da içeren osteosarkomun histolojik bir alt tipi olan dev hücreden zengin OSA idi.18 Komşu kemik trabekülüne mikroskobik infiltratif patern, osteoblastlarla çevrili belirgin dantel benzeri osteoid birikimi, çok sayıda mitotik figür içeren atipik pleomorfik spindloid hücreler ve ekstra tümöral lenfovasküler permeasyonun olması dev hücreli OSA teşhisini daha muhtemel kılacaktır.18,42,43 Periost reaksiyonunun olmaması ve malignite özelliklerinin bulunmaması GHTB teşhisini desteklemiştir. İmmünohistokimyasal bulgular, GCTB için spesifik olmamakla birlikte hücrelerin karakterize edilmesine yardımcı olmuştur. İnsanlarda GCTB’ye özgü bir immünohistokimya belirteci bulunmuştur, ancak veteriner hekimlikte henüz mevcut değildir.39,44 GCTB ve OSA arasındaki ayrım önemlidir çünkü GCTB’lerin çoğunun prognozu olumludur. Buna karşılık, OSA tüm kedi primer kemik tümörlerinin yaklaşık %70’ini oluşturan malign bir neoplazmdır. Kedi OSA’sının klinik seyri daha yavaş ve metastazlar köpek muadiline göre daha az sıklıkta olsa da, prognoz lokalizasyona bağlı olarak değişmektedir.18,20,45,46 Aksiyel OSA’lı kediler için ortalama sağkalım süresi apendiküler veya iskelet dışı OSA’ya (49 ay) göre daha düşüktür (5,5-6,7 ay).18,47 Bizim vakamızda, bir OSA ile hızlı bir kötüleşme beklenebilirdi. Cerrahi, insanlarda spinal GCTB’ler için tercih edilen tedavidir. II. evre lezyonlarda intralezyonel eksizyon endike iken, III. evre lezyonlarda parçalı total spondilektomi veya total en bloc spondilektomi endikedir. Lokal rekürrens %6-17 arasındadır.13,48,49 Küçük hayvanlarda, sadece apendiküler GCTB’ler için tedavi bildirilmiştir ve bu tedavide lezyonun amputasyonu veya rezeksiyonu yer almaktadır. Bu vakaların üçünde 12 aylık takipte nüks veya metastaz görülmemiştir.20,22,25,27 III. evre tibial GCTB’li bir köpekle ilgili bir vaka raporunda, ameliyattan 5 ay sonra lokal nüks görülmüştür.29 İnsan sınıflandırmasını takiben, bu kedi II. evre GCTB’ye sahipti ve bu nedenle tedavi yaklaşımımızın uygun olduğu kabul edilmelidir. SonuçVertebra, GCTB’ler için alışılmadık bir bölgedir ve daha önce kedilerde rapor edilmemiştir. Bu vaka raporu, metastaz olmaksızın ekspansil, litik vertebral kitle ile gelen yaşlı bir kedide GCTB’yi ilgili bir ayırıcı tanıyı ortaya koymaktadır. Vertebral stabilizasyon ile en bloc eksizyon tatmin edici bir fonksiyonel sonuç sağlamış ve lokal nüks görülmemiştir. Histopatolojik olarak dev hücreden zengin OSA’dan ayırt edilmesi zordur, ancak prognoz bu iki neoplazm arasında önemli ölçüde farklılık gösterdiğinden gereklidir. |
Yazarın notu Bu vaka raporu, Palma de Mallorca, İspanya’da düzenlenen ESVN-ECVN 34. Yıllık Sempozyumu’nda poster şeklinde sunulmuştur. Çıkar çatışması beyanı Yazarlar, bu makalenin araştırması, yazarlığı ve/veya yayını ile ilgili olarak herhangi bir potansiyel çıkar çatışması beyan etmemişlerdir. Finansman Yazarlar bu makalenin araştırması, yazarlığı ve/veya yayını için herhangi bir finansal destek almamıştır. Etik Onay Bu makalede belirtilen çalışmalarda deneysel olmayan (sahipli veya sahipsiz) hayvanlar kullanılmıştır. Bireysel hasta için veteriner klinik bakımının uluslararası kabul görmüş yüksek standartları (‘en iyi uygulama’) her zaman takip edilmiş ve/veya bu çalışma kadavra kullanımını içermiştir. Bu nedenle, JFMS Open Reports’ta yayınlanması için bir komiteden etik onay alınması gerekmemiştir. Gerekli olmamasına rağmen, etik onayın alındığı durumlarda, bu durum makalede belirtilmiştir. Bilgilendirilmiş Onam Bu çalışmada tanımlanan tüm hayvan(lar)ın (deneysel veya deneysel olmayan hayvanlar, kadavralar dahil) sahibinden veya yasal velisinden, gerçekleştirilen tüm prosedür(ler) için (prospektif veya retrospektif çalışmalar) bilgilendirilmiş onam (sözlü veya yazılı) alınmıştır. Bu yayında hiçbir hayvanın veya insanın kimliği belirlenememektedir ve bu nedenle yayın için ek bilgilendirilmiş onam gerekmemiştir. ORCID iD Clare Rusbridge https://orcid.org/0000-0002-3366-2110 |
| KAYNAKÇA 1. Sharp NJH and Wheeler SJ. Neoplasia. In: Sharp NJH and Wheeler SJ (eds). Small animal spinal disorders: diagnosis and surgery. New York: Elsevier Mosby, 2005, pp 247–273. 2. Martín de las Mulas J, Espinosa de los Monteros A, Carrasco L, et al. Immunohistochemical distribution of vimentin, desmin, glial fibrillary acidic protein and neurofilament proteins in feline tissues. Zentralbl Veterinarmed A 1994; 41. DOI: 10.1111/j.1439-0442.1994.tb00059.x. 3. Pierezan F, Mansell J, Ambrus A, et al. Immuno histochemical expression of ionized calcium binding adapter molecule 1 in cutaneous histiocytic proliferative, neoplastic and inflammatory disorders of dogs and cats. J Comp Pathol 2014; 151: 347–351. 4. Ferreras MC, Fuertes M, Pérez V, et al. Giant cell tumour of bone in a cat with extraskeletal metastases: pathologi cal and immunohistochemical study. J Vet Med A Physiol Pathol Clin Med 2005; 52: 225–229. 5. Nakashima K, Zhou X, Kunkel G, et al. The novel zinc fingercontaining transcription factor osterix is required for osteoblast differentiation and bone formation. Cell 2002; 108: 17–29. 6. Flanagan-Steet H, Aarnio M, Kwan B, et al. Cathepsin mediated alterations in TGFßrelated signaling underlie disrupted cartilage and bone maturation associated with impaired lysosomal targeting. J Bone Miner Res 2016; 31: 535–548. 7. Murakami M, Yonemaru K, Goto M, et al. Feline uterine carcinosarcoma infiltrated with osteoclastlike giant cells. J Vet Med Sci 2022; 84: 1579–1584. 8. Jongeward SJ. Primary bone tumors. Vet Clin North Am Small Anim Pract 1985; 15: 609–641. 9. Turcotte RE. Giant cell tumor of bone. Orthop Clin North Am 2006; 37: 35–51. 10. Sobti A, Agrawal P, Agarwala S, et al. Giant cell tumor of bone: an overview. Arch Bone Jt Surg 2016; 4: 2–9. 11. López-Pousa A, Martín Broto J, Garrido T, et al. Giant cell tumour of bone: new treatments in development. Clin Transl Oncol 2015; 17: 419–430. 12. Bridge JA, Neff JR and Mouron BJ. Giant cell tumor of bone. Chromosomal analysis of 48 specimens and review of the literature. Cancer Genet Cytogenet 1992; 58: 2–13. 13. Tsukamoto S, Mavrogenis AF, Kido A, et al. Current con cepts in the treatment of giant cell tumors of bone. Cancers (Basel) 2021; 13: 1–17. DOI: 10.3390/cancers13153647. 14. Flanagan AM, Larousserie F, O’Donnell PG, et al. Giant cell tumour of bone. In: WHO Classification of Tumours Editorial Board (eds). Soft tissue and bone tumours. Lyon: International Agency for Research on Cancer Press, 2020, pp 440–446. 15. Rock MG, Pritchard DJ and Unni KK. Metastases from histologically benign giantcell tumor of bone. J Bone Joint Surg Am 1984; 66: 269–274. 16. Dominkus M, Ruggieri P, Bertoni F, et al. Histologically verified lung metastases in benign giant cell tumours – 14 cases from a single institution. Int Orthop 2006; 30: 499–504. 17. Beebe-Dimmer JL, Cetin K, Fryzek JP, et al. The epidemiol ogy of malignant giant cell tumors of bone: an analysis of data from the surveillance, epidemiology and end results program (1975–2004). Rare Tumors 2009; 1: 159–163. 18. Thompson KG and Dittmer KE. Tumors of bone. In: Meuten DJ (ed). Tumours in domestic animals. Ames, IA: John Wiley & Sons, 2017, pp 356–424. 19. Walsh BA and Rhodes WH. Giant cell tumor of bone in a cat. J Small Anim Pract 1995; 36: 325–329. 20. Turrel JM and Pool RR. Primary bone tumors in the cat: a retrospective study of 15 cats and a literature review. Vet Radiol Ultrasound 1982; 23: 152–166. 21. Howard EB and Kenyon AJ. Malignant osteoclastoma (giant cell tumor) in the cat with associated mastcell response. Cornell Vet 1967; 57: 398–409. 22. Bennett D and Duff RS. Giant cell tumour of the ulna in a cat. J Small Anim Pract 1983; 24: 341–345. 23. Thornburg LP. Giant cell tumor of bone in a cat. Vet Pathol 1979; 16: 255–257. 24. McClelland RB. A giantcell tumor of the tibia in a cat. Cornell Vet 1941; 31: 86–87. 25 Wobeser BK, Kidney BA, Powers BE, et al. Diagnoses and clinical outcomes associated with surgically amputated feline digits submitted to multiple veterinary diagnostic laboratories. Vet Pathol 2007; 44: 362–365. 26. LeCouteur RA, Nimmo JS, Price SM, et al. A case of giant cell tumor of bone (osteoclastoma) in a dog. J Am Anim Hosp Assoc 1978; 14: 356–362. 27. Berg J, Gliatto JM and Wallace MK. Giant cell tumor of the accessory carpal bone in a dog. J Am Vet Med Assoc 1990; 197: 883–885. 28. Trigo FJ, Leathers CW and Brobst DF. A comparison of canine giant cell tumor and giant cell reparative granu loma of bone. Vet Pathol 1983; 20: 215–222. 29. Blondel M, Gros L, Semin M-O, et al. A case of giant cell tumour of bone in a dog. VCOT Open 2019; 2: 64–69. DOI: 10.1055/s-0039-3400513. 30. Garman RH, Powell FR and Tompsett JW. Malignant giant cell tumor in a dog. J Am Vet Med Assoc 1977; 171: 546–548. 31. May SA and Baker JR. A giant cell tumour (osteoclastoma) of the tibia in a horse. Equine Vet J 1985; 17: 477–479. 32. Imai T, Hibino N, Hayakawa K, et al. Giant cell tumor of bone in an aged Fischer 344 rat. Toxicol Pathol 1998; 26: 802–805. 33. Amann O, Meij BP, Westerhof I, et al. Giant cell tumor of the bone in a scarlet macaw (Ara macao). Avian Dis 2007; 51: 146–149. 34. Radaelli E, Rustighi A and Scanziani E. Giant cell tumor of bonelike lesion in a Trp53 mutant mouse. Toxicol Pathol 2012; 40: 675–681. 35. Gordon GE. Osteoclastoma in a mare. Mod Vet Pract 1974; 55: 540–541. 36. Mavrogenis AF, Igoumenou VG, Megaloikonomos PD, et al. Giant cell tumor of bone revisited. SICOT J 2017; 3: 54. 37. Enneking WF. A system of staging musculoskeletal neoplasms. Clin Orthop Relat Res 1986; 204: 9–24. 38. Campanacci M. Giantcell tumor and chondrosarcomas: grading, treatment and results (studies of 209 and 131 cases). Recent Results Cancer Res 1976; 54: 257–261. 39. Noh BJ and Park YK. Giant cell tumor of bone: updated molecular pathogenesis and tumor biology. Hum Pathol 2018; 81: 1–8. DOI: 10.1016/j.humpath.2018.06.017. 40. Wülling M, Delling G and Kaiser E. The origin of the neo plastic stromal cell in giant cell tumor of bone. Hum Pathol 2003; 34: 983–993. 41. Cowan RW and Singh G. Giant cell tumor of bone: a basic science perspective. Bone 2013; 52: 238–246. 42. Chow LTC. Fibular giant cellrich osteosarcoma virtually indistinguishable radiographically and histopathologi cally from giant cell tumoranalysis of subtle differenti ating features. APMIS 2015; 123: 530–539. 43. Mallick A, Shah N, Mahmud S, et al. Giant cellrich osteosarcoma – a rare case. J Oral Maxillofac Pathol 2020; 24 Suppl 1: 67–72. 44. Amary F, Berisha F, Ye H, et al. H3F3A (Histone 3.3) G34W immunohistochemistry: a reliable marker defining benign and malignant giant cell tumor of bone. Am J Surg Pathol 2017; 41: 1059–1068. 45. Ehrhart NP, Christensen NI and Fan TM. Tumors of the skeletal system. In: Vail DM, Thamm DH and Liptak JM (eds). Withrow & MacEwen’s small animal clinical oncology. St Louis, MO: Elsevier, 2020, pp 524–564. 46. Dernell W, van Vechten B, Straw R, et al. Outcome following treatment of vertebral tumors in 20 dogs (1986–1995). J Am Anim Hosp Assoc 2000; 36: 245–251. 47. Heldmann E, Anderson M and Wagner-Mann C. Feline osteosarcoma: 145 cases (1990–1995). J Am Anim Hosp Assoc 2000; 36: 518–521. 48. Boriani S, Bandiera S, Casadei R, et al. Giant cell tumor of the mobile spine: a review of 49 cases. Spine 2012; 37: 37–45. 49. Tomita K, Kawahara N, Murakami H, et al. Total en bloc spondylectomy for spinal tumors: improvement of the technique and its associated basic background. J Orthop Sci 2006; 11: 3–12. |