1Veteriner Klinik Bilimleri Bölümü, Purdue Üniversitesi, West Lafayette, IN, ABD 2Karşılaştırmalı Patobiyoloji Bölümü, Purdue Üniversitesi, West Lafayette, IN, ABD 3Endocyte Inc., West Lafayette, IN, ABD 4Kimya Bölümü, Purdue Üniversitesi, West Lafayette, IN, ABD 5Kimya Bölümü, Purdue Üniversitesi, West Lafayette, IN, ABD İlgili Yazar: Deborah W. Knapp, e-posta: knappd@purdue.edu anahtar Kelimeler: hayvan modeli; mesane kanseri; köpek, klinik çalışma; hedefe yönelik kemoterapi Sunum: 2 Ağustos 2018 Kabul: 26 Kasım 2018 Yayın: 11 Aralık 2018 Telif Hakkı: Bu makale, orijinal yazar ve kaynağa atıfta bulunulması koşuluyla, herhangi bir ortamda sınırsız kullanım, dağıtım ve çoğaltmaya izin veren Creative Commons Attribution License 3.0 (CC BY 3.0) koşulları altında dağıtılan açık erişimli bir makaledir. |
ÖZETAmaç: Bu çalışmanın amacı, bir folat-tubulizin konjugatının (EC0531) ilgili preklinik hayvan modelinde, doğal olarak oluşan invaziv ürotelyal karsinomlu (iUC) köpeklerde güvenliğini ve antitümör aktivitesini belirlemektir. Köpek iUC’si, insan kanserinin bazı formlarındakine benzer şekilde yüksek folat reseptörü (FR) ekspresyonuna sahip agresif bir kanserdir. Deneysel Tasarım: EC0531’in 3+3 doz eskalasyon çalışması (başlangıç dozu 0,2 mg/kg iki haftalık aralıklarla intravenöz olarak verilmiştir) yüksek düzeyde FR eksprese eden (>%50 pozitif tümör hücreleri) iUC’li köpeklerde gerçekleştirilmiştir. Farmakokinetik (PK) analizi yapılmış ve tolere edilebilir maksimum doz (MTD) belirlenmiştir. Antitümör aktivitesini belirlemek için MTD’deki doz kohortu genişletilmiştir. Sonuçlar: EC0531’in MTD’si iki haftada bir 0,26 mg/kg olup, daha yüksek dozlarda derece 3-4 nötropeni ve gastrointestinal toksisite gözlenmiştir. MTD’deki tedavi iyi tolere edilmiştir. Kısmi remisyon gösteren üç köpek ve stabil hastalığı olan 17 köpek dahil olmak üzere 28 köpeğin 20’sinde (%71) klinik fayda görülmüştür. Köpeklerdeki plazma EC0531 konsantrasyonları, FR-eksprese eden hücrenin in vitro proliferasyonunu inhibe etmek için gerekli olanları çok aşmıştır. İnsan nötrofillerinin aksine, köpek nötrofillerinin FR’leri eksprese ettiği ve bunun da köpeklerde EC0531’in yüksek dozlarında nötropeniye katkıda bulunduğu bulunmuştur. Sonuçlar: EC0531, iUC’li köpeklerde iyi tolere edilmiş ve iyi antitümör aktiviteye sahip olmuştur. İnsan nötrofillerinde FR’lerin bulunmaması nedeniyle insanların miyelotoksisite olmaksızın daha yüksek, potansiyel olarak daha etkili folat-tubulizin dozlarını tolere etmesi muhtemeldir. Sonuçlar, folat-tubulizinin insan klinik çalışmalarında değerlendirilmesi gerektiğini açıkça ortaya koymaktadır. |
GİRİŞHedefe yönelik kemoterapi, sitotoksik bir yükün tümör hücrelerine selektif şekilde verilmesini mümkün kılarken normal dokulara maruziyeti ve toksisiteyi sınırlandırır. İlacın tümörde tercihli olarak birikmesi, daha düşük sistemik maruziyetle ilaç aktivitesini artırabilir, yani terapötik indeksi artırabilir. Bu şekilde, sitotoksik ilaçların hedefli dağıtımı, daha önce çok düşük terapötik indeks nedeniyle klinik olarak uygun olmadığı düşünülen bileşiklerin yeniden değerlendirilmesine olanak tanımaktadır. Kanser tedavisi için umut verici, yeni ortaya çıkan, ilaçlanabilir bir hedef, folat (B9 vitamini) için yüksek afiniteli bir reseptör olan folat reseptör alfa (FRα)’dır [1, 2]. Folat, DNA sentezi için tüm hücreler tarafından gereklidir [1, 2]. Memeli hücrelerinin çoğu indirgenmiş folat (5-metil- tetrahidrofolat) kullanır ve bu folat indirgenmiş folat taşıyıcısı aracılığıyla hücre içine taşınır [1–3]. Buna karşılık, indirgenmemiş folat tümör hücreleri tarafından kullanılır ve tipik olarak yüksek afiniteli folat reseptörleri (FR’ler), özellikle de solid tümörlerde FRα aracılığıyla taşınır [4]. Yumurtalık karsinomu, renal karsinom, küçük hücreli dışı akciğer kanseri, kolorektal kanser ve metastatik beyin kanseri gibi çeşitli insan kanser türleri, normal dokulara göre 10 ila 100 kat daha yüksek FR ekspresyonuna sahiptir [2, 4]. FR’lerin yüksek ekspresyonu, folata konjuge sitotoksik ilaçların verilmesi için kullanılabilir [2-5]. Bu nedenle, folat hedefli ilaçların, belirli kanser türlerinin tümör hücrelerine tercihli olarak bağlanarak normal dokuları büyük ölçüde kurtarması beklenmektedir. FR ekspresyonundaki bu eşitsizlikten yararlanmak amacıyla çeşitli folat ve sitotoksik ilaç konjugatları veya folat ve immün modüle edici ilaçlar geliştirilmiştir [2, 3, 6]. En kapsamlı çalışılanlardan biri desasetilvinblastin monohidrazid (DAVLBH) folat konjugatıdır (vintafolid, EC145) [2, 3, 5]. Bir tümör ksenograft fare modelinde, serbest DAVLBH uygulaması, etkili anti-tümör aktivitesi gözlenmeden önce kabul edilemez toksisite yaratmıştır [7]. Ancak, ilacın folata konjugasyonu iyi tolere edilmiş ve farelerde çoklu ilaca dirençli tümörlerin tamamen remisyona girmesine yol açmıştır [2, 3, 7]. Daha sonra, bir faz I çalışması, çeşitli solid tümörler için bu ilacı alan kişilerde vintafolidin kabul edilebilir bir güvenlik profili olduğunu göstermiştir [8]. Faz II ve III çalışmalarında, en yüksek FR ekspresyonuna sahip tümörleri olan hastalarda ve P-glikoprotein ekspresyonu olmayan tümörlerde kaydedilen en büyük fayda ile değişen derecelerde klinik etkinlik gözlenmiştir [2, 3, 5, 9]. Bu bulgular FR’lerin gelecekteki hedeflenmesi için cesaret vericiydi, ancak aynı zamanda ek, potansiyel olarak daha aktif ilaç konjugatlarına ihtiyaç olduğunu göstermiştir. Tubulysins A, B, C ve D, 40 yıl önce bir Alman toprak örneğinde bulunan Archangium gephyra adlı bir mikobakteriden izole edilen güçlü anti-mitotik bileşiklerdir [10]. Etki mekanizması vinka alkaloidleri ve dolastatinlere benzerdir, mikrotübül oluşumunun dengesizliğine ve ardından geç G2/M fazında hücre döngüsünün durmasına neden olur [10]. Bununla birlikte, tubulizinlerin diğer anti-mitotik bileşiklere göre çeşitli potansiyel avantajları vardır. Vinka alkaloidlerinin aksine, tubulizinlerin CYP metabolizması için bir substrat olduğu görülmemektedir, bu nedenle ilaç-ilaç etkileşimleri konusunda daha az endişe vardır [11]. Tubulisinler ayrıca P-glikoprotein ilaç efluks pompası için zayıf substratlardır, böylece çoklu ilaç dirençli (MDR) tümör fenotiplerine karşı etkinliklerini korurlar [11]. İn vitro ortamda, tubulisin A, P-glikoprotein substratı olan ilaçlara kıyasla, yüksek P-glikoprotein ekspresyonuna sahip kolon kanseri hücrelerine (HCT-15 hücreleri) karşı üstün etkiye sahipti [11]. HCT-15 hücrelerinin hücre çoğalmasını %50 (IC50) oranında engellemek için gereken tubulizin A konsantrasyonu, vinblastin ve paklitakselin IC50’sinden sırasıyla 200 ve 2.000 kat daha azdı [11]. Ayrıca, antikanser ilaç taraması için ABD Ulusal Kanser Enstitüsü 60 tümör hücre hattı olan standartlaştırılmış bir kanser hücre hattı panelinde test edilen hücre hatlarının %33’ünde büyüme inhibisyonu gözlenmiştir. Bu sonuçlar, Ulusal Kanser Enstitüsü tarafından aynı şekilde test edilen diğer bileşiklerin %95’inden daha iyidir [11]. Bu ikna edici bilgilere rağmen, çok düşük terapötik indeks nedeniyle tubulizinlerin klinik etkinliği tam olarak belirlenememiştir. Serbest tubulizin uygulaması, farelerde sub-terapötik dozlarda bile kabul edilemeyecek derecede toksisite yaratmaktadır [12]. Ancak tubulizin, özellikle de tubulizin B’nin folata konjugasyonu, konjuge edilmemiş tubulizin dozlarından 20 kat daha yüksek dozlarda tolere edilen ve fare ksenograft modellerinde kanserin tamamen gerilemesine neden olan bir ilaç oluşturur [12–14]. Folat-tubulizin konjugatlarına spesifik bir moleküler ara parçanın, 1-amino-1-deoksi-glukitolil-γ-glutamatın eklenmesi, elde edilen bileşiğin terapötik aralığını arttırmada özellikle etkili olmuştur (EC0531, Endocyte, Inc., West Lafayette, IN) [14]. Folat-tubulizin konjugatlarının, özellikle tümör heterojenitesi, metastatik potansiyel, tümör-konak immün etkileşimleri ve doğal veya edinilmiş ilaç direnci açısından insan kanseri ile ilgili hayvan kanseri modellerinde daha fazla preklinik (insan öncesi) değerlendirilmesine büyük ilgi vardır. Doğal olarak ortaya çıkan belirli kanser türlerine sahip köpekler, köpeklerde yeni bileşiklerin sonuçlarının insanlardakini taklit etmesinin beklendiği bu son derece ilgili, in vivo insan kanseri modelleri olarak hizmet edebilir [15–21]. Doğal olarak ortaya çıkan belirli kanser türlerine sahip evcil köpekleri insanlarda aynı kanserler için model olarak incelemenin birçok avantajı vardır. Bu benzerlikler arasında tümör histopatolojisi, heterojenite, genetik ve epigenetik değişiklikler, biyolojik davranış, sık uzak metastazlar ve tedaviye yanıt yer almaktadır [17–24]. Benzer şekilde, köpekler ve insanlar arasında FR ekspresyonunda benzerlikler bildirilmiştir [16, 24]. Normal köpek dokuları, bazı köpek tümör tiplerine kıyasla nispeten düşük FR ifadesine sahiptir, tıpkı normal insan dokularının tümör dokularına kıyasla nispeten düşük FR ifadesine sahip olması gibi [24]. Köpek kanserinin en kapsamlı çalışılan formlarından biri olan invaziv ürotelyal karsinomda (iUC), iUC vakalarının %76’sında FR aşırı ekspresyonu kaydedilmiş ve kanserdeki folat alımı sintigrafi ile doğrulanmıştır [24]. Aynı çalışmada, insan iUC vakalarının %78’inde, köpek dokularındaki ile aynı antikor kullanılarak tespit edildiğinde FR’lerin ekspresyonunda artış görülmüş, ancak diğer antikorlarla tespit edildiğinde ekspresyon seviyesi daha düşük bulunmuştur [24]. Köpek Frα proteini, insan FRα’sı ile tahmin edilen homolojinin >%80’ine sahiptir. Burada rapor edilen çalışmanın amacı, tümör heterojenitesi, metastatik davranış, bağışıklık sistemi etkileşimleri ve doğuştan gelen ve edinilen ilaç direnci gibi insanlarda ilaç yanıtını etkileyebilecek faktörleri içeren bir köpek spontan kanser modelinde bir folat-tubulizin B ilaç konjugatının (EC0531) güvenliğini ve antitümör aktivitesini belirlemektir. Spesifik olarak, çalışmanın hedefleri şunlardır: (1) doğal olarak ortaya çıkan idrar yolu iUC’si olan evcil köpeklerde EC0531’in güvenliğini, tolere edilebilirliğini, tolere edilebilir maksimum dozunu (MTD) ve farmakokinetiğini belirlemek ve (2) yüksek FR ekspresyonu ile spontan olarak ortaya çıkan iUC’si olan köpeklerde antitümör aktivitesini belirlemektir. |
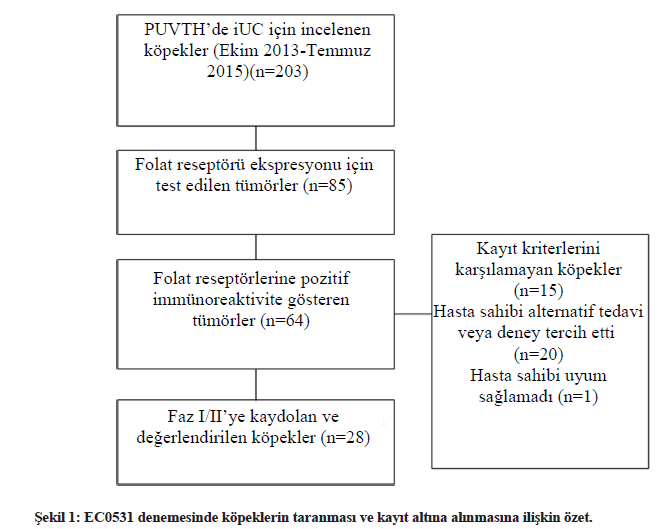
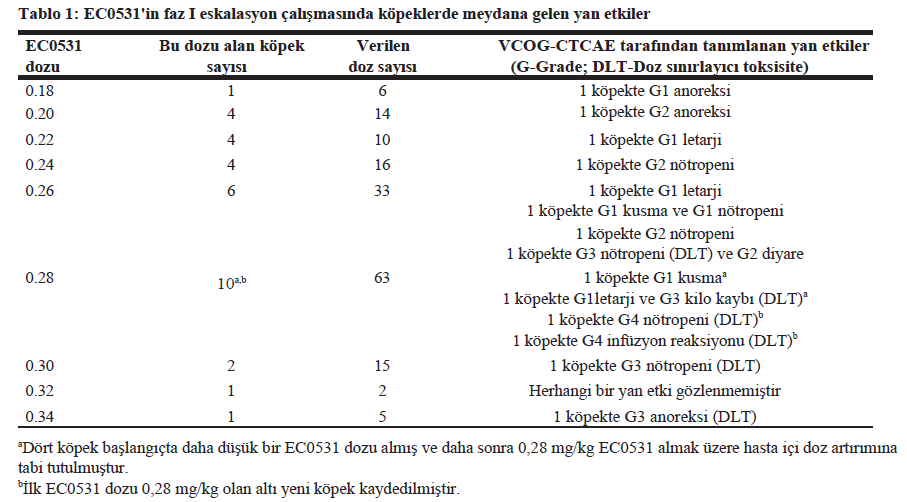
SONUÇLARVaka kaydı ve EC0531’in MTD’sinin belirlenmesiFaz I/II denemesi için köpeklerin seçimi Şekil 1’de özetlenmiştir. EC0531’in MTD’sini belirlemek için on beş köpek çalışmaya dahil edilmiştir. Yan Etkiler (AE’ler) Tablo 1’de özetlenmiştir. Kohort, 0,28 mg/kg EC0531 alan köpek kohortunda bir DLT gözlendiğinde genişletilmiştir. Kohort, başlangıçta daha düşük bir EC0531 dozu alan ve 0,28 mg/kg almak için hasta içi doz yükseltmesi yapılan dört köpeği ve başlangıç EC0531 dozu olarak 0,28 mg/kg alan altı ilave köpeği içermektedir. İlk doz olarak 0.28 mg/kg alan köpeklerde gözlenen AE’ler MTD için izin verilen değerleri aşmıştır. Altı köpek bir sonraki düşük dozla (0,26 mg/kg) tedavi edilmiş ve bu doz MTD olarak belirlenmiştir. İlacın tolere edilebilirliği köpekten köpeğe farklılık göstermiş ve bazı köpekler MTD’nin üzerinde artan dozları tolere etmiştir (Tablo 1). Örneğin, bir köpek EC0531’in 0,30 ve 0,32 dozlarını ve 0,34 mg/kg’lık beşinci dozdan sonra G3 anoreksi geliştirmeden önce 0,34 mg/kg’lık ilk dozları tolere etmiştir. Faz I/II denemesine ilave 13 köpek veya toplam 28 köpek dahil edilmiştir. FR’lerin ekspresyonu 25 köpekte biyopsi örneklerinde IHC ile ve üç köpekte idrar sedimentindeki tümör hücrelerinde ICC ile tespit edilmiştir. Köpeklerin ortalama yaşı 11,4 (7,1-16,5 yıl) ve ortalama ağırlığı 17,5 kg (2,5-33,0 kg) olup, 21 kısırlaştırılmış dişi ve yedi kısırlaştırılmış erkek köpekten oluşmaktadır. |
En yaygın görülen ırk melezdi (n = 12), bunu Scottish Terrier (n = 4), Dachshund (n = 2), Yorkshire Terrier (n = 2) ve aşağıdakilerin her birinden birer tane şeklinde dağılım gösterdi: Norwegian Elkhound, Irish Setter, American Eskimo Dog, Fox Terrier, Border Collie, West Highland White Terrier, Boxer ve Tibetan Terrier. Primer tümör 10 köpekte mesanede, iki köpekte üretrada ve 16 köpekte mesane artı üretra/prostatta mevcuttu. İki köpekte uzak metastazlar ve bir köpekte tanı sırasında nodal metastazlar vardı. On iki köpek daha önce siklooksijenaz inhibitörü (COXi) ile tedavide başarısız olmuş ve çalışma sırasında COXi tedavisi almaya devam etmiştir. Beş köpek vinblastin, karboplatin, mitoksantron ve toceranib dahil olmak üzere daha önce kemoterapi almamıştı. 28 köpek toplam 311 doz EC0531 almış ve ilaç genel olarak iyi tolere edilmiştir. Hasta içi doz artırımı, EC0531’i MTD’de alan köpek kohortunun genişletilmesine izin vermiştir. Bu çalışmadaki 28 köpeğin 26’sı EC0531’i MTD’de veya üzerinde almıştır. Belirtilen toksisite nötropeni, anoreksi veya letarjiden oluşmuştur. Nötropeniye eozinopeni eşlik etmiştir. Bir köpekte grade 2 trombositopeni görülmüştür. Bu köpek EC0531 çalışmasına katılmadan önce kemoterapi ile yoğun bir şekilde ön tedavi görmüştü ve kronik olarak düşük trombosit sayısına sahipti. EC0531 tedavisinden bir hafta sonra trombosit sayısı düşmüş ve 14. günde EC0531 öncesi seviyelere geri dönmüştür. Geç evre kanseri veya üretral/üreteral obstrüksiyonu olan birkaç köpekte, kanser ilerlemeye başladığı için tedavilerinin sonunda azotemi ve kilo kaybı görülmüştür. Ancak bu bulgular yine de AE olarak kaydedilmiştir. Bunlar geçici olmayan tek yan etkilerdi (AE). Hiçbir köpek AE veya yaşam kalitesine yönelik olumsuz etkiler nedeniyle çalışmadan çekilmemiştir. Tek bir köpekte hipotansiyon, kompansatuar taşikardi ve akabinde senkopal ataktan oluşan bir infüzyon reaksiyonu gelişmiştir. Reaksiyon geçiciydi ve müdahale olmaksızın üç dakika içinde düzeldi. Köpeğin diğer tedavileri başarısız olmuş ve EC0531 tedavisi ile remisyona girmiştir, bu nedenle EC0531 tedavisine devam edilmiştir. Uygulama hızının yavaşlatılması reaksiyonu hafifletmemiştir. Difenhidramin uygulaması klinik belirtileri kısmen hafifletmiştir. Bu köpek tedaviden fayda görmeye devam etmiş ve 11 doz EC0531 almıştır. |
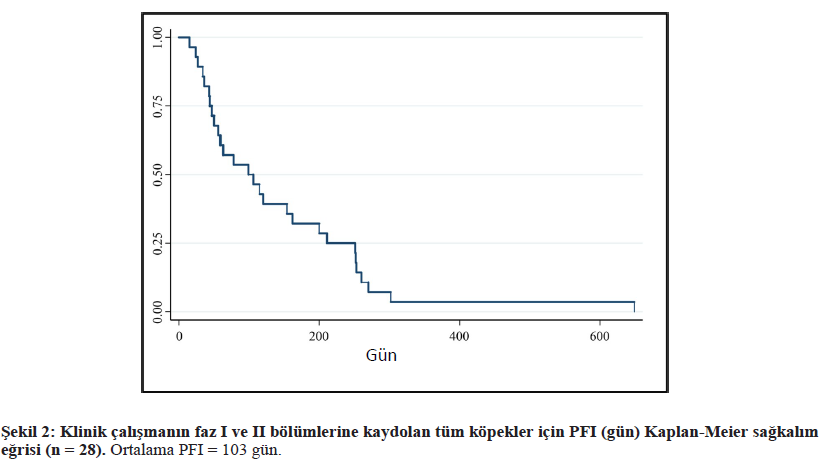
EC0531’nin Antitümör aktivitesiÜç köpekte PR ve 17 köpekte SD olmak üzere 28 köpeğin 20’sinde (%71) klinik fayda görülmüştür. Tüm köpekler için ortalama PFI 103 gündü (aralık 24-649 gün) (Şekil 2). EC0531’in tüm dozlarını MTD’nin altında alan iki köpeğin tümörlerinde sırasıyla SD ve PD görülmüştür. Son takip sırasında on dokuz köpekte PD kaydedilmiştir. Kanser progresyonu 12 köpekte primer bölgede, iki köpekte metastatik bölgede ve beş köpekte hem primer hem de metastatik bölgede meydana gelmiştir. PFI üzerinde önemli etkileri olduğu tespit edilen iki değişken en iyi tümör yanıtı ve daha önce kemoterapi tedavisi almış olmaktır (p = 0.0001). Tedaviye yanıt vermeyenler, yani ilk iki tedaviden sonra PD olan köpeklerin ortalama PFI süresi 34 gündü (aralık 24-47). SD’li köpeklerin ortalama PFI süresi 200 gündü (aralık 56-296 gün). PR’ye ulaşan üç köpeğin PFI veya çalışmadan sansürlenme süresi sırasıyla 162, 251 ve 649 gündü. PFI, SD’li köpekler ile PD’li köpekler arasında [tehlike oranı = 0,013 (%95 GA 0,001-0,124)] ve PR elde eden köpekler ile PD’li köpekler arasında [tehlike oranı = 0,003 (%95 GA 0-0,066)] ciddi farklılıklar göstermiştir. Daha önce kemoterapi almış ve başarısız olmuş köpeklerin ortalama PFI süresi 95 gün (aralık 34-162) ve erken PD için HR 4,6 (%95 GA 1,2-16,7) idi. Tedavi öncesi biyopside FR ekspresyonu seviyesi ile tümör yanıtı veya PFI arasında herhangi bir ilişki bulunmamıştır. Dokuz köpek PFI verilerinden sansürlenmiştir. Bir köpek, şiddetli, konuyla ilgisi olmayan osteoartrit ağrısını kontrol etmek için COXi almaya başladığı sırada çaliışmadan sansürlenmiştir. COXi ilaçlarının köpek iUC’sine karşı antitümör aktiviteye sahip olduğu kaydedilmiştir [16]. Bir köpeğin nekropsisinde, ötenaziye yol açan ve yaşam kalitesindeki düşüşe neden olduğundan şüphelenilen iki ek tümör tipi bulunmuştur. Dört köpeğe, kalıcı klinik belirtiler nedeniyle yaşam kalitesinin düşmesinden endişe duyan sahipleri nedeniyle ötenazi uygulanmış, ancak tümör ilerlemesi görülmemiştir. Son olarak, kanserin hala kontrol altında olduğu üç köpekte, köpek sahipleri diğer tedavilerle kanser remisyonu elde etmek amacıyla köpekleri çalışmadan çekmiştir. Bu köpeklerin üçü de EC0531 ile SD’ye ulaşmıştır. |
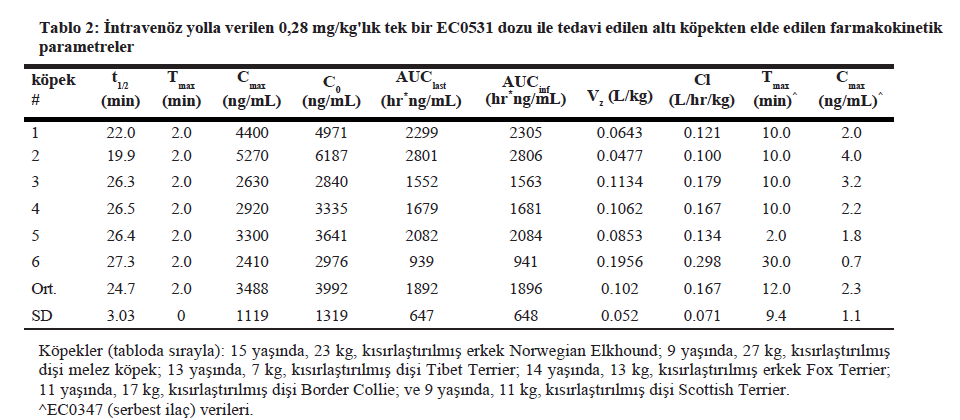
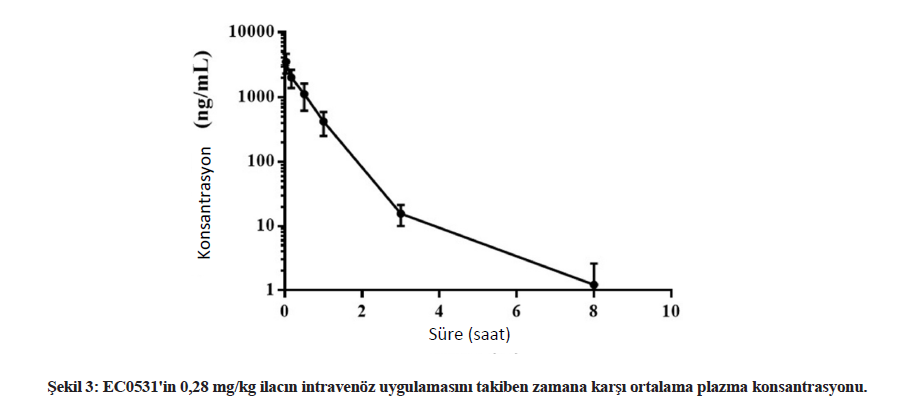
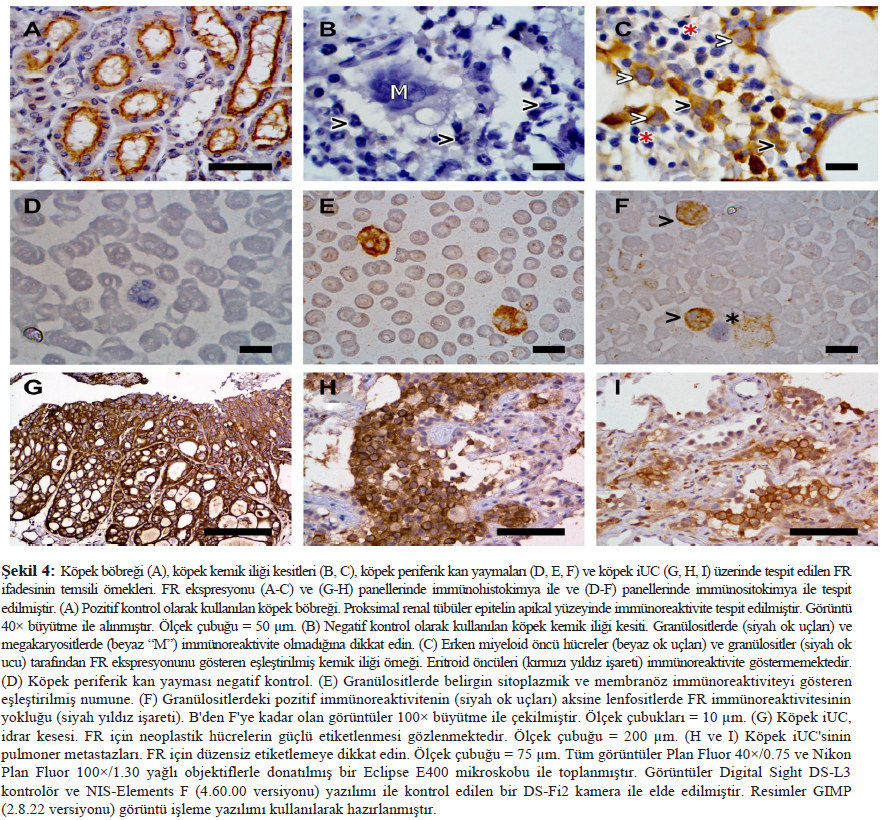
Farmakokinetik analizAltı köpekten alınan 0,28 mg/kg EC0531 örneklerinin farmakokinetik analiz sonuçları Tablo 2 ve Şekil 3’te özetlenmiştir. Beklendiği üzere, EC0531 bifazik farmakokinetik davranış sergilemiş ve yaklaşık 25 dakikalık bir yarılanma ömrü ile dolaşımdan hızla atılmıştır. Önemli bir diğer nokta da, infüzyon reaksiyonu geçiren köpekte (Tablo 2’deki 3 numaralı köpek) farmakokinetik parametrelerin diğer köpeklerinkinden farklı olmamasıdır. Bu köpeğin plazmasındaki EC0347 (serbest, aktif ana tubulizin bileşiği) konsantrasyonu minimaldi (3.2 ng/mL) ve aynı zamanda tedavi edilen başka bir köpekteki EC0347 konsantrasyonuna (4.0 ng/mL) benzerdi (Tablo 2’de köpek #2). EC0531 ve EC0347 konsantrasyonları tedaviden yaklaşık üç saat sonra üç köpeğin iUC dokularında ölçülmüştür. EC0531 konsantrasyonu iki köpek numunesinde tespit seviyesinin altındaydı ve üçüncü köpekten alınan numunede 3,9 ng/mL idi. EC0347 konsantrasyonları bu üç vakadan alınan dokularda sırasıyla 5,5, 7,3 ve 13,8 ng/mL idi. Her üç köpek de 0,28 mg/kg EC0531 almıştır ve her üç köpeğin de tümör yanıtı SD’dir. Nötrofiller ve nötrofil öncülleri üzerinde FR ekspresyonuKemik iliği çekirdek biyopsi örneklerinde, miyeloid soy içindeki öncü hücrelerin membranı ve sitoplazması FR’ye karşı orta ila belirgin immünoreaktiviteye sahipti (Şekil 4). Kemik iliği çekirdeklerindeki daha olgun granülositik hücrelerde hem sitoplazma hem de membranda güçlü immünoreaktivite kaydedilmiştir. Altı çekirdek biyopsi örneğinin tümünde megakaryositlerde heterojen, hafif ila orta derecede immünoreaktivite kaydedilmiştir. Kemik iliğindeki eritroid öncüllerinde ve lenfoid hücrelerde immünoreaktivite gözlenmemiştir. |
Kan yaymalarında, 16 köpek vakasının 15’inde granülositlerin %85’inden fazlasında hem membran hem de sitoplazmada FR’ler tespit edilmiştir (Şekil 4). Buna nötrofillerde orta derecede immünoreaktivite ve eozinofillerde hafif immünoreaktivite dahildir. Kan yaymalarında eritrositlerde, trombositlerde veya lenfositlerde FR’lere karşı immünoreaktivite tespit edilmemiştir. Primer İUC ve metastatik bölgelerde nekropsi bulguları ve FR ekspresyonuÇalışmadaki 28 köpeğin 21’ine nekropsi yapılmıştır. Nekropside 14 köpekte (%67) histopatolojik olarak doğrulanmış metastatik hastalık bulunmuştur. Bunlar arasında nodal metastazı olan dört köpek, uzak metastazı olan iki köpek ve hem nodal hem de uzak metastazı olan sekiz köpek bulunmaktadır. Uzak metastaz bölgeleri arasında akciğer, karaciğer, dalak, kas, ince bağırsak, kolon, beyin, adrenal bez ve deri yer almıştır. Nekropsi yapılan 21 köpekten 11’i EC0531’in başarısız olmasının ardından ek tedavi almıştır. İmmünoreaktif hücrelerin yüzdesi, immünoreaktivitenin yoğunluğu ve immünoreaktivitenin yeri (membran, sitoplazmik) açısından FR ekspresyonunda heterojenlik primer tümörler içinde ve primer ve metastatik tümörler arasında bulunmuştur (Şekil 4). 11 köpekte, aynı köpekten alınan primer tümör içindeki birden fazla (iki ila dört) bölge arasında FR ekspresyonunu karşılaştırmak için örnekler mevcuttu. |
Altı vakada, FR ekspresyonu aynı köpekte örneklenen primer tümörün tüm alanlarında benzerdi. Beş vakada, primer tümör içinde yüksek pozitiflikten (>%50 immünoreaktif hücreler, güçlü immünoreaktivite yoğunluğu) aynı tümörün farklı alanlarında negatif FR ekspresyonuna kadar değişen heterojenite kaydedilmiştir. Aynı vakadan alınan metastazlar arasında da heterojenite kaydedilmiştir (Şekil 4). Pozitif FR ekspresyonu yedi vakanın üçünde metastatik düğümlerde ve örneklerin mevcut olduğu dokuz vakanın üçünde uzak metastazlarda kaydedilmiştir. Tedavi öncesi biyopsiler ile nekropsi sırasında alınan biyopsiler arasında IHC bulgularında tutarlı bir değişiklik olmamıştır. TARTIŞMABu köpek deneyinin sonuçları, folat-tubulizin’in insan klinik deneylerinde değerlendirilmesi için güçlü bir temel oluşturmaktadır. Folat-tubulizin evcil köpeklerde iyi tolere edilmiş ve agresif, kendiliğinden ortaya çıkan kanser ortamında klinik etkinlik göstermiştir. |
Bu çalışmada, nötrofil tükenmesinin EC0531’in antitümör aktivitesinde olumlu ya da olumsuz herhangi bir rolü olup olmadığını bilmek mümkün olmamıştır. İUC’li insanlarda, periferik kanda yüksek nötrofil/lenfosit oranının veya tümörde nötrofil infiltrasyonunun zararlı sistemik inflamasyonun bir göstergesi olduğu düşünülmektedir ve kötü prognozla ilişkilendirilmiştir [32]. Nötrofiller pro-tümörijenik sitokinler ve pro-anjiyojenik vasküler endotelyal büyüme faktörü üretebilir [33, 34]. Bununla birlikte, nötrofiller özellikle N1 tipi nötrofiller olarak bulunduklarında antitümör etkiler de gösterebilirler [35]. Bu çalışmadaki köpeklerde nötropeninin süresi kısa olmasına rağmen, EC0531’in antitümör etkileri üzerindeki etkisi göz ardı edilememiştir. Daha yüksek periferik kan nötrofil/lenfosit oranına sahip insanlarda bildirilen daha kötü prognozun aksine, bu çalışmadaki köpeklerde EC0531 tedavisinin başlangıcındaki nötrofil/lenfosit oranı tedavi sonucuyla ilişkili değildi. |
Sonuç olarak, EC0531’in köpeklerdeki bu agresif kanserde gözlemlenen güvenlik ve antitümör aktivitesi, folat-tubulizinin insan klinik çalışmaları için önemli bir destek sağlamaktadır. Doğal olarak ortaya çıkan evcil köpek iUC modeli, tümör heterojenitesi, agresif kanser davranışı, çoklu ilaç direnci mekanizmaları ve ilaç toksisitesine karşı sınırlı tolerans dahil olmak üzere insanlarda kanser tedavisini etkileyen aynı klinik sorunları barındırmaktadır. Bu nedenle, folat-tubulizin özellikle ilaç güvenliği ve antitümör aktivite açısından iyi incelenmiş ve FR’leri aşırı eksprese eden kanserlerde insan çalışmaları için uygun bir seçim olarak değerlendirilmelidir. MATERYALLER VE METOTLARÇalışmaya genel bakışÇalışma, doğal olarak ortaya çıkan iUC’li köpeklerde folat-tubulizin konjugatı EC0531’in (Endocyte Inc., West Lafayette, IN, ABD) faz I/II klinik çalışmasını ve farmakokinetik analizini kapsamaktadır. Doz eskalasyonu ve MTD’nin belirlenmesinin ardından, antitümör aktivitesini daha fazla değerlendirmek için MTD’de tedavi edilen köpeklerden oluşan bir kohort genişletilmiştir. EC0531 alan köpeklerde miyelosupresyonun gözlemlenmesinin ardından, köpek beyaz kan hücrelerinde (WBC’ler) ve WBC öncülerinde FR ekspresyonunun bir değerlendirmesi de yapılmıştır. Köpek klinik çalışması Purdue Üniversitesi Veteriner Hekimliği Eğitim Hastanesi’nde (PUVTH) Purdue Hayvan Bakım ve Kullanım Komitesi ve Klinik İnceleme Kurulu’nun yönergeleri ve onayına uygun olarak yürütülmüştür. Çalışma, Ekim 2013 ve Temmuz 2015 tarihleri arasında PUVTH’ye başvuran köpeklere açıktı. Bu süre zarfında, iUC’li köpeklerin sahipleri bu çalışma da dahil olmak üzere tedavi seçenekleri konusunda bilgilendirilmiş ve çalışma hakkında ayrıntılı bilgi verilmiştir. Köpeğin araştırmaya katılabilmesi için köpek sahibinin yazılı onayı gerekmiştir. Çalışmaya uygunlukDahil edilme kriterleri, tümör hücrelerinin >%50’sinde FR’lerin eksprese edildiği (aşağıda açıklanan yöntemlerle tespit edilen), beklenen sağkalım süresi en az altı hafta olan ve serum kreatinin <2.0 mg/dL (normal referans aralığı 0.5 ila 1.5 mg/dL) olan histolojik olarak teşhis edilmiş alt üriner sistem iUC’li köpeklerden oluşuyordu. Beklenen sağkalım süresi, tıbbi öykü, fizik muayene, CBC (tam kan hücresi sayımı), serum biyokimyasal profili, idrar tahlili ve görüntüleme (torasik/abdominal radyografi, abdominal ultrasonografi) ile belirlenip köpeğin sağlık durumuna göre tespit edilmiştir. Önceki tedavilerle tedavi edilen köpekler, önceki tedaviye yanıt olarak kanser ilerlemesi kaydedilmişse veya EC0531’i almadan önce tedavi en az dört hafta süreyle kesilmişse çalışmaya uygun bulunmuştur. COXi ve EC0531’in eşzamanlı kullanımına, kayıttan önce COXi’ye rağmen kanser progresyonu meydana gelmişse veya artrit veya diğer komorbiditelerden kaynaklanan ağrının giderilmesi için COXi tedavisi gerekliyse izin verilmiştir. Tedavi ve çalışma tasarımıEC0531 her iki haftada bir 0,2 mg/kg başlangıç dozunda intravenöz (IV) bolus olarak verilmiştir. Başlangıç dozu ve sıklığı, laboratuvar köpeklerinden ve tedaviden dört ila yedi gün sonra nötrofil nadirliğinin gözlendiği iUC’li evcil köpeklerde yapılan bir pilot çalışmadan elde edilen verilere dayanmaktadır (n = 10 köpek). Pilot çalışmadaki 10 evcil köpek, çeşitli ırklardan ve ağırlıkları 5 ila 46 kg arasında değişen altı kısırlaştırılmış erkek köpek ve dört kısırlaştırılmış dişi köpekten oluşuyordu. Başlangıçta haftada iki kez dozlama başlatılmış, ancak doz sınırlaması-nötropeni ve anoreksi nedeniyle devam edilmemiştir. Haftalık doz aralığı da nötropeni nedeniyle askıya alınmıştır. Dozaj kohortlarındaki köpekler 3+3 çalışma tasarımı kullanılarak kaydedilmiştir. Hastalar arası ve hasta içi doz artışına izin verilmiştir. İlaç tolerabilitesi, sahip anketi, fizik muayene, tedavi günü ve tedaviden sonraki yedi gün CBC ve dört haftalık aralıklarla biyokimya paneli ile değerlendirilmiştir. Toksisite VCOG-CTCAE kriterleri kullanılarak derecelendirilmiştir [36]. EC0531 dozu, doz sınırlayıcı toksisite (DLT) kaydedilmediği takdirde sonraki her doz kohortunda 0,02 mg/kg artırılmıştır. DLT, > grade 2 yan etki (AE) olarak tanımlanmıştır. Grade 3 AE meydana geldiğinde, kohort altı yeni köpek, yani daha düşük dozlarda daha önce EC0531 almamış altı köpek de dahil olmak üzere en az altı köpeğe genişletilmiştir. Birden fazla grade 3 AE veya herhangi bir grade 4 veya 5 AE meydana gelirse, altı köpek önceki kohortta kaydedilmiştir. MTD, birden fazla grade 3 AE ve grade 4-5 AE olmaksızın altı köpek tarafından tolere edilen en yüksek doz olarak tanımlanmıştır. İlacın iki dozu uygulandıktan sonra herhangi bir AE meydana gelmemişse hasta içi doz artışına izin verilmiştir. Her köpekte EC0531 dozu grade 2 toksisite görülmesi halinde %10, grade 3 veya daha yüksek toksisite görülmesi halinde %20 azaltılmıştır. Tedavinin yapılacağı gün nötrofil sayısı <3.000/mm3 veya trombosit sayısı <100.000/mm3 ise tedavi bir hafta ertelenmiştir. Doz ayarlamalarını takiben kanser progresyonu veya kabul edilemez toksisite yaşayan köpekler çalışma dışında başka tedaviler almaya uygun görülmüştür. Antitümör aktivitesini tahmin etmek için, MTD alan köpek kohortu, MTD’de veya üzerinde tedavi edilen en az 24 köpekte antitümör etkilerini değerlendirmek amacıyla genişletilmiştir [37]. EC0531’in tümör üzerindeki etkileri belirli bir standart protokol [38] kullanılarak sistosonografi ve dört haftalık aralıklarla rektal muayene dahil olmak üzere fizik muayene ile değerlendirilmiştir. Sekiz haftalık aralıklarla tam kanser evrelemesi (sol lateral, sağ lateral ve ventrodorsal projeksiyonlu toraks radyografisi; sağ lateral ve ventrodorsal projeksiyonlu abdominal radyografi; ve tam abdominal ultrasonografi) yapılmıştır. Primer tümördeki yanıt, sistosonografi ile hacim ölçümleri karşılaştırılarak şu şekilde belirlendi: tam remisyon (CR, kanser saptanmadı), kısmi remisyon (PR, tümör hacminde ≥%50 azalma ve yeni tümör lezyonu yok), stabil hastalık (SD, tümör hacminde <%50 değişiklik ve yeni tümör lezyonu yok) ve ilerleyici hastalık (PD, tümör hacminde ≥%50 artış veya yeni tümör lezyonları gelişimi) [26]. Metastatik lezyon yanıtı RECIST kriterlerine göre değerlendirilmiştir [39]. Progresyonsuz aralık (PFI) EC0531 tedavisinin başlangıcından lokal veya metastatik lezyon(lar)ın PD’sine kadar geçen süre olarak tanımlanmıştır. Köpeğin ölümü sırasında (kanserden veya diğer nedenlerden ölüm) nekropsi yapmak için izin istenmiştir. Nekropside toplanan dokular, primer ve metastatik lezyonlarda FR ekspresyonunu tespit etmek için histolojik ve immünohistokimyasal olarak incelenmiştir. Folat reseptörünün değerlendirilmesiTümör FR ekspresyonu, sistoskopik biyopsi ile toplanan primer tümör dokularından iUC hücrelerinin immünohistokimyası (IHC) veya çalışmaya kayıttan önceki dört hafta içinde toplanan idrar sedimentinden iUC hücrelerinin immünositokimyası (ICC) ile değerlendirilmiştir. Uzak metastazlardaki folat alımı daha önce tarif edildiği gibi nükleer sintigrafi ile değerlendirilmiştir [24]. Dokulardaki FR’leri tespit etmek için immünohistokimya daha önce tarif edildiği gibi gerçekleştirilmiştir [24]. İdrardaki iUC hücrelerindeki FR’leri tespit etmek için bir ICC protokolü oluşturulmuştur. ICC için slaytlar soğuk asetonda sabitlendi, ardından hidrasyon ve ardından formalin fiksasyonu yapıldı. Antijen geri kazanımı ve tavşan poliklonal anti-FR antikoru (PU17, Endocyte, Inc., West Lafayette, IN, ABD) ile tespit gerçekleştirilmiştir. Eşleştirilmiş negatif kontrol lamları Evrensel Negatif Kontrol Serumu (Biocare Medical, Concord, CA, ABD) ile çalışılmıştır. İmmünoreaktivite, hematoksilen kontrast boyası ile immünoperoksidaz-DAB ile tespit edildi. PU17 ile immün boyanmış idrar yaymaları kullanılarak elde edilen sonuçlar, aynı köpekten alınan eşleştirilmiş tümör örneklerinde (n = 10) immünohistokimyasal olarak tespit edilen FR ekspresyonu ile karşılaştırılmıştır. Nötrofillerde ve nötrofil öncüllerinde FR ekspresyonunun tespiti için immünositokimya ve IHC de kullanılmıştır. İmmünositokimya 16 köpekten alınan periferik kan yaymalarında, IHC ise histolojik arşivlerden alınan altı köpekten alınan kemik iliği çekirdek biyopsilerinde gerçekleştirilmiştir. Bu örnekler kemik iliğinde nötropeni veya neoplazi bulunmayan köpeklerden alınmıştır. Farmakokinetik analizlerPlazma farmakokinetik analizi, çalışmaya sırayla kaydedilen altı köpekte gerçekleştirilmiştir. Kan 0, 2, 10 ve 30. dakikalarda ve tedaviden 1, 2, 8 ve 24 saat sonra toplanmıştır. Tüpler santrifüj edilmiş ve plazma toplanarak -80° C’de saklanmıştır. Keşif amaçlı analizde, bu köpeklerden üçünden tedaviden 3 saat sonra sistoskopi eşliğinde tümör dokusu da alınmış ve bu doku da analize kadar -80° C’de saklanmıştır. Plazmadaki EC0531 konsantrasyonlarının analizi için EC0531, 96 hücreli katı faz ekstraksiyonu (SPE) ile 100 µL köpek plazmasından ekstrakte edilmiştir. Bir Strata X-A SPE plakası (Phenomenex, Torrance, CA, ABD) kullanılarak ekstraksiyon öncesinde tüm numunelere dahili standart eklenmiştir. Elüat toplandı, buharlaştırıldı ve son olarak 40 mM mannitol içeren 85/15 su/asetonitril ile sulandırıldı. Ekstrakte edilen numuneler, mobil faz gradyanı uygulayan bir BEH C18 ters faz kolonu (Waters) kullanılarak bir UPLC/MS/MS sistemine (Waters, Milford, MA, ABD) enjekte edilmiştir. Oluşan numune konsantrasyonları daha sonra boş köpek plazmasında hazırlanan bir kalibrasyon eğrisine karşı geri hesaplanmıştır. EC0347 (ana tubulizin bileşiği) ve diğer potansiyel metabolitler de plazma örneklerinde değerlendirilmiştir. EC0347, 96 hücreli destekli sıvı ekstraksiyonu (SLE) ile 100 µL köpek plazmasından ekstrakte edilmiştir. Ekstraksiyon öncesinde tüm numunelere 200 µL SLE+ plakası (Biotage, Charlotte, NC, ABD) kullanılarak dahili standart eklenmiştir. Elüat toplanmış, buharlaştırılmış ve toplama plakası 1 saat boyunca mühürlenip ısıtılmadan önce aseton ile sulandırılmıştır. İnkübasyondan sonra ekstraktlar tekrar buharlaştırıldı ve son olarak enjeksiyondan önce sulandırıldı. Ekstrakte edilen örnekler bir BEH shield RP18 ters faz kolonu (Waters) kullanılarak bir UPLC/MS/MS sistemine (Waters) enjekte edilmiş ve izokratik koşullar altında çözünmüştür. EC0347, aseton ile türevlendirmenin ardından bileşiğin hidrazon formu izlenerek tespit edilmiştir. Elde edilen numune konsantrasyonları daha sonra boş köpek plazmasında hazırlanan bir kalibrasyon eğrisine karşı geri hesaplanmıştır. EC0531 ve EC0347’nin iUC doku örneklerinde analizi için örnekler N-maleoil-ß-alanin ve asetik asit içeren 50 mM sitrat tamponu içinde dört hacim %3 mannitol ile homojenize edilmiştir. Örnekler tampon içinde bilyeli çırpıcı veya elle tutulan homojenizatör ile homojenize edilmiştir. Her numuneden 100 µL’lik alikotlara aseton içinde 400 µL dahili standartlar eklenmiştir. Ekstraktlar kapatılmış ve 55° C’de 1 saat inkübe edilmiştir. Ekstraktlar daha sonra asetonu uzaklaştırmak için buharlaştırılmış ve yeniden oluşturulmuştur. Son olarak, sulandırılmış numuneler, hazırlanan bir kalibrasyon eğrisine karşı EC0531 ve metabolitlerin konsantrasyonlarını değerlendirmek için bir UPLC-MS/MS sistemine (Waters) enjeksiyon yoluyla analiz edilmiştir. Ana bileşik olan EC0347’nin dokularda salınması beklenmiştir. İstatistiksel analizÖngörücü değişkenler ile progresyonsuz sağkalım (PFI) arasındaki ilişkiyi değerlendirmek için adımsal Cox regresyon analizi yapılmıştır. Şu değişkenler dikkate alınmıştır: yaş, kilo, cinsiyet, tedavi başlangıcında periferik kan nötrofil/lenfosit oranı, tümör yerleşimi (mesane vs üretra/prostat vs her ikisi), tedavinin < MTD veya ≥ MTD’de başlaması, kemoterapi ile ön tedavi, eş zamanlı COXi kullanımı, IHC/ICC skoru ve en iyi tümör yanıtı (PD vs SD vs PR/CR). Tek değişkenli modellerde p-değerleri <0,25 olan değişkenler daha sonra çok değişkenli modellemeye dahil edilmiştir. Nihai çok değişkenli Cox regresyon modelinde p-değeri < 0,05 olan değişken(ler)in PFI üzerinde istatistiksel olarak anlamlı bir etkisi olduğu kabul edilmiştir. KısaltmalariUC: invaziv ürotelyal karsinom; FR: folat reseptörü; MTD: tolere edilebilir maksimum doz; PK: farmakokinetik; DLT: doz sınırlayıcı toksisite; PR: kısmi remisyon; PD: progresif hastalık; SD: stabil hastalık; PFI: progresif serbest aralık; IHC: immünohistokimya; G: grade. TEŞEKKÜRLERYazarlar, Purdue Karşılaştırmalı Onkoloji Programı klinisyenlerine ve personeline bu çalışmadaki özverili çalışmaları için ve bu çalışmayı destekleyen ve köpeklerinin katılmasına izin veren birçok köpek sahibine teşekkür eder. Yazarlar ayrıca Dr. Henry Green ve Dan Hogan’a transfüzyon reaksiyonu gösteren köpeğin değerlendirilmesinde yardımcı oldukları için ayrıca teşekkür eder. ÇIKAR ÇATIŞMASIC.P. Leamon, P.J. Klein, M.R. Pugh, S. Rao ve I. Vlahov Endocyte, Inc. şirketinin çalışanlarıdır. Philip S. Low, Endocyte, Inc. şirketinde Baş Bilim Sorumlusu olarak görev yapmaktadır. Diğer yazarların herhangi bir potansiyel çıkar çatışması bulunmamaktadır. FİNANSMANFinansman Hayvan Kanseri Vakfı, Endocyte Inc. ve Purdue Üniversitesi’nde mesane kanseri araştırmaları için yapılan özel bağışlar yoluyla sağlanmıştır. |
KAYNAKÇA
|