| 1 Evcil Hayvan Hekimliği ve Cerrahisi Bölümü, Veteriner Hekimliği Fakültesi, Universiti Putra Malaysia, Serdang, Malezya, 2 UPM-MAKNA Kanser Araştırma Laboratuvarı, Biyobilim Enstitüsü, Universiti Putra Malaysia, Serdang, Malezya, 3 Klinik Çalışmalar Bölümü, Ontario Veteriner Koleji, Guelph Üniversitesi, Guelph, ON, Kanada, 4 Onkoloji Bölümü, Lakeshore Hayvan Sağlığı Ortakları, Mississauga, ON, Kanada, 5 Sorumlu ve Etik Yapay Zekayı Geliştirme Merkezi, Guelph Üniversitesi, Guelph, ON, Kanada, 6 ANI. ML Research, ANI.ML Sağlık A.Ş, Toronto, ON, KanadaAÇIK ERİŞİM DÜZENLEYEN Antonio Giuliano, Hong Kong Şehir Üniversitesi, Hong Kong ÖİB, ÇinİNCELEYEN Petros Frezoulis, Southfields Veteriner Uzmanları, Birleşik Krallık Angelo Capasso, Dick White Referrals, Birleşik Krallık *İLETİŞİM Siew Mei Ong siewmei@upm.edu.my Michelle L. Oblak moblak@uoguelph.ca TESLİM: 30 Ekim 2024 KABUL: 23 Aralık 2024 YAYIN: 21 Ocak 2025 ATIFTA BULUNMAK İÇİN: Ong SM, McKenna C, Pinard C, Richardson D and Oblak ML (2025) Clinical outcomes of dogs with high-grade cutaneous mast cell tumors Front. Vet. Sci. 11:1519636. doi: 10.3389/fvets.2024.1519636 COPYRIGHT © 2025 Ong, McKenna, Pinard, Richardson ve Oblak. Bu makale Creative Commons Attribution License (CC BY) koşulları altında dağıtılan açık erişimli bir makaledir. Orijinal yazar(lar)a ve telif hakkı sahip(ler)ine atıfta bulunulması ve bu dergideki orijinal yayına atıfta bulunulması koşuluyla, kabul edilmiş akademik uygulamalara uygun olarak diğer forumlarda kullanılmasına, dağıtılmasına veya çoğaltılmasına izin verilir. Bu şartlara uymayan hiçbir kullanım, dağıtım veya çoğaltmaya izin verilmez. |
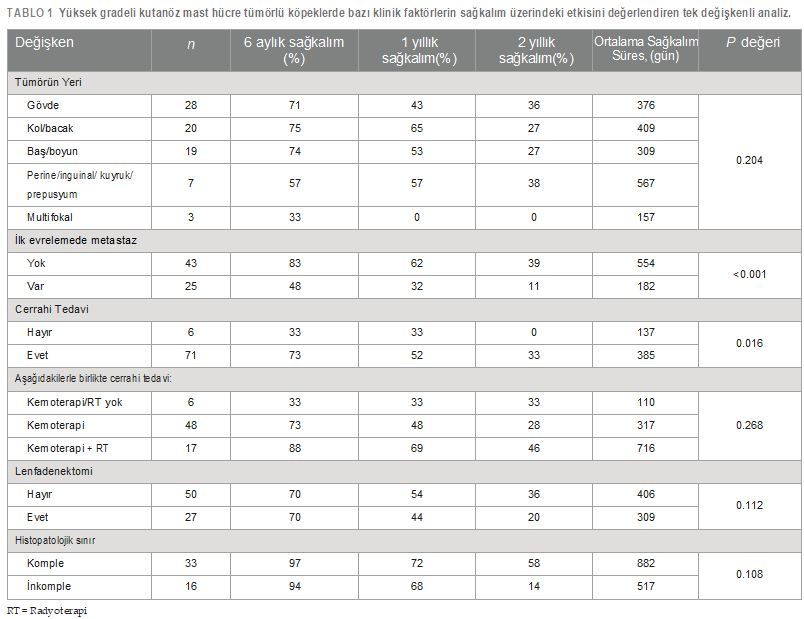
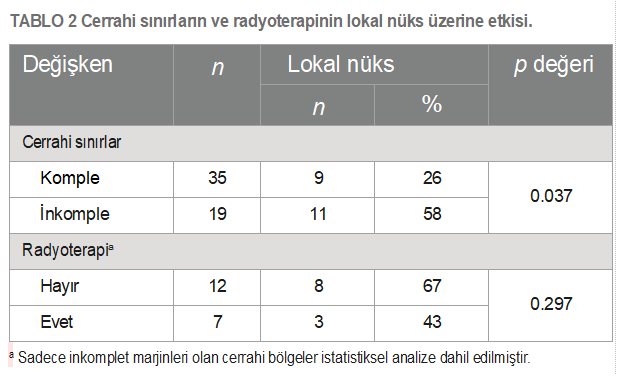
| Amaçlar: Yüksek gradeli kutanöz mast hücreli tümörlü (HGMCT) köpeklerde prognostik faktörleri ve tedavi sonuçlarını değerlendirmek. Yöntemler: Histopatolojik tanısı HGMCT olan köpeklerin tıbbi kayıtları tek bir kurumdan incelendi. Klinik faktörler, tedaviyle ilişkili değişkenler ve adjuvan tedaviler, klinik sonuçlarla ilişkilerini değerlendirmek için belgelendi. Karşılaştırmalı ve sağkalım analizleri Kaplan-Meier sağkalım analizi, log-rank ve Fisher’s exact testleri kullanılarak yapıldı. Sonuçlar: Toplam 77 köpeğin ortalama sağkalım süresi 317 gün (dağılım 20-3.041 gün) olup 6 aylık, 1 yıllık ve 2 yıllık sağkalım oranları sırasıyla %69, 50 ve 30’dur. Cerrahi olarak tedavi edilen köpeklerin sağkalım süreleri önemli ölçüde uzamış ve 5,5 aydan fazla hayatta kalma olasılıkları 6,88 kat daha fazla olmuştur. İlk evrelemede metastaz görülmesi daha kötü sonuçlara yol açmıştır; ilk evrelemede metastaz görülmeyen köpeklerin 2 yıldan sonra hayatta kalma olasılığı 6,94 kat daha yüksektir. İnkomplet sınırlara sahip cerrahi bölgeler, temiz marjinlere (%26) kıyasla daha yüksek lokal nüks oranına (%58) sahipti. Agresif tedaviye rağmen, eş zamanlı cerrahi ve adjuvan tedavi alan köpeklerin %75’inde hastalık ilerlemesi görülmüştür. Lenf nodu ekstirpasyonu, tümör lokalizasyonu, tümör sayısı ve lokal nüks genel sonuçla ilişkili bulunmamıştır. Klinik önemi: Agresif lokal tedavi ve adjuvan sistemik kemoterapi kombinasyonu, HGMCT’li köpeklerde kayda değer bir sağkalım faydası sağlamaktadır. Lokorejyonel lenf nodu ekstirpasyonunun sınırlı terapötik faydası, sistemik kemoterapiye rağmen ısrarla yüksek seyreden metastatik oranla birleştiğinde, HGMCT hastaları için daha etkili bölgesel ve sistemik tedavi yaklaşımlarına duyulan kritik ihtiyacı ön plana çıkarmaktadır. ANAHTAR KELİMELER köpek, yüksek grade’li kutanöz mast hücreli tümör, cerrahi eksizyon, lenfadenektomi, adjuvan tedavi |
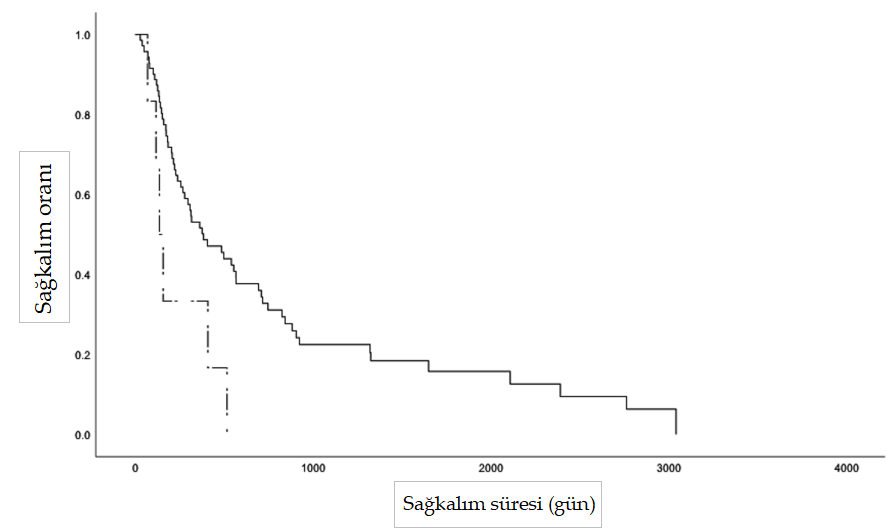
| Giriş Mast hücreleri, çeşitli enflamatuar ve immünolojik reaksiyonlardaki merkezi rolleriyle yaygın olarak tanınan granüler immün hücrelerdir (1, 2). Bu hücreler hematopoetik kök hücrelerden türemekte ve çeşitli dokulara, özellikle de deri, solunum yolu ve gastrointestinal sistem gibi dış ortama maruz kalan yüzeylere doğru yayılmaktadır (1, 2). Mast hücrelerinin neoplastik dönüşümünün arkasındaki mekanizmalar büyük ölçüde hala belirsizliğini korumaktadır; ancak altta yatan genetik nedenler ve KIT mutasyonları işaret edilmiştir (3–6).Mast hücre tümörleri köpeklerde en sık görülen kutanöz malignite olup, biyolojik davranış ve prezentasyon açısından önemli farklılıklar göstermekte, iyi huyludan belirgin şekilde daha fazla metastatik potansiyele sahip oldukça agresif formlara kadar çeşitlilik göstermektedir (7–11). Ayrıca, mast hücre granüllerinden histamin, heparin, eozinofil kemotaktik faktör ve proteolitik enzimlerin salınımına atfedilebilen, Darier belirtisi, gastrointestinal ülserasyon, koagülopati, hipotansiyon ve dolaşım kollapsı gibi paraneoplastik bozuklukların ortaya çıkması, bu tümörlerin yönetiminde ek zorluklar ortaya çıkarmaktadır (12–14). Histolojik grade (10, 11, 15–17), mitotik sayı (18), klinik evre (19, 20), anatomik yerleşim (21), mikrodamar yoğunluğu (22) ve c-kit gen mutasyonları (6, 23, 24) gibi faktörlerin araştırılmasıyla birlikte, tedavi kararlarını yönlendirmek için prognostik belirteçlerin araştırılmasına büyük önem verilmiştir.Histolojik grade genellikle köpek kutanöz mast hücre tümörleri (MCT’ler) için en güvenilir ve tutarlı şekilde öngörücü faktör olarak kabul edilir (10, 11,16, 20). 1984’ten beri yaygın olarak benimsenen 3 aşamalı grade şeması (Patnaik), kutanöz MCT’leri grade I (düşük grade), II (orta grade) veya III (yüksek grade) olarak sınıflandırırken (10), yeni önerilen 2 aşamalı grade şeması (Kiupel) bunları düşük ve yüksek grade olarak ayırmaktadır (16). Düşük grade’li kutanöz mast hücreli tümörlerin (LGMCT’ler) çoğu sadece geniş cerrahi eksizyon ile etkili bir şekilde tedavi edilir, ancak LGMCT’lerin küçük bir alt kümesi agresif davranış sergileyerek metastaza ve potansiyel olarak ölüme yol açabilir (25). Buna karşın, yüksek grade’li tümörlere sahip köpeklerin prognozu daha kötüdür; metastaz oranları %55 ila 96 arasında değişmekte ve ölümler genellikle tanıdan sonraki ilk yıl içinde gerçekleşmektedir (10, 11, 16, 17, 20, 26). Son yıllarda, neoadjuvan vinblastin uygulaması (27), vinblastin ve toceranib fosfat ile kombinasyon tedavisi (28), lomustin ve prednizon tedavisi (29) ve lenf nodu ekstirpasyonu (30) dahil olmak üzere HGMCT’lerin davranışını ve terapötik stratejilerini değerlendirmek için çok sayıda klinik çalışma yapılmıştır. Ancak bunların çoğu, muhtemelen HGMCT’lerin düşük insidansı (%4-20) ve randomize kontrollü çalışmaların karmaşıklığı nedeniyle, yetersiz derecede küçük örneklem boyutlarına sahip randomize olmayan çalışmalardı (10, 16, 31, 32). Bu retrospektif çalışmanın amacı, klinik ortamda farklı terapötik protokollerle tedavi edilen HGMCT’li köpeklerdeki prognostik faktörler ve sonuçlar hakkındaki mevcut anlayışımızı genişletmektir. Yöntemler Guelph Üniversitesi Ontario Veteriner Hekimliği Fakültesi Evcil Hayvan Hastanesine başvuran müşterilerin sahip olduğu köpeklerin tıbbi kayıtları, 2007 ile 2024 yılları arasında yüksek grade (Kiupel), Kiupel yüksek grade ile uyumlu histolojik kriterlere sahip grade II (Patnaik) veya grade III kutanöz MCT’lerin histopatolojik tanıları için retrospektif olarak incelenmiştir. Yalnızca en az 6 aylık takip süresi olan veya HGMCT tanısından sonraki 6 ay içinde ölen köpekler analize dahil edilmiştir. En az biri HGMCT olmak üzere birden fazla MCT’si olan köpekler ve dahil edilme kriterlerini karşılayan ölüm sonrası HGMCT teşhisi konulan köpekler de analize dahil edilmiştir. Mukokutanöz veya subkutanöz tümörü olan köpekler bu çalışmanın dışında tutulmuştur. Tıbbi kayıtlardan toplanan veriler arasında hasta özellikleri (yaş, ırk, cinsiyet ve vücut ağırlığı), tanısal ve ilk evreleme incelemeleri, tedavi ayrıntıları (insizyonel veya eksizyonel biyopsi tarihi, cerrahi eksizyonun tam olup olmadığı, lenfadenektomi) ve uygulandıysa kemoterapi ve radyoterapi bilgileri yer almıştır. Mevcut olduğunda ölüm sonrası bulgular da kaydedilmiştir. Takip bilgileri tıbbi kayıtlardan alınmış veya sevk eden veteriner hekimlerle telefon iletişimi yoluyla elde edilmiştir. Değerlendirilen tümör özellikleri arasında anatomik yerleşim (baş/boyun, gövde, uzuv, perine/inguinal/prepuce/kuyruk veya tümörler bu bölgelerden birden fazlasında bulunuyorsa multifokal) ve daha önce MCT öyküsü olup olmadığı yer almıştır. Rezeksiyon sınırında mikroskobik rezidüel tümör yoksa cerrahi eksizyon tam olarak kabul edildi ve rezeksiyon sınırında rezidüel tümör varlığı inkomplet eksizyon olarak kabul edildi. Lokal nüks, cerrahi bölgede veya tıbbi kayıtlarda belirtildiği şekilde bir tümörün yeniden büyümesi olarak tanımlanmış ve tedavi başlangıcından sonra uzak bölgelerde gelişen tümörler de novo lezyonlar olarak sınıflandırılmıştır. Metastatik hastalığın yeri, yeniden evreleme prosedürleri veya post-mortem inceleme sırasında sitolojik veya histolojik bulgulara dayanarak kaydedilmiştir. Ortalama sağkalım süresi, tedaviye başlama tarihinden (cerrahi veya neoadjuvan kemoterapi) ölüm veya sansür tarihine kadar hesaplanmıştır. Köpekler takipte kaybedildiklerinde, MCT ile ilişkili olmayan nedenlerle öldüklerinde veya istatistiksel analiz sırasında hayatta olduklarında sansürlenmiştir. Sürekli veriler Shapiro-Wilk testi kullanılarak normallik açısından analiz edilmiştir. Normal dağılım gösteren veriler ortalama ± SD olarak, normal dağılım göstermeyen veriler ise ortalama (aralık) olarak ifade edilmiştir. Sağkalım grafikleri Kaplan-Meier çarpım-limit yöntemi kullanılarak oluşturulmuştur. MST ile ilişki açısından değerlendirilen değişkenler arasında cinsiyet, anatomik konum, ilk evrelemede metastaz varlığı, tedavi protokolü (cerrahi eksizyon, lenfadenektomi ve radyoterapi [RT] ile birlikte veya tek başına kemoterapi uygulanması) ve cerrahi eksizyonun tamlığı yer almıştır. Çeşitli kategorik değişkenler ve sonuçlar (cerrahi sınır, lokal nüks ve metastaz) arasındaki ilişkiler Fisher’in kesin testi kullanılarak değerlendirilmiştir. Tüm istatistiksel analizler SPSS Statistics sürüm 29.0 (IBM Corp., Armonk, NY, ABD) kullanılarak gerçekleştirilmiş ve <0.05 p-değerleri anlamlı kabul edilmiştir. Bulgular Bu çalışmaya sahipli yetmiş yedi köpek dahil edilmiştir. Ortalama teşhis yaşı 8,3 ± 0,3 yaş (dağılım 2,0-13,8 yaş) ve ortalama ağırlık 28,5 kg (dağılım 3,4-83,0 kg) idi. Çalışma popülasyonu 39 kısırlaştırılmış dişi, 1 kısırlaştırılmamış dişi, 34 kısırlaştırılmış erkek ve 3 kısırlaştırılmamış erkekten oluşmuştur. Yirmi altı ırk tespit edilmiştir; Labrador Retrieverler (n = 17, %22), karışık ırklar (n = 17, %22) ve Golden Retrieverler (n = 7, %9) yüksek oranda görülmüştür. Karışık ırk kategorisine dahil edilen altı retriever melezi ile birlikte retrieverlar çalışma popülasyonunun %39’unu (n = 30) oluşturmuştur. Boston Terrier (n = 3), Amerikan Bulldog (n = 2), Fransız Bulldog (n = 2), İngiliz Bulldog (n = 1) ve Alapaha Blue Blood Bulldog (n = 1) gibi Bulldog ile ilişkili ırklar %12’lik bir oranı oluşturmuştur. Primer HGMCT yerleşimi gövde (n = 28, %36), ekstremite (n = 20, %26), baş/boyun (n = 19, %25), perine/ inguinal/kuyruk sokumu/prepuce (n = 7, %9) ve multifokal (n = 3, %4) şeklinde kaydedilmiştir. Evreleme araştırmaları standardize edilmemişti ancak torasik radyografiler (n = 59, %77), abdominal ultrason (n = 67, %87), bölgesel lenf düğümlerinin sitolojik ve/veya histolojik değerlendirmesi (n = 32, %41), karaciğerin sitolojisi (n = 46, %60), dalak (n = 50, %65), ve kemik iliği (n = 2, %0,03) ve bilgisayarlı tomografi (n = 2, %0,03) ve manyetik rezonans (n = 1, %0,01) yoluyla görüntüleme yapılmıştır. Bölgesel lenf nodu tutulumu olan 22, hem lenf nodlarına hem de dalağa metastazı olan iki ve lenf nodlarına, dalağa ve karaciğere yayılımı olan bir köpek dahil olmak üzere 25 köpekte (%37) metastaz tespit edilmiştir. Ayrıca, HGMCT’li 23 köpekte (%30) LGMCT veya deri altı MCT de vardı. Köpeklere her 3 veya 6 ayda bir torasik radyografiler, abdominal ultrason ve karaciğer, dalak, bölgesel lenf düğümleri ve yeni tümörlerin sitolojik muayenesi dahil olmak üzere klinisyen veya sahibinin takdirine bağlı olarak çeşitli standartlaştırılmamış yeniden evreleme prosedürleri uygulanmıştır. Sekiz köpek üzerinde post-mortem muayene (PM) gerçekleştirilmiştir. Çalışmanın sonunda, çalışma popülasyonunun %58’inde (n = 45) metastaz belgelenmiştir. En sık etkilenen bölgeler lenf düğümleri (n = 27, 6’sı PM ile doğrulandı), dalak (n = 14, 4’ü PM ile doğrulandı) ve karaciğer (n = 10, 5’i PM ile doğrulandı) idi. Daha az sıklıkla etkilenen ve tamamı PM yoluyla tespit edilen bölgeler arasında böbrekler (n = 3), akciğerler (n = 2), kalp (n = 2) ve kemik iliği (n = 2) yer almaktadır. Adrenal bez, plevra, pankreas, gastrointestinal sistem, omentum ve mezenterde tek vakalar gözlenmiştir. Genel ortalama sağkalım süresi (MST) 317 gün (dağılım 20-3.041 gün) olup, 6 aylık, 1 yıllık ve 2 yıllık sağkalım oranları sırasıyla %69, 50 ve 30’dur. HGMCT’lerin primer tümör lokasyonu ve ek LGMCT veya subkutan MCT varlığının metastaz veya MST üzerinde önemli bir etkisi olmamıştır. Bununla birlikte, ilk evrelemede metastaz görülen köpeklerin MST süresi anlamlı derecede kısaydı (p < 0.001, MST = 182 gün, Şekil 1). Özellikle, ilk evrelemede metastazı olmayan köpeklerin 2 yıldan sonra hayatta kalma olasılığı 6,94 kat daha yüksekti. Kohorttan 65 köpek tümör rezeksiyonunu takiben kemoterapi almış, altı köpeğe sadece cerrahi tedavi uygulanmış, beş köpek RT ile birlikte veya RT olmadan kemoterapi ile tedavi edilmiş ve bir köpek klinisyen veya sahibinin takdirine bağlı olarak herhangi bir tedavi almamıştır. Birinci basamak ve kurtarma kemoterapileri vinblastin bazlı protokoller, CCNU bazlı protokoller, tirozin kinaz inhibitörleri (toceranib, imatinib veya masitinib), siklofosfamid ile vinkristin, intralezyonel triamsinolon enjeksiyonu, hidroksiüre ve prednizonu içeriyordu. Cerrahi tedavi uygulanan köpeklerin MST süresi (n = 71, MST = 385 gün) sadece cerrahi olmayan tedavi uygulanan köpeklerden (n = 6, MST = 137 gün, p = 0.016, Şekil 2) daha uzundu. Cerrahi tedavi uygulanan köpeklerin 5,5 aydan fazla hayatta kalma olasılığı 6,88 kat daha yüksekti. Agresif tedaviye rağmen, eş zamanlı cerrahi ve cerrahi olmayan tedavi (n = 65) alan köpeklerin %75’inde (n = 49) de novo lezyonlar (n = 32, %49), lokal nüks (n = 17, %26) ve lenf nodlarına (n = 24, %37), dalağa (n = 12, %18) ve karaciğere (n = 8, %12) metastazlar dahil olmak üzere hastalık ilerlemesi görülmüştür. İstatistiksel olarak anlamlı olmasa da, kombine kemoterapi ve RT alan cerrahi hastalar (n = 17, MST = 716 gün) sadece kemoterapi alanlara (n = 48, MST = 317 gün, Tablo 1) göre daha iyi sağkalım sonuçları göstermiştir. Herhangi bir tedavi uygulanmayan köpek, hastalığın ilerlemesi nedeniyle insancıl ötenazi uygulanmadan önce 409 gün hayatta kalmıştır. Lenfadenektomi 27 köpeğe (%35) uygulanmış ve bunların 25’i için histopatolojik analiz yapılmıştır. Çıkarılan düğümlerin %63’ünde (n = 17) lenf düğümü metastazı tespit edilmiştir. Lenf nodu eksizyonu önemli bir sağkalım avantajı sağlamadığı gibi (Tablo 1), metastatik yayılımda da kayda değer bir azalmaya yol açmamıştır. Ayrıca, lenfadenektomi metastatik lenf düğümleri olan köpekler için net bir sağkalım faydası sağlamamıştır (p = 0.694). 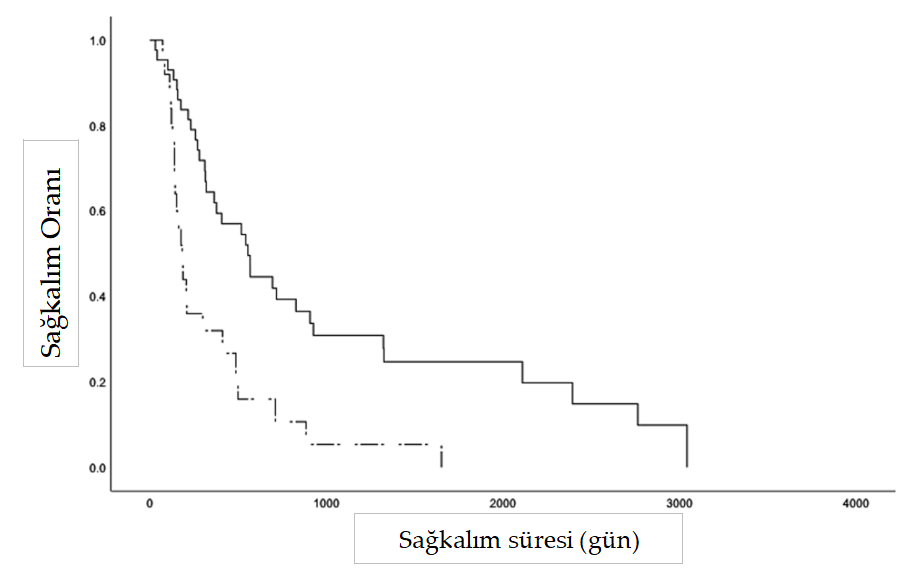
|
| Lenfadenektomi yapılmayan metastatik lenf nodu olan köpekler için Ortalama Sağkalım Süresi (MST) 161 gün iken, prosedür uygulananlar için bu süre 182 gündü. Cerrahi sınırların lokal nüks üzerindeki etkisini değerlendirmek için, nüks 6 ay içinde meydana gelmediği sürece, yalnızca ameliyat sonrası minimum 6 aylık takip süresi olan cerrahi bölgeler analiz edilmiştir. Rekürren HGMCT’ler de dahil olmak üzere 49 köpekten cerrahi olarak çıkarılan toplam 54 HGMCT bu kriteri karşılamıştır (dahil edilen köpeklerin %64’ü). Tamamlanmamış cerrahi sınırlar lokal nüks ile anlamlı derecede ilişkiliydi (olasılık (odds) oranı = 3.97, p = 0.037, Tablo 2), ancak postoperatif metastaz gelişimi veya sağkalım süresi ile ilişkili değildi. Tam olmayan cerrahi sınırlara sahip 19 kitlenin 11’inde (%58) lokal yeniden büyüme gelişirken, tam sınırlara sahip 35 kitlenin dokuzunda (%26) nüks görüldü. Lokal nükse kadar geçen ortalama süre 140 gündü. İnkomplet sınırlara sahip 19 cerrahi bölgenin yedisi RT ile tedavi edildi ve bu bölgelerin %43’ünde (n = 3) MCT yeniden büyüdü. Bu çalışmadan elde edilen verilere göre, eş zamanlı kemoterapi ve RT’nin lokal nüks açısından anlamlı bir faydası görülmemiştir (Tablo 2). Çalışmanın sonunda 62 köpek aşağıdaki nedenlerle ölmüş veya ötenazi uygulanmıştır: MCT ile ilişkili nedenler (n = 52), belirlenemeyen nedenler (n = 6) ve MCT ile ilişkili olmayan nedenler (n = 4). On beş köpek analizden çıkarılmıştır; bunlardan 12’si hala hayattadır ve üçü takipten çıkarılmıştır. Çalışma popülasyonunun bir alt kümesi aşağıdaki komorbiditelerden bir veya daha fazlasına sahipti: kardiyovasküler bozukluklar (n = 9), nörolojik hastalıklar (n = 5), kas-iskelet sistemi hastalıkları (n = 3), melanom (n = 2), hemanjiyosarkom (n = 1), skuamöz hücreli karsinom (n = 1), renal adenokarsinom (n = 1), anaplastik karsinom (n = 1), yumuşak doku sarkomu (n = 1), primer akciğer histiyositik sarkomu (n = 1), duodenal kitle (n = 1) ve kronik böbrek yetmezliği (n = 1). Cinsiyet, başvuru sırasındaki MCT sayısı, lokal nüks ve sağkalım süresi arasında bir ilişki bulunmamıştır. Tartışma |
| LGMCT’li köpekler, primer tümörün tam eksizyonunu takiben iyi bir uzun vadeli prognoza sahip olabilir, bu da yeterli sınırlarla geniş cerrahi eksizyonu başarılı bir sonuç için çok önemli hale getirir (35). Bulgularımız, HGMCT’lerde yetersiz cerrahi sınırların, köpeklerin %58’inde meydana gelen lokal tümör yeniden büyüme riskini artırdığını göstermiştir. Tam eksizyonla bile, tümörlerin %26’sının tam rezeksiyondan sonra nüks etmesiyle önemli bir nüks riski devam etmiştir. Bu bulgu, tam rezeksiyona rağmen HGMCT’lerde (%36) LGMCT’lere (%4) kıyasla önemli ölçüde daha yüksek bir lokal nüks oranı bildiren önceki bir çalışma ile tutarlıdır (35). Bununla birlikte, bu çalışmada cerrahi sınır değerlendirmesinin doğruluğu, histolojik tümörsüz sınırları ölçmek için kullanılan yöntem nedeniyle tehlikeye girmiş olabilir. Tamamlanmamış sınırların belirlenmesinde daha yüksek hassasiyete sahip olduğu bilinen bir teknik olan tanjansiyel kesit alma (36) tutarlı bir şekilde uygulanmamıştır ve yanlış negatif sınıflandırmalara neden olmuş olabilir. Veteriner onkolojide, tam bir histolojik eksizyonun tanımı, tutarsız bir şekilde uygulanan ve genellikle destekleyici kanıtlardan yoksun olan değişen tümörsüz kenar genişlikleri ile tanımlanmamıştır. Bu boşluğu gidermek için, insan onkolojisinde yaygın olarak kullanılan ve 0 mm’den büyük bir histolojik tümörsüz sınırın tam eksizyon olarak kabul edildiği ve insanlarda çoğu malign tümör için yüksek prognostik olan R sınıflandırma sistemini kullandık (37). Teorik olarak, inkomplet cerrahi eksizyon yapılan tüm hastalarda lokal yeniden büyüme beklenir, ancak bu çalışmada bu gözlenmemiştir. Bunu açıklamak için ameliyat sonrası immün infiltrasyon ve tümör hücrelerinin eradikasyonu, bağ dokularından gelen anti-invazyon faktörlerinin inhibe edici etkileri, rezidüel hücrelerin hayatta kalmalarını desteklemek için otokrin büyüme faktörleri salgılayamaması ve analizler sırasında hatalı hasta kategorizasyonuna neden olan yetersiz takip süresi gibi çeşitli faktörler öne sürülmüştür (38). İlginç bir şekilde, tamamen rezeke edilen tümörlerde bile lokal nüks oranı yüksek kalmıştır. Bu tekrarlayan lezyonlar, gerçek lokal nükslerden ziyade, cerrahi sırasında çıkarılmayan çevredeki uydu tümör hücresi popülasyonlarından veya cerrahi skarların yakınındaki de novo tümörlerden kaynaklanıyor olabilir. Diğer literatürlerin aksine, lokal nüks ile metastaz ve sağkalım süresi arasında negatif bir ilişki olduğuna dair kanıt bulamadık (15, 39). Nodal metastaz, ilk tanıda hastaların %37’sinde görülmüş ve daha önceki raporlarla karşılaştırılabilir şekilde daha kötü bir sağkalım sonucuyla ilişkilendirilmiştir (15, 19, 40). Bu çalışmadan elde edilen veriler şaşırtıcı bir şekilde nodal metastazı olan köpeklerde lenfadenektominin önemli bir sağkalım avantajı olduğunu gösterememiştir. Bu durum, lenfadenektomi sırasında nodal metastazı olan hasta sayısının az olmasından kaynaklanıyor olabilir ve istatistiksel analizlerimizi etkilemiş olabilir. Birçok çalışma MCT’li köpeklerde metastatik lenf nodu ekstirpasyonunun olumlu bir terapötik etkisi olduğunu göstermiştir ve son zamanlarda terapötik lenfadenektomi veteriner cerrahi onkolojide artan bir ilgi görmüştür (15, 30, 41, 42). Bu çalışmada sağkalım faydası görülmemesi, potansiyel olarak metastatik lenf düğümlerini gözden kaçıran seçici olmayan nodal diseksiyon tekniğine bağlanabilir. Tümörlerin lenfatik drenaj paterninin anormal olabileceği ve tümör kaynaklı lenfagiogenez nedeniyle köpek hastaların %63’üne kadarında bölgesel lenf nodlarına karşılık gelmediği gösterilmiştir (43–45). Bu nedenle, seçici olmayan nodal diseksiyon yetersiz tedaviye neden olabilir ve lenfadenektominin terapötik etkinliğini zayıflatabilir. Ek olarak, bu çalışmadaki köpeklere farklı evreleme prosedürleri uygulanmıştır, bu da bazı hastaların ilk tanı sırasında düşük evrelenmiş olabileceği anlamına gelmektedir. HGMCT’lerin yüksek oranda metastatik olduğu iyi bilinmektedir. Sonuç olarak, tümör hücrelerinin sistemik yayılım olasılığını azaltmak için görünür metastaz gözlenmediğinde bile adjuvan kemoterapi uygulanması standart tedavi haline gelmiştir (20). Adjuvan sistemik tedavi hastalığın ilerlemesini süresiz olarak durdurmamıştır; başlangıçta metastazı olmayan köpeklerin %79’unda (n = 31/39) daha sonra ilerleme görülmüş ve %38’inde (n = 15) kemoterapiye rağmen metastatik hastalık gelişmiştir. Ayrıca, köpeklerin %65’i RT ile birlikte veya RT olmaksızın cerrahi ve kemoterapi kombinasyon tedavisine rağmen hastalıklarına yenik düşmüştür. Bu durum, köpeklerin bu alt kümesi için daha etkili tedavi rejimlerine veya stratejilerine duyulan ihtiyacın altını çizmektedir. Bununla birlikte, RT’li veya RT’siz adjuvan sistemik tedavinin uzayan sağkalım süresine katkısı göz ardı edilmemelidir. Bu çalışmadaki MST, 1 yıllık ve 2 yıllık sağkalım oranları, yalnızca cerrahi tedavi uygulanan köpekler üzerinde yapılan önceki çalışmalarda bildirilenlerden daha uzundur (16, 19, 33, 34). Bu çalışmada gözlemlenen retriever ve bulldog ile ilişkili ırkların MCT’lere olan yatkınlığı önceki raporlarla tutarlılık göstermektedir (46, 47). İnguinal ve perineal bölgelerdeki mast hücreli tümörler tarihsel olarak olumsuz bir sonuçla ilişkilendirilmiştir ve son literatür bu bölgelerde HGMCT gelişme riskinin arttığını göstermiştir (32). Bununla birlikte, verilerimiz HGMCT’lerin çoğunun gövde (%36), ekstremite (%26) ve baş/boyun (%25) yerleşimli olduğunu göstermektedir ve bu yerleşimler ile prognoz arasında anlamlı bir ilişki gösteremedik. Sfiligoi ve arkadaşları (48) ayrıca perineal ve inguinal bölgelerde MCT’si olan köpeklerin daha kötü bir prognoza sahip olmayabileceğini öne sürmüştür. Bu bulgu, klinisyenlerin daha bilinçli tedavi kararları vermesine yardımcı olabilecek tümör lokalizasyonunun prognostik etkisini belirlemek için daha fazla araştırma yapılmasını gerektirmektedir. Bu çalışmanın retrospektif doğası, dikkat edilmesi gereken sınırlamalar sunmaktadır. Birincil sınırlama, klinik evre ve tümör çapına göre tabakalandırma yapılmamasıdır, bu da potansiyel olarak bulgulara önyargı katmaktadır. Moore ve arkadaşları (18), evre I HGMCT ve 25 mm’den küçük tümör çapına sahip köpeklerin olumlu sonuçlar elde edebileceğini göstermiş ve gelecekteki analizlerde bu tür tabakalamanın gerekliliğinin altını çizmiştir. Ayrıca, bu çalışma popülasyonundaki histopatolojik lamları ve hastaları sırasıyla farklı patologlar ve klinisyenler incelemiş, bu da potansiyel patologlar ve klinisyenler arası değişkenliğe yol açmıştır. Diğer kısıtlamalar arasında, tedavi edilen ve edilmeyen köpekler arasındaki sonuçları karşılaştırmak için bir kontrol grubunun olmaması ve belirli tedavi gruplarındaki küçük örneklem büyüklüğü yer almaktadır. Hastalığın ilerleme tarihi tıbbi kayıtlarda aynı şekilde mevcut olmadığından ve bazı köpekler daha fazla tanısal doğrulama yapılmaksızın ilgili klinisyenin klinik yargısına göre nüks olarak sınıflandırıldığından, ilerlemesiz aralık incelenmemiştir. Bu çalışmanın sonuçları, lokal tümör kontrolü ve adjuvan medikal tedavinin, sadece cerrahi tedavi uygulanan HGMCT’li köpeklerin sonuçlarını değerlendiren diğer çalışmalardan elde edilen bulgularla karşılaştırıldığında, HGMCT’li köpekler için bir sağkalım avantajı sağladığını göstermektedir. İlk tanıda metastaz prognozu olumsuz etkilediğinden, HGMCT’lerin erken teşhisi ve müdahalesi esastır. Lenfadenektomi bu çalışmada sonuçları iyileştirmemiştir; ancak, HGMCT’li köpeklerde sentinel lenf nodu haritalaması ve biyopsisinin faydalarına ilişkin daha fazla araştırma yapılması önerilmektedir. Tamamen rezeke edilen HGMCT’lerde yüksek lokal nüks oranı, cerrahların rezeksiyon teknikleri konusunda bilinçli kararlar almalarına ve klinik sonuçları iyileştirmelerine yardımcı olmak için daha güvenilir sonuç verilerine duyulan ihtiyacın altını çizmektedir. Son olarak, adjuvan kemoterapinin hastalığın ilerlemesini engellemedeki başarısızlığı önemli bir sorun olmaya devam etmekte ve HGMCT’ler için daha iyi tedavi stratejilerine olan acil ihtiyacı ortaya koymaktadır. Katkıda Bulunan Yazarlar: Finansman Çıkar çatışması beyanı Üretken yapay zeka beyanı Yayıncının notu |
| KAYNAKÇA 1. Galli SJ, Nakae S, Tsai M. Mast cells in the development of adaptive immune responses. Nat Immunol. (2005) 6:135–42. doi: 10.1038/ni1158 2. Elieh Ali Komi D, Wöhrl S, Bielory L. Mast cell biology at molecular level: a comprehensive review. Clin Rev Allergy Immunol. (2016) 58:342–65. doi: 10.1007/ s12016-019-08769-2 3. London CA, Kisseberth WC, Galli SJ, Geissler EN, Helfand SC. Expression of stem cell factor receptor (c-kit) by the malignant mast cells from spontaneous canine mast cell tumours. J Comp Pathol. (1996) 115:399–414. doi: 10.1016/S0021-9975(96)80074-0 4. London CA, Galli SJ, Yuuki T, Hu ZQ, Helfand SC, Geissler EN. Spontaneous canine mast cell tumors express tandem duplications in the proto-oncogene c-kit. Exp Hematol. (1999) 27:689–97. doi: 10.1016/S0301-472X(98)00075-7 5. Letard S, Yang Y, Hanssens K, Palmérini F, Leventhal PS, Guéry S, et al. Gain-of- function mutations in the extracellular domain of KIT are common in canine mast cell tumors. Mol Cancer Res. (2008) 6:1137–45. doi: 10.1158/1541-7786.MCR-08-0067 6. Downing S, Chien MB, Kass PH, Moore PF, London CA. Prevalence and importance of internal tandem duplications in exons 11 and 12 of c- kit in mast cell tumors of dogs. Am J Vet Res. (2002) 63:1718–23. doi: 10.2460/AJVR.2002.63.1718 7. Bostock DE. Neoplasms of the skin and subcutaneous tissues in dogs and cats. Br Vet J. (1986) 142:1–19. doi: 10.1016/0007-1935(86)90002-3 8. Villamil JA, Henry CJ, Bryan JN, Ellersieck M, Schultz L, Tyler JW, et al. Identification of the most common cutaneous neoplasms in dogs and evaluation of breed and age distributions for selected neoplasms. J Am Vet Med Assoc. (2011) 239:960–5. doi: 10.2460/JAVMA.239.7.960 9. Rothwell TL, Howlett CR, Middleton DJ, Griffiths DA, Duff BC. Skin neoplasms of dogs in Sydney. Aust Vet J. (1987) 64:161–4. doi: 10.1111/J.1751-0813.1987.TB09673.X 10. Patnaik AK, Ehler WJ, MacEwen EG. Canine cutaneous mast cell tumor: morphologic grading and survival time in 83 dogs. Vet Pathol. (1984) 21:469–74. doi: 10.1177/030098588402100503 11. Murphy S, Sparkes AH, Brearley MJ, Smith KC, Blunden AS. Relationships between the histological grade of cutaneous mast cell tumours in dogs, their survival and the efficacy of surgical resection. Vet Rec. (2004) 154:743–6. doi: 10.1136/ VR.154.24.743 12. Howard EB, Sawa TR, Nielsen SW, Kenyon AJ. Mastocytoma and gastroduodenal ulceration: gastric and duodenal ulcers in dogs with mastocytoma. Vet Pathol. (1969) 6:146–58. doi: 10.1177/030098586900600205 13. Ishiguro T, Kadosawa T, Takagi S, Kim G, Ohsaki T, Bosnakovski D, et al. Relationship of disease progression and plasma histamine concentrations in 11 dogs with mast cell tumors. J Vet Intern Med. (2003) 17:194–8. doi: 10.1111/J.1939-1676.2003.TB02433.X 14. O’Keefe DA, Couto CG, Burke-Schwartz C, Jacobs RM. Systemic mastocytosis in 16 dogs. J Vet Intern Med. (1987) 1:75–80. doi: 10.1111/J.1939-1676.1987.TB01990.X 15. Hume CT, Kiupel M, Rigatti L, Shofer FS, Skorupski KA, Sorenmo KU. Outcomes of dogs with grade 3 mast cell tumors: 43 cases (1997-2007). J Am Anim Hosp Assoc. (2011) 47:37–44. doi: 10.5326/JAAHA-MS-5557 16. Kiupel M, Webster JD, Bailey KL, Best S, DeLay J, Detrisac CJ, et al. Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Vet Pathol. (2011) 48:147–55. doi: 10.1177/ 0300985810386469 17. Takeuchi Y, Fujino Y, Watanabe M, Takahashi M, Nakagawa T, Takeuchi A, et al. Validation of the prognostic value of histopathological grading or c-kit mutation in canine cutaneous mast cell tumours: a retrospective cohort study. Vet J. (2013) 196:492–8. doi: 10.1016/J.TVJL.2012.11.018 18. Moore AS, Frimberger AE, Taylor D, Sullivan N. Retrospective outcome evaluation for dogs with surgically excised, solitary Kiupel high-grade, cutaneous mast cell tumours. Vet Comp Oncol. (2020) 18:402–8. doi: 10.1111/vco.12565 19. Murphy S, Sparkes AH, Blunden AS, Brearley MJ, Smith KC. Effects of stage and number of tumours on prognosis of dogs with cutaneous mast cell tumours. Vet Rec. (2006) 158:287–91. doi: 10.1136/VR.158.9.287 20. London CA, Thamm DH. Mast cell tumours. Withrow and MacEwen’s small animal clinical oncology. St. Louis: Saunders Elsevier (2013). p. 335–355 21. Hillman LA, Garrett LD, de Lorimier LP, Charney SC, Borst LB, Fan TM. Biological behavior of oral and perioral mast cell tumors in dogs: 44 cases (1996-2006). J Am Vet Med Assoc. (2010) 237:936–42. doi: 10.2460/JAVMA.237.8.936 22. Preziosi R, Sarli G, Paltrinieri M. Prognostic value of intratumoral vessel density in cutaneous mast cell tumours of the dog. J Comp Pathol. (2004) 130:143–51. doi: 10.1016/J.JCPA.2003.10.003 23. Kiupel M, Webster JD, Kaneene JB, Miller R, Yuzbasiyan-Gurkan V. The use of KIT and tryptase expression patterns as prognostic tools for canine cutaneous mast cell tumors. Vet Pathol. (2004) 41:371–7. doi: 10.1354/vp.41-4-371 24. Mullins MN, Dernell WS, Withrow SJ, Ehrhart EJ, Thamm DH, Lana SE. Evaluation of prognostic factors associated with outcome in dogs with multiple cutaneous mast cell tumors treated with surgery with and without adjuvant treatment: 54 cases (1998–2004). J Am Vet Med Assoc. (2006) 228:91–5. doi: 10.2460/ JAVMA.228.1.91 25. Bae S, Milovancev M, Bartels C, Irvin VL, Tuohy JL, Townsend KL, et al. Histologically low-grade, yet biologically high-grade, canine cutaneous mast cell tumours: a systematic review and meta-analysis of individual participant data. Vet Comp Oncol. (2020) 18:580–9. doi: 10.1111/vco.12581 26. Weisse C, Shofer FS, Sorenmo K. Recurrence rates and sites for grade II canine cutaneous mast cell tumors following complete surgical excision. J Am Anim Hosp Assoc. (2002) 38:71–3. doi: 10.5326/0380071 27. Anderson K, Pellin M, Snyder E, Clarke D. Tumor grade and mitotic count are prognostic for dogs with cutaneous mast cell tumors treated with surgery and adjuvant or neoadjuvant vinblastine chemotherapy. Vet Sci. (2024) 11:363. doi: 10.3390/ VETSCI11080363 28. Todd JE, Nguyen SM, White J, Langova V, Thomas PM, Tzannes S. Combination vinblastine and palladia for high-grade and metastatic mast cell tumors in dogs. Can Vet J. (2021) 62:1335–40. 29. Hay JK, Larson VS. Lomustine (CCNU) and prednisone chemotherapy for high- grade completely excised canine mast cell tumors. Can Vet J. (2019) 60:1326–30. 30. Chalfon C, Sabattini S, Finotello R, Faroni E, Guerra D, Pisoni L, et al. Lymphadenectomy improves outcome in dogs with resected Kiupel high-grade cutaneous mast cell tumours and overtly metastatic regional lymph nodes. J Small Anim Pract. (2022) 63:661–9. doi: 10.1111/JSAP.13525 31. Pierini A, Lubas G, Gori E, Binanti D, Millanta F, Marchetti V. Epidemiology of breed-related mast cell tumour occurrence and prognostic significance of clinical features in a defined population of dogs in west-Central Italy. Vet Sci. (2019) 6:53. doi: 10.3390/vetsci6020053 32. Śmiech A, Ślaska B, Łopuszyński W, Jasik A, Bochyńska D, Dąbrowski R. Epidemiological assessment of the risk of canine mast cell tumours based on the Kiupel two-grade malignancy classification. Acta Vet Scand. (2018) 60:70. doi: 10.1186/ s13028-018-0424-2 33. Sabattini SI, Scarpa F, Berlato D, Bettini GI. Histologic grading of canine mast cell tumor: is 2 better than 3? Vet Pathol. (2015) 52:70–3. doi: 10.1177/0300985814521638 34. Bostock DE. The prognosis following surgical removal of mastocytomas in dogs. J Small Anim Pract. (1973) 14:27–40. doi: 10.1111/J.1748-5827.1973.TB06891.X 35. Donnelly L, Mullin C, Balko J, Goldschmidt M, Krick E, Hume C, et al. Evaluation of histological grade and histologically tumour-free margins as predictors of local recurrence in completely excised canine mast cell tumours. Vet Comp Oncol. (2015) 13:70–6. doi: 10.1111/VCO.12021 36. Dores CB, Milovancev M, Russell DS. Comparison of histologic margin status in low-grade cutaneous and subcutaneous canine mast cell tumours examined by radial and tangential sections. Vet Comp Oncol. (2018) 16:125–30. doi: 10.1111/ VCO.12321 37. Liptak JM. Histologic margins and the residual tumour classification scheme: is it time to use a validated scheme in human oncology to standardise margin assessment in veterinary oncology? Vet Comp Oncol. (2020) 18:25–35. doi: 10.1111/VCO.12555 38. Misdorp W. Incomplete surgery, local immunostimulation, and recurrence of some tumour types in dogs and cats. Vet Q. (1987) 9:279–86. doi: 10.1080/01652176. 1987.9694113 39. Hahn KA, King GK, Carreras JK. Efficacy of radiation therapy for incompletely resected grade-III mast cell tumors in dogs: 31 cases (1987–1998). J Am Vet Med Assoc. (2004) 224:79–82. doi: 10.2460/JAVMA.2004.224.79 40. Krick EL, Billings AP, Shofer FS, Watanabe S, Sorenmo KU. Cytological lymph node evaluation in dogs with mast cell tumours: association with grade and survival. Vet Comp Oncol. (2009) 7:130–8. doi: 10.1111/J.1476-5829.2009.00185.X 41. Marconato L, Polton G, Stefanello D, Morello E, Ferrari R, Henriques J, et al. Therapeutic impact of regional lymphadenectomy in canine stage II cutaneous mast cell tumours. Vet Comp Oncol. (2018) 16:580–9. doi: 10.1111/vco.12425 42. Baginski H, Davis G, Bastian RP. The prognostic value of lymph node metastasis with grade 2 MCTs in dogs: 55 cases (2001–2010). J Am Anim Hosp Assoc. (2014) 50:89–95. doi: 10.5326/JAAHA-MS-5997 43. Ran S, Volk L, Hall K, Flister MJ. Lymphangiogenesis and lymphatic metastasis in breast cancer. Pathophysiology. (2010) 17:229–51. doi: 10.1016/J.PATHOPHYS. 2009.11.003 44. Worley DR. Incorporation of sentinel lymph node mapping in dogs with mast cell tumours: 20 consecutive procedures. Vet Comp Oncol. (2014) 12:215–26. doi: 10.1111/J. 1476-5829.2012.00354.X 45. Ferrari R, Chiti LE, Manfredi M, Ravasio G, De Zani D, Zani DD, et al. Biopsy of sentinel lymph nodes after injection of methylene blue and lymphoscintigraphic guidance in 30 dogs with mast cell tumors. Vet Surg. (2020) 49:1099–108. doi: 10.1111/ VSU.13483 46. Mochizuki H, Motsinger-Reif A, Bettini C, Moroff S, Breen M. Association of breed and histopathological grade in canine mast cell tumours. Vet Comp Oncol. (2017) 15:829–39. doi: 10.1111/VCO.12225 47. Warland J, Dobson J. Breed predispositions in canine mast cell tumour: a single Centre experience in the United Kingdom. Vet J. (2013) 197:496–8. doi: 10.1016/J. TVJL.2013.02.017 48. Sfiligoi G, Rassnick KM, Scarlett JM, Northrup NC, Gieger TL. Outcome of dogs with mast cell tumors in the inguinal or perineal region versus other cutaneous locations: 124 cases (1990–2001). J Am Vet Med Assoc. (2005) 226:1368–74. doi: 10.2460/ JAVMA.2005.226.1368 |