| 1 Veteriner Kliniği ve Cerrahisi Bölümü, Minas Gerais Federal Üniversitesi, Belo Horizonte 31270-901, MG, Brezilya; rodrigohvet@gmail.com 2 Veteriner Klinik Bilimleri Bölümü, Jokey Kulübü Veteriner Fakültesi, Hong Kong Şehir Üniversitesi, Hong Kong, Çin; agiulian@cityu.edu.hk (A.G.); pbeczkow@cityu.edu.hk (P.M.B.) 3 Veteriner Tıp Merkezi, Hong Kong Şehir Üniversitesi, Hong Kong, Çin * Yazışma adresi: pedropimentel@vetufmg.edu.brAtıf için: Pimentel, P.A.B.; Giuliano, A.; Be˛czkowski, P.M.; Horta, R.D.S. Molecular Profile of Canine Hemangiosarcoma and Potential Novel Therapeutic Targets. Vet. Sci. 2023, 10, 387. https://doi.org/ 10.3390/vetsci10060387 Akademik Editör: Louise van der Weyden Teslim alındı: 14 Mayıs 2023 Revize edildi: 31 Mayıs 2023 Kabul edildi: 2 Haziran 2023 Yayınlanma tarihi: 5 Haziran 2023Telif hakkı: © 2023 yazarlar tarafından. Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution (CC BY) lisansının hüküm ve koşulları altında dağıtılan açık erişimli bir makaledir (https:// creativecommons.org/licenses/by/ 4.0/). |
| Kısa Özet: Hemanjiosarkom (HSA) oldukça agresif seyreden vasküler bir tümördür. Köpeklerde en sık görülen dalak kanseri ve travmatik olmayan abdominal hemorajinin nedenidir. HSA’nın kısa genel sağkalım süresi ve yüksek yayılma potansiyeli, özellikle spesifik tümöral hedeflerle yeni ve daha etkili tedavilerin gerekli olduğunu göstermektedir. Bu çalışma, köpek hemanjiosarkomunun moleküler açıdan son gelişmeleri araştırmakta ve umut verici terapötik hedefler sunmaktadır. Özet: Köpek hemanjiosarkomu (HSA) nispeten yaygın bir neoplazidir ve çoğunlukla deri, dalak, karaciğer ve sağ atriyumda görülür. Köpek HSA’sının tedavisini araştıran çok sayıda çalışmaya rağmen, son 20 yılda sağkalımda önemli bir iyileşme sağlanamamıştır. Genetik ve moleküler profillemedeki gelişmeler, köpek HSA ile insan anjiyosarkomu arasındaki moleküler benzerlikleri ortaya koymuştur. Bu nedenle, insanlarda ve köpeklerde yeni ve daha etkili tedavilerin araştırılması için değerli bir model olarak kullanılabilir. Köpek HSA’sında en yaygın genetik anormallikler fosfatidilinositol-4,5-bisfosfat 3-kinaz katalitik alt ünite alfa (PIK3CA) ve nöroblastoma RAS viral onkogen homolog (NRAS) yolaklarında bulunmuştur. Mutasyonlar ayrıca tümör proteini p53 (TP53), fosfataz ve tensin homoloğu (PTEN) ve siklin bağımlı kinaz inhibitörü 2A’da (CDKN2A) da bulunur. Bilinen anormal protein ekspresyonu, hem köpek hem de insan hastalar için faydalı olabilecek yeni hedef tedavileri denemek için kullanılabilir. Vasküler endotelyal büyüme faktörü (VEGF) ve reseptörünün (VEGFR) yüksek ekspresyonuna rağmen, genel sağkalım süresi ile hiçbir korelasyon bulunamamıştır. Bu çalışmada, köpek HSA’sında moleküler profillemedeki en son gelişmeler incelenmekte ve bu ölümcül hastalığın prognozu ve tedavisindeki olası uygulamaları tartışılmaktadır. Anahtar Kelimeler: anjiyosarkom; köpek; NRAS; PIK3CA; VEGF; CDKN2A; PTEN; TP53 |
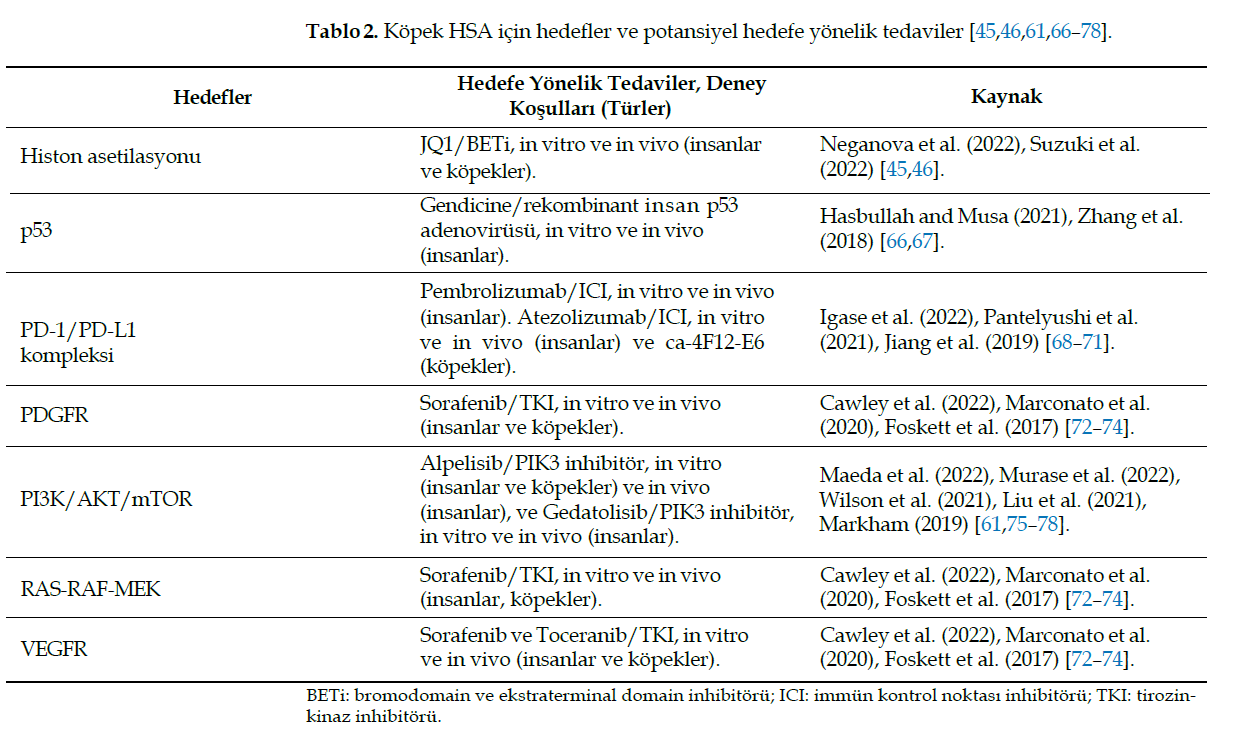
| Giriş Anjiyosarkom, insanlarda kötü prognoza sahip agresif bir kanserdir ve 5 yıllık sağkalım oranı %30’dan azdır [1]. Köpeklerde, lenfatik damarların maligniteleri nadiren tanımlanırken, kan damarlarının bir tümörü olan hemanjiosarkom (HSA) nispeten yaygındır. HSA vücudun herhangi bir bölgesinde, özellikle deri, dalak, karaciğer ve atriyumda ortaya çıkabilir [2,3]. Deri lezyonları çok sayıda, genellikle küçük ve ultraviyole radyasyon (UV) ve aktinik hasarla ilişkili olabilir, özellikle beyaz veya ince tüylü köpeklerin alt karın bölgesinde görülebilir [4,5]. Bununla birlikte, HSA deri altı, kas ve viseral organlarda da görülebilir. Kutanöz olmayan HSA’lar yüksek metastatik oranıyla oldukça agresif tümörlerdir [6–9]. Dalak formu ilk ilerleyişi sırasında spesifik olmayan klinik belirtiler gösterir, ancak karaciğer, mezenter, abdominal lenf düğümleri ve akciğerlere yüksek oranda metastaz ile akut hemoperitoneumun [10,11] en yaygın nedenidir [7,8]. Kardiyak HSA, hızlı lokal büyüme ve ilerleme nedeniyle kötü bir prognoza sahiptir ve sıklıkla eş zamanlı olarak akciğer, dalak ve karaciğer tutulumu görülür [6]. HSA’nın ırksal yatkınlığı değişkendir. Dermal neoplazi, özellikle Pitbull Terrier ve Boxer gibi beyaz köpek ırklarında doğrudan UV maruziyetinden kaynaklanıyor gibi görünürken [4,5], visseral formlar Golden Retriever, Labrador Retriever, German Shepherd ve Miniature Schnauzer gibi ırklarda daha fazla görülmektedir [3,7,8,12–14]. HSA’nın anatomik formu sitogenetik kökeni ile doğrudan ilişkilidir. Eski çalışmalar, histolojik tablo ve lökositler ve histiyositler bakımından negatif ancak CD31, CD105, CD146, VEGFR, faktör VIII ve avb3-i-integrin (aktive endotel hücrelerinden) bakımından pozitif boyanmaya bağlı olarak HSA’nın transforme olmuş olgun endotel hücrelerinden geliştiğini öne sürmektedir [15,16]. Bu teori, biyolojik davranışı ve metastazların nadiren tespit edilmesini haklı çıkaran kutanöz HSA için doğru olabilir. Ancak, birincil tümörün bir organda ortaya çıktığı ve buradan metastaz yaptığı bu klasik model, köpek HSA’sının diğer formlarındaki davranışını tam olarak açıklamamaktadır [15–17]. İkinci bir teori son 15-20 yıldır ivme kazanmaktadır. Aktinik kutanöz form dışında, köpek HSA’sı öncü (pluripotent) bir endotelyal hücreden kaynaklanabilir. Bu teori, endotel öncü hücre proteinleri olan CD34, CD45, CD133 ve KITr ekspresyonuna dayanan birkaç moleküler çalışmada doğrulanmıştır [15,16]. Bu hücreler, HSA’lı köpeklerde %0,5’ten yüksek ve HSA’sız ya da daha önce ameliyat edilmiş HSA’lı köpeklerde %0,3’ten düşük değerlerle dolaşımda tespit edilebilir. Bu pluripotent hücreler kemik iliğini terk ederek vücudun farklı bölgelerine yayılır [15]. Hayatta kalmaları, büyümeleri ve çoğalmaları mikro çevreye bağlıdır. Muhtemelen dalak daha elverişli bir ortamdır, bunu karaciğer ve sağ atriyum takip eder. Bir çalışma HSA’yı farklı endotelyal, miyeloid ve hematopoetik belirteçlere (CD14, CD34, D105, CD115, CD117, CD133 ve CD146) göre sınıflandırmış ve farklı pluripotent progenitörlerden kaynaklanabileceğini düşündürmüştür [18], ayrıca anjiyojenik, inflamatuar ve adipojenik olarak sınıflandırılmıştır [16]. Şekil 1, Kim ve arkadaşları (2015) ve Lamerato-Kozicki ve arkadaşları (2006) tarafından sunulan HSA yayılımı açısından hematopoietik progenitör teorisinin bir uyarlamasını göstermektedir [15,16]. |
| Köpek HSA’sının tanısı, sitolojinin doğal sınırlamaları nedeniyle genellikle histopatoloji ile konur [21,22]. Ancak histopatoloji, invaziv cerrahi yapılmadan her zaman mümkün değildir. Yeni bir minimal invaziv tanı testi (kan örneğinin sıvı biyopsisi) yakın zamanda onaylanmıştır. Küçük bir örneklem büyüklüğüne (n = 12) dayanmasına rağmen, bu testin köpek HSA tanısı için %83,3’lük bir özgüllüğe ulaştığı gösterilmiştir [23]. Köpek HSA için plazma nükleozom konsantrasyonlarını ölçen farklı bir sıvı biyopsi testi, önceki çalışmadan (n = 77) altı kat daha fazla sayıda vaka içermiş, gelişmiş özgüllük (%97) göstermiş ve %81,2’lik bir duyarlılık sergilemiştir [24]. Bununla birlikte, sıvı biyopsinin duyarlılığının hastalığın evresinden etkilenmesi muhtemeldir; daha düşük evrelerin tespit edilme olasılığı daha düşüktür [23,24]. Daha fazla araştırmaya ihtiyaç duyulsa da sıvı biyopsi, özellikle HSA’ya yatkınlığı yüksek olan belirli köpek ırkları için invazif olmayan bir tarama muayenesi haline gelebilir. Aktinik kutanöz lezyonlar için prognoz olumludur ve cerrahi genellikle uzun sağkalım oranları ile küratiftir [25,26]. Bununla birlikte, hastalığın agresif sistemik formları, 23-292 günlük ortalama sağkalım süresi (MST) ile kötü prognozla ilişkilidir [4,25–27]. Köpek HSA’sının tedavisini araştıran çok sayıda çalışmaya rağmen, son 20 yılda sağkalımda önemli bir iyileşme sağlanamamıştır. Standart tedavi, cerrahi rezeksiyon ve ardından tolere edilen en yüksek dozda antrasiklin bazlı kemoterapiden oluşur. Köpeklerde en çok kullanılan tirozin kinaz inhibitörleri olan toceranib ve masitinib, köpek HSA tedavisinde etkili olmamıştır [28,29]. Standart splenektomi ve ardından adjuvan doksorubisin ile tedavi edilen splenik hemanjiosarkomlu köpekler üzerinde yapılan bir çalışmada, toceranib fosfat ilavesi genel sağkalımda veya hastalıksız aralıkta iyileşme ile sonuçlanmamıştır [29]. Masitinib in vitro olarak köpek HSA hücreleri üzerinde bazı anti-proliferatif etkilere sahip olsa da, in vivo etki klinik çalışmalarda güvenilir bir şekilde gösterilememiştir [28]. İdame metronomik kemoterapinin eklenmesi de genel sağkalımı artırmada etkili olmamıştır [30]. Bununla birlikte, talidomid içeren veya içermeyen metronomik kemoterapi ile tedavi, bakım standardı adjuvan doksorubisin kadar etkili olabilir [31–34]. HSA için immünoterapi stratejileri de dahil olmak üzere farklı tedavileri araştıran çalışmaların sonuçları büyük ölçüde hayal kırıklığı yaratmıştır [35–39]. Spesifik kanserlerin genetik ve moleküler profillemesindeki gelişmeler, hem insan hem de veterinerlik tıbbında kişiselleştirilmiş ve hedefe yönelik tedavi için yeni yollar açmıştır. Köpeklerde HSA’nın moleküler profilini araştıran az sayıda çalışma bulunmaktadır [40–42]. Köpek HSA’sının morfolojik ve immünohistokimyasal çalışmaları, kökeni ve davranışıyla ilgili önemli yönleri deşifre etmiş olsa da, hastalığın moleküler temeli üzerine yapılan araştırmalar hedefe yönelik tedavi için daha önemli olabilir. Köpek HSA ve insan anjiyosarkomu arasındaki bazı moleküler benzerlikler, hedefe yönelik tedavilerin geliştirilmesi için avantaj sağlayabilir [43,44]. Histon asetilasyonu, kanser modülasyonunun epigenetik bir mekanizmasıdır ve yakın zamanda potansiyel hedefli tedaviler için incelenmiştir [45,46]. Bir in vitro çalışma köpek HSA için potansiyelini göstermiştir: köpek HSA hücre hatlarında ve bazı in vivo vakalarda histon asetilasyon seviyeleri yüksekti ve bir bromodomain ve ekstraterminal domain inhibitörü (BETi) olan JQ1 tarafından baskılanmıştı [46]. Bu tedavinin potansiyeli hala belirsizdir, bu nedenle düzgün bir şekilde karakterize edilmesi için yeni çalışmalara ihtiyaç vardır. Bir çalışmada DNA kopya sayısı varyasyonları analiz edilmiş ve intrabdominal HSA tanısı konan köpeklerde belirli lokuslarda farklı kazanç veya kayıp modelleri bulunmuştur [47]. Kromozom 13’te VEGFR2, PDGFRA ve KIT genlerinde önemli kazançlar meydana gelmiştir. Kromozom 12’de, köpekler aynı zamanda VEGFA gen kazancı da göstermiştir; bu, özellikle Flat-Coated Retriever’larda daha yüksek gen kazancı oranı nedeniyle HSA tedavisi için potansiyel bir prognostik faktördür [47,48]. Çoğu vakada, p14 ve p16’yı kodlayan önemli bir tümöral baskılayıcı gen olan CDKN2AIP geninde (genomik konum 16:49.9) kayıp görülmüştür [47]. Köpek HSA’sında CDKN2AIP mutasyonlarına ilişkin veriler hala azdır; ancak yakın zamanda yapılan bir çalışmada vakaların %11’inde mutasyonlar tespit edilmiştir [40], bu oran en çok çalışılan tümör baskılayıcı gen olan PTEN mutasyonlarına kıyasla daha yüksektir [49–51]. Köpek HSA’sı, farklı patojenik yollardan kaynaklanabilecek moleküler modellere göre belirli alt tiplere ayrılmıştır [18,43,44]. Köpeklerde üç farklı HSA alt tipinin ayrımı, etkilenen köpek hastaları arasında sürücü genlerde en sık görülen spesifik somatik mutasyonların analizine dayanmaktadır: onkogen Fosfatidilinositol-4,5-bisfosfat3-kinaz katalitik alt ünite alfa (PIK3CA), onkogen nöroblastom sıçan sarkomu virüsü (NRAS) aktivasyonu ve tümör baskılayıcı gen tümör proteini p53 (TP53). NRAS ve PIK3CA yolaklarındaki değişiklikler köpek HSA’larının sırasıyla %24 (15/50) ve %46’sında (23/50) meydana gelebilir ve hedef tedaviler için özellikle ilginç olabilir [18]. Şekil 2, köpek HSA ile ilişkili ana sürücü mutasyonlara ilişkin son literatürün bir özetini sunmaktadır. Golden Retriever HSA’ları diğer saf ırklara kıyasla farklı bir mutasyon modeli ifade etmekte, AKT ve PIK3CA genlerinde daha yüksek mutasyon sıklığı göstermekte ve mutasyonların analizinde kalıtsal faktörlerin önemini ortaya koymaktadır [41,52]. Bu nedenle, bu genleri hedefleyen tedaviler için faydalı olabilirler. |
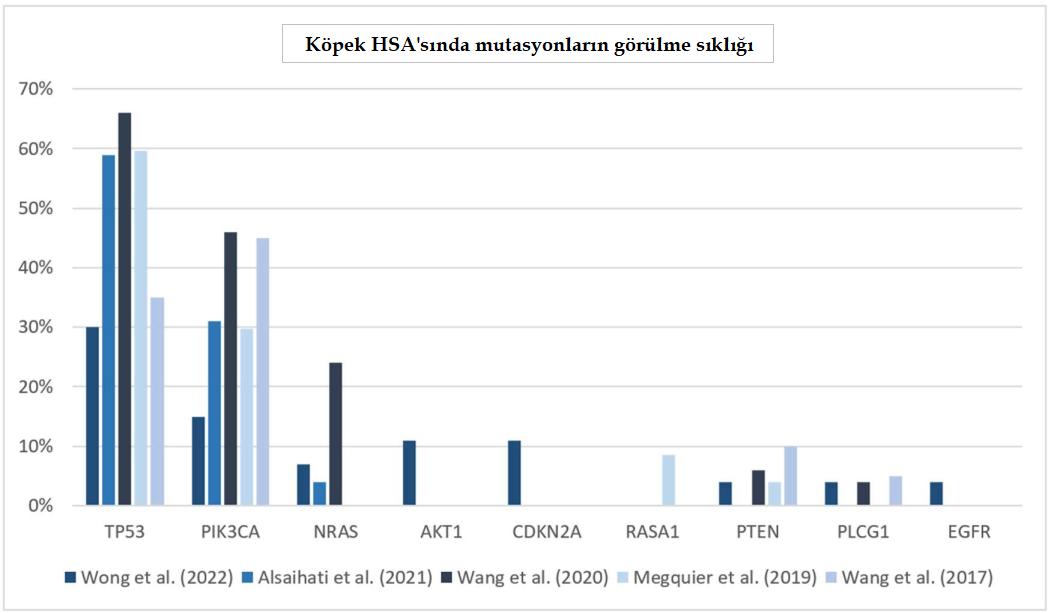
| Bu derlemeyi yazmak için şu anahtar kelimeler kullanılarak PubMed taraması yapılmıştır: hemanjiosarkom, canine, dogs, angiosarcoma. Arama yöntemi 2015 ile 2023 yılları arasındaki makalelerin değerlendirilmesini içermektedir. Başlangıçta seçilen makalelerden uygunluklarına ve referanslarına göre ek çalışmalar dahil edilmiştir. Çalışmaya dahil etme kriterleri, özellikle hakemli dergilerden olmak üzere kurumsal erişim veya internet üzerinden arama yoluyla elde edilen çalışmaları dikkate almıştır. Seçim sürecinde in vitro ve in vivo çalışmaların özelliklerine ilişkin herhangi bir kısıtlama getirilmemiştir. Köpek HSA’sı için cerrahi ve doksorubisin ve karboplatin gibi kemoterapiler gibi geleneksel ve köklü tedaviler kapsamlı bir şekilde değerlendirilmemiştir ve bu nedenle bu çalışmanın odak noktasının moleküler özellikleri analiz etmek olduğu düşünüldüğünde çalışma dışı bırakma kriteri olarak kullanılmıştır. Süreç, ilk arama, ilgili makalelerin belirlenmesi, uygunluk taraması, uygunluk kriterlerinin değerlendirilmesi ve sonuçta nihai olarak çalışmaya dahil edilmenin belirlenmesi gibi çeşitli aşamalardan meydana gelmiştir. Hemanjiosarkom Karsinogenezi Primer köpek HSA’sı farklı organlarda, farklı sıklıklarda ortaya çıkabilir. En sık tanı konulan organlar dalak, karaciğer, deri ve kalptir [6,7,54,55]; ancak bu neoplazm akciğerler, periton, böbrekler, iskelet kasları, plevra, ağız boşluğu, pankreas, kemikler, bağırsaklar ve neredeyse her malign transformasyona uğramış endotelyal vasküler dokudan kaynaklanabilir [8,9,52,53]. Bu nedenle, her zaman için potansiyel ayırıcı tanı olarak düşünülmelidir. Bu karmaşık neoplazmın etiyopatogenezi genetik yatkınlıklara, edinilmiş mutasyonlara, hormonal faktörlere ve UV ışığı gibi çevresel karsinojenlere maruz kalmaya bağlıdır [4,53,56,57]. Bu etiyolojik faktörler ayrıca köpeğin ırkına, yaşına, kilosuna ve deri özelliklerine göre bireysel klinik tabloyu da etkileyebilir [8,26,52,58]. HSA karsinogenezinde gonadal steroidlerin etkisi hala tartışılmaktadır ve bazı çalışmalar kısırlaştırılmış köpeklerde HSA gelişimi için riskin arttığını göstermektedir [57,59,60]. HSA’lı köpeklerdeki tipik mutasyonlar, genellikle “genomun koruyucusu” olarak adlandırılan TP53 genlerinde ve PI3K-AKT-mTOR hücre proliferasyon sinyal yolunda aktif olan PIK3CA’da meydana gelir [41,43,44]. Son on yılda, hücre kültürü çalışmaları, genom çapında ve transkriptomik analizler yoluyla mutasyonların ve kanser mekanizmalarının karakterizasyonu da dahil olmak üzere, ‘as’ın etiyopatogenezi ve altında yatan mekanizmalar hakkındaki bilgilerimizi önemli ölçüde artırmıştır [19,20,61,62]. 2017 yılında Im ve arkadaşları, HSA’nın yayılabileceği CXCR4/CXCL12 ekseni aracılığıyla bir hücre göçü ve istilası mekanizması sunmuştur [19]. 2022 yılında Maeda ve arkadaşları, ilgili insan genine oldukça homolog olan köpek PIK3CA’nın (GenBank erişim no. LC625864) ilk klonlamasını gerçekleştirmiştir. Bulgular, insan anjiyosarkomu ve köpek HSA’sı arasındaki bir başka potansiyel benzerliği daha vurgulamaktadır [61]. Çeşitli onkogenler ve tümöral baskılayıcı genler köpeklerde HSA’nın gelişimi ve ilerlemesi ile ilişkilidir. Tablo 1’de bu genler ve köpek HSA’sındaki rolleri gösterilmektedir: |
| Mutasyonlar ve Potansiyel Terapötik Hedefler Tablo 2, aşağıdaki bölümlerde tartışıldığı gibi, yakın zamanda çalışılan ve potansiyel terapötik hedefleri göstermektedir. Bu tabloda spesifik hedefler ve bunların potansiyel hedef tedavileri hakkında ayrıntılar verilmektedir. Deneysel koşulların belirtilmesi, çalışmanın yalnızca köpek HSA’sına odaklanmak yerine insanlarda ve/veya köpeklerde yürütülüp yürütülmediğini belirlemek açısından önemlidir. |
NRAS RAS (sıçan sarkomu), hücre çoğalması ve hayatta kalmayla ilgili çeşitli sinyal yollarının iletimini işaret etmek için GTP ligasyonu ile aktive edilen bir grup küçük proteini içerir. RAS aktivitesinin düzensizliği anormal hücre çoğalmasına yol açabilir ve insan kanserlerinin %30’undan fazlası aktive edici RAS mutasyonları tarafından yönlendirilir [79]. RAS gen grubu, mutasyona uğradığında insanlarda ve evcil hayvanlarda farklı neoplazmların karsinogenezine yol açan HRAS, KRAS ve NRAS’ı içerir [80–82]. NRAS’taki mutasyonlar köpek lösemisi ve HSA ile ilişkilendirilirken [43,80], KRAS’taki değişiklikler köpeklerde pankreatik ve pulmoner karsinomlara neden olabilir [83,84]. HRAS hala köpek kanseri patojenik mekanizmalarında diğer genler kadar önemli görünmemektedir [80]. Köpek HSA’sında, NRAS mutasyonları anatomik lokalizasyondan bağımsız olarak HSA vakalarının %24’ünde (12/50) bulunmuştur [43]. Ras p21 protein aktivatörü 1 geni (RASA1), GDP ve GTP ile bağlanmasını kontrol ederek RAS yolunun düzenlenmesinden sorumludur ve bu nedenle RAS/GAP grubunun bir tümör baskılayıcı geni olarak kabul edilir. RAS GAP’larının inhibisyonu, Ras yolağının yukarı regülasyonuna yol açarak büyük olasılıkla hücre proliferasyonunu ve büyümesini artırır ve sonuçta tümörigenezi indükler [85]. RASA1 anjiyogenez gibi fizyolojik mekanizmalar için çok önemlidir; ancak mutasyonları akciğer, meme, karaciğer ve kolorektal neoplazmlar dahil olmak üzere insanlarda yaygın kanserlerle ilişkilidir [86,87]. RASA1’in downregülasyonu tümöral anjiyogenezi ve metastazı teşvik edebilir [87]. Bu mutasyonlar köpek visseral HSA vakalarının %8,5’inde (4/47) tespit edilmiştir [44,64]. Bu tür mutasyonların neden olduğu kanserlerin tedavisi zordur çünkü RAS’a bağlanabilen mevcut bir ilaç yoktur. Bununla birlikte, daha sonra RAS tarafından aktive edilen RAF proteini, sorafenib, vemurafenib, dabrafenib ve regorafenib dahil olmak üzere bir grup tirozin kinaz inhibitörü tarafından inhibe edilebilir [88,89]. İnsanlarda, BRAF inhibitörü sorafenib ile hedef tedavinin belirli ölçüde etkili olduğu görülmüştür [48]. Buna rağmen, köpek HSA’sı için bu ilaçları içeren klinik çalışmaların yayınlanmış sonuçları yoktur. Sorafenibin köpeklerde genellikle oldukça güvenli olduğu düşünülmektedir [72–74]. Küçük çaplı yapılan bir çalışmada, sorafenibin günde iki kez 5 mg/kg dozunda tedavi edilen rezeke edilemeyen hepatoselüler karsinomlu köpekler için güvenli ve etkili olduğu kanıtlanmıştır. Hedef terapi alan köpeklerde progresyona kadar geçen ortalama süre 363 gün iken, metronomik kemoterapi ile tedavi edilen köpeklerde sadece 27 gün olmuştur (p = 0.079) [73]. Sorafenib, köpek HSA için umut verici hedefe yönelik bir tedavi olabilir [72,73,90]; ancak maliyeti birçok evcil hayvan sahibi için bir engel olabilir. MAPK olarak da bilinen RAS-RAF-MEK-ERK yolağı, hücre proliferasyonu ve farklılaşması için gerekli bir sinyal kaskadından oluşur [80,82,90]. RAS ve RAF onkogenleri, iyi tanımlanmış karsinojenik potansiyelleri nedeniyle bu grup içinde en fazla ilgiyi çekmiştir [79,81–83,85,86]. Bununla birlikte, mitojenle aktive olan protein/ hücre dışı sinyalle düzenlenen kinaz (MEK) dahil olmak üzere potansiyel öneme sahip birçok başka gen ve protein de bulunmaktadır. Köpek HSA’sında test edilmemiş olmasına rağmen, MEK trametinib veya kobimetinib tarafından inhibe edilebilir [90-92]. RAF, MEK’i fosforile ederek ve aktive ederek işlev görür, bu da daha sonra ERK’yi fosforile eder ve aktive eder, sonuçta gen transkripsiyonu ile sonuçlanır [85] (Şekil 3). |
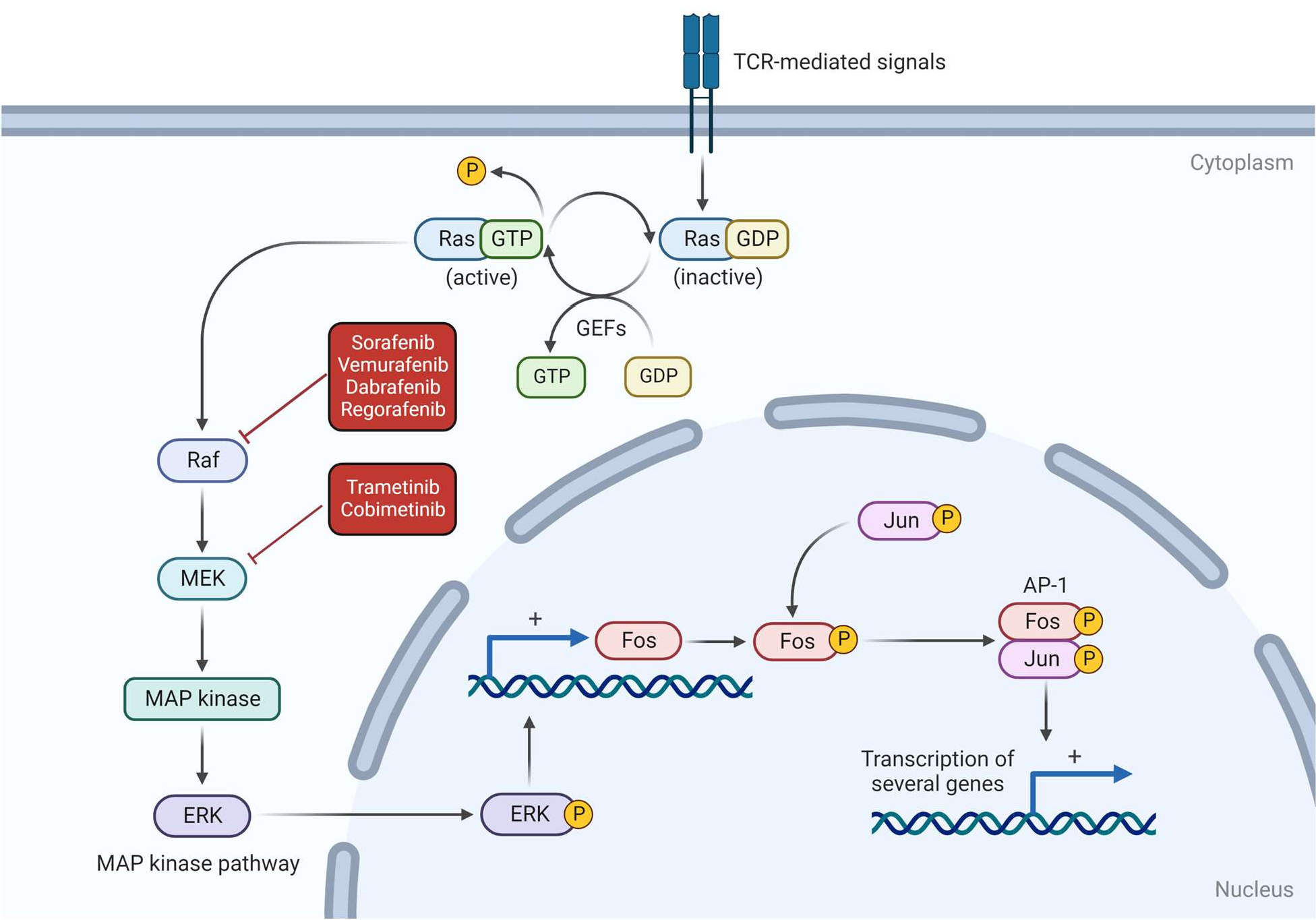
| MAPK’nın in vitro inhibisyonunun primer dalak, kardiyak ve kutanöz sunumların köpek HSA hücre kültürlerinde tümöral büyümeyi azalttığı görülmüştür [90]. Üç MEK inhibitörü, CI-1040, Sorafenib ve LY294002 test edilmiş ve in vivo olarak bile bu yolun inhibisyonunun hem insan anjiyosarkomunu hem de köpek HSA proliferasyonunu baskılayabildiğine dair kanıt elde edilmiştir [90]. PIK3CA Fosfatidilinositol 3-kinaz (PI3K), katalitik üniteye sahip ve potansiyel bir antikanser hedefi olarak kabul edilen onkogen bir üründür. Fosfatidilinositol-4,5- bifosfat 3-kinaz katalitik alt birimi alfa (PIK3CA), AKT-mTOR yolunda hareket ederek, P110α onkoproteinini kodlayarak ve çeşitli insan kanserlerinde bu hücresel metabolik yolu düzenleyerek temel bir rol oynar [51,93–95]. PI3K-AKT-mTOR, vasküler tümörler de dahil olmak üzere birçok kanserde en önemli yolaklardan biri olarak kabul edilir. AKT’nin bağımsız fosforilasyonu (Ser473), PTEN delesyonunun olmadığı ve fetal sığır serumu ile değiştirilmemiş köpek HSA hücre kültürleri ile ilişkilendirilmiş ve bu hücre hatlarında PI3K/Akt/mTOR yolağının yapısal bir aktivasyonuna işaret etmiştir [95]. PI3K-AKT-mTOR yolağının düzensizliği, kanserin ayırt edici özelliklerinden biri olan proliferasyon sinyalinin artmasına ve hücresel metabolizmanın düzensizliğine yol açar [94,96,97]. PIK3CA’daki mutasyonlar çoğunlukla ana sıcak nokta olan P110α’nın kodlama alanlarında tespit edilmiştir, ancak kanserin kökenine göre farklı alanlar mutasyona uğrayabilir [94]. P110α protein döngüsü konformasyonundan sorumlu amino asit 1047’nin modifikasyonu, PIK3CA’daki tüm mutasyonların %71’ini (10/14) temsil eden ve H1047R veya H1047L olarak karakterize edilen köpek HSA vakalarında sıklıkla mutasyona uğramış gibi görünmektedir [40,44,61]. Hem insan hem de veterinerlik tıbbında, PI3K mutasyonu genel olarak kanser türünden bağımsız olarak hayatta kalma süresi üzerinde olumsuz bir etkiye sahiptir [42]. PIK3’ü hedeflemek ilginç bir antikanser tedavi stratejisi olarak görünmektedir ve insan tıbbında, iki PIK3 inhibitörü olan Alpelisib ve Copanlisib çeşitli kanserlerin tedavisi için onaylanmıştır [78]. Yakın zamanda yapılan bir çalışmada Alpelisib’in PIK3CA mutasyonlu köpek HSA hücre hatları üzerindeki etkisi değerlendirilmiştir [61]. Bu PI3K inhibitörü, PIK3CA mutasyonları olan köpekler için hedefe yönelik bir tedavi olarak potansiyel sergilemektedir: in vitro etkiler, kanser hücresi göçünü inhibe etme, AKT fosforilasyonunu baskılama, böylece hücre proliferasyonunu inhibe etme ve kaspaz-3/7 aktivasyonu yoluyla apoptozu indükleme kapasitesini göstermiştir [61]. Klinik çalışmalar, Alpelisib’in köpek HSA’sı için etkinliği ve PIK3CA mutasyonlarının bu tedavi için öngörücü belirteçler olma potansiyeli hakkında daha fazla kanıt sağlayabilir. Gedatolisib, PIK3CA mutasyonları olan kanser hastalarında kullanılan, geliştirilmekte olan bir ilaçtır. PI3K geninin P110α katalitik alt birimini inhibe ederek PI3K/mTOR yolunu inhibe eder [75–77,98]. Son kanıtlar, osteosarkom ve histiyositik sarkom gibi belirli hücre hatlarının köpek tümör hücrelerinin canlılığını azalttığını göstermektedir [75]. Bununla birlikte, köpek ve insan hastalarda HSA ve anjiyosarkomda PI3K ile yapılan çalışmalar eksiktir. Köpek HSA’sındaki yüksek PI3K mutasyon yüzdesi ve ön in vitro sonuçlar göz önüne alındığında, PI3K’nın inhibisyonu bu tür tümörler için uygun bir terapötik strateji olabilir [99]. Bir onkogende spesifik bir mutasyonun ortaya çıkması, diğer onkogenlerde mutasyon olasılığını ortadan kaldırmaz; PIK3CA-AKT-mTOR yolağının farklı segmentlerinde ve endometriyal, meme ve kolorektal insan kanserinde farklı PI3K mutasyonlarıyla bir arada bulunan PIK3CA mutasyonları gibi ek mutasyonlara sahip tümörlerde sinerjizm etkisi ortaya çıkabilir [100]. Dalak ve kardiyak köpek HSA’sında zaman zaman PIK3CA ve TP53’te birlikte bulunan mutasyonlar tespit edilmiştir [44]. PTEN PTEN, PI3K/Akt sinyalinin inhibisyonu yoluyla PI3K-AKT-mTOR yolunun düzenlenmesinden sorumlu, kromozom 10’da bulunan tümör baskılayıcı bir gendir [51,101–104]. TP53 gibi PTEN de hayvan neoplazmlarında sıklıkla mutasyona uğrar ve PTEN kaybı PI3K-AKT-mTOR yolunu upregüle ederek hücre döngüsü ilerlemesini kolaylaştırır ve kanser hücrelerinde protein sentezini arttırarak proliferasyonu ve anabolik metabolizmayı arttırır [104]. PTEN mutasyonları insanlarda meme ve prostat kanserinde sıklıkla bulunur ve PTEN kaybı ile olumsuz sonuçlar ve kötü prognoz arasında pozitif bir korelasyon vardır [51,103]. Meme bezi tümörleri de PTEN ekspresyonundaki düzensizliklerle ilişkili olabilir [101,105]. Buna ek olarak, PTEN’in PI3K-AKT-mTOR yolağından bağımsız olarak kanser davranışının daha fazla yönünü düzenleyebileceğine, tümöral mikroçevreyi ve immünoterapiye klinik yanıtı etkileyebilecek immünomodülasyonu etkileyebileceğine dair kanıtlar vardır [50,51,104]. Yaklaşık yirmi yıl önce rapor edilen [64], köpek HSA’sındaki PTEN mutasyonları vakaların %4 (2/47) ila %10’unda (2/20) ortaya çıkabilir [40,41,43,44] ve bu tümörde daha sık mutasyona uğrayan bir gen olan PIK3CA’nın düzenlenmesinde önemli bir rol oynadığı görülmektedir [41,44]. PTEN ayrıca insanlarda kafa derisi ve yüz anjiyosarkomlarında da downregüle edilir ve malign ve yüksek grade’li tümörler için immünohistokimyada düşük ekspresyon şeklinde görülür [49]. PTEN’in inaktivasyonu mTOR yolağının upregülasyonuna yol açar ve mTOR yolağının hedeflenmesi etkili bir antikanser stratejisi olabilir [102]. Spesifik mTOR inhibitörleri, Temsirolimus ve Everolimus, insanlarda renal hücreli karsinom tedavisinde başarıyla kullanılmış ve onaylanmıştır [106,107]. Vasküler tümörlerdeki potansiyel etkinliğine rağmen, mTOR inhibitörleri insanlarda anjiyosarkomda klinik çalışmalarda araştırılmamıştır. Bununla birlikte, Everolimus kemik ve yumuşak doku sarkomu olan kişilerde bir miktar etkinlik göstermiştir [108]. Köpek meme neoplazmları için, hem Temsirolimus hem de Everolmius, in vitro olarak mTOR yolunu inhibe ederek tümöre yapışık hücrelerin ve kürelerin büyümesinin baskılanmasına yol açan kanıtlar sergilemiştir [109]. Ayrıca Everolimus, kendini yenileme yeteneğine sahip kanser kök hücreleriyle ilgili küre oluşturma deneylerinde büyüme karşıtı bir potansiyel sunmaktadır. Bununla birlikte, bu inhibitörlerin bu modeldeki kesin antitümör etkisi belirsizliğini korumaktadır, çünkü kontrol grubu ile mTOR inhibitörleriyle tedavi edilen gruplar arasında mitotik figür sayısı ve anjiyogenez açısından belirgin bir fark gözlenmemiştir [109]. İlk keşfedilen mTOR inhibitörü olan Sirolimus (rapamisin), HSA’lı köpeklerde araştırılmamıştır. Bununla birlikte, Sirolimus’un köpek apendiküler osteosarkomu için standart tedaviye eklenmesi, tek başına standart tedaviye kıyasla genel sağkalımda önemli bir fayda göstermemiştir [110]. Sirolimusun hemanjiosarkom için standart tedavi ile birlikte etkinliği araştırılmaktadır, ancak hızlı seyreden ve agresif davranış gösteren bir hastalıkta tek başına etkili olması pek olası değildir. Standart kemoterapi, mTOR inhibitörleri ve β-blokerler gibi yeniden tasarlanmış ilaçlar dahil olmak üzere çeşitli tedavilerin bir kombinasyonu daha etkili olabilir [111]. TP53 Bu tümör baskılayıcı gen, insanlarda ve evcil hayvanlarda farklı kökenlerden gelen neoplazmlarda yaygın olarak etkilenmektedir [41]. Köpek HSA’sında en sık mutasyona uğrayan gendir, bu nedenle büyüme mekanizmasında önemli bir rol oynar, en önemlisi mutasyona uğradığında tümöral baskılanmayı önler [43,64,65]. TP53 ayrıca genomik instabilite yoluyla genlerin füzyonunu teşvik edebilmektedir [44]. İmmünohistokimyada, aktinik hasarlı kutanöz HSA, viseral bulgulara ve aktinik değişikliklerin olmadığı kutanöz formlara kıyasla daha yüksek bir p53 indeksi ifade etmiştir [26]. Yakın zamanda yapılan bir çalışmada, TP53 mutasyonlarının kanser türünden bağımsız olarak negatif bir prognostik faktör olduğu gösterilmiştir. Ayrıca, bu mutasyona uğramış tümör baskılayıcı genin en sık görüldüğü kanser köpek HSA’sı olmuştur [42]. Alsaihati ve arkadaşları (2021), prognostik bir analiz yapılmamasına rağmen, özellikle Golden Retriever’larda analiz edilen neoplazmlar arasında en yüksek TP53 mutasyon sıklığına (%59) sahip tümörün HSA olduğu benzer bir model tanımlamıştır [41]. p53’ü hedef alan tedaviler, genomik stabilitenin korunmasında ve kanserlerde hücre döngüsünün düzenlenmesinde son derece faydalı olabilir [112–114]. Gen terapisi, spesifik mutasyonları hedefleyerek ve etkilenen genin işlevselliğini geri kazandırarak çalışır [67,113]. P53’ün işlevselliğini geri kazandıran gen terapisi teorik olarak çok çeşitli kanser türlerinde kullanılabilir; ancak bu tedavinin etkinliği p53 mutasyonu olan birçok tümör için büyük ölçüde bilinmemektedir [113]. Rekombinant insan p53 adenovirüsü (Gendicine), insanlarda p53 kaybı olan baş ve boyun karsinomlarının tedavisi için onaylanan ilk gen terapisidir. Gendicine, baş ve boyun karsinomunda kemoterapi ve/veya radyoterapi ile birlikte kullanıldığında yanıt oranını ve genel sağkalım süresini artırmaktadır [66,67]. Ne yazık ki, p53 genetik tedavisi henüz küçük hayvan onkolojisinde mevcut değildir ve kanserli köpeklerde bu tedavinin etkinliğini değerlendiren hiçbir çalışma yapılmamıştır. CDKN2A Sikline bağımlı kinaz inhibitörü 2A (CDKN2A), p16 ve p14 proteinlerini kodlayarak çoğunlukla G1 ila S fazında hücre döngüsünü kontrol eden bir tümör baskılayıcı gendir [115,116]. Bu gendeki anormallikler, hücre döngüsü düzenlemesinin eksikliğinin bir sonucu olarak tümörigenez ve metastaza yol açar [116]. İnsanlarda, pankreas kanseri, melanom ve anjiyosarkom dahil olmak üzere çeşitli tümörlerle ilişkilendirilmiştir [117–119]. Deneysel bir çalışma, farelerde CDKN2A veya TP53’ün devreden çıkarılmasıyla onkojenik HRAS’ın aşılanmasını test etmiş ve bu birlikteliklerin anjiyosarkom ve diğer yumuşak doku sarkomlarının gelişimini indükleyebildiğini tespit etmiştir [119]. Köpek HSA’sında CDKN2A’yı analiz eden çok az çalışma vardır; yine de yakın zamanda HSA’lı köpeklerin %11’inin bu gende mutasyon eksprese ettiği tespit edilmiştir [40]. VEGF, Anjiyogenez ve Hipoksi Vasküler endotelyal büyüme faktörü (VEGF), hem fizyolojik hem de patolojik koşullarda kan damarlarının gelişimini tetikleyen bir sinyal proteinidir [120]. Düzensizliği, zaten tümöral kemokinler tarafından desteklenen anjiyogenezi aşırı uyararak kanser büyümesini artırır. Sonuç olarak anjiyogenez, hipoksiye rağmen kanser hücrelerinin çoğalmasına yol açar [120,121]. Farklı VEGF türleri, tümöral koşullarda bile kan ve lenfatik vaskülatür gelişiminde farklı işlevler görür, özellikle VEGF-A ve VEGF-D, genellikle insanlarda meme kanseri ve anjiyosarkomda aşırı eksprese edilir [122–124]. Hipoksi, bazı neoplazmlarda ikili bir faktördür [120,124,125]. Bir tümör hücresinin hayatta kalabilmesi için besin ve kan kaynağına ihtiyaç duymasına rağmen, anjiyosarkom gibi bazı kanserler hipoksik bir mikroçevrede daha iyi gelişebilir, immün antitümöral yanıttan kaçabilir ve proliferasyon ve göçü kolaylaştırabilir [121,125–127]. Tümöral oksijenasyon eksikliği ve VEGF’nin aşırı ekspresyonu, büyümeyi teşvik etmek için kanser mikroçevresini değiştiren kötü prognostik faktörler olabilir [123,125,128]. Köpek kutanöz HSA’larında VEGF ekspresyonu ile genel sağkalım süresi arasında bir korelasyon tespit edilmemiştir [26]. Köpeklerde splenik HSA, splenik hemanjiyomlara kıyasla daha yüksek sayıda VEGF+ hücre eksprese etmiştir (p = 0,004) [132] ve VEGFR-2’nin ortalama boyanma ekspresyonu normal dalaklardan dört kat daha yüksektir [130]. Kanıtlar, VEGF ve VEGFR-2’nin yararlı tanı belirteçleri olabileceğini göstermektedir, ancak ne VEGF ne de reseptörleri henüz köpek HSA’sı için öngörücü veya prognostik faktörler olarak iyi bir şekilde belirlenmemiştir [26],130,132]. VEGF’yi bağlayan antikorlar, VEGFR blokerleri ve modifiye edilmiş reseptörler, köpek kanser hastalarında anjiyogenezde VEGF etkisini potansiyel olarak azaltabilen terapötik seçeneklerdir. Sorafenib, VEGFR-2 ve PDGFR’yi inhibe eden, insan anjiyosarkom tedavisi için uygun [48,133] ve köpekler tarafından iyi tolere edilen bir tirozin kinazdır [72,74]. Bu nedenle, dalak HSA hücrelerinde VEGFR-2’nin yüksek ekspresyonu göz önüne alındığında, köpek-HSA hedefli bir tedavi olarak hastalık kontrolünde etkili olabilir [130]. Bununla birlikte, VEGFR’yi bloke eden bir TKI olan toceranib kullanımının standart tedaviden sonra dalak HSA’sında faydalı olduğu kanıtlanmamıştır [29]. İmmünoterapi vasküler tümörler için sıklıkla kullanılmamaktadır. Bevacizumab (Avastin®; Genentech, Inc., South San Francisco, CA, ABD), VEGF karşıtı, potansiyel olarak tümöral anjiyogenezi inhibe eden, umut verici bir tedavi olarak kabul edilen bir monoklonal antikordur, ancak son çalışmalarda insan anjiyosarkom tedavisi için faydalı olmadığı bulunmuştur [134]. PD-1/PD-L1 Kompleksi İmmün kontrol noktası inhibitörleri (ICI) ve aşılar, insanlarda ve evcil hayvanlarda çeşitli tümörler için umut verici tedavi yöntemleridir. Son on yılda yapılan çalışmalar, köpeklerde invaziv ürotelyal karsinom ve melanom tedavisinde Oncotherad nano-immünoterapi ve Oncept aşısı gibi bazı etkinlik kanıtları göstermiştir [135–139]. Az sayıda çalışma PD-1/PD-L1 kompleksini köpek HSA için potansiyel bir hedef olarak değerlendirmeye odaklanmıştır [70,140,141]. Programlanmış hücre ölüm proteini 1 (PD-1), ligandı olan programlanmış ölüm-ligand 1’e (PD-L1) bağlandığında T hücrelerini aşağı regüle edebilen bir lenfosit yüzey proteinidir. Bu etkileşim, bir tümör bağışıklık sistemi kaçınma mekanizması olarak işlev görür [70]. Bu mekanizmanın yolları arasında tümör infiltre eden T lenfositlerin inhibisyonu ve apoptozu, pro-inflamatuar sitokinlerin salgılanmasının azalması ve G0/G1 fazında hücre döngüsünün durması yer almaktadır [70,141,142]. ISOS-1 (RRID:CVCL_C517) anjiyosarkom hücre hattı, köpek hemanjiyosarkomu (HSA) ile moleküler benzerlikler paylaşmaktadır [140]. Özellikle, bir çalışma bu tümör hücrelerinin makrofajlar üzerinde kontrol uyguladığını, onları M2 fazına polarize ettiğini, pro-tümör etkilerle ilişkili olduğunu ve PD-L1 ekspresyonunu upregüle ettiğini ortaya koymuştur. Bu ligand ekspresyonu çoğu köpek HSA vakasında [140] ve ayrıca tümör infiltre eden makrofajlarda gözlenmektedir, bu da PD-1/PD-L1 kompleksinin köpek HSA’daki pro-tümör rolüne işaret etmektedir [140]. Bir anti-PD-1 immün kontrol noktası inhibitörünün (ca-4F12-E6) in vivo etkinliği melanom teşhisi konmuş iki köpekte belgelenmiştir [68]. Bu hastalar, geleneksel tedavinin beklenen sonuçlarını aşarak bir yıldan fazla süren tam yanıt vermiştir [68],71]. Tedavinin etkinliğini ve güvenliğini değerlendirmek için daha geniş çaplı köpek kohortlarını ve kapsamlı güvenlik değerlendirmelerini içeren ek çalışmalara ihtiyaç vardır. Şu anda, Pembrolizumab ve Atezolizumab gibi PD-1 ve PD-L1’i hedefleyen bazı etkili antikorların, insan tümörlerinin tedavisi için kullanımı onaylanmıştır [69,70]. Bununla birlikte, veteriner hekimlikte henüz piyasaya sürülmüş immün kontrol noktası inhibitörleri bulunmamaktadır. Sonuçlar ve Geleceğe Yönelik Stratejiler Visseral köpek HSA’sının prognozu hala kötüdür. Son çalışmalar, köpeklerde HSA’nın en yaygın moleküler profili hakkındaki bilgilerimizi geliştirmiş ve neoplazmın her durumuna göre farklı paternleri netleştirmiştir. Çalışmamızda, son makalelerde tanımlanan köpek HSA’sında en sık analiz edilen mutasyona uğramış genler TP53, PIK3CA ve NRAS’tır. Bununla birlikte, son yıllarda yapılan az sayıda araştırma, CDKN2A, PTEN ve AKT1 gibi diğer genlerdeki mutasyonları araştırmıştır; bu da bu tümörün direnci ve etiyopatogenezi hakkında daha fazla bilgi sağlayabilir. RAS-RAF-MEK ve AKT-mTOR gibi düzensiz moleküler yolaklardan birinin ya da daha büyük olasılıkla birkaçının hedeflenmesi, bu ölümcül hastalığın tedavisinde faydalı olabilir. Bu nedenle, yeni çalışmalar belirli yollara odaklanan farklı stratejileri test etmelidir. Daha önce gösterildiği gibi, köpek HSA’sının moleküler profili diğer neo-plazmlardan farklıdır. Aynı neoplazmın farklı bölümlerinde bile farklı bir moleküler arka plan mevcut olabilir. Yakın gelecekte, HSA’nın tedavisi, HSA’lı köpeklerin spesifik moleküler profiline dayalı olarak daha kişiselleştirilmiş bir tedaviye odaklanmalıdır. Katkıda Bulunan Yazarlar: Kavramsallaştırma, P.A.B.P. ve R.D.S.H.; metodoloji, P.A.B.P., R.D.S.H. ve A.G.; araştırma, P.A.B.P., R.D.S.H. ve A.G.; yazım-orijinal taslağın hazırlanması, P.A.B.P., R.D.S.H. ve A.G.; yazım-inceleme ve düzenleme, P.A.B.P., P.M.B., R.D.S.H. ve A.G.; görselleştirme, P.A.B.P., P.M.B., R.D.S.H. ve A.G.; danışmanlık, R.D.S.H. ve A.G.; proje yönetimi, P.A.B.P. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir. Finansman: Bu araştırma herhangi bir dış finansman almamıştır. Etik Kurul Beyanı: Yok. Bilgilendirilmiş Onam Beyanı: Yok Veri Erişim Beyanı: Bu makalede analiz edilen veriler, çalışma türü (anlatı niteliğinde derleme) nedeniyle ikincil olarak kabul edilmektedir. Verilerimizle ilgili her türlü soru, ilgili yazara yöneltilmelidir. Teşekkürler: Brezilya Eğitim Bakanlığı’na bağlı kurumsal Coordenação de Aperfeiçoamento de Pessoal de Nível Superior’a (CAPES) teşekkür ederiz. Çıkar Çatışması: Yazarlar herhangi bir çıkar çatışması beyan etmemektedir. |
KAYNAK1. Naka, N.; Ohsawa, M.; Tomita, Y.; Kanno, H.; Uchida, A.; Myoui, A.; Aozasa, K. Prognostic Factors in Angiosarcoma: A Multivariate Analysis of 55 Cases. J. Surg. Oncol. 1996, 61, 170–176. [CrossRef] 2. Rocha, M.S.T.; Lucci, C.M.; dos Santos, J.A.M.; Longo, J.P.F.; Muehlmann, L.A.; Azevedo, R.B. Photodynamic Therapy for Cutaneous Hemangiosarcoma in Dogs. Photodiagnosis Photodyn. Ther. 2019, 27, 39–43. [CrossRef] [PubMed] 3. Carnio, A.; Eleni, C.; Cocumelli, C.; Bartolomé Del Pino, L.E.; Simeoni, S.; Spallucci, V.; Scaramozzino, P. Evaluation of Intrinsic and Extrinsic Risk Factors for Dog Visceral Hemangiosarcoma: A Retrospective Case-Control Study Register-Based in Lazio Region, Italy. Prev. Vet. Med. 2020, 181, 105074. [CrossRef] 4. Baretta, L.T.; De Oliveira Dhein, J.; Lupion, C.G.; Figueiredo, C.D.; Gerardi, D.G. Occurrence of Cutaneous Neoplasia in Dogs with Actinic Dermatitis in a Veterinary Medical Teaching Hospital—UFRGS, Brazil. Acta Sci. Vet. 2021, 49. [CrossRef] 5. Ward, H.; Fox, L.E.; Calderwood-Mays, M.B.; Hammer, A.S.; Couto, C.G. Cutaneous Hemangiosarcoma in 25 Dogs: A Retrospec- tive Study. J. Vet. Intern. Med. 1994, 8, 345–348. [CrossRef] [PubMed] 6. Yamamoto, S.; Hoshi, K.; Hirakawa, A.; Chimura, S.; Kobayashi, M.; Machida, N. Epidemiological, Clinical and Pathological Features of Primary Cardiac Hemangiosarcoma in Dogs: A Review of 51 Cases. J. Vet. Med. Sci. 2013, 75, 1433–1441. [CrossRef] 7. Wendelburg, K.M.; Price, L.L.; Burgess, K.E.; Lyons, J.A.; Lew, F.H.; Berg, J. Survival Time of Dogs with Splenic Hemangiosarcoma Treated by Splenectomy with or without Adjuvant Chemotherapy: 208 Cases (2001–2012). J. Am. Vet. Med. Assoc. 2015, 247, 393–403. [CrossRef] [PubMed] 8. Story, A.L.; Wavreille, V.; Abrams, B.; Egan, A.; Cray, M.; Selmic, L.E. Outcomes of 43 Small Breed Dogs Treated for Splenic Hemangiosarcoma. Vet. Surg. 2020, 49, 1154–1163. [CrossRef] [PubMed] 9. Carloni, A.; Terragni, R.; Morselli-Labate, A.M.; Paninarova, M.; Graham, J.; Valenti, P.; Alberti, M.; Albarello, G.; Millanta, F.; Vignoli, M. Prevalence, Distribution, and Clinical Characteristics of Hemangiosarcoma-Associated Skeletal Muscle Metastases in 61 Dogs: A Whole Body Computed Tomographic Study. J. Vet. Intern. Med. 2019, 33, 812–819. [CrossRef] [PubMed] 10. Fleming, J.; Giuffrida, M.A.; Runge, J.J.; Balsa, I.M.; Culp, W.T.N.; Mayhew, P.D.; Steffey, M.; Epstein, S.E. Anatomic Site and Etiology of Hemorrhage in Small versus Large Dogs with Spontaneous Hemoperitoneum. Vet. Surg. 2018, 47, 1031–1038. [CrossRef] 11. Wright, L.V.; Renwick, M.; Soh, R.W.Y.; Fan, N.R.; Tebb, A.J.; Indrawirawan, Y.H. Outcomes and Blood Product Use in 89 Surgically Managed and 79 Medically Managed Cases of Acute Spontaneous Hemoperitoneum in the Dog. Front. Vet. Sci. 2021, 8, 736329. [CrossRef] 12. Kim, S.E.; Liptak, J.M.; Gall, T.T.; Monteith, G.J.; Woods, J.P. Paul Woods Epirubicin in the Adjuvant Treatment of Splenic Hemangiosarcoma in Dogs: 59 Cases (1997–2004). JAVMA 2007, 231, 1550–1557. 13. Matsuyama, A.; Poirier, V.J.; Mantovani, F.; Foster, R.A.; Mutsaers, A.J. Adjuvant Doxorubicin with or without Metronomic Cyclophosphamide for Canine Splenic Hemangiosarcoma. J. Am. Anim. Hosp. Assoc. 2017, 53, 304–312. [CrossRef] 14. Masyr, A.R.; Rendahl, A.K.; Winter, A.L.; Borgatti, A.; Modiano, J.F. Retrospective Evaluation of Thrombocytopenia and Tumor Stage as Prognostic Indicators in Dogs with Splenic Hemangiosarcoma. J. Am. Vet. Med. Assoc. 2021, 258, 630–637. [CrossRef] 15. Lamerato-Kozicki, A.R.; Helm, K.M.; Jubala, C.M.; Cutter, G.C.; Modiano, J.F. Canine Hemangiosarcoma Originates from Hematopoietic Precursors with Potential for Endothelial Differentiation. Exp. Hematol. 2006, 34, 870–878. [CrossRef] 16. Kim, J.H.; Graef, A.J.; Dickerson, E.B.; Modiano, J.F. Pathobiology of Hemangiosarcoma in Dogs: Research Advances and Future Perspectives. Vet. Sci. 2015, 2, 388–405. [CrossRef] [PubMed] 17. Martins, B.D.C.; Torres, B.B.J.; Rodriguez, A.A.M.; Gamba, C.O.; Cassali, G.D.; Lavalle, G.E.; Martins, G.D.C.; Melo, E.G. Clinical and Pathological Aspects of Multicentric Hemangiosarcoma in a Pinscher Dog. Arq. Bras. Med. Vet. Zootec. 2013, 65, 322–328. [CrossRef] 18. Gorden, B.H.; Kim, J.H.; Sarver, A.L.; Frantz, A.M.; Breen, M.; Lindblad-Toh, K.; O’Brien, T.D.; Sharkey, L.C.; Modiano, J.F.; Dickerson, E.B. Identification of Three Molecular and Functional Subtypes in Canine Hemangiosarcoma through Gene Expression Profiling and Progenitor Cell Characterization. Am. J. Pathol. 2014, 184, 985–995. [CrossRef] [PubMed] 19. Im, K.S.; Graef, A.J.; Breen, M.; Lindblad-Toh, K.; Modiano, J.F.; Kim, J.H. Interactions between CXCR4 and CXCL12 Promote Cell Migration and Invasion of Canine Hemangiosarcoma. Vet. Comp. Oncol. 2017, 15, 315–327. [CrossRef] 20. Kim, J.H.; Frantz, A.M.; Anderson, K.L.; Graef, A.J.; Scott, M.C.; Robinson, S.; Sharkey, L.C.; O’Brien, T.D.; Dickerson, E.B.; Modiano, J.F. Interleukin-8 Promotes Canine Hemangiosarcoma Growth by Regulating the Tumor Microenvironment. Exp. Cell. Res. 2014, 323, 155–164. [CrossRef] 21. Herman, E.J.; Stern, A.W.; Fox, R.J.; Dark, M.J. Understanding the Efficiency of Splenic Hemangiosarcoma Diagnosis Using Monte Carlo Simulations. Vet. Pathol. 2019, 56, 856–859. [CrossRef] [PubMed] 22. Tecilla, M.; Gambini, M.; Forlani, A.; Caniatti, M.; Ghisleni, G.; Roccabianca, P. Evaluation of Cytological Diagnostic Accuracy for Canine Splenic Neoplasms: An Investigation in 78 Cases Using STARD Guidelines. PLoS ONE 2019, 14, e0224945. [CrossRef] [PubMed] 23. Flory, A.; Kruglyak, K.M.; Tynan, J.A.; McLennan, L.M.; Rafalko, J.M.; Fiaux, P.C.; Hernandez, G.E.; Marass, F.; Nakashe, P.; Ruiz-Perez, C.A.; et al. Clinical Validation of a Next-Generation Sequencing-Based Multi-Cancer Early Detection “Liquid Biopsy” Blood Test in over 1000 Dogs Using an Independent Testing Set: The CANcer Detection in Dogs (CANDiD) Study. PLoS ONE 2022, 17, e0266623. [CrossRef] [PubMed] 24. Wilson-Robles, H.M.; Bygott, T.; Kelly, T.K.; Miller, T.M.; Miller, P.; Matsushita, M.; Terrell, J.; Bougoussa, M.; Butera, T. Evaluation of Plasma Nucleosome Concentrations in Dogs with a Variety of Common Cancers and in Healthy Dogs. BMC Vet. Res. 2022, 18. [CrossRef] [PubMed] 25. Scarff, D. Solar (Actinic) Dermatoses in the Dog and Cat. Companion Anim. 2017, 22, 188–196. [CrossRef] 26. Nóbrega, D.F.; Sehaber, V.F.; Madureira, R.; Bracarense, A.P.F.R.L. Canine Cutaneous Haemangiosarcoma: Biomarkers and Survival. J. Comp. Pathol. 2019, 166, 87–96. [CrossRef] 27. Moore, A.S.; Rassnick, K.M.; Frimberger, A.E. Evaluation of Clinical and Histologic Factors Associated with Survival Time in Dogs with Stage II Splenic Hemangiosarcoma Treated by Splenectomy. J. Am. Vet. Med. Assoc. 2017, 251, 559–565. [CrossRef] 28. Lyles, S.E.; Milner, R.J.; Kow, K.; Salute, M.E. In Vitro Effects of the Tyrosine Kinase Inhibitor, Masitinib Mesylate, on Canine Hemangiosarcoma Cell Lines. Vet. Comp. Oncol. 2012, 10, 223–235. [CrossRef] 29. Gardner, H.L.; London, C.A.; Portela, R.A.; Nguyen, S.; Rosenberg, M.P.; Klein, M.K.; Clifford, C.; Thamm, D.H.; Vail, D.M.; Bergman, P.; et al. Maintenance Therapy with Toceranib Following Doxorubicin-Based Chemotherapy for Canine Splenic Hemangiosarcoma. BMC Vet. Res. 2015, 11, 131. [CrossRef] 30. Alexander, J.E.; Colyer, A.; Haydock, R.M.; Hayek, M.G.; Park, J. Understanding How Dogs Age: Longitudinal Analysis of Markers of Inflammation, Immune Function, and Oxidative Stress. J. Gerontol. Ser. A Biol. Sci. Med. Sci. 2018, 73, 720–728. [CrossRef] 31. De Campos, C.B.; Lavalle, G.E.; Monteiro, L.N.; Arantes Pêgas, G.R.; Fialho, S.L.; Balabram, D.; Cassali, G.D. Adjuvant Thalidomide and Metronomic Chemotherapy for the Treatment of Canine Malignant Mammary Gland Neoplasms. In Vivo (Brooklyn) 2018, 32, 1659–1666. [CrossRef] 32. Treggiari, E.; Borrego, J.F.; Gramer, I.; Valenti, P.; Harper, A.; Finotello, R.; Toni, C.; Laomedonte, P.; Romanelli, G. Retrospective Comparison of First-Line Adjuvant Anthracycline vs Metronomic-Based Chemotherapy Protocols in the Treatment of Stage I and II Canine Splenic Haemangiosarcoma. Vet. Comp. Oncol. 2020, 18, 43–51. [CrossRef] 33. Finotello, R.; Stefanello, D.; Zini, E.; Marconato, L. Comparison of Doxorubicin–Cyclophosphamide with Doxorubicin– Dacarbazine for the Adjuvant Treatment of Canine Hemangiosarcoma. Vet. Comp. Oncol. 2017, 15, 25–35. [CrossRef] 34. Bray, J.P.; Munday, J.S. Thalidomide Reduces Vascular Endothelial Growth Factor Immunostaining in Canine Splenic Heman- giosarcoma. Vet. Sci. 2020, 7, 67. [CrossRef] 35. Musser, M.L.; Coto, G.M.; Lingnan, Y.; Mochel, P.; Johannes, C.M. Pilot Safety Evaluation of Doxorubicin Chemotherapy Combined with Non-Specific Immunotherapy (Immunocidin®) for Canine Splenic Hemangiosarcoma. PLoS ONE 2022, 17, e0279594. [CrossRef] 36. Lucroy, M.D.; Clauson, R.M.; Suckow, M.A.; El-Tayyeb, F.; Kalinauskas, A. Evaluation of an Autologous Cancer Vaccine for the Treatment of Metastatic Canine Hemangiosarcoma: A Preliminary Study. BMC Vet. Res. 2020, 16, 447. [CrossRef] 37. Konduri, V.; Halpert, M.M.; Baig, Y.C.; Coronado, R.; Rodgers, J.R.; Levitt, J.M.; Cerroni, B.; Piscoya, S.; Wilson, N.; DiBernardi, L.; et al. Dendritic Cell Vaccination plus Low-Dose Doxorubicin for the Treatment of Spontaneous Canine Hemangiosarcoma. Cancer Gene Ther. 2019, 26, 282–291. [CrossRef] 38. Faulhaber, E.A.; Janik, E.; Thamm, D.H. Adjuvant Carboplatin for Treatment of Splenic Hemangiosarcoma in Dogs: Retrospec- tive Evaluation of 18 Cases (2011-2016) and Comparison with Doxorubicin-Based Chemotherapy. J. Vet. Intern. Med. 2021, 35, 1929–1934. [CrossRef] [PubMed] 39. Gedney, A.; Salah, P.; Mahoney, J.A.; Krick, E.; Martins, R.; Scavello, H.; Lenz, J.A.; Atherton, M.J. Evaluation of the Anti-Tumour Activity of Coriolus Versicolor Polysaccharopeptide (I’m-Yunity) Alone or in Combination with Doxorubicin for Canine Splenic Hemangiosarcoma. Vet. Comp. Oncol. 2022, 20, 688–696. [CrossRef] [PubMed] 40. Wong, S.; Ehrhart, E.J.; Stewart, S.; Zismann, V.; Cawley, J.; Halperin, R.; Briones, N.; Richter, K.; Sivaprakasam, K.; Perdigones, N.; et al. Genomic Landscapes of Canine Splenic Angiosarcoma (Hemangiosarcoma) Contain Extensive Heterogene- ity within and between Patients. PLoS ONE 2022, 17, e0264986. [CrossRef] [PubMed] 41. Alsaihati, B.A.; Ho, K.L.; Watson, J.; Feng, Y.; Wang, T.; Dobbin, K.K.; Zhao, S. Canine Tumor Mutational Burden Is Correlated with TP53 Mutation across Tumor Types and Breeds. Nat. Commun. 2021, 12, 4670. [CrossRef] 42. Wu, K.; Rodrigues, L.; Post, G.; Harvey, G.; White, M.; Miller, A.; Lambert, L.; Lewis, B.; Lopes, C.; Zou, J. Analyses of Canine Cancer Mutations and Treatment Outcomes Using Real-World Clinico-Genomics Data of 2119 Dogs. NPJ Precis. Oncol. 2023, 7, 8. [CrossRef] 43. Wang, G.; Wu, M.; Durham, A.C.; Radaelli, E.; Mason, N.J.; Xu, X.W.; Roth, D.B. Molecular Subtypes in Canine Hemangiosarcoma Reveal Similarities with Human Angiosarcoma. PLoS ONE 2020, 15, e0229728. [CrossRef] [PubMed] 44. Kim, J.H.; Megquier, K.; Thomas, R.; Sarver, A.L.; Song, J.M.; Kim, Y.T.; Cheng, N.; Schulte, A.J.; Linden, M.A.; Murugan, P.; et al. Genomically Complex Human Angiosarcoma and Canine Hemangiosarcoma Establish Convergent Angiogenic Transcriptional Programs Driven by Novel Gene Fusions. Mol. Cancer Res. 2021, 19, 847–861. [CrossRef] 45. Neganova, M.E.; Klochkov, S.G.; Aleksandrova, Y.R.; Aliev, G. Histone Modifications in Epigenetic Regulation of Cancer: Perspectives and Achieved Progress. Semin. Cancer Biol. 2022, 83, 452–471. [CrossRef] 46. Suzuki, T.; Aoshima, K.; Yamazaki, J.; Kobayashi, A.; Kimura, T. Manipulating Histone Acetylation Leads to Antitumor Effects in Hemangiosarcoma Cells. Vet. Comp. Oncol. 2022, 20, 805–816. [CrossRef] [PubMed] 47. Thomas, R.; Borst, L.; Rotroff, D.; Motsinger-Reif, A.; Lindblad-Toh, K.; Modiano, J.F.; Breen, M. Genomic Profiling Reveals Extensive Heterogeneity in Somatic DNA Copy Number Aberrations of Canine Hemangiosarcoma. Chromosom. Res. 2014, 22, 305–319. [CrossRef] [PubMed] 48. Penel, N.; Ray-Coquard, I.; Bal-Mahieu, C.; Chevreau, C.; Le Cesne, A.; Italiano, A.; Bompas, E.; Clisant, S.; Baldeyrou, B.; Lansiaux, A.; et al. Low Level of Baseline Circulating VEGF-A Is Associated with Better Outcome in Patients with Vascular Sarcomas Receiving Sorafenib: An Ancillary Study from a Phase II Trial. Target Oncol. 2014, 9, 273–277. [CrossRef] 49. Wan, H.; Zhang, D.; Hu, W.; Xie, Z.; Du, Q.; Xia, Q.; Wen, T.; Jia, H. Aberrant PTEN, PIK3CA, PMAPK, and TP53 Expression in Human Scalp and Face Angiosarcoma. Medicine 2021, 100, e26779. [CrossRef] 50. Conciatori, F.; Bazzichetto, C.; Falcone, I.; Ciuffreda, L.; Ferretti, G.; Vari, S.; Ferraresi, V.; Cognetti, F.; Milella, M. Pten Function at the Interface between Cancer and Tumor Microenvironment: Implications for Response to Immunotherapy. Int. J. Mol. Sci. 2020, 21, 5337. [CrossRef] 51. Papa, A.; Pandolfi, P.P. The PTEN–PI3K Axis in Cancer. Biomolecules 2019, 9, 153. [CrossRef] [PubMed] 52. Tamburini, B.A.; Trapp, S.; Phang, T.L.; Schappa, J.T.; Hunter, L.E.; Modiano, J.F. Gene Expression Profiles of Sporadic Canine Hemangiosarcoma Are Uniquely Associated with Breed. PLoS ONE 2009, 4, e5549. [CrossRef] 53. Wang, G.; Wu, M.; Maloneyhuss, M.A.; Wojcik, J.; Durham, A.C.; Mason, N.J.; Roth, D.B. Actionable Mutations in Canine Hemangiosarcoma. PLoS ONE 2017, 12, e0188667. [CrossRef] 54. Clendaniel, D.C.; Sivacolundhu, R.K.; Sorenmo, K.U.; Donovan, T.A.; Turner, A.; Arteaga, T.; Bergman, P.J. Association between Macroscopic Appearance of Liver Lesions and Liver Histology in Dogs with Splenic Hemangiosarcoma: 79 Cases (2004–2009). J. Am. Anim. Hosp. Assoc. 2014, 50, e6–e10. [CrossRef] [PubMed] 55. Batschinski, K.; Nobre, A.; Vargas-Mendez, E.; Tedardi, M.V.; Cirillo, J.; Cestari, G.; Ubukata, R.; Dagli, M.L.Z. Canine Visceral Hemangiosarcoma Treated with Surgery Alone or Surgery and Doxorubicin: 37 Cases (2005–2014). Can. Vet. J. 2018, 59, 967–972. [PubMed] 56. García-Iglesias, M.J.; Cuevas-Higuera, J.L.; Bastida-Sáenz, A.; De Garnica-García, M.G.; Polledo, L.; Perero, P.; González- Fernández, J.; Fernández-Martínez, B.; Pérez-Martínez, C. Immunohistochemical Detection of P53 and Pp53 Ser392in Canine Hemangiomas and Hemangiosarcomas Located in the Skin. BMC Vet. Res. 2020, 16, 239. [CrossRef] [PubMed] 57. Robinson, K.L.; Bryan, M.E.; Atkinson, E.S.; Keeler, M.R.; Hahn, A.W.; Bryan, J.N. Neutering Is Associated with Developing Hemangiosarcoma in Dogs in the Veterinary Medical Database: An Age and Time-Period Matched Case-Control Study (1964– 2003). Can. Vet. J. 2020, 61, 499–504. 58. Sherwood, J.M.; Haynes, A.M.; Klocke, E.; Higginbotham, M.L.; Thomson, E.M.; Weng, H.Y.; Millard, H.A.T. Occurrence and Clinicopathologic Features of Splenic Neoplasia Based on Body Weight: 325 Dogs (2003–2013). J. Am. Anim. Hosp. Assoc. 2016, 52, 220–226. [CrossRef] 59. Torres de la Riva, G.; Hart, B.L.; Farver, T.B.; Oberbauer, A.M.; Messam, L.L.M.V.; Willits, N.; Hart, L.A. Neutering Dogs: Effects on Joint Disorders and Cancers in Golden Retrievers. PLoS ONE 2013, 8, 55937. [CrossRef] 60. Hart, B.L.; Hart, L.A.; Thigpen, A.P.; Willits, N.H. Neutering of German Shepherd Dogs: Associated Joint Disorders, Cancers and Urinary Incontinence. Vet. Med. Sci. 2016, 2, 191–199. [CrossRef] 61. Maeda, M.; Ochiai, K.; Michishita, M.; Morimatsu, M.; Sakai, H.; Kinoshita, N.; Sakaue, M.; Onozawa, E.; Azakami, D.; Yamamoto, M.; et al. In Vitro Anticancer Effects of Alpelisib against PIK3CA-mutated Canine Hemangiosarcoma Cell Lines. Oncol. Rep. 2022, 47, 84. [CrossRef] [PubMed] 62. Igase, M.; Fujiki, N.; Shibutani, S.; Sakai, H.; Noguchi, S.; Nemoto, Y.; Mizuno, T. Tenovin-6 Induces the SIRT-Independent Cell Growth Suppression and Blocks Autophagy Flux in Canine Hemangiosarcoma Cell Lines. Exp. Cell. Res. 2020, 388. [CrossRef] [PubMed] 63. Megquier, K.; Turner-Maier, J.; Swofford, R.; Kim, J.H.; Sarver, A.L.; Wang, C.; Sakthikumar, S.; Johnson, J.; Koltookian, M.; Lewellen, M.; et al. Comparative Genomics Reveals Shared Mutational Landscape in Canine Hemangiosarcoma and Human Angiosarcoma. Mol. Cancer Res. 2019, 17, 2410–2421. [CrossRef] 64. Dickerson, E.B.; Thomas, R.; Fosmire, S.P.; Lamerato-Kozicki, A.R.; Bianco, S.R.; Wojcieszyn, J.W.; Breen, M.; Helfand, S.C.; Modiano, J.F. Mutations of Phosphatase and Tensin Homolog Deleted from Chromosome 10 in Canine Hemangiosarcoma. Vet. Pathol. 2005, 42, 618–632. [CrossRef] 65. Wong, K.; Ludwig, L.; Krijgsman, O.; Adams, D.J.; Wood, G.A.; Van Der Weyden, L. Comparison of the Oncogenomic Landscape of Canine and Feline Hemangiosarcoma Shows Novel Parallels with Human Angiosarcoma. DMM Dis. Models Mechan. 2021, 14, dmm049044. [CrossRef] 66. Hasbullah, H.H.; Musa, M. Gene Therapy Targeting P53 and Kras for Colorectal Cancer Treatment: A Myth or the Way Forward? Int. J. Mol. Sci. 2021, 22, 11941. [CrossRef] 67. Zhang, W.W.; Li, L.; Li, D.; Liu, J.; Li, X.; Li, W.; Xu, X.; Zhang, M.J.; Chandler, L.A.; Lin, H.; et al. The First Approved Gene Therapy Product for Cancer Ad-P53 (Gendicine): 12 Years in the Clinic. Hum. Gene Ther. 2018, 29, 160–179. [CrossRef] [PubMed] 68. Igase, M.; Inanaga, S.; Tani, K.; Nakaichi, M.; Sakai, Y.; Sakurai, M.; Kato, M.; Tsukui, T.; Mizuno, T. Long-term Survival of Dogs with Stage 4 Oral Malignant Melanoma Treated with Anti-canine Therapeutic Antibody: A Follow-up Case Report. Vet. Comp. Oncol. 2022, 20, 901–905. [CrossRef] 69. Pantelyushin, S.; Ranninger, E.; Guerrera, D.; Hutter, G.; Maake, C.; Markkanen, E.; Bettschart-Wolfensberger, R.; Bley, C.R.; Läubli, H.; Vom Berg, J. Cross-Reactivity and Functionality of Approved Human Immune Checkpoint Blockers in Dogs. Cancers 2021, 13, 785. [CrossRef] 70. Jiang, Y.; Chen, M.; Nie, H.; Yuan, Y. PD-1 and PD-L1 in Cancer Immunotherapy: Clinical Implications and Future Considerations. Hum. Vaccin. Immunother. 2019, 15, 1111–1122. [CrossRef] 71. Boston, S.E.; Lu, X.; Culp, W.T.N.; Montinaro, V.; Romanelli, G.; Dudley, R.M.; Liptak, J.M.; Mestrinho, L.A.; Buracco, P. Efficacy of Systemic Adjuvant Therapies Administered to Dogs after Excision of Oral Malignant Melanomas: 151 Cases (2001–2012). J. Am. Vet. Med. Assoc. 2014, 245, 401–407. [CrossRef] [PubMed] 72. Cawley, J.R.; Stewart, S.D.; Mochel, J.P.; Veluvolu, S.; Khanna, C.; Fenger, J.M. Pharmacokinetic Exposures Associated With Oral Administration of Sorafenib in Dogs With Spontaneous Tumors. Front. Vet. Sci. 2022, 9, 888483. [CrossRef] [PubMed] 73. Marconato, L.; Sabattini, S.; Marisi, G.; Rossi, F.; Leone, V.F.; Casadei-Gardini, A. Sorafenib for the Treatment of Unresectable Hepatocellular Carcinoma: Preliminary Toxicity and Activity Data in Dogs. Cancers 2020, 12, 1272. [CrossRef] 74. Foskett, A.; Manley, C.; Naramore, R.; Gordon, I.; Stewart, B.; Khanna, C. Tolerability of Oral Sorafenib in Pet Dogs with a Diagnosis of Cancer. Vet. Med. Res. Rep. 2017, 8, 97–102. [CrossRef] [PubMed] 75. Murase, Y.; Hosoya, K.; Sato, T.; Kim, S.; Okumura, M. Antitumor Activity of the Dual PI3K/MTOR Inhibitor Gedatolisib and the Involvement of ABCB1 in Gedatolisib Resistance in Canine Tumor Cells. Oncol. Rep. 2022, 47, 61. [CrossRef] 76. Wilson, G.D.; Wilson, T.G.; Hanna, A.; Dabjan, M.; Buelow, K.; Torma, J.; Marples, B.; Galoforo, S. Dacomitinib and Gedatolisib in Combination with Fractionated Radiation in Head and Neck Cancer. Clin. Transl. Radiat. Oncol. 2021, 26, 15–23. [CrossRef] 77. Liu, C.; Xing, W.; Yu, H.; Zhang, W.; Si, T. ABCB1 and ABCG2 Restricts the Efficacy of Gedatolisib (PF-05212384), a PI3K Inhibitor in Colorectal Cancer Cells. Cancer Cell Int. 2021, 21, 108. [CrossRef] 78. Markham, A. Alpelisib: First Global Approval. Drugs 2019, 79, 1249–1253. [CrossRef] 79. Prior, I.A.; Hood, F.E.; Hartley, J.L. The Frequency of Ras Mutations in Cancer. Cancer Res. 2020, 80, 2669–2974. [CrossRef] 80. Usher, S.G.; Radford, A.D.; Villiers, E.J.; Blackwood, L. RAS, FLT3, and C-KIT Mutations in Immunophenotyped Canine Leukemias. Exp. Hematol. 2009, 37, 65–77. [CrossRef] 81. Gong, B.; Liu, W.W.; Nie, W.J.; Li, D.F.; Xie, Z.J.; Liu, C.; Liu, Y.H.; Mei, P.; Li, Z.J. MiR-21/RASA1 Axis Affects Malignancy of Colon Cancer Cells via RAS Pathways. World J. Gastroenterol. 2015, 21, 1488–1497. [CrossRef] [PubMed] 82. Mochizuki, H.; Breen, M. Sequence Analysis of RAS and RAF Mutation Hot Spots in Canine Carcinoma. Vet. Comp. Oncol. 2017, 15, 1598–1605. [CrossRef] [PubMed] 83. Mayr, B.; Schaffner, G.; Reifinger, M. K-Ras Mutations in Canine Pancreatic Cancers. Vet. Rec. 2003, 153, 87–89. [CrossRef] 84. Griffey, S.M.; Kraegel, S.A.; Madewell, B.R. Rapid Detection of K-Ras Gene Mutations in Canine Lung Cancer Using Single-Strand Conformational Polymorphism Analysis. Carcinogenesis 1998, 19, 959–963. [CrossRef] [PubMed] 85. Degirmenci, U.; Wang, M.; Hu, J. Targeting Aberrant RAS/RAF/MEK/ERK Signaling for Cancer Therapy. Cells 2020, 9, 198. [CrossRef] 86. Zhang, Y.; Li, Y.; Wang, Q.; Su, B.; Xu, H.; Sun, Y.; Sun, P.; Li, R.; Peng, X.; Cai, J. Role of RASA1 in Cancer: A Review and Update (Review). Oncol. Rep. 2020, 44, 2386–2396. [CrossRef] 87. Xiao, W.; Zheng, S.; Zou, Y.; Yang, A.; Xie, X.; Tang, H.; Xie, X. CircAHNAK1 Inhibits Proliferation and Metastasis of Triple- Negative Breast Cancer by Modulating MiR-421 and RASA1. Aging 2019, 11, 12043–12056. [CrossRef] 88. Pottier, C.; Fresnais, M.; Gilon, M.; Jérusalem, G.; Longuespée, R.; Sounni, N.E. Tyrosine Kinase Inhibitors in Cancer: Breakthrough and Challenges of Targeted Therapy. Cancers 2020, 12, 731. [CrossRef] 89. Xu, Y.; Huang, J.; Ma, L.; Shan, J.; Shen, J.; Yang, Z.; Liu, L.; Luo, Y.; Yao, C.; Qian, C. MicroRNA-122 Confers Sorafenib Resistance to Hepatocellular Carcinoma Cells by Targeting IGF-1R to Regulate RAS/RAF/ERK Signaling Pathways. Cancer Lett. 2016, 371, 171–181. [CrossRef] 90. Andersen, N.J.; Nickoloff, B.J.; Dykema, K.J.; Boguslawski, E.A.; Krivochenitser, R.I.; Froman, R.E.; Dawes, M.J.; Baker, L.H.; Thomas, D.G.; Kamstock, D.A.; et al. Pharmacologic Inhibition of MEK Signaling Prevents Growth of Canine Hemangiosarcoma. Mol. Cancer Ther. 2013, 12, 1701–1714. [CrossRef] 91. Signorelli, J.; Shah Gandhi, A. Cobimetinib: A Novel MEK Inhibitor for Metastatic Melanoma. Ann. Pharmacother. 2017, 51, 146–153. [CrossRef] 92. Morales, M.L.; Arenas, A.; Ortiz-Ruiz, A.; Leivas, A.; Rapado, I.; Rodríguez-García, A.; Castro, N.; Zagorac, I.; Quintela-Fandino, M.; Gómez-López, G.; et al. MEK Inhibition Enhances the Response to Tyrosine Kinase Inhibitors in Acute Myeloid Leukemia. Sci. Rep. 2019, 9, 18630. [CrossRef] [PubMed] 93. Cathomas, G. PIK3CA in Colorectal Cancer. Front. Oncol. 2014, 4, 35. [CrossRef] [PubMed] 94. Arafeh, R.; Samuels, Y. PIK3CA in Cancer: The Past 30 Years. Semin. Cancer Biol. 2019, 59, 36–49. [CrossRef] 95. Murai, A.; Asa, S.A.; Kodama, A.; Hirata, A.; Yanai, T.; Sakai, H. Constitutive Phosphorylation of the MTORC2/Akt/4E-BP1 Pathway in Newly Derived Canine Hemangiosarcoma Cell Lines. BMC Vet. Res. 2012, 8, 128. [CrossRef] 96. Hanahan, D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022, 12, 31–46. [CrossRef] [PubMed] 97. Hanahan, D.; Weinberg, R.A. Hallmarks of Cancer: The next Generation. Cell 2011, 144, 646–674. [CrossRef] [PubMed] 98. Langdon, S.P.; Kay, C.; Um, I.H.; Dodds, M.; Muir, M.; Sellar, G.; Kan, J.; Gourley, C.; Harrison, D.J. Evaluation of the Dual MTOR/PI3K Inhibitors Gedatolisib (PF-05212384) and PF-04691502 against Ovarian Cancer Xenograft Models. Sci. Rep. 2019, 9. [CrossRef] 99. Pyuen, A.A.; Meuten, T.; Rose, B.J.; Thamm, D.H. In Vitro Effects of PI3K/MTOR Inhibition in Canine Hemangiosarcoma. PLoS ONE 2022, 13, e0200634. [CrossRef] 100. Oda, K.; Okada, J.; Timmerman, L.; Rodriguez-Viciana, P.; Stokoe, D.; Shoji, K.; Taketani, Y.; Kuramoto, H.; Knight, Z.A.; Shokat, K.M.; et al. PIK3CA Cooperates with Other Phosphatidylinositol 3′-Kinase Pathway Mutations to Effect Oncogenic Transformation. Cancer Res. 2008, 68, 8127–8136. [CrossRef] 101. Kim, S.H.; Seung, B.J.; Cho, S.H.; Lim, H.Y.; Bae, M.K.; Sur, J.H. Dysregulation of Pi3k/Akt/Pten Pathway in Canine Mammary Tumor. Animals 2021, 11, 2079. [CrossRef] 102. Yu, L.; Wei, J.; Liu, P. Attacking the PI3K/Akt/MTOR Signaling Pathway for Targeted Therapeutic Treatment in Human Cancer. Semin. Cancer Biol. 2022, 85, 69–94. [CrossRef] 103. Jamaspishvili, T.; Berman, D.M.; Ross, A.E.; Scher, H.I.; De Marzo, A.M.; Squire, J.A.; Lotan, T.L. Clinical Implications of PTEN Loss in Prostate Cancer. Nat. Rev. Urol. 2018, 15, 222–234. [CrossRef] 104. Álvarez-Garcia, V.; Tawil, Y.; Wise, H.M.; Leslie, N.R. Mechanisms of PTEN Loss in Cancer: It’s All about Diversity. Semin. Cancer Biol. 2019, 59, 66–79. [CrossRef] [PubMed] 105. Qiu, C.; Lin, D.; Wang, J.; Wang, L. Expression and Significance of PTEN in Canine Mammary Gland Tumours. Res. Vet. Sci. 2008, 85, 383–388. [CrossRef] [PubMed] 106. Wyeth Pharmaceuticals. TORISELTMKit (Temsirolimus). U.S Patent No. 5,362,718, 2 January 2007. 107. Motzer, R.J.; Escudier, B.; Oudard, S.; Hutson, T.E.; Porta, C.; Bracarda, S.; Grünwald, V.; Thompson, J.A.; Figlin, R.A.; Hollaender, N.; et al. Efficacy of Everolimus in Advanced Renal Cell Carcinoma: A Double-Blind, Randomised, Placebo- Controlled Phase III Trial. Lancet 2008, 372, 449–456. [CrossRef] 108. Yoo, C.; Lee, J.; Rha, S.Y.; Park, K.H.; Kim, T.M.; Kim, Y.J.; Lee, H.J.; Lee, K.H.; Ahn, J.H. Multicenter Phase II Study of Everolimus in Patients with Metastatic or Recurrent Bone and Soft-Tissue Sarcomas after Failure of Anthracycline and Ifosfamide. Invest. New Drugs 2013, 31, 1602–1608. [CrossRef] [PubMed] 109. Michishita, M.; Ochiai, K.; Nakahira, R.; Azakami, D.; Machida, Y.; Nagashima, T.; Nakagawa, T.; Ishiwata, T. MTOR Pathway as a Potential Therapeutic Target for Cancer Stem Cells in Canine Mammary Carcinoma. Front. Oncol. 2023, 13, 1100602. [CrossRef] 110. LeBlanc, A.K.; Mazcko, C.N.; Cherukuri, A.; Berger, E.P.; Kisseberth, W.C.; Brown, M.E.; Lana, S.E.; Weishaar, K.; Flesner, B.K.; Bryan, J.N.; et al. Adjuvant Sirolimus Does Not Improve Outcome in Pet Dogs Receiving Standard-of-Care Therapy for Appendicular Osteosarcoma: A Prospective, Randomized Trial of 324 Dogs. Clin. Cancer Res. 2021, 27, 3005–3016. [CrossRef] 111. Giuliano, A.; Horta, R.S.; Vieira, R.A.M.; Hume, K.R.; Dobson, J. Repurposing Drugs in Small Animal Oncology Repurposing Drugs in Small Animal Oncology. Animals 2023, 13, 139. [CrossRef] 112. Marei, H.E.; Althani, A.; Afifi, N.; Hasan, A.; Caceci, T.; Pozzoli, G.; Morrione, A.; Giordano, A.; Cenciarelli, C. p53 Signaling in Cancer Progression and Therapy. Cancer Cell Int. 2021, 21, 703. [CrossRef] [PubMed] 113. Dunbar, C.E.; High, K.A.; Joung, J.K.; Kohn, D.B.; Ozawa, K.; Sadelain, M. Gene Therapy Comes of Age. Science 2018, 359, eaan4672. [CrossRef] [PubMed] 114. Zhao, Y.; Simon, M.; Seluanov, A.; Gorbunova, V. DNA Damage and Repair in Age-Related Inflammation. Nat. Rev. Immunol. 2023, 23, 75–89. [CrossRef] 115. Sargen, M.R.; Merrill, S.L.; Chu, E.Y.; Nathanson, K.L. CDKN2A Mutations with P14 Loss Predisposing to Multiple Nerve Sheath Tumours, Melanoma, Dysplastic Naevi and Internal Malignancies: A Case Series and Review of the Literature. British J. Dermatol. 2016, 175, 785–789. [CrossRef] [PubMed] 116. Zhao, R.; Choi, B.Y.; Lee, M.H.; Bode, A.M.; Dong, Z. Implications of Genetic and Epigenetic Alterations of CDKN2A (P16INK4a) in Cancer. EBioMedicine 2016, 8, 30–39. [CrossRef] 117. Cicenas, J.; Kvederaviciute, K.; Meskinyte, I.; Meskinyte-Kausiliene, E.; Skeberdyte, A. KRAS, TP53, CDKN2A, SMAD4, BRCA1, and BRCA2 Mutations in Pancreatic Cancer. Cancers 2017, 9, 42. [CrossRef] 118. Miller, T.I.; Zoumberos, N.A.; Johnson, B.; Rhodes, D.R.; Tomlins, S.A.; Chan, M.P.; Andea, A.A.; Lucas, D.R.; McHugh, J.B.; Smith, N.; et al. A Genomic Survey of Sarcomas on Sun-Exposed Skin Reveals Distinctive Candidate Drivers and Potentially Targetable Mutations. Hum. Pathol. 2020, 102, 60–69. [CrossRef] 119. Brandt, L.P.; Albers, J.; Hejhal, T.; Pfundstein, S.; Gonçalves, A.F.; Catalano, A.; Wild, P.J.; Frew, I.J. Mouse Genetic Background Influences Whether Hras G12V Expression plus Cdkn2a Knockdown Causes Angiosarcoma or Undifferentiated Pleomorphic Sarcoma. Oncotarget 2018, 9, 19753–19766. [CrossRef] 120. Melincovici, C.S.; Bos¸ca, A.B.; S¸ us¸man, S.; Mărginean, M.; Mihu, C.; Istrate, M.; Moldovan, I.-M.; Roman, A.L.; Mihu, C.M. Vascular Endothelial Growth Factor (VEGF)-Key Factor in Normal and Pathological Angiogenesis. Rom. J. Morphol. Embryol. 2018, 59, 455–467. 121. Nejad, A.E.; Najafgholian, S.; Rostami, A.; Sistani, A.; Shojaeifar, S.; Esparvarinha, M.; Nedaeinia, R.; Haghjooy Javanmard, S.; Taherian, M.; Ahmadlou, M.; et al. The Role of Hypoxia in the Tumor Microenvironment and Development of Cancer Stem Cell: A Novel Approach to Developing Treatment. Cancer Cell Int. 2021, 21, 62. [CrossRef] 122. Li, X.; Gao, Y.; Li, J.; Zhang, K.; Han, J.; Li, W.; Hao, Q.; Zhang, W.; Wang, S.; Zeng, C.; et al. FOXP3 Inhibits Angiogenesis by Downregulating VEGF in Breast Cancer. Cell. Death Dis. 2018, 9, 744. [CrossRef] [PubMed] 123. Young, R.J.; Woll, P.J. Anti-Angiogenic Therapies for the Treatment of Angiosarcoma: A Clinical Update. Mag. Eur. Med. Oncol. 2017, 10, 190–193. [CrossRef] 124. Hegde, P.S.; Wallin, J.J.; Mancao, C. Predictive Markers of Anti-VEGF and Emerging Role of Angiogenesis Inhibitors as Im- munotherapeutics. Semin. Cancer Biol. 2018, 52, 117–124. [CrossRef] 125. Maeda-Otsuka, S.; Kajihara, I.; Tasaki, Y.; Yamada-Kanazawa, S.; Sakamoto, R.; Sawamura, S.; Masuzawa, M.; Masuzawa, M.; Amoh, Y.; Hoshina, D.; et al. Hypoxia Accelerates the Progression of Angiosarcoma through the Regulation of Angiosarcoma Cells and Tumor Microenvironment. J. Dermatol. Sci. 2019, 93, 123–132. [CrossRef] [PubMed] 126. Moschetta, M.G.; Maschio, L.B.; Jardim-Perassi, B.V.; Gelaleti, G.B.; Lopes, J.R.; Leonel, C.; Do Nascimento Goncalves, N.; Ferreira, L.C.; Martins, G.R.; Borin, T.F.; et al. Prognostic Value of Vascular Endothelial Growth Factor and Hypoxia-Inducible Factor 1α in Canine Malignant Mammary Tumors. Oncol. Rep. 2015, 33, 2345–2353. [CrossRef] [PubMed] 127. Wei, X.; Chen, Y.; Jiang, X.; Peng, M.; Liu, Y.; Mo, Y.; Ren, D.; Hua, Y.; Yu, B.; Zhou, Y.; et al. Mechanisms of Vasculogenic Mimicry in Hypoxic Tumor Microenvironments. Mol. Cancer 2021, 20, 7. [CrossRef] 128. Walsh, J.C.; Lebedev, A.; Aten, E.; Madsen, K.; Marciano, L.; Kolb, H.C. The Clinical Importance of Assessing Tumor Hypoxia: Relationship of Tumor Hypoxia to Prognosis and Therapeutic Opportunities. Antioxid. Redox Signal. 2014, 21, 1516–1554. [CrossRef] 129. Ghahremani, M.F.; Radaelli, E.; Haigh, K.; Bartunkova, S.; Haenebalcke, L.; Marine, J.C.; Goossens, S.; Haigh, J.J. Loss of Autocrine Endothelial-Derived VEGF Significantly Reduces Hemangiosarcoma Development in Conditional P53-Deficient Mice. Cell Cycle 2014, 13, 1502–1508. [CrossRef] 130. Adachi, M.; Hoshino, Y.; Izumi, Y.; Takagi, S. Immunohistochemical Detection of a Potential Molecular Therapeutic Target for Canine Hemangiosarcoma. J. Vet. Med. Sci. 2016, 78, 649–656. [CrossRef] 131. Lebellec, L.; Bertucci, F.; Tresch-Bruneel, E.; Ray-Coquard, I.; Le Cesne, A.; Bompas, E.; Blay, J.Y.; Italiano, A.; Mir, O.; Rycke- waert, T.; et al. Prognostic and Predictive Factors for Angiosarcoma Patients Receiving Paclitaxel Once Weekly plus or Minus Bevacizumab: An Ancillary Study Derived from a Randomized Clinical Trial. BMC Cancer 2018, 18, 963. [CrossRef] 132. Campos, G.A. Juliana Alvares Duarte Bonini Campos; Daniel Soares Sanches; Maria Lúcia Zaidan Dagli; Julia Maria Matera Im- munohistochemical Evaluation of Vascular Endothelial Growth Factor (VEGF) in Splenic Hemangiomas and Hemangiosarcomas in Dogs. Open J. Vet. Med. 2012, 2, 191–195. [CrossRef] 133. Cao, J.; Wang, J.; He, C.; Fang, M. Angiosarcoma: A Review of Diagnosis and Current Treatment. Am. J. Cancer Res. 2019, 9, 2303–2313. [PubMed] 134. Sturm, E.C.; Marasco, I.S.; Katz, S.C. Multidisciplinary Management of Angiosarcoma—A Review. J. Surg. Res. 2021, 257, 213–220. [CrossRef] [PubMed] 135. Verganti, S.; Berlato, D.; Blackwood, L.; Amores-Fuster, I.; Polton, G.A.; Elders, R.; Doyle, R.; Taylor, A.; Murphy, S. Use of Oncept Melanoma Vaccine in 69 Canine Oral Malignant Melanomas in the UK. J. Small Anim. Pract. 2017, 58, 10–16. [CrossRef] [PubMed] 136. Alonso, J.C.C.; MacIel, M.C.; Ferrari, H.A.; Gonçalves, J.M.; Sasaki, B.R.S.; Cintra, A.A.; Durán, N.; Billis, A.; Fávaro, W.J. Safety and Efficacy of OncoTherad Nano-Immunotherapy in Patients with Non-Muscle Invasive Bladder Cancer. J. Phys. Conf. Ser. 2021, 1953, 012012. [CrossRef] 137. Böckelmann, P.K.; Tizziani, S.H.S.; Durán, N.; Fávaro, W.J. New Therapeutic Perspective for Bladder Cancer in Dogs: Toxicological and Clinical Effects of OncoTherad Nanostructured Immunotherapy. J. Phys. Conf. Ser. 2019, 1323, 012022. [CrossRef] 138. Durán, N.; Dias, Q.C.; Fávaro, W.J. OncoTherad: A New Nanobiological Response Modifier, Its Toxicological and Anticancer Activities. J. Phys. Conf. Ser. 2019, 1323, 012018. [CrossRef] 139. Rhea, L.P.; Mendez-Marti, S.; Kim, D.; Aragon-Ching, J.B. Role of Immunotherapy in Bladder Cancer. Cancer Treat Res. Commun.2021, 26, 100296. [CrossRef] 140. Gulay, K.C.M.; Aoshima, K.; Maekawa, N.; Suzuki, T.; Konnai, S.; Kobayashi, A.; Kimura, T. Hemangiosarcoma Cells Induce M2 Polarization and PD-L1 Expression in Macrophages. Sci. Rep. 2022, 12. [CrossRef] 141. Maekawa, N.; Konnai, S.; Okagawa, T.; Nishimori, A.; Ikebuchi, R.; Izumi, Y.; Takagi, S.; Kagawa, Y.; Nakajima, C.; Suzuki, Y.; et al. Immunohistochemical Analysis of PD-L1 Expression in Canine Malignant Cancers and PD-1 Expression on Lymphocytes in Canine Oral Melanoma. PLoS ONE 2016, 11. [CrossRef] 142. Reis, I.B.; Tibo, L.H.S.; de Souza, B.R.; Durán, N.; Fávaro, W.J. OncoTherad®Is an Immunomodulator of Biological Response That Downregulate RANK/RANKL Signaling Pathway and PD-1/PD-L1 Immune Checkpoint in Non-Muscle Invasive Bladder Cancer. J. Cancer Res. Clin. Oncol. 2022, 20–30. [CrossRef] [PubMed] |
| Sorumluluk Reddi/Yayıncının Notu: Tüm yayınlarda yer alan ifadeler, görüşler ve veriler yalnızca yazar(lar)a ve katkıda bulunan(lar)a aittir, MDPI ve/veya editör(ler)e ait değildir. MDPI ve/veya editör(ler), içerikte atıfta bulunulan herhangi bir fikir, yöntem, talimat veya üründen kaynaklanan insanlara veya mallara gelebilecek herhangi bir zarar için sorumluluk kabul etmez. |