| Veteriner Patoloji 1–7 © Yazar(lar) 2024 Makalenin yeniden kullanım yönergeleri: sagepub.com/journals-permissions DOI: 10.1177/03009858241265005 journals.sagepub.com/home/vet1 Tennessee Üniversitesi, Knoxville, TN İletişim: Linden E. Craig, Tennessee Üniversitesi, Veteriner Hekimliği Fakültesi, Knoxville, TN 37996, ABD. E-posta: linden@utk.edu |
ÖzetBu derlemenin amacı, köpeklerde en sık görülen sinovyal tümörlerin terminolojisini, olası köken hücrelerini ve beklenen davranışlarını netleştirmektir. Sinovyal membran, tip A ve tip B olmak üzere 2 hücre tipinden oluşur. Tip A sinoviyositler, CD18, Iba-1 ve CD204 gibi tipik histiyosit kökenli belirteçlere karşı antikorlarla immünoreaktif olan kemik iliği kökenli histiyositlerdir. Bazı ırklar ve daha önce eklem yaralanması geçirmiş köpekler, özellikle de kraniyal çapraz bağ rüptürü, sinovyal histiyositik sarkoma yatkındır. Tip B sinoviyositler sinovyal sıvı üreten mezenkimal hücrelerdir. B tipi sinoviyositlerin spesifik belirteçleri yoktur, ancak gros ve mikroskobik görünümlerine dayanarak sinovyal miksosarkomların (önceden sinovyal miksoma olarak kabul edilirdi) B tipi sinoviyosit kökenli olduğu varsayılır. Bunlar çevre dokulara sızabilir, ancak yavaş büyürler ve nadiren metastaz yaparlar, o zaman da sadece bölgesel lenf düğümlerine yayılırlar. Sinovyal histiyositik sarkomlar ve miksosarkomlar eklemi çevreleyen birden fazla kemikte lizise neden olabilir, ancak farklı prognozları vardır ve teşhis için histopatoloji ve bazen immünohistokimya gerekir. Sinovyal sarkom ve sinovyal hücre sarkomu, insan tıp literatüründe sinovyal kökenli olmayan bir tümör için kullanılan terimlerdir; bu terimler veteriner hekimlikte kullanılmamalıdır. Anahtar Kelimelerköpek, CD18, E-cadherin, histiyositik sarkom, immünohistokimya, miksoma, miksosarkom, derleme, sinovyal sarkom, sinovyum |
İnsanlarda ve diğer hayvanlarda, sinovyal kökenli sarkomların terminolojisi kafa karıştırıcıdır. Bu derlemenin amacı, köpeklerde en sık görülen sinovyal tümörlerin terminolojisini, olası köken hücrelerini ve beklenen davranışlarını netleştirmektir. Normal sinovyumun histolojisi de benzer şekilde kafa karıştırıcıdır; bazı histoloji ders kitaplarında sinoviyositlerden hiç bahsedilmezken32 bazıları da hücreleri sinoviyosit olarak adlandırmakta ancak birden fazla hücre tipi içerdiklerinden bahsetmemektedir.35 Çoğu ders kitabı 2 sinovyal hücre tipi tanımlamaktadır,42,44 ancak bazı yayınlar, özellikle fetal sinovyumdaki ultrastrüktürel özelliklere dayanarak üçüncü bir ara tip tanımlamaktadır.4,13,43 Ara hücre tipinin varlığı, sinovyumun seri kesitlerinin transmisyon elektron mikroskopisi ile çürütülmüştür.15 En yaygın olarak kabul edilen iki sinoviyosit tipi tip A (fagositik) ve tip B’dir (sinovyal sıvı üreten).44 Bu iki hücre tipi rutin boyama ile ayırt edilemez ve birlikte eklemlerin, bursaların ve tendon kılıflarının içini kaplayan ince (1-2 hücre kalınlığında) bir tabaka oluşturur.44 Elektron mikroskobu ile A tipi sinoviyositlerde Golgi aparatı, vakuoller, veziküller, mikrovilluslar ve mikroplika bulunur.3,4,15 İmmünohistokimya ile tip A hücreleri, formal fikse, parafine gömülü dokularda histiyositleri (dendritik hücreler ve makrofajlar) tespit etmek için sıklıkla kullanılan kemik iliği kaynaklı hücrelerin markörü olan CD18’i eksprese eder.8,24 Ayrıca histiyosit markörü olan Iba-1’i de eksprese ederler.28 Elektron mikroskobu ile tip B sinoviyositler daha kaba endoplazmik retikuluma sahiptir.3,4 Tip B sinoviyositler genellikle “fibroblast” olarak adlandırılır, ancak kolajen üretmezler. Bunlar, “sinovyal ekstraselüler matriksin son derece özel sıvı formu” olarak tanımlanan sinovyal sıvıyı üreten mezenkimal hücrelerdir.44 Isı şok proteini 25 ve cadherin 11, tip B sinoviyositlerin belirteçleri olarak kullanılmış olsa da,2,13,40,43 bunlar aynı zamanda diğer birçok mezenkimal hücre tipini de immün olarak işaretler.7 Hayvanlardaki eklem içi tümörler sinoviyositlerden veya eklem içindeki destekleyici dokulardan kaynaklanabilir. Köpeklerde en sık görülen eklem içi tümör, altta yatan sinovyal dokulardaki interstisyel dendritik hücrelerden kaynaklandığı bildirilen histiyositik sarkomdur.24 Bununla birlikte, bu köken hücreyi destekleyen verilerin çoğu yayınlanmamıştır23 ve sinovyal histiyositik sarkomlarla ilgili geniş çalışmalar yapılmamıştır. Bu makalenin yazarı, bazı sinovyal histiyositik sarkomların A tipi sinoviyositlerden kaynaklandığını varsaymaktadır, ancak bu hipotezi destekleyen veriler eksiktir. İkinci en yaygın eklem içi tümör, daha önce sinovyal miksoma olarak adlandırılan sinovyal miksosarkomdur.7 Sinovyal miksosarkom muhtemelen B tipi sinoviyositlerden kaynaklanır, ancak bunu doğrulayacak B tipi sinoviyositler için spesifik markörler yoktur. Bu iki tümörün her ikisi de kemik erimesine neden olabilir ve bu da radyografik olarak ayırt edilmelerini zorlaştırır. Farklı davranışlara sahip olduklarından, histopatoloji ve bazen immünohistokimya tanı koymak ve böylece prognozu belirlemek için gereklidir. |
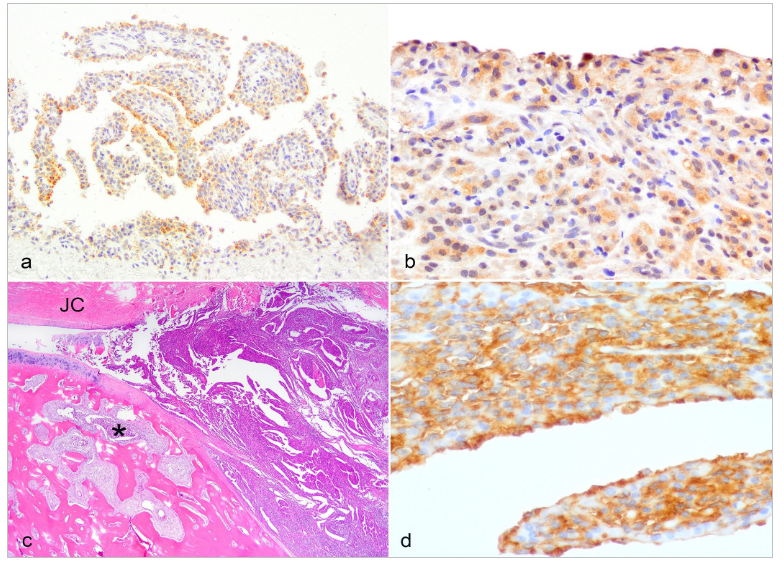
Sinovyal Histiyositik SarkomTümör Kaynağı HücreEklem içi histiyositik sarkomun ortaya çıkabileceği 2 tip histiyosit vardır: sinovyal membran içindeki A tipi sinoviyositler ve alttaki (sinovyal alt tabaka) dokudaki perivasküler histiyositler (interstisyel dendritik hücreler). Bu hücre tiplerinin her ikisi de CD18 ve Iba-1 antikorları ile immünoreaktiftir, ancak yalnızca Langerhans hücreleri ve daha az sıklıkla makrofajlar E-cadherin eksprese eder.24 İntraepidermal Langerhans dendritik hücrelerinde E-cadherin, keratinositler tarafından eksprese edilen E-cadherin’e bağlanır. Karşılaştırma için, Langerhans hücrelerinden kaynaklandığı bilinen diğer tümörler kedilerde pulmoner Langerhans hücreli histiyositoz, köpeklerde kutanöz Langerhans hücreli histiyositoz ve köpeklerde benign kutanöz histiyositomlardır.24 Benign kutanöz histiyositomlar intraepidermal veya dermal Langerhans dendritik hücrelerinden kaynaklanır ve hem membranöz hem de intrasitoplazmik paternde E-cadherin eksprese eder.27,31 Histiyositomlar E-cadherini homojen olarak eksprese etmezler ve bazıları hiç eksprese etmez.24 Sinovyal olmayan lokasyonlardaki çoğu histiyositik sarkom interstisyel dendritik hücrelerden kaynaklanır ve bu nedenle E-cadherini eksprese etmezler.24 Normal köpek sinovyal astarında (incelenen 2 köpekten 2’si), E-cadherin antikorları ile reaksiyon gösteren hücreler (muhtemelen A tipi sinoviyositler; Şekil 1a) ve göstermeyen hücreler (muhtemelen B tipi sinoviyositler) vardır. E-cadherin pozitif hücreler, elektron mikroskobu çalışmalarında A tipi sinoviyositlerin bulunduğu yer olan sinovyal membranın yüzeyi boyunca yer almaktadır.15 Herhangi bir çalışma yapılmamış olmasına rağmen, bazı (yazarın kişisel deneyiminde 2’de 2) sinovyal histiyositik sarkomlar E-cadherin için immünoreaktiftir (Şekil 1b), bu da bunların çevre dokulardaki interstisyel dendritik hücrelerden ziyade A tipi sinoviyositlerden kaynaklanabileceğini düşündürmektedir. Normal sinoviyositler ve sinovyal histiyositik sarkomlardaki etiketleme beklendiği gibi membranöz değil sitoplazmiktir, ancak Langerhans hücresi kökenli histiyositomlar E-kaderin için membranöz veya sitoplazmik etiketlemeye sahip olabilir.27,31 E-cadherin soylara özgü bir belirteç olmamasına rağmen, sinovyumdaki pozitif hücrelerin A tipi sinoviyositlerden (Langerhans hücreleri veya makrofajlar gibi) başka bir şey olması olası değildir. Ne yazık ki, histiyositlerin alt kümelerini ayırt etmek için gerekli olan belirteçlerin çoğu, retrospektif çalışmalar için nadiren mevcut olan dondurulmuş dokular25 gerektirir. Daha fazla sayıda sinovyal histiyositik sarkomun köken hücre(ler)ini ve köken hücrenin prognozu etkileyip etkilemediğini belirlemek için CD1a, E-cadherin ve CD204 ekspresyonu açısından test edilmesi gerekir. Bazı yazarlar sinovyal histiyositik sarkomları “periartiküler” olarak adlandırmaktadır17,20,41 ancak bu makalenin yazarının görüşüne göre, eklem içinde ortaya çıktıkları, sıklıkla çevre yumuşak dokulara ve bazen de kemiklere yayıldıkları için artiküler veya sinovyal histiyositik sarkomlar olarak adlandırılmalıdırlar. Bazıları kemik lizisine neden olmadan önce yumuşak doku kitleleri olarak tespit edilebilse de,41 bu durum eklem içinde ortaya çıktıklarını geçersiz kılmaz. Bazıları gros ve mikroskobik olarak sadece fibröz eklem kapsülünün6 içindedir ve sinovyal membranla bitişiktir (Şekil 1c); hem histiyositik sarkom hem de sinovyal astar CD18-pozitif hücreler içerir (Şekil 1d). Diğerleri sinovyal membranın altındadır.23 Histiyositik sarkomların, kranial çapraz bağ rüptürü (onarılmış veya onarılmamış), patellar lüksasyon, dirsek displazisi, travma, enfeksiyöz artrit ve otoimmün poliartrit dahil olmak üzere daha önce yaralanmış eklemlerde ortaya çıkma olasılığı daha yüksektir.21 Muhtemelen, ortaya çıkan eklem iltihabı kronik aktivasyonu ve bazı köpeklerde, yerleşik dendritik hücrelerin nihai malign dönüşümünü uyarır.6 Tüm bu predispozan koşullar, eklem kapsülü dışındaki dokuların iltihaplanmasından ziyade sinovyal iltihaplanma ile sonuçlandığından, ortaya çıkan neoplazmın periartiküler değil intraartiküler olması beklenir. Tüm sinovyal histiyositik sarkomların öncesinde yaralanma görülmez. Irk YatkınlığıHistiyositik sarkomlar dikkat çekici ırk yatkınlıklarına işaret etmektedir. Bernese dağ köpekleri %25’lik yaşam boyu risk ile en yatkın ırktır,1 ancak retrieverlar (düz tüylü ve golden), Rottweilerlar, minyatür Schnauzerlar ve Pembroke Welsh corgilerin hepsinde histiyositik sarkom gelişme olasılığı diğer ırklara göre daha yüksektir.17,25,30 Sadece büyük ırklar sinovyal forma yatkındır.16 Özellikle Rottweiler cinsi köpeklerde daha önce eklem hastalığı görülme olasılığı daha yüksektir.21 Bernese dağ köpekleri ve flat-coated retriever cinsi köpekleri histiyositik sarkom ile karşılaştıran Hedan ve arkadaşları12 hasta köpeklerde tümöre özgü (ırklar arasında paylaşılan) çok sayıda DNA sapmasının yanı sıra bazı ırklara özgü sapmalar da bulmuştur. Sadece flat-coated retrieverlarda bulunan DNA sapmaları, bu köpeklerin neden histiyositik sarkomun sinovyal formuna daha yatkın olduğunu açıklayabilir.12 DNA sapmalarının bazıları apoptoz ve tümör supresyonu ile ilişkili genlerdedir, ancak histiyositik sarkoma yatkınlık yaratan tek bir gen tanımlanmamıştır.12 Bernese dağ köpekleriyle sınırlı çalışmalar, daha önce eklem hastalığı olanların olmayanlara göre 2,5 kat33 ila 5,4 kat41 daha fazla histiyositik sarkom geliştirme olasılığı olduğunu ortaya koymuştur. İlginç bir şekilde, 6 aydan uzun süre reçeteli anti-enflamatuar ilaçlarla tedavi edilen Bernese dağ köpeklerinde histiyositik sarkom gelişme olasılığı daha düşüktür,33 bu da sinovyal enflamasyonun malign dönüşüme katkıda bulunduğuna dair daha fazla kanıt sağlamaktadır. TeşhisKraniyal çapraz yırtılma gibi eklemde önceden meydana gelen yaralanmalar bu tümöre yatkınlık oluşturduğundan,17,21 hasta köpeklerde genellikle neoplazmın klinik olarak tespit edilmesini geciktirebilecek önceden var olan bir topallık söz konusudur. Radyografik olarak, kemiğin yerini alan neoplastik hücrelerin neden olduğu kemik lizisinin yanı sıra, bazıları önceden var olan dejeneratif eklem hastalığıyla ilişkili olabilecek kemik proliferasyonları da görülebilir (Şekil 2a). 36 Sinovyal histiyositik sarkomlar, etkilenen eklemlerin içini kaplayan ve dolduran pembemsi birleşen nodüllerden oluşur (Şekil 2b).6 Neoplastik nodüller ayrıca kemikleri istila eder ve değiştirir, eklemi çevreler (Şekil 2a) ve kas ve diğer yumuşak dokulara sızar.6 Sinovyal histiyositik sarkomların mikroskobik görünümü diğer bölgelerdeki histiyositik sarkomlara benzer. Hücreler eozinofilik sitoplazmalı, yuvarlaktan poligonale ve iğ şeklindedir. Hücre kenarları değişken şekilde belirgindir ve sitoplazmik vakuoller bulunabilir.8 Çekirdekler düzensiz ovalden minimal anizokaryoza ve belirgin pleomorfik yapıya kadar değişir. Birçok histiyositik sarkomda lenfositler, nötrofiller ve eozinofilleri içerebilen multifokal ila diffüz inflamatuar hücre infiltratları bulunur (Şekil 2c). CD18, Iba-1 veya CD204 için immünohistokimya, neoplastik hücrelerin histiyositik kökenini doğrulamak için kullanılabilir. CD18 bir panlökosit belirteci olmasına rağmen, CD18-pozitif olan tipik histiyositik morfolojiye (bol sitoplazma) sahip neoplastik hücreler histiyositik olarak tanımlanabilir. CD18 işaretlemesi sitoplazmik veya membranöz olabilir. Iba-1 tüm histiyositik hücrelerde (hem dendritik antijen sunan hücreler hem de makrofajlar dahil) ve mikroglial hücrelerde eksprese edilir. CD204 bir çöpçü reseptörüdür ve histiyositik kökeni doğrulamak için bir başka yararlı belirteçtir; tüm makrofajlar ve interstisyel dendritik hücreler tarafından olmasa da bazıları tarafından eksprese edilir, ancak Langerhans dendritik hücreleri tarafından eksprese edilmez.23 |
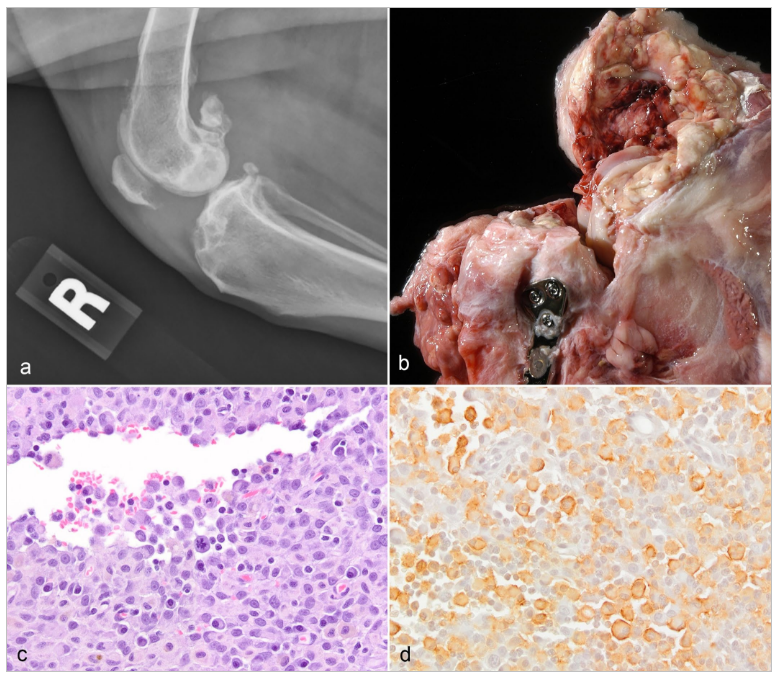
Bir histiyositik sarkomdaki neoplazik hücrelerin hepsi bu belirteçlerle işaretlenmeyecektir (Şekil 2d), ancak işaretlenen hücrelerde malignite özelliklerinin bulunması neoplazmın histiyositik olduğunu doğrular. Bu düzensiz immünolabeling paterninin patogenezi bilinmemektedir, ancak eklem içi bir neoplazmın varlığı (yer kaplayan ve malignite özellikleri olan) histiyositik sarkomu antijen sunan hücrelerin nonneoplastik infiltrasyonundan ayırmaya yardımcı olur. PrognozEklemlerde ortaya çıkan histiyositik sarkomlu köpekler, başka yerlerde ortaya çıkan histiyositik sarkomlu köpeklere göre daha iyi bir prognoza sahiptir (sinovyal histiyositik sarkomlar için 391 gün ve sinovyal olmayan histiyositik sarkomlar için 128 gün genel ortalama sağkalım süresi).16 Başka hiçbir prognostik faktör (mitotik sayı veya immünohistokimyasal etiketleme paterni gibi) bildirilmemiştir. Sinovyal MiksosarkomTümör Kaynağı HücreTip B sinoviyositler, sinovyal sıvı üreten mezenkimal hücrelerdir.44 sinovyal miksosarkomlar, eklemlerde ortaya çıkan ve gros olarak bol miktarda viskoz sıvı içeren mezenkimal tümörlerdir; mikroskopik olarak, bol miktarda soluk bazofilik hücre dışı matriks içeren seyrek hücresel nodüllerden oluşurlar.7 |
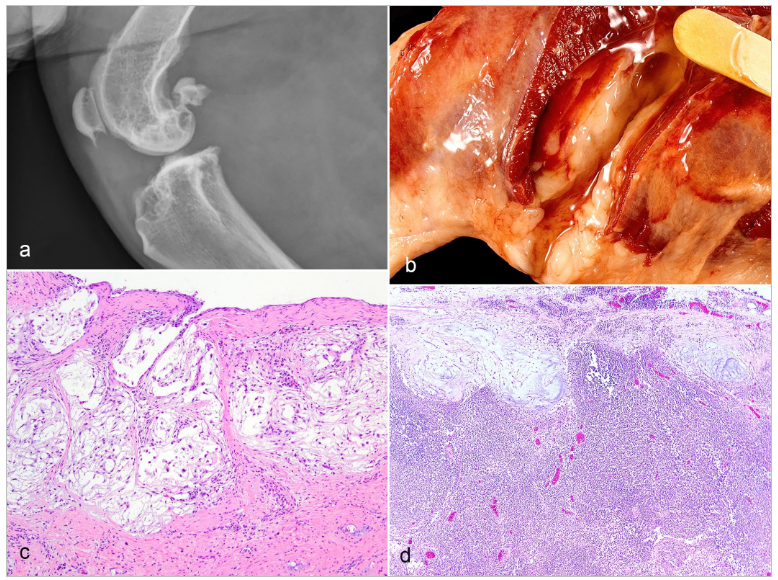
Bu nedenle, bu tümörlerin B tipi sinoviyositlerden kaynaklandığını varsaymak mantıklıdır. Neoplastik hücreler minimal atipiye ve sadece nadir mitotik figürlere sahiptir. Bu tümörün orijinal raporlarında “sinovyal miksoma”7,29 terimi kullanılmıştır çünkü yavaş büyürler ve daha önce metastaz yaptıkları bilinmemektedir. Ancak, nadiren bölgesel lenf düğümlerine metastaz yaparlar (Brian Murphy, şahsi irtibat ve yazarın kişisel gözlemi) ve kemiğe ve fasiyal düzlemler boyunca, bazen amputasyon sınırına kadar invaze olurlar9 , bu nedenle daha uygun bir terim “sinovyal miksosarkom” olacaktır. Metastaz yapmış olan sinovyal miksomatöz tümörler histolojik olarak metastaz yapmamış olanlara benzediğinden, mitotik figürler veya malignitenin diğer histolojik özellikleri daha fazla olmadığından, bu yazarın görüşüne göre, hepsine miksosarkom tanısı konulmalıdır. Irk Yatkınlığı Sinovyal miksosarkomlar için ırk yatkınlığı, sinovyal histiyositik sarkomlarda olduğu kadar belirgin değildir. Çok kurumlu bir incelemede 39 vaka arasında 11 Doberman pinschers, 10 Labrador retriever, 4 Basset hounds, 3 Rottweiler, 2 Shetland sheepdog, 6 melez köpek ve 1’er miniature poodle, labradoodle ve beagle yer almıştır.7 Ancak bu yayından sonra Tennessee Üniversitesi’nde teşhis edilen 9 vaka arasında hiç Doberman pinscher, 2 Labrador retriever, 2 melez köpek ve 1’er Basset hound, Shetland sheepdog, Norwegian elkhound, border collie ve golden retriever bulunmamaktadır. Tanı konulduğunda ortalama yaş 8,5’tir (aralık = 2-14).7 2010 yılındaki yayın7 ve o tarihten bu yana görülen 9 vaka birleştirildiğinde, en sık etkilenen eklemin boğum olduğu (%40), bunu tarsus (%23), parmak (%21), dirsek (%6), karpus (%6), kalça (%2) ve omurların (%2) izlediği görülmektedir. TeşhisRadyografik olarak, sinovyal miksosarkomların sinovyal histiyositik sarkomlardan ayırt edilmesi zordur çünkü her ikisi de kemik lizisine neden olabilir (Şekil 3a).6,9 Sinovyal miksosarkomlar, sinovyal sıvıya benzeyen berrak viskoz sıvı cepleri içerebilir (Şekil 3b) ve hastalanan eklem genellikle aşırı miktarda benzer sıvı içerir.7 Sitolojik olarak, bu sıvı sinovyal sıvıya benzer: pembe matriksli seyrek hücresel.8 Histolojik olarak, sinovyal miksosarkomlar ayırt edilebilir şekilde nodüler bir yapıya sahiptir ve her bir nodül bol miktarda berrak ila soluk bazofilik ekstraselüler matriks içinde süspanse olmuş seyrek yıldızsı mezenkimal hücrelerden oluşur (Şekil 3c).7 Neoplastik hücreler malignite özelliği göstermeyen küçük hiperkromatik çekirdeklere sahiptir. Tümörün bazı alanları daha az matriks ile daha fazla hücresel olacaktır. Bu tümörün mikroskobik görünümü karakteristik ve tanısaldır. Köken hücrenin B tipi sinoviyositler olduğunu belirlemek için immünohistokimya denenmiş olsa da, bu hücre tipi için spesifik bir belirteç gösterilememiştir.7,15 İmmünohistokimya bu tümörün tanısında gerekli veya yardımcı değildir. TeşhisSinovyal miksosarkomlar yavaş büyüyen tümörlerdir ve topallık ve eklem şişliği gibi klinik bulgular dejeneratif eklem hastalığını taklit edebilir. Tanıdan önce klinik belirtilerin ortalama süresi 6 aydır ve bu süre 1 hafta ile 3 yıl arasında değişmektedir.7 Tam eksizyon için genellikle ampütasyon gerekir, ancak inkomplet eksizyonda bile sağkalım süreleri uzundur (ortalama 2,5 yıl).7 Neoplastik hücrelerin miksomatöz nodülleri fasiyal düzlemler boyunca infiltre olur ve kemiğe invaze olarak lizise neden olabilir.7 Nadiren bölgesel lenf düğümlerine metastaz meydana gelir (Brian Murphy, şahsi irtibat ve yazarın kişisel deneyimi). Dr. Murphy ve bu makalenin yazarı tarafından görülen 9 vakada, metastatik nodüller primer tümöre benzemektedir ve genellikle lenf düğümlerinin periferindedir (Şekil 3d), bu da afferent lenfatik damarlar yoluyla geldiklerini düşündürmektedir. Sarkomların çoğu lenfatik damarlardan ziyade kan damarları yoluyla metastaz yapsa da,10,11 köpeklerde deri altı miksosarkomların lenf düğümlerine metastaz yapma olasılığı diğer sarkom türlerine göre daha yüksektir.14 Bu tümörler lokal olarak infiltratif olmasına ve metastaz yapabilmesine rağmen, bildirilen vakaların hiçbiri hastanın ölümü veya ötenazisi ile sonuçlanmadığı için nispeten iyi bir prognoza sahiptir.7 Bölgesel lenf düğümlerinin ötesinde metastazlar bildirilmemiştir. “Sinovyal Hücre Sarkomu”Sinovyal hücre sarkomu tanısı veteriner hekimlikte kullanılmamalıdır. İnsan tıbbında bu terim (veya daha güncel olan “sinovyal sarkom”) vücudun herhangi bir yerinde ortaya çıkabilen ve sinoviyosit kökenli olmayan bir tümörü ifade eder.18,23,34,37,39 Yanlış isimlendirme, neoplastik hücrelerin embriyonik sinovyuma benzerliğinden kaynaklanmıştır. Bu yanlış adlandırılmış sinovyal olmayan neoplazmın sitokeratin ekspresyonuna dayanarak, hayvanlarda sinovyal hücre sarkomlarını tanımlamak için sitokeratin ekspresyonu yanlış bir şekilde önerilmiştir.6 Bu öneriye dayanarak, sitokeratin ekspresyonu hayvanlarda hem eklem içi19,26 hem de eklem dışı20,38 tümörler için yanlışlıkla sinovyal kökenli bir belirteç olarak kullanılmıştır. Sitokeratin, insanlarda sinoviyosit kökenli olmadığı bilinen bir tümörün belirteci olduğundan, veteriner hekimlikte sinovyal neoplazmları teşhis etmek için kullanılmamalıdır. Önerilerden biri “sitokeratin pozitif eklem ilişkili sarkom”22 teriminin kullanılmasıdır, ancak sitokeratin pozitif sarkomlar vücudun herhangi bir yerinde görülebilir5,11 ve 25 subkutan ve 7 periartiküler sarkomun karşılaştırıldığı yakın tarihli bir çalışma, sitokeratinin sarkomlar tarafından ekspresyonunun lokasyona göre farklılık göstermediğini veya prognozu etkilemediğini göstermiştir.9 Bu nedenle, sinovyal veya başka türlü sarkomları sitokeratin ekspresyonu açısından test etmeye gerek yoktur. Eklemlerde Görülebilen Diğer SarkomlarEklemlerdeki diğer mezenkimal hücreler sarkoma yol açabilir. Birkaç örnek arasında fibroblastlar (fibrosarkom), adipositler (liposarkom) ve kondrositler (kondrosarkom) bulunmaktadır.6 Bu tümörlerin tanı, tedavi ve prognozu eklem dışı benzerleriyle aynı olmalıdır. TeşekkürlerBu makalenin yazarı, radyografileri temin ettiği için Dr. Silke Hecht’e, Şekil 3b’yi temin ettiği için Dr. A. James Cooley’e ve Şekil 3d’nin lamını temin ettiği için Dr. Danielle Reel’e sonsuz teşekkürlerini sunmaktadır. Katkıda Bulunan YazarlarLEC makaleyi yazmıştır. Çıkar Çatışması BeyanıYazar(lar) bu makalenin araştırması, yazarlığı ve/veya yayını ile ilgili olarak herhangi bir potansiyel çıkar çatışması beyan etmemişlerdir. FinansmanYazar(lar) bu makalenin araştırması, yazarlığı ve/veya yayını için herhangi bir mali destek almamıştır. ORCID iDLinden E. Craig https://orcid.org/0000-0003-0013-7544 |
| KAYNAKÇA 1. Abadie J, Hédan B, Cadieu E, et al. Epidemiology, pathology, and genetics of histiocytic sarcoma in the Bernese mountain dog breed. J Hered. 2009;100(suppl 1):S19–S27. 2. Agarwal S, Lee D, Kiener H, et al. Coexpression of two mesenchymal cadherins, cadherin 11 and N-cadherin, on murine fibroblast-like synoviocytes. Arthritis Rheum. 2008;58:1044–1054. 3. Alvez CS, Carvalho de Moraes LO, Marques SR, et al. Analysis by Light, Scanning, and Transmission Microscopy of the Intima Synovial of the Temporomandibular Joint of Human Fetuses during the Development. Anat Res Int. 2014;2014:732720. 4. Barland P, Novikoff A, Hammerman D. Electron microscopy of the human synovial membrane. J Cell Biol. 1962;14:207–220. 5. Chijiwa K, Uchida K, Tateyama S. Immunohistochemical evaluation of canine peripheral nerve sheath tumors and other soft tissue sarcomas. Vet Pathol. 2004;41:307–318. 6. Craig LE, Julian M, Ferracone J. The diagnosis and prognosis of synovial tumors in dogs: 35 cases. Vet Pathol. 2002;39:66–73. 7. Craig LE, Krimer PM, Cooley AJ. Canine synovial myxoma: 39 cases. Vet Pathol. 2010;47:931 Linden E. Craig 936. 8. Craig LE, Thompson K. Tumors of joints. In: Meuten D, ed. Tumors in Domestic Animals. 5th ed. Wiley Blackwell; 2017:337–355. 9. Craig LE, Wager A, Bergee R. Springer C: cytokeratin expression by sarcomas does not indicate synovial origin. Paper presented at the American College of Veterinary Pathologist Annual Meeting; October 2023; Chicago, IL. 10. Cullen JM, Breen M. An overview of molecular cancer pathogenesis, prognosis, and diagnosis. In: Meuten DJ, ed. Tumors in Domestic Animals. 5th ed. Wiley-Blackwell; 2017:1–26. 11. Davis JL, Thaler R, Cox L, et al. Constitutive activation of NF-κB inducing kinase (NIK) in the mesenchymal lineage using Osterix (Sp7)- or Fibroblastspecific protein 1 (S100a4)-Cre drives spontaneous soft tissue sarcoma. PLoS ONE. 2021;16:e0254426. 12. Hedan B, Thomas R, Motsinger-Reif A, et al. Molecular cytogenetic characterization of canine histiocytic sarcoma: a spontaneous model for human histiocytic cancer identifies deletion of tumor suppressor genes and highlights influence of genetic background on tumor behavior. BMC Cancer. 2011;11:201. 13. Ikeda N, Nozawa-Inoue K, Takagi R, et al. Development of the synovial membrane in the rat temporomandibular joint as demonstrated by immunocytochemistry for heat shock protein 25. Anat Rec A Discov Mol Cell Evol Biol. 2004;279:623–635. 14. Iwaki Y, Lindley S, Smith A, et al. Canine myxosarcomas, a retrospective analysis of 32 dogs (2003-2018). BMC Vet Res. 2019;15:217. 15. Iwanaga T, Shikichi M, Kitamura H, et al. Morphology and functional roles of synoviocytes in the joint. Arch Histol Cytol. 2000;63:17–31. 16. Klahn SL, Kitchell BE, Dervisis NG. Evaluation and comparison of outcomes in dogs with periarticular and nonperiarticular histiocytic sarcoma. J Am Vet Med Assoc. 2011;239:90–96. 17. Lenz JA, Furrow E, Craig LE, et al. Histiocytic sarcoma in 14 miniature schnauzers—a new breed predisposition? J Small Anim Pract. 2017;58:461–467. 18. Llombart-Bosch A, Lopez-Guerrero JA, Peydro-Olaya A. Synovial sarcoma (SS): new perspectives supported by modern technology. Arkh Patol. 2002;64:39–47. 19. Loukopoulos P, Heng HG, Arshad H. Canine biphasic synovial sarcoma: case report and immunohistochemical characterization. J Vet Sci. 2004;5:173–180. 20. Lovell S, Burchell RK, Roady PJ, et al. Canine intrathoracic sarcoma with ultrastructural characteristics of human synovial sarcoma—case report. BMC Vet Res. 2017;13:247. 21. Manor EK, Craig LE, Sun X, et al. Prior joint disease is associated with increased risk of periarticular histiocytic sarcoma in dogs. Vet Comp Oncol. 2018;16:E83–E88. 22. Monti P, Barnes D, Adrian AM, et al. Synovial cell sarcoma in a dog: a misnomer—cytologic and histologic findings and review of the literature. Vet Clin Pathol. 2018;47:181–185. 23. Moore PF. A review of histiocytic diseases of dogs and cats. Vet Pathol. 2014;51:167–184. 24. Moore PF. Histiocytic Diseases. Vet Clin North Am Small Anim Pract. 2023;53:121–140. 25. Mullin C, Clifford CA. Histiocytic Sarcoma and Hemangiosarcoma Update. Vet Clin North Am Small Anim Pract. 2019;49:855–879. 26. Oyamada T, Otsuka H, Kohiruimaki M, et al. Well-differentiated biphasic synovial sarcoma in the atlanto-occipital joint of a Holstein cow. Vet Pathol. 2004;41:687–691. 27. Paździor-Czapula K, Rotkiewicz T, Otrocka-Domagała I, et al. Morphology and immunophenotype of canine cutaneous histiocytic tumours with particular emphasis on diagnostic application. Vet Res Commun. 2015;39:7–17. 28. Pierezan F, Mansell J, Ambrus A, et al. Immunohistochemical expression of ionized calcium binding adapter molecule 1 in cutaneous histiocytic proliferative, neoplastic and inflammatory disorders of dogs and cats. J Comp Pathol. 2014;151:347–351. 29. Pool R, Thompson K. Tumors of joints. In:Meuten D, ed. Tumors in Domestic Animals. 4th ed. Iowa State Press; 2002:199–243. 30. Purzycka K, Peters LM, Elliott J, et al. Histiocytic sarcoma in miniature schnauzers: 30 cases. J Small Anim Pract. 2020;61:338–345. 31. Ramos-Vara JA, Miller MA. Immunohistochemical expression of E-cadherin does not distinguish canine cutaneous histiocytoma from other canine round cell tumors. Vet Pathol. 2011;48:758–763. 32. Ross M, Wojciech P. Bone. In: Histology: A Text and Atlas with Correlated Cell and Molecular Biology. 5th ed. Lippincott; 2006:205. 33. Ruple A, Morley PS. Risk factors associated with development of histiocytic sarcoma in Bernese mountain dogs. J Vet Intern Med. 2016;30:1197–1203. 34. Sacchetti F, Alsina AC, Muratori F, et al. Tumor size and surgical margins are important prognostic factors of synovial sarcoma—a retrospective study. J Orthop. 2023;42:74–79. 35. Samuelson D. Cartilage and bone. In: Textbook of Veterinary Histology. Saunders-Elsevier; 2007:128. 36. Schultz RM, Puchalski SM, Kent M, et al. Skeletal lesions of histiocytic sarcoma in nineteen dogs. Vet Radiol Ultrasound. 2007;48:539–543. 37. Smith ME, Fisher C, Wilkinson LS, et al. Synovial sarcoma lack synovial differentiation. Histopathology. 1995;26:279–281. 38. Takimoto N, Suzuki K, Ogawa T, et al. A non-joint tissue biphasic synovial sarcoma in a dog. J Comp Pathol. 2014;150:204–207. 39. Thway K, Fisher C. Synovial sarcoma: defining features and diagnostic evolution. Ann Diagn Pathol. 2014;18:369–380. 40. Valencia X, Higgins J, Kiener H, et al. Cadherin-11 provides specific cellular adhesion between fibroblast-like synoviocytes. J Exp Med. 2004;200:1673–1679. 41. van Kuijk L, van Ginkel K, de Vos JP, et al. Peri-articular histiocytic sarcoma and previous joint disease in Bernese Mountain Dogs. J Vet Intern Med. 2013;27:293–299. 42. Van Lommel A. Skeleton. In: From Cells to Organs: A Histology Textbook and Atlas. Kluwer; 2003:142. 43. Vasanjee S, Paulsen D, Hosgood G, et al. Characterization of normal canine anterior cruciate ligament-associated synoviocytes. J Orthop Res. 2008;26:809–815. 44. Young B, O’Dowd G, Woodford P. Wheater’s Functional Histology. 6th ed. Elsevier; 2013:194. |




