| 1Kanser Biyolojisi ve Genetiği Laboratuvarı, Kanser Araştırma Merkezi, Ulusal Kanser Enstitüsü, Bethesda, MD, Amerika Birleşik Devletleri, 2Leidos Biomedical Research, Inc, Frederick Ulusal Kanser Araştırma Laboratuvarı, Frederick, MD, Amerika Birleşik Devletleri, 3Klinik Farmakoloji Programı, Kanser Araştırma Merkezi, Ulusal Kanser Enstitüsü, Bethesda, MD, Amerika Birleşik Devletleri, 4Patoloji Laboratuvarı, Kanser Araştırma Merkezi, Ulusal Kanser Enstitüsü, Bethesda, MD, Amerika Birleşik Devletleri, 5Genitoüriner Maligniteler Şubesi, Kanser Araştırma Merkezi, Ulusal Kanser Enstitüsü, Bethesda, MD, Birleşik Devletler |
| ANAHTAR KELİMELER kinaz inhibisyonu, kombinasyon tedavisi, karşılaştırmalı onkoloji, translasyonel araştırma, ilaç-ilaç etkileşimi, melanom, veterinerlik, ilaç güvenliği |
| Ras/MAPK ve PI3K/Akt/mTOR sinyal iletim yolaklarından birinin veya her ikisinin aktivasyonunun, mukozal melanomlar da dahil olmak üzere çeşitli köpek ve insan kanserlerinin onkojenitesine aracılık ettiği bilinmektedir. İki yolak arasındaki karşılıklı çapraz aktivasyon ilaç direnci yaratabilir. Sonuç olarak, plazma farmakokinetik (PK) analizi için oral dozlama ve ikili TORC1/2 inhibitörü olan sapanisertib ve MEK inhibitörü olan trametinib kombinasyonunun tolere edilebilirliği, paralel yolak hedeflemede kullanılma potansiyeli açısından tümör taşımayan laboratuvar köpeklerinde değerlendirilmiştir. Üç eşit gruba ayrılan on iki köpek ya kombinasyon tedavisi ya da tek ajan almıştır. Hayvanlar tek doz ve 17 günlük ardışık dozun ardından PK açısından ve klinik gözlemler, hematoloji, serum biyokimyası, koagülasyon çalışmaları ve idrar analizleri ile izlenmiştir. Emilimini artıran dimetil sülfoksit olarak sülfatlanmış tek bir trametinib dozu (0,025 mg/kg), 1,5 saat (sa) maksimum konsantrasyona (Tmax) kadar geçen ortalama sürede ortalama maksimum konsantrasyona (Cmax) 0,64 ng/mL [%18 varyasyon katsayısı (CV)] ve ortalama konsantrasyon-zaman eğrisi altındaki alana (AUC) 16,8 sa∗ng/mL (%14CV) ulaşmıştır; bu değerler tek başına veya sapanisertib ile birlikte verildiğinde benzerlik göstermiştir. Uzun yarılanma ömrü, insanlara benzer şekilde günlük dozlama ile trametinibin 3-4 kat plazma birikimini sağlamıştır. Trametinib PK, köpeklerdeki önceki yasal verileri yansıtırken, maruziyet yayınlanmış bazı insan değerlerine yaklaşmış, ancak tüm hastalar için geçerli olmamıştır. Köpek plazmasında tek başına sapanisertib Tmax 2.0 saat ve ortalama EAA 248 saat∗ng/mL (%41CV)], tek bir 0.1 mg/kg dozunu takiben [ortalama Cmax 26.3 ng/mL (%21CV), ortalama insan terapötik denemelerindeki seviyelere benzerken; köpek sapanisertib maruziyeti, bilinen bir sitokrom P450 CYP3A4 indükleyicisi olan trametinib ile kombine edildiğinde azalmıştır. Her iki ilaç için de cinsiyet farklılıkları saptanmamıştır. İlaçlardan biri veya her ikisi ile tekrar dozlama yapıldığında yan etkiler arasında kilo kaybı, sindirim bozukluğu ve deride renk değişikliği sayılabilir. Klinik laboratuvar analizleri ilaca bağlı akut faz enflamasyonu, proteinüri ve kan retikülositlerinde azalma gibi müdahale gerektirmeyen hafif değişiklikler ortaya koymasına rağmen kombine tedavi doz sınırlayıcı toksisite olmaksızın tolere edilmiştir. Bu kombinasyonla köpeklerde elde edilen kısa süreli sonuçlar, köpek ve muhtemelen insan melanomunun yanı sıra bir veya her iki sinyal iletim yolağı aktivasyonuna sahip diğer kanserleri hedeflemek amacıyla klinik çalışma yapılması için translasyonel umut vaat etmektedir. |
| AÇIK ERİŞİM EDİTLEYEN DEĞERLENDİREN Lilia Gutierrez, Universidad Nacional Autónoma de México, Meksika *İLGİLİ YAZAR UZMANLIK BÖLÜMÜ SUNUM: 28 Eylül 2022 Makaleye atıfta bulunmak için TELİF HAKKI © 2022 Wei, Peer, Richardson, Hewitt, Figg ve Simpson. Bu makale Creative Commons Attribution License (CC BY) koşulları altında dağıtılan açık erişimli bir makaledir. Orijinal yazar(lar)a ve telif hakkı sahip(ler)ine atıfta bulunulması ve bu dergideki orijinal yayına atıfta bulunulması koşuluyla, kabul edilmiş akademik uygulamalara uygun olarak diğer forumlarda kullanımına, dağıtımına veya çoğaltılmasına izin verilir. Bu şartlara uymayan hiçbir kullanım, dağıtım veya çoğaltmaya izin verilmez.
Bu makalenin orijinaline şu adresten ulaşılabilir: 10.3389/fvets.2022.1056408 |
GirişHedefe yönelik küçük moleküllü inhibitör ilaçlar, insan kanser hastalarına benzer şekilde kendiliğinden oluşan doğal kanserli köpekleri tedavi etmek için klasik sitotoksik kemoterapötiklere alternatif ve yardımcı olarak giderek daha fazla kullanılmaktadır (1-3). Kanserleri daha spesifik bir şekilde hedefleyerek, hasta yanıtı ve güvenlik profilleri optimize edilebilir. Ayrıca, daha geniş spektrumlu kemoterapinin bazı zararlı sonuçlarından kaçınılabilir (4). İnsanlarda ve veteriner hastalarda kanser tedavisi için çeşitli küçük moleküllü ilaçlar onaylanmıştır (örneğin, köpek terapötikleri: toceranib phosphate ve tigilanol tiglate) ve bunlar stabilite, maliyet, hasta uyumu ve farmakokinetik (PK) özellikler açısından belirli avantajlara sahiptir (4, 5). Günümüzdeki küçük moleküllü onkoloji ilaç hedefleri arasında protein kinazlar, DNA hasar onarım enzimleri, proteozomlar ve epigenetik modifikasyonları düzenleyen diğer proteinler yer almaktadır. Ancak bu tür küçük moleküllü inhibitörler sınırsız değildir. Tüm hastalar bu tedavilere yanıt vermemekte ve hastalar ilk yanıttan sonra ilaç direnci kazanabilmektedir (6). En uygun yanıtları elde etmek için çeşitli etki mekanizmaları arasından tedavi seçimine rehberlik etmek üzere kanser hücrelerinin ve doku mikroçevresinin özelliklerine dayalı yeni tedavi stratejileri geliştirilmelidir. Kritik sinyal yolaklarının onkojenik düzensizliği, hücre büyümesini, farklılaşmasını, metabolizmasını, çoğalmasını, hayatta kalmasını ve hareketliliğini değiştiren anormal protein etkileşim zincirlerine yol açabilir. Kanserdeki kontrolsüz sinyal iletim olayları büyüme faktörleri, sitokinler, hücre-hücre etkileşimleri ve hücre-matriks etkileşiminin yanı sıra gen mutasyonel olayları ile de tetiklenebilir (1). Çeşitli kanserlerde düzensiz hale gelebilen iki temel sinyal iletim yolağı RAS/MAPK (mitojen aktive protein kinaz) ve fosfoinositid 3- kinaz (PI3K)/Akt (protein kinaz B)/mTOR’dur (rapamisinin memeli hedefi). MAPK hiperaktivitesi insan kanserlerinin %85 kadarında görülen bir özelliktir (7), PI3K-Akt yolağı da birçok insan kanserinde sıklıkla anormal şekilde aktive olmaktadır (8). Osteosarkom, mast hücreli tümör, ürotelyal mesane kanseri ve melanom gibi köpek kanserlerinde de bu yolaklar boyunca yüksek hücre sinyali gözlenmiştir (1, 9, 10). Köpek mukozal melanomunda bu sinyal yolaklarından biri veya her ikisi boyunca birden fazla aracının aşırı aktivasyonu tespit edilmiştir; bu özellik insanlardaki bu nadir melanom alt tipiyle benzerlik göstermektedir (11, 12). Ayrıca, Ras/MAPK ve PI3K/Akt/mTOR yolakları arasında sinyal kaskadı çapraz etkileşimi meydana gelir ve hedefe yönelik monoterapi yaklaşımlarında ilaç direncinin bir mekanizması olarak işlev görebilir (6, 13, 14). Bu nedenle, RAS/MAPK ve PI3K/Akt/mTOR’un birlikte hedeflenmesi hem köpek hem de insan mukozal melanomları için faydalı olabilir (12, 13, 15). Köpek spontan mukozal melanomu insan mukozal melanomundan nispeten daha sık görüldüğünden, köpek hastalarda yürütülen karşılaştırmalı onkoloji araştırmaları translasyonel fayda potansiyeline sahiptir (11, 16). Köpek mukozal melanom hücre hatları ve preklinik ksenograft modelleri kullanılarak Ras/MAPK ve PI3K/Akt/mTOR sinyal iletim yolaklarına odaklanan bir ilaç taraması sürecinde, küçük moleküllü kinaz inhibitörleri sapanisertib ve trametinib kombinasyon olarak daha ileri seviyede değerlendirilmek üzere seçilmiştir (13). Sapanisertib (PubChem CID 45375953 veya TAK-228), oldukça seçici rekabetçi adenozin trifosfat bağlanması yoluyla hareket eden PI3K/Akt sinyal iletim yolağı içindeki raptor-mTOR (TORC1) ve rictor-mTOR’un (TORC2) (rapamisin kompleksinin memeli hedefi) oral olarak biyoyararlanabilen bir benzoksazol inhibitörüdür (17). Şu anda birden fazla kanser türü için insan onkolojisi klinik çalışmalarına konu olan sapanisertib, köpek melanom hücrelerinde apoptoz ve hücre döngüsü durması ile bağlantılı olarak PI3K downstream mediatörleri S6 ve 4EBP1’i baskılar (13). Trametinib (MEKINIST), aktive edilmiş mitojenle aktive edilen protein/ hücre dışı sinyalle düzenlenen kinaz 1 ve 2’yi (MEK1/2) hedefleyen geri dönüşümlü bir reseptör olmayan tirozin kinaz inhibitörüdür. Trametinib, BRAF (v-raf mürin sarkom viral onkogen homolog B1) V600E veya V600K mutasyonlarını barındıran rezeke edilemeyen veya metastatik melanomlu insan hastaların tedavisi için FDA onaylıdır (18). Trametinib, in vitro ve fare modellerinde köpek melanom hücre hatlarının büyümesini, fosforile edilmiş hücre dışı sinyalle düzenlenen kinazın (ERK) down modülasyonu ile birlikte apoptoz ve hücre döngüsü durması indüksiyonu eşliğinde inhibe eder (13, 19). Trametinibin ERK aktivasyonu ve sitoproliferasyon üzerindeki benzer etkileri, köpek mesane kanseri organoidlerinde ve farelerdeki tümör ksenograftlarında da gözlenmiştir (10). Bu çalışmada, kombine inhibitör tolerabilitesi ve plazma farmakokinetiği, kısa süreli ardışık doz oral uygulama sırasında sağlıklı laboratuvar köpeklerinde tek ajanlara kıyasla incelenmiştir. Bu çalışma, MAPK ve PI3K/Akt hücre sinyal yolaklarından birinin veya her ikisinin yüksek aktiviteleri ile doğal olarak ortaya çıkan köpek kanserlerinin tedavisi ve gelecekte klinik uygulamaya aktarılması için rasyonel bir başlangıç dozu belirlemeye odaklanmıştır. Amaç, mukozal melanomlu köpekler ve nihayetinde insanlar için faydalı tedavi sağlayabilmektir. |
Materyal ve Metod |
Küçük moleküllü inhibitör ilaçlarİlaçlar kapsül formunda tedarik edilmiştir (Wedgewood 36 ila 46◦F ve Pharmacy, Swedesboro, NJ’yi korumak için nem ve ışıktan uzak tutulmuştur). Her iki ilaç da stabilite aralığında saklanmıştır. Daha yüksek sıcaklıklara kısa süreli maruz kalma (<24 saat) kabul edilebilir olarak değerlendirilir. Eczane, bileşimi ve etki gücünü bağımsız üçüncü taraf analizleriyle doğrulamakta ve ölçülen bileşenlerdeki varyans standardını, genel ABD Farmakopesi tarafından önerilen etki marjlarından (+/- %10) daha sınırlı bir aralık olan +/- %5 olarak belirlemiştir. Her iki ilaç da veteriner hekimlikte kullanım için onaylanmamıştır. Bununla birlikte, trametinib in vitro ve fare modellerinde köpek histiyositik sarkomu ve köpek ürotelyal mesane kanserine karşı umut vaat ettiğini göstermiştir (10, 22). Hücresel sinyal iletim yolağı kaskadları içinde inhibitör hedeflemenin grafik çizimleri gösterilmiştir (Ek Şekil S1). |
Trametinib dimetil sülfoksit (trametinib) ve sapanisertib deneyleriTrametinib ve sapanisertib, ven ponksiyonu ile toplanan köpek plazmasında, K2 etilendiamin tetraasetik asit (EDTA) (BioIVT, Hicksville, New York) içeren kan tüplerinde ölçülmüş, santrifüj ile ayrılmış ve Charles River Labs (Mattawan, MI) laboratuvarlarında analiz edilene kadar -80◦C’de dondurulmuş şekilde saklanmıştır. Her bir ilaç analiti 8 köpekten alınan toplam 192 örnekte ölçülmüştür. Benzer polariteye sahip olan ve kromatografi ile etkileşime girmeyen propranolol hidroklorür, her bağımsız test için bir iç standart işlevi görmüştür. |
| Konsantrasyonu bilinen standartların, kalite kontrol numunesinin veya çalışma numunesinin her 50 µL’lik alikotu 200 µL çalışma dahili standart çözeltisi (asetonitril içinde 10 ng/mL) ile karıştırılmıştır. Örnekler vortekslenmiş ve santrifüjlenmiştir. Elde edilen süpernatanttan 150 µL’lik bir alikot temiz bir 96 kuyucuklu plakaya aktarılmış, buharlaştırılmış ve 100 µL su/asetonitril (40/60, v/v) ile sulandırılmıştır. Bir alikot, analiz için 0,3000 mL/dak akış hızında su/formik asit (100/0,1, v/v) ve asetonitril/formik asitten (100/0,1, v/v) oluşan izokratik akışlı 50 x 2,1 mm (2,5 µm partikül boyutu) kolona sahip bir LC-MS/MS XBridge BEH C18 sıvı kromatografi sistemine (Waters Associates, Framingham, MA) enjekte edilmiştir. Analit ve dahili standart, pozitif iyon modunda çalıştırılan bir ESI (TurboIonSpray) iyonizasyon kaynağı ile donatılmış bir API 6500+ üçlü kuadrupol LC-MS/MS sistemi (AB Sciex, LLC, Framingham, MA) kullanılarak tespit edilmiştir. İlgili [M+H]+ iyonlarının kütle spektrometrik Çoklu Reaksiyon İzleme (MRM) geçişleri trametinib (Tablo 2) ve sapanisertib (Tablo 3) izlemek için kullanılmıştır. |
| Sapanisertib ve trametinib standart kalibrasyonu ve kalite kontrol numune çalışmaları için oluşturulan validasyon, analitik yöntemin her analit için 0,1-100 ng/ml aralığında tekrarlanabilir ve doğrusal olduğunu göstermiştir. |
Kompartımansız farmakokinetik analizlerPK analizi için FDA 21CFR Bölüm 11 yönetmeliklerine göre onaylanmış Phoenix WinNonlin v8.3 (Certara Corp, Cary, NC) kullanılarak kompartmansız yöntem kullanılmıştır. Maksimum plazma konsantrasyonu (CMAX) ve maksimum plazma konsantrasyonu zamanı (TMAX) gözlenen değerler olarak kaydedilmiştir. Sıfır zamanından son ölçülebilir numune zamanına (AUClast) kadar olan konsantrasyon-zaman eğrisi (AUC) altındaki alan doğrusal yukarı/log-aşağı trapezoidal yöntem [model tipi Plazma (200-202)] kullanılarak hesaplanmıştır. AUCINF (sıfırdan sonsuza kadar olan AUC), CLAST (son ölçülebilir ilaç konsantrasyonu) terminal fazın hız sabiti olan λZ’ye bölünerek ekstrapolasyon yoluyla hesaplanmıştır. Bu sabit, tahmin prosedürü olarak düzgün ağırlıklı en küçük kareler ve (i) düzeltilmiş r2 > 0,8, (ii) terminal fazda TMAX’tan sonra meydana gelen > 3 zaman noktasını içeren kabul kriterleri kullanılarak konsantrasyon-zaman eğrisinin terminal fazının eğiminden belirlenmiştir. Terminal faz sırasında görünen oral dağılım hacmini (Vz/F) ve mutlak dozun AUCINF’ye bölünmesiyle hesaplanan görünen oral sistemik klerensi (CL/F) içerecek şekilde belirli ilk doz PK parametrelerini tahmin ettik. Ekstrapole edilen AUCINF miktarı >%25’i aşarsa, bu denekler için klerens tahminleri işaretlenmiş ve istatistiksel özetlerden çıkarılmıştır. Bu çalışmada intravenöz dozlama yapılmadığı için biyoyararlanım (F) değerlendirilmediğinden bu, tahmini klerens ve hacmin CL/F ve V/F olarak raporlanması için kabul edilebilir bir standart isimlendirme işlevi görmüştür. Kararlı durum dozlaması için, AUCTAU (kararlı durum dozlama aralığı sırasında) ve kararlı durumdaki görünür oral klerens (CLssF; doz/AUCTAU olarak hesaplanmıştır) kullanılmıştır. Birikim indeksi (AI), ilk dozu takiben kararlı durumdaki AUCTAU’nun AUCLAST’a (o doz aralığı boyunca) bölünmesiyle hesaplanmıştır. |
İstatistiksel analizler ve PK özellikleriLog-normal dağılımlı bu PK verileri için tüm özet istatistikler aritmetik ortalama, medyan, standart sapma, %CV ve geometrik ortalama (GM) şeklinde sunulmuştur. Bir ilaç etkileşiminin kapsamını değerlendirmek amacıyla, seçilen PK parametreleri (CMAX, AUC) için, kombinasyon tedavi grubundaki her bir maruziyet metriğindeki tek ajan gruplarına göre farklılıklardan %90 güven aralığı (CI) ile birlikte bir geometrik ortalama oran (GMR) oluşturulmuştur. Eğer bu %90 güven aralığı varsayılan etkisizlik sınırları olan 0,8-1,25 eşiğini aşarsa, bu durum söz konusu parametrede klinik olarak anlamlı bir değişiklik, yani bir ilaç-ilaç etkileşimi olabileceği şeklinde yorumlanmıştır. Tedavi grupları içinde CMAX ve AUC’nin cinsiyetler arası karşılaştırmaları ve tek ajan ve kombinasyon grupları arasında bir analit için parametrik olmayan iki örnek T-testi (Mann-Whitney, alfa = 0.05;) (GraphPad Prism) kullanılarak yapılmıştır. Benzer testler, tedavi edilen hayvanlarda aktive parsiyel tromboplastin zamanının (APTT) ortalama örnek gün değerlerini her grup için ilaç uygulamasından önceki değerlerle karşılaştırmak için de yapılmıştır (MSExcel;v16.61.1). |
Sonuçlar |
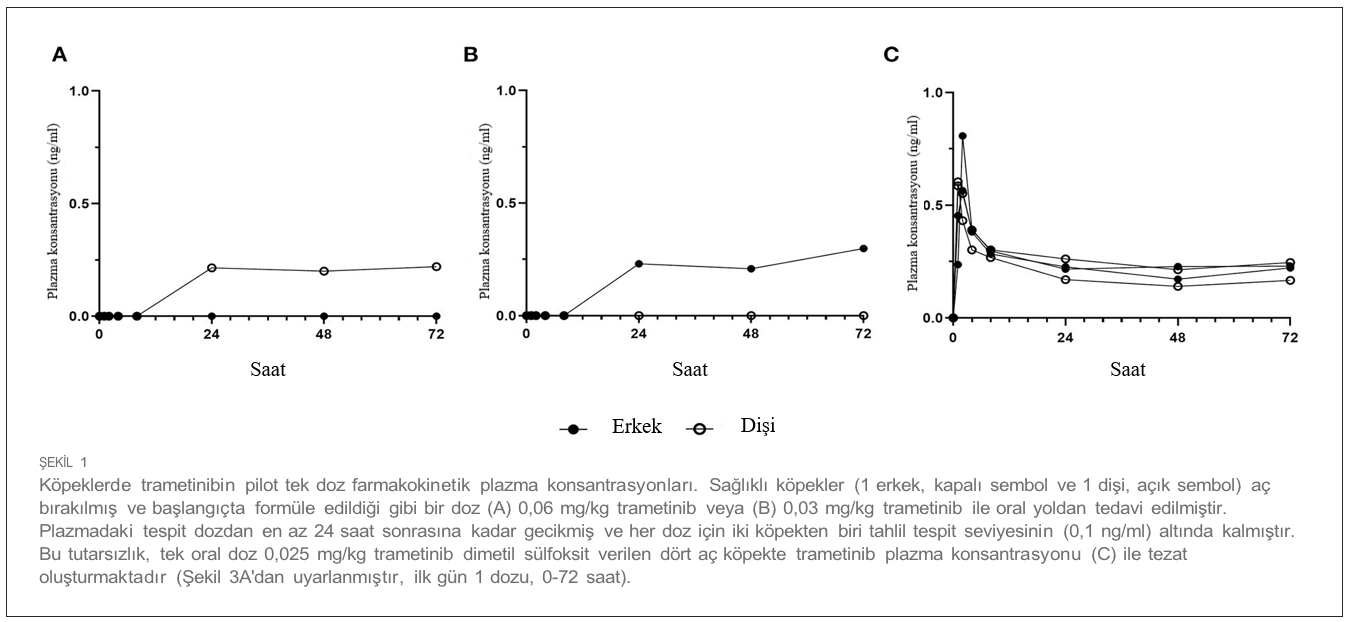
Sapanisertib’in doz yükseltme tolerabilitesiSapanisertib ile ilgili ilk çalışmalar, tümör taşımayan laboratuvar beagle köpeklerinde oral yoldan uygulanan trametinib dimetil sülfoksit (trametinib) ile kombinasyon halinde nihai test için doz seçimine odaklanmıştır. Trametinib dozu, insan ilaç onayı (MEKINIST , Novartis) için hazırlanan köpek klinik dışı yasal bilgilerinden seçilirken, ideal sapanisertib başlangıç dozu ve programı farelerde yapılan önceki çalışmalara (ayrıca bkz. materyaller ve yöntemler) ve iki köpekte tek başına sapanisertib kullanılarak yapılan bir pilot eskalasyon denemesine dayanmaktadır. |
| Sapanisertib doz eskalasyonu, 0,10 mg/kg sapanisertib ile başlayan ve ardından artan bireysel dozlardan oluşmaktaydı (Şekil 2). Köpekler, ≥0,5 mg/kg sapanisertib dozları arasında en az 3 gün ve 7 güne kadar ara verme süresi ile dozlandığında kilo kaybetmiştir. 23. günde, erkek köpek başlangıçtaki vücut ağırlığının yaklaşık %19’unu, dişi köpek ise %7’sini kaybetmiş ve sapanisertib uygulaması sonlandırılmıştır (Şekil 2A). Bu iki köpekte doz sonrası yeterli zamanın geçmesiyle birlikte vücut ağırlığında iyileşme görülmüştür. ≥ 0,5 mg/kg sapanisertib uygulamasını takiben, her iki cinsiyette de kırmızı kan hücresi retikülosit sayılarında orta ila belirgin düşüşler, serum alkalin fosfataz (ALP) [çalışma öncesi değerin 0,36 katı kadar düşük], aspartat aminotransferaz (AST) (0,68 kat kadar düşük) ve alanin aminotransferaz (ALT) (0,41 kat kadar düşük) değerlerinde minimal ila orta düzeyde düşüşler görülmüştür (Şekil 2B). ≥ 0,65 mg/kg uygulamasını takiben, serum kolesterol konsantrasyonlarında her iki cinsiyette de minimal ila hafif artışlar, periferik kan lenfosit sayılarında hafif ila orta dereceli progresif düşüşler (0,33x kadar düşük), kadınlarda nötrofil sayılarında hafif ila orta dereceli düşüşler (0,24x kadar düşük) ve erkeklerde globulin konsantrasyonlarında hafif artışlar (1,33x’e kadar, globulin, gösterilmemiştir) görülmüştür. Erkekte 0,8 mg/kg sapanisertib uygulamasını takiben, bir kusma epizoduyla ilişkili olabilecek sodyum (0,98x) ve klorür (0,89x) serum konsantrasyonlarında da hafif azalma görülmüştür (Şekil 2B). Takip eden kombinasyon tekrar dozu çalışmasını başlatmak için 0,1 mg/kg sapanisertib seçimi bu bulgular ışığında yapılmıştır. |
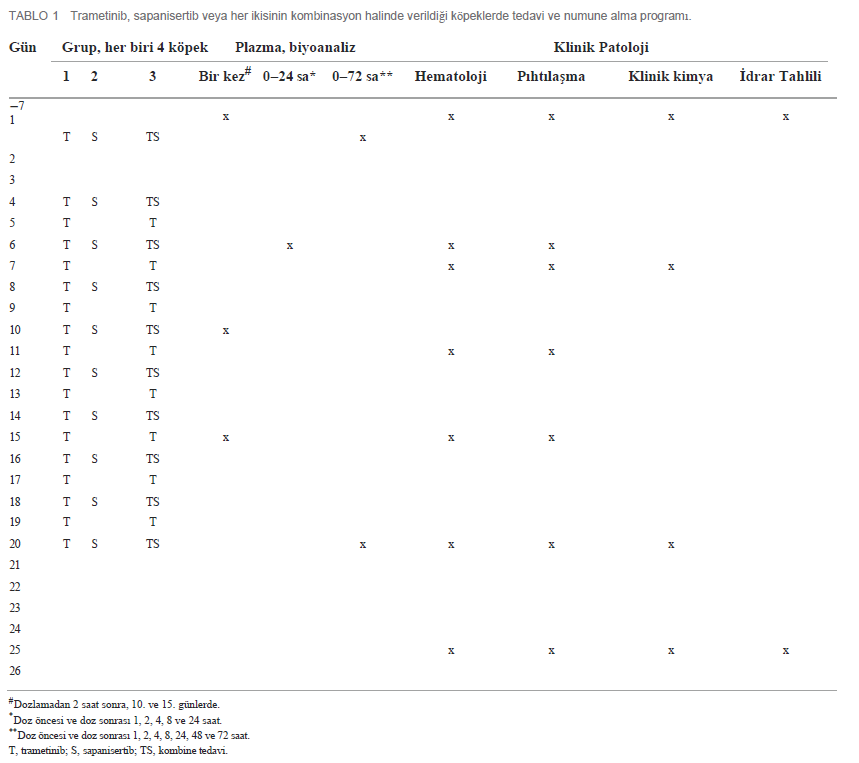
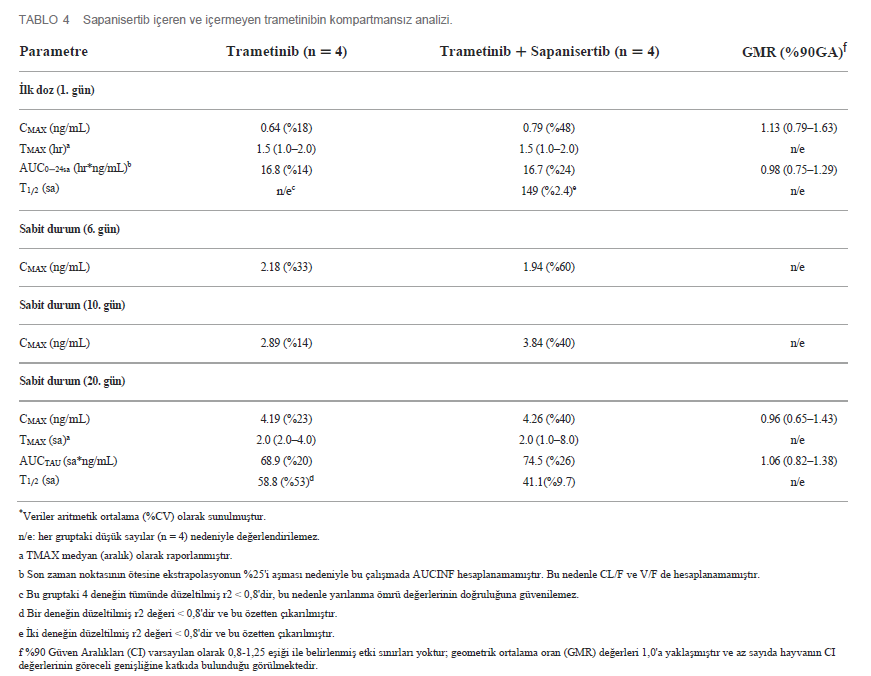
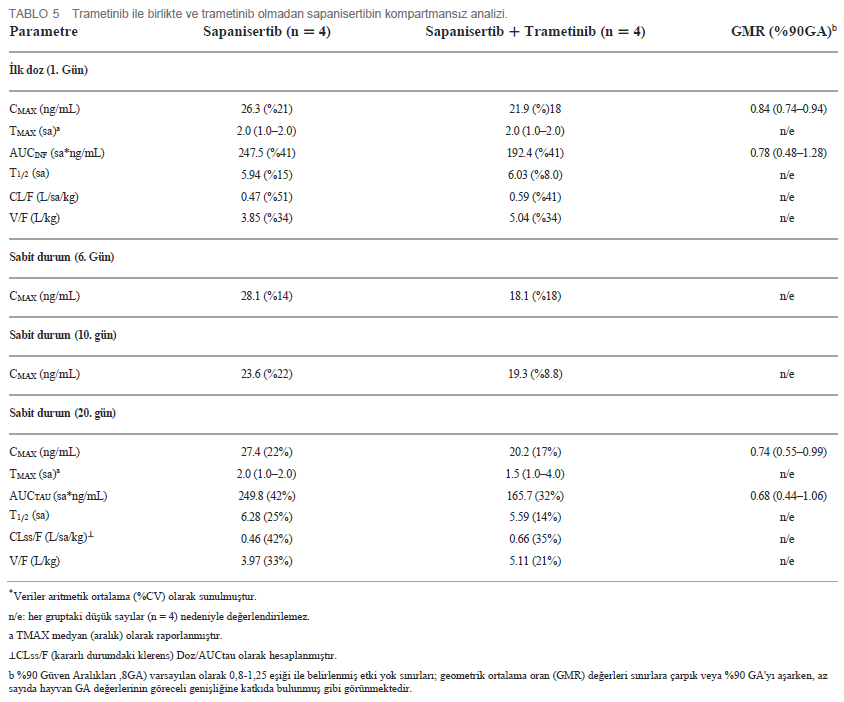
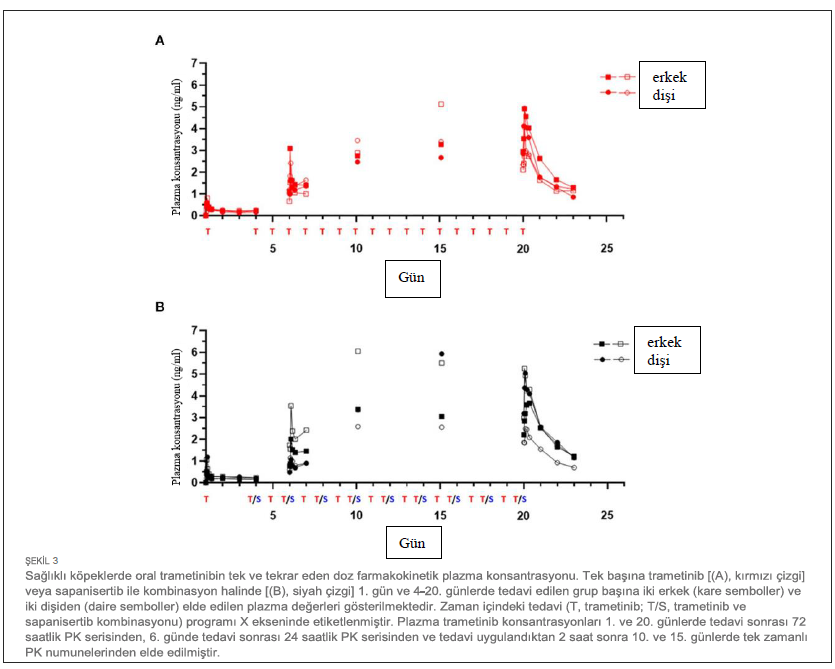
| İlk doz ve Tekrar Eden Doz Çalışmalarında Farmakokinetik Özellikler 4 köpekten oluşan gruplara (2 K, 2 E) ya tek ajan ya da iki ilaçlı kombinasyon uygulanmıştır. Her iki ilacın plazma konsantrasyonu, ilk tek oral dozun (1. Gün) ardından ve 4-20. günlerde tekrarlanan dozlama sırasında zaman içinde ölçülmüştür (Tablo 1). Trametinib günde 0,025 mg/kg (q.d.) dozunda ve sapanisertib gün aşırı 0,1 mg/kg (QOD) dozunda verilmiştir. CMAX, TMAX, AUC ve T1/2 sırasıyla trametinib ve sapanisertib için Tablo 4, 5’te belirtilmiştir. CMAX veya AUC, her iki ilaç için de erkek ve dişi köpekler arasında belirgin bir farklılık göstermemiştir (p > 0.05). İlk dozlamayı takiben TMAX, tek başına veya kombinasyon halinde verilen her bir ilaç karşılaştırıldığında benzerdi (Tablo 4, 5). Trametinibin plazma seviyeleri, hem tek ajan olarak verildiğinde Grup 1 (Şekil 3A) hem de iki ilaç kombinasyonu olan Grup 3 (Şekil 3B) için 1. günden 20. güne kadar biyoakümülasyona dair kanıtlar (3-4 kat artış) ortaya koymuştur. Trametinibin uzun yarılanma ömrü de belirgindi, ancak birçok deneğin tahminleri yetersiz korelasyonlar nedeniyle kullanılamadı (r2 < 0,8) (Tablo 4). Tek başına trametinib ile karşılaştırıldığında sapanisertib ile kombinasyondan elde edilen trametinib ilaç konsantrasyonları üzerindeki potansiyel etkiye ilişkin kritik bir soru, iki tedavi (Grup 1 ve 3) arasında geometrik ortalama orana (GMR) göre hem ilk doz (1. gün) hem de kararlı durum (20. gün) maruziyet ölçümleri (hem CMAX hem de AUC) %90 güven aralığı (CI) ile karşılaştırılarak yanıtlanmıştır. %90 Güven Aralığı trametinib için varsayılan 0,8 – 1,25 etkisizlik eşiğini aşmasına rağmen, GMR genellikle 1,0’a yaklaşmıştır (Tablo 4), bu da sapanisertibin trametinib PK üzerinde sınırlı etkisi olduğunu veya hiç etkisi olmadığını göstermektedir. |
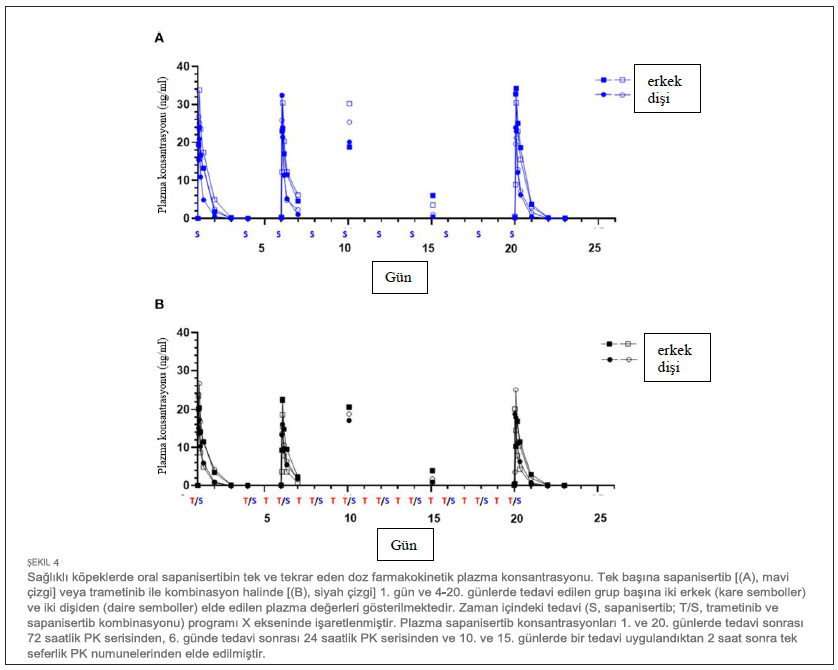
| %90’lık geniş güven aralığı büyük olasılıkla az sayıda numune (n = 4) arasındaki değişkenliği temsil etmektedir. İlk ve tekrar doz sapanisertib hızla emilmiştir (aralık 1-4 saat) (Tablo 5). Trametinibin aksine, sapanisertibin |
| Ayrıca, yukarıda belirtilen trametinib seviyeleri üzerinde belirgin sapanisertib etkileşiminin olmamasının aksine, sapanisertib plazma konsantrasyonu trametinib ile kombine edildiğinde etkilenmiştir. 1. günde, hem sapanisertib CMAX hem de AUC (AUCINF), kombinasyon kolunda (Grup 3) tek başına sapanisertib’e (Grup 2) kıyasla benzer büyüklükte (GMR, CMAX ve AUCINF için sırasıyla 0,84, 0,78) anlamlı olarak daha düşüktü (Tablo 5). Bu bulgu, bu etkinin kararlı durumda aşırı artması ile de desteklenmektedir; 20. günde sapanisertib CMAX ve AUC (AUCTAU) için GMR sırasıyla 0,74 ve 0,68 olmuştur. Yarılanma ömrü ve TMAX zaman içinde ve kollar arasında büyük ölçüde değişmemiştir (Tablo 5). |
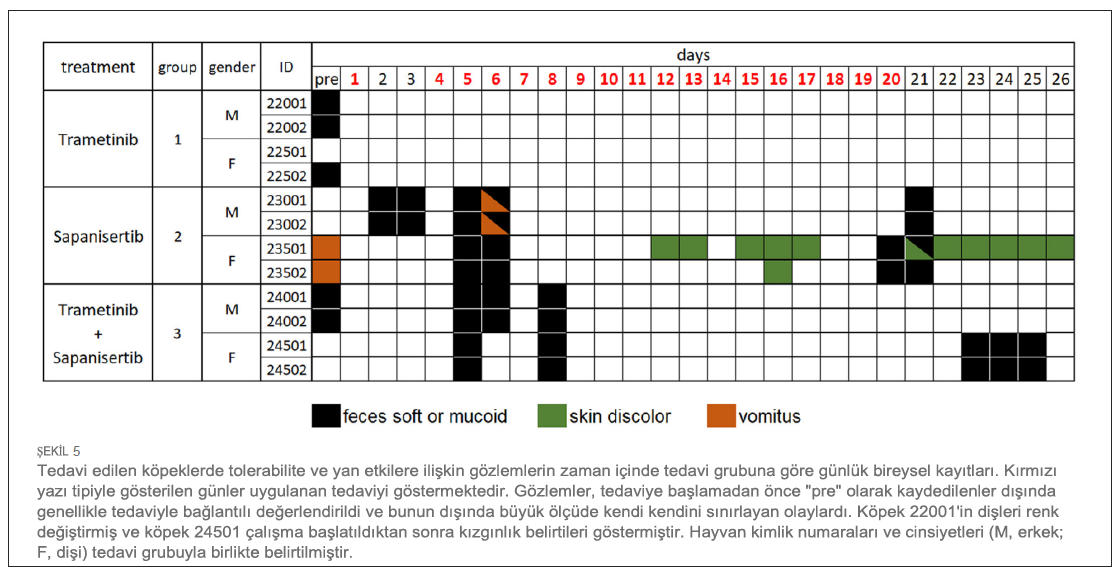
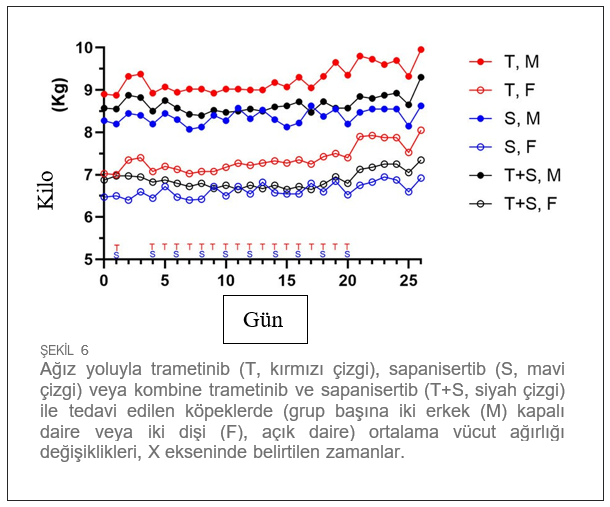
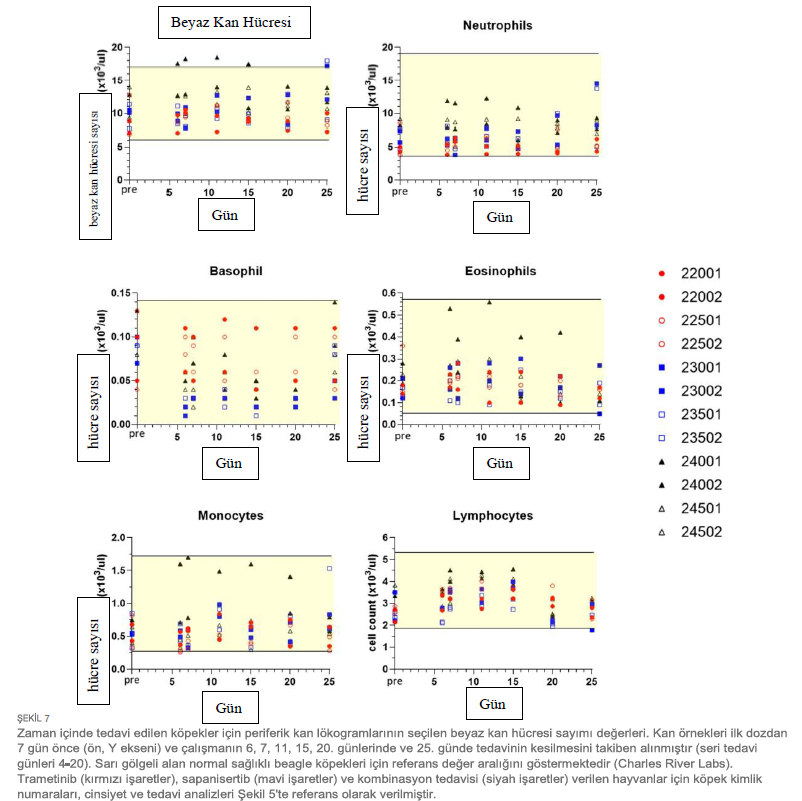
Klinik gözlemler ve hematoloji parametreleri ile değerlendirilen tekrar dozu tolerabilitesiTekrar eden dozlarla 17 güne kadar tedavi edilen köpeklerde ciddi yan etkiler veya doz sınırlayıcı toksisiteler görülmemiştir. Tedaviyle ilişkili klinik belirtiler arasında geçici yumuşak veya mukoid dışkılama epizodları (n = 8), kusma (n = 2) veya ciltte renk değişikliği (n = 2) yer almıştır (Şekil 5). Gözlenen yan etkiler (grade 1,2) müdahale gerektirmemiştir ve tek ajan ve kombinasyon tedavi gruplarında sapanisertib’e ilişkilendirilmiştir. Birer köpekte daha dişlerde renk değişikliği (22001) veya kızgınlık belirtileri (24501) görülmüştür. Üç tedavi koşulundan herhangi birine bağlı olarak tekrar eden doz çalışması süresince her iki cinsiyet için de vücut ağırlığı üzerinde önemli bir etki kaydedilmemiştir (Şekil 6). Çeşitli dönemlerde tedavi etkilerinin izlenmesini kolaylaştırmak için hematoloji, serum kimyası, koagülasyon ve idrar tahlili için numune alınmış ve elde edilen değerler her denek için tedavi öncesi yapılan ölçümlerle karşılaştırılmıştır (Tablo 1). Genel olarak mütevazı olmakla birlikte, tedavi bazı klinikopatolojik parametreleri değiştirmiştir. Üç köpekte dolaşımdaki kan nötrofillerinde hafif artış görülmüştür (Şekil 7). Nötrofiller, 20. ve 25. günlerde sadece sapanisertib (Grup 2) alan bir erkek (23002) ve bir dişide (23501) çalışma öncesi bireysel değerlerin 1,95 katına kadar artmıştır. İki ilaç kombinasyonunu alan bir 3. Grup erkekte (24001) 6 ila 25. günlerde kan nötrofillerinde 2,6 kata kadar artış görülmüştür. |
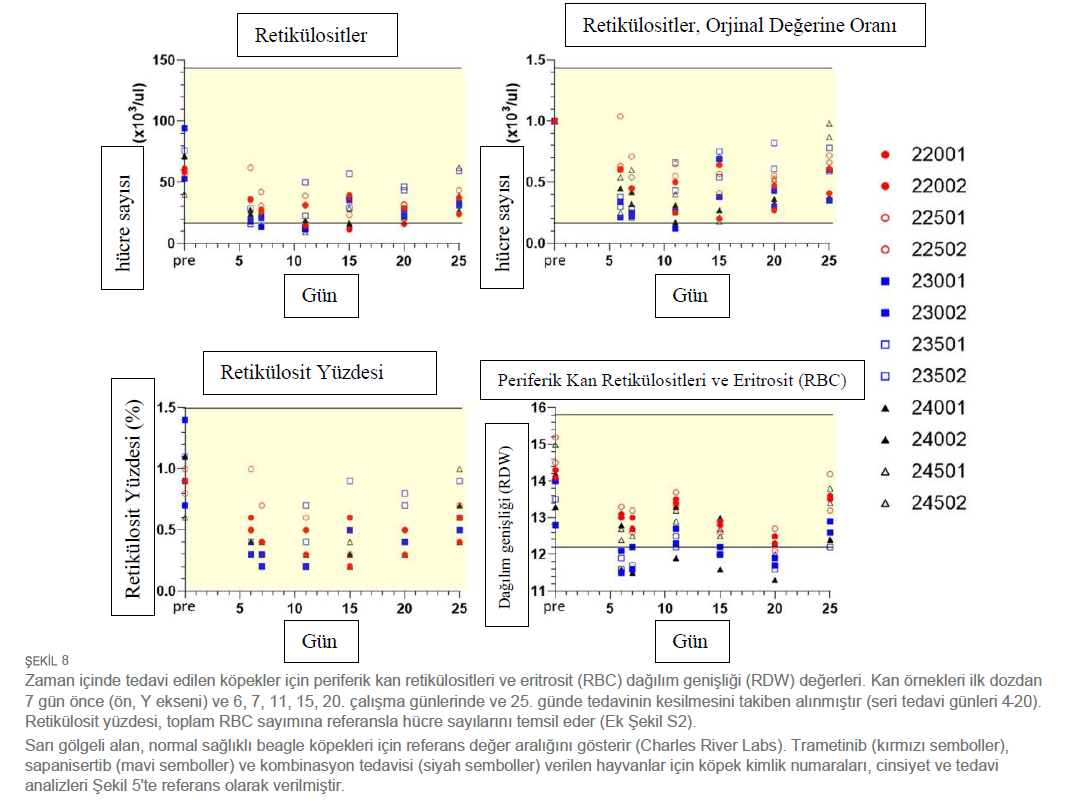
| Diğer lökosit popülasyonlarının değerlerindeki minimal dalgalanmaların, ilacın kesilmesinin ardından (25. gün) çoğu hayvanda tedavi öncesi değerlere (normal aralıklar) döndüğü görülmüştür (Şekil 7). 6-25. günlerde, tüm tedavi gruplarındaki her iki cinsiyette de bireysel mutlak retikülosit sayılarında (0,12x kadar düşük) minimal ila belirgin şekilde düşüşler görülmüştür (Şekil 8). Tipik olarak, bu durum kırmızı hücre dağılım genişliğinde (RDW) tedavi öncesi değerin 0,82 katına kadar (kırmızı kan hücresi boyutundaki değişkenliğin azaldığını göstermektedir) eşzamanlı düşüşlerle birlikte meydana gelmiştir. Ek olarak, 12 köpekten 10’u 6. günden 25. güne kadar bireysel kırmızı kan hücresi kütle parametrelerinde (eritrosit sayısı, hemoglobin konsantrasyonu ve/veya hematokrit; 0,81x kadar düşük) minimal ila hafif düşüşler sergilemiştir (Ek Şekil S2). Son dozlamadaki 20. gün ile karşılaştırıldığında, 25. gün örneklemesi, daha yüksek retikülosit korpusküler hemoglobin içeriği (CHr) ve ortalama retikülosit korpusküler hacmi (MCVr) ile birlikte dolaşımdaki retikülositlerin iyileşmesine yönelik bir eğilim ortaya koymuştur (Şekil 8) (veriler gösterilmemiştir). Bu durum, ilaç kesildikten sonra tüm tedavi gruplarında daha büyük taze kırmızı kan hücrelerinin ortaya çıkmasıyla tutarlılık göstermiştir. Tedaviden önce ve izlemin sonunda toplanan idrar örnekleri analiz edilmiştir. 25. Günde, sadece trametinib verilen bir erkek köpek (22001), sadece sapanisertib verilen dört köpekten üçü ve trametinib artı sapanisertib kombinasyonuyla tedavi edilen dört köpekten ikisinin idrar protein konsantrasyonunda (idrar çubuğu ile kantitatif olarak ölçülenden daha büyük) yarı belirgin artışlar ölçülen ≥1.000 mg/dL’ye kadar minimum ila çalışma öncesi kaydedilen değerler vardı (Ek Tablo S1). Ayrıca, Grup 2 (sadece sapanisertib) ve 3’teki (kombinasyon) her iki cinsiyetten hayvanlarda idrar glukozunda minimal ila hafif artışlar olmuştur (idrar çubuğu ile yarı kantitatif olarak ölçülen 250 mg/dL’ye kadar). Grup 2’deki erkeklerde ve Grup 3’teki her iki cinsiyette de idrar pH’ında orta derecede artışlar görülmüştür (pH ≥ 9,0’a kadar). İdrar proteini, glukoz ve pH’daki bu artışların trametinib, sapanisertib ve/veya trametinib artı sapanisertib uygulaması ile ilişkili olduğu düşünülmüştür. Tedavilerin kan pıhtılaşmasının laboratuvar analizini etkileme potansiyeli de incelenmiştir. Çeşitli dönemlerde bireysel hayvan fibrinojen konsantrasyonunda (2,61 kata kadar) minimal ila orta düzeyde artışlar görülmüş olup, bu artışlar en çok kombinasyon uygulanan Grup 3 örneklerinde belirgin olmuştur (Ek Şekil S3A). Kan fibrinojen konsantrasyonundaki bu artışların trametinib, sapanisertib ve trametinib artı sapanisertib kombinasyonu uygulaması ile ilişkili olduğu düşünülmüştür. Tedavi öncesi örneklerle karşılaştırıldığında, aktive parsiyel tromboplastin zamanı (APTT) testi, sadece sapanisertib verilen bir erkek ve bir dişi köpekte ve iki ilaç kombinasyonu ile tedavi edilen her iki erkek ve bir dişi köpekte 6, 11, 15, 22 ve/veya 25. günlerde tedavi sırasında 1,21 kata kadar uzamıştır (Ek Şekil S3B). Tek başına veya kombinasyon halinde sapanisertib alan köpekler için grup ortalama APTT değerlerinin daha detaylı analizi, tek başına trametinib alan köpeklere kıyasla 11. gün ve sonrasında sürekli olarak anlamlı farklılıklar ortaya koymuştur. Buna ek olarak, tek başına veya kombinasyon halinde sapanisertib alan köpekler için bu ortalama APTT değerleri de tüm köpeklerin tedavi öncesi ortalama değerlerinden belirgin şekilde farklıydı. Bu olası sapanisertib tedavisi etkisine rağmen, tedavi edilen köpeklerin analiz edilen APTT değerlerinin hiçbiri normal köpek referans aralığı üst sınırlarını aşmamıştır ve bu çalışmada klinik olarak anlamlı bulunmamıştır (Ek Şekil S3B). Protrombin zamanı (PT) testleri için benzer bir etki görülmemiştir. Tedavi sırasında çeşitli serum biyokimyasal parametreleri arasında birkaç küçük dalgalanma daha meydana gelmiştir. Bu minimal biyokimyasal değişiklikler müdahale gerektirmemiştir. Bununla birlikte, bazı gözlemler özetlenmiştir (Ek Dosya 1) ve spontan kanserleri ve potansiyel komorbiditeleri olan yaşlı köpeklerde daha etkili olabilecek terapötik sonuçların olası işaretleri olarak değerlendirilebilir. |
TartışmaMEK ve mTOR’un kombine hedeflenmesi birçok preklinik kanser modeli sisteminde başarıyla uygulanmış ve karaciğer ve pankreas kanserlerinde edinilmiş ilaç direncinin bazı formlarının üstesinden gelmek için fırsatl yaratmıştır 1. (23, 24). Bu hassas hedefleme yöntemi, özellikle glioblastoma (25) ve melanomada (13) kombine trametinib ve sapanisertibin sinerjik paralel kullanımı ile uygulanmıştır. |
| Bu gelişmeyi klinik uygulamaya doğru ilerletmek için çalışmamızda, mukozal melanomlu köpekler için klinikte tedaviyi yönlendirmek amacıyla, tümör taşımayan sağlıklı laboratuvar köpeklerinde 17 gün boyunca tek ajan olarak veya kombinasyon halinde günlük trametinib ve gün aşırı sapanisertib kullanılmıştır. Paralel, sabit dozlu, tekrar eden dozda üç kollu çalışmadaki bu tedaviler nispeten iyi tolere edilmiş, önemli bir kilo değişikliği, klinik müdahale gereksinimi veya kısa süreli maruziyet sırasında ilaç uygulamasına ara verme gibi durumlar olmaksızın gerçekleştirilmiştir. Köpekler tarafından deneyimlenen tedaviye bağlı yanıtlar, klinik patoloji parametrelerindeki değişikliklerin eşlik ettiği, çoğunlukla kendi kendini sınırlayan sulu, mukoid dışkı ve deri renginde bozulma veya kusma gibi seyrek atakları içermektedir. Bu köpek çalışmasında trametinib ile kombinasyon halinde sapanisertib kullanımı, gün aşırı uygulama programı kullanan bir fare modeline (13) ve bu çalışmada açıklanan doz artırımımıza göre yapılmıştır. Sapanisertib, insanlar için çeşitli dozlar ve programlar aracılığıyla klinik araştırma geliştirme altında devam etmektedir (17). Kilo kaybı, hemogram ve idrar tahlillerinde ≥0,1 mg/kg dozlarda meydana gelen dalgalanmalar göz önünde bulundurulduğunda, tekrar tekrar uygulanan oral dozun köpeklerde en iyi tolere edilen seviye olduğu görülmüştür. Daha önce köpekler için mevcut olan Trametinib klinik dışı doz ve program verileri (21) günlük 0.025 mg/kg trametinib oral uygulamasına rehberlik etmiştir. Tüm gruplardaki tedaviler kırmızı kan hücrelerini azaltma ve akut faz enflamatuar reaksiyonu tetikleme eğiliminde olup, bu reaksiyon kan örneklerinde öncelikle dolaşımdaki nötrofillerin artması, fibrinojenin artması, serum albümininin azalması ve globülinin artması ile karakterize edilmiştir. Hemogram ve biyokimyasal parametreler sapanisertib ve/veya trametinibe yanıt olarak tedavi öncesi ölçümlerden farklılık gösterse de, değişiklik dereceleri sınırlıydı ve nadiren normal sağlıklı beagle köpek referans aralığı değerlerinin önemli ölçüde dışına çıkıyordu. |
| Klinik laboratuvar değerlerindeki en önemli değişiklik, tedavinin eritropoez üzerindeki etkisi şeklinde ortaya çıkmıştır. Daha önce trametinib ile tedavi edilen köpeklerde gözlemlenen (EMA, Avrupa Kamu Değerlendirme Raporu: MEKINIST), dolaşımdaki retikülositlerin azalması ve bu çalışmada kırmızı kan hücresi endekslerindeki ilişkili değişiklikler, her üç grupta da tedaviye dinamik bir yanıt şeklinde ortaya çıkmıştır; bileşiklerin geri çekilmesiyle 20. günden sonra etkide belirgin bir azalma görülmüştür. Bu değişiklikler ilaca bağlı geçici eritroid üretimi ve olgunlaşmanın durması ile tutarlılık göstermektedir. Küçük molekül inhibisyonuna tabi olan hem MAPK hem de PI3K/Akt yolakları, normal eritropoezde önemli rol oynayan eritropoietin ve transferrin reseptör sinyalizasyonunun downstream’i durumundadır (26, 27). Akut indüksiyon altında, dolaşımdaki retikülositlerin azalması, rutin kan örneklemesine uygun bir farmakodinamik taşıyıcı olarak işlev görebilir ve test edilen dozlarda köpeklerde belli bir düzeyde konakçı hedef inhibisyonuna işaret edebilir. Ayrıca, bu ilaç etkisi, telafi edilmeyen zararlı bir sekel haline gelip gelmeyeceğini belirlemek için kanser tedavisi sırasında zaman içinde izlenmelidir. Proteinüri, glikozüri ve idrar pH’sında artış en çok sapanisertib ve kombinasyonla tedavi edilen köpeklerde belirgindi ve esas olarak sapanisertib ile tedaviye atfedilebilecek renal etkiler şeklinde yorumlandı. Klinik öncesi bir modelde, günde 2,5 mg/Kg sapanisertib verilen bazı farelerde orta derecede histopatolojik kortikal tübüler epitelyal dejenerasyon ve nekroz ile birlikte akut böbrek hasarı (AKI) gözlenmiştir (13). Buna karşın, aynı dozda sapanisertib ile gün aşırı tedavi edilen farelerde belirgin AKI görülmemiş, bunun yerine doku kesitlerinde tek tek tübüler hücre mitozunun eşlik ettiği izole ve ayrık renal tübüler hücre ölümü görülmüştür, bu da telafi edici rejenerasyon ile düşük gradeli hücre döngüsünün göstergesidir. Köpeklerde kullanılan 0,1 mg/kg sapanisertib dozu, farelerde kullanılan 2,5 mg/kg’dan (13) daha düşük kabul edilmiştir; bu doz köpeklerde yaklaşık olarak 0,37 mg/kg’a eşdeğerdir (20). Bununla birlikte, farelerde sapanisertib maruziyetine benzer renal ilaç etkilerinin ortaya çıkma potansiyeli, tedavi edilen köpeklerde, özellikle nefropatisi olan hastalarda göz önünde bulundurulmalıdır. Bazı köpeklerde, özellikle tedavi grubu 2 ve 3’te belgelenen APTT’deki uzamalar, olası sapanisertib ile sapanisertib ve trametinib kombinasyon ilaç etkilerine işaret ediyor gibi görünmektedir. İhtiyatlı olunması gerekmekle birlikte, tüm uzun süreli APTT değişiklikleri minimal düzeydeydi ve tedavi edilen hayvanlar için elde edilen değerler normal köpek referans aralığı (veya altında) içindeydi; bu çalışmada herhangi bir klinik müdahale veya ilaç dozu ayarlaması gerekmemiştir. Bununla birlikte, ilaca maruz kalma süresi nispeten kısa sürmüştür ve tedavinin in vitro test üzerindeki minör etkinin ötesinde köpek kanser hastalarında koagülasyon kaskadlarını etkileme potansiyeli göz önünde bulundurulmalıdır. CMAX ve AUC dahil olmak üzere mevcut çalışmada elde edilen trametinib PK parametreleri, daha önce yasal kurumlara bildirilen köpek değerlerini büyük ölçüde tekrarlamıştır (28). Benzer şekilde, mevcut çalışmadaki erkek ve dişi köpekler karşılaştırıldığında CMAX ve AUC değerlerinde önemli farklılıkların olmaması da bu yasal sonuçları yansıtmaktadır. |
| Trametinibin DMSO ile sülfatlanmasıyla birlikte, dozlama öncesi ve sonrası sınırlı süreyle mama verilmemesinin ölçülebilir plazma seviyelerine önemli ölçüde etki etmesi dikkat çekicidir; bu durum, sülfatlanmış formülasyonun gastrik çözünürlüğünün artması nedeniyle oral emilimin iyileşmesinin olası bir sonucudur. Ayrıca, test edilen doz ve programla yaklaşık olarak, trametinib köpekler tarafından 13 haftalık daha uzun süreler boyunca tolere edilmiştir (28). Trametinib PK parametrelerinin köpekler ve insanlar arasında karşılaştırılmasında, bir miktar benzerlik görülmüştür, ancak tek tip değildir. İnsanlarda bilinen trametinib biyoakümülasyonu (29, 30) köpek plazmasında da gözlenmiş ve hem köpeklerde hem de insanlarda günlük dozun tekrarlanmasıyla altı kata kadar birikim olmuştur. Trametinibin köpeklerde (0.37 L/saat/kg) insanlara (0.07 L/saat/kg; MEKINIST Reçete Bilgisi) kıyasla daha hızlı klerensi, trametinibin köpeklerde (32 L/kg) insanlara (3.1 L/kg) kıyasla daha geniş dağılım hacmiyle ilişkili olarak, protein bağlanmasındaki farklılıklardan kaynaklanıyor olabilir, çünkü trametinib insan serum albüminine %97 oranında bağlanmaktadır. Genel olarak, 0,025 mg/kg günlük rejimi (ortalama 8 kg’lık bir beagle köpeği için yaklaşık 0,2 mg doz) takiben 20. günde (69 saat∗ng/mL) trametinibin sistemik maruziyeti (AUCTAU), 2 mg doz verilen insanların maruz kaldığının yaklaşık 1/3’ü kadardır (31). Ancak, türler arası PK karşılaştırmaları yapılırken, bu çalışmada sadece dört köpek deneğin tek başına trametinib alması nedeniyle dikkatli olunmalıdır. |
| Sapanisertib köpekler tarafından hızla emilmiş (Tmax ortalama 2 saat) ve tekrar eden QOD dozlarında birikim göstermemiştir. Farmakokinetik profil bulguları tek ajanlı insan çalışmalarına benzerdir (17, 32). Kombinasyon halinde verildiğinde sapanisertib kullanımının trametinib PK üzerinde önemli bir etkisi yokken, bunun tersi kanıtlanmıştır. 1. günde, hem sapanisertib CMAX hem de AUC (AUCINF) kombinasyon grubunda tek başına sapanisertibe kıyasla önemli ölçüde daha azdı; bu bulgu fare modelinde önceden görülmüştü (13). Trametinib ile kombinasyon halinde, bu Grup 3 köpeklerde sapanisertib klirensi, tek başına sapanisertib ile tedavi edilen Grup 2’deki köpeklere kıyasla daha hızlı ve dağılım hacmi daha büyüktü (daha düşük maruziyet), bu sonuçlar daha düşük EAA için telafi edici etkiyle tutarlıdır. Trametinib bilinen bir sitokrom P450 CYP3A4 indükleyicisidir (33, 34). Bu nedenle, sitokrom P450 indüksiyonu, kombinasyon tedavisi sırasında sapanisertibin tek başına sapanisertibe göre daha hızlı klerens ve daha düşük maruziyetinin (CMAX ve AUC) arkasında yatan potansiyel bir mekanizmadır. Bu, tekrar eden dozlar süresince trametinibin ekstra birikimi ve buna makul bir şekilde daha fazla sitokrom P450 mikrozomal indüksiyonunun eşlik etmesi ile tutarlı olup, bu nedenle daha sonraki zamanlarda trametinib ile kombine edildiğinde gözlemlenen sapanisertib azalmasında da görülebilir. Maalesef, spesifik CYP izoformunu doğrulamak için yayınlanmış kanıtlar ortaya çıkarılmamıştır, ancak bu köpek çalışmasına dayanarak, CYP3A ailesi indüksiyonu potansiyel bir metabolik mekanizma olarak görünmektedir. Köpeklerin 0,1 mg/kg (ortalama 7,4 kg olan beagle cinsi köpekler için kabaca 0,55-0,85 mg) sapanisertib maruziyetlerinin, faz II denemelerine dahil edilen bir doz seviyesi olan 4 mg oral sapanisertib alan insan kanser hastalarının PK’sı ile türler arası karşılaştırması, benzerlikler ortaya koymuştur (35). Ortalama hayvan-insan maruziyet oranları (sadece köpek sapanisertib grubu) CMAX için 1.11, AUCINF için 1.31 ve T1/2 için 0.91’dir. Bu nedenle, bu köpeklerde elde edilen sapanisertib seviyeleri, insanlarla yapılan bu karşılaştırmaya dayanarak potansiyel klinik önem taşıyacaktır. Bu inhibitör kombinasyonunun beagle cinsi laboratuvar köpeklerinde değerlendirilmesi, farelerde elde edilen önceki bulguları genişletmekte (13) ve ilaç geliştirme sürecinde gerekli ve faydalı bir adım olarak hizmet etmektedir. Benzer şekilde, genel sonuçların türler arasında doğrulanması, klinik öncesi çalışmalarda sıklıkla bir endişe kaynağı olan bilimsel tekrarlanabilirliği ele alarak elde edilen kanıtların geçerliliğini desteklemektedir (36). |
Veri Erişim BeyanıBu makalenin sonuçlarını destekleyen ham veriler, yazarlar tarafından, bilimsel araştırma için nitelikli araştırmacılara herhangi bir çekince olmaksızın sunulacaktır. Etik BeyanBu çalışma AAALAC tarafından akredite edilmiş hayvan tesislerinde [Charles River Laboratories, Mattawan, MI; NIH Laboratuvar Hayvanları Sağlık Hizmetleri Ofisi onayı (https://olaw. nih.gov/assured/app/index.html)], tesisin Laboratuvar Hayvanları Bakım ve Kullanım Komitesi’nin inceleme, izleme ve onayı altında, ABD Halk Sağlığı Servisi’nin laboratuvar hayvanlarının bakımı ve kullanımına ilişkin ulusal kılavuz ve yönetmeliklerine uygun olarak yürütülmüştür. |
Katkıda bulunan yazarlarB-RW ve RS çalışmayı tasarlamış, yönetmiş, sonuçları analiz etmiş ve yorumlamış, makaleyi yazmış ve onaylamıştır. CP, WR ve WF farmakokinetik numuneleri ve verileri analiz etmiş, sonuçları yorumlamış ve makaleyi düzenleyip onaylamıştır. SH çalışma tasarımına, veri analizine katkıda bulunmuş, sonuçları yorumlamış ve makaleyi düzenleyip onaylamıştır. Tüm yazarlar makaleye katkıda bulunmuş ve gönderilen versiyonu onaylamıştır. FinansmanBu araştırma Intramural Araştırma Programı, Kanser Araştırma Merkezi, Ulusal Kanser Enstitüsü, Bethesda, Maryland tarafından desteklenmiştir. Bu destek, NCI Federal Olarak Finanse Edilen Araştırma ve Geliştirme Merkezi belirsiz süreli Sözleşme Numaraları aracılığıyla elde edilen araştırma hizmetlerini içermektedir: 75N91019D00024; 75N91020F00003 ile Leidos Biomedical Research, Inc, Frederick Ulusal Kanser Araştırmaları Laboratuvarı, Frederick, Maryland. |
Çıkar Çatışması BeyanıUlusal Kanser Enstitüsü ve Frederick Ulusal Kanser Araştırma Laboratuvarı, burada incelenen kinaz inhibitörlerinden herhangi biri üzerinde mülkiyet hakkına veya başka bir mülkiyet çıkarına sahip değildir. Her iki kurum da her iki ilacın onaylanması veya izlenmesi konusunda herhangi bir yasal yetkiye sahip değildir. Yazar B-RW, Ulusal Kanser Enstitüsü’nden bir devlet araştırma hizmetleri sözleşmesi kapsamında Leidos Biomedical Research, Inc. tarafından istihdam edilmiştir. Şirketin bu araştırmanın başlatılmasında, tasarımında, gözetiminde veya bu araştırmadan kaynaklanan araştırma iletişiminde hiçbir rolü yoktur. Diğer yazarlar, araştırmanın potansiyel bir çıkar çatışması olarak yorumlanabilecek herhangi bir ticari veya finansal ilişki olmaksızın yürütüldüğünü beyan etmektedirler. Yayıncının NotuBu makalede ifade edilen tüm iddialar yalnızca yazarlara aittir ve bağlı oldukları kuruluşların veya yayıncının, editörlerin ve hakemlerin iddialarını temsil etmeyebilir. Bu makalede değerlendirilebilecek herhangi bir ürün veya üreticisi tarafından ileri sürülebilecek herhangi bir iddia, yayıncı tarafından taahhüt edilmemekte veya desteklenmemektedir. Ek MateryallerBu çalışmaya ilişkin Ek Materyallere şu adresten erişilebilir https://www.frontiersin.org/articles/10.3389/fvets.2022.1056408/full#supplementary-material |
Kaynakça
|