Genel Özet: Onkoloji, küçük hayvan tıbbında hızla büyüyen bir alandır ve yenilikçi terapötik yaklaşımların önemini ortaya koymaktadır. Tirozin kinaz inhibitörleri (TKI’ler) çeşitli önemli hücresel fonksiyonları bloke eden ilaçlardır ve hem insanlarda hem de köpeklerde kanser tedavisinde önemli bir rol oynamaktadır. Bununla birlikte, kedi onkolojisindeki rolleri daha az bilinmektedir. Bu kapsamlı inceleme, tirozin kinazlar (TK’ler) ve TKI’lerin kedilerde kullanımına ilişkin mevcut literatürü inceleyerek bilgi boşluklarını tespit etmeyi, potansiyel endikasyonlar hakkında fikir yürütmeyi ve gelecekteki araştırmalar için zemin hazırlamayı amaçlamaktadır. Çeşitli kedi dokuları farklı TK ekspresyonları açısından incelenmiştir. Bununla birlikte, spesifik kedi tümörlerinde TKI’lerin kullanımına ilişkin sınırlı sayıda veri bulunmasına rağmen, bu veriler insan ve köpek onkolojisindeki ilerlemenin gerisinde kalmaktadır. Ek araştırmaların bu ilaçların yeni kullanım alanlarını belirleyebileceğine ve gelecekte kanserli kediler için tedavi seçeneklerini artırabileceğine inanıyoruz. |
Özet: Tirozin kinaz inhibitörleri (TKI’ler) insan ve köpek malignitelerinin tedavisinde son derece değerli hale gelmiştir, ancak kedi onkolojisindeki rolleri henüz yeterince tanımlanmamıştır. Köpeklerde toceranib fosfat ve masitinib mesilat kullanımı için izin verilmiş olsa da, kediler için henüz onaylanmış bir TKI bulunmamaktadır. Bu derleme, neoplastik ve neoplastik olmayan evcil kedi dokularında tirozin kinazların ekspresyonu ve evcil kedilerde TKI’lerin in vitro/in vivo kullanımı üzerine yapılan araştırmaları sistematik olarak ele almaktadır. Bilgi boşluklarını tespit edip tartışarak, kedilerde TKI kullanımına yönelik daha ileri düzey araştırmalar ve potansiyel endikasyonlar hakkında fikir yürüteceğiz. Üç elektronik veri tabanında ve ilgili makale kaynak listelerinde yapılan kapsamlı bir araştırmada, çalışmaya dahil edilme kriterlerini karşılayan 139 vaka tespit edilmiştir. En sık görülen tümörler mast hücre tümörleri (MCT’ler), meme ve skuamöz hücreli karsinomlar ve enjeksiyon yeri sarkomlarıydı. Mevcut literatüre dayanarak, toceranib fosfat kedilerde, özellikle MCT’lere karşı en etkili TKI olarak görünmektedir. TKI’lerin meme karsinomlarında klinik kullanımının araştırılması umut vaat etmektedir. Kaydedilen ilerlemeye rağmen, şu anda kanıtlar yetersiz kalmakta ve kedi onkolojisinde yeni endikasyonlar keşfetmek ve hem insan hem de kedi tıbbı arasındaki bilgi boşluklarını kapatmak için daha fazla araştırma yapılması gerekmektedir. Anahtar Kelimeler: kedi; toceranib fosfat; masitinib mesilat; KIT; HER2; mast hücreli tümör; meme karsinomu; skuamöz hücreli karsinom; hayvan modeli; karşılaştırmalı onkoloji |
Bu makaleye atıfta bulunmak için: Zagar, Z.; Schmidt, J.M. A Scoping Review on Tyrosine Kinase Inhibitors in Cats: Current Evidence and Future Directions. Animals 2023, 13, 3059. https://doi.org/10.3390/ani13193059
|
1. Giriş
Bilinen ilk onkogen olan v-src’nin hücresel ürünü 1980’lerde bir protein kinaz olarak tanımlandığından beri [1-3], bu hücresel transdüksiyon molekülleri grubu kanser araştırmalarında büyük ilgi uyandırmaktadır. Protein kinazlar, farklılaşma, büyüme, hayatta kalma ve apoptoz gibi çoklu hücresel fonksiyonlarda anahtar rol oynayan enzimlerdir [4]. Bir ATP molekülünden bir fosfat grubunu ya kendileri (otofosforilasyon) ya da downstream substrat proteinleri (fosforilasyon) üzerindeki spesifik kalıntılara bağlayarak hareket ederler [5]. Protein kinazlar genellikle fosforile ettikleri amino asitlere göre sınıflandırılır. Başlıca iki ana sınıf, proteinleri tirozin kalıntıları üzerinde fosforilleyen tirozin kinazlar (TK’ler) ve proteinleri serin ve/veya treonin kalıntıları üzerinde fosforilleyen serin-treonin kinazlardır [6].
Memeli hücrelerinde, mitojenik yollar büyük ölçüde tirozin fosforilasyonu yoluyla sinyalleşmeyi kullanır [5], bu nedenle TK’ler onkolojide özellikle ilgi çekicidir. Bunlar ayrıca reseptör ve reseptör olmayan TK’ler olarak ikiye ayrılır. Reseptör TK’lar (RTK’lar), ligand bağlayıcı bir hücre dışı alana, bir transmembran alana ve bir sitoplazmik katalitik alana sahip transmembran proteinlerdir. Reseptör olmayan TK’lar transmembran alanından yoksundur ve sitozolde, çekirdekte ve hücre zarlarının iç yüzeyinde serbest olarak bulunurlar [6]. Sağlıklı durumda, RTK’lar aktivasyon için spesifik liganda (örn. büyüme faktörleri) bağlanmayı gerektirir. Spesifik ligandların yokluğunda, RTK’lar inaktif kalır. Reseptör olmayan TK’ler, hücre içi inhibitör proteinler ve lipidlerin yanı sıra molekül içi otoinhibisyon yoluyla inaktif tutulur. İnhibitörlerin ayrılması, transmembran reseptörlerine bağlanma ve diğer kinazlar tarafından trans-fosforilasyon yoluyla aktive edilirler [7].
Farklı TK’lerdeki düzensizlikler çeşitli insan [8], köpek [9-16] ve bazı kedi [17-20] malignitelerinde görülmüştür. Düzensiz TK’ler, uygun negatif düzenleme olmaksızın yapısal olarak aktif kalır ve hücrelerin kontrolsüz çoğalmasına ve hayatta kalmasına neden olur [21]. Kanser hastalarında TK’lerin terapötik olarak hedeflenmesi, monoklonal antikorlar (mAb’ler) veya “küçük moleküllü tirozin kinaz inhibitörleri” kullanılarak gerçekleştirilebilir [21]. mAb’ler insan onkolojisinde yaygın olarak kullanılırken, evcil hayvanlarda kullanımları henüz bilinmemektedir [22]. İnsanlarda kullanım için onaylanmış 40’tan fazla farklı tirozin kinaz inhibitörüne (TKI) rağmen [23], sadece iki TKI, masitinib mesilat (masitinib) [24] ve toceranib fosfat (toceranib) [25], köpekler için kanser ilaçları olarak geliştirilmiş ve onaylanmıştır. Bugüne kadar, bu tür bir ilaç kedilerde kullanım için onay almamıştır.
Kanser, kedilerde önemli bir morbidite ve mortalite nedenidir [26-28]. Bugüne kadar 51.322 kediyi kapsayan en geniş çalışmada, kanser insidansının %35 olduğu bildirilmiştir [26]. Çeşitli kanser türleri arasında, epitelyal tümörler en yaygın olarak ortaya çıkmış, bunu mezenkimal ve hematopoetik ve lenforetiküler tümörler izlemiş ve tüm tümörlerin en az dörtte üçü malign yapıda olmuştur. Spesifik olarak, malign tümörler spektrumu içinde, meme tümörleri, skuamöz hücreli karsinomlar (SCC’ler), lenfomalar ve fibrosarkomlar (FSA’lar) en sık bildirilen türler olup, deri ve bağ dokuları en sık etkilenen dokular olmuştur [26-28].
TK’ler ve TKI’lerin evcil hayvanlarda, özellikle de köpeklerde kullanımı hakkında çeşitli inceleme makaleleri yayınlanmıştır [21,29,30]. Ancak, yazarların bildiği kadarıyla, kedilerle ilgili karşılaştırılabilir bir inceleme yayınlanmamıştır. Bu nedenle, bu kapsam belirleme derlemesinin amacı, evcil kedi neoplastik ve neoplastik olmayan dokularında çeşitli TK’lerin ekspresyonu ve evcil kedilerde TKI’lerin kullanımı üzerine yapılan araştırmaları sistematik olarak tanımlamaktır. Ayrıca, kedilerde TKI kullanımı için yeni endikasyonları belirlemeyi, bilgi birikimindeki boşlukları tespit etmeyi ve bu alanda yapılması gereken daha ileri araştırmalar hakkında fikir yürütmeyi amaçlıyoruz..
2. Materyal ve Metod
MedLine (PubMed aracılığıyla), CAB Abstracts ve Agricola veritabanları, aşağıdaki arama kriterleri kullanılarak, son güncelleme tarihi 12 Temmuz 2023 olan ve çalışmaya dahil edilmeye uygun çalışmalar bulmak için taranmıştır: (“tirozin kinaz inhibitörü*” [tw] VEYA “tirozin kinaz*” [tw] VEYA “kit” [tw] VEYA “kök hücre faktör reseptörü” [tw] VEYA “cd117” [tw] VEYA “erbb” [tw] VEYA “her2” [tw] VEYA “pdgfr” [tw] VEYA “vegfr” [tw] VEYA “ron” [tw]) VE (cats[tw] VEYA cat[tw] VEYA feline[tw]). PubMed veritabanı araması ayrıca aşağıdaki tıbbi konu başlıkları (MeSH) terimlerini de içermiştir: “Protein-Tirozin Kinazlar” [Mesh] VEYA “Tirozin Protein Kinaz İnhibitörleri” [Mesh] VEYA “Proto-Onkogen Proteinler c-kit” [Mesh] VEYA “Reseptör, ErbB-2” [Mesh] VEYA “Reseptör, ErbB-3” [Mesh] VEYA “ErbB Reseptörleri” [Mesh] VEYA “Reseptörler, Trombosit Kaynaklı Büyüme Faktörü” [Mesh] VEYA “Reseptör, Trombosit Kaynaklı Büyüme Faktörü beta” [Mesh] VEYA “Reseptörler, Vasküler Endotelyal Büyüme Faktörü” [Mesh] VEYA “Vasküler Endotelyal Büyüme Faktörü Reseptörü-3” [Mesh] VEYA “Vasküler Endotelyal Büyüme Faktörü Reseptörü-2” [Mesh] VEYA “Vasküler Endotelyal Büyüme Faktörü Reseptörü-1” [Mesh] VEYA “RON proteini” [Ek Konsept]. Çalışmalar, hakemli dergilerde yayınlanmış ve evcil kedi neoplastik veya neoplastik olmayan doku veya hücre hatlarında TK ekspresyonu veya evcil kedilerde TKI kullanımı hakkında rapor edilmişse çalışmaya dahil edilmiştir. Konuyla ilgili mevcut klinik verilerin azlığı nedeniyle vaka raporları da dahil edilmiştir.
İlgili makalelerin ve derleme makalelerinin referans listeleri de dahil edilmiştir. Başlangıçtaki özet ve başlık tarama sürecini kolaylaştırmak ve belgelemek için, tüm kaynaklar sistematik incelemeler için ücretsiz bir web otomasyon aracı olan Rayyan’a aktarılmış ve taranmıştır [31]. Başlıklar ve özetler aşağıdaki hariç tutma kriterlerine göre taranmıştır: (1) çalışmanın odağının evcil olmayan kediler olup olmadığı; (2) çalışmanın odağının tirozin kinazlar olup olmadığı; (3) kedi tıbbı üzerinde belirgin bir etkisi olmayan deneysel ve/veya moleküler çalışmalar; (4) kitap bölümleri, derleme makaleler ve başyazılar ve (5) İngilizce dışındaki dillerde yazılmış makaleler.
Uygun bulunan çalışmalar aşağıdaki kriterlere göre sınıflandırılmıştır: (1) tümör hücre hatları, (2) neoplastik olmayan dokular, (3) neoplastik dokularda veya neoplastik hastalığı olan kedilerin serumunda TK ekspresyonu, (4) klinik ortamda TKI’ler ve (5) vaka raporları. Tümör hücre hattı çalışmaları, çeşitli TK’lerin ekspresyonunu ve/veya çeşitli TKI’lerin evcil kedi tümör hücre hatları üzerindeki etkisini araştıran dosyaları içermektedir. Neoplastik olmayan dokular, evcil kedilerin neoplastik olmayan dokularında çeşitli TK’ların ekspresyonunu belirlemeye çalışan araştırmaları kapsamaktadır. TKI’lerle ilgili klinik çalışmalar (vaka raporları dahil), anti- kanser, anti-pruritik veya anti-enflamatuar tedavinin bir parçası olarak farklı TKI’lerin kullanımına yönelik toksisite ve yanıtın değerlendirilmesine odaklanmıştır.
Tam metin incelemesinden çıkarılan veriler, çalışmaya atıf yapılmasını sağlayan ayrıntıları (yazarlar, yayın yılı, dergi başlığı), çalışma sınıflandırmasını, çalışma tasarımını, tümör tipini (varsa), kullanılan TKI’yi (varsa), yanıtı veya tümör hücre hatları üzerindeki etkiyi, eşzamanlı tedaviyi (varsa) ve toksisiteyi (varsa) içermektedir. Mümkün olduğunda, toksisite VCOG- CTCAE kriterlerine göre raporlanmıştır [32]. Mevcut olmadığında ve mümkünse, yan etkiler yazarlar tarafından VCOG-CTCAE kriterlerine göre derecelendirilmiştir. Ayrıca, eğer mevcutsa, klinik çalışmalardaki yanıt RECIST [33] veya DSÖ [34] kriterlerine göre rapor edilmiştir.
Bu derlemenin tanımlayıcı niteliği nedeniyle, dahil edilen çalışmalar yanlılık açısından değerlendirilmemiştir.
3. Sonuçlar
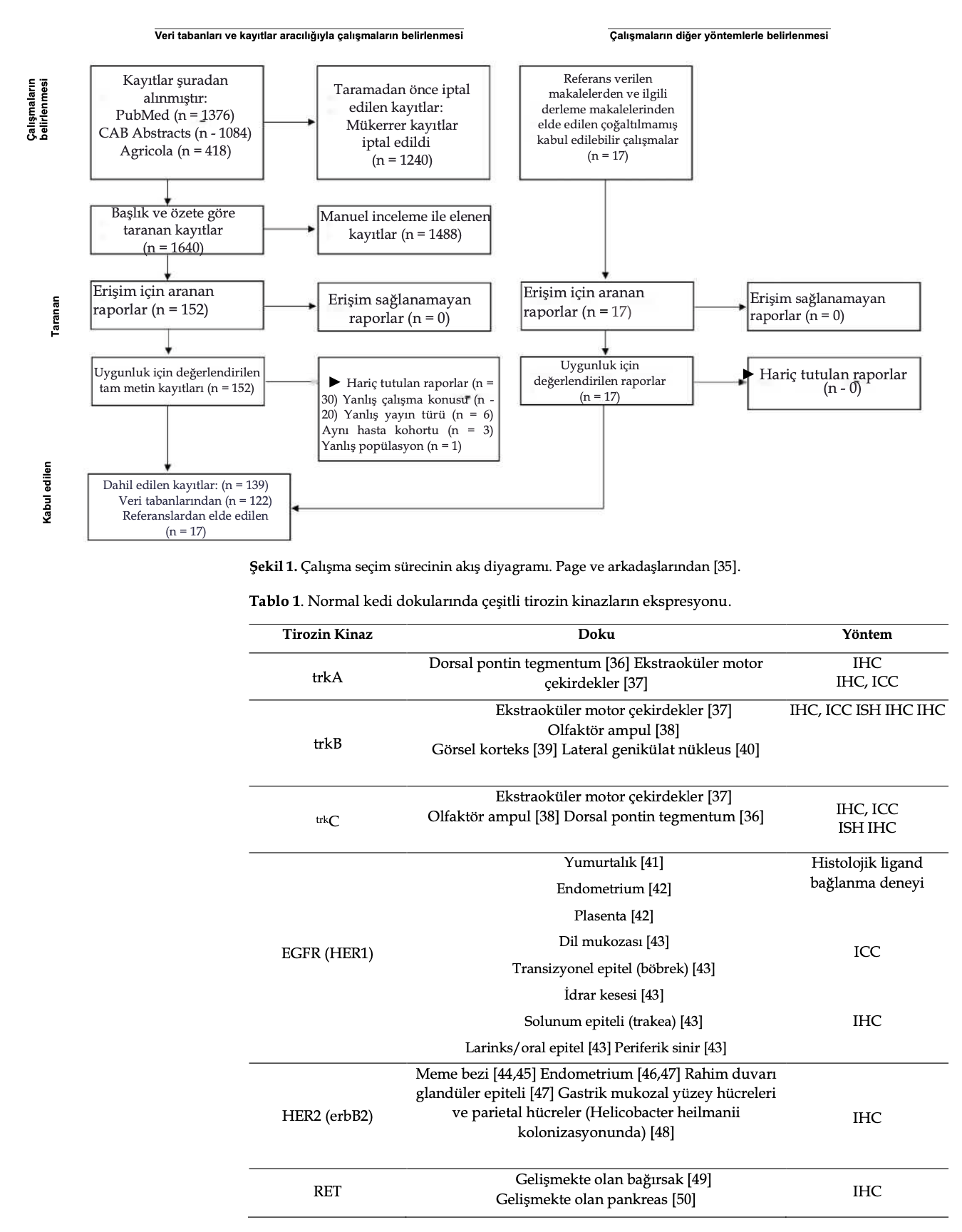
Başlangıçta taranan 1640 İngilizce makaleden 122’si nihai dahil edilme kriterlerini karşılamıştır (Şekil 1). Ek olarak, ilgili makalelerin kaynak listelerinden ve derleme makalelerden 17 mükerrer olmayan makale eklenmiştir. Bu yayınlar, meme karsinomu (n = 36), çeşitli lokasyonlarda mast hücreli tümör (MCT) (n = 22), çeşitli lokasyonlarda SCC (n = 13), enjeksiyon yeri sarkomu (n = 11), gastrointestinal stromal tümör (n = 4), renal hücreli karsinom (n = 4), gastrointestinal sistem leiomyosarkomu (n = 3), pulmoner karsinom (n = 2), iris melanomu (n = 2), endometriyal adenokarsinom (n = 2), pankreatik adenokarsinom (n = 2), histiyositik hastalıklar (n = 1), osteosarkom (n = 1), granüloza hücreli tümör (n = 1), adrenal korteks karsinomu (n = 1), tiroid bezi karsinomu (n = 1), Non-Hodgkin lenfoma (n = 1), oligodendroglioma ve subependymoma (n = 1), kolonik malign periferik sinir kılıfı tümörü (n = 1), gemistositik astrositom (n = 1), Merkel hücreli karsinom (n = 1), kemodektom (n = 1), trakeal adenokarsinom (n = 1) ve hipereozinofilik sendrom (n = 1) dahil olmak üzere toplam 25 tümör tipini kapsıyordu. Ek çalışmalar kedi atopik deri sendromu (n = 4) ve kedi astımı (n = 1) üzerine odaklanmıştır.
Ayrıca çalışmaları ele alınan TKI’ye göre gruplandırdık: toceranib (n = 13), masitinib (n = 8), imatinib mesilat (imatinib) (n = 8), oklasitinib (n = 6). Bazı çalışmalar farmakokinetik (n = 2) ve güvenlik/toksisite (n = 5) üzerine odaklanmıştır.
3.1. Normal Kedi Dokularında Çeşitli Tirozin Kinazların Ekspresyonu
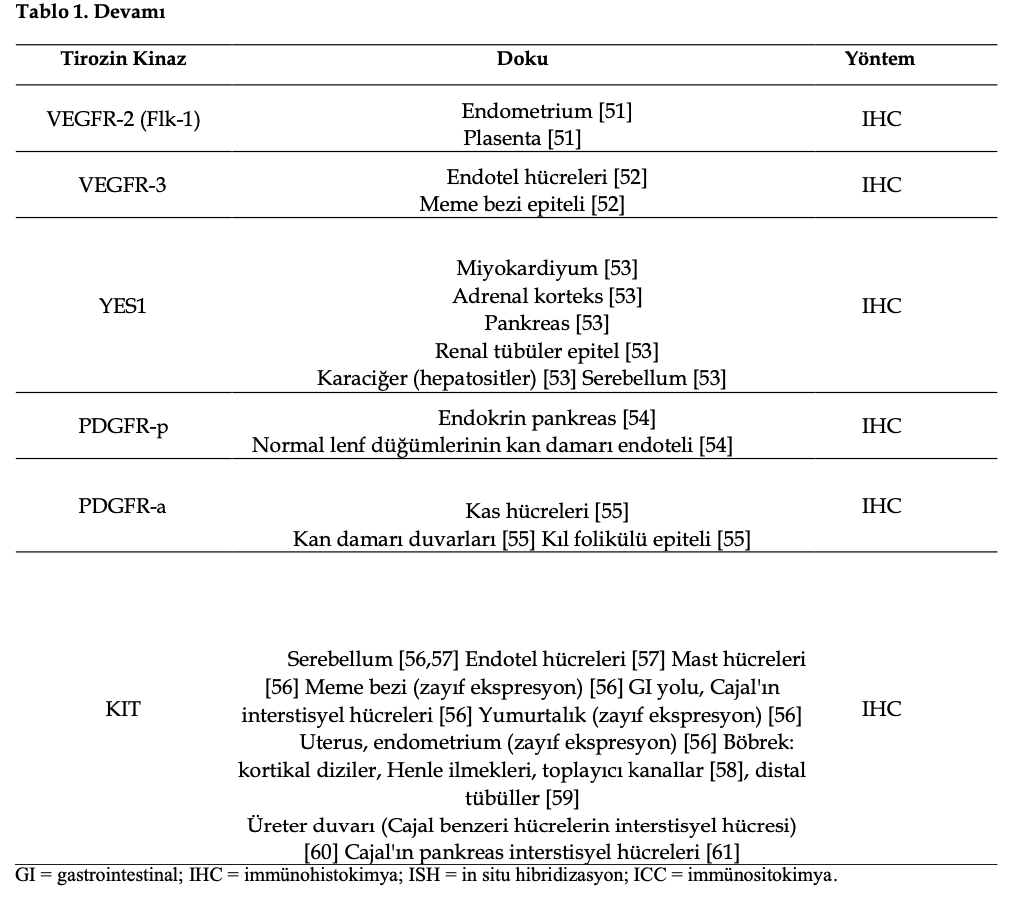
Normal kedi dokularında TK’lerin ekspresyonu, Tablo 1’de belgelenen toplam 28 makalenin gösterdiği gibi, immünohistokimya baskın yaklaşım olmak üzere çeşitli yöntemlerle araştırılmıştır. Şimdiye kadar, 12 TK’nin ekspresyon profilleri 37 farklı normal doku veya hücrede karakterize edilmiştir. Ekspresyonun gücü her zaman ölçülmemiş, bu da farklı doku veya hücrelerdeki çokluğunun raporlanmasında farklılıklara yol açmıştır.
3.2. Kedi Malignitelerinde Tirozin Kinazların Ekspresyonu ve Tedavi Amaçlı Hedeflenmesi
Araştırmada toplam 24 farklı tümör tipinde TK ekspresyonuna ilişkin 81 yayın tespit edilmiştir. Meme karsinomları (n = 36), MCT’ler (n = 22), SCC (n = 13) ve enjeksiyon bölgesi sarkomları (n = 11) bugüne kadar en sık çalışılan dört tümör tipidir. En çok çalışılan dört malignitede çeşitli tirozin kinazların ekspresyonu, prognostik etkileri ve TKI’lerin in vitro ve in vivo kullanımının bir özeti Tablo 2’de verilmiştir.
3.2.1. Mast Hücreli Tümörler
Kedi Mast Hücreli Tümörlerde Tirozin Kinaz Ekspresyonu
RTK KIT ekspresyonu kedi MCT’lerinde kutanöz, dalak, bağırsak ve belirtilmemiş bölgeler dahil olmak üzere çeşitli yerlerde keşfedilmiştir [56,62-73]. İncelenen tüm çalışmalarda 168/208 (%81; dağılım: %55-93) tümör örneğinde immünohistokimyada (IHC) çeşitli derecelerde pozitif KIT işaretlemesi ile kutanöz formun en yaygın çalışılan form olması şaşırtıcı olmamıştır [62-64,69-71]. Ekspresyon paterni 87 (%52) örnekte membranöz, 76 (%45) örnekte sitoplazmik (fokal veya diffüz) ve 5 (%3) örnekte her ikisi şeklinde raporlanmıştır. Sitoplazmik ve dolayısıyla düzensiz ekspresyon, iki çalışmada [62,63] tek değişkenli analizlerde istatistiksel olarak anlamlı derecede daha kötü prognozla ilişkilendirilmiş, ancak birinde [64] anlamlı bulunmamıştır. Splenik MCT’ler, IHC (5 membranöz ve 24 sitoplazmik ekspresyon paterni) ve immünositokimyada vakaların %67’sinde (29/43) pozitif KIT etiketlenmesi sergilemiştir [65,67,68,70,71,73]. Ancak, ekspresyon paterni sağkalım ile korelasyon göstermemiştir [65]. Bağırsak MCT’lerinde, vakaların %59’unda (22/37) (6 membranöz, 11 sitoplazmik ekspresyon paterni ve 5’inde rapor edilmemiştir) pozitif KIT işaretlemesi bulunmuş ve sağkalım ile ilişkisi bulunmamıştır [66,72].
RTK KIT’i kodlayan c-kit proto-onkogenindeki mutasyonlar 6, 8, 9, 10, 11 ve 18. ekzonlarda tanımlanmıştır [17,19,20,63,65,67,74,75].
Bildirilen c-kit mutasyonlarının oranı %56-68 arasında değişmektedir. Bir çalışmada 10 dalak MCT’sinde ekzon 11, 12 ve 17’de mutasyon bulunmazken [76], yakın zamanda yapılan bir araştırmada dalak ve deri hastalığı olan bir kediden alınan dalak MCT’sinde ekzon 8, 9, 10 ve18’de mutasyonlar tespit edilmiştir [20]. Bu çalışma aynı zamanda ilk kez c-kit mutasyonlarında intratümöral heterojenitenin varlığını rapor ederek önemli bir bulgu ortaya koymuştur; bu da tümör hücrelerinin aynı tümör kitlesi içinde farklı genetik değişiklikler barındırdığını düşündürmektedir. Dalak örneklerinin toceranib ile 3,5 aylık bir tedaviden sonra toplandığına değinmek önemlidir, bu da TKI’nin bu heterojenliğin gelişimini etkilemiş olabileceği ihtimalini artırmaktadır [20]. Ayrıca, ilginç bir şekilde, birden fazla MCT’si olan kediler her tümörde farklı mutasyon profilleri sergileyebilir [63]. Öte yandan, bağırsak MCT’lerinde şimdiye kadar hiçbir mutasyon tespit edilmemiştir [66].
Şimdiye kadar, mutasyon durumu sağkalım süreleriyle ilişkili görünmemektedir, bu da c- kit mutasyonlarının tümör davranışında ikincil bir rol oynadığını düşündürmektedir [65]. Bununla birlikte, anormal KIT protein lokalizasyonu ve c-kit mutasyonları arasındaki tutarsız ilişki, c-kit geninde henüz keşfedilmemiş driver mutasyonları olasılığını akla getirmektedir [63]. Şimdilik, ekzon 8, 9 ve muhtemelen 10’da çeşitli fonksiyonel mutasyonlar tanımlanmışken, ekzon 6 ve 11’deki mutasyonların KIT protein aktivitesi üzerindeki etkisi açıkça araştırılmamıştır [17,19,20,63,74]. İlginç bir şekilde, ekson 18’de baskılayıcı bir mutasyon bulunmuştur. Bununla birlikte, bu mutasyonların kedi MCT patogenezi üzerindeki kesin etkisi tam olarak aydınlatılmayı beklemektedir [20].
Kedi Mast Hücresi Tümörlerinde Tirozin Kinazların Hedeflenmesi
Terapötik etkinlik açısından, imatinib, dasatinib, nilotinib ve midostaurin splenik
neoplastik mast hücrelerine karşı in vitro etkinlik göstermiştir [67]. Toceranib [77], imatinib [17,19,78,79] ve masitinib [66] klinik ortamda araştırılmıştır. MCT’li 50 kedide (22 kutanöz, 10 splenik/hepatik, 17 gastrointestinal, 1 diğer) haftada üç kez veya gün aşırı (EOD) ortalama 2,5 mg/kg dozda Toceranib tedavisi %80 (40/50) genel klinik fayda oranı göstermiştir, %26’sında (13/50) tam yanıt (CR), %44’ünde (22/50) kısmi yanıt (PR), %24’ünde (12/50, 7’si 10 haftadan kısa) stabil hastalık (SD) ve %6’sında (3/50) ilerleyici hastalık (PD) görülmüştür [77]. Ortalama yanıt süresi 32 hafta olup köpeklerdeki bulgularla tutarlılık göstermektedir [25]. Önceki sitoredüktif tıbbi tedavi sonucu olumsuz etkilememiştir [77].
İmatinib (günde 10-15 mg/kg) 13 kedide (kutanöz n = 8 splenik/hepatik n = 2; kutanöz/splenik/hepatik n = 2; intestinal n = 1; mastositemi ile birlikte n = 7) bir çalışmada [19] ve üç tek raporda [17,78,79] değerlendirilmiştir. 2-3 haftalık tedaviden sonra 1 kedide (%8) tam yanıt, saptanabilir c-kit mutasyonu olmayan en az 1 kedi dahil 8 kedide (%62) PR ve 3 kedide (%23) SD veya yanıt yok olarak kaydedilmiştir. Bir kedide (%8), 5 hafta sonra kutanöz tümörlerde CR, ancak mastositeminin devam ettiği gözlenmiştir [17]. İki kedinin mutasyon durumu rapor edilmemiştir [78,79]. Çok çeşitli tedavi süreleri nedeniyle, yanıt süresi belirlenememiştir.
Masitinib sadece iki bağırsak MCT vakasında kullanılmış ve bir kedi 538 gün hayatta kalmış, diğer kedi ise en az 90 gün hayatta kalmıştır [66]. Ancak, tedavi süreci hakkında ayrıntılı bilgi verilmemiştir. Kedi dalak MCT’lerine odaklanan bir çalışmada, TKI’lerin değerlendirilmesi sınırlıydı çünkü sadece dört kedi herhangi bir özellik belirtilmeden TKI tedavisi aldı ve bunlar diğer sistemik tedavilerle gruplandırıldı [80].
3.2.2. Meme Tümörleri
Kedi Meme Tümörlerinde Tirozin Kinaz Ekspresyonu
İnsan epidermal büyüme faktörü reseptörü (EGFR, HER1, ErbB1) [81-85], insan epidermal büyüme faktörü reseptörü 2 (HER2, ErbB2) [44,81,86-101], insan epidermal büyüme faktörü reseptörü 3 (HER3, ErbB3) [83], RON kinaz (Recepteur d’Origine Nantais, makrofaj uyarıcı protein reseptörü, MST1R) [102,103] ve vasküler endotelyal büyüme faktörü reseptörleri 1 ve 2 (VEGFR-1/Flt-1; VEGFR-2/KDR/Flk-1) [104,105] kedi meme karsinomunda (FMC) çalışılmıştır.
Çoğu çalışma HER2 ekspresyonuna odaklanmıştır. FMC’de HER2 ekspresyonu üzerine yapılan araştırmalar %5,5 ila %90 arasında değişen değişken immünohistokimyasal ekspresyon oranları ortaya koymuştur [44,81,86-93,95-101]. Bir çalışmada, iyi huylu kedi meme lezyonlarında ve normal meme dokusunda HER2 ekspresyon oranının FMC’den daha yüksek olduğu bildirilmiştir [44]. Belgelenen oranlardaki farklılıklar antikorlar, antijen alma teknikleri, skorlama sistemleri ve yorumlamadaki farklılıklara bağlanabilir [44,92]. Bu sorunlar nedeniyle ve raporlamayı birleştirmek amacıyla, birkaç çalışmada FMC’de in situ hibridizasyon (ISH) da kullanılmıştır [90,91,93]. FMC’de HER2 aşırı baskılanmasının prognostik önemine ilişkin çelişkili bulgular gözlenmiştir [87,92,98]. İki araştırma, tek değişkenli analizde HER2 aşırı ekspresyonu ile daha kısa genel sağkalım (OS) arasında anlamlı bir korelasyon olduğunu göstermiştir, ancak “aşırı ekspresyonu” tanımlamak için kullanılan kriterlerdeki farklılıklar, farklı ekspresyon oranlarının bildirilmesine neden olmuştur (%60 veya 28/47 vs. %10 veya 5/51) [87,98]. İlginç bir şekilde, daha küçük tümörlerde daha yüksek HER2 ekspresyonu görülmüş ve bu da erken karsinogenezde olası bir şekilde rol oynadığının düşünülmesine yol açmıştır [98]. Buna karşılık, 73 numuneyi içeren başka bir analiz %5,5 gibi düşük bir ekspresyon oranı bulmuş ve HER2 aşırı ekspresyonu ile OS arasında bir korelasyon bulamadığı için HER2’nin FMC prognozundaki önemi hakkında şüpheler uyandırmıştır [92]. Ayrıca, başka bir çalışmada HER2 aşırı ekspresyonu gösteren FMC’lerin sadece %16’sında (2/12) Her2 gen amplifikasyonu görüldüğü bildirilirken [93], başka bir çalışmada Her2 gen amplifikasyonunun aşırı ekspresyonuyla ilgili olmadığı öne sürülmüştür [106]. Primer tümör ve metastazlar arasında HER2 ekspresyonundaki uyum ise tüm çalışmalarda tutarlı değildi [88,95]. Bu farklı bulgular, HER2’nin FMC’deki rolünün karmaşıklığını vurgulamaktadır. Her2 amplifikasyonunun FMC karsinogenezinde bir driver gen değişikliği mi yoksa sadece bir bystander passenger mutasyonu mu olduğu henüz belirlenmemiştir [90].
Enflamatuar ve anaplastik FMC’li iki vakada HER2 immünohistokimyasal ekspresyonunun sonuçları çelişkilidir [107,108]. Benign veya pre-invaziv kedi meme lezyonlarında, en büyük çalışmalar vakaların sırasıyla %29’unda (17/59) ve %36’sında (16/45) HER2 aşırı ekspresyonu bildirmiştir [45,109].
Bir çalışmada, 60 FMC’li ve 20 sağlıklı kedide HER2 ekstraselüler alanının serum seviyeleri karşılaştırılmıştır [94]. FMC’li kedilerin serum HER2 seviyeleri sağlıklı kedilere göre önemli ölçüde daha yüksekti ve HER2+ FMC’li kedilerin HER2- FMC’li kedilere göre daha yüksek seviyeleri vardı. Yazarlar, serum HER2 ölçümünün kedilerde anti-HER2 ajanlarına terapötik yanıtı tahmin etmek için potansiyel olarak kullanılabileceğini öne sürmekte ve insan tıbbındaki benzer önerilerle paralellik göstermektedir [110]. Çalışma aynı zamanda sağlıklı kedilerde %25- 30’luk bir yanlış pozitif oran gösterdiğinden, yorumlama konusunda dikkatli olunması tavsiye edilmektedir. Ek olarak, insan tıbbında gözlemlenen kanıtların aksine [111], serum ve dokudaki HER2 seviyeleri daha az agresif özelliklerle ilişkilendirilmiştir [94]. Bu çelişkili bulgular, testin kedi hastalarında klinik kullanım için pratik ve güvenilir olarak kabul edilmeden önce daha fazla araştırma yapılması gerektiğini vurgulamaktadır.
Diğer çeşitli TK’lar, FMC’de olası prognostik önemi ve tedavi amaçlı hedefler bakımından incelenmiştir. Özellikle, HER2’nin yanı sıra, hem EGFR hem de HER3 ekspresyonu çok sayıda FMC hücre hattında ve tümör örneğinde tespit edilmiştir. MET ailesi içinde ilgi çeken bir başka TK olan RON ve transkripti de FMC’de görülmüştür [102,103]. İlginç bir şekilde, RT-PCR ile tespit edilen kısa formunun (sf-RON) transkriptinin varlığı, tek değişkenli analizde kötü diferansiye tümörler, daha kısa hastalıksız geçen süre (DFI) ve daha kısa sağkalım ile ilişkilendirilmiştir [102].
Ayrıca, VEGFR-2 ve ligandı VEGF’nin invaziv kedi meme tümörlerinin epitelyal, endotelyal ve stromal kompartmanlarında gözlenen ekspresyonu ile kanıtlandığı üzere, anjiyogenez invaziv kedi meme tümörlerinde potansiyel bir prognostik faktör olarak ortaya çıkmıştır [105]. Ayrıca, belirli moleküler FMC alt tiplerine (HER2+ ve üçlü negatif normal benzeri) sahip kedilerde, VEGFR-1, VEGFR-2 ve VEGF-A’nın serum seviyeleri önemli ölçüde yükselmiştir, bu da bu moleküllerin bu spesifik tümör tipleri için invazif olmayan biyobelirteçler olarak hizmet edebileceğini göstermektedir [104].
FMC’nin Her2 genindeki mutasyonlar da incelenmiştir [112-114].
En eski çalışmalardan biri, FMC örneklerinde beş farklı dizi varyantı tespit etmiştir; bu, kedilerin normal meme dokusundan iki fazladır. Biyoinformatik analiz, bu dizi varyantlarından dördünü, HER2’nin kesilmiş protein izoformlarının üretimine yol açabilecek alternatif ekleme için potansiyel adaylar şeklinde tanımlamıştır. Ayrıca, yabani tip olmayan haplotipler ile daha fazla sayıda tümör gelişimi ve daha büyük tümör boyutu arasında bir ilişki olduğu öne sürülmüştür [114]. Son çalışmalar Her2 mutasyonlarının FMC örneklerinin çoğunda (%90, 36/40) mevcut olduğunu göstermiş ve toplam 42 dizi varyantı tanımlamıştır. Mutasyonların sıklığı dört farklı moleküler alt tip (üçlü-negatif, HER2-pozitif, luminal B, luminal A) arasında değişiklik göstermiş, üçlü-negatif FMC’ler en yüksek derecede (%71,4) mutasyon gösterirken luminal A’da hiç mutasyon görülmemiştir. Özellikle, ekzon 18’deki tek bir mutasyon daha büyük bir tümör boyutu ile ilişkilendirilmiştir. Tanımlanan mutasyonların hiçbirinin şimdiye kadar insan meme kanseri (HBC) hastalarında TKI’lere veya immünoterapiye direnç oluşturduğu açıklanmadığından, bu mutasyonların FMC’li kedilerde TKI’lerin kullanımının tehlike oluşturmayacağına inanılmaktadır [112,113].
Kedi Meme Tümörlerinde Tirozin Kinazların Hedeflenmesi
FMC’yi hedefleyen TKI’lerin kullanımı konusunda çok az araştırma yapılmıştır. İki
çalışmada dört insan TKI’sinin (geftinib, AG825, GW583340 ve lapatinib) çeşitli FMC hücre hatları üzerindeki etkisi incelenmiştir [82,83]. Bir çalışmada, ikili EGFR ve HER2 inhibitörü GW583340 hücre proliferasyonunu en etkili şekilde azaltırken [82], diğer çalışma hem gefitinib hem de lapatinib ile proliferasyonun doza bağlı inhibisyonunu ortaya koymuştur [83], bu da FMC’de fonksiyonel RTK’ların varlığına işaret etmektedir. Epidermal büyüme faktörünün (EGF) eklenmesi FMC hücre hatlarının proliferasyon oranını artırarak işlevsel bir EGFR yolağı olabileceğini düşündürmüştür. Ayrıca, FMC hücreleri HER2 hedeflemesine kıyasla EGFR hedeflemesine karşı sürekli olarak daha yüksek hassasiyet göstermiştir [82].
İki ek çalışma, iki TKI’nin [112] ve anti-HER2 mAb’lerin [113] antiproliferatif etkilerini, farklı seviyelerde HER2 ekspresyonuna sahip üç FMC hücre hattında araştırmıştır. Lapatinib tüm hücre hatlarında %100 sitotoksisite gösterirken, neratinib daha düşük sitotoksisite oranları (%31-79) göstermiştir. HBC’de direnç gelişimiyle mücadele etmek için umut vadeden bir strateji de TKI’lerin mTOR inhibitörü rapamisin ile birleştirilmesidir [115]. Bu kombinasyon in vitro güçlü bir sinerjik antiproliferatif etki göstermiştir [112]. Aynı üç kedi hücre hattında, trastuzumab (%60-93), pertuzumab (%51-62) ve antikor-ilaç konjuge trastuzumab-emtansin (T- DM1; %54-94) ile biraz daha düşük doza bağlı antiproliferatif etkiler gözlenmiştir [113]. İlginç bir şekilde, hem mAb’lerin hem de mAb’lerin ve lapatinibin kombine maruziyetleri sinerjik anti- proliferatif etki göstermiştir [112,113].
VEGF’ye karşı rekombinant hümanize bir mAb olan Bevacizumab, FMC’nin bir ksenograft modelinde tümör büyümesini baskılamış ancak tümör proliferasyon indeksini etkilememiştir [116]. Bugüne kadar, TKI’lerin FMC’de kullanımı klinik ortamlarda araştırılmamıştır. Bununla birlikte, yukarıda bahsedilen bir çalışma [83] heterolog kedi HER2 DNA’sı ile elektro aşılamanın etkilerini araştırmış ve bazı kedilerde insan HER2’sine karşı yüksek düzeyde IgG antikorları ve spesifik kedi HER2 T-hücresi yanıtı tespit edilmiştir.
3.2.3. Skuamöz Hücreli Karsinomlar
Kedi Skuamöz Hücreli Karsinomlarında Tirozin Kinaz Ekspresyonu
EGFR, HER2 ve trombosit kaynaklı büyüme faktörü reseptörü a (PDGFR- a) ekspresyonu kedi SCC’sinde incelenmiştir [43,82,117-120]. İmmünohistokimyasal çalışmalar, kedi oral SCC’sinin %69’unda (9/13) ve %100’ünde (67/67) [43,117] ve başın kutanöz [119] SCC’sinin %74’ünde (14/19) EGFR ekspresyonunu ortaya koymuştur. Ayrıca, in vitro çalışmalar, FMC’ye benzer şekilde, EGF ilavesinin oral SCC hücre hatlarının proliferasyon oranını artırdığını ve bunun da işlevsel EGFR yolağını akla getirdiği görülmüştür [82]. Bununla birlikte, kedi SCC’sinde EGFR ekspresyonunun prognostik önemi henüz netlik kazanmamıştır. Daha küçük çaplı bir çalışmada, kedilerde kafadaki kutanöz SCC’de (n = 19) tek değişkenli analizde EGFR immünoekspresyonu ile daha kısa DFI ve OS arasında istatistiksel olarak anlamlı bir korelasyon tespit edilirken [119], oral (n = 22) SCC’de EGFR ekspresyonu ile prognoz arasında bir ilişki bulunamamıştır [118].
Buna karşılık, daha geniş kapsamlı bir çalışma (n = 67) daha yüksek EGFR ekspresyon skoruna sahip kedi oral SCC’sinde (FOSCC) daha iyi sağkalım trendi olduğunu göstermiştir. Çalışmada, küçük örneklem boyutu, tümör evresi açısından hasta heterojenliği ve potansiyel olarak yanlışcut-off noktası dahil olmak üzere beklenmedik sonuçların olası nedenleri tartışılmıştır [117]. Ayrıca, HER2 ekspresyonu iki FOSCC hücre hattında Western blot, immünositokimya ve RT- PCR ile belgelenmiştir [82]. Son olarak, bir çalışmada 24/27 (%89) kedi oral ve kutanöz SCC’de PDGFR-a’nın immünohistokimyasal ekspresyonunun yanı sıra çeşitli anjiyojenik büyüme faktörleri de belgelenmiştir. Tümör lokasyonu PDGFR-a ekspresyonunu ciddi ölçüde etkilememiştir [120].
Bildiğimiz kadarıyla, RTK’ları kodlayan genlerdeki mutasyonlar kedi SCC’sinde henüz rapor edilmemiştir. Çoklu hücre dizilerinin sıralanması, bazı yazarların FOSCC’deki Egfr düzensizliğinin TK alanındaki mutasyonlardan kaynaklanmayabileceğini öne sürmesine sebep olan vahşi tip Egfr genotipini ortaya çıkarmıştır [121,122].
Kedi Skuamöz Hücreli Karsinomlarında Tirozin Kinazların Hedeflenmesi
Dört çalışma TKI’lerin FOSCC hücre hatları üzerindeki etkilerini değerlendirmiştir [82,121,123,124]. Egfr geninin RNA interferansı ile devre dışı bırakılması hücre proliferasyonu ve koloni oluşumu üzerinde derin bir etkiye sahip olduğundan, EGFR’nin önemli bir onkojenik faktör olduğu öne sürülmektedir ve bu da EGFR hedeflemenin FOSCC’de tedavi edici bir potansiyele sahip olabileceğini göstermektedir [121]. EGFR’yi hedefleyen TKI olan Geftinib, laringeal SCC hücre hattında hücresel proliferasyon ve migrasyonda azalma göstermiştir, ancak in vivo olarak elde edilmesi mümkün olmayan nispeten yüksek oranlarda [82,121]. Yazarlar ayrıca, endotelden mezenkime geçişi andıran ve kısmen hücre morfolojisindeki değişiklikle karakterize edilen geftinib direnci oluşumunu da belgelemişlerdir [121,124]. FMC hücre hattında olduğu gibi, FOSCC hücre hatları da ikili EGFR ve HER2 inhibitörü GW583340’tan daha fazla etkilenmiştir [82]. Yakın zamanda yapılan bir çalışma da üç kedi SCC hücre hattında (laringeal, gingival, lingual) anti-EGFR insan mAb cetuximab tarafından hücre proliferasyonunun bozulduğunu göstermiştir [122]. Bunun dışında, masitinib KIT inhibisyonu ile hücre proliferasyonunu inhibe ederken aynı zamanda COX-2 ekspresyonunu daartırmaktadır [123], bu da tedavi direnci için potansiyel bir mekanizma ve masitinibin bir COX
inhibitörü ile kombine edilmesi için geçerli bir zemin oluşturmaktadır.
Klinik ortamda, imatinib ve toceranibin kedi SCC’si üzerindeki etkinliği araştırılmış ve
farklı sonuçlar elde edilmiştir. İmatinib, FOSCC’li üç kedide hiçbir etki göstermemiştir [78]. Öte yandan, bir çalışmada FOSCC’li kedilerde toceranibin etkileri retrospektif olarak değerlendirilmiştir [125]. Steroid olmayan antienflamatuvar ilaçlarla (NSAID’ler) birlikte veya tek başına toceranib kullanılan tedavi, 23 kedilik bir grupta %56,5’lik bir biyolojik yanıt oranıyla (1 CR, 2 PR, 10 SD, 10 PD) sonuçlanmıştır. Ayrıca, toceranib alan kediler, toceranib tedavisi almayan 23 kediden oluşan gruba (45 gün) kıyasla önemli ölçüde daha uzun ortalama sağkalım süresi (123 gün) göstermiştir. Bununla birlikte, uzun süreli sağkalım hayal kırıklığı yaratmaya devam etmiştir; bir yıl sonra sadece 3 kedi (%6,5) hayatta kalmıştır ve bunların hepsi NSAID’lerle birlikte toceranib almıştır [125]. Bir vaka raporunda, anal kese SCC için yapılan cerrahi rezeksiyon, adjuvan radyoterapi ve toceranib içeren multimodal bir tedavi ile 236 günlük progresyonsuz sağkalım elde edilmiştir [126].
3.2.4. Enjeksiyon Yeri Sarkomları
Kedi Enjeksiyon Yeri Sarkomlarında Tirozin Kinaz Ekspresyonu
Histolojik olarak, çoğu kedi enjeksiyon yeri sarkomu (FISS) FSA’lardır, ancak diğer sarkom alt tipleri de rapor edilmiştir [127,128]. FISS’lerde KIT, PDGFR, PDGFR-B, EGFR, VEGFR ve HER2 ekspresyonu incelenmiştir [18,55,129-133]..
Üç çalışma, toplam 81 kedide FISS’lerde ve diğer yumuşak doku FSA’larında KIT’in immünohistokimyasal ekspresyonunu araştırmıştır [129-131]. KIT immünoreaktivitesi kedilerin %0-26’sında (0/14; 4/21; 12/46) gözlenmiş, en yüksek ekspresyon oranı FISS olarak kabul edilmeyen vakalarda bulunmuş ve bir çalışmada tüm tümörlerin sadece %9’u (4/46) güçlü reaksiyon göstermiştir [131]. KIT ekspresyonu 17 FISS vakası için spesifik olarak açıklanmamış olsa da, FISS’ler ve diğer yumuşak doku FSA’ları arasında KIT immünoreaktivitesi açısından önemli bir fark bulunmamıştır.
Ayrıca, KIT immünoreaktivitesi ile sağkalım süresi arasında anlamlı bir korelasyon bulunmamıştır, bu da KIT dışındaki faktörlerin kedilerde yumuşak doku FSA’larının tümörijenezine katkıda bulunabileceğini düşündürmektedir [131]. Bu hipotez, 14 vakada KIT ekspresyonu bulunmayan başka bir çalışma tarafından da desteklenmektedir [129].
FISS tümörigenezinde PDGFR’nin rolü olduğu öne sürülmüştür [18,55,133]. FISS’de EGFR ve VEGFR ekspresyonu ile birlikte PDGFR’nin yüksek immünohistokimyasal ekspresyonu görülmüştür [55,129,133]. İlginç bir şekilde, enjeksiyon yeri kökenli olmayan sarkomlar PDGFR ve EGFR’nin immünohistokimyasal ekspresyonunu göstermemiştir [133]. Ayrıca, PDGFR-p Western blot analizi yoluyla birkaç FISS hücre hattında ve bir yumuşak doku FSA hücre hattında da tespit edilmiştir [18,132].
Şimdiye kadar çok az sayıda çalışma FISS ve genel olarak kedi yumuşak doku sarkomlarının genetiğini araştırmıştır [134]. Yapılan bir çalışmanın yazarları, c-kit de dahil olmak üzere kanserle ilişkili birkaç önemli genin DNA kopya sayılarındaki dengesizlikleri tespit etmek için genom çapında bir oligonükleotid mikroarray platformu kullanmıştır [135]. Bu derlemenin yazarlarının bilgisi dahilinde, FISS’de RTK’ları kodlayan genlerdeki mutasyonlara ilişkin herhangi bir yayın bulunmamaktadır.
Kedi Enjeksiyon Bölgesi Sarkomlarında Tirozin Kinazların Hedeflenmesi
En eski çalışmalardan birinde, imatinibin in vitro PDGFR-p’nin PDGF ile indüklenen otofosforilasyonunu inhibe ettiği gösterilmiştir. Sadece FISS hücre hatlarının canlılığını azaltmakla kalmamış, aynı zamanda bir ksenograft murin modelinde FISS’in büyümesini kontrollere kıyasla ciddi ölçüde inhibe etmiştir. Ayrıca, imatinibin doksorubisine ve (daha az ölçüde) karboplatine karşı in vitro kemosensitiviteyi artırdığı bulunmuştur [18]. Bununla birlikte, klinik ortamda, günde 1-10 mg/kg dozunda imatinib, dört kedide yalnızca ortalama 2
ay boyunca stabil hastalık sağlamıştır [78].
İmatinibe benzer şekilde, masitinibin de PDGFR-p’nin otofosforilasyonunu inhibe ettiği ve
iki FISS hücre hattında doza bağlı bir şekilde hücre proliferasyonunu önemli ölçüde inhibe ettiği gösterilmiştir [132]. Bununla birlikte, IC50 değerleri PDGFR eksprese eden insan hücre hatları için bildirilenlerden çok daha yüksektir [136] ve bu dozlar muhtemelen kediler için toksik olacaktır [132]. Aynı araştırma grubu başka çalışmalarda da benzer veriler bildirmiş ve masitinibin üç FISS hücre hattında radyosensitiviteyi artırmadığını bulmuştur [137,138]. Sadece tek bir vaka raporunda, tekrarlayan FISS’in (malign fibröz histiyositoma) birkaç yıl boyunca masitinib ile başarılı şekilde adjuvan tedavi uygulandığını bildirmektedir [139].
Bugüne kadar sadece bir çalışmada, rezeke edilemeyen tümörleri olan 18 kedide FISS tedavisinde toceranib kullanımı değerlendirilmiş ve 3,25 mg/kg EOD hedef dozunda uygulanmıştır [129]. Sonuçlar hayal kırıklığı yaratmış, 13/14 kedide ortalama 43 gün sonra PD görülmüştür (dört kedi sansürlenmiştir). Özellikle, bir kedi toceranib öncesinde palyatif radyoterapi almış ve nedeni bilinmeyen paraparezi nedeniyle ötenazi edilmeden önce yaklaşık 130 gün boyunca SD’de kalmıştır. Yazarlar, tümörlerin çoğunun immünohistokimyasal olarak PDGFR eksprese etmesine rağmen, sadece %35’inin (5/14) hem PDGFR hem de ligandı olan PDGF’yi birlikte eksprese ettiğini öne sürerek FISS’de PDGF/PDGFR yolağının önemine dair itirazda bulunmuşlardır [129]. Ancak yakın zamanda yapılan bir araştırmada, incelenen 14 FISS örneğinin tamamında PDGFR- a ve PDGFA’nın immünoekspresyonu tespit edilmiştir [55]. Bu tutarsızlık, önceki çalışmada kullanılan izoform belirtilmediğinden, farklı PDGFR izoformlarının (örn. a vs. p) kullanılmasına bağlanabilir.
3.2.5. Gastrointestinal Stromal Tümörler
Gastrointestinal stromal tümörler (GIST’ler) kedilerde son derece nadirdir ve az sayıda
vaka raporu yayınlanmıştır [140-143]. İnsanlarda [144] ve köpeklerde [14,145] olduğu gibi, kedilerde de c-kit geninin 11. ekzonunda bir delesyon ve KIT için immünoreaktivite tespit edilmiştir [56,140,143], bu da kedi GIST’lerinin tümörijenezinde benzer bir rol olduğunu düşündürmektedir.
Tek bir vaka raporunda, rezeke edilemeyen bir gastrik GİST’in 18 aydan uzun bir süre boyunca toceranib ile tıbbi yönetimi ve kedinin hastalığının stabil kalması (maksimal tümör çapında %29,5 azalma) rapor edilmiştir [141]. Başka bir vaka raporunda, imatinib ve toceranib de ince bağırsak GİST’inde SD sağlamış, ancak her iki tedavi de yan etkiler (ilaç kesildikten sonra düzelen hiperbilirubinemi) nedeniyle kesilmiştir. Bu kedide c-kit ve PDGFRA genlerinde işlev kazanma mutasyonları tespit edilmemiştir [142].
3.2.6. Diğer Maligniteler
Yukarıda belirtilen tümörlerin dışında, TK ekspresyonu ve/veya TKI tedavisi şu
hastalıklarda araştırılmıştır: kedi pulmoner karsinomları [146,147], endometriyal adenokarsinom [46], kedi histiyositik hastalıkları [54], renal hücreli karsinom [58,59,148,149], iris melanomları [150], granüloza hücreli tümörler [56], adrenal korteks karsinomu [56], tiroid bezi karsinomu [56], Non-Hodgkin lenfoma [56], gastrointestinal sistem leiomyosarkomu [140, 151,152], osteosarkom [57], oligodendroglioma ve subependymoma [153], kolonik malign periferik sinir kılıfı tümörleri [154] ve gemistositik astrositom [155], Merkel hücreli karsinom [156], pankreatik adenokarsinom [157,158], kemodektom [159], trakeal adenokarsinom [160] ve hipereozinofilik sendrom [161].
Yakın zamanda yapılan bir çalışmada, 13 kedi pulmoner karsinomunda IHC ile HER2 ekspresyonu ve ISH ile Her2 gen amplifikasyonu araştırılmıştır [146]. HER2 aşırı ekspresyonu ve amplifikasyonu vakaların sırasıyla %15 ve %27’sinde tespit edilmiş ve aşırı ekspresyon herzaman gen amplifikasyonuna karşılık gelmiştir. HER2 aşırı ekspresyonu, amplifikasyonları ve mutasyonları, insan küçük hücreli dışı akciğer karsinomlarında (NSCLC) olası terapötik etkileri ile iyi karakterize edilmiştir [162,163] ve kedilerde de potansiyel olarak görülebilir. Benzer şekilde, 5/24 (%21) kedi pulmoner karsinomunda mutant EGFR protein ekspresyonu tespit edilmiş, ancak prognostik etkisi değerlendirilememiştir [147].
HER2 immünoekspresyonu 20/34 (%59) kedi endometriyal adenokarsinomunda (FEA) da görülmüştür. Ancak, HER2 ekspresyonu ile nükleer atipi, mitotik sayı ve miyometriyum, seroza ve vasküler invazyon gibi çeşitli patolojik özellikler arasında bir korelasyon bulunmamıştır. Sonuç olarak, HER2’nin FEA’nın progresyonu ve prognozu üzerindeki etkisi sorgulanmıştır [46]. Öte yandan, kistik endometriyal hiperplazi-piyometra kompleksi olan iki kedinin hiperplastik endometriyal poliplerinde HER2’nin immünoekspresyonu da bildirilmiş ve endometriyal hiperplazi patogenezinde potansiyel rolünü düşündürmüştür [47,164].
Bir çalışmada, çeşitli kedi histiyositik hastalıklarının 15 vakasında (beş kedi progresif histiyositozu, sekiz histiyositik sarkom ve iki hemofagositik histiyositik sarkom) IHC ile PDGFR-p ve KIT ekspresyonu araştırılmıştır [54]. PDGFR-p ekspresyonu vakaların %87’sinde gözlenmiş ve %66’sı güçlü pozitif boyanma sergilerken, örneklerin hiçbirinde KIT boyanması tespit edilmemiştir. Tanı konulduktan sonra 300 günden daha uzun süre hayatta kalan kedilerin neredeyse tamamı yüksek PDGFR-p ekspresyonu göstermiştir ve yazarlar bunu muhtemelen daha yüksek tümör farklılaşmasına bağlamıştır. Histiyositik sarkomu ve progresif histiyositozu olan iki kedi, sırasıyla 110 ve 223 gün boyunca masitinib ile CR elde etmiştir. İkinci kedi toceranib’e geçirilmiş ve 1800 gün sonra PD’ye rağmen hayatta kalmıştır. Ancak TKI alan kedi sayısının sınırlı olması nedeniyle PDGFR- ekspresyonu ile TKI’lere yanıt arasındaki korelasyon değerlendirilememiştir. Yazarlar PDGFR-‘yi prognostik potansiyele sahip olası bir farklılaşma belirteci olarak ileri sürmektedir [54]. Şaşırtıcı olmayan bir şekilde, bir kedideki oküler histiyositik sarkom vakası da KIT için immünonegatifti [165].
İki çalışma [58,59], bir vaka serisi [148] ve bir vaka raporu [149] renal hücreli karsinomların immüno-histokimyasal profillerini araştırmıştır.
KIT’in yaygın sitoplazmik immünoekspresyonu 23/37 (%62, aralık %0-92) vakada belgelenmiştir. Ekspresyon oranlarındaki farklılıklar farklı antijen alma yöntemlerinden kaynaklanıyor olabilir [58]. Ayrıca, VEGFR-2 immünoekspresyonu 4/4 vakada gösterilirken, ligandı VEGF 2/4 vakada pozitif bulunmuştur; bu da potansiyel olarak farklı tümörler arasındaki değişken aktiviteyi yansıtmaktadır [148].
Çeşitli çalışmalar, farklı kedi malignitelerinde KIT ekspresyonunu ve potansiyel terapötik etkilerini araştırmıştır [56,57,150,156,166]. İmmünofloresan analizi, 57 kedi diffüz iris melanomunda KIT’in aşırı ekspresyonunu ortaya çıkararak bu tümörlerin tümörijenezinde olası bir rol ve potansiyel bir terapötik hedef olduğunu düşündürmüştür [150]. Bununla birlikte, 11 iris melanomunda ve bir konjonktival melanomda c-kit genetik bölgelerinde herhangi bir mutasyon tespit edilmemiştir [166].
Buna karşılık, tek bir granüloza hücreli tümör vakasında zayıf bir immünohistokimyasal KIT ekspresyonu gösterilirken [56], gastrointestinal leiomyosarkom (n = 1), endometriyal adenokarsinom (n = 1), adrenal korteks karsinomu (n = 1), tiroid bezi karsinomu (n = 1) ve Non- Hodgkin lenfomada (n = 2) KIT ekspresyonu tespit edilmemiştir. Benzer şekilde, bir duodenal leiomyosarkom [151] ve bir özofageal anjiyoleiomyosarkom [152] vakasında da KIT immünoekspresyonu gözlenmemiştir.
Ayrıca, dört kedi osteosarkomu (OSA) vakasında KIT’in immünohistokimyasal ekspresyonu tespit edilmemiştir. Bu, köpek OSA’sından elde edilen sonuçlarla çelişmekte ve her iki türde de OSA’nın tümörijenezinde KIT’in farklı bir rolü olduğunu göstermektedir [57].
Yakın zamanda yapılan bir çalışmada, kedi oligodendrogliomları ve subepandimomları PDGFR-a bakımından immünopozitif bulunmuştur [153]. Ayrıca, karaciğer metastazı olan nadir bir kolonik malign periferik sinir kılıfı tümörü vakası, KIT yönünden silik immünoreaktivite göstermiş ve S-100 için pozitif boyanma ve KIT boyanmasının kesin olmayan doğasına dayanarak GIST’in dışlanmasına yol açmıştır [154]. Ayrıca, başka bir nadir vaka raporunda, bir omurilik gemistositik astrositomu EGFR için immünonegatif bulunmuştur [155]. Kedi (ve köpek) Merkel hücreli karsinomlarından oluşan bir vaka serisinde, üç kedi örneğinin tümü KIT için pozitif reaksiyon vermiş, ancak lenfoid köken gösterilememiştir [156].
Terapötik müdahaleler bağlamında, iki vaka raporunda pankreas adenokarsinomlu kedilerin adjuvan veya tek ajan toceranib kullanılarak tedavi edildiği ve sırasıyla 1436 ve 792 günden fazla sağkalım süreleriyle sonuçlandığı rapor edilmiştir [157,158]. Benzer şekilde, tek bir vaka raporunda, bir kaval kemodektomun cerrahi eksizyonunu takiben toceranib ile bir yıl süren adjuvan tedavi tanımlanmış ve 2,5 yıllık bir sağkalım süresiyle sonuçlanmıştır [159]. Başka bir vaka raporunda, bir kedi trakeal adenokarsinoma karşı multimodal tedavinin bir parçası olarak dört ay boyunca toceranib almış ve 755 günlük bir sağkalım süresiyle sonuçlanmıştır [160]. Son olarak, hipereozinofilik sendromlu bir kediyi tedavi etmek için günde 9,6 mg/kg reçete edilen dozda imatinib kullanılmıştır. Başlangıçtaki klinik iyileşme ve periferik eozinofil sayısının normalleşmesinden sonra, minimal değişiklik glomerülopatisi gelişmesi nedeniyle tedavi sekiz hafta sonra kesilmiştir [161].
3.3. Neoplastik Olmayan Hastalıklar
Masitinibin (günde 50 mg), deneysel olarak astım hastası olan 12 kedinin bronkoalveolar lavaj sıvısındaki eozinofil sayısını ve toplam protein seviyesini plasebo kontrollerine kıyasla azalttığı gösterilmiştir [167]. Pulmoner mekanik test sonuçları da tedavi edilen kedilerde solunum uyumunun arttığını göstermiştir. Yazarlar bu bulguları göz önünde bulundurarak, kedilerin insan tıbbı için bir model olarak hizmet edebileceğini öne sürmüşlerdir [167]. Gerçekten de, masitinib şiddetli astımı olan insanlarda umut vaat ettiğini göstermiştir [168].
Oklasitinibin kedi alerjik dermatitine karşı etkinliği çeşitli çalışmalarda ve en az 53 kedide değerlendirilmiştir [169-171]. Günde bir veya iki kez 1 mg/kg’lık ortalama dozlar, kedilerin sırasıyla %60-88’inde ve %61-70’inde doğrulanmış Kedi Alerjik Dermatit Skorlaması (SCORFAD) [172] ve Pruritus Görsel Analog Ölçeği (PVAS) [173] skorlarını >%50 azaltmıştır [169,170]. Etkiler daha az belirgindi ancak günde iki kez 0,5 mg/kg dozlarda hala görülebiliyordu [171]. Metilprednizolon ile karşılaştırıldığında, ikincisi daha iyi performans göstermiştir, ancak oklasitinib glukokortikoidler kontrendike olduğunda yararlı bir alternatif olabilir [169].
3.4. Kedilerde Yaygın Olarak Kullanılan Tirozin Kinaz İnhibitörlerinin Farmakokinetiği, Güvenliği ve Toksisitesi
3.4.1. Toceranib
Toceranib, VEGFR, PDGFR, Flt-3 ve KIT dahil olmak üzere RTK’ların split-kinaz domain ailesinin çeşitli üyelerinin güçlü ve seçici bir inhibitörüdür [174]. Bu derlemenin yazarları, kedilerde toceranib farmakokinetiğini değerlendiren hiçbir çalışma bulamamıştır. Tek vaka raporları hariç olmak üzere, birkaç retrospektif [77,125,175-177] ve prospektif [129] çalışma toplam 195 kedide toceranibin güvenliğini değerlendirmiştir. Toceranib çoğunlukla 2,5-2,78 mg/kg dozunda haftada üç kez veya EOD olarak reçete edilmiş ve genellikle iyi tolere edilmiştir [77,125,175-177]. Sadece prospektif bir çalışmada 3,25 mg/kg EOD doz programı kullanılmış ve iyi tolere edilebilirlik ve genellikle hafif ve geçici yan etkiler bildirilmiştir [129]. En sık bildirilen yan etkiler 195 kediden 91’inde (%47) anoreksi, kusma, diyare veya bunların bir kombinasyonu gibi semptomlarla karakterize hafif (VCOG grade 1 ve 2) gastrointestinal rahatsızlıklardır.
Özellikle, bazı çalışmalar oral SCC’li [125,176,177] ve visseral ve gastrointestinal MCT’li [77,176] kedileri de değerlendirdiğinden, bu yan etkilerin bazıları birincil hastalığa da atfedilebilir. Yaygın olarak letarji, hafif hematolojik (nötropeni, lenfopeni, anemi, trombositopeni) ve biyokimyasal (alanin aminotransferaz [ALT] ve azotemide artış) anormallikler bildirilmiştir. VCOG grade 3 ve 4 yan etkiler 195 kedinin 22’sinde (%11) gözlenmiş, bu vakaların 12’sinde (%55) ALT artışı görülmüştür. Grade 3 ve 4 ALT yükselmesi olan 12 kediden en az 7’si haftada üç kez veya daha fazla 3.08 mg/kg toceranib dozu almıştır. Köpeklerde toceranibin klirensi öncelikle hepatiktir [178] ve aynı durum kediler için de geçerli olabilir. Kedilerdeki daha yüksek karaciğer toksisitesinin, bozulmuş glukoronidasyon mekanizmalarından kaynaklanabileceği öne sürülmüştür [176].
One study reports two cases of grade 5 toxicities (azotemia and anemia) resulting in death in cats with visceral MCTs. However, the authors suspected neither of these events were related to toceranib administration [77]. One cat had received toceranib for 149 weeks prior to developing azotemia [77].
Bir çalışmada visseral MCT’li kedilerde ölümle sonuçlanan iki grade 5 toksisite (azotemi ve anemi) vakası bildirilmiştir. Ancak yazarlar bu olayların hiçbirinin toceranib uygulamasıyla ilişkili olmadığını düşünmektedir [77]. Bir kedi azotemi gelişmeden önce 149 hafta boyuncatoceranib almıştır [77].
Birkaç çalışmada nadiren uzun süreli uygulama yapılan vakalar (100 hafta veya daha fazla) bildirilmiş olsa da, hiçbiri kedilerde toceranibin uzun süreli güvenliğini özel olarak değerlendirmemiştir [77,175,177].
Üriner protein:kreatinin oranı (UPC) ile idrar analizleri 30 kedide değerlendirilmiştir [125,129]. Bir çalışmada 12/18 kedide idrar çubuğu ile ölçülen grade 1 ve 2 proteinüri rapor edilmesine rağmen, UPC sadece bir vakada hafif derecede yükselmiştir (>0.8) [129]. Başka bir çalışmada, mevcut verilere sahip 12 kedinin hiçbirinde önemli proteinüri (UPC > 0,4) görülmemiştir [125].
Tek bir vaka raporu, 14 aylık toceranib tedavisinden sonra tüylerde hipopigmentasyon geliştiğini belgelemektedir [157]. Benzer şekilde, köpeklerde de deri depigmentasyonu bildirilmiştir [179].
Masitinib
Masitinib en etkili ve seçici olarak KIT TK’yı ve daha az ölçüde PDGFR, Lyn ve fibroblast büyüme faktörü reseptörü 3’ü (FGFR3) hedef alır [136]. Kedilerde, masitinibin oral uygulamadan sonra biyoyararlanımı daha düşüktür (%60’a karşı %80) ve köpeklerle karşılaştırıldığında daha kısa yarılanma ömrüne (3-5 saate karşı 10-20 saat) sahiptir [180]. Pik konsantrasyona iki saat sonra ulaşılır (~1 gM) ve bu da köpeklerdekinden daha düşüktür, ancak insan ve murin KIT’in bildirilen IC50 değerinin üzerindedir [24,180].
Tolerabilite 26 kedi üzerinde iki çalışmada [167,181] ve nadiren vaka raporlarında [139] değerlendirilmiştir. Günlük 50 mg/kedi veya EOD doz programı çoğunlukla iyi tolere edilmiştir. Bildirilen en yaygın yan etkiler kusma (10/20 kedi ve dört olay), ishal (3/20 kedi ve bir olay), nötropeni (3/26 kedi) ve proteinüridir (8/26 kedi). Proteinüri dışında, yan etkiler VCOG grade 1 veya 2 idi ve kendi kendini sınırlıyordu. Kedilerin %30’unda pro-teinüri kaydedilmiştir (ikisinde VCOG grade 3 [181] ve 6/6’sında “orta ila şiddetli” [167]). Bununla birlikte, EOD programındaki kedilerin hiçbirinde proteinüri gelişmemiş ve daha da önemlisi, tüm vakalarda masitinibin kesilmesinden sonra proteinüri kendiliğinden düzelmiştir. Bu çalışmalardaki kediler ya sağlıklı (n = 20) [181] ya da deneysel olarak indüklenmiş astıma sahip (n = 6) [167] olduğundan, yan etkiler muhtemelen masitinib ile ilişkilidir.
Çalışma sırasında serum kreatinini artmış ve serum albümini başlangıç seviyesine göre önemli ölçüde azalmış, ancak referans aralıkta kalmıştır [181]. Bir kedi için ALT’de kendi kendini sınırlayan bir artış rapor edilmiştir. Her iki çalışma da sadece 4 hafta sürdüğünden, masitinibin kedilerdeki uzun vadeli etkileri ve toksisitesi yeterince belgelenmemiştir.
Tek bir vaka raporunda, bir kedi tedavinin ilk ayında hafif bulantı ve kusma dışında herhangi bir klinik yan etki olmaksızın 50 mg (12,5 mg/kg) EOD dozunu bir yıldan fazla tolere etmiştir [139]. Ancak, klinikopatolojik veri sağlanmamıştır.
Imatinib
İmatinib, BCR-ABL TK inhibitörü olarak geliştirilmiştir ve BCR-ABL, KIT, PDGFR, koloni
uyarıcı faktör 1 reseptörü, ABL1, ABL2, diskoidin alan reseptörü 1/2 ve lenfosit spesifik protein tirozin kinazı hedef alır [182,183]. Bu derlemenin yazarlarına göre kedilerde imatinib farmakokinetiğini değerlendiren herhangi bir çalışma bilinmemektedir.
Tolere edilebilirlik, doz artışı yapılan bir çalışmada [78], bir prospektif çalışmada [19] ve çok sayıda vaka raporunda [17,79,161,184] 26 kedide rapor edilmiştir. Doz aralığı genişti (günde 1-15 mg/kg) ve yan etkiler tutarsız bir şekilde rapor edilmişti. İki büyük çalışmada [19,78] ortalama tedavi süresi 9 hafta olmuştur. En yaygın kullanılan dozaj günde 10 mg/kg idi. İmatinib genellikle iyi tolere edilmiş, sadece nadiren ve hafif yan etkiler (VCOG grade 1 kusma ve uyuşukluk) [78] ve tek bir vakada hafif ila orta şiddette AST ve ALT artışı görülmüştür [19]. Bir kedide günlük 1 mg/kg tedaviye başladıktan iki hafta sonra grade 4 ALT artışı görülmüştür, ancak kedi daha önce çoklu dozlarda lomustin, gemsitabin ve karboplatin içeren bir tedavi aldığı için imatinib ile nedensel ilişkisi belirsizdir [78]. Köpeklerde masitinib ile ilgili bildirilen vakalara benzer şekilde [185,186], bir kedi vaka raporunda imatinib ile günlük 9,6 mg/kg tedaviye başlandıktan sonraki iki ay içinde minimal değişiklik glomerülopatisi geliştiği belgelenmiştir [161]. İmatinib kesildikten sonra proteinüri kısmen düzelmiştir. Son olarak, insan tıbbında imatinib kullanımı ile iyi bilinen bir fenomen olan kardiyotoksisitenin [187,188] kedilerde (henüz) bildirilmediğini belirtmek gerekir.
Oclacitinib
Oclacitinib, Janus kinaz 1’in seçici bir inhibitörüdür ve köpeklerde atopik dermatit ve
alerjik kaşıntının klinik belirtilerinin tedavisi için kullanım ruhsatına sahiptir [189]. Oklasitinibin farmakokinetiği [190] ve güvenliği, sırasıyla 6 ve 80 kedide yapılan çeşitli prospektif [169-171,191] çalışmalarda değerlendirilmiştir. Oral 1 mg/kg uygulamasından sonra, ilaç yüksek ve hızlı emilim ve eliminasyon göstermiş, 35 dakika içinde ortalama %87 biyoyararlanıma ve köpeklerde gözlenen farmakokinetiğe benzer şekilde 2,3 saatlik bir yarılanma ömrüne [190] ulaşmıştır [192].
Kedilerin çoğunluğu dört hafta boyunca günde iki kez 0,5-2 mg/kg’lık ortalama dozları çok iyi tolere etmiştir. Gözlenen yan etkiler ara sıra hafif, ancak VCOG derecelendirmesinde olmayan kusma ve yumuşak dışkı iken, hematolojik ve biyokimyasal anormallikler arasında bir adet grade 3 anemi vakası, iki adet grade 4 ALT artışı ve dört adet grade 1 ve 2 azotemi vakası yer almıştır [169,170,191]. Okrasitinib kesildikten sonra anemi düzelmiştir [170]. Ayrıca, periferik lenfadenopati ile ilgili anekdot niteliğinde raporlar vardır [191].
Bir raporda, beş aylık oklasitinib tedavisinden sonra ölümcül dissemine toksoplazmoz vakası rapor edilmiştir. Bununla birlikte, kedi aynı zamanda kedi immün yetmezlik virüsü bakımından da pozitif olduğundan, oklasitinibin toksoplazmoz duyarlılığına katkısı tam olarakbelirlenememiştir [193].
Tanımlanan dört TKI’nin en yaygın yan etkilerinin bir özeti Tablo 3’te sunulmuştur.
Tartışma
Bu derlemenin amacı, kedilerin neoplastik ve neoplastik olmayan dokularında çeşitli TK’lerin ekspresyonunun yanı sıra evcil kedilerde TKI’lerin kullanımına ilişkin kapsamlı bir genel bakış sağlamaktır. Araştırmamızda tespit edilen önemli sayıda çalışmaya rağmen, derlememiz kedilerde TK’ler ve TKI’ler hakkındaki mevcut bilgilerimizin hala çok sınırlı olduğunu göstermektedir. Derlememiz, kedi onkolojisinde TK’ler ve TKI’lerle ilgili mevcut bilgi eksikliklerini ve tartışmaları ortaya koymakta ve bu alanda daha fazla araştırma yapılması gerektiğini vurgulamaktadır. Normal kedi dokularındaki TK ekspresyonu analizimizde, çeşitli çalışmaların TK’lerin normal işleyişini ve hücresel süreçlerdeki sinyal yolaklarını anlamamıza katkıda bulunduğunu gördük. Araştırmacılar, normal ve hastalıklı dokular arasındaki TK ekspresyon seviyelerini karşılaştırarak, belirli hastalıkların varlığını veya ilerlemesini gösteren potansiyel biyobelirteçleri belirleyebilirler. Normal dokularda TK ifadesinin incelenmesi, hangi TK’ların yaygın olarak ifade edildiğini ve hangilerinin hastalık koşullarında benzersiz veya aşırı ifade edildiğini belirlemeye yardımcı olur. Bu bilgi, TKI’ler gibi düzensiz TK’lerin aktivitesini spesifik olarak modüle eden hedefe yönelik tedaviler geliştirmek için hedef tanımlamaya yardımcı olur. Normal dokularda TK ekspresyonu bilgisi, araştırmacılara TKI’lerin potansiyel hedef dışı etkilerini belirlemede ve güvenlik profillerini değerlendirmede de yardımcı olur. İncelememiz, normal kedi dokularında KIT ekspresyonunun iyi karakterize edildiğini [56], piyasada bulunan TKI ile hedeflenen bir başka TK olan PDGFR ve HER2 (ErbB2) ekspresyonunun halen yeterince iyi tanımlanmadığını göstermiştir. Bu nedenle, normal kedi dokularında PDGFR ve HER2 (ErbB2) ekspresyonuna odaklanan daha sonraki çalışmalar, hastalık koşullarındaki rollerini ve TKI’lerin potansiyel hedef dışı etkilerini aydınlatmak için son derece faydalı olacaktır.
Kedi malignitelerinde TK ekspresyonu araştırmamızda, TKI ekspresyonunun 21 farklı tümör tipinde araştırılmış olmasına rağmen, bu kayıtların neredeyse yarısının ya tek vaka olduğunu ya da sadece tek bir TK ekspresyonunun (KIT veya EGFR) eksikliğini bildirdiğini gördük. Meme karsinomları, MCT’ler, SCC’ler ve FISS’ler en sık çalışılan tümör tipleridir. Bu tümör tiplerinde TK’ların ekspresyonu ve klinik etkilerinin anlaşılmasında bazı ilerlemeler kaydedilmiş olsa da, önemli bilgi boşlukları hala mevcuttur.
Örneğin, MCT’lerde RTK KIT ekspresyonu ve bunun prognozla ilişkisi araştırılmıştır. RTK KIT proteini, kedi mast hücresi tümörlerinde farklı lokasyonlarda eksprese edilir ve sitoplazmik ekspresyon kutanöz formda daha kötü bir prognozla bağlantılıdır [62,63]. Prognostik önemin yalnızca tek değişkenli analizde belgelendiğini belirtmek gerekir. Daha sonra yapılacak araştırmalar, altta yatan mekanizmaları ve sitoplazmik ekspresyonun hastalığın ilerlemesi ve hasta sonuçları üzerindeki spesifik etkisini araştırabilir. Bu, sitoplazmik KIT ekspresyonu ve prognoz arasındaki ilişkiyi doğrulamak için çeşitli MCT vakaları popülasyonu ile daha büyük ölçekli çalışmaları kapsayabilir.
Kedi MCT’lerinin önemli bir yüzdesinde c-kit geninde mutasyonlar mevcuttur [17,19,20,63,65,67,74], ancak bunların sağkalım ile ilişkisi henüz kanıtlanmamıştır [65]. Gelecekteki araştırmalar, kedi MCT’lerindeki c-kit mutasyonlarının spesifik türlerini ve sıklıklarını ve bunların klinik sonuçlarla korelasyonunu anlamaya odaklanabilir. Bu, farklı c- kit mutasyonlarının prognostik önemi ve kedi MCT hastalarında tedavi yanıtı ve sağkalımı konusunda prediktif belirteçler olarak potansiyelleri hakkında değerli bilgiler sağlayabilir. MCT’li köpeklerde, son çalışmalar farklı ekzonlardaki mutasyonların prognozda farklılıkla ilişkili olabileceğini ortaya koymuştur [194,195].
Toceranib, imatinib ve daha az ölçüde olmak üzere masitinib MCT’lerin tedavisinde etkinlik göstermiştir [17,19,66,77-79], toceranib kedilerde %80’lik genel klinik fayda göstermiştir [77]. İleride yapılacak araştırmalar, bu TKI’lerin etkinliğini daha geniş MCT hasta kohortlarında karşılaştırarak yanıt oranlarını, progresyonsuz sağkalımı ve uzun vadeli sonuçları değerlendirebilir. Ayrıca, tedavi direnci veya nüks ile ilişkili faktörlerin araştırılması, tedavi stratejilerinin optimize edilmesine ve spesifik TKI’lere verilen yanıtın tahmin edilmesinde potansiyel biyobelirteçlerin belirlenmesine yardımcı olabilir. Köpek onkolojisinden, MCT’lerin TKI’lere heterojenlik ve değişken yanıtlar gösterebileceği bilinmektedir [24,25,196-198] ve TKI’leri ve diğer tedavi yöntemlerini (geleneksel kemoterapi, cerrahi veya radyoterapi gibi) içeren kombinasyon tedavilerinin araştırılması faydalı olabilir. Köpeklerde yapılan çalışmalar, toceranib ile vinblastin gibi konvansiyonel sitotoksik ajanları birleştirirken umut verici yanıt oranları göstermiştir [199-201]. Buna karşılık, lomustin ile kombinasyonun yüksek toksisite nedeniyle başarısız olduğu kanıtlanmıştır [202]. TKI’lerin diğer tedavilerle optimal sıralamasının araştırılması ve sinerjik etkilerinin değerlendirilmesi, tedavi sonuçlarının iyileştirilmesine yardımcı olabilir ve klinik karar verme sürecini etkileyebilir.
Çeşitli RTK’ların ekspresyonu en kapsamlı şekilde FMC’de incelenmiştir [44,81- 105,107,108]. Kedi meme karsinomları HBC ile benzerlikler gösterir ve HBC için bir model olarak önerilmiştir [44,81,86,89,91,93,96]. HER2 aşırı ekspresyonunun negatif prognostik etkisi HBC’de iyi belgelenmiş olsa da [203], araştırmanın mevcut durumuna dayanarak, HER2 ekspresyonu ve kedilerde prognoz ile korelasyonunu çevreleyen tartışmalar gözlemlenmiştir. FMC’de bildirilen HER2 ekspresyonu oranlarındaki tutarsızlıklar nedeniyle, antikorların seçimi, antijen alma teknikleri, skorlama sistemleri ve yorumlama dahil olmak üzere HER2 ekspresyonunu değerlendirmek için HBC’de [204] kullanıldığı gibi standartlaştırılmış yöntemler oluşturmak için daha fazla araştırmaya ihtiyaç vardır. Ayrıca, serum HER2 ve sf- RON ölçümlerinin kedilerde prognoz ve terapötik yanıtın bir belirleyicisi olarak potansiyel kullanımını kanıtlamak ve altta yatan biyolojik mekanizmaları incelemek için daha fazla araştırmaya ihtiyaç vardır.
TKI’ler FMC hücre proliferasyonunu in vitro olarak inhibe etmede etkinlik göstermiş olsa da, FMC’de klinik kullanımları araştırılmamıştır. İn vitro olarak yapılan sınırlı araştırma, beş TKI’nin FMC hücre hatlarında çeşitli etkinlik göstermesi ve bu tümörlerde fonksiyonel RTK’ların varlığına işaret etmesi nedeniyle umut verici sonuçlar göstermiştir [82,83,112]. İkili EGFR ve HER2 inhibitörü GW583340, FMC hücre hatlarında hücre proliferasyonunda en etkili azalmayı sergilemiştir [82], ancak aynı zamanda gefitinib, lapatinib ve daha az ölçüde neratinib FMC hücre hatlarında sitotoksik potansiyel göstermiştir [83,112]. Bu, TKI’lerin FMC’deki potansiyelini belgelemekte ve farklı TKI’lerin etkinliğini değerlendirmek için daha kapsamlı çalışmalara duyulan ihtiyacı vurgulamaktadır. Yazarlar, TKI’lerin klinik ortamda kullanımına ilişkin herhangi bir çalışma bulamadığından, gelecekteki araştırmalar, yukarıda belirtilen TKI’lerin ve potansiyel olarak toceranib’in FMC hastalarında güvenliğini, tolere edilebilirliğini ve terapötik sonuçlarını değerlendirmeye odaklanmalıdır. Bu özellikle önemlidir çünkü adjuvan konvansiyonel sitotoksik kemoterapinin FMC’deki rolü tartışmalıdır [205,206]. Keşfedilmesi gereken bir diğer tedavi seçeneği de mAb’lerin kullanılmasıdır. Her ne kadar hümanize mAb’ler in vitro ortamda ve FMC’nin ksenograft modelinde etkinlik göstermiş olsa da [113,116] ve kedi VEGF’si ile insan VEGF-A arasında %92’lik bir homoloji ve ayrıca bevacizumab’ın kedi VEGF’si ile immünoreaktivitesi gösterilmiş olsa da [207], veteriner hastalara sadece hümanize mAb’lerin uygulanmasının başarılı olması pek olası değildir. Olası komplikasyonlar arasında mAb’nin alıcının bağışıklık sistemi tarafından inaktive edilmesi veya (ciddi) yan etkilerin görülmesi sayılabilir [208,209]. Köpek EGFR’sine karşı kaninize edilmiş bir mAb üretimi ve bunun iki köpek meme hücre hattına karşı etkinliği gösterilmiştir [210], bu da böyle bir tedavinin kedilerde de uygulanabilir olabileceğini göstermektedir.
Bununla birlikte, mAb’lerin türetilmesi ve üretilmesinin maliyeti, veterinerlik tıbbı bir yana, insan tıbbında bile bir zorluk teşkil etmektedir [208]. Şu anda, kedilerde osteoartritik ağrının tedavisi için kedileştirilmiş bir anti-sinir büyüme faktörü mAb (frunevetmab) tescil edilmiş olsa da [211], hiçbir kedileştirilmiş anti-tümör mAb piyasada mevcut değildir.
Ayrıca, kedi oral ve kutanöz SCC’lerine ilişkin analizimiz, bu tümör tiplerinde TK ekspresyonuna ilişkin sınırlı araştırma olduğunu ortaya koymuştur [43,82,117-120]. FMC’ye benzer şekilde, FOSCC insan baş ve boyun SCC’si için spontan bir model olarak önerilmiştir [212]. Şu anda, kedi SCC’sinde EGFR ekspresyonunun prognostik önemi belirsizliğini korumaktadır [117-119]. Kedi SCC’sinde EGFR ekspresyonu ve prognoz arasındaki korelasyonu değerlendirmek için daha büyük örneklem boyutlarına ve standart metodolojilere sahip daha fazla çalışmaya ihtiyaç vardır. TKI’lerin SCC’lerdeki potansiyel terapötik önemi ve mevcut etkili konvansiyonel kemoterapötik ajanların eksikliği göz önüne alındığında [213], EGFR ve VEGFR gibi TK’lerin ekspresyon profillerine ilişkin daha fazla araştırma yapılması gerekmektedir. Bazı çalışmalar EGFR ve HER2 inhibitörlerinin kedi SCC hücre hatları üzerindeki inhibitör etkilerini göstermiş olsa da [82], bu inhibitörlerin in vivo modellerde ve klinik ortamda etkinliğini değerlendirmek için daha fazla araştırmaya ihtiyaç vardır. İmatinib ve toceranibin kedi SCC’sindeki etkinliği kesin değildir [78,125]. Kedi SCC’sinde bu tedavilerin etkinliğini ve uzun vadeli sağkalım sonuçlarını değerlendirmek için daha büyük örneklemli ve kontrollü klinik çalışmalar gereklidir. GW583340 [214] gibi ikili EGFR ve HER2 inhibitörlerinin etkilerinin araştırılması, kedi SCC’si için yeni tedavi yaklaşımları konusunda değerli bilgiler sağlayabilir. Benzer şekilde, cetuximab gibi mAb’ler, in vitro aktivitesinin son kanıtlarıyla desteklenen FOSCC tedavisinde çok değerli olabilir [122]. Kedi Egfr TK alanında bilinen mutasyonların olmaması, setuksimabın kedilerde etkili olabileceğini düşündürmektedir, çünkü bu mutasyonların bu ilacın insan baş ve boyun SCC hastalarında etkisini azalttığından şüphelenilmektedir [122,215].
FISS durumunda, KIT, PDGFR, EGFR ve VEGFR dahil olmak üzere TK’lerin ekspresyonu ve klinik etkileri araştırılmıştır [18,55,129-133]. Ancak, bu TK’ların FISS’deki prevalansını ve klinik etkilerini belirlemek için daha fazla çalışmaya ihtiyaç vardır. TK ekspresyonu ile FISS içindeki spesifik tümör alt tipleri arasındaki korelasyonun değerlendirilmesinin yanı sıra TKI’lerin daha geniş FISS hasta kohortlarındaki etkinliğinin değerlendirilmesi, FISS’deki TK ekspresyon paternlerinin ve tedavi seçeneklerinin daha kapsamlı bir şekilde anlaşılmasını sağlayacaktır. İmatinib, masitinib ve toceranib gibi TK inhibitörlerinin FISS tedavisindeki etkinliğini değerlendiren çalışmalar karışık sonuçlar vermiştir [18,78,129,132,137-139]. İmatinib in vitro olarak umut vaat etse de [18], sadece bir çalışmada bir TKI (toceranib) özellikle FISS’de klinik ortamda değerlendirilmiş ve hayal kırıklığı yaratan sonuçlar elde edilmiştir [129]. Buna karşılık, insan tıbbında, TKI’ler henüz sarkom tedavisinin ana akımına girmemiştir, bu da bu tümörlerin heterojenitesinden kaynaklanıyor olabilir [216]. Değişken yanıtlara katkıda bulunan faktörleri anlamak ve bu inhibitörlerin kullanımını optimize etmek için daha fazla araştırmaya ihtiyaç vardır. TK inhibitörlerinin farklı FISS alt tiplerindeki etkinliğinin değerlendirilmesi ve potansiyel kombinasyon tedavilerinin araştırılması tedavi sonuçlarını iyileştirebilir. TKI’lere, özellikle imatinib ve masitinib’e karşı direnç mekanizmalarının araştırılması ve PDGF/PDGFR yolağının FISS tümörijenezindeki öneminin araştırılması ilginç olabilecek araştırma alanlarıdır. TKI’lerin kullanımıyla bile FISS’li kedilerde uzun vadeli sağkalım sonuçlarının sınırlı olması [129,217,218], gelişmiş tedavi stratejilerine olan ihtiyacı vurgulamaktadır. Daha büyük örneklem büyüklükleri ve daha uzun takip süreleri ile kontrollü klinik çalışmaların yürütülmesi, FISS’de farklı tedavi yöntemlerinin etkinliği ve uzun vadeli sağkalım faydaları hakkında daha doğru değerlendirmeler sunabilir.
Araştırılan diğer tümör tiplerinde olduğu gibi, kedi pulmoner karsinomlarında HER2 ekspresyonu [146,147], HER2’nin terapötik bir yaklaşım olarak hedeflenmesi olasılığını ortaya koymaktadır. HER2 değişiklikleri olan kedi pulmoner karsinomlarında HER2 hedefli tedavilerin etkinliğini araştırmak için daha fazla çalışmaya ihtiyaç vardır ve bu da kediler için potansiyel tedavi seçenekleri hakkında değerli bilgiler sağlayabilir. Ayrıca, PDGFR-p ekspresyonu ile kedi histiyositik hastalıklarında TKI’lere yanıt arasındaki korelasyonun incelenmesi, PDGFR-p’nin prognostik değerini ve terapötik bir hedef olarak potansiyelini belirleyebilir.
Kedi böbrek hücreli karsinomlarında [58,59,148] ve diffüz iris melanomlarında [150] KIT aşırı ekspresyonunun rolünü anlamak ve bu spesifik tümör tipleri için potansiyel tedaviler olarak KIT inhibitörlerinin etkinliğini değerlendirmek için daha fazla araştırmaya ihtiyaç vardır.
Kedilerdeki çeşitli tümör tiplerinde TK ekspresyonuna ilişkin bilgilerimizi genişletmek için daha fazla araştırmaya ihtiyaç vardır. Daha geniş bir kedi tümörü yelpazesinde TK ekspresyonunun araştırılmasıyla, TKI tedavisi için potansiyel hedefler belirlenebilir ve TKI’lerin farklı tümör tiplerindeki etkinliği değerlendirilebilir. Bazı kedi tümörleri insan kanserleri için değerli spontan modeller olarak hizmet ettiğinden [44,81,86,89,91,93,96,212], bu modellerde TKI tedavisinin araştırılması, ilgili insan kanser türlerini tedavi etme bilgimizi artırabilir ve sonuçta hem kedi hem de insan onkolojisine fayda sağlayabilir.
Son yıllarda, onkoloji alanı, genomik ve mutasyon verilerinin entegrasyonunun terapötik stratejilere rehberlik etmede çok önemli bir rol oynamasıyla derin bir dönüşüm geçirmiştir [219,220]. İncelememiz kedi kanserinde RTK ekspresyonu alanını kapsamlı bir şekilde incelemiş olsa da, genomik bilgilerin artan öneminin altını çizmek önemlidir. Kedi onkogenomiği üzerine yakın zamanda yapılan bir inceleme mevcut bilgi durumunu ortaya çıkardıkça, kedi kanserinin genetik temellerini daha iyi anlamak için daha fazla araştırmanın zorunlu olduğu giderek daha belirgin hale gelmektedir [134]. İnsan onkolojisinde, RTK inhibitörlerinin hedefe yönelik kullanımı, tümörlerdeki genetik mutasyonların daha iyi anlaşılmasıyla yakından ilgilidir [219-221]. İnsan tıbbındaki bu ilerlemelere paralel olarak, kedi kanseri genomlarının kapsamlı bir şekilde anlaşılması, gelecekteki terapötik gelişim için yeni hedefler belirleme vaadini taşımaktadır. Yüksek kaliteli bir kedi genom referansının yakın zamanda yayınlanması, bu alanda gelecekteki araştırmalar için zemin hazırlamaktadır [222].
Klinik ortamda, şu anda kedilerde kullanım için ruhsatlı TKI bulunmamaktadır ve kedi onkolojisinde TKI’lerin kullanımına ilişkin bugüne kadar hiçbir prospektif, randomize plasebo kontrollü klinik çalışma yapılmamıştır. Bugüne kadar, kediler için klinik ortamda dört tirozin kinaz inhibitörü kullanılmıştır: toceranib, masitinib, imatinib ve oclacitinib [17,77,78,129,139,167,169,170,175-177,181]. Kedilerde, TKI’lerin kullanımı en kapsamlı şekilde kedi MCT’si için araştırılmıştır. Ancak, bugüne kadar TKI’lerle tedavi edilen 70’ten az kedi MCT’si bildirilmiştir ve buna vaka raporları da dahildir [17,19,66,77-79]. Bu durum, son 20 yılda kanserli köpeklerde TKI’lerin kullanımına ilişkin çok sayıda klinik çalışmanın yapıldığı ve köpek MCT’lerine karşı 2 TKI’nin ruhsatlandırıldığı köpeklerle tezat oluşturmaktadır [24,25].
Bu TKI’lerin kedilerdeki farmakokinetiği, güvenliği ve toksisitesi hakkındaki mevcut araştırmalar sınırlıdır [19,77,78,125,129,167,170-172,175-177,181,191]. Mevcut farmakokinetik veriler, masitinibin kedilerde köpeklere kıyasla daha düşük biyoyararlanıma ve daha kısa bir yarılanma ömrüne sahip olduğunu göstermektedir [180]. Öte yandan, oklasitinibin kedilerde yüksek ve hızlı emilim ve eliminasyona sahip olduğu görülmektedir [190]. Bununla birlikte, kedilerde bu ilaçlarla ilgili kapsamlı farmakokinetik çalışmalar eksiktir. Ayrıca, kedilerde özellikle toceranib ve imatinib farmakokinetiğini değerlendiren herhangi bir çalışma bulunmamaktadır. Gelecekteki araştırmalar, kedilerde bu TKI’lerin emilimini, dağılımını, metabolizmasını ve eliminasyonunu araştırmaya odaklanmalıdır. Bu araştırma, gıda veya eş zamanlı ilaçlar gibi ilaç emilimini etkileyebilecek faktörlerin daha iyi anlaşılmasına yardımcı olacaktır. TKI’lerin plazma proteinlerine bağlanması ve belirli dokularda potansiyel birikimi de dahil olmak üzere kedilerdeki dağılımının da daha fazla araştırılması gerekmektedir. Yaş, böbrek veya karaciğer yetmezliği veya diğer ilaçlarla etkileşimlerin TKI’lerin vücuttan atılmasını nasıl etkileyebileceği şu anda belirsizdir. Kedilerde bu TKI’lerin dozajı ve güvenliğine ilişkin mevcut sınırlı araştırmaya dayanarak, şu anda kullanılan toceranib (haftada üç kez 2,5-2,78 mg/kg veya EOD) ve masitinib (günde 50 mg/kedi veya EOD) dozajlarının çoğu kedi tarafından iyi tolere edildiği görülmektedir. Bu dozajlarda ciddi veya geri dönüşü olmayan yan etkiler nadirdir. Bununla birlikte, kedilerde uzun süreli TKI kullanımının güvenliği araştırılmamıştır ve vücutta istenen ilaç seviyelerine ulaşmak için biyolojik olarak etkili dozu (BED) veya optimum dozaj rejimini belirlemek için faz 1 klinik çalışmalar yapılmamıştır. Ek olarak, potansiyel ilaç-ilaç etkileşimleri hakkında bilgi eksiktir ve kanserli kedilerin çoğunun diğer tıbbi rahatsızlıkla için eşzamanlı ilaçlar alan yaşlı hayvanlar olduğu düşünüldüğünde bu çok önemlidir.
Köpeklere benzer şekilde [24,25,198], kedilerde TKI’lerin en yaygın yan etkileri gaz- trointestinaldir, ancak ilaçlar arasında bazı önemli farklılıklar mevcuttur. ALT artışı toceranib ile sık görülürken ve kedilerde bozulmuş hepatik glukoronidasyon süreciyle bağlantılı olduğu düşünülürken [176], diğer TKI’lerle daha az yaygın olarak bildirilmiştir [19,77,129,170]. Bu nedenle, toceranib ile ilgili olarak, potansiyel riskler nedeniyle önceden karaciğer rahatsızlıkları olan kedilerde dikkatli bir şekilde uygulanması tavsiye edilir. Masitinib ise tüm kedilerin yaklaşık üçte birinde klinik olarak anlamlı proteinüriye sebebiyet vererek köpeklerde bildirilen %18’lik oranı aşmıştır [223]. Kedilerin masitinib kaynaklı proteinüriye köpeklerden daha yatkın görünmesine rağmen, bu derlemenin yazarları köpeklerde görüldüğü gibi herhangi bir nefrotik sendrom veya minimal değişiklik glomerülopatisi raporuna rastlamamıştır [185,186]. Kedilerde masitinib uygulamasının çoğunlukla dört hafta ile sınırlı olmasının [167,181] bu tutarsızlığa katkıda bulunmuş olması mümkündür. Özellikle, proteinüri yalnızca günlük dozlama ile gelişmiştir, bu da EOD dozlama programının kediler için daha güvenli bir alternatif sağlayabileceğini düşündürmektedir.
Klinik olarak kullanılan dört TKI (toceranib, masitinib, imatinib, oclacitinib) kedilerde iyi tolere ediliyor gibi görünse de, bugüne kadar hiçbir çalışma bu ilaçların uzun vadeli etkilerini değerlendirmemiştir ve veriler tek vakalarla sınırlı kalmıştır [77,139,175,177]. Kronik TKI kullanımının uzun vadeli yan etkileri insanlarda iyi bilindiğinden [224,225], bu riskler kedilerde göz ardı edilemez ve araştırılmalıdır. TKI’lerin güvenlik profilleri, özellikle uzun süreli kullanımda, belirsizliğini korumaktadır ve kronik yan etkilerin gelişme riski göz ardı edilemez.
Kedilerde TKI’lerin etkinliğini ve güvenliğini destekleyen sağlam klinik kanıtların mevcut eksikliği göz önüne alındığında, yayınlanan doz önerileri dikkatle yorumlanmalı ve titiz farmakokinetik çalışmalarla doğrulukları ve uygunlukları teyit edilmelidir.
Kapsam incelememizin bazı kısıtlamaları olduğu kabul edilmelidir. Her ne kadar veteriner literatüründe sistematik arama yapılmasına ilişkin mevcut literatürde [226] nadiren önerilen geniş ve sistematik bir arama stratejisi uygulamış olsak da, bazı ilgili çalışmaların gözden kaçmış olması mümkündür. Kapsamlı olma çabalarımıza rağmen, bu alandaki geniş ve sürekli büyüyen literatür, ilgili her yayını yakalamayı zorlaştırmaktadır. Ayrıca, derlememizde kullanılan dahil etme kriterleri ve arama terimleri, değerli içgörülere katkıda bulunabilecek bazı çalışmaları yanlışlıkla dışarıda bırakmış olabilir. Bu nedenle, bulgularımızın mevcut kanıtların tamamını temsil etmeyebileceğini göz önünde bulundurmak önemlidir. Çalışmamızın bütünlüğünü korumak adına, özetleri ve hakemli olmayan literatürü analizimizin dışında bırakmayı tercih ettik. Sonuç olarak, bu kaynaklarda mevcut olabilecek bazı veriler araştırmamıza dahil edilmemiştir. Yalnızca hakemli yayınlara odaklanarak, çalışmamızda sunulan bilgilerin güvenilirliğini ve inandırıcılığını sağlamayı amaçladık. Ayrıca, potansiyel olarak önemli bazı belirsiz literatürün gözden kaçmış olabileceğini ve bu nedenle bu incelemeye dahil edilmediğini kabul ediyoruz.
Ayrıca, TKI’lerin kedilerde kullanımına ilişkin verilerin sınırlı olması, sonuçlara varmak için nispeten küçük bir kanıt havuzu oluşmasına neden olmuştur. Bunun nedeni, genel olarak klinik ortamda yer alan nispeten az sayıda çalışma ve özellikle kedi onkolojisinde TKI’lerin kullanımına ilişkin prospektif, randomize plasebo kontrollü klinik çalışmaların bulunmamasıdır. Sonuç olarak, yüksek düzeyde kanıt sağlamayan tek vaka raporlarını dahil etmeye karar verdik (Oxford klinik kanıta dayalı tıp, OCEBM seviye 4). Son olarak, yanıtların ve advers olayların raporlanması dahil edilen tüm çalışmalarda tek tip ve tutarlı olmadığından, doğrudan karşılaştırma her zaman mümkün olmamıştır.
Bu sınırlamalara rağmen, kapsam belirleme incelememiz alandaki araştırmaların mevcut durumuna ilişkin değerli bir genel bakış sunmaktadır. Mevcut çalışmaları ve bulgularını vurgulamakta, bilgi boşluklarına ve daha fazla araştırma gerektiren alanlara ışık tutmaktadır. Bu sınırlamaları kabul ederek, gelecekteki araştırmacıları çalışmalarımızı geliştirmeye ve literatürdeki boşlukları ele almaya teşvik edebiliriz.
Sonuç
Sonuç olarak, TKI’ler çeşitli insan ve köpek malignitelerinde standart tedavi haline gelmiş olsa da, kedilerde kullanımları yeterince araştırılmamıştır ve şu anda hiçbir TKI kedi onkolojisinde kullanılmak üzere ruhsat almamıştır. Çeşitli TKI’lerin kedi malignitelerindekietkinliğine ilişkin bazı in vitro kanıtlar mevcut olsa da, bu verilerin klinik ortama aktarılması sınırlı düzeyde olup, çoğu TKI’nin kedilerdeki dozajı, güvenliği ve etkinliği hakkında yetersiz bilgi bulunmaktadır. En sağlam klinik veriler, 70’ten az kediden oluşan küçük bir örneklem büyüklüğü ile kedi MCT’lerinde toceranib kullanımına odaklanmaktadır. İlginç bir şekilde, bazı kedi tümörleri bazı insan maligniteleri için spontan modeller olarak önerilmiştir ve bu da insan TKI’lerini içeren yeni terapötik yaklaşımları keşfetmek veya kedileştirilmiş mAb’lerin geliştirilmesi için bir fırsat sunmaktadır.
Gelecekteki araştırmalar, prognostik değerlerini ve TKI kullanım potansiyelini daha iyi tahmin etmek için daha fazla sayıda kediyi içeren farklı kedi malignitelerinde çeşitli TK’lerin ekspresyonuna odaklanabilir. Buna ek olarak, kedi kanserlerinin moleküler etkenlerinin daha iyi anlaşılması, kediler için yeni hedefe yönelik tedavi yöntemlerinin geliştirilmesini sağlayabilir. Halihazırda mevcut olan insan TKI’lerinin kullanımı FMC’lerin ve FOSCC’lerin tedavisinde umut vaat etse de, öncelikle bunların kedi hastalarda farmakokinetik ve güvenlik profillerinin değerlendirilmesi çok önemlidir. Kediler, toceranib gibi halihazırda mevcut olan veteriner TKI’lerini iyi tolere ediyor gibi göründüğünden, bunların kullanımı, daha önce tanımlananların ötesinde daha geniş bir malignite spektrumunda potansiyel taşıyabilir. Kapsam incelememiz, TK ekspresyonu ve TKI’lerin çeşitli kedi malignitelerinde kullanımı ile ilgili bazı temel bilgi eksikliklerini vurgularken, bu alanda daha fazla araştırma yapılması için önemli bir zemin hazırladığına inanıyoruz.
Katkıda bulunan yazarlar: Kavramsallaştırma, 2.2. ve J.M.S.; metodoloji, 2.2. ve J.M.S.; araştırma, 2.2. ve J.M.S.; veri düzenleme, 2.2. ve J.M.S.; yazım-orijinal taslak hazırlama, 2.2.; yazım-inceleme ve düzenleme, J.M.S.; danışmanlık, J.M.S. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir.
Finansman: Bu araştırma herhangi bir dış finansman almamıştır.
Etik Kurul Onayı: Veri yok.
Bilgilendirilmiş Onam Beyanı: Veri yok.
Veri Erişim Beyanı: Bu çalışmada yeni veri oluşturulmamış veya analiz edilmemiştir. Veri paylaşımı bu makale için geçerli değildir.
Çıkar çatışması beyanı: Yazarlar herhangi bir çıkar çatışması beyan etmemektedir..
Kaynakça
- Brugge, J.S.; Erikson, R.L. Identification of a Transformation-Specific Antigen Induced by an Avian Sarcoma Virus. Nature 1977, 269, 346- 348. [CrossRef] [PubMed]
- Collett, M.S.; Erikson, R.L. Protein Kinase Activity Associated with the Avian Sarcoma Virus Src Gene Product. Proc. Natl. Acad. Sci. USA1978, 75, 2021-2024. [CrossRef] [PubMed]
- Levinson, A.D.; Oppermann, H.; Levintow, L.; Varmus, H.E.; Bishop, J.M. Evidence That the Transforming Gene of Avian Sarcoma Virus Encodes a Protein Kinase Associated with a Phosphoprotein. Cell 1978, 15, 561-572. [CrossRef] [PubMed]
- London, C. Kinase Inhibitors in Cancer Therapy. Vet. Comp. Oncol. 2004, 2, 177-193. [CrossRef]
- Weinberg, R.A. Growth Factors, Receptors, and Cancer. In The Biology of Cancer; Garland Science, Taylor & Francis Group: New York,NY, USA, 2014; pp. 131-174.
- Shchemelinin, I.; Sefc, L.; Necas, E. Protein Kinases, Their Function and Implication in Cancer and Other Diseases. Folia Biol. 2006, 52, 81-100.
- Krause, D.S.; Van Etten, R.A. Tyrosine Kinases as Targets for Cancer Therapy. N. Engl. J. Med. 2005, 353, 172-187. [CrossRef]
- Madhusudan, S.; Ganesan, T.S. Tyrosine Kinase Inhibitors in Cancer Therapy. Clin. Biochem. 2004, 37, 618-635. [CrossRef]
- Brown, R.J.; Newman, S.J.; Durtschi, D.C.; Leblanc, A.K. Expression of PDGFR-P and Kit in Canine Anal Sac Apocrine GlandAdenocarcinoma Using Tissue Immunohistochemistry. Vet. Comp. Oncol. 2012, 10, 74-79. [CrossRef]
- Koltai, Z.; Szabo, B.; Jakus, J.; Vajdovich, P Tyrosine Kinase Expression Analyses in Canine Mammary Gland Tumours—A Pilot Study.Acta Vet. Hung. 2018, 66, 294-308. [CrossRef]
- Chen, Y.-C.; Liao, J.-W.; Hsu, W.-L.; Chang, S.-C. Identification of the Two KIT Isoforms and Their Expression Status in Canine
Hemangiosarcomas. BMC Vet. Res. 2016, 12, 142. [CrossRef]
- Gil da Costa, R.M.; Oliveira, J.P.; Saraiva, A.L.; Seixas, F.; Faria, F.; Gartner, F.; Pires, M.A.; Lopes, C. Immunohistochemical Characterization of 13 Canine Renal Cell Carcinomas. Vet. Pathol. 2011, 48, 427-432. [CrossRef] [PubMed]
- Gramer, I.; Killick, D.; Scase, T.; Chandry, D.; Marrington, M.; Blackwood, L. Expression of VEGFR and PDGFR-a/-|3 in 187 Canine Nasal Carcinomas. Vet. Comp. Oncol. 2017, 15, 1041-1050. [CrossRef] [PubMed]
- Gregory-Bryson, E.; Bartlett, E.; Kiupel, M.; Hayes, S.; Yuzbasiyan-Gurkan, V. Canine and Human Gastrointestinal Stromal Tumors Display Similar Mutations in c-KIT Exon 11. BMC Cancer 2010, 10, 559. [CrossRef] [PubMed]
- Dickinson, P.J.; Roberts, B.N.; Higgins, R.J.; Leutenegger, C.M.; Bollen, A.W.; Kass, P.H.; LeCouteur, R.A. Expression of Receptor Tyrosine Kinases VEGFR-1 (FLT-1), VEGFR-2 (KDR), EGFR-1, PDGFRalpha and c-Met in Canine Primary Brain Tumours. Vet. Comp. Oncol. 2006, 4, 132-140. [CrossRef] [PubMed]
- Urie, B.K.; Russell, D.S.; Kisseberth, W.C.; London, C.A. Evaluation of Expression and Function of Vascular Endothelial Growth Factor Receptor 2, Platelet Derived Growth Factor Receptors-Alpha and -Beta, KIT, and RET in Canine Apocrine Gland Anal Sac Adenocarcinoma and Thyroid Carcinoma. BMC Vet. Res. 2012, 8, 67. [CrossRef]
- Isotani, M.; Tamura, K.; Yagihara, H.; Hikosaka, M.; Ono, K.; Washizu, T.; Bonkobara, M. Identification of a c-KIT Exon 8 Internal Tandem Duplication in a Feline Mast Cell Tumor Case and Its Favorable Response to the Tyrosine Kinase Inhibitor Imatinib Mesylate. Vet. Immunol. Immunopathol. 2006, 114, 168-172. [CrossRef]
- Katayama, R.; Huelsmeyer, M.K.; Marr, A.K.; Kurzman, I.D.; Thamm, D.H.; Vail, D.M. Imatinib Mesylate Inhibits Platelet-Derived Growth Factor Activity and Increases Chemosensitivity in Feline Vaccine-Associated Sarcoma. Cancer Chemother. Pharmacol. 2004, 54, 25- 33. [CrossRef]
- Isotani, M.; Yamada, O.; Lachowicz, J.L.; Tamura, K.; Yagihara, H.; Fujino, Y.; Ono, K.; Washizu, T.; Bonkobara, M. Mutations in the Fifth Immunoglobulin-like Domain of Kit Are Common and Potentially Sensitive to Imatinib Mesylate in Feline Mast Cell Tumours. Br. J. Haematol. 2010, 148, 144-153. [CrossRef]
- Hasegawa, Y.; Shosu, K.; Tsuji, K.; Shimoyama, Y.; Miyama, T.S.; Baba, K.; Okuda, M.; Itamoto, K.; Igase, M.; Mizuno, T. Intratumoral Heterogeneity of c-KIT Mutations in a Feline Splenic Mast Cell Tumor and Their Functional Effects on Cell Proliferation. Sci. Rep. 2022, 12, 15791. [CrossRef]
- London, C.A. Tyrosine Kinase Inhibitors in Veterinary Medicine. Top. Companion Anim. Med. 2009, 24, 106-112. [CrossRef]
- Klingemann, H. Immunotherapy for Dogs: Still Running Behind Humans. Front. Immunol. 2021, 12, 665784. [CrossRef] [PubMed]
- Huang, L.; Jiang, S.; Shi, Y. Tyrosine Kinase Inhibitors for Solid Tumors in the Past 20 Years (2001-2020). J. Hematol. Oncol. 2020,13, 143. [CrossRef] [PubMed]
- Hahn, K.A.; Oglivie, G.; Rusk, T.; Devauchelle, P.; Leblanc, A.; Legendre, A.; Powers, B.; Leventhal, P.S.; Kinet, J.-P.; Palmerini, F.; et al.Masitinib Is Safe and Effective for the Treatment of Canine Mast Cell Tumors. J. Vet. Intern. Med. 2008, 22, 1301-1309. [CrossRef] [PubMed]
- London, C.A.; Malpas, P.B.; Wood-Follis, S.L.; Boucher, J.F.; Rusk, A.W.; Rosenberg, M.P.; Henry, C.J.; Mitchener, K.L.; Klein, M.K.; Hintermeister, J.G.; et al. Multi-Center, Placebo-Controlled, Double-Blind, Randomized Study of Oral Toceranib Phosphate (SU11654), a Receptor Tyrosine Kinase Inhibitor, for the Treatment of Dogs with Recurrent (Either Local or Distant) Mast Cell Tumor FollowingSurgical Excision. Clin. Cancer Res. 2009, 15, 3856-3865. [CrossRef] [PubMed]
- Graf, R.; Gruntzig, K.; Hassig, M.; Axhausen, K.W.; Fabrikant, S.; Welle, M.; Meier, D.; Guscetti, F.; Folkers, G.; Otto, V.; et al. SwissFeline Cancer Registry: A Retrospective Study of the Occurrence of Tumours in Cats in Switzerland from 1965 to 2008. J. Comp. Pathol.
2015, 153, 266-277. [CrossRef] [PubMed]
- Perez-Enriquez, J.M.; Romero-Romero, L.; Alonso-Morales, R.A.; Fuentes-Panana, E.M. Tumor Prevalence in Cats: Experience from aReference Diagnostic Center in Mexico City (2006-2018). Vet. Mexico 2020, 7, 1-14. [CrossRef]
- Pinello, K.; Pires, I.; Castro, A.F.; Carvalho, P.T.; Santos, A.; de Matos, A.; Queiroga, F.; Canadas-Sousa, A.; Dias-Pereira, P.; Catarino, J.;et al. Cross Species Analysis and Comparison of Tumors in Dogs and Cats, by Age, Sex, Topography and Main Morphologies. Data
from Vet-OncoNet. Vet. Sci. 2022, 9, 167. [CrossRef]
- Bavcar, S.; Argyle, D.J. Receptor Tyrosine Kinase Inhibitors: Molecularly Targeted Drugs for Veterinary Cancer Therapy. Vet. Comp.Oncol. 2012, 10, 163-173. [CrossRef]
- Frezoulis, P.; Harper, A. The Role of Toceranib Phosphate in Dogs with Non-Mast Cell Neoplasia: A Systematic Review. Vet. Comp.Oncol. 2022, 20, 362-371. [CrossRef]
- Ouzzani, M.; Hammady, H.; Fedorowicz, Z.; Elmagarmid, A. Rayyan-a Web and Mobile App for Systematic Reviews. Syst. Rev.2016, 5, 210. [CrossRef]
- LeBlanc, A.K.; Atherton, M.; Bentley, R.T.; Boudreau, C.E.; Burton, J.H.; Curran, K.M.; Dow, S.; Giuffrida, M.A.; Kellihan, H.B.; Mason,N.J.; et al. Veterinary Cooperative Oncology Group—Common Terminology Criteria for Adverse Events (VCOG-CTCAE v2) Following
Investigational Therapy in Dogs and Cats. Vet. Comp. Oncol. 2021, 19, 311-352. [CrossRef] [PubMed]
- Nguyen, S.M.; Thamm, D.H.; Vail, D.M.; London, C.A. Response Evaluation Criteria for Solid Tumours in Dogs (v1.0): A VeterinaryCooperative Oncology Group (VCOG) Consensus Document. Vet. Comp. Oncol. 2015, 13, 176-183. [CrossRef]
- World Health Organization. WHO Handbook for Reporting Results of Cancer Treatment; WHO: Geneva, Switzerland, 1979.
- Page, M.J.; McKenzie, J.E.; Bossuyt, P.M.; Boutron, I.; Hoffmann, T.C.; Mulrow, C.D.; Shamseer, L.; Tetzlaff, J.M.; Akl, E.A.; Brennan,S.E.; et al. The PRISMA 2020 Statement: An Updated Guideline for Reporting Systematic Reviews. Syst. Rev. 2021, 10, 89. [CrossRef] [PubMed]
- Yamuy, J.; Ramos, O.; Torterolo, P.; Sampogna, S.; Chase, M.H. The Role of Tropomyosin-Related Kinase Receptors in Neurotrophin- Induced Rapid Eye Movement Sleep in the Cat. Neuroscience 2005,135, 357-369. [CrossRef] [PubMed]
- Benftez-Temiho, B.; Morcuende, S.; Mentis, G.Z.; de la Cruz, R.R.; Pastor, A.M. Expression of Trk Receptors in the Oculomotor System of the Adult Cat. J. Comp. Neurol. 2004, 473, 538-552. [CrossRef]
- Deckner, M.L.; Frisen, J.; Verge, V.M.; Hokfelt, T.; Risling, M. Localization of Neurotrophin Receptors in Olfactory Epithelium and Bulb.Neuroreport 1993, 5, 301-304. [CrossRef]
- Tong, C.; Cao, S. Study on the Mechanism of Visual Aging in Cats’ Primary Visual Cortex Based on BDNF-TrkB Signal Pathway. Sci. Rep. 2022, 12, 10576. [CrossRef]
- Tong, C.-W.; Wang, Z.-L.; Li, P.; Zhu, H.; Chen, C.-Y.; Hua, T.-M. Effects of Senescence on the Expression of BDNF and TrkB Receptor in the Lateral Geniculate Nucleus of Cats. Dongwuxue Yanjiu 2015, 36, 48-53. [CrossRef]
- Goritz, F.; Jewgenow, K.; Meyer, H.H. Epidermal Growth Factor and Epidermal Growth Factor Receptor in the Ovary of the Domestic Cat (Felis Catus). J. Reprod. Fertil. 1996, 106, 117-124. [CrossRef]
- Boomsma, R.A.; Mavrogianis, P.A.; Verhage, H.G. Immunocytochemical Localization of Transforming Growth Factor Alpha, Epidermal Growth Factor and Epidermal Growth Factor Receptor in the Cat Endometrium and Placenta. Histochem. J. 1997, 29, 495-504. [CrossRef]
- Looper, J.S.; Malarkey, D.E.; Ruslander, D.; Proulx, D.; Thrall, D.E. Epidermal Growth Factor Receptor Expression in Feline OralSquamous Cell Carcinomas. Vet. Comp. Oncol. 2006, 4, 33-40. [CrossRef] [PubMed]
- Santos, S.; Baptista, C.S.; Abreu, R.M.V.; Bastos, E.; Amorim, I.; Gut, I.G.; Gartner, F.; Chaves, R. ERBB2 in Cat Mammary NeoplasiasDisclosed a Positive Correlation between RNA and Protein Low Expression Levels: A Model for erbB-2 Negative Human Breast Cancer.
PLoS ONE 2013, 8, e83673. [CrossRef] [PubMed]
- Burrai, G.P.; Mohammed, S.I.; Miller, M.A.; Marras, V.; Pirino, S.; Addis, M.F.; Uzzau, S.; Antuofermo, E. Spontaneous Feline MammaryIntraepithelial Lesions as a Model for Human Estrogen Receptor- and Progesterone Receptor-Negative Breast Lesions. BMC Cancer 2010,
10, 156. [CrossRef] [PubMed]
- Saraiva, A.L.; Payan-Carreira, R.; Gartner, F.; Faria, F.; Louren^o, L.M.; Pires, M.A. Changes in C-erbB-2 Immunoexpression in FelineEndometrial Adenocarcinomas. Reprod. Domest. Anim. 2016, 51, 33-39. [CrossRef] [PubMed]
- Misirlioglu, D.; Nak, D.; Sevimli, A.; Nak, Y.; Ozyigit, M.O.; Akkoc, A.; Cangul, I.T. Steroid Receptor Expression and HER-2/Neu (c-erbB-2) Oncoprotein in the Uterus of Cats with Cystic Endometrial Hyperplasia-Pyometra Complex. J. Vet. Med. A Physiol. Pathol. Clin.
Med. 2006, 53, 225-229. [CrossRef]
- de Sousa, D.A.; da Silva, K.V.; Cascon, C.M.; Silva, F.B.; de Mello, M.F.; da Silva Leite, J.; Fonseca, A.B.; El-Jaick, K.B.; Ferreira, A.M.Epidermal Growth Factor Receptor 2 Immunoexpression in Gastric Cells of Domestic Cats with H. Heilmannii Infection. Acta Histochem.
2019, 121, 413-418. [CrossRef]
- Lucini, C.; D’angelo, L.; de Girolamo, P.; Castaldo, L. RET Receptor in the Gut of Developing Cat. Res. Vet. Sci. 2013, 94, 1-4. [CrossRef]
- Lucini, C.; Maruccio, L.; Facello, B.; Cocchia, N.; Tortora, G.; Castaldo, L. Cellular Localization of GDNF and Its GFRalpha1/RETReceptor Complex in the Developing Pancreas of Cat. J. Anat. 2008, 213, 565-572. [CrossRef]
- Santos, L.C.; Dos Anjos Cordeiro, J.M.; da Silva Santana, L.; Santos, B.R.; Barbosa, E.M.; da Silva, T.Q.M.; Correa, J.M.X.; Niella, R.V.;Lavor, M.S.L.; da Silva, E.B.; et al. Kisspeptin/Kiss1r System and Angiogenic and Immunological Mediators at the Maternal-Fetal
Interface of Domestic Cats. Biol. Reprod. 2021, 105, 217-231. [CrossRef]
- Sarli, G.; Sassi, F.; Brunetti, B.; Rizzo, A.; Diracca, L.; Benazzi, C. Lymphatic Vessels Assessment in Feline Mammary Tumours. BMCCancer 2007, 7, 7. [CrossRef]
- Rungsipipat, A.; Tateyama, S.; Yamaguchi, R.; Uchida, K.; Miyoshi, N. Expression of C-Yes Oncogene Product in Various Animal Tissuesand Spontaneous Canine Tumours. Res. Vet. Sci. 1999, 66, 205-210. [CrossRef] [PubMed]
- Treggiari, E.; Ressel, L.; Polton, G.A.; Benoit, J.; Desmas, I.; Blackwood, L. Clinical Outcome, PDGFRp and KIT Expression in FelineHistiocytic Disorders: A Multicentre Study. Vet. Comp. Oncol. 2017, 15, 65-77. [CrossRef] [PubMed]
- Ishtiaq, A.; Sozmen, M. Expression of Platelet Derived Growth Factor A, Its Receptor, and Integrin Subunit Alpha v in Feline Injection-Site Sarcomas. ID—20210105841. Acta Vet. 2021, 71, 13-31. [CrossRef]
- Morini, M.; Bettini, G.; Preziosi, R.; Mandrioli, L. c-KIT Gene Product (CD117) Immunoreactivity in Canine and Feline Paraffin Sections.J. Histochem. Cytochem. 2004, 52, 705-708. [CrossRef]
- Wolfesberger, B.; Fuchs-Baumgartinger, A.; Hlavaty, J.; Meyer, F.R.; Hofer, M.; Steinborn, R.; Gebhard, C.; Walter, I. Stem Cell GrowthFactor Receptor in Canine vs. Feline Osteosarcomas. Oncol. Lett. 2016, 12, 2485-2492. [CrossRef]
- Ramos-Vara, J.A.; Edmondson, E.F.; Miller, M.A.; Dusold, D.M. Immunohistochemical Profile of 20 Feline Renal Cell Carcinomas. J.Comp. Pathol. 2017, 157, 115-125. [CrossRef]
- Matsumoto, I.; Chambers, J.K.; Nibe, K.; Kinoshita, R.; Nishimura, R.; Nakayama, H.; Uchida, K. Histopathologic and Immuno-histochemistry Findings in Feline Renal Cell Carcinoma. Vet. Pathol. 2018, 55, 663-672. [CrossRef]
- Metzger, R.; Schuster, T.; Till, H.; Franke, F.-E.; Dietz, H.-G. Cajal-like Cells in the Upper Urinary Tract: Comparative Study in VariousSpecies. Pediatr. Surg. Int. 2005, 21, 169-174. [CrossRef]
- Wang, X.-Y.; Diamant, N.E.; Huizinga, J.D. Interstitial Cells of Cajal: Pacemaker Cells of the Pancreatic Duct? Pancreas 2011, 40, 137-143.[CrossRef]
- Dobromylskyj, M.J.; Rasotto, R.; Melville, K.; Smith, K.C.; Berlato, D. Evaluation of Minichromosome Maintenance Protein 7 and c-KIT as Prognostic Markers in Feline Cutaneous Mast Cell Tumours. J. Comp. Pathol. 2015,153, 244-250. [CrossRef]
- Sabattini, S.; Guadagni Frizzon, M.; Gentilini, F.; Turba, M.E.; Capitani, O.; Bettini, G. Prognostic Significance of Kit Receptor Tyrosine Kinase Dysregulations in Feline Cutaneous Mast Cell Tumors. Vet. Pathol. 2013, 50, 797-805. [CrossRef] [PubMed]
- Sabattini, S.; Bettini, G. Prognostic Value of Histologic and Immunohistochemical Features in Feline Cutaneous Mast Cell Tumors. Vet. Pathol. 2010, 47, 643-653. [CrossRef] [PubMed]
- Sabattini, S.; Barzon, G.; Giantin, M.; Lopparelli, R.M.; Dacasto, M.; Prata, D.; Bettini, G. Kit Receptor Tyrosine Kinase Dysregula- tions in Feline Splenic Mast Cell Tumours. Vet. Comp. Oncol. 2017, 15, 1051-1061. [CrossRef] [PubMed]
- Sabattini, S.; Giantin, M.; Barbanera, A.; Zorro Shahidian, L.; Dacasto, M.; Zancanella, V.; Prata, D.; Trivigno, E.; Bettini, G. Feline Intestinal Mast Cell Tumours: Clinicopathological Characterisation and KIT Mutation Analysis. J. Feline Med. Surg. 2016, 18, 280-289. [CrossRef] [PubMed]
- Hadzijusufovic, E.; Peter, B.; Rebuzzi, L.; Baumgartner, C.; Gleixner, K.V.; Gruze, A.; Thaiwong, T.; Pickl, W.F.; Yuzbasiyan-Gurkan, V.; Willmann, M.; et al. Growth-Inhibitory Effects of Four Tyrosine Kinase Inhibitors on Neoplastic Feline Mast Cells Exhibiting a Kit Exon 8 ITD Mutation. Vet. Immunol. Immunopathol. 2009, 132, 243-250. [CrossRef]
- Bagwell, J.M.; Herd, H.R.; Breshears, M.A.; Hodges, S.; Rizzi, T.E. Concurrent Multiple Myeloma and Mast Cell Neoplasia in a 13-Year- Old Castrated Male Maine Coon Cat. Vet. Clin. Pathol. 2017, 46, 151-157. [CrossRef]
- Rodriguez-Carino, C.; Fondevila, D.; Segales, J.; Rabanal, R.M. Expression of KIT Receptor in Feline Cutaneous Mast Cell Tumors. Vet. Pathol. 2009, 46, 878-883. [CrossRef]
- Mallett, C.L.; Northrup, N.C.; Saba, C.F.; Rodriguez, C.O.; Rassnick, K.M.; Gieger, T.L.; Childress, M.O.; Howerth, E.W. Immunohistochemical Characterization of Feline Mast Cell Tumors. Vet. Pathol. 2013, 50, 106-109. [CrossRef]
- Sakurai, M.; Iwasa, R.; Sakai, Y.; Chambers, J.K.; Uchida, K.; Morimoto, M. Expression of Stem Cell Factor in Feline Mast Cell Tumour. J. Comp. Pathol. 2018, 163, 6-9. [CrossRef]
- Halsey, C.H.C.; Powers, B.E.; Kamstock, D.A. Feline Intestinal Sclerosing Mast Cell Tumour: 50 Cases (1997-2008). Vet. Comp. Oncol. 2010, 8, 72-79. [CrossRef]
- Lee, S.; Kang, M.S.; Jeong, Y.; Kim, Y.; Kwak, H.H.; Choi, E.W.; Choi, S.; Park, I.; Chung, J.Y.; Choi, J.H.; et al. Clinical and Immunohistochemical Findings of Splenic Mast Cell Tumour in a Cat: A Case Report. Veterinarm Medicma 2021, 66, 498-502. [CrossRef]
- Tamlin, V.S.; Bottema, C.D.K.; Campbell-Ward, M.L.; Hanshaw, D.; Peaston, A.E. KIT Mutations in Mast Cell Tumours from Cheetahs(Acinonyx Jubatus) and Domestic Cats (Felis Catus). Vet. Comp. Oncol. 2021, 19, 381-392. [CrossRef] [PubMed]
- Takanosu, M.; Sato, M.; Kagawa, Y. Sensitive Detection of the c-KIT c.1430G>T Mutation by Mutant-Specific Polymerase Chain Reactionin Feline Mast Cell Tumours. Vet. Comp. Oncol. 2014, 12, 138-142. [CrossRef] [PubMed]
- Dank, G.; Chien, M.B.; London, C.A. Activating Mutations in the Catalytic or Juxtamembrane Domain of c-KIT in Splenic Mast CellTumors of Cats. Am. J. Vet. Res. 2002, 63, 1129-1133. [CrossRef] [PubMed]
- Berger, E.P.; Johannes, C.M.; Post, G.S.; Rothchild, G.; Shiu, K.-B.; Wetzel, S.; Fox, L.E. Retrospective Evaluation of Toceranib Phosphate(Palladia) Use in Cats with Mast Cell Neoplasia. J. Feline Med. Surg. 2018, 20, 95-102. [CrossRef] [PubMed]
- Lachowicz, J.L.; Post, G.S.; Brodsky, E. A Phase I Clinical Trial Evaluating Imatinib Mesylate (Gleevec) in Tumor-Bearing Cats.J. Vet. Intern. Med. 2005, 19, 860-864. [CrossRef]
- Kim, J.; Kim, H.J. Treatment of a Feline Cutaneous Mast Cell Tumour Using Imatinib Mesylate as a Neoadjuvant Tyrosine KinaseInhibitor Therapeutic Agent. ID—20203291474. Veterinarm Medicma 2020, 65, 84-88. [CrossRef]
- Evans, B.J.; O’Brien, D.; Allstadt, S.D.; Gregor, T.P.; Sorenmo, K.U. Treatment Outcomes and Prognostic Factors of Feline Splenic MastCell Tumors: A Multi-Institutional Retrospective Study of 64 Cases. Vet. Comp. Oncol. 2018, 16, 20-27. [CrossRef]
- Wiese, D.A.; Thaiwong, T.; Yuzbasiyan-Gurkan, V.; Kiupel, M. Feline Mammary Basal-like Adenocarcinomas: A Potential Model forHuman Triple-Negative Breast Cancer (TNBC) with Basal-like Subtype. BMC Cancer 2013, 13, 403. [CrossRef]
- Gray, M.E.; Lee, S.; McDowell, A.L.; Erskine, M.; Loh, Q.T.M.; Grice, O.; Argyle, D.J.; Bergkvist, G.T. Dual Targeting of EGFR and ERBB2 Pathways Produces a Synergistic Effect on Cancer Cell Proliferation and Migration in Vitro. Vet. Comp. Oncol. 2017, 15, 890-909.[CrossRef]
- Gibson, H.M.; Veenstra, J.J.; Jones, R.; Vaishampayan, U.; Sauerbrey, M.; Bepler, G.; Lum, L.; Reyes, J.; Weise, A.; Wei, W.-Z. Inductionof HER2 Immunity in Outbred Domestic Cats by DNA Electrovaccination. Cancer Immunol. Res. 2015, 3, 777-786. [CrossRef] [PubMed]
- Barbieri, F.; Wurth, R.; Ratto, A.; Campanella, C.; Vito, G.; Thellung, S.; Daga, A.; Cilli, M.; Ferrari, A.; Florio, T. Isolation of Stem-like Cells from Spontaneous Feline Mammary Carcinomas: Phenotypic Characterization and Tumorigenic Potential. Exp. Cell Res. 2012, 318,847-860. [CrossRef] [PubMed]
- Minke, J.M.; Schuuring, E.; van den Berghe, R.; Stolwijk, J.A.; Boonstra, J.; Cornelisse, C.; Hilkens, J.; Misdorp, W. Isolation of TwoDistinct Epithelial Cell Lines from a Single Feline Mammary Carcinoma with Different Tumorigenic Potential in Nude Mice and
Expressing Different Levels of Epidermal Growth Factor Receptors. Cancer Res. 1991, 51, 4028-4037. [PubMed]
- De Maria, R.; Olivero, M.; Iussich, S.; Nakaichi, M.; Murata, T.; Biolatti, B.; Di Renzo, M.F. Spontaneous Feline Mammary Carcinoma Isa Model of HER2 Overexpressing Poor Prognosis Human Breast Cancer. Cancer Res. 2005, 65, 907-912. [CrossRef] [PubMed]
- Millanta, F.; Calandrella, M.; Citi, S.; Della Santa, D.; Poli, A. Overexpression of HER-2 in Feline Invasive Mammary Carcinomas: An Immunohistochemical Survey and Evaluation of Its Prognostic Potential. Vet. Pathol. 2005, 42, 30-34. [CrossRef]
- Brunetti, B.; Asproni, P.; Beha, G.; Muscatello, L.V.; Millanta, F.; Poli, A.; Benazzi, C.; Sarli, G. Molecular Phenotype in Mammary Tumours of Queens: Correlation between Primary Tumour and Lymph Node Metastasis. J. Comp. Pathol. 2013, 148, 206-213. [CrossRef]
- Winston, J.; Craft, D.M.; Scase, T.J.; Bergman, P.J. Immunohistochemical Detection of HER-2/Neu Expression in Spontaneous FelineMammary Tumours. Vet. Comp. Oncol. 2005, 3, 8-15. [CrossRef]
- Muscatello, L.V.; Di Oto, E.; Sarli, G.; Monti, V.; Foschini, M.P.; Benazzi, C.; Brunetti, B. HER2 Amplification Status in Feline MammaryCarcinoma: A Tissue Microarray-Fluorescence In Situ Hydridization-Based Study. Vet. Pathol. 2019, 56, 230-238. [CrossRef]
- Soares, M.; Correia, J.; Rodrigues, P.; Simoes, M.; de Matos, A.; Ferreira, F. Feline HER2 Protein Expression Levels and Gene Status in Feline Mammary Carcinoma: Optimization of Immunohistochemistry (IHC) and in Situ Hybridization (ISH) Techniques. Microsc.Microanal. 2013, 19, 876-882. [CrossRef]
- Rasotto, R.; Caliari, D.; Castagnaro, M.; Zanetti, R.; Zappulli, V. An Immunohistochemical Study of HER-2 Expression in FelineMammary Tumours. J. Comp. Pathol. 2011, 144, 170-179. [CrossRef]
- Ordas, J.; Millan, Y.; Dios, R.; Reymundo, C.; de Las Mulas, J.M. Proto-Oncogene HER-2 in Normal, Dysplastic and Tumorous FelineMammary Glands: An Immunohistochemical and Chromogenic in Situ Hybridization Study. BMC Cancer 2007, 7, 179. [CrossRef]
[PubMed]
- Soares, M.; Ribeiro, R.; Najmudin, S.; Gameiro, A.; Rodrigues, R.; Cardoso, F.; Ferreira, F. Serum HER2 Levels Are Increased in Cats withMammary Carcinomas and Predict Tissue HER2 Status. Oncotarget 2016, 7, 17314-17326. [CrossRef] [PubMed]
- Beha, G.; Muscatello, L.V.; Brunetti, B.; Asproni, P.; Millanta, F.; Poli, A.; Benazzi, C.; Sarli, G. Molecular Phenotype of Primary MammaryTumours and Distant Metastases in Female Dogs and Cats. J. Comp. Pathol. 2014, 150, 194-197. [CrossRef] [PubMed]
- Soares, M.; Madeira, S.; Correia, J.; Peleteiro, M.; Cardoso, F.; Ferreira, F. Molecular Based Subtyping of Feline Mammary Carcinomasand Clinicopathological Characterization. Breast 2016, 27, 44-51. [CrossRef] [PubMed]
- Dagher, E.; Abadie, J.; Loussouarn, D.; Fanuel, D.; Campone, M.; Nguyen, F. Bcl-2 Expression and Prognostic Significance in FelineInvasive Mammary Carcinomas: A Retrospective Observational Study. BMC Vet. Res. 2019, 15, 25. [CrossRef] [PubMed]
- De Campos, C.B.; Damasceno, K.A.; Gamba, C.O.; Ribeiro, A.M.; Machado, C.J.; Lavalle, G.E.; Cassali, G.D. Evaluation of PrognosticFactors and Survival Rates in Malignant Feline Mammary Gland Neoplasms. J. Feline Med. Surg. 2016, 18, 1003-1012. [CrossRef]
- Maniscalco, L.; Iussich, S.; de Las Mulas, J.M.; Millan, Y.; Biolatti, B.; Sasaki, N.; Nakagawa, T.; De Maria, R. Activation of AKT in FelineMammary Carcinoma: A New Prognostic Factor for Feline Mammary Tumours. Vet. J. 2012, 191, 65-71. [CrossRef]
- Marques, C.S.; Soares, M.; Santos, A.; Correia, J.; Ferreira, F. Serum SDF-1 Levels Are a Reliable Diagnostic Marker of Feline MammaryCarcinoma, Discriminating HER2-Overexpressing Tumors from Other Subtypes. Oncotarget 2017, 8, 105775-105789. [CrossRef]
- Millanta, F.; Citi, S.; Della Santa, D.; Porciani, M.; Poli, A. COX-2 Expression in Canine and Feline Invasive Mammary Carcinomas:Correlation with Clinicopathological Features and Prognostic Molecular Markers. Breast Cancer Res. Treat. 2006, 98, 115-120. [CrossRef]
- Maniscalco, L.; Guil-Luna, S.; Iussich, S.; Gattino, F.; Trupia, C.; Millan, Y.; de Las Mulas, J.M.; Cespedez, R.S.; Saeki, K.; Accornero, P.;et al. Expression of the Short Form of RON/STK in Feline Mammary Carcinoma. Vet. Pathol. 2019, 56, 220-229. [CrossRef]
- De Maria, R.; Maggiora, P.; Biolatti, B.; Prat, M.; Comoglio, P.M.; Castagnaro, M.; Di Renzo, M.F. Feline STK Gene Expression inMammary Carcinomas. Oncogene 2002, 21, 1785-1790. [CrossRef] [PubMed]
- Nascimento, C.; Gameiro, A.; Ferreira, J.; Correia, J.; Ferreira, F. Diagnostic Value of VEGF-A, VEGFR-1 and VEGFR-2 in FelineMammary Carcinoma. Cancers 2021, 13, 117. [CrossRef] [PubMed]
- Millanta, F.; Silvestri, G.; Vaselli, C.; Citi, S.; Pisani, G.; Lorenzi, D.; Poli, A. The Role of Vascular Endothelial Growth Factor and ItsReceptor Flk-1/KDR in Promoting Tumour Angiogenesis in Feline and Canine Mammary Carcinomas: A Preliminary Study of
Autocrine and Paracrine Loops. Res. Vet. Sci. 2006, 81, 350-357. [CrossRef] [PubMed]
- Ferreira, D.; Soares, M.; Correia, J.; Adega, F.; Ferreira, F.; Chaves, R. Assessment of ERBB2 and TOP2a Gene Status and ExpressionProfile in Feline Mammary Tumors: Findings and Guidelines. Aging 2019, 11, 4688-4705. [CrossRef] [PubMed]
- Millanta, F.; Verin, R.; Asproni, P.; Giannetti, G.; Poli, A. A Case of Feline Primary Inflammatory Mammary Carcinoma:Clinicopathological and Immunohistochemical Findings. J. Feline Med. Surg. 2012, 14, 420-423. [CrossRef]
- Soares, M.; Correia, J.; Nascimento, C.; Ferreira, F. Anaplastic Mammary Carcinoma in Cat. Vet. Sci. 2021, 8, 77. [CrossRef]
- Soares, M.; Correia, A.N.; Batista, M.R.; Correia, J.; Ferreira, F. fHER2, PR, ER, Ki-67 and Cytokeratin 5/6 Expression in Benign FelineMammary Lesions. Animals 2022, 12, 1599. [CrossRef]
- Perrier, A.; Boelle, P.-Y.; Chretien, Y.; Gligorov, J.; Lotz, J.-P.; Brault, D.; Comperat, E.; Lefevre, G.; Boissan, M. An Updated Evaluationof Serum sHER2, CA15.3, and CEA Levels as Biomarkers for the Response of Patients with Metastatic Breast Cancer to Trastuzumab-
Based Therapies. PLoS ONE 2020, 15, e0227356. [CrossRef]
- Wu, Y.; Li, L.; Zhang, D.; Ma, F. Prognostic Value of the Serum HER2 Extracellular Domain Level in Breast Cancer: A Systematic Reviewand Meta-Analysis. Cancers 2022, 14, 4551. [CrossRef]
- Gameiro, A.; Almeida, F.; Nascimento, C.; Correia, J.; Ferreira, F. Tyrosine Kinase Inhibitors Are Promising Therapeutic Tools for Cats with HER2-Positive Mammary Carcinoma. Pharmaceutics 2021, 13, 346. [CrossRef]
- Gameiro, A.; Nascimento, C.; Correia, J.; Ferreira, F. HER2-Targeted Immunotherapy and Combined Protocols Showed Promising Antiproliferative Effects in Feline Mammary Carcinoma Cell-Based Models. Cancers 2021, 13, 2007. [CrossRef] [PubMed]
- Santos, S.; Bastos, E.; Baptista, C.S.; Sa, D.; Caloustian, C.; Guedes-Pinto, H.; Gartner, F.; Gut, I.G.; Chaves, R. Sequence Variants and Haplotype Analysis of Cat ERBB2 Gene: A Survey on Spontaneous Cat Mammary Neoplastic and Non-Neoplastic Lesions. Int. J. Mol. Sci. 2012,13, 2783-2800. [CrossRef] [PubMed]
- Malaguti, P.; Vari, S.; Cognetti, F.; Fabi, A. The Mammalian Target of Rapamycin Inhibitors in Breast Cancer: Current Evidence and Future Directions. Anticancer. Res. 2013, 33, 21-28.
- Michishita, M.; Ohtsuka, A.; Nakahira, R.; Tajima, T.; Nakagawa, T.; Sasaki, N.; Arai, T.; Takahashi, K. Anti-Tumor Effect of Bevacizumab on a Xenograft Model of Feline Mammary Carcinoma. J. Vet. Med. Sci. 2016, 78, 685-689. [CrossRef]
- Bergkvist, G.T.; Argyle, D.J.; Morrison, L.; MacIntyre, N.; Hayes, A.; Yool, D.A. Expression of Epidermal Growth Factor Receptor (EGFR) and Ki67 in Feline Oral Squamous Cell Carcinomas (FOSCC). Vet. Comp. Oncol. 2011, 9, 106-117. [CrossRef]
- Yoshikawa, H.; Ehrhart, E.J.; Charles, J.B.; Thamm, D.H.; Larue, S.M. Immunohistochemical Characterization of Feline Oral Squamous Cell Carcinoma. Am. J. Vet. Res. 2012, 73, 1801-1806. [CrossRef] [PubMed]
- Sabattini, S. Epidermal Growth Factor Receptor Expression Is Predictive of Poor Prognosis in Feline Cutaneous Squamous Cell Carcinoma. J. Feline Med. Surg. 2010, 12, 760-768. [CrossRef] [PubMed]
- Kabak, Y.B.; Sozmen, M.; Devrim, A.K.; Sudagidan, M.; Yildirim, F.; Guvenc, T.; Yarim, M.; Gulbahar, Y.M.; Ahmed, I.; Karaca, E.; et al. Expression Levels of Angiogenic Growth Factors in Feline Squamous Cell Carcinoma. Acta Vet. Hung. 2020, 68, 37-48. [CrossRef]
- Bergkvist, G.T.; Argyle, D.J.; Pang, L.Y.; Muirhead, R.; Yool, D.A. Studies on the Inhibition of Feline EGFR in Squamous Cell Carcinoma: Enhancement of Radiosensitivity and Rescue of Resistance to Small Molecule Inhibitors. Cancer Biol. Ther. 2011, 11, 927-937. [CrossRef]
- Altamura, G.; Borzacchiello, G. Anti-EGFR Monoclonal Antibody Cetuximab Displays Potential Anti-Cancer Activities in Feline Oral Squamous Cell Carcinoma Cell Lines. Front. Vet. Sci. 2022, 9, 1040552. [CrossRef]
- Rathore, K.; Alexander, M.; Cekanova, M. Piroxicam Inhibits Masitinib-Induced Cyclooxygenase 2 Expression in Oral Squamous Cell Carcinoma Cells in Vitro. Transl. Res. 2014, 164, 158-168. [CrossRef]
- Pang, L.Y.; Bergkvist, G.T.; Cervantes-Arias, A.; Yool, D.A.; Muirhead, R.; Argyle, D.J. Identification of Tumour Initiating Cells in Feline Head and Neck Squamous Cell Carcinoma and Evidence for Gefitinib Induced Epithelial to Mesenchymal Transition. Vet. J. 2012, 193, 46-52. [CrossRef]
- Wiles, V.; Hohenhaus, A.; Lamb, K.; Zaidi, B.; Camps-Palau, M.; Leibman, N. Retrospective Evaluation of Toceranib Phosphate (Palladia) in Cats with Oral Squamous Cell Carcinoma. J. Feline Med. Surg. 2017, 19, 185-193. [CrossRef]
- Kopke, M.A.; Gal, A.; Piripi, S.A.; Poirier, V.J. Squamous Cell Carcinoma of the Anal Sac in Two Cats. J. Small Anim. Pract. 2021, 62, 704-708. [CrossRef]
- Hendrick, M.J.; Brooks, J.J. Postvaccinal Sarcomas in the Cat: Histology and Immunohistochemistry. Vet. Pathol. 1994, 31, 126-129. [CrossRef] [PubMed]
- Hartmann, K.; Day, M.J.; Thiry, E.; Lloret, A.; Frymus, T.; Addie, D.; Boucraut-Baralon, C.; Egberink, H.; Gruffydd-Jones, T.; Horzinek, M.C.; et al. Feline Injection-Site Sarcoma: ABCD Guidelines on Prevention and Management. J. Feline Med. Surg. 2015, 17, 606-613. [CrossRef] [PubMed]
- Holtermann, N.; Kiupel, M.; Hirschberger, J. The Tyrosine Kinase Inhibitor Toceranib in Feline Injection Site Sarcoma: Efficacy and Side Effects. Vet. Comp. Oncol. 2017, 15, 632-640. [CrossRef] [PubMed]
- Carneiro, C.S.; de Queiroz, G.F.; Pinto, A.C.; Dagli, M.L.; Matera, J.M. Feline Injection Site Sarcoma: Immunohistochemical Characteristics. J. Feline Med. Surg. 2019, 21, 314-321. [CrossRef]
- Smith, A.J. Immunohistochemical Expression of c-KIT Protein in Feline Soft Tissue Fibrosarcomas. Vet. Pathol. 2009, 46, 934-939. [CrossRef] [PubMed]
- Lawrence, J.; Saba, C.; Gogal, R.; Lamberth, O.; Vandenplas, M.L.; Hurley, D.J.; Dubreuil, P.; Hermine, O.; Dobbin, K.; Turek, M. Masitinib Demonstrates Anti-Proliferative and pro-Apoptotic Activity in Primary and Metastatic Feline Injection-Site Sarcoma Cells. Vet. Comp. Oncol. 2012, 10, 143-154. [CrossRef] [PubMed]
- Hendrick, M.J. Feline Vaccine-Associated Sarcomas. Cancer Investig. 1999, 17, 273-277. [CrossRef] [PubMed]
- Ludwig, L.; Dobromylskyj, M.; Wood, G.A.; van der Weyden, L. Feline Oncogenomics: What Do We Know about the Genetics of Cancerin Domestic Cats? Vet. Sci. 2022, 9, 547. [CrossRef] [PubMed]
- Thomas, R.; Pontius, J.U.; Borst, L.B.; Breen, M. Development of a Genome-Wide Oligonucleotide Microarray Platform for Detection ofDNA Copy Number Aberrations in Feline Cancers. Vet. Sci. 2020, 7, 88. [CrossRef]
- Dubreuil, P.; Letard, S.; Ciufolini, M.; Gros, L.; Humbert, M.; Casteran, N.; Borge, L.; Hajem, B.; Lermet, A.; Sippl, W.; et al. Masitinib(AB1010), a Potent and Selective Tyrosine Kinase Inhibitor Targeting KIT. PLoS ONE 2009, 4, e7258. [CrossRef] [PubMed]
- Feldhaeusser, B.R.; Turek, M.; Lawrence, J.; Cornell, K.; Gogal, R.M. Influence of Different Cell Storage/Culture Conditions on Spontaneous Proliferation and Level of Tyrosine Kinase Receptor Inhibition in Two Feline Injection-Site Sarcoma Cell Lines. J.Immunoass. Immunochem. 2013, 34, 266-282. [CrossRef]
- Turek, M.; Gogal, R.; Saba, C.; Vandenplas, M.L.; Hill, J.; Feldhausser, B.; Lawrence, J. Masitinib Mesylate Does Not Enhance Sensitivity to Radiation in Three Feline Injection-Site Sarcoma Cell Lines under Normal Growth Conditions. Res. Vet. Sci. 2014, 96, 304-307. [CrossRef]
- Ledoux, J.-M.; Brun, P.; Chapuis, T.; Dumas, P.; Guillotin, J. Medical Approach to the Treatment of Feline Injection Site Sarcoma with Masitinib: A Case Report. Vet. Med. 2014, 5, 109-113. [CrossRef]
- Morini, M.; Gentilini, F.; Pietra, M.; Spadari, A.; Turba, M.E.; Mandrioli, L.; Bettini, G. Cytological, Immunohistochemical and Mutational Analysis of a Gastric Gastrointestinal Stromal Tumour in a Cat. J. Comp. Pathol. 2011, 145, 152-157. [CrossRef]
- McGregor, O.; Moore, A.; Yeomans, S. Management of a Feline Gastric Stromal Cell Tumour with Toceranib Phosphate: A Case Study.Aust. Vet. J. 2020, 98, 181-184. [CrossRef]
- Fujii, Y.; Iwasaki, R.; Ikeda, S.; Chimura, S.; Goto, M.; Yoshizaki, K.; Sakai, H.; Ito, N.; Mori, T. Gastrointestinal Stromal Tumour Lacking Mutations in the KIT and PDGFRA Genes in a Cat. J. Small Anim. Pract. 2022, 63, 239-243. [CrossRef]
- Suwa, A.; Shimoda, T. Intestinal Gastrointestinal Stromal Tumor in a Cat. J. Vet. Med. Sci. 2017, 79, 562-566. [CrossRef] [PubMed]
- Schaefer, I.-M.; Marino-Enriquez, A.; Fletcher, J.A. What Is New in Gastrointestinal Stromal Tumor? Adv. Anat. Pathol. 2017, 24, 259-267. [CrossRef] [PubMed]
- Del Alcazar, C.M.; Mahoney, J.A.; Dittrich, K.; Stefanovski, D.; Church, M.E. Outcome, Prognostic Factors and HistologicalCharacterization of Canine Gastrointestinal Sarcomas. Vet. Comp. Oncol. 2021, 19, 578-586. [CrossRef] [PubMed]
- Muscatello, L.V.; Oto, E.D.; Dignazzi, M.; Murphy, W.J.; Porcellato, I.; De Maria, R.; Raudsepp, T.; Foschini, M.P.; Sforna, M.; Benazzi,C.; et al. HER2 Overexpression and Amplification in Feline Pulmonary Carcinoma. Vet. Pathol. 2021, 58, 527-530. [CrossRef]
- D’Costa, S.; Yoon, B.-I.; Kim, D.-Y.; Motsinger-Reif, A.A.; Williams, M.; Kim, Y. Morphologic and Molecular Analysis of 39Spontaneous Feline Pulmonary Carcinomas. Vet. Pathol. 2012, 49, 971-978. [CrossRef]
- Bonsembiante, F.; Benali, S.L.; Trez, D.; Aresu, L.; Gelain, M.E. Histological and Immunohistochemical Characterization of FelineRenal Cell Carcinoma: A Case Series. J. Vet. Med. Sci. 2016, 78, 1039-1043. [CrossRef]
- Wu, B.; Kastl, B.; Cino-Ozuna, A.G.; Springer, N.L.; Thakkar, R.; Biller, D.; Whitehouse, W.; Easterwood, L.; Nguyen, T.A. FelineSarcomatoid Renal Cell Carcinoma with Peritoneal Carcinomatosis and Effusion. J. Vet. Diagn. Investig. 2022, 34, 153-159. [CrossRef]
- Rushton, J.G.; Korb, M.; Kummer, S.; Reichart, U.; Fuchs-Baumgartinger, A.; Tichy, A.; Nell, B. Protein Expression of KIT, BRAF,GNA11, GNAQ and RASSF1 in Feline Diffuse Iris Melanomas. Vet. J. 2019, 249, 33-40. [CrossRef]
- Henker, L.C.; Dal Pont, T.P.; Dos Santos, I.R.; Bandinelli, M.B.; Zardo, I.L.; Rodrigues, R.; Pavarini, S.P. Duodenal Leiomyosarcoma ina Cat: Cytologic, Pathologic, and Immunohistochemical Findings. Vet. Clin. Pathol. 2022, 51, 507-510. [CrossRef]
- Teo, L.H.W.; Cahalan, S.D.; Benigni, L.; Halfacree, Z. Oesophageal Angioleiomyosarcoma in a Cat. J. Feline Med. Surg. 2014, 16, 846-852.[CrossRef]
- Yoshida, K.; Chambers, J.K.; Nibe, K.; Kagawa, Y.; Uchida, K. Immunohistochemical Analyses of Neural Stem Cell Lineage Markers inNormal Feline Brains and Glial Tumors. Vet. Pathol. 2023, 3009858231182337. [CrossRef] [PubMed]
- Boland, L.; Setyo, L.; Sangster, C.; Brunel, L.; Foo, T.; Bennett, P. Colonic Malignant Peripheral Nerve Sheath Tumour in a Cat. J. FelineMed. Surg. Open Rep. 2019, 5, 2055116919849979. [CrossRef] [PubMed]
- Aloisio, F.; Levine, J.M.; Edwards, J.F. Immunohistochemical Features of a Feline Spinal Cord Gemistocytic Astrocytoma. J. Vet. Diagn.Investig. 2008, 20, 836-838. [CrossRef] [PubMed]
- van der Steen, F.E.M.M.; Grinwis, G.C.M.; Weerts, E.A.W.S.; Teske, E. Feline and Canine Merkel Cell Carcinoma: A Case Series andDiscussion on Cellular Origin. Vet. Comp. Oncol. 2021, 19, 393-398. [CrossRef] [PubMed]
- Todd, J.E.; Nguyen, S.M. Long-Term Survival in a Cat with Pancreatic Adenocarcinoma Treated with Surgical Resection andToceranib Phosphate. J. Feline Med. Surg. Open Rep. 2020, 6, 2055116920924911. [CrossRef] [PubMed]
- Dedeaux, A.M.; Langohr, I.M.; Boudreaux, B.B. Long-Term Clinical Control of Feline Pancreatic Carcinoma with Toceranib Phosphate.Can. Vet. J. 2018, 59, 751-754.
- Martinez, I.; Brockman, D.; Purzycka, K. Caval Chemodectoma in a Cat. J. Feline Med. Surg. Open Rep. 2022, 8, 20551169221106990.[CrossRef]
- Azevedo, C.; Brawner, W.; Schleis Lindley, S.; Smith, A. Multimodal Non-Surgical Treatment of a Feline Tracheal Adenocarcinoma. J.Feline Med. Surg. Open Rep. 2017, 3, 2055116916689630. [CrossRef]
- Backlund, B.; Cianciolo, R.E.; Cook, A.K.; Clubb, F.J.; Lees, G.E. Minimal Change Glomerulopathy in a Cat. J. Feline Med. Surg. 2011, 13,291-295. [CrossRef]
- Mazieres, J.; Peters, S.; Lepage, B.; Cortot, A.B.; Barlesi, F.; Beau-Faller, M.; Besse, B.; Blons, H.; Mansuet-Lupo, A.; Urban, T.; et al.Lung Cancer That Harbors an HER2 Mutation: Epidemiologic Characteristics and Therapeutic Perspectives. J. Clin. Oncol. 2013, 31,
1997-2003. [CrossRef]
- Uy, N.F.; Merkhofer, C.M.; Baik, C.S. HER2 in Non-Small Cell Lung Cancer: A Review of Emerging Therapies. Cancers 2022,14, 4155. [CrossRef] [PubMed]
- Misirlioglu, D.; Nak, D.; Ozyigit, M.O.; Nak, Y.; Akkoc, A. HER-2/Neu (c-erbB-2) Oncoprotein in Hyperplastic Endometrial PolypsDetected in Two Cats. J. Feline Med. Surg. 2009, 11, 885-888. [CrossRef] [PubMed]
- Scurrell, E.; Trott, A.; Rozmanec, M.; Belford, C.J. Ocular Histiocytic Sarcoma in a Cat. Vet. Ophthalmol. 2013, 16, 173-176. [CrossRef][PubMed]
- Rushton, J.G.; Ertl, R.; Klein, D.; Nell, B. Mutation Analysis and Gene Expression Profiling of Ocular Melanomas in Cats. Vet. Comp. Oncol. 2017,15, 1403-1416. [CrossRef]
- Lee-Fowler, T.M.; Guntur, V.; Dodam, J.; Cohn, L.A.; DeClue, A.E.; Reinero, C.R. The Tyrosine Kinase Inhibitor Masitinib Blunts Airway Inflammation and Improves Associated Lung Mechanics in a Feline Model of Chronic Allergic Asthma. Int. Arch. Allergy Immunol. 2012,158, 369-374. [CrossRef]
- Davidescu, L.; Ursol, G.; Korzh, O.; Deshmukh, V.; Kuryk, L.; Nortje, M.-M.; Godlevska, O.; Devouassoux, G.; Khodosh, E.; Israel, E.; et al. Efficacy and Safety of Masitinib in Corticosteroid-Dependent Severe Asthma: A Randomized Placebo-Controlled Trial. J. Asthma Allergy 2022, 15, 737-747. [CrossRef]
- Noli, C.; Matricoti, I.; Schievano, C. A Double-Blinded, Randomized, Methylprednisolone-Controlled Study on the Efficacy of Oclacitinib in the Management of Pruritus in Cats with Nonflea Nonfood-Induced Hypersensitivity Dermatitis. Vet. Dermatol. 2019, 30, 110-e30. [CrossRef]
- Carrasco, I.; Ferrer, L.; Puigdemont, A. Efficacy of Oclacitinib for the Control of Feline Atopic Skin Syndrome: Correlating Plasma Concentrations with Clinical Response. J. Feline Med. Surg. 2022, 24, 787-793. [CrossRef]
- Ortalda, C.; Noli, C.; Colombo, S.; Borio, S. Oclacitinib in Feline Nonflea-, Nonfood-Induced Hypersensitivity Dermatitis: Results of a Small Prospective Pilot Study of Client-Owned Cats. Vet. Dermatol. 2015, 26, 235-e52. [CrossRef]
- Steffan, J.; Olivry, T.; Forster, S.L.; Seewald, W. Responsiveness and Validity of the SCORFAD, an Extent and Severity Scale for Feline Hypersensitivity Dermatitis. Vet. Dermatol. 2012, 23, 410-e77. [CrossRef]
- Rybnfcek, J.; Lau-Gillard, P.J.; Harvey, R.; Hill, P.B. Further Validation of a Pruritus Severity Scale for Use in Dogs. Vet. Dermatol. 2009, 20, 115-122. [CrossRef] [PubMed]
- London, C.A.; Hannah, A.L.; Zadovoskaya, R.; Chien, M.B.; Kollias-Baker, C.; Rosenberg, M.; Downing, S.; Post, G.; Boucher, J.; Shenoy, N.; et al. Phase I Dose-Escalating Study of SU11654, a Small Molecule Receptor Tyrosine Kinase Inhibitor, in Dogs with Spontaneous Malignancies. Clin. Cancer Res. 2003, 9, 2755-2768.
- Merrick, C.H.; Pierro, J.; Schleis, S.E.; Sones, E.A.; Wright, Z.M.; Regan, R.C.; Siedlecki, C.T.; Bergman, P.J. Retrospective Evaluation ofToceranib Phosphate (Palladia®) Toxicity in Cats. Vet. Comp. Oncol. 2017, 15, 710-717. [CrossRef] [PubMed]
- Harper, A.; Blackwood, L. Toxicity and Response in Cats with Neoplasia Treated with Toceranib Phosphate. J. Feline Med. Surg. 2017, 19, 619-623. [CrossRef]
- Olmsted, G.A.; Farrelly, J.; Post, G.S.; Smith, J. Tolerability of Toceranib Phosphate (Palladia) When Used in Conjunction with Other Therapies in 35 Cats with Feline Oral Squamous Cell Carcinoma: 2009-2013. J. Feline Med. Surg. 2017, 19, 568-575. [CrossRef]
- Yancey, M.F.; Merritt, D.A.; White, J.A.; Marsh, S.A.; Locuson, C.W. Distribution, Metabolism, and Excretion of Toceranib Phosphate (PalladiaTM, SU11654), a Novel Tyrosine Kinase Inhibitor, in Dogs. J. Vet. Pharmacol. Ther. 2010, 33, 154-161. [CrossRef] [PubMed]
- Cavalcanti, J.V.J.; Hasbach, A.; Barnes, K.; Dange, R.B.; Patterson, J.; Saavedra, P.V. Skin Depigmentation Associated with ToceranibPhosphate in a Dog. Vet. Dermatol. 2017, 28, 400-e95. [CrossRef] [PubMed]
- Bellamy, F.; Bader, T.; Moussy, A.; Hermine, O. Pharmacokinetics of Masitinib in Cats. Vet. Res. Commun. 2009, 33, 831-837. [CrossRef]
- Daly, M.; Sheppard, S.; Cohen, N.; Nabity, M.; Moussy, A.; Hermine, O.; Wilson, H. Safety of Masitinib Mesylate in Healthy Cats. J. Vet.Intern. Med. 2011, 25, 297-302. [CrossRef]
- Deininger, M.; Buchdunger, E.; Druker, B.J. The Development of Imatinib as a Therapeutic Agent for Chronic Myeloid Leukemia. Blood2005, 105, 2640-2653. [CrossRef]
- Bonkobara, M. Dysregulation of Tyrosine Kinases and Use of Imatinib in Small Animal Practice. Vet. J. 2015, 205, 180-188. [CrossRef]
- Cochet Faivre, N.; Prelaud, P.; Bensignor, E.; Declercq, J.; Defalque, V. Three Cases of Feline Hypereosinophilic Syndrome Treated withImatinib Mesilate. Rev. Veterinaire Clin. 2014, 49, 139-144. [CrossRef]
- Sum, S.O.; Hensel, P.; Rios, L.; Brown, S.; Howerth, E.W.; Driskell, E.A.; Moussy, A.; Hermine, O.; Brown, C.A. Drug-Induced MinimalChange Nephropathy in a Dog. J. Vet. Intern. Med. 2010, 24, 431-435. [CrossRef]
- Devine, L.; Polzin, D.J. Presumed Masitinib-Induced Nephrotic Syndrome and Azotemia in a Dog. Can. Vet. J. 2016, 57, 752-756.
- Kerkela, R.; Grazette, L.; Yacobi, R.; Iliescu, C.; Patten, R.; Beahm, C.; Walters, B.; Shevtsov, S.; Pesant, S.; Clubb, F.J.; et al. Cardiotoxicityof the Cancer Therapeutic Agent Imatinib Mesylate. Nat. Med. 2006, 12, 908-916. [CrossRef] [PubMed]
- Orphanos, G.S.; Ioannidis, G.N.; Ardavanis, A.G. Cardiotoxicity Induced by Tyrosine Kinase Inhibitors. Acta Oncol. 2009, 48, 964-970.[CrossRef]
- Cosgrove, S.B.; Cleaver, D.M.; King, V.L.; Gilmer, A.R.; Daniels, A.E.; Wren, J.A.; Stegemann, M.R. Long-Term Compassionate Use ofOclacitinib in Dogs with Atopic and Allergic Skin Disease: Safety, Efficacy and Quality of Life. Vet. Dermatol. 2015, 26, 171-179.e35.
[CrossRef]
- Ferrer, L.; Carrasco, I.; Cristdfol, C.; Puigdemont, A. A Pharmacokinetic Study of Oclacitinib Maleate in Six Cats. Vet. Dermatol. 2020, 31,134-137. [CrossRef]
- Lopes, N.L.; Campos, D.R.; Machado, M.A.; Alves, M.S.R.; de Souza, M.S.G.; da Veiga, C.C.P.; Merlo, A.; Scott, F.B.; Fernandes, J.I. ABlinded, Randomized, Placebo-Controlled Trial of the Safety of Oclacitinib in Cats. BMC Vet. Res. 2019, 15, 137. [CrossRef] [PubMed]
- Collard, W.T.; Hummel, B.D.; Fielder, A.F.; King, V.L.; Boucher, J.F.; Mullins, M.A.; Malpas, P.B.; Stegemann, M.R. The Pharmacokinetics of Oclacitinib Maleate, a Janus Kinase Inhibitor, in the Dog. J. Vet. Pharmacol. Ther. 2014, 37, 279-285. [CrossRef] [PubMed]
- Moore, A.; Burrows, A.K.; Malik, R.; Ghubash, R.M.; Last, R.D.; Remaj, B. Fatal Disseminated Toxoplasmosis in a Feline Immunodeficiency Virus-Positive Cat Receiving Oclacitinib for Feline Atopic Skin Syndrome. Vet. Dermatol. 2022, 33, 435-439. [CrossRef] [PubMed]
- Chen, P.; Marconato, L.; Sabattini, S.; Kiupel, M. Mutations in Exons 8 and 11 of c-KIT Gene in Canine Subcutaneous Mast Cell Tumors and Their Association with Cell Proliferation. Vet. Sci. 2022, 9, 493. [CrossRef] [PubMed]
- Brocks, B.A.W.; Bertram, C.A.; Bartel, A.; Kirpensteijn, J.; Collins-Webb, A.; Catlin, C.; Thaiwong, T.; Kiupel, M. Internal Tandem Duplication of Exon 8 of c-KIT Is Associated with Longer Total Survival in Canine Cutaneous Mast Cell Tumors. Vet. Pathol. 2021, 58, 315-324. [CrossRef] [PubMed]
- Smrkovski, O.A.; Essick, L.; Rohrbach, B.W.; Legendre, A.M. Masitinib Mesylate for Metastatic and Non-Resectable Canine Cutaneous Mast Cell Tumours. Vet. Comp. Oncol. 2015, 13, 314-321. [CrossRef]
- Grant, J.; North, S.; Lanore, D. Clinical Response of Masitinib Mesylate in the Treatment of Canine Macroscopic Mast Cell Tumours. J. Small Anim. Pract. 2016, 57, 283-290. [CrossRef]
- Macedo, T.R.; de Queiroz, G.F.; Casagrande, T.A.C.; Alexandre, P.A.; Brandao, P.E.; Fukumasu, H.; Melo, S.R.; Dagli, M.L.Z.; Pinto, A.C.B.C.F.; Matera, J.M. Imatinib Mesylate for the Treatment of Canine Mast Cell Tumors: Assessment of the Response and Adverse Events in Comparison with the Conventional Therapy with Vinblastine and Prednisone. Cells 2022, 11, 571. [CrossRef]
- Robat, C.; London, C.; Bunting, L.; McCartan, L.; Stingle, N.; Selting, K.; Kurzman, I.; Vail, D.M. Safety Evaluation of CombinationVinblastine and Toceranib Phosphate (Palladia®) in Dogs: A Phase I Dose-Finding Study. Vet. Comp. Oncol. 2012, 10, 174-183. [CrossRef]
- Olsen, J.A.; Thomson, M.; O’Connell, K.; Wyatt, K. Combination Vinblastine, Prednisolone and Toceranib Phosphate for Treatment ofGrade II and III Mast Cell Tumours in Dogs. Vet. Med. Sci. 2018, 4, 237-251. [CrossRef]
- Todd, J.E.; Nguyen, S.M.; White, J.; Langova, V.; Thomas, P.M.; Tzannes, S. Combination Vinblastine and Palladia for High-Grade andMetastatic Mast Cell Tumors in Dogs. Can. Vet. J. 2021, 62, 1335-1340.
- Bavcar, S.; de Vos, J.; Kessler, M.; de Fornel, P.; Buracco, P.; Murphy, S.; Hirschberger, J.; Argyle, D.J. Combination Toceranib andLomustine Shows Frequent High Grade Toxicities When Used for Treatment of Non-Resectable or Recurrent Mast Cell Tumours in
Dogs: A European Multicentre Study. Vet. J. 2017, 224, 1-6. [CrossRef]
- Slamon, D.J.; Clark, G.M.; Wong, S.G.; Levin, W.J.; Ullrich, A.; McGuire, W.L. Human Breast Cancer: Correlation of Relapse and Survivalwith Amplification of the HER-2/Neu Oncogene. Science 1987, 235, 177-182. [CrossRef] [PubMed]
- Wolff, A.C.; Hammond, M.E.H.; Allison, K.H.; Harvey, B.E.; Mangu, P.B.; Bartlett, J.M.S.; Bilous, M.; Ellis, I.O.; Fitzgibbons, P.; Hanna,W.; et al. Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer: American Society of Clinical Oncol- ogy/College of
American Pathologists Clinical Practice Guideline Focused Update. Arch. Pathol. Lab. Med. 2018, 142, 1364-1382. [CrossRef] [PubMed]
- Petrucci, G.N.; Henriques, J.; Lobo, L.; Vilhena, H.; Figueira, A.C.; Canadas-Sousa, A.; Dias-Pereira, P.; Prada, J.; Pires, I.; Queiroga, F.L. Adjuvant Doxorubicin vs Metronomic Cyclophosphamide and Meloxicam vs Surgery Alone for Cats with Mammary Carcinomas: ARetrospective Study of 137 Cases. Vet. Comp. Oncol. 2021, 19, 714-723. [CrossRef] [PubMed]
- McNeill, C.J.; Sorenmo, K.U.; Shofer, F.S.; Gibeon, L.; Durham, A.C.; Barber, L.G.; Baez, J.L.; Overley, B. Evaluation of AdjuvantDoxorubicin-Based Chemotherapy for the Treatment of Feline Mammary Carcinoma. J. Vet. Intern. Med. 2009, 23, 123-129. [CrossRef]
[PubMed]
- Muellerleile, L.-M.; Buxbaum, B.; Nell, B.; Fux, D.A. In-Vitro Binding Analysis of Anti-Human Vascular Endothelial Growth FactorAntibodies Bevacizumab and Aflibercept with Canine, Feline, and Equine Vascular Endothelial Growth Factor. Res. Vet. Sci. 2019, 124,
233-238. [CrossRef] [PubMed]
- Beirao, B.C.B.; Raposo, T.; Jain, S.; Hupp, T.; Argyle, D.J. Challenges and Opportunities for Monoclonal Antibody Therapy in VeterinaryOncology. Vet. J. 2016, 218, 40-50. [CrossRef]
- Hambly, J.N.; Ruby, C.E.; Mourich, D.V.; Bracha, S.; Dolan, B.P. Potential Promises and Perils of Human Biological Treatments forImmunotherapy in Veterinary Oncology. Vet. Sci. 2023, 10, 336. [CrossRef]
- Singer, J.; Fazekas, J.; Wang, W.; Weichselbaumer, M.; Matz, M.; Mader, A.; Steinfellner, W.; Meitz, S.; Mechtcheriakova, D.; Sobanov,Y.; et al. Generation of a Canine Anti-EGFR (ErbB-1) Antibody for Passive Immunotherapy in Dog Cancer Patients. Mol. Cancer Ther.
2014, 13, 1777-1790. [CrossRef]
- Gruen, M.E.; Myers, J.A.E.; Tena, J.-K.S.; Becskei, C.; Cleaver, D.M.; Lascelles, B.D.X. Frunevetmab, a Felinized Anti-Nerve GrowthFactor Monoclonal Antibody, for the Treatment of Pain from Osteoarthritis in Cats. J. Vet. Intern. Med. 2021, 35, 2752-2762. [CrossRef]
- Wypij, J.M. A Naturally Occurring Feline Model of Head and Neck Squamous Cell Carcinoma. Pathol. Res. Int. 2013, 2013, 502197.[CrossRef]
- Bilgic, O.; Duda, L.; Sanchez, M.D.; Lewis, J.R. Feline Oral Squamous Cell Carcinoma: Clinical Manifestations and Literature Review. J.Vet. Dent. 2015, 32, 30-40. [CrossRef] [PubMed]
- Sodani, K.; Tiwari, A.K.; Singh, S.; Patel, A.; Xiao, Z.-J.; Chen, J.-J.; Sun, Y.-L.; Talele, T.T.; Chen, Z.-S. GW583340 and GW2974, Human EGFR and HER-2 Inhibitors, Reverse ABCG2- and ABCB1-Mediated Drug Resistance. Biochem. Pharmacol. 2012, 83, 1613-1622. [CrossRef] [PubMed]
- Smilek, P.; Neuwirthova, J.; Jarkovsky, J.; Dusek, L.; Rottenberg, J.; Kostrica, R.; Srovnal, J.; Hajduch, M.; Drabek, J.; Klozar, J. Epidermal Growth Factor Receptor (EGFR) Expression and Mutations in the EGFR Signaling Pathway in Correlation with Anti-EGFR Therapy in Head and Neck Squamous Cell Carcinomas. Neoplasma 2012, 59, 508-515. [CrossRef]
- Kyriazoglou, A.; Gkaralea, L.E.; Kotsantis, I.; Anastasiou, M.; Pantazopoulos, A.; Prevezanou, M.; Chatzidakis, I.; Kavourakis, G.; Economopoulou, P.; Nixon, I.F.; et al. Tyrosine Kinase Inhibitors in Sarcoma Treatment. Oncol. Lett. 2022, 23, 183. [CrossRef] [PubMed]
- Muller, N.; Kessler, M. Curative-Intent Radical En Bloc Resection Using a Minimum of a 3 Cm Margin in Feline Injection-Site Sarcomas: A Retrospective Analysis of 131 Cases. J. Feline Med. Surg. 2018, 20, 509-519. [CrossRef] [PubMed]
- Kobayashi, T.; Hauck, M.L.; Dodge, R.; Page, R.L.; Price, G.S.; Williams, L.E.; Hardie, E.M.; Mathews, K.G.; Thrall, D.E. Preoperative Radiotherapy for Vaccine Associated Sarcoma in 92 Cats. Vet. Radiol. Ultrasound 2002, 43, 473-479. [CrossRef]
- Waarts, M.R.; Stonestrom, A.J.; Park, Y.C.; Levine, R.L. Targeting Mutations in Cancer. J. Clin. Investig. 2022, 132, e154943. [CrossRef]
- Aleksakhina, S.N.; Imyanitov, E.N. Cancer Therapy Guided by Mutation Tests: Current Status and Perspectives. Int. J. Mol. Sci. 2021, 22,10931. [CrossRef]
- Choi, H.Y.; Chang, J.-E. Targeted Therapy for Cancers: From Ongoing Clinical Trials to FDA-Approved Drugs. Int. J. Mol. Sci. 2023, 24,13618. [CrossRef]
- Buckley, R.M.; Davis, B.W.; Brashear, W.A.; Farias, F.H.G.; Kuroki, K.; Graves, T.; Hillier, L.W.; Kremitzki, M.; Li, G.; Middleton, R.P.;et al. A New Domestic Cat Genome Assembly Based on Long Sequence Reads Empowers Feline Genomic Medicine and Identifies a
Novel Gene for Dwarfism. PLOS Genet. 2020, 16, e1008926. [CrossRef]
- Kuijlaars, M.; Helm, J.; McBrearty, A. Development and Progression of Proteinuria in Dogs Treated with Masitinib for Neoplasia: 28Cases (2010-2019). J. Small Anim. Pract. 2021, 62, 646-654. [CrossRef] [PubMed]
- Caldemeyer, L.; Dugan, M.; Edwards, J.; Akard, L. Long-Term Side Effects of Tyrosine Kinase Inhibitors in Chronic Myeloid Leukemia.Curr. Hematol. Malig. Rep. 2016, 11, 71-79. [CrossRef] [PubMed]
- Dong, E.E.; Bruno, M.A.; Kim, J.J.; Bernhardt, M.B.; Brown, A.L.; Gramatges, M.M. Distribution and Frequency of Tyrosine KinaseInhibitor-Associated Long-Term Complications in Children with Chronic Myeloid Leukemia. Pediatr. Blood Cancer 2022, 69, e29786.
[CrossRef] [PubMed]
- Grindlay, D.J.C.; Brennan, M.L.; Dean, R.S. Searching the Veterinary Literature: A Comparison of the Coverage of Veterinary Journalsby Nine Bibliographic Databases. J. Vet. Med. Educ. 2012, 39, 404-412. [CrossRef] [PubMed]
Sorumluluk Reddi/Yayıncının Notu: Tüm yayınlarda yer alan ifadeler, görüşler ve veriler yalnızca yazar(lar)a ve katkıda bulunan(lar)a aittir, MDPI ve/veya editör(ler)e ait değildir. MDPI ve/veya editör(ler), içerikte atıfta bulunulan herhangi bir fikir, yöntem, talimat veya üründenkaynaklanan insanlara veya mallara gelebilecek herhangi bir zarar için sorumluluk kabul etmez..