Özet
Journal of Feline Medicine and Surgery Open Reports
1–5
© Yazar(lar) 2022
Makale yeniden kullanım yönergeleri: sagepub.com/journals-permissions
DOI: 10.1177/20551169221074231 journals.sagepub.com/home/jfmsopenreports
Bu makale, JFMS Open Reports’ta yayınlanmak üzere Avrupa Yayın Ofisi (ISFM) tarafından incelenmiş ve işleme alınmıştır.
Vaka Özeti 4 yaşında domestic shorthair cinsi bir kedi, nazal planumda 7 mm’lik melanom nedeniyle North Downs Hastanesi’ne başvurmuştur. Kemoterapötik ajan olarak intravenöz bleomisin kullanılarak iki elektrokemoterapi tedavisi uygulanmıştır. Tedaviden sonra tümör artık görünmüyordu. 292 günlük takip sonucunda bölgede nüks görülmedi ve hasta klinik olarak iyi durumdaydı.
Konuya ilişkin önemli bulgular ve yeni bilgiler Oküler olmayan kedi melanomlu kedilerin durumu ile ilgili çok az veri bulunmaktadır ve literatürde tedavi seçeneklerinden biri olarak elektrokemoterapi ile ilgili çok az bilgi mevcuttur. Mevcut veriler, nazal melanomun prognozunun daha kötü olabileceğini ve melanomların lokal olarak invaziv olduğunu ve metastaz eğiliminin yüksek olduğunu göstermektedir. Lokal kontrolü sağlamanın en etkili yolu geniş sınırlarla yapılan cerrahidir. Bu vakadaki yerleşim göz önüne alındığında, nazal planektomi gerekirken, elektrokemoterapi etkili ve daha cazip görünmektedir.
Anahtar kelimeler: Elektrokemoterapi; nazal planum melanomu; bleomisin; melanom tedavi seçenekleri Kabul tarihi: 24 Aralık 2021
Vakaya dair bilgiler
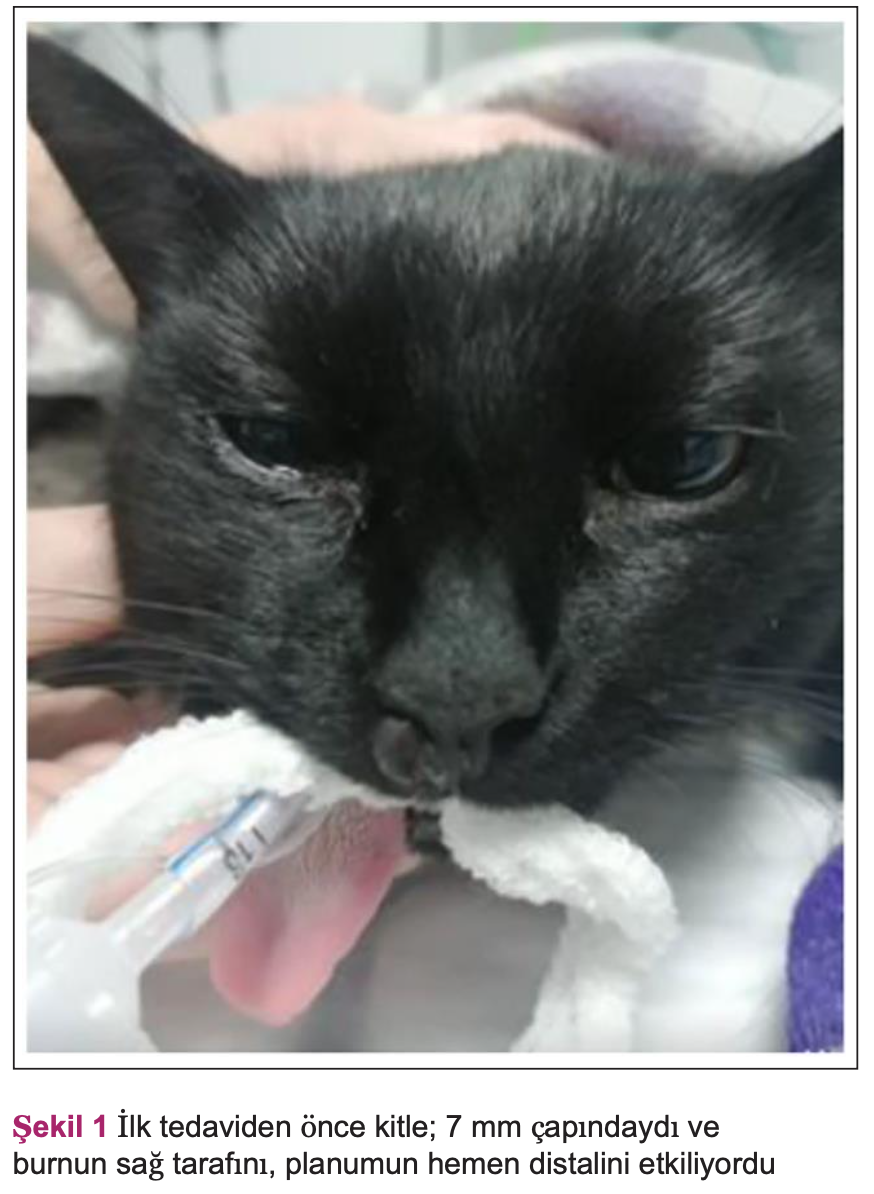
4 yaşındaki kısırlaştırılmış dişi domestic shorthair kedi, planumun hemen distalinde burnun sağ tarafını etkileyen 5 mm çapında bir kitle nedeniyle primer bakım veren veteriner hekime getirildi. İlk muayenede kitleden bir parça biyopsi alınmış ve Nationwide Laboratuarlarına gönderilerek histoloji sonucu melanom olarak teşhis edilmiştir. Histolojide 10 büyük büyütme alanında 11 mitoz görüldü. Bu, oküler olmayan kedi melanomu için histolojik sınıflandırma şemasına göre ‘yüksek gradeli melanom’ ile tutarlılık gösteriyordu.1 Kedi tedavi için North Downs Hastanesi’nin onkoloji bölümüne sevk edildi. İlk muayene ile tedavi arasındaki 2 hafta içinde 5 mm’den 7 mm’ye çıkan kitlenin hızla büyümesi endişe yaratmıştır (Şekil 1).
Kedi klinik anlamda kitleden etkilenmemiştir. Tam kapsamlı klinik muayenede başka herhangi bir soruna rastlanmadı ve kedinin öyküsünde başka önemli bir tıbbi anamnez yoktu.
Rutin hematoloji ve serum biyokimya paneli için kan örnekleri alındı; tüm sonuçlar normal sınırlar içindeydi.
Palpabl lenfadenopati yoktu; ancak lokal lenf nodlarından iğne biyopsi örneği alınmadı.
Sol sefalik vene 22 G intravenöz kateter yerleştirildi. Hastaya premidikasyon olarak 0,005 mg/kg medetomidin (Sedator 1 mg/ml; Dechra) ve 0,2 mg/kg metadon (Synthadon 10 mg/ml; Animalcare) verildi, bu ilaçlar hastada iyi bir sedasyon sağladı. Hasta propofol (Propofol-Lipuro Vet 10 mg/ml; Virbac) ile etkili olacak şekilde indüklendi (2 mg/kg gerekliydi). Hasta 3,5 numara endotrakeal tüp ile entübe edildi ve daha sonra kafı kapatıldı.
Ortogonal çekilen şişirilmiş göğüs radyografileri incelenmiş ve radyografik olarak göğüs metastazı bulgusuna rastlanmamıştır.
North Downs Hastanesi, Bletchingley, İngiltere
İlgili yazar:
Annika Little BVMS(Hons), MRCVS, North Downs Hastanesi, 3 & 4 The Brewerstreet Dairy Business Park, Brewer St, Bletchingley RH1 4QP, İngiltere
Eposta: annika.little@ndsr.co.uk
Bleomisin intravenöz olarak 20 mg/m2 dozunda bolus şeklinde enjekte edilmiştir. Pulslar veteriner hekimlikte kullanılmak üzere onaylanmışelektroporatör (Onkodisruptor) ile uygulanmıştır. Hastalar ve elektrotlar (M1 klemp elektrotları; Onkodisruptor) arasındaki temas, elektro iletken bir jel kullanılarak optimize edilmiştir. Kemoterapi enjeksiyonlarından beş dakika sonra, sekiz bifazik puls sekansı (her bir elektrik pulsunda verilen 50 μs’lik iki faz) 1200 V/cm’lik burst’lar (ani artan, yoğun puls) halinde verildi.
Genel anestezi stabildi. İyileşme yavaş ama sorunsuzdu. Atipamezol 0.001 mg/kg (Atipam 5.0 mg/ml; Dechra) ekstübasyondan önce kas içine verildi. Hasta aynı günün ilerleyen saatlerinde taburcu edildi. İşlem sırasında veya sonrasında akut başlangıçlı herhangi bir yan etki kaydedilmedi.
Hasta 5 günlük 0,05 mg/kg PO q24h meloksikam (Metacam 0,5 mg/ml kediler için oral süspansiyon; Boehringer Ingelheim) tedavisi ile taburcu edildi. Bölgede kendi kendine travma oluşmasını önlemek için sert bir Elizabethan tasması da verildi.
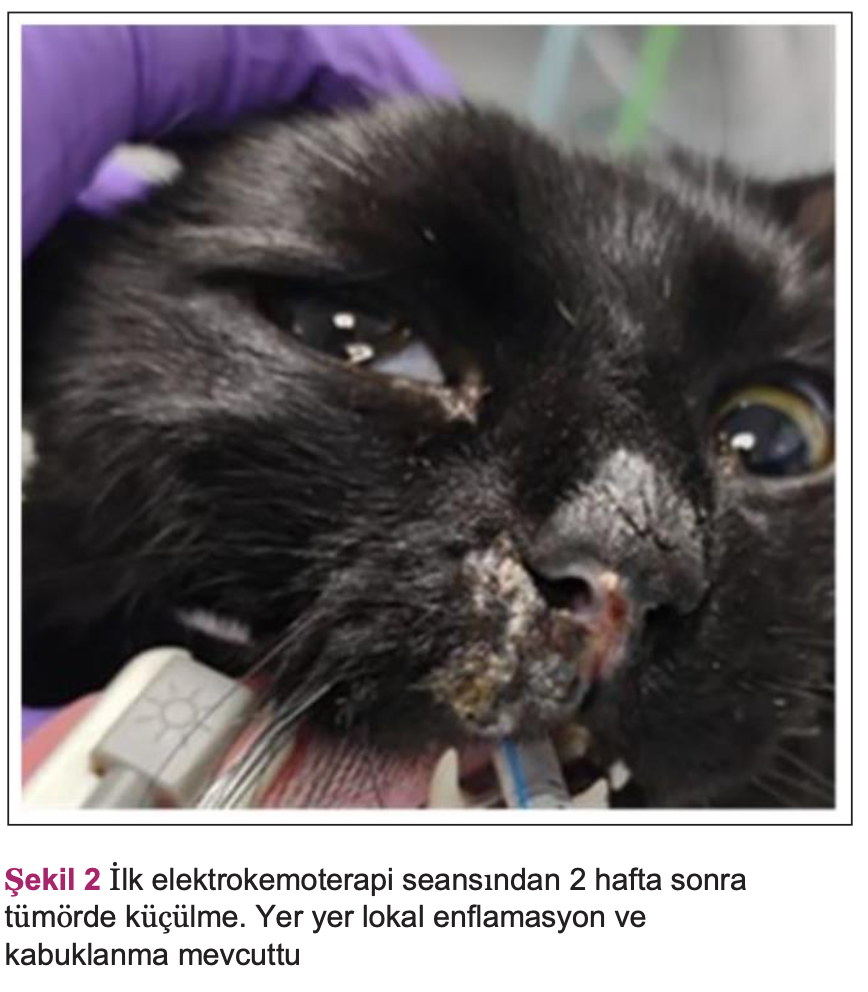
Hasta 2 hafta sonra ikinci bir elektrokemoterapi (EKT) kürü için geri döndü. Hasta sahipleri ilk EKT seansından sonra tümörde küçülme olduğunu ve bir miktar lokal iltihaplanma ve kabuklanma görüldüğünü rapor etmişlerdir. Hasta sahibi, hasta bölgeye herhangi bir tepki göstermediği için Elizabeth tasmasının evde
kullanılmadığını ve hastanın yakın gözetim altında tutularak kendi kendine travma yaşamadığını ifade etmiştir (Şekil 2).
İkinci seans için aynı genel anestezi ve EKT protokolü tekrarlandı. Anestezi ve prosedür yine sorunsuzdu ve iyileşme de sorunsuz gerçekleşti. Hasta aynı gün hiçbir endişe duymadan taburcu edildi. Gerekmesi halinde sert bir Elizabethan boyunluk verildi, ancak hasta sahibi hasta bölgeye herhangi bir ilgi göstermediği için bunun endike olmadığını tekrar bildirdi. İkinci EKT kürünün ardından, meloksikamın oral kürü tekrarlandı ve evde hapşırmanın yanı sıra bölgede lokal enflamasyon ve kabuklanma görülmesi nedeniyle 2 hafta (0,05 mg/kg PO q24h) daha uzun bir süreye çıkarıldı (Şekil 3). Bununla birlikte, hasta ikinci EKT tedavisinden sonraki 3 hafta içinde, kitlenin yanı sıra lokal kabuklanma ve enflamasyonun tamameniyileşmesiyle normal haline dönmüştür.
EKT tedavisinden altı ay sonra, orijinal kitle bölgesinde tümör büyümesinde nüks görülmedi. Bölgede lokal alopesi ve deride hafif kalınlaşma vardı (Şekil 4). Kedi klinik olarak iyiydi ve klinik muayenede palpe edilebilir lenfadenopati veya anormallik yoktu. Bu makalenin yazıldığı sırada, ikinci EKT tedavisinden 292 gün (9 ay) sonra, hasta klinik olarak çok iyi durumda seyretmeye devam etmekte, herhangi bir klinik belirti veya kitle nüksü görülmemektedir.
Tartışma
Melanomlar, melanozom aracılığıyla melanin pigmenti üreten hücreler olan melanositlerin veya öncüllerinin kontrolsüz çoğalmasından kaynaklanan tümörlerdir.2,3
İnsanlarda melanom insidansı son 50 yılda artış göstermektedir. Kutanöz insan malignitelerinin <%5’ini oluşturmasına rağmen, metastaz yapma eğilimi nedeniyle insan deri kanseri nedeniyle gerçekleşen ölümlerin başlıca nedenidir.3,4 EKT, insanlarda melanomun kutanöz metastazı tedavisinde etkili bir yöntemdir ve 500 hastada 2000’den fazla tümörün %74’ünde tümör yanıtı (tam veya kısmi yanıt) ile sonuçlanmıştır.5
Ayrıca, ESOPE çalışmasının (Elektrokemoterapi için Avrupa Standart Çalışma Prosedürleri) sonuçları, malign melanomlu insan hastaların kutanöz ve subkutanöz tümör nodüllerinin tedavisinde EKT’nin etkisinin nodülün boyutuna göre değişmediğini ortaya koymuştur.6 Melanomlar köpeklerde de yaygın görülen bir neoplazmdır ve bu türde oral neoplazmların en yüksek insidansını oluşturmaktadır.2,7,8 Bu vakalarda da EKT etkili bir tedavi seçeneği olarak öne çıkmaktadır.9
Buna karşılık, melanositik neoplazmlar kedilerde daha nadir görülmekle birlikte genellikle kötü huyludur.2,7,8 En sık görüldüğü yer gözdür ve melanom kedilerde en sık görülen göz içindeki kitledir.7,8 Göz dışı kedi melanomlarının sonuçlarına ilişkin çok az veri bulunmaktadır.1 Dolayısıyla, bu tümörlerin klinik prezentasyonu, biyolojik davranışı ve klinik pratikteki tedavisine ilişkin mevcut bilgiler oldukça sınırlıdır. Nazal planumda melanositik tümörü olan 10 kediden oluşan retrospektif bir vaka serisinde, nazal planumun pigmentasyonunun predispozan bir faktör olduğu bulunmuştur.10 Bu vaka çalışmasındaki kedi de pigmente nazal planuma sahipti.10
Bu vaka raporunda özetlenen EKT protokolüne geçmeden önce, kedi melanomu için mevcut tedavi seçenekleri hasta sahipleri ile tartışılmıştır.
Şu anda genel olarak kedi melanomu için belirlenmiş herhangi bir tedavi önerisi bulunmamaktadır. Kedilerde göz dışı 30 melanomun incelendiği retrospektif bir çalışmada, cerrahi eksizyon uygulanan kediler, yalnızca tıbbi tedavi uygulanan kedilere kıyasla önemli ölçüde daha uzun süre hayatta kalmıştır.7 Ancak, bu vakada nazal planumdaki yerleşim göz önüne alındığında, cerrahi tedavi radikal nazal planektomi gerektirmektedir. Bir kedide nazal melanomla ilgili daha önce yapılan bir vaka çalışması, nazal planektominin 5 yıl içinde nüks görülmeyen başarılı bir tedavi olduğunu göstermiştir.11 Bu vakada, hasta sahipleri radikal ve invaziv doğası ve kozmetik sonuçlarla ilgili endişeleri nedeniyle cerrahiyi kabul edilemez bir seçenek olarak görmüş ve bu nedenle bu yola gidilmemiştir.
Hipofraksiyone radyasyon, kedi melanomunun tedavisinde minimal düzeyde araştırılmıştır. Beş kedide yapılan bir çalışmada, oral malign melanomda radyasyon protokolüne belli ölçüde yanıt alındığı tespit edilmiştir; ancak bu yanıtın kalıcı olmadığı görülmüş ve çalışmadaki tüm kediler hastalığın ilerlemesi nedeniyle ötenazi edilmiştir; ortalama sağkalım süresi 146 gün olmuştur.12 Başka bir çalışmada, nazal melanomlu altı kedi hipofraksiyone radyasyonla tedavi edilmiş, tedavi edilen kedilerin tümünde tedaviyle birlikte tümörde gerileme görülmüş, %50’sinde kısmi, %50’sinde ise tam yanıt alınmıştır. Ancak, tüm vakalarda, tümörün ilerlemesi veya nüksetmesi kısa bir zaman dilimi içinde gerçekleşmiştir (kısmi yanıt gösteren hayvanlarda tümör ilerlemesine kadar sırasıyla 30, 43 ve 92 gün ve tam yanıt gösteren hayvanlarda nüksetmeye kadar 84,
97 ve 160 gün). Tüm hayvanlara, yaşam kalitesini düşüren klinik belirtilere (anoreksi, apati ve kilo kaybı) neden olan hastalığın ilerlemesi nedeniyle ötenazi uygulanmıştır.10 Bu raporun yazıldığı tarihte, burada rapor edilen hasta şu anda EKT tedavisinden 9 ay sonrası dönemde olup, lokal tümör nüksü ve klinik hastalık belirtileri görülmemektedir; bu durum, EKT’nin hipofraksiyone radyasyona kıyasla önemli ölçüde daha kalıcı yanıt verdiğini göstermektedir.
Kanser tedavisinde immünoterapi son on yılda büyük bir gelişme göstermiş ve köpek malign melanomu da dahil olmak üzere insanlarda ve hayvanlarda çeşitli farklı neoplazmların tedavisinde kullanılmıştır.13 Veteriner hekimlikte ilk ruhsatlı immünoterapötik ajan köpek melanom aşısıdır (Oncept; Merial). Bu aşı, lokal hastalık kontrolünün sağlandığı II. veya III. evre oral melanomlu köpeklerde kullanımı ruhsatlı ksenojenik insan tirozinaz DNA aşısıdır.14 Bu aşının kedilerde de minimum yan etki riski ile iyi tolere edildiği görülmüştür.15 Oncept melanom aşısı, sedasyon veya genel anestezi gerekmediği için tedavi kolaylığı avantajı taşımaktadır. Retrospektif çalışmalarda, köpek oral malign melanomunda ortalama sağkalım süresini artırmadığı tespit edildiğinden, etkinliği konusunda bazı tartışmalar mevcuttur.16 Belirtilen vakada tek başına uygun bir tedavi yöntemi olarak düşünülmemiş, ancak nüks riskini azaltmak amacıyla cerrahi veya EKT’ye ek olması açısından tartışılmıştır. Bu vakada, aşının ek bir tedavi yöntemi olarak kullanılmasının getirdiği ciddi mali yük nedeniyle aşı kullanılmamıştır; ancak bu, kedilerde kutanöz melanom tedavisine yönelik gelecekteki çalışmalar için potansiyel bir ilgi alanı olabilir.
EKT, kemoterapötik ilaçların (bleomisin veya sisplatin) yüksek voltajda elektrik pulsları ile birlikte kullanılmasıdır. Bu, hücre zarında geçici bir permeabilizasyona neden olarak kemoterapötik ilaçların neoplastik hücrelere girişine izin verir. İnsan onkolojisinde kutanöz ve subkutanöz kitlelerin tedavisinde yaygın olarak kullanılan bir tedavi yöntemidir.6 EKT’nin ayrıca nazal planumun kedi skuamöz hücreli karsinomunun tedavisinde güvenli ve etkili olduğu görülmüştür.17
Şu anda kedi nazal melanomu için EKT tedavisini açıklayan çok az literatür bulunmaktadır. Bir vaka raporunda, bölgesel metastazlı kutanöz malign melanomlu bir kedinin tedavisi için kalsiyum elektroporasyonu (CaEP) ile birlikte EKT kullanımı rapor edilmiştir; hasta hayvanda submandibular lenf nodu büyümesi ile birlikte kutanöz peripalpebral plak lezyonu vardı. Bu vakada (iki EKT ve CaEP tedavisinden sonra), ince iğne aspirasyonu ile doğrulanan retrofarengeal lenf nodunda hastalığın nüksetmesinden önce beş aylık remisyon elde edilmiştir. CaEP, neo- plastik hücrelere suprafizyolojik seviyelerde kalsiyum
akışına neden olarak nekroz yoluyla hücre ölümüne yol açmaktadır.18 Bu iki yeni kanser tedavi yönteminin kombinasyonu, sinerjik etkilerinin anlaşılması için daha fazla araştırma yapılması gerektiğini göstermektedir. Bu vaka, hem EKT hem de CaEP’in kedilerde kutanöz melanom tedavisinde etkili olabileceğini düşündürmektedir ve bu vaka raporunda da görülen olumlu yanıt göz önüne alındığında, EKT’nin kedi kutanöz melanom tedavisinde uygulanabilecek alternatif bir tedavi seçeneği olarak daha fazla araştırılması gerektiğini göstermektedir.
Bir başka vaka çalışmasında, bir kedide oral melanomun büyük kısmının CO2 lazer cerrahisi ile çıkarılmasından sonra ek olarak nano-ECT kullanımı açıklanmıştır.19 Nano-ECT, daha yaygın olarak kullanılan ve bu vakada kullanılan mikrosaniyeler20 yerine nanosaniye süresinde pulslu elektrik akımı sağlayan EKT yöntemidir. Bu vaka raporunda hasta nanosaniye pulslar ve bleomisin ile tedavi edilmiştir. Nano-EKT’den 16 hafta sonra primer kitlede nüks görülmediği için bu yöntem bu vakada umut vaat etmiştir. Bununla birlikte, tarif edilen hastada ilk muayenede lokal lenf düğümünde metastatik hastalık vardı ve lokal kitlenin kontrol altına alınmasına rağmen kedi, nano-EKT’den 17 hafta sonra genel sağlık durumunda düşüşe neden olan metastatik hastalık nedeniyle ötenazi edilmiştir.
EKT literatürde şimdiye kadar çok az tanımlanmış olsa da, daha önce bahsedilen iki vaka raporundaki bazı umut verici sonuçlar göz önüne alındığında, bu vakada uygun bir tedavi yöntemi olduğu ve daha fazla araştırılması gerektiği düşünülmektedir. Bu vaka raporundaki başlıca eksiklik, hasta hastaneye getirildiğinde lokal lenf nodlarından İİAB örneği alınmamış olmasıdır; bu da lokal metastatik hastalığın göz ardı edilemeyeceğini göstermektedir. Palpabl lenfadenopati olmadığı için lokal lenf nodlarına yayılım olmadığı varsayılmıştır; ancak bunu doğrulamak için sitoloji yapılması daha uygun olurdu. Bu vaka raporunun sonuçlarının yukarıda bahsedilen iki vaka raporuyla doğrudan karşılaştırılması oldukça zordur çünkü önceki iki vaka raporunda da lokal lenf nodu metastazları doğrulanmıştır. Ayrıca, EKT lokal kontrol sağlamak için diğer modalitelerle birlikte kullanılmıştır (sırasıyla CaEP ve CO2 lazer kitlesinin cerrahi olarak çıkarılması). Bu vakada, makalenin yazıldığı tarihte, ikinci EKT seansından 292 gün sonra hastada herhangi bir kitle nüksü veya klinik belirti görülmemiştir ve EKT nazal planum melanomunu tedavi etmek için kullanılan tek yöntemdir.
Palyatif tedavi de gündeme gelmiştir; bu tedavi, tümör ağrılı hale geldiğinde ağrının giderilmesini ve hastanın ilk geldiğinde çok iyi olan yaşam kalitesinin sürekli ve dikkatli bir şekilde değerlendirilmesi anlamına gelmektedir. Histolojideki kitlenin metastatik doğası ve melanomların metastatik hastalığa neden olma eğilimi göz önüne alındığında, hastalığın çok hızlı ilerleyebileceğini farz etmek mantıklı olacaktır.
Retrospektif nitelikte yapılan bir çalışmada, ağız boşluğu, dudaklar veya burunda ortaya çıkan melanositik tümörlü kedilerin ortalama sağkalım süresi 83 gün olarak tespit edilmiştir.7 Dolayısıyla, hastanın ikinci EKT seansından 292 gün sonra remisyonda olduğu göz önüne alındığında, EKT’nin bir tedavi protokolü olarak kedi nazal melanomunda önemli bir rol oynadığı görülmektedir.
Sonuç
EKT, bildiğimiz kadarıyla, nazal planumun kedi melanomu için şu anda tanımlanmış bir tedavi seçeneği değildir, ancak diğer modalitelerle birlikte kullanıldığına dair vaka raporları mevcuttur (biri oral melanomlu bir kedide ve diğeri peripalpebral melanomlu bir kedide). Tanımlanan bu vakadaki olumlu sonuç göz önüne alındığında, EKT’nin tedavi yöntemi olarak etkinliğini doğrulamak ve etkili bir lokal kontrol yöntemi olarak mevcut diğer seçeneklerle karşılaştırmak için daha kapsamlı prospektif çalışmalar yapılması gerekmektedir.
Çıkar çatışması beyanı Yazarlar, bu makalenin araştırması, yazarlığı ve/veya yayını ile ilgili olarak herhangi bir çıkar çatışması beyan etmemişlerdir.
Finansman Bu çalışma Linnaeus Veterinary Limited’in bir parçası olan North Downs Hastanesi tarafından finanse edilmiştir.
Etik Kurul Onayı Bu çalışmada sadece deneysel olmayan hayvanlar kullanılmıştır (sahipli veya sahipsiz hayvanlar ve prospektif veya retrospektif çalışmalardan elde edilen veriler dahil). Bireysel veteriner klinik hasta bakımında uluslararası kabul görmüş yüksek standartlar (‘en iyi uygulama’) takip edilmiştir. Bu nedenle JFMS Open Reports’ta yayınlanması için bir komiteden etik onay alınması gerekmemiştir.
Bilgilendirilmiş onam Bu çalışmada belirtilen tüm hayvan(lar)ın (deneysel veya deneysel olmayan hayvanlar, kadavralar dahil) sahibinden veya yasal sorumlusundan, gerçekleştirilen tüm prosedür(ler) için (prospektif veya retrospektif çalışmalar) bilgilendirilmiş onam (sözlü veya yazılı) alınmıştır. Bu yayında hiçbir hayvanın veya insanın kimliği teşhis edilememektedir ve bu nedenle yayın için ek bilgilendirilmiş onam gerekmemiştir.
ORCID iD Annika Little https://orcid.org/0000-0001- 9363-953X
Kaynakça
1 Pittaway R, Dobromylskyj M, Erles K, et al. Nonocular melanocytic neoplasia in cats: characterization and pro- posal of a histologic classification scheme to more accu- rately predictclinicaloutcome.VetPathol2019;56:868–877.
- 2 Vail DM, Thamm DH and Liptak JM. Withrow & MacEwen’s small animal clinical oncology. St Louis, MO: Elsevier, 2020.
- 3 Matthews NH, Li W-Q, Qureshi AA, et al. Epidemiology of melanoma. In: Cutaneous melanoma: etiology and therapy. Singapore: Codon Publications, 2017, pp 3–22.
4 Davis LE, Shalin SC and Tackett AJ. Current state of mela- noma diagnosis and treatment. Cancer Biol Ther 2019; 20: 1366–1379.
5 Wichtowski M and Murawa D. Electrochemotherapy in the treatment of melanoma. Contemp Onkol (Pozn) 2018; 22: 8–13.
6 Marty M, Sersa G, Garbay J, et al. Electrochemotherapy
– an easy, highly effective and safe treatment of cuta- neous and subcutaneous metastases: results of ESOPE (European Standard Operating Procedures of Electro- chemotherapy) study. Eur J Cancer Suppl 2006; 4: 3–13.
7 Chamel G, Abadie J, Albaric O, et al. Non-ocular melano- mas in cats: a retrospective study of 30 cases. J Feline Med Surg 2016; 19: 351–357.
8 Patnaik AK and Mooney S. Feline melanoma: a compara- tive study of ocular, oral, and dermal neoplasms. Vet Pathol 1988; 25: 105–112.
9 Tellado M, Maglietti F, Michinski S, et al. Electrochemo- therapy in treatment of canine oral malignant melanoma and factors influencing treatment outcome. Radiol Oncol 2020; 54: 68–78.
10 Reck A and Kessler M. Melanocytic tumours of the nasal planum in cats: 10 cases (2004–2019). J Small Anim Pract 2020; 62: 131–136.
11 Kojimoto A, Itoh T, Uchida K, et al. Malignant melanoma on the nasal planum treated with nasal planectomy in a cat. Jpn J Vet Anesth Surg 2020; 51:8–12.
12 Farrelly J, Denman DL, Hohenhaus AE, et al. Hypofrac- tionated radiation therapy of oral melanoma in five cats. Vet Radiol Ultrasound 2004; 45: 91–93.
13 Almela R and Ansón A. A review of immunotherapeutic strategies in canine malignant melanoma. Vet Sci 2019; 6: 15.
14 Biller B, Berg J, Garrett L, et al. 2016 AAHA oncology
guidelines for dogs and cats. J Am Anim Hosp Assoc 2016; 52:
181–204.
15 Sarbu L, Kitchell BE and Bergman PJ. Safety of administer-
ing the canine melanoma DNA vaccine (Oncept) to cats with malignant melanoma – a retrospective study. J Feline Med Surg 2016; 19: 224–230.
16 Ottnod J, Smedley R, Walshaw R, et al. A retrospective analysis of the efficacy of Oncept vaccine for the adjunct treatment of canine oral malignant melanoma. Vet Comp Oncol 2013; 11: 219–229.
17 Simčič P, Pierini A, Lubas G, et al. A retrospective multi- centric study of electrochemotherapy in the treatment of feline nasal planum squamous cell carcinoma. Vet Sci 2021; 8: 53. DOI: 10.3390/vetsci8030053.
18 Dos Anjos D, Rodrigues C, Silva N, et al. Electrochemother- apy associated with calcium electroporation in metastatic feline cutaneous malignant melanoma. Acta Sci Vet 2019; 47. DOI: 10.22456/1679-9216.96498.
19 Tunikowska J, Antończyk A, Rembiałkowska N, et al. The first application of nanoelectrochemotherapy in feline oral malignant melanoma treatment – case study. Ani- mals 2020; 10: 556. DOI: 10.3390/ani10040556.
20 Beebe JS. Mechanisms of nanosecond pulsed electric field (NsPEF)-induced cell death in cells and tumors. J Nanomed Res 2015; 2. DOI:10.15406/jnmr.2015.02.00016.