Amaç Hücre döngüsü fazına özgü spesifik bir antimetabolit olan sitarabinin, kombine kemoterapi alan kemik iliği (BM) veya merkezi sinir sistemi (MSS) lenfoma tutulumu olan köpeklerde tedavi sonuçlarını iyileştirdiği rapor edilmiştir. Bu çalışmanın amacı, yüksek gradeli Hodgkin dışı lenfomalı köpeklerde sitarabin sabit hızda ı̇ nfüzyon yönteminin (CRI) toksisite insidansını ve şiddetini değerlendirmektir.
Metod CRI olarak verilen tek doz sitarabin de dahil olmak üzere modifiye siklofosfamid, epirubisin, vinkristin ve prednizolon protokolü ile tedavi edilen, BM (grup 1) veya MSS (grup 2) tutulumu olduğu kesinleşmiş veya şüphelenilen köpek lenfoma hastalarının tıbbi kayıtları incelenmiş ve yan etkiler derecelendirilmiştir.
Bulgular Yirmi altı köpek çalışmaya dahil edilmiştir. 17 köpekte (%65,3) gastrointestinal toksisite meydana gelmiş, 5 köpekte (%19,2) grade III veya IV toksisite görülmüştür. Dokuz köpekte (%34,6) nötropeni görüldü, ancak çoğu vakada grade I veya II idi. Üç köpekte (%11,5) trombositopeni görülmüştür: biri grade III ve ikisi grade IV idi. Dört köpekte (%15,3) alanin amino transferaz artışı görülmüştür: her biri grade I ve II ve ikisi grade III şeklindeydi. Beş köpekte (%19,2) sitarabin SHİ tamamlandıktan sonra toksisiteyi kontrol altına almak için hastaneye yatış gerekmiş ve hematolojik toksisite beş köpekte tedavinin gecikmesine neden olmuştur (ortalama gecikme 4 gün, aralık: 3-7 gün).
Sonuç Elde ettiğimiz sonuçlar, sitarabin CRI uygulanan lenfoma hastalarında gastrointestinal toksisitenin kaçınılmaz olduğunu göstermektedir.
Anahtar Kelimeler kemik iliği; merkezi sinir sistemi; kemoterapi; sitarabin; sitozin arabinosid; lenfoma
Kısaltmalar ALT, alanin amino transferaz; BM, kemik iliği; CEOP, siklofosfamid, epirubisin, vinkristin ve prednizolon; CHOP, sitoksan, hidroksirubisin (adriamisin), onkovin (vinkristin), prednizon; cNHL, Hodgkin dışı lenfoma; MSS, merkezi sinir sistemi; CR, klinik yanıt; CRI, sabit hızda infüzyon; G-CSF, granülosit koloni uyarıcı faktör; GI, gastrointestinal; MRI, manyetik rezonans görüntüleme; MST, ortalama sağkalım süresi; PARR, antijen reseptör gen yeniden düzenlemesi için PCR; PD, progresif hastalık; PR, kısmi yanıt; RI, referans aralık; SD, stabil hastalık.
Köpeklerde hematopoietik neoplaziler sık görülmekte olup, köpek Hodgkin dışı lenfomaları (cNHL’ler) tüm hematopoietik kanserlerin %80’inden fazlasını oluşturmaktadır.1,2
cNHL’ler arasında yüksek gradeli B hücreli lenfomalar baskındır ve ilk basamak kemoterapi prednizolon, vinkristin, siklo-fosfamid ve doksorubisin (CHOP) gibi idame gerektirmeyen protokollerden oluşmaktadır; doksorubisin yerine epirubisin kullanılan varyasyonlar (siklofosfamid, epirubisin, vinkristin ve prednizolon[CEOP]) da benzer sonuçlar göstermektedir.3-6 Yüksek gradeli T- hücreli lenfomalar daha az görülmektedir ve CHOP bazlı protokoller kullanıldığında yanıt oranları daha düşük ve remisyon oranları daha kısadır.7
Sitarabin (1b-arabinofuranozilsitozin, sitozin arabinosid veya araC) Cryptothethya crypta adlı süngerden izole edilen bir pirimidin analoğudur.8 Sitarabin kana karıştıktan sonra tümör hücrelerine girer ve burada sıralı enzimatik etkileşimler yoluyla fosforilasyona uğrayarak aktif metabolit olan arabinozilsitozin trifosfat oluşturur. Arabinozilsitozin trifosfat replikasyon sırasında DNA’ya dahil olarak DNA sentezinin başarılı olmasını engeller ve DNA onarımına müdahale eder. Bu nedenle S fazına özgüdür. Sitarabin ayrıca DNA polimeraz α’yı inhibe eder ve DNA elongasyonunu sonlandırarak hücre ölümüne neden olur.8 Sitarabin ve metabolitleri sitidin/deoksisitidin deaminaz tarafından inaktif metabolit urasil arabinozide (ara-U) dönüştürülür ve esas olarak karaciğerde parçalanır.8,9
Kısa yarılanma ömrü (subkutan ve intravenöz uygulamadan sonra sırasıyla 1,33 ve 1,15 saat T1/2) ve hızlı deaminasyon sonucunda, sitotoksik sitarabin metabolitlerinin plazma seviyelerinin kararlı duruma ulaşması en iyi şekilde ilaca sürekli maruz kalınmasıyla sağlanır.9 Ayrıca, sitarabinin hücresel birikimi ve tutulması da insan lösemilerinde sitotoksisite ve klinik yanıt süresi bakımından birbiriyle bağlantılıdır.10 Bu etki üç hipotezle açıklanabilir:
- 1 Kemoterapötik ajanların çoğu sadece hücreler aktif olarak döngü halindeyken tümör hücresi ölümüne neden olur ve bu nedenle durağan hücreler (G0) etkilenmez. Hücre döngüsünün uzunluğuna bakılmaksızın, sabit hızda infüzyon (CRI) ile verilen sitarabin, kanser hücresini uygun fazda öldürme şansını artırabilir.11
- 2 Sitarabinin kısa yarılanma ömrü nedeniyle, CRI ilaç konsantrasyonunu daha uzun süre koruyarak terapötik indeksi daha da yükseltir.9,12
3 Tümör hücresine geçiş difüzyon ve bazen de aktif taşınma yoluyla gerçekleşir. Bu geçiş sadece ilaç konsantrasyonuna değil aynı zamanda ilacın hücre membranına etki ettiği sürenin uzunluğuna da bağlı olabilir.8,11
Bu nedenle, sitarabinin CRI olarak uygulanması subkütan yoldan daha avantajlıdır ve ilaç dozu ve uygulama süresi hem etkinliği hem de toksisiteyi belirleyecektir.9,11–13
Beşeri tıpta, sitarabin akut miyeloid lösemi, merkezi sinir sistemi (MSS) lenfoması ve lenfoblastik lösemi tedavisinde son derece önemlidir.14-16 MSS lenfoması olan insanlarda yapılan faz II çalışması, metotreksat tek ajan protokolüne sitarabin eklenmesinin yanıt oranını ve genel sağkalımı önemli ölçüde arttırdığını göstermiştir.15
Evcil hayvanlarda başlıca kullanım alanları lenfoproliferatif hastalıkların ve etiyolojisi bilinmeyen meningoensefalitin tedavisidir.17-24 Köpek lenfomasında tek ajan olarak etkisinin zayıf olmasına rağmen,23 sitarabin kan-beyin bariyerini geçtiği için MSS (V. evre) lenfomasında etkili olabilir.12,25,26 Buna ek olarak, kemik iliği (BM) infiltrasyonu olan az sayıda hastada indüksiyon protokollerinin sitarabin ile yoğunlaştırılması sağkalımı artırmıştır.22
İnsanlarda, tedavi süresi ve ilaç konsantrasyonu toksisite insidansını etkilemektedir. En yaygın toksisiteler miyelosupresyon, oral mukozit, diyare, ileus, ateşe yol açan idiyosenkratik reaksiyonlar ve karaciğer enzimlerinde yükselmedir.13,14 Köpeklerde en sık bildirilen yan etkiler BM ve gastrointestinal (GI) toksisitedir,22,23 ancak sınırlı sayıdaki veriler genellikle subkutan uygulama ve/veya çok ajanlı kurtarma protokolleri ile ilgilidir. Kalsinozis kutis ve infiltratif akciğer hastalığı da ayrıca rapor edilmiştir.27,28
Bugüne kadar sadece iki çalışma CRI sitarabin sonrası toksisite verilerini spesifik olarak rapor etmiştir. Ruslander ve ark. lenfomalı 15 köpekte CRI şeklinde uygulanan tek ajan sitarabini ilk basamak tedavi olarak incelemiştir. Toplam 600 mg/m2 doz 48 saat boyunca verilmiştir. 15 köpeğin altısında hafif ila orta şiddette GI toksisitesi, iki köpekte şiddetli ishal, bir köpekte epistaksis, iki köpekte uyuşukluk ve hematolojik toksisite (dört köpekte hafif, beş köpekte orta ve bir köpekte şiddetli) görülmüş, ancak hastaneye yatış gerekmemiştir.23 Daha sonra, Marconato ve ark. naif lenfoma ve BM tutulumu olan köpeklerde idame gerektirmeyen vinkristin, siklofosfamid, asparaginaz ve doksorubisin bazlı protokole sitarabin eklemeyi değerlendirmiştir. Beş ardışık gün boyunca 24 saat boyunca günde 150 mg/m2 sitarabin CRI ile tedavi edilen dokuz köpekte, sitarabin almayan sekiz köpeğe kıyasla ortalama sağkalım süresi önemli ölçüde uzamıştır (243’e karşı 72,5 gün). Bildirilen toksisite iki grade II GI ve bir grade I hematolojik toksisite ile sınırlı kalmıştır.22 Bu çelişkili sonuçlar kısmen doz ve tedavi süresindeki farklılıklardan ve bu retrospektif çalışmalardaki veri kayıtlarındaki farklılıklardan kaynaklanıyor olabilir. Marconato ve arkadaşlarının çalışmasında granülosit koloni uyarıcı faktör (G-CSF) kullanılması hematolojik toksisite insidansını azaltmış olabilir, ancak bu durum GI toksisite oranının düşük olmasını açıklamamaktadır.
Bu çelişkili veriler göz önüne alındığında, bu retrospektif çalışmanın amacı, kesinleşmiş veya şüpheli BM veya MSS tutulumu olan yüksek gradeli cNHL ilk basamak tedavisinin bir parçası olarak verilen CRI sitarabinin toksisite profilini ortaya çıkarmaktır. Klinik deneyime ve az sayıda vakanın ön klinik tetkikine dayanarak, hipotezimiz, sitarabin CRI’nin önceki raporlara kıyasla daha yüksek GI toksisite insidansına neden olduğudur. İkincil amacımız klinik yanıtları değerlendirmek ve köpek gruplarımızdaki prognostik faktörleri araştırmaktır. Sağkalım verileri de ayrıca rapor edilmiştir.
Materyal ve metot
Çalışma popülasyonu
Bu retrospektif vaka serisi için, hastanenin bilgisayarlı klinik kayıt veri tabanında 2012-2017 yılları arasında CRI olarak sitarabin alan hastalar aranmıştır. Köpekler aşağıdaki durumlarda çalışmaya dahil edilmiştir:
(1) sitolojik veya histopatolojik olarak yüksek gradeli cNHL tanısı almış olanlar, (2) naif köpekleri tedavi etmek için ilk basamak CEOP kemoterapi protokolüne5 sitarabin CRI dahil edilmiş olanlar ve (3) tedavi öncesi ve sonrası hematoloji sonuçları mevcut olanlar..
Köpekler, subkutan sitarabin almışlarsa veya eksik kayıtları varsa çalışmaya dahil edilmemiştir.
Grup 1’deki köpeklerde, akım sitometrisi veya BM aspiratlarının sitolojisine göre kesinleşmiş veya şüpheli BM lenfoması vardı: numuneler kurul onaylı bir klinik patolog tarafından incelendi ve çekirdekli hücrelerin >%3’ü daha önce belirlendiği gibi neoplastik lenfositler olarak sınıflandığında sonuç pozitif olarak rapor edildi.29 Graff ve arkadaşları lenfomalı köpeklerde kan yaymasında neoplastik lenfositlerin varlığı ile BM tutulumu arasında bir korelasyon olduğunu ortaya koyduğu için, hematolojide lenfositoz (>3,8 × 109/L, yani kurum içi laboratuvar referans aralığımızın [RI] üst değerinden daha büyük) ve kan yayması incelemesinde atipik lenfoblastların baskınlığı görüldüğünde bazı hastalara varsayımsal olarak BM infiltrasyonu tanısı konulmuştur.30 Neoplastik hücreler, uygun olduğunda akut lenfoblastik lösemiden ziyade lenfomayı (CD34 negatif) doğrulamak için CD34 ekspresyonu bakımından değerlendirilmiştir31
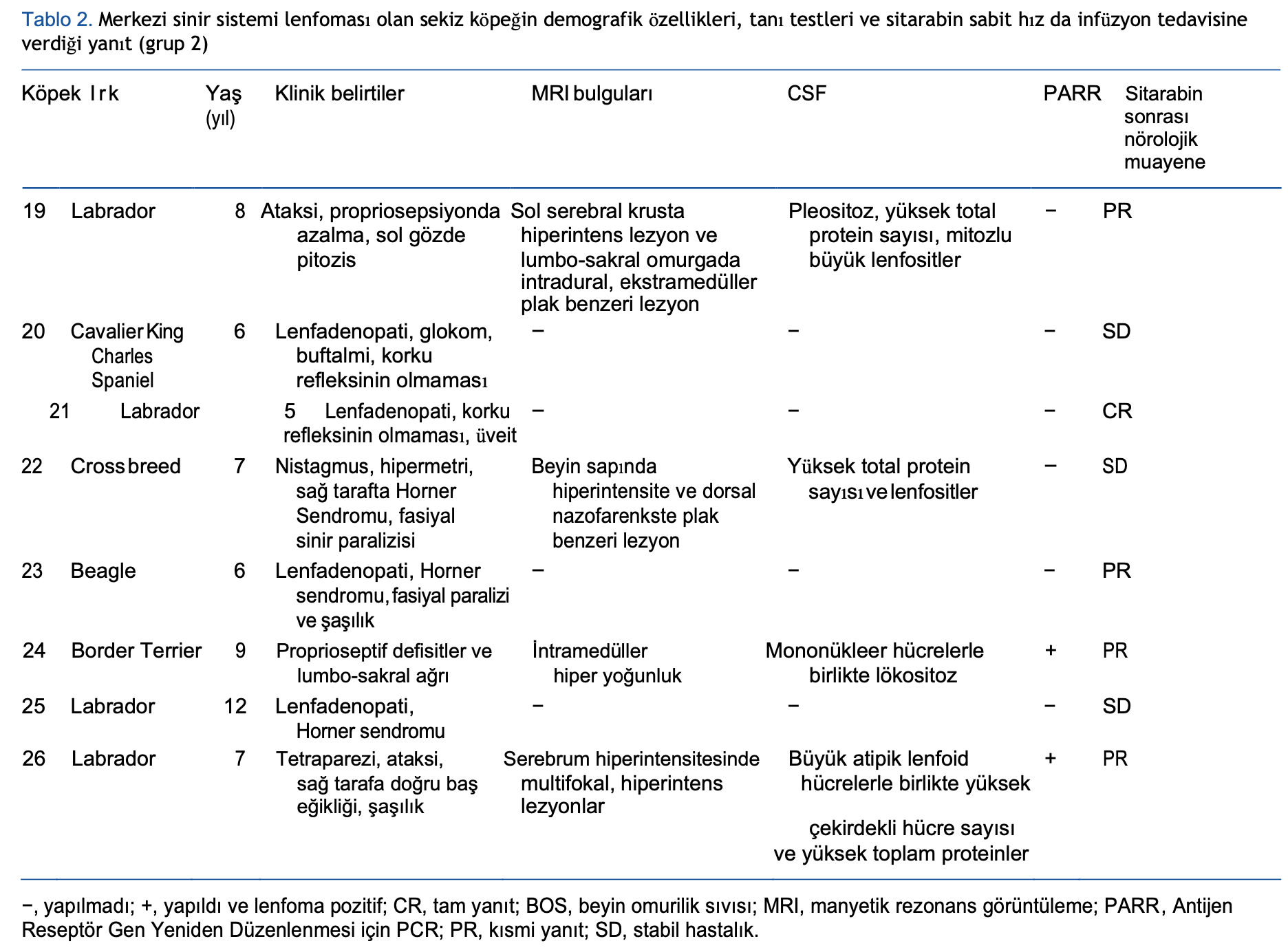
Grup 2’deki köpeklerde kesinleşmiş veya şüpheli MSS lenfoması vardı. Soliter MSS lenfoması tanısı, manyetik rezonans görüntüleme (MRG) bulguları ile birlikte neoplastik lenfositoz veya monomorfik blast hücre popülasyonunun varlığını doğrulayan BOS analizine dayanmaktaydı. Antijen yeniden düzenlemesi için PCR (PARR), sitolojinin belirsiz olması durumunda klonaliteyi değerlendirmek için BOS numuneleri üzerinde gerçekleştirilmiştir. Köpekler, çok merkezli lenfo-proliferatif hastalık ve lenfomaya bağlı olabileceği düşünülen nörolojik belirtilerle geldiğinde, varsayım olarak çok merkezli hastalığın bir parçası olduğu düşünülen MSS lenfoması tanısı konmuştur.32
Belirtiler, tümörün yeri, hastalığın evresi ve alt evresi, daha önce verilen ilaçlar, yan etkiler, ilaç protokolü ve sağkalım verilerine ilişkin bilgiler kayıtlardan ve/veya telefonla takip yoluyla elde edilmiştir. Tüm köpekler için evreleme çalışması; fizik muayene, tam kan hücresi sayımı, biyokimya, anormal lenf düğümleri, karaciğer ve dalağın ince iğne aspiratları ile birlikte veya bunlar olmadan torasik ve abdominal görüntüleme (bilgisayarlı tomografi, radyografi veya ultrasonografi ile) ile yapılmıştır. Tüm köpekler Dünya Sağlık Örgütü klinik evreleme sistemine göre evrelendirilmiştir.33 Her iki grupta da immünofenotiplendirme, klinisyenin takdirine bağlı olarak B-hücresi ve T-hücresi immünofenotiplerini ayırt etmek için akış sitometrisi (kan, lenf düğümü veya BM örneklerinde) veya immünohistokimya ile gerçekleştirilmiştir.
Sitarabin protokolü ve uygulama şekli
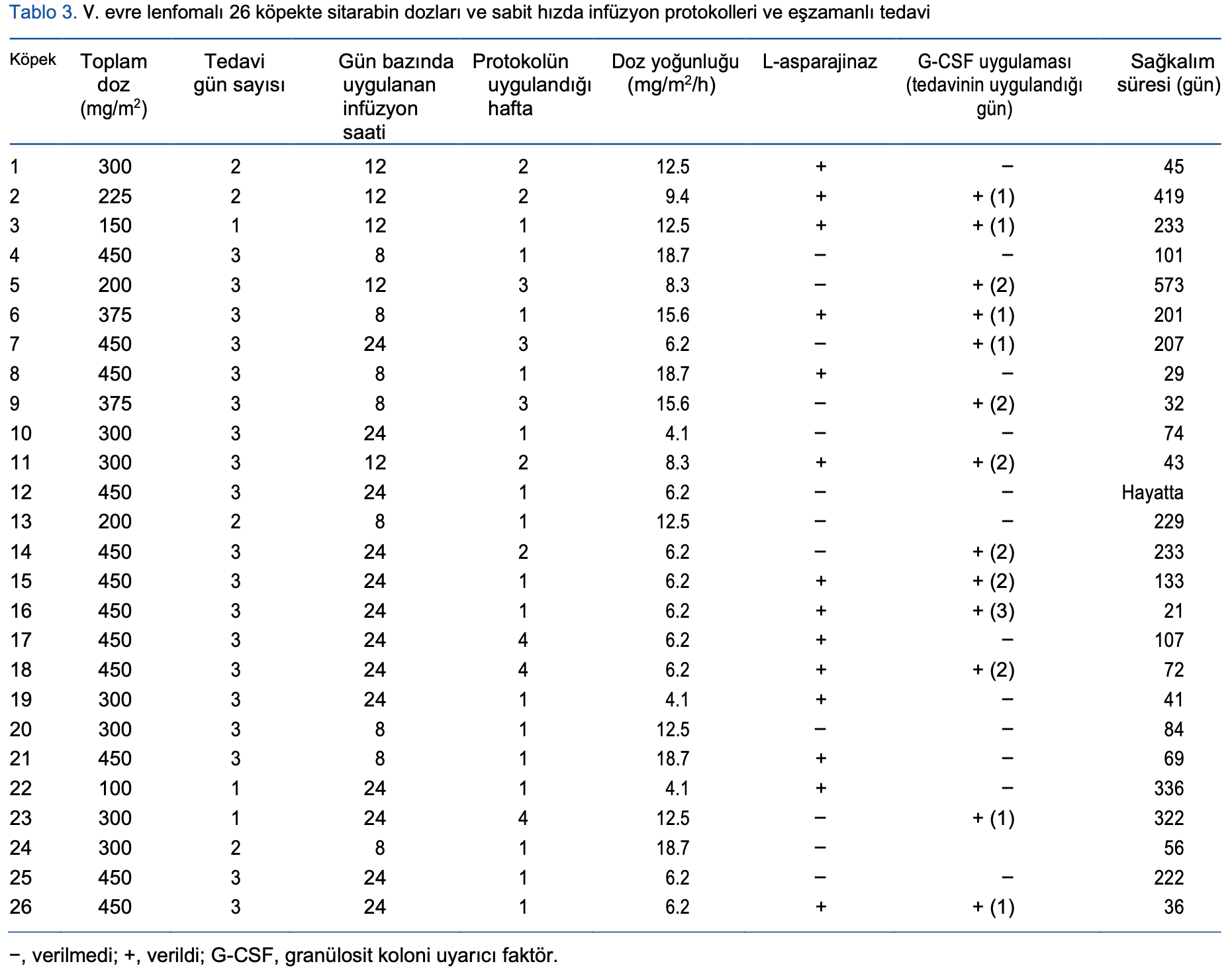
Tüm köpekler, şüpheli veya doğrulanmış BM (grup 1) veya MSS (grup 2) lenfoma tutulumu nedeniyle değişiklik yapılarak 25 haftalık kesintili CEOP protokolünün bir parçası olarak sitarabin (Cytarabine®, 100 mg/mL, Hospira Limited, Maidenhead, Birleşik Krallık) almıştır. CEOP, kurumumuzda lenfoma için uygulanan standart protokoldür.5 Her iki grupta da tedaviyi yoğunlaştırmak amacıyla indüksiyon fazı sırasında protokolün birinci, ikinci, üçüncü ve dördüncü haftalarında birer kez sitarabin verilmiştir.
Sitarabin salin (%0,9 NaCl) içinde seyreltilmiş ve bir ila dört ardışık gün boyunca 8, 12 veya 24 saat boyunca büret tipi infüzyon seti ve infüzyon pompası ile uygulanmıştır. Toplam doz 100 ila 450 mg/m2 arasında değişmiştir. Çalışma dönemi boyunca tedavi standart hale getirilmemiştir. G-CSF (filgastrim, Neupogen® 60 MU/0.5 mL; Dompe Biotec, Milano, İtalya) klinisyenin takdirine bağlı olarak tedavi öncesinde veya sırasında profilaktik olarak verilmiştir.
Toksisite değerlendirmesi
Tüm hastalar sitarabin infüzyonunun ilk gününden 7-10 gün sonra öykü, fizik muayene ve hematoloji ile değerlendirilmiştir. Biyokimya, klinisyenin takdirine bağlı olarak analiz edilmiştir. Yan etkiler tıbbi kayıtlardan, hasta sahibi raporlarından (konsültasyon sırasında veya telefonla) ve klinik notlardan belirlenmiş ve Veteriner Onkoloji Grubu-Yan Etkiler için Ortak Terminoloji Kriterlerine (VCOG-CTAE, 2011) göre değerlendirilmiştir.34 Toksisite ayrıca ani (sitarabin tedavisi için hastanede yatış süresi boyunca) veya gecikmiş (taburcu olduktan sonra) şeklinde sınıflandırılmıştır.
Tedaviye alınan yanıtın değerlendirilmesi
Mevcut verilere dayanarak kesin yanıt değerlendirmesi mümkün olmadığından, mevcut VCOG kriterlerine ve önceki çalışmalara dayanarak kaba yanıt değerlendirme kriterleri geliştirilmiştir.26,35 Tam klinik yanıt (CR), ölçülebilir tüm lezyonların kaybolması, periferik yayma incelemesinde saptanabilir lenfoid blast hücreleri olmaksızın lenfosit sayısının normale dönmesi ve/veya nörolojik bulguların tamamen düzelmesi şeklinde tanımlanmıştır. Kısmi yanıt (PR), ölçülebilir lezyonların boyutunda ≥%30 azalma, periferik kanda <%5 olgunlaşmamış hücrelerin varlığını sürdürmesi ile lenfosit sayısında RI aralığında azalma veya nörolojik fonksiyonda normale dönmeden iyileşme şeklinde tanımlanmıştır. Stabil hastalık (SD) ölçülebilir lezyonların boyutunda <%30 azalma veya <%20 artış, anormal hücre sayısında <%20 artışla birlikte periferik kanda >%5 olgunlaşmamış hücrenin varlığını sürdürmesi veya en az 14 gün boyunca nörolojik durumda kayda değer herhangi bir değişiklik olmaması şeklinde tanımlanmıştır. Progresif hastalık (PH) ölçülebilir lezyonların boyutunda ≥%20 artış veya yeni lezyonların gelişmesi ve dolaşımdaki neoplastik hücrelerde >%20 artış veya nörolojik bulgularda kötüleşme şeklinde tanımlanmıştır. Tedaviye alınan yanıt sitarabin öncesi ve tedaviden 7-10 gün sonraki değerlendirmeye dayanmaktadır. Yeniden evrelemenin tutarsız olması nedeniyle, progresyonsuz geçen süre doğru bir şekilde belgelenememiştir.
İstatistiksel analiz
Genel sağkalım süresi tanı gününden ölüme veya ötenaziye ya da son takibe kadar hesaplanmıştır. Tanımlayıcı istatistikler sürekli veriler bakımından medyan değerlerden, kategorik veriler bakımından ise sıklık değerlerinden alınmıştır. Sürekli değişkenler Cox regresyon analizi ile prognostik faktörler açısından analiz edilmiştir. Grup 1 (BM) ve 2 (CNS) arasındaki sonuçları belirlemek için SPSS 13 yazılımı (SPSS 13.0, SPSS Inc, IBM, Chicago, IL, ABD) kullanılarak Kaplan-Meier sağkalım eğrileri oluşturulmuştur. Tüm testler için P değerinin <0,05 olması istatistiksel bakımdan anlamlı kabul edilmiştir.
Sonuçlar
Çalışma grubu
2012 ve 2017 yılları arasında 31 lenfoma hastası köpek sitarabin CRI ile tedavi edilmiştir: 26 köpek çalışmaya dahil edilme kriterlerini karşılamıştır. Beş köpek çalışma dışı bırakılmıştır: ikisi CRI sırasında şüpheli tümör lizis sendromu nedeniyle ölmüş, biri yeniden değerlendirilmeden önce hastalığın ilerlemesi nedeniyle ötenazi edilmiştir ve iki köpekte sitarabin dozu kaydedilmemiştir. Çalışmaya dahil edilen 26 köpeğin cins ve yaş verileri Tablo 1 ve 2’de verilmiştir. Tanı anındaki ortalama yaş 7 (yaş aralığı: 1-12) ve ortalama ağırlık 23,7 kg (kilo aralığı: 6,2-54,6 kg) idi.
Yedi vakada toraks ve batın bilgisayarlı tomografi taraması ile evreleme yapılmış, 17 köpeğe toraks radyografisi, 14’üne batın ultrasonu ve 7’sine batın radyografisi çekilmiştir. Dört köpekte MSS MRG ve BOS analizi yapılmıştır (Tablo 2). 18 köpekte karaciğer ve/veya dalaktan ince iğne aspirasyonu yapılmış ve 13 köpekte her iki organda, bir köpekte sadece karaciğerde ve bir köpekte de sadece dalakta lenfoma infiltrasyonuyla uyum saptanmıştır. 12 köpekte BM aspirasyonu yapılmıştır (Tablo 1).
Sadece iki köpek başlangıçta asemptomatik (alt evre a) kabul edildi: geri kalanlar alt evre b idi. 26 köpeğin 22’si için immünofenotip mevcuttu: 18 köpek B hücreli lenfoma, üç köpek T hücreli lenfoma ve bir köpekte sonuç yetersizdi (CD3, CD8, CD4 ve CD21 bakımından negatif). B-hücreli fenotipi olan bir köpek CD3 bakımından negatifti, ancak akış sitometrisinde CD8 bakımından (anormal olarak tahmin edilen) pozitifti.
Grup 1: BM tutulumu
On sekiz köpek grup 1’e dahil edilmiştir: On iki köpekte kesin BM lenfoması ve altı köpekte BM infiltrasyonu şüphesi vardı. En yaygın klinik bulgular lenfadenopati (13), letarji (7), kilo kaybı (5), hiporeksi (6), diyare (4), öksürük (2), kusma (3) ve pireksi (2) idi. On köpekte (%55,5) hematoloji, dolaşımda anormal blastların baskın olduğu 3,8 × 109/L’den büyük lenfositoz ( ortalama lenfoid hücre sayısı 43,5 × 109/L, aralığı: 7,59-104) göstermiştir. Lenfositozu olan 10 köpekten beşinde BM lenfoması tespit edilmiş, diğer beş köpekte de bu durumdan şüphelenilmiştir. BM infiltrasyonu şüphesi olan altı köpekte ek tanı testleri yapıldı: beş köpekte lenf nodu akış sitometrisi, birinde kan akış sitometrisi ve diğerinde lenf nodu immünohistokimyası yapıldı. Kalan köpekte lenf nodu immünohistokimyası mevcuttu. Köpek 9’da pansitopeni nedeniyle şiddetli BM tutulumu olduğundan şüphelenilmiştir. Tüm bu köpeklerde akut lenfoblastik lösemi görülme olasılığı, akış sitometrisi (CD34 ekspresyonunun olmaması), prezentasyon ve hastalığın ilerleyişine bağlı olarak oldukça düşük olarak değerlendirilmiştir (Tablo 1).
Grup 2: MSS tutulumu olan köpekler
Sekiz köpek grup 2’ye dahil edilmiştir: Dört köpekte BOS analizi ve MRG bulguları ile teşhis edilen soliter MSS lenfoma ve iki köpekte ek olarak yapılan PARR testi vardı. Bu dört vakada lenfadenopati veya başka organ tutulumu yoktu. Dört köpekte ise klinik ön bulgulara (eş zamanlı lenfadenopati) ve kemoterapi tedavisisonrasında nörolojik bulguların düzelmesine dayanılarak multisentrik hastalığın bir parçası olarak MSS tutulumu tespit edilmiştir.
 aKesin değil. bAnormal CD8 ekspresyonu. -, yapılmadı; +, lenfoma tutulumu; B, B-hücreli lenfoma; BM, kemik iliği; IHC, immünohistokimya; T, T-hücreli lenfoma.
aKesin değil. bAnormal CD8 ekspresyonu. -, yapılmadı; +, lenfoma tutulumu; B, B-hücreli lenfoma; BM, kemik iliği; IHC, immünohistokimya; T, T-hücreli lenfoma.
Köpeklerin hiçbirinin Birleşik Krallık dışına seyahat öyküsü yoktu. Nörolojik muayeneye göre iki vakada ön beyinde, bir vakada multifokal (beyin ve omurga), iki köpekte torakolomber omurgada, iki köpekte oküler sinirde ve bir köpekte diğer kraniyal sinirlerde lezyon tespit edilmiştir. Klinik bulgular ve MR taramalarının sonuçları Tablo 2’de sunulmuştur.
Sitarabin tedavisi
Sitarabin CRI hastanede yatış sırasında 8 ila 72 saat boyunca verilmiştir. Toplam doz 100-450 mg/m2 (ortalama: 300 mg/m2) arasında değişmiştir. Tedavi uygulama süresi ve ani yan etkilerin kontrol altına alınması için gereken ek süre de dahil olmak üzere hastanede yatış süresi ortalama 3 gündü (aralığı: 1-11 gün).
Sitarabin 16 köpeğe ilk tedavi olarak (protokolün 1. haftası), dört köpeğe protokolün ikinci haftasında, üç köpeğe üçüncü haftasında ve üç köpeğe dördüncü haftasında verilmiştir. On dört köpek sitarabin ile eş zamanlı olarak L-asparaginaz almıştır. Daha önce alınan ilaçlar arasında vinkristin, siklofosfamid, L-asparaginaz ve bir köpekte rabakfosadin bulunmaktaydı. Nötropeni ihtimali nedeniyle 13 köpek (%50) ayrıca profilaktik olarak üç ardışık gün boyunca 5 μg/kg G-CSF ile subkutan olarak tedavi edilmiştir (Tablo 3).
Genel toksisite
17 hasta için toplam 65 toksisite vakası kaydedilmiştir (Tablo 4). Bunlar çoğunlukla GI etkiler (24 vaka) ve miyelosupresyon (12 vaka) şeklindeydi. Sadece dokuz köpek herhangi bir yan etki yaşamamıştır.
İnfüzyon sırasında infüzyona bağlı reaksiyon veya anafilaktik olay görülmemiştir. Tedavi sonrasında bir köpekte eritem ve iki köpekte
infüzyon kateterinin yerleştirildiği bölgede kısa süreli topallığa neden olan flebit görülmüştür. İki hastada tedavi sırasında nötropeni ile bağlantılı olmayan yüksek ateş (>39.3 ○C) görülmüştür; bu ilaca bağlı olabileceği gibi tümör lizisine karşı sistemik inflamatuvar tepkinin bir sonucu da olabilir.
Dokuz hastada (%34,6) nötropeni görülmüştür: beş köpekte grade I, üç köpekte grade II ve bir köpekte grade IV şeklindeydi. Bu dokuz köpeğin yedisi protokolün ilk ilacı olarak sitarabin almıştır, ancak diğer ikisi önceki 7 gün içinde vinkristin almıştır. Hiçbir köpekte sepsis gelişmemiştir.
Üç köpekte (%11,5) trombositopeni görülmüştür: bir köpekte grade III ve iki köpekte grade IV şeklindeydi. Bir köpekte grade IV nötropeni ve grade III trombositopeni tespit edilmiştir ancak tanı sırasında pansitopeniktir (tedavi öncesi nötrofil sayısı 0,45 × 109/L RI: 3-12 ve trombosit sayısı 65 × 109/L RI: 150-400) ve şiddetli BM tutulumundan şüphelenilmektedir. Grade IV trombositopeni gelişen başka bir köpeğin de tedavi görmeden önce trombosit sayısı (57 × 109/L) düşüktü. Bu olayların hiçbiri klinik kanama ile bağlantılı değildi.
On altı köpekte (%61,5) anoreksi, kusma, diyare, kolit veya melena görülmüştür. İki vakada, inatçı melena nedeniyle, hastalarda trombositopeni veya pıhtılaşma anormallikleri ile bağlantılı olmayan şiddetli anemi meydana gelmiş ve bu da tam kan hücresi transfüzyonuna yol açmıştır..
Dokuz köpekte (%34,6) ani toksisite görülmüş ve hastanede yatarken ishal sorunu yaşanmıştır. Bir köpek metronidazol ile semptomatik tedaviye rağmen bir hafta boyunca evde kesintili aralıklarla ishal olmaya devam etmiş ve yedi köpekte (%26,9) taburcu olduktan sonra gecikmiş GI semptomları gelişmiştir.
GI toksisitesi beş köpekte (%19,2) orta veya şiddetli (grade III ve IV) olarak derecelendirilmiştir ve bunlardan üçü eşzamanlı L- asparaginaz almıştır ( 1, 2 ve 16 numaralı köpekler). Eş zamanlı L- asparaginaz alan 14 köpeğin 8’inde (%57,1) ve almayan 12 köpeğin beşinde (%41,6) ishal görülmüştür.
GI toksisitesi olan 16 köpeğin 12’sinde yan etkiler gastroprotektanlar, anti-emetikler ve iştah açıcılarla ayakta tedavi şeklinde semptomatik olarak tedavi edilmiştir. Antibiyotikler, eş zamanlı nötropeni veya GI bariyerinin bozulmasıyla ilgili endişeler nedeniyle hekimin tercihine göre verilmiştir. Beş köpek hastaneye yatırılmıştır: dört köpekte infüzyon sonunda toksisite nedeniyle ilk yatış süresi uzamış ve bu köpeklerden ikisi hastaneden taburcu olduktan sonra aşırı ve sürekli ishal nedeniyle tekrar hastaneye yatırılmıştır. Beşinci köpek sorunsuz bir şekilde taburcu edilmiş ancak daha sonra grade III diyare ile tekrar hastaneye yatırılmıştır.
Alanin amino transferazın (ALT) ölçüldüğü beş köpeğin dördünde ALT değerinde artış meydana gelmiştir. Bir köpekte sitolojik olarak lenfoma infiltrasyonu tespit edilmiş ve bu köpekte grade III ALT artışı görülmüştür. Grade III hepatotoksisitesi olan başka bir köpekte, ultrasonografi ve karaciğer aspiratlarında ne vakuolarhepatopati ne de lenfoma tespit edildi, bu nedenle bu durum sitarabin toksisitesi ile ilişkilendirildi.
İki köpekte daha grade I ve II artışlar görülmüş ancak başka incelemeyapılmamıştır.
Sitarabin sonrası üriner komplikasyonlar arasında iki hastada idrar yolu enfeksiyonu ve bir köpekte normoglisemiye rağmen akut renal tübüler hasarla ilişkilendirilen ve kendi kendini sınırlayan glikozüri gelişmiştir.
Bir hastanın tedaviden sonra taşipneik olduğu ve egzersizi tolere edemediği bildirilmiştir; ancak toraks radyografilerinde kardiyak veya pulmoner anormallik saptanmamış ve klinik bulgular günler içinde düzelmiştir.
Hematolojik toksisite beş köpekte tedavinin gecikmesine neden olmuş ve ortalama gecikme 4 gün (aralık: 3-7 gün) sürmüştür: verilen bir sonraki ilaç için doz azaltılmamıştır.
Alınan yanıtlar ve sağkalım analizi
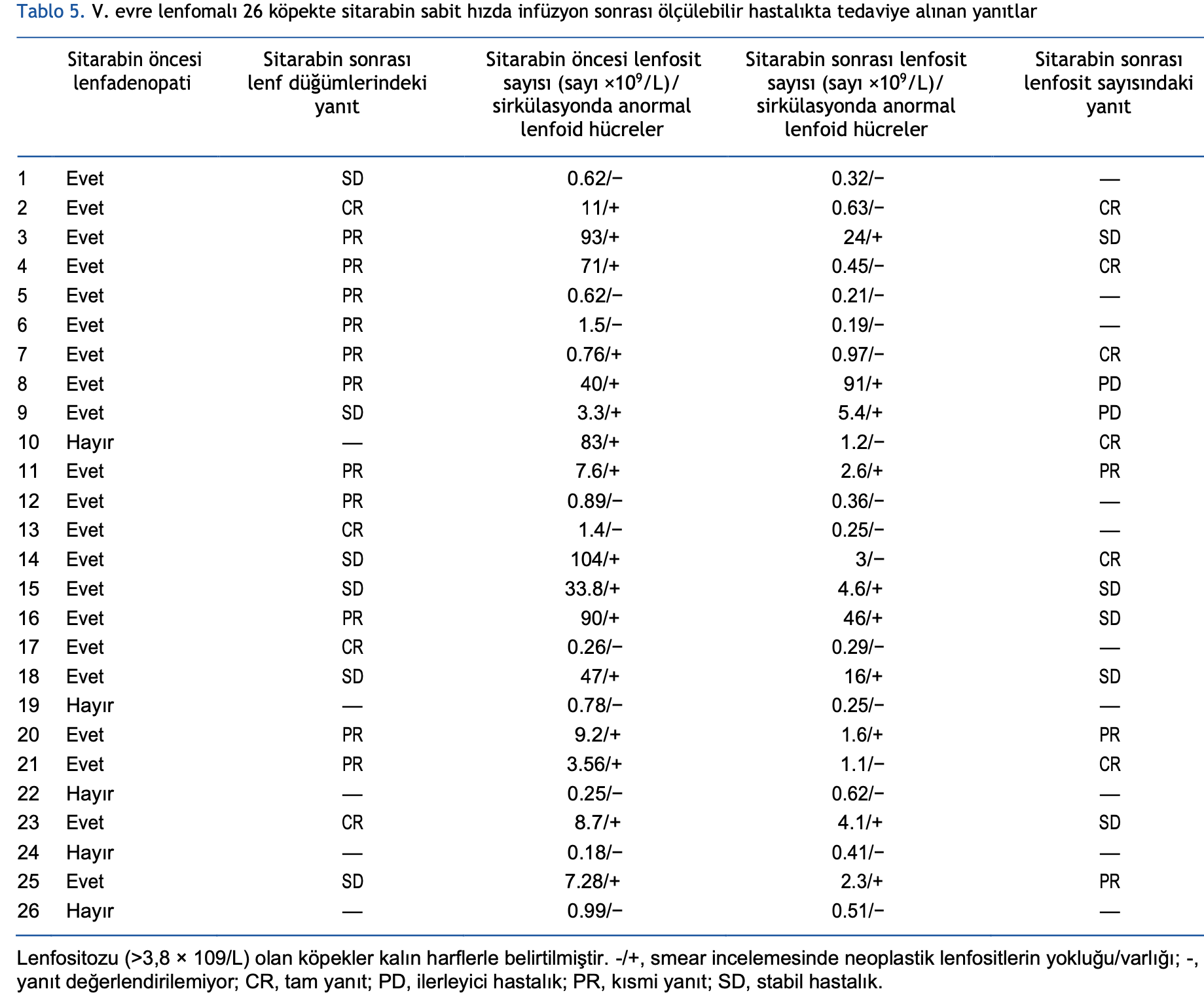
Genel olarak, 26 köpeğin 21’inde periferik lenfadenopati vardı: sitarabin CRI sonrası lenf nodu değerlendirmesine göre, 4 köpek CR, 11 PR ve 6 SD elde etti. Lenfosit sayısına göre yanıt analiz edildiğinde, 13 köpekte lenfositoz vardı ve üç köpekte daha smear değerlendirmesinde sirküle eden neoplastik lenfoid hücrelerle
birlikte lenfosit sayısı normaldi. Sitarabin CRI sonrasında beş CR, üç PR, beş SD ve üç PD elde edilmiştir.
Grup 1’de, 18 köpeğin 17’sinde periferik lenfadenopati vardı ve üç CR, dokuz PR ve beş SD vardı. CR olan iki köpek CRI’dan 7 gün önce vinkristin almıştı ve zaten PR’deydi. Bu grupta lenfositoz veya sirkülasyonda anormal lenfoblast bulunan 12 köpeğin yanıtı incelendiğinde, beş CR, bir PR, dört SD ve iki PD vardı. Köpek 8’de periferik lenf düğümlerinde PR olmasına rağmen lenfositozda kötüleşme (PD) görülmüştür. Öte yandan, köpek 14’ün periferik lenf düğümlerinde SD ile lenfosit sayısına bağlı olarak CR görülmüştür. Alınan yanıtlar Tablo 5’te sunulmuştur.
Grup 2’de, dokuz köpekten dördünde eş zamanlı lenfadenopati görüldü ve bir CR, iki PR ve bir SD vardı. Dört köpekte lenfositoz veya sirkülasyonda anormal lenfositler vardı ve bir CR, iki PR ve bir SD vardı. Dokuz köpeğin altısında (%66,6) nörolojik muayeneye göre kısmi veya tam yanıt elde edilmiştir (Tablo 3).
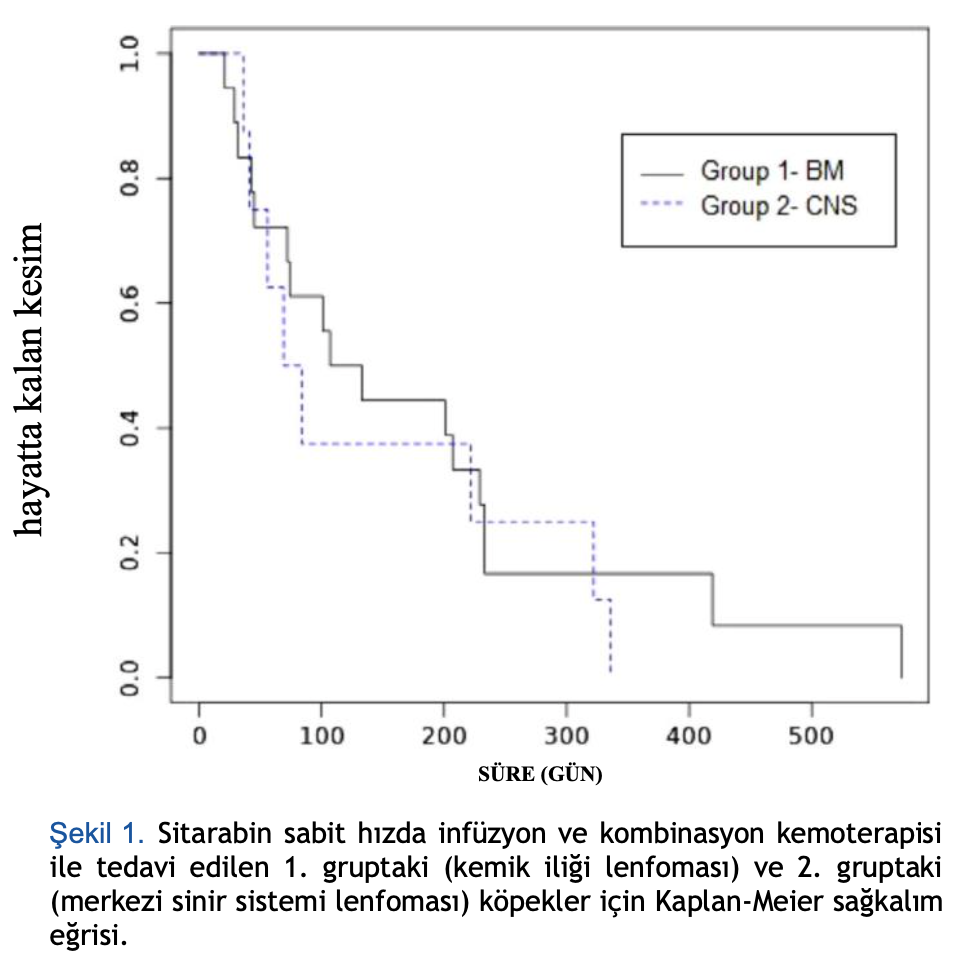
Makalenin yazıldığı sırada sadece bir köpek hayattaydı ve sağkalım analizinden çıkarıldı. Genel ortalama sağkalım süresi 101 gündü
(aralık: 21-573 gün). Grup 1’deki köpekler için ortalama sağkalım süresi 107 gün (aralık: 21-573 gün) ve grup 2’de 76 gün (aralık: 36- 336 gün) idi (Şekil 1). Her iki grupta da ön tanısı olan köpekler hariç tutulduktan sonra, sağkalım süresi benzerdi: grup 1’deki 12 köpek için 113 gün (aralık: 21-573 gün) ve grup 2’deki dört köpek için 48 gün (aralık: 36-336 gün).
Grup 1’de, lenfositozlu köpekler için ortalama sağkalım süresi (87,5 gün), tanı sırasında normal lenfosit sayısına sahip köpeklerden (154 gün) daha kısaydı. Bununla birlikte, ne lenfositoz varlığı, cinsiyet, vücut kondisyon skoru, yaş, nötropeni gelişimi, GI toksisitesi gelişimi ne de toplam sitarabin dozu veya doz yoğunluğu köpek popülasyonlarımızda sağkalım ile istatistiksel olarak ilişkiliydi.
Tartışma
Sitarabin hızla bölünen hücrelerde DNA sentezi ve onarımını engelleyen güçlü bir inhibitördür ve bağırsak bariyerinin bu ilaca uzun süre maruz kalmasının enterosit apoptozuna ve villöz atrofiye
neden olarak bağırsak mukozal bariyerinin bütünlüğünün kaybolmasına, geçirgenliğin artmasına ve GI kanalından bakteriyel translokasyon olasılığını artırması beklenmektedir.8,13 Bu durum, 16 köpekte (%61,5) anoreksi, kusma, diyare, kolit ve/veya melaena görülmesiyle birlikte bu çalışmadaki yüksek GI toksisite insidansı ile tutarlılık göstermektedir. Ayakta semptomatik tedavi 12 köpeğe (%46,1) uygulanmış ancak beş köpeğin (%19,2) hastaneye yatırılması gerekmiştir. L-asparaginaz tek ajan olarak da GI yan etkilerle ilişkilendirilmiş olsa da,36 eş zamanlı olarak L-asparaginaz alan veya almayan köpekler arasında toksisite insidansı veya şiddeti açısından herhangi bir fark bulunmamıştır. Benzer şekilde, tüm köpekler sitarabin CRI sırasında prednizolon almaktaydı ve bu ilacın genel GI toksisitesine etkisi belirsizdir.
İlginç bir şekilde, GI yan etki insidansı Ruslander ve arkadaşları tarafından bildirilen %53,3’e benzerdi. Buna karşılık, Marconato ve arkadaşlarının çalışmasında toksisite dokuz köpekten ikisinde grade II inappetans ve kusma ile sınırlıydı, ancak ishal bildirilmedi. Bu iki çalışmada da prednizolon kullanılmamıştır ve bu çalışmalar yapıldığında VCOG kriterleri mevcut değildi, ancak yine de mevcut çalışma Ruslander ve arkadaşlarının bulgularıyla daha tutarlıdır.
Dokuz hastada (%34,6) nötropeni meydana gelmiş ve bu durum üç köpekte (iki köpek grade II ve bir grade III toksisite nedeniyle) tedavinin gecikmesine yol açmıştır. Bu dokuz hastanın yedisinde, sitarabin ile eş zamanlı olarak G-CSF almalarına rağmen nötropeni meydana gelmiştir. Bu nötropeni insidansı Ruslander ve arkadaşlarının yaptığı ve hiçbir uyarıcı faktörün kullanılmadığı çalışmadan (%66,6) daha düşük, ancak G-CSF’nin düzenli olarak reçete edildiği Marconato ve arkadaşlarının çalışmasından (%11,1) daha yüksektir. Bunun nedeni, Marconato ve arkadaşlarının çalışmasında G-CSF’nin her zaman tedavinin ilk gününde verilmesi, bizim çalışmamızdaki köpeklerin ise sitarabin CRI’ye başladıktan 24-48 saat sonra G-CSF alması olabilir. İlginç bir şekilde, G- CSF’nin insanlarda ishale neden olduğu bildirilmiştir, ancak bu durumun köpeklerdeki etkisi bilinmemektedir.37 Marconato ve arkadaşlarının çalışmasına kıyasla mevcut çalışmada daha az hastada G-CSF kullanılmıştır, bu nedenle bunun GI toksisitesinin daha sık görülmesine neden olmuş olması pek olası görünmemektedir.
Üç köpekte (%11,5) trombositopeni meydana gelmiştir, ancak ikisinde tedavi öncesi trombositopeni bulunmaktaydı ve bu nedenle bu durum yalnızca sitarabine bağlanamamıştır. Diğer köpekte herhangi bir klinik sonuç veya tedavi gecikmesi gözlenmemiştir.
ALT artışı beş köpekten dördünde görülmüştür, ancak üç köpekte bunun sitarabin toksisitesinden kaynaklanıp kaynaklanmadığı net
değildir, çünkü lenfoma infiltrasyonu veya diğer hepatopatiler de hepatoselüler hasara katkıda bulunmuş olabilir. Hepatotoksisite kemirgenlerle yapılan deneysel çalışmalarda ve karaciğer metabolizmanın ana organı olduğu için insanlarda idiyosenkratik reaksiyonlar şeklinde tanımlanmıştır, ancak köpeklerde bunu değerlendirmek için daha fazla çalışma yapılması gerekmektedir.9
Nörolojik toksisite de insanlarda sitarabin tedavisinin bilinen bir komplikasyonudur ve en yaygın olarak yüksek dozlarda sitarabinin (1-2 g/m2) hızlı infüzyonlarında veya yaşam boyu yüksek kümülatif dozlarda görülür.10,14 Bu durum nöbetleri, serebellar toksisiteyi, periferik nöropatileri ve jeneralize ensefalopatiyi de beraberinde getirebilir.13 MSS lenfomalı köpeklerden oluşan kohortumuzda bunu değerlendirmek zor olsa da, BM tutulumu olan köpek popülasyonunda nörolojik bulgulara dair herhangi bir kayıt bulunmamıştır; bu durum veteriner hastalarda kullanılan daha düşük dozlar ile açıklanabilir.
Sitarabin CRI için rapor edilen yanıt oranları çelişkilidir; Ruslander ve arkadaşlarının çalışmasında tek ajan tedavisine klinik yanıt alınamadığı bildirilirken, Marconato ve arkadaşlarının çalışmasında
dokuz köpekten sekizinde (%88,8) CR gözlenmiştir. Bu iki çalışma arasındaki tutarsızlık, grupların örneklem sayısının azlığına veya ilkinde tedavi süresinin daha kısa olmasına (2 güne karşı 5 gün) bağlanabilir. Yanıt değerlendirmesi bu çalışmanın birincil hedefi olmamasına rağmen, köpeklerin sırasıyla %19 ve %52,4’ünde periferik lenf düğümlerinde CR ve PR gözlenmiştir. Ayrıca, yanıt lenfositoz ve/veya dolaşımdaki neoplastik lenfositlerin varlığına göre değerlendirildiğinde, sitarabin sonrasında köpeklerin %31,2’sinde CR ve %18,7’sinde PR gözlenmiştir.
Görülen yanıtlara rağmen, grup 1 için sonuç ve ortalama sağkalım süreleri (MST: 107 gün) Marconato ve arkadaşları tarafından bildirilenlere kıyasla (sitarabin ile tedavi edildiğinde 243 gün, edilmediğinde 72,5 gün) hayal kırıklığı yaratmaya devam etmektedir. Her iki çalışma da küçük kohortlar rapor ettiğinden ve çalışma tasarımı farklılık gösterdiğinden, verilerin yorumlanmasında dikkatli olunmalıdır. Marconato ve arkadaşlarının çalışmasındaki modifiye CHOP protokolüne kıyasla mevcut çalışmada modifiye CEOP protokolü kullanılmıştır: önceki çalışmalarda sağkalım sürelerinin eşdeğer olduğu öne sürülmüştür.5 Popülasyonumuzdaki sağkalımın daha kötü olması, daha kısa infüzyon süresine ve hasta grubumuzdaki protokolün standardizasyon eksikliğine bağlı olabilir.
Ayrıca, protokolümüzde steroid kullanımı, hastalığın erken dönemlerinde çoklu ilaç direnci transporterlerinin ekspresyonunun artmasına neden olmuş olabilir.4
İlk etapta, sitarabin ilavesinin, diğer ilaçların çoğunun geçemediği kan beyin bariyerini geçme kabiliyeti nedeniyle köpek MSS lenfoma tedavisinde faydalı olduğu düşünülmektedir.8 Ayrıca, sitarabin insanlarda MSS lenfoma tedavisinin temel dayanağı olmaya devam etmektedir.16 Yakın zamanda LaRue ve arkadaşları, ikisi intratekal olarak sitarabin alan dört köpek de dahil olmak üzere farklı yöntemlerle tedavi edilen primer MSS lenfomalı 18 köpeğin sonuçlarını rapor etmiştir.25 Sağlıklı köpeklerdeki plazma konsantrasyonlarına kıyasla sitozin arabinosidin sadece %15’inin BOS’ta yoğunlaştığı tespit edildiğinden,12 intratekal uygulama toksisite seyrini iyileştirirken etkinliği artırmanın da etkili bir yolu olabilir.38 LaRue ve arkadaşları tarafından rapor edilen 171 günlük (aralık: 1-1942 gün) MST’nin, çalışmamızdaki 2. grup için 76 günlük (aralık: 36-1019) MST ile karşılaştırıldığında görünüşte daha uzun olması, intratekal olarak tedavi edilen iki köpeğin 113 ve 268 günlük sağkalım süresi ile nispeten açıklanabilir.
Sitarabinin MSS lenfomasında sonucu iyileştirdiğine dair kanıtlar olsa da,25,26 bu durum BM tutulumu için geçerli değildir.22 BM lenfomalı köpeklerde, özellikle de büyük tümör yükü olanlarda, sitarabinin diğer ajanlarla değiştirilmesi sonucu indüksiyon protokolü sırasında tedavi yoğunluğunun düşmesi ve standartprotokolde ilerlemenin gecikmesi endişe yaratmaktadır. Bu durum, toksisitesi olan hastalarda tedavinin gecikmesiyle potansiyel olarak daha da kötüleşmektedir. Sitarabin, insanlarda miyeloid ve lenfoid neoplazmlarda konsolidasyon tedavisinde ve erken nükslerin önlenmesinde önemli bir rol oynadığını gösteren tam remisyona ulaşıldıktan sonra protokolün ilerleyen aşamalarında verilmesi daha iyi olabilir.10,16 Sitarabin CRI eklenmesinin sağkalım bakımından fayda sağlayıp sağlamadığını daha fazla netleştirmek için randomize, prospektif çalışmalar yapılması gerekmektedir.
Bu çalışmanın, çoğunlukla retrospektif doğasından kaynaklanan çeşitli kısıtlamaları bulunmaktadır. Bazı vakalarda evreleme tamamlanmamıştır ve BM veya MSS tutulumu tanısı kesin olmaktan ziyade varsayımsaldır. Bununla birlikte, çalışmanın birincil amacı toksisiteyi değerlendirmek olduğundan, bu konu çok da önemli değildir. Graff ve arkadaşları periferik dolaşımda neoplastik lenfositlerin varlığı ile lenfomalı köpeklerde BM tutulumu arasında bağlantı olduğunu göstermiş olsa da,30 lenfoma yayılımı başka bir olasılık olarak karşımıza çıkmaktadır. Aşırı yayılma veteriner hekimlikte nadir görülen ve yeterince araştırılmamış bir fenomen olmasına rağmen, son evre lenfomalı insanlarda olduğu gibi, çoğunlukla büyük tümör yükü olan hastalarda rapor edilmektedir.2 Buna ek olarak, CD34 ekspresyonu tutarlı bir şekilde değerlendirilmemiştir ve sitoloji, akış sitometrisi, klinik sunum ve yanıt sonuçlarına göre, beş hastada en olası tanı V. evre lenfoma olmasına rağmen, bu kesin olarak doğrulanamamıştır.31,39 Pragmatik olarak, bu durum sağkalım süresini etkileyecek, ancak toksisite, özellikle de GI toksisite üzerinde daha az etkili olacaktır.
MSS lenfomasında antemortem tanı genellikle BOS analizi, MRI bulguları ve PARR kombinasyonuna dayanmaktadır. Vakaların çoğunda ölüm sonrası yapılan histopatolojik doğrulama hala altın standart olarak kabul edilmektedir.25,32 Klinik bulgular, tetkikler ve tedaviye verilen yanıt kohortumuzdaki köpeklerde lenfoma teşhisini desteklese de, Birleşik Krallık dışına hiç seyahat etmemiş köpeklerde olası görülmediği için hepsi enfeksiyöz ajanlar açısından test edilmemiştir.
Mevcut çalışmanın en önemli kısıtlamalarından biri de sitarabin tedavilerinin standardize edilmemiş olmasıdır. Bununla birlikte, kullanılan protokoller Marconato ve arkadaşları tarafından bildirilenden daha düşük dozlar ve daha kısa infüzyon süreleri içermekteydi ve bunun daha önce rapor edilenden çok daha az genel toksisite ile sonuçlanması gerekirdi, ancak bunun yerine yan etkiler oldukça yaygındı. Bunun aksine, raporların incelenmesi, klinisyenin semptomların klinik açıdan önemli olmadığını düşünmesi veya hasta sahibinin bunları rapor etmemesi halinde yan etkiler olduğundan daha düşük tahmin edilmiş olabilir.
Sonuç olarak, bu çalışma Gİ toksisitenin yaygın olduğunu ve sitarabin CRI ile tedavi edilen köpeklerde bu durumun göz önünde bulundurulması gerektiğini göstermiştir. Bu ilacın çok ilaçlı CEOP’a eklenmesi BM ve MSS lenfomalı köpeklerde önerilmektedir, ancak potansiyel faydaların daha iyi değerlendirilmesi için daha büyük prospektif çalışmalara ihtiyaç vardır.
Çıkar çatışması beyanı ve finansman kaynağı
Yazarlar, burada sunulan çalışma için herhangi bir çıkar çatışması veya finansman kaynağı beyan etmemektedir.
Kaynakça
1. Seelig DM, Avery AC, Ehrhart EJ et al. The comparative diagnostic features of canine and human lymphoma. Vet Sci 2016;3:11.
2. MarconatoL,GelainME,ComazziSThedogasapossibleanimalmodelfor human non-Hodgkin lymphoma: a review. Hematol Oncol 2013;31:1–9.
3. WangSL,LeeJJ,LiaoATComparisonofefficacyandtoxicityofdoxorubicin and mitoxantrone in combination chemotherapy for canine lymphoma. Can Vet J 2016;57:271–276.
4. ChildressMO,Ramos-VaraJA,RupleAArandomizedcontrolledtrialofthe effect of prednisone omission from a multidrug chemotherapy protocol on treatment outcome in dogs with peripheral nodal lymphomas. J Am Vet Med Assoc 2016;249:1067–1078.
5. Elliott JW, Cripps P, Marrington AM et al. Epirubicin as part of a multi-agent chemotherapy protocol for canine lymphoma. Vet Comp Oncol 2013;11: 185–198.
6. Hosoya K, Kisseberth WC, Lord LK et al. Comparison of COAP and UW-19 pro- tocols for dogs with multicentric lymphoma. J Vet Intern Med 2007;21: 1355–1363.
7. Moore AS Treatment of T cell lymphoma in dogs. Vet Rec 2016;179:277.
8. Chabner BA, Glass J. Cytidine analogues. In: Chabner BA, Longo DL, editors. Cancer chemotherapy and biotherapy: principles and practice. 5th edn. Lippincott Williams &Wilkins, Philadelphia,2011;171–191.
9. Crook KI, Early PJ, Messenger KM et al. The pharmacokinetics of cytarabine in dogs when administered via subcutaneous and continuous intravenous infu- sion routes. J Vet Pharmacol Ther 2013;36:408–411.
10. Reese ND, Schiller GJ High dose cytarabine (HD ara-C) in the treatment of leukaemias: a review. Curr Hematol Malig Rep 2013;8:141–148.
11. Vogelzang NJ Continuous infusion chemotherapy: a critical review. J Clin Oncol 1984;2:1289–1304.
12. Scott-Moncrieff JC, Chan TC, Samuels ML et al. Plasma and cerebrospinal fluid pharmacokinetics of cytosine arabinoside in dogs. Cancer Chemother Pharmacol 1991;29:13–18.
13. Stentoft J The toxicity of cytarabine. Drug Saf 1990;5:7–27.
14. Wu D, Duan C, Chen L et al. Efficacy and safety of different dose of cytarabine in consolidation therapy for adult acute myeloid leukaemia patients: a network meta-analysis. Sci Rep 2017;25:9509.
15. Ferreri AJM, Reni M, Foppoli M et al. High-dose cytarabine plus high-dose methotrexate versus high-dose methotrexate alone in patients with primary CNS lymphoma: a randomised phase 2 trial. Lancet 2009;374:1512–1520.
16. Citterio G, Reni M, Gatta G et al. Primary central nervous system lymphoma. Crit Rev Oncol Hematol 2017;113:97–110.
17. Gillem J, Giuffrida M, Krick E Efficacy and toxicity of carboplatin and cytarabine chemotherapy for dogs with relapsed or refractory lymphoma (2000–2013). Vet Comp Oncol2017;15:400–410.
18. Parsons-Doherty M, Poirier VJ, Monteith G The efficacy and adverse event pro- file of dexamethasone, melphalan, actinomycin D, and cytosine arabinoside (DMAC) chemotherapy in relapsed canine lymphoma. Can Vet J 2014;55:175–180. 19. Alvarez FJ, Kisseberth WC, Gallant SL et al. Dexamethasone, melphalan, acti- nomycin D and cytosine arabinoside (DMAC) protocol for dogs with relapsed lymphoma. J Vet Intern Med 2006;20:1178–1183.
20. Smallwood K, Tanis JB, Grant IA et al. Evaluation of a multi-agent chemo- therapy protocol combining dexamethasone, melphalan, actinomycin D, and cytarabine for the treatment of resistant canine non-Hodgkin high-grade lym- phomas: a single centre’s experience. Vet Comp Oncol 2019;21:1–9.
21. Batschinski K, Dervisis N, Kitchell B et al. Combination of bleomycin and cytosine arabinoside chemotherapy for relapsed canine lymphoma. J Am Anim Hosp Assoc 2018;54:150–155.
22. Marconato L, Bonfati U, Stefanello D et al. Cytosine arabinoside in addition to VCAA-based protocols for the treatment of canine lymphoma with bone marrow involvement: does it make the difference? Vet Comp Oncol 2008; 6:80–89.
23. Ruslander D, Moore AS, Gliatto JM et al. Cytosine arabinoside as a single agent for the induction of remission in canine lymphoma. J Vet Intern Med1994;8:299–301.
24. Early PJ, Crook KI, Williams LM et al. Plasma and serum concentrations of cytarabine administered by continuous infusion to dogs with meningoenceph- alitis of unknown origin. J Vet Pharmacol Ther 2017;40:411–414.
25. LaRueMK,TaylorAR,BackARetal.Centralnervoussystemlymphomain 18 dogs (2001 to 2015). J Small Anim Pract 2018;59:547–552.
26. Couto CG, Cullen J, Pedroia V et al. Central nervous system lymphosarcoma in the dog. J Am Vet Med Assoc 1984;184:809–813.
27. VolkAV,VolkHA,RestJRetal.Calcinosiscutisatcytarabineinjectionsitein three dogs receiving prednisolone. Vet Rec 2012;29:327.
28. Hart SK, Waddell L Suspected drug-induced infiltrative lung disease culmi- nating in acute respiratory failure in a dog treated with cytarabine and predni- sone. J Vet Emerg Crit Care (San Antonio) 2016;26:844–850.
29. Marconato L, Martini V, Aresu L et al. Assessment of bone marrow infiltra- tion diagnosed by flow cytometry in canine large B cell lymphoma: prognosticsignificance and proposal of a cut off value. Vet J 2013;197:776–781.
30. Graff EC, Spangler EA, Smith A et al. Haematological findings predictive of bone marrow disease in dogs with multicentric large-cell lymphoma. Vet Clin Pathol 2014;43:505–512.
31. Comazzi S, Gelain ME Use of flow cytometric immunophenotyping to refine the cytological diagnosis of canine lymphoma. Vet J 2011;188:149–155.
32. Sisó S, Marco-Salazar P, Moore PF et al. Canine nervous system lymphoma subtypes and characteristic neuroanatomical pattern. Vet Pathol 2017;54:53–60. 33. Owen LN, Veterinary Public Health Unit & WHO Collaborating Centre for Comparative Oncology. TNM classification of tumours in domestic animals. 1st edition. Geneva, World Health Organization, 1980.
34. Veterinary cooperative oncology group – common terminology criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineo- plastic therapy in dogs and cats v1.0. Vet Comp Oncol 2004;2:194–213.
35. Vail DM, Michels GM, Khanna C et al. Response evaluation criteria for peripheral lymph nodal lymphoma in dogs (v1.0) – a veterinary cooperative oncology group (VCOG)consensus document. Vet Comp Oncol 2010;8:28–37. 36. Viau AT, Abuchowski A, McCoy JR et al. Toxicologic studies of a conjugate of asparaginase and polyethylene glycol in mice, rats, and dogs. Am J Vet Res 1986;47:1398–1401.
37. Grant SM, Heel RC Recombinant granulocyte-macrophage colony- stimulating factor (rGM-CSF): a review of its pharmacological properties and prospective role in the management of myelosuppression. Drugs 1992;43: 516–560.
38. Genoni S, Palus V, Eminaga S et al. Safety of intrathecal administration of cytosine arabinoside and methotrexate in dogs and cats. Vet Comp Oncol 2016; 14:331–336.
39. RiondatoF,MiniscalcoB,PoggiAetal.Analyticalanddiagnosticvalidation of a flow cytometric strategy to quantify blood and marrow infiltration in dogs with large B-cell lymphoma. Cytometry B Clin Cytom 2016;90:525–530.
(Yayınlanmak üzere kabul edildi 27 Ekim 2019)
KÜÇÜK HAYVANLAR
78 Australian Veterinary Journal Volume 98 No 3, March 2020
© 2019 Australian Veterinary Association