1Cerrahi Anabilim Dalı, Veteriner Hekimlik ve Hayvan Bilimleri Fakültesi, São Paulo Üniversitesi, São Paulo 05508-010, Brezilya; tharmacedo@gmail.com (T.R.M.); samymelo@usp.br (S.R.M.); anacarol@usp.br (A.C.B.C.F.P.); materajm@usp.br (J.M.M.)
2 Hayvan Bilimi Anabilim Dalı, Semi-Arid Federal Bölge Üniversitesi, Mossoró 59625-900, Brezilya
3 Positivo Üniversitesi Endüstriyel Biyoteknoloji Yüksek Lisans ve Doktora Programı, Curitiba 81280-330, Brezilya; thaiscosta@yahoo.com.br
4 Koruyucu Veteriner Hekimlik ve Hayvan Sağlığı Bölümü,
Veteriner Hekimliği ve Hayvan Bilimleri Fakültesi, São Paulo Üniversitesi, São Paulo 05508-010, Brezilya; pama.alexandre@gmail.com (P.A.A.); paulo7926@usp.br (P.E.B.)
5 Karşılaştırmalı ve Translasyonel Onkoloji Laboratuvarı (LOCT), Veteriner Hekimliği Bölümü,
Hayvan Bilimi ve Gıda Mühendisliği Fakültesi, Sao Paulo Üniversitesi, Pirassununga 13635-900, Brezilya; fukumasu@usp.br
6 Deneysel ve Karşılaştırmalı Onkoloji Laboratuvarı, Patoloji Bölümü, Veteriner Hekimliği ve Hayvan Bilimleri Fakültesi, São Paulo Üniversitesi, São Paulo 05508-010, Brezilya; mlzdagli@usp.br
Makaleye atıfta bulunmak için: Macedo, T.R.; de Queiroz, G.F.; Casagrande, T.A.C.; Alexandre, P.A.; Brandão, P.E.; Fukumasu, H.; Melo, S.R.; Dagli, M.L.Z.; Pinto, A.C.B.C.F.; Matera, J.M. Imatinib Mesylate for the Treatment of Canine Mast Cell Tumors: Assessment of the Response and Adverse Events in Comparison with the Conventional Therapy with Vinblastine and Prednisone. Cells 2022, 11, 571.https://doi.org/ 10.3390/cells11030571
Akademik Editör: Alexander E. Kalyuzhny
Sunum Tarihi: 14 Aralık 2021 Kabul Tarihi: 20 Ocak 2022 Yayın tarihi: 7 Şubat 2022
Yayıncının Notu: MDPI,
yayınlandığı ülkelerdeki
iddiaları ve kurumlar arası ilişkiler konusunda tarafsız kalacaktır.
Telif hakkı: © 2022 yazarlar tarafından. Lisans sahibi MDPI, Basel, İsviçre. Bu makale Creative Commons Attribution hüküm ve koşulları altında yayınlanan erişime açık bir makaledir. (CC BY) license (https://creativecommons.org/licenses/b y/ 4.0/).
* İlgili kişi: ferque@usp.br; Tel.: +55-1130917712
Özet: Mast hücre tümörleri (MHT) köpeklerde sık rastlanan tümörlerdir ve bu hastalıkların tedavileri arasında cerrahi, polikemoterapi ve tirozin kinaz inhibitörleri ile hedefe yönelik tedavi yer almaktadır. Bu çalışmanın amacı köpek kutanöz MHT’lerinde konvansiyonel vinblastin ve prednizolon (VP) tedavisine kıyasla imatinib mesilat (IM) tedavisine alınan yanıtın ve yan etkilerin incelenmesidir. Yirmi dört köpek çalışmaya dahil edildi; 13 hayvan IM ve 11 hayvan VP ile tedavi edildi. Tümör doku örnekleri histolojik tanı, derecelendirme ve KIT immün boyaması yapılması için alınmıştır. Tedaviye yanıt VCOG kriterlerine göre tomografik ölçümlerle değerlendirildi. Yan etkiler VCOG-CTCAE kriterlerine göre sınıflandırılmıştır. IM ve VP gruplarında benzer ırk, cinsiyet, yaş, MHT lokalizasyonu, DSÖ evresi ve lenf nodu metastazı profiline sahip köpekler vardı. MHT’lerin çoğu grade 2/düşüktü ve KIT- patern 2 ve 3’e sahipti. Objektif yanıt oranı (ORR) IMgrubunda (%30,79) VP grubundan (%9,09) istatistiksel olarak belirgin şekilde daha yüksekti. IM grubundaki yan etkilerin (YE) tümü grade 1 olup VP’den istatistiksel açıdan belirgin şekilde farklıydı. Sonuç olarak, IM, VP ile karşılaştırıldığında objektif yanıt oranı daha iyi ve yan etkiler daha az görülmüş, düşük gradeli köpek MHT’lerinin tedavisi için uygun bir seçenek olduğu görülmüştür.
Anahtar Kelimeler: c-KIT; imatinib mesilat; immünohistokimya; mast hücreli tümör; prednizon; vinblastin
1. Giriş
Mast hücre tümörleri (MHT’ler) köpeklerde yaygın olarak görülen hematopoetik neoplazmlardır ve bu türde rapor edilen deri tümörlerinin %7-21’ini oluşturmaktadır [1,2]. Son zamanlarda, köpek ve insan mast hücreli neoplazmları karşılaştırılmış ve karşılaştırmalı onkolojinin önemi ortaya çıkmıştır: insan sistemik mastositozu ve köpek mast hücreli tümörleri, tanısal yaklaşımlar, c-KIT mutasyonları ve hatta tedavi yöntemleri gibi birçok özelliğin ortak
olduğu görülmektedir [3]. Köpek mast hücre tümörlerinin çoğu, c-KIT geninde, juxtamembrane bölgesindeki internal tandem duplikasyonlar [4,5] dahil olmak üzere, KIT’in yapısal aktivasyonu sonucu artan ve kontrolsüz hücre proliferasyonuna yol açan farklı mutasyonlar sergilemektedir. Köpek MHT’leri biyolojik davranışları açısından geniş bir çeşitlilik göstermektedir; benign tümörlerden yüksek derecede invaziv ve metastatik tümörlere kadar değişmektedir [6]; çoğu yazar bu tümörlerin daima malign olarak kabul edilmesi gerektiğini belirtmiştir. Köpek MHT’si için iki histolojik derecelendirme sistemi önerilmiştir. Petnaik sisteminde, MHT’ler grade 1, 2 veya 3 olarak kategorize edilmektedir, dolayısıyla grade 3 tümörler daha fazla metastatik potansiyele sahip daha agresif tümörlerdir ve bu nedenle klinik açıdan daha endişe vericidir [7]. Daha güncel olan Kiupel iki kategorili derecelendirme sistemi MHT’yi yüksek veya düşük gradeli tümörler olarak sınıflandırmaktadır [8]. Histolojik grade, yerleşimi ve c-KIT mutasyon durumu, yüksek ve düşük gradeli MHT’leri birbirinden ayıran ve yaygın olarak kullanılan prognostik faktörlerdir [9,10].
MHT’li köpeklerin tedavisi ya polikemoterapi ya da toceranib, masitinib veya daha az sıklıkla imatinib gibi tirozin kinaz inhibitörlerinden meydana gelmektedir [11-13]. Tedavi seçimi klinik ve histopatolojik tanılara ve hastalığın evresine göre belirlenmektedir. Mast hücreli tümörler için tedavi seçenekleri şunlardır: cerrahi, kemoterapi, radyoterapi veya karma tedavi. Cerrahi eksizyon, bölgesel lenf nodlarının tutulumu olsun ya da olmasın, geniş eksizyona izin veren alanlarda saptanan ve homojen kitleler olarak ortaya çıkan mast hücreli tümörlerin tedavisinde tercih edilmektedir [14]. Mast hücreli tümörler son derece invazivdir ve bu hastalıkları tedavi etmek için geniş cerrahi sınırlar endikedir. Çoklu tümörler, inoperabl tümörler veya uzak metastazlar söz konusu olduğunda, diğer tedavi yöntemleri endikedir [15]. Mast hücreli tümörler için kemoterapi, ileri klinik evrelerdeki yüksek gradeli tümörlerin tedavisinde, debulking için veya inkomplet eksizyon vakalarında lokal nüksü önlemek için endikedir. [16]. Mast hücreli tümörlerin tedavisi için standart kemoterapi protokolü vinblastinin prednizon ile birlikte kullanılmasıdır [17].
Tirozin kinaz aktivitesine sahip reseptörler (RTK’lar), insanlarda ve neoplastik hastalıkları olan hayvanlarda genellikle düzensiz regüle olan ve yaygın olarak araştırılan hücre proteinleridir [18,19]. Köpek MHT’sinde VEGFR-2 ve PDGFRB’ye ek olarak KIT’in heterojen ekspresyonu da rapor edilmiştir [20,21].
İmatinib mesilat (IM), antineoplastik etkinliği olduğu bilinen ve bir tirozin kinaz inhibitörü olan imatinibin mesilat tuzudur. İmatinib, tirozin kinazlar (TK) içinde bulunan hücre içi bir cebe bağlanır, böylece ATP bağlantısını, fosforilasyonu ile büyüme reseptörlerinin ve bunların downstream sinyal transdüksiyon yollarının sekonder aktivasyonunu inhibe eder. Bu ajan, c-KIT ve trombosit kaynaklı büyüme faktörü reseptörü (PDGFR) onkogenleri ile kodlanan RTK’ları inhibe eder. İmatinib, insanlarda gastrointestinal stromal tümörleri [22] ve köpeklerde MHT’yi [11-13] tedavi etmek için kullanılan seçici bir RTK inhibitörüdür, çünkü bu tümörler anormal konstitütif tirozin kinaz ekspresyonları gösterir ve dolayısıyla disregüle hücre büyümesine neden olur [5].
IM, köpek MHT’lerini tedavi etmek için kullanılmaktadır [11-13]; ancak, bu ajanın konvansiyonel vinblastin ve prednizon (VP) kemoterapisine göre etkinliği henüz belirlenmemiştir. Bu nedenle, bu çalışma MHT’li köpeklerde konvansiyonel vinblastin ve prednizolon (VP) tedavisine kıyasla imatinib mesilat (IM) tedavisine alınan yanıtı değerlendirmeyi hedeflemiştir. Bu çalışma ayrıca IM ve VP tedavilerinin yan etkilerini karşılaştırmayı da hedeflemektedir.
2. Materyal ve Metot
2.1. Etik Kurul Onayı, Köpek Hastalar ve Çalışmaya Dahil Edilme Kriterleri
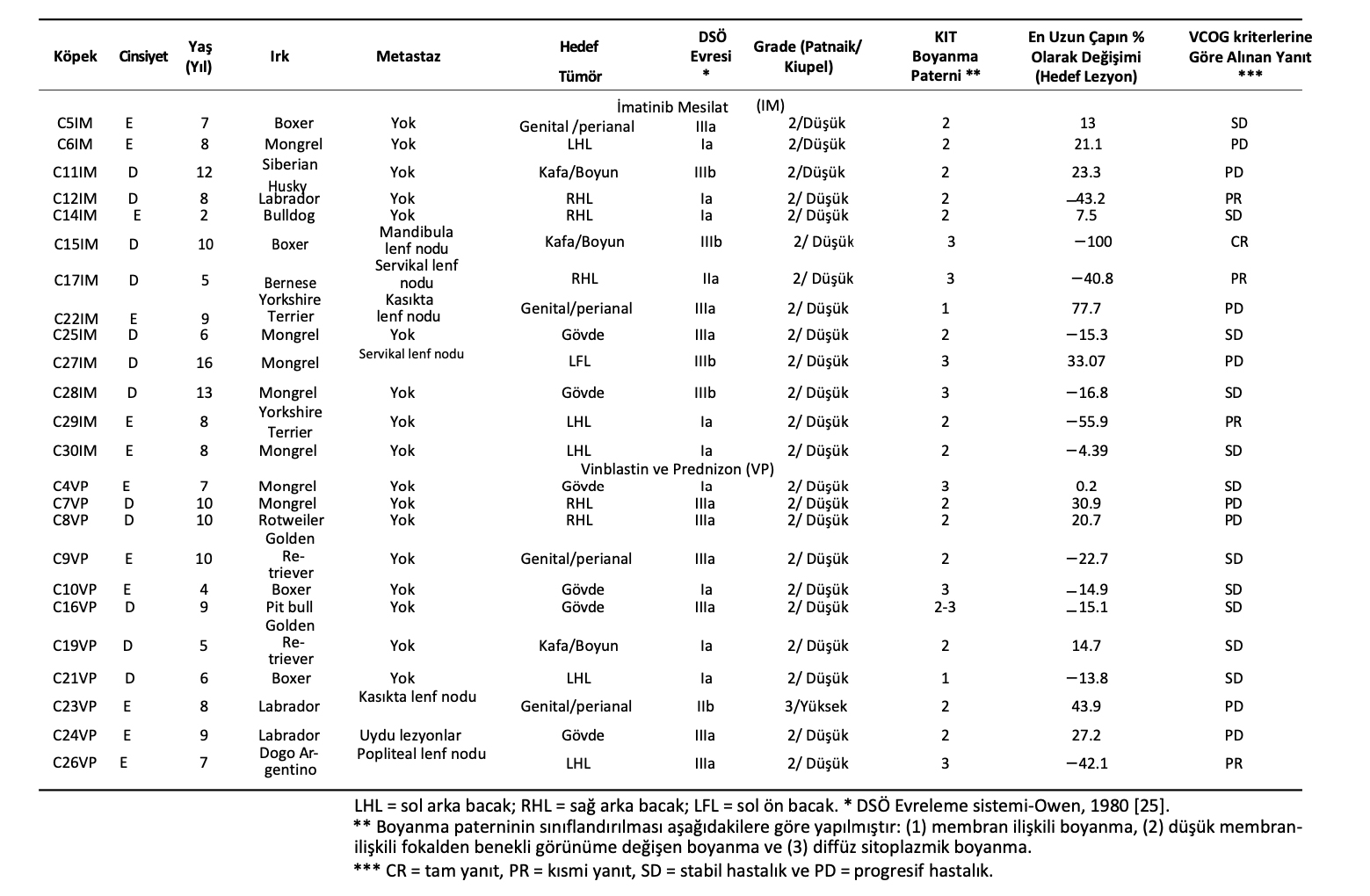
Bu çalışma Sao Paulo Üniversitesi, FMVZ-USP Veterinerlik ve Hayvan Bilimleri Fakültesi Etik Kurulu (CEUA) tarafından onaylanmıştır (işlem numarası 2092/2010). Köpek sahipleri bilgilendirilmiş onam formlarını imzalamışlardır. São Paulo Üniversitesi Veteriner Hekimliği ve Hayvan Bilimi Fakültesi Küçük Hayvan Hastanesi’nde (FMVZ-USP) toplam 24 sahipli köpek çalışmaya dahil edilmiştir. Dahil edilme ve hariç tutulma kriterleri Tablo1’de listelenmiştir.
2.2. Teşhis ve Evreleme
Klinik değerlendirme ve evreleme, tıbbi öykü, fizik muayene, tam kan sayımı (Tam kan sayımı; diferansiyel ve trombosit sayıları dahil), serum biyokimyası, idrar tahlili, transabdominal ultrason ve eğer mümkünse bölgesel lenf nodu sitolojisiyle ilgili verilerin eksiksiz olarak toplanması ile yapılmıştır.
Tanı, punch biyopsi örneklerinin histolojik analizine göre konulmuştur. Tümör örnekleri histolojik ve immünohistokimyasal analizler için toplanmıştır. Bunlar %10 formalin içinde fikse edildi ve rutin olarak parafine eklenmek üzere işlendi. 5 um’lik kesitler cam lamlara yerleştirilmiş ve tanı için hematoksilen ve eozin ile boyanmıştır. Histolojik slaytlar tek bir veteriner patolog (M.L.Z.D.) tarafından incelenmiştir.
Birden fazla MHT’si olan köpeklerde, grade’leme yapmak için en büyük tümör seçilmiştir. Tümörler hem Patnaik [7] hem de Kiupel [8] derecelendirme sistemlerine göre derecelendirilmiştir.
Tümör örnekleri, c-kit mutasyonlarının analizi (PCR amplifikasyonları ve sekanslama) ve Real-Time PCR ile c-kit ve c-kit ligandının yarı kantitatif ekspresyonu için DNA ve RNA ekstraksiyonlarına tabi tutulmuştur. Elde edilen sonuçlar net değildi ve bu nedenle de bu çalışmaya dahil edilmemiştir.
2.3. İmmünohistokimya
Köpek kutanöz MHT’lerinin doku kesitleri, daha önce tarif edildiği gibi KIT protein lokalizasyonunun immünohistokimyasal değerlendirmesi için kullanılmıştır [22].
Lamları immünohistokimyaya hazırlamak için parafin bloklardan 5 μm kalınlığında kesitler alınmış, silanize lamlara yapıştırılmış, mumları alınmış ve rehidre edilmiştir. KIT için antijenlerin geri kazanımı, histolojik kesitlerin pH 6.0 olan %1 sitrat tampon çözeltisi içinde otoklavda 3.5 dakika ısıtılmasıyla gerçekleştirilmiştir. Soğutulduktan sonra, lamlar %6 hidrojen peroksit solüsyonunda 30 dakika boyunca endojen peroksidaz bloğu ile işlem görmüş, ardından lamlar 10 dakika boyunca akan suda ve 5 dakika boyunca distile suda yıkanmış, ardından her biri 5 dakika boyunca PBS ile 5 banyo yapılmıştır. Histolojik kesitler anti-KIT 1 (Dako Denmark A/S, 1:100) primer antikorlarıyla inkübe edilmiş ve %1 sığır albümini (BSA; Sigma® A9647) ve %0,1 sodyum azid (NaN3) içeren PBS tamponunda 30 dakika 37 ◦C’de etüvde seyreltilmiş, ardından nemli bir odada 4 ◦C’de 18 saat (bir gece) bekletilmiş, ardından PBS ile yıkanmış ve Super Picture Poly HRP konjugat polimeriyle 30 dakika 37 ◦C’de etüvde inkübe edilmiştir. Revelasyon diaminobenzen (DAB+Chromogen, Dako Carpinteria, CA, ABD) içeren bir solüsyon kullanılarak yapılmıştır. Hematoksilen ile karşı boyama gerçekleştirildi. Daha sonra, alkol banyolarında dehidrasyon (her biri 5 dakika olmak üzere iki kez %70, %95 ve saf alkol), ardından ksilen ile karıştırılmış alkol solüsyonu ile diyafanizasyon, her biri 10 dakika süren iki ksilen banyosu ve sentetik reçine ve lamel içine yerleştirme yapıldı.
KIT boyanma paternleri ve protein lokalizasyonu Kiupel ve arkadaşları tarafından tarif edildiği şekilde değerlendirilmiştir [22]. KIT protein lokalizasyonu tek bir veteriner patolog (M.L.Z.D.) tarafından yorumlanmıştır. KIT-pozitif hücreler Nikon marka mikroskopta (40× büyütme) ışık mikroskobu ve Image Pro Plus yazılımı (Image Pro Plus 4.5®, Media Cybernetics, Silver Spring, MD, ABD) kullanılarak manuel olarak sayılmıştır.
Her MHT, neoplastik hücre popülasyonunun en az %10’unda bulunan (Büyük Büyütme Alanında 100 neoplastik hücre temel alınarak tahmin edilmiş) veya tümör içinde büyük neoplastik hücre kümelerinde bulunan en yüksek boyanma paternine (boyanma paterni I, II veya III) göre üç boyanma paterninden birine atanmıştır [22].
2.4. Tedavi Protokolleri
Köpekler farklı tedavi protokolleri alan iki gruptan birine rastgele tayin edilmiştir. IM grubundaki köpekler (13 hayvan) 8 hafta boyunca günlük oral dozlarda (10 mg/kg) IM (Gleevec 100 veya 400 mg, Novartis Pharma AG, Basel, İsviçre) almıştır. VP Grubundaki köpeklere (11 hayvan) 4 haftalık ve daha sonra 4 iki haftada bir, IV bolus enjeksiyonla 2,0 mg/m2 olarak verilen vinblastin (Faublastina 10 mg, Libbs) kürleri ile birlikte günlük oral prednizon (Meticorten 5 veya 20 mg, Schering-Plough S.A., Kenilworth, NJ, ABD) önce 2 mg/kg olarak uygulandı, daha sonra 12 hafta boyunca azaltıldı ve kesildi [20]. Köpeklere ayrıca olası MHT degranülasyonunun etkilerinden kaçınmak için difenhidramin (2 mg/kg PO, B.I.D.) ve omeprazol (0,5 mg/kg PO, günde bir kez) reçete edilmiştir.
2.5. Tedaviye Alınan Yanıtın Değerlendirilmesi
Tedaviye alınan yanıt, Veteriner Onkoloji Grubu (VCOG) tarafından belirlenen solid tümörlerde yanıt değerlendirme kriterlerine göre belirlenmiş [23] ve tam yanıt (CR), kısmi yanıt (PR), stabil hastalık (SD) veya progresif hastalık (PD) şeklinde sınıflandırılmıştır. Tümör başlangıç ölçümleri 0. günde dijital kaliperler ve Bilgisayarlı Tomografi (BT) görüntüleri (XPRESS/G6 BT Tarayıcı, Toshiba, Tokyo, Japonya) kullanılarak elde edilmiştir. Tedavi sırasında köpeğin hastalık ölçümlerindeki değişiklikler, dijital kaliper kullanılarak yapılan tümör ölçümlerine dayanarak VP grubunda her hafta veya IM grubunda her 10 günde bir kontrol edilmiştir. Dijital kaliper ölçümlerine göre hastalığı ilerleyen ve alternatif tedavi alan köpekler çalışmadan çıkarılmıştır (veriler sunulmamıştır).
Objektif yanıt oranı (ORR) çalışmanın primer sonlanım noktasıydı. ORR, değerlendirme sonucunda en iyi yanıt olarak CR veya PR elde edilen köpeklerin yüzdesi şeklinde tanımlanmıştır. Primer sonlanım noktası olarak IM grubunda 8. haftada ve VP grubunda 12. haftada BT görüntüleri ile belirlenen tümör büyüklüğü ölçümlerindeki ORR, 0. günde elde edilen başlangıç ölçümlerindeki ORR ile karşılaştırılmıştır. Tümörler, radyoloji uzmanının girdisine göre ayarlanan yarı otomatik segmentasyon algoritması kullanılarak ana hatlarıyla belirlenmiş ve en uzun çap MHT konturlarından ölçülmüştür. Birden fazla tümör mevcut olduğunda, yanıt değerlendirmesi için yalnızca en büyük çapa sahip tümör dikkate alınmıştır. ORR, değerlendirme sonucunda en iyi yanıt olarak CR veya PR elde edilen köpeklerin yüzdesi şeklinde tanımlanmıştır.
2.6. Yan Etkilerin Değerlendirilmesi
Yan etkilerin değerlendirilmesinde Veteriner Onkoloji Grubu (VCOG-CTCAE) tarafından belirlenen kriterler esas alınmıştır [24]. VP grubundaki köpekler ilaç uygulamasından önce haftada bir kontrol edilmiştir. IM grubundaki köpekler 10 günlük aralıklarla tekrar kontrol edildi. Hematolojik toksisite, böbrek ve karaciğer fonksiyonu sırasıyla tam kan sayımı bulguları, serum kreatinin ve kan üre azotu ve karaciğer enzim (ALP ve AST) seviyelerine göre değerlendirildi. Gastrointestinal toksisite, hasta sahipleri tarafından bildirilen sonuçlara göre değerlendirilmiştir. Vinblastin uygulaması için nötrofil sayısı sınırı ≥2500/μL olarak belirlenmiştir (veriler sunulmamıştır).
2.7. İstatiksel Analiz
İstatistiksel analize tabi tutulacak değişkenler sayısal veya kategorik olarak sınıflandırılmıştır. Sayısal veriler ortalama veya medyan olarak, kategorik veriler ise frekans ve yüzde şeklinde ifade edilmiştir. Sayısal değişkenler Mann-Whitney testi kullanılarak karşılaştırılmıştır. Kategorik değişkenler Fisher’in kesin olasılık testi kullanılarak kohortlar arasında karşılaştırılmıştır. IM veya VP ile tedavi edilen, MHT’li köpeklerde genel yanıt (PR ve CR toplamı) verilerini karşılaştırmak için Fisher’in kesin olasılık testi kullanılmış ve bu test ayrıca IM ve VP ile tedavi edilen köpekler arasında grade 1 yan etki insidansını karşılaştırmak için de kullanılmıştır. Bildirilen tüm p- değerleri 2 yönlüdür ve istatistiksel anlamlılığı tanımlamak için p < 0,05 olarak kabul edilmiştir. Tüm istatistiksel analizler GraphPad Prism yazılımı kullanılarak gerçekleştirilmiştir.
3. Sonuçlar
3.1. Hastalara Dari Bilgiler ve Tümörün Özellikleri
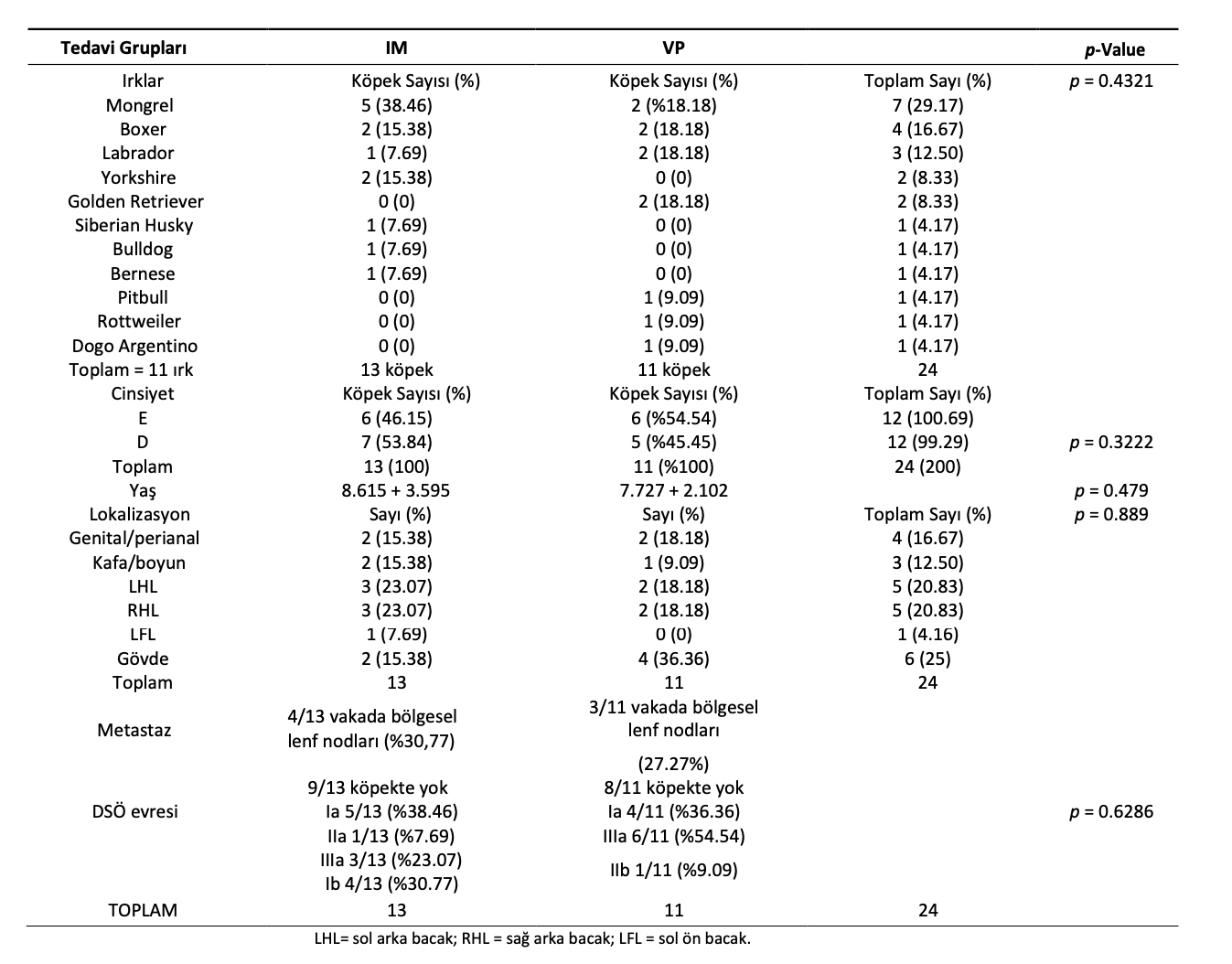
Çalışmaya 10 farklı ırktan (Boxer, Sibirya Husky, Labrador, Bulldog, Bernese, Yorkshire, Pitbull, Golden Retriever, Rottweiler, Dogo Argentino) ve melez olmak üzere yaşları 2 ila 16 arasında değişen (ortalama yaş, 8 yaş; 12 erkek ve 12 dişi) 24 köpek dahil edilmiştir. IM ve VP gruplarındaki köpeklere dair bilgiler Tablo2’de verilmiştir. Çalışmaya dahil edilen tüm MHT vakaları kutanözdü. İki tedavi grubu dikkate alındığında çalışmaya dahil edilen köpeklerin ırkları, cinsiyetleri, yaşları, tümör lokalizasyonları, DSÖ sistemine göre evresi ve metastazları arasında istatistiksel bir fark bulunmamıştır. (Tablo3).
IM grubundaki on üç köpekten dördü ve VP grubundaki on bir köpekten ikisi tanı anında lenf düğümlerine metastaz göstermiştir (Tablo3). IM veya VP tedavilerinin değerlendirilmesi için yalnızca hedef lezyonlar dikkate alınmıştır.
Tablo 2. Çalışmaya dahil edilen köpeklere ait bilgiler ve imatinib mesilat (IM) veya vinblastin ile prednizona (VP) verdikleri yanıtlar.
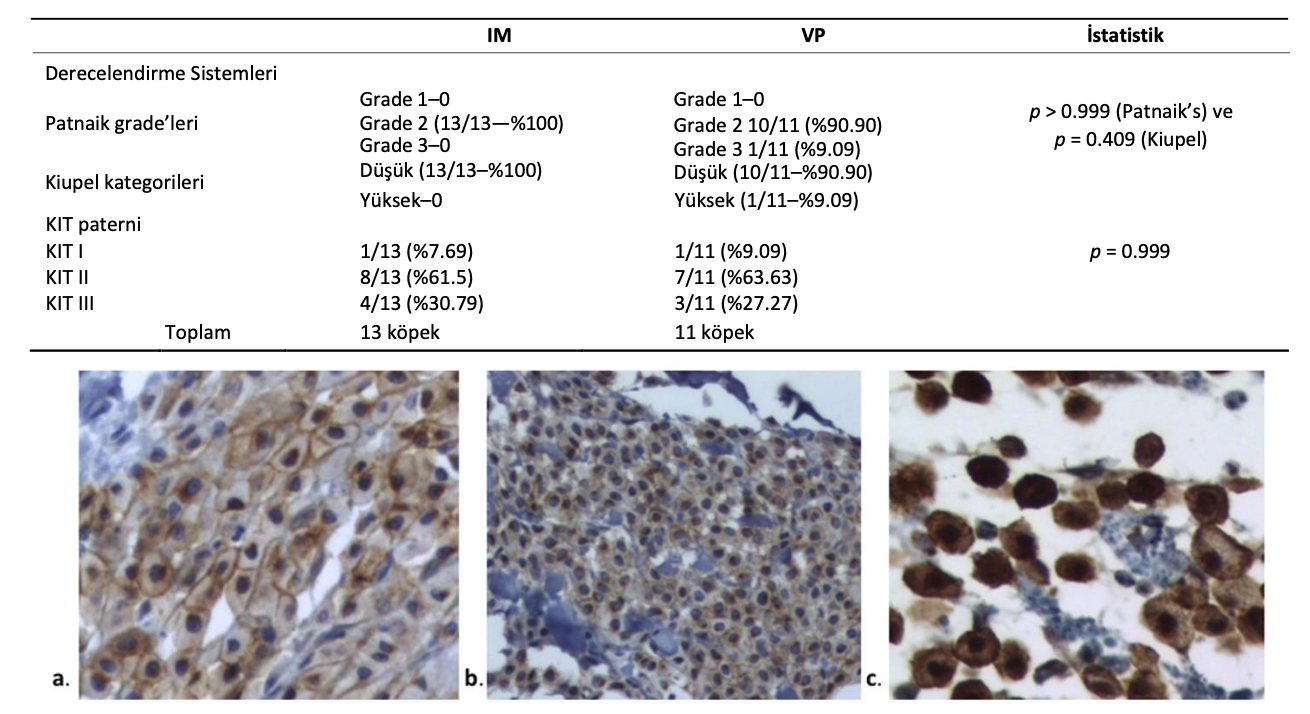
Bu çalışmaya dahil edilen köpeklerden alınan MHT örneklerinin histolojik özellikleri Tablo4’te verilmiştir. IM grubunda, Patnaik’in ve Kiupel’in derecelendirme sistemlerine göre vakaların %100’ü grade 2 ve düşük grade idi. VP grubunda ise MHT’lerin %90,90’ı grade 2 ve 1 MHT grade 3; 1 MHT ise grade 3 ve yüksek grade idi. Tümör derecelendirmesi gruplar arasında istatistiksel olarak anlamlı bir farklılık göstermemiştir (Patnaik ve Kiupel sınıflandırmaları: p > 0.999 ve p = 0.409).
Tablo 3. Mast hücre tümörü olan köpeklerde IM ve VP tedavilerinin karşılaştırıldığı çalışmaya dahil edilen hayvanların demografik özellikleri.
3.2. KIT Protein Lokalizasyonu
Tüm MHT’lerde KIT protein lokalizasyonu mikroskobik inceleme ile belirlenmiştir. KIT boyanma paternleri Şekil1 ve Tablo4’te sunulmuştur. IM ve VP gruplarındaki MHT’lerin çoğu Kit 2 paternine göre sınıflandırılmıştır (sırasıyla %61,50 ve %63,63). KIT paterni gruplar arasında istatistiksel olarak anlamlı farklılık göstermemiştir (p = 0,999).
3.3. Tedaviye Alınan Yanıt
Tedaviye alınan yanıt, tümörlerin BT tarama görüntülerinden VCOG [23] kriterlerine göre tek boyutlu kurallar (en uzun çap) kullanılarak değerlendirildi.
IM ile tedavi edilen 13 MHT’li köpekten birinde CR, üçünde PR, beşinde SD ve dördünde PD (sırasıyla %7,7, %23,1, %38,5 ve %30,8) elde edilmiş ve genel yanıt oranı (CR ve PR toplamı) %30,76 bulunmuştur (Tablo5). VP ile tedavi edilen 11 MHT’li köpekten hiçbiri tam remisyona (CR) ulaşamamıştır: bir köpekte kısmi yanıt (PR) (%9,09), altı köpekte stabil hastalık (SD) ve dört hayvanda progresif hastalık (PD) görülmüştür. Tedavi yanıt verileri Tablo 2 ve 5’te sunulmuştur.
Tablo 4. İki tedavi grubuna ayrılan köpeklerde MHT’nin histolojik özellikleri.
Şekil 1. Kiupel ve diğerlerine göre kit boyanma paternleri, 2004 [19] (a). Kit I: membran ilişkili boyanma, (b). Kit II: düşük membran-ilişkili fokalden benekli görünüme değişen boyanma ve (c). Kit III: diffüz sitoplazmik boyanma.
IM veya VP tedavilerine alınan genel yanıt, yani tam yanıt (CR) + kısmi yanıt (PR) toplamı, bir kontenjans tablosunda karşılaştırıldığında ve Fisher kesin olasılık testi ile analiz edildiğinde, fark istatistiksel olarak son derece belirgindi (p = 0.0003). Dolayısıyla, IM’nin bu vakalarda VP’ye kıyasla genel yanıtı daha yüksek tespit edilmiştir.
3.4. Yan Etkiler
İmatinib mesilat (IM), vinblastin ve prednizon (VP) ile tedavi edilen hastalardaki yan etkiler VCOG-CTCAE’ye [24] göre sınıflandırılmış ve Tablo6’da gösterilmiştir. IM ile tedavi edilen hastalardaki yan etkilerin tümü grade 1 olarak sınıflandırılırken, VP grubundaki hayvanlar grade 1 ve 2 olarak sınıflandırılmıştır; IM grubundaki köpeklerin %38,46’sında ve VP grubunun %54,54’ünde grade 1 yan etki görülürken, VP grubundaki bir köpekte grade 2 yan etki görülmüştür.
IM köpeklerdeki grade 1 görülme insidansı VP köpeklerdekiyle karşılaştırıldığında, aradaki fark istatistiksel olarak anlamlıydı: VP köpeklerde grade 1 görülme insidansı istatistiksel olarak daha yüksekti.
4. Tartışma
Mast hücre tümörleri köpeklerde çok sık görülen tümörler olduğundan, uygulanan tedaviler iyi tolere edilmeli ve etkili olmalıdır. Bu nedenle, hedefe yönelik tedavilerin araştırılması, bu tedavilerin insanlarda etkili olduğu gibi köpekler üzerinde de faydalı olabilir. VP, köpek MHT’lerinin cerrahi rezeksiyonundan sonra uygulanan standart adjuvan kemoterapi rejimidir ve rezeke edilemeyen tümörlerin veya ilerlemiş hastalığın tedavisi için de tercih edilen bir tedavi yöntemidir [26,27]. Bu çalışmada, vinblastin köpek MHT tedavisi için yaygın olarak bildirilen dozlarda (2 mg/m2) uygulanmıştır [28,29]. Bildiğimiz kadarıyla, literatürde köpek MHT’si için uygulanan IM ve VP tedavilerinin karşılaştırılmasına dair başka bir rapor bulunmamaktadır, bu da bu çalışmanın önemini ortaya koymaktadır. Önceki çalışmalar IM’nin MHT’li bazı köpeklerde biyolojik aktiviteye sahip olabileceğini göstermiştir [13,30-32]; bu nedenle IM’nin MHT taşıyan köpeklerde VP taşıyanlara göre daha fazla faydalı olup olmadığını test etmeye karar verdik.
Bu çalışmaya dahil edilen köpekler USP Veteriner Hekimliği ve Hayvan Bilimleri Fakültesi Veteriner Eğitim Hastanesinden (HOVET) seçilmiştir. Mast hücre tümörü taşıyan 24 köpek önceden belirlenmiş dahil edilme kriterlerine göre iki gruba ayrılmıştır; böylece 13 hayvan IM protokolü ile tedavi edilirken 11 hayvana konvansiyonel VP tedavisi uygulanmıştır. İki köpek grubu, yapılan karşılaştırmalarda istatistiksel açıdan herhangi bir anlamlı fark bulunmamasından da anlaşılacağı üzere ırk, cinsiyet, yaş, tümör lokalizasyonu ve WHO evresi bakımından benzerlik göstermiştir. Tüm MHT örnekleri, tanıyı doğrulamak ve mevcut iki sisteme (Patnaik ve Kiupel) göre bir grade skoru atamak için histopatolojik analize tabi tutulmuştur. Ayrıca, tüm MHT’ler KIT paternlerini değerlendirmek üzere c-KIT için immünohistokimyasal analize tabi tutulmuştur. Yine, bu çalışmaya dahil edilen MHT vakalarının grade’leri ve KIT boyanma paternleri benzerdi. İstatistiksel karşılaştırmalar sayesinde, iki tedavi grubuna ayrılan MHT’li köpeklerin çok benzer koşullardan geldiğini doğrulamak mümkün olmuştur. İki tedavi arasında karşılaştırma yapıldığında bu durum son derece önemlidir.
IM veya VP protokolü uygulanan köpeklerin tümörleri başlangıçta dijital kaliperler ve/veya BT taraması kullanılarak ölçülmüş ve daha sonra belirlenen zamanlarda ölçülmüştür. Her iki köpek grubunda da VCOG değerlendirme protokolüne [23] göre PR, SD ve PD olan hayvanlar vardı; ancak sadece IM grubunda bir hayvan tam remisyon göstermiştir. Daha sonra objektif yanıt oranı (ORR), her bir tedavi grubunda tam yanıt (CR) olan köpeklerin yüzdesi ile kısmi yanıt (PR) olan köpeklerin yüzdesi toplanarak hesaplanmıştır. İlginç bir şekilde, IM grubunda VP grubuna kıyasla önemli ölçüde daha yüksek ORR elde edilmiştir.
Imatinib (STI-571/Gleevec®) bir 2-fenilamino-pirimidin bileşiğidir ve Abl tirozin kinaz enziminin ve BCR-ABL geninin seçici bir inhibitörüdür. Bu ilaç, Abl’nin tirozin kinaz alanının hücresel ATP reseptörünün spesifik bir komponenti olarak hareket eder ve bu proteinin ATP fosfat gruplarını ve fosforile tirozin kalıntılarını transfer etme yeteneğini engeller, bu da hücre proliferasyonu ve apoptoz için gerekli enerji sinyallerinin iletimini ortadan kaldırır. IM, 2002 yılında insanlarda inoperabl ve/veya metastatik malign gastrointestinal stromal tümörlerin (GIST) ve kronik miyeloid löseminin (CML) tedavisinde kullanılmak üzere FDA tarafından onaylanmıştır [33].
2003 yılında London ve arkadaşları köpeklerin mast hücre tümörlerinde c-kit’in 11 ve 12. ekzonlarında internal tandem duplikasyonları tespit etmişlerdir [34]. Veteriner hekimlikte imatinib mesilatın ilk kullanımı, Isotani ve arkadaşları tarafından 2006 yılında rapor edilmiştir [35], bir kedi mast hücre tümöründe ekson 8’de bir c-kit internal tandem duplikasyonu saptamışlardır.
Kobie ve arkadaşları, 2007 [36], ilk olarak IM’nin fare ksenograft modellerinde köpek mast hücre tümörlerine karşı etkili olduğunu göstermiş ve MHT’lerin imatinib tedavisi için potensiyel bir hedef olabileceğini belirtmişlerdir. Buna ek olarak, IM 21 köpekte MHT’ye karşı klinik etkinlik göstermiştir, ancak alınan yanıt c-kit’in 11. ekzonunda herhangi bir mutasyonun bulunup bulunmamasına bağlı olarak tahmin edilememiştir [13]. IM ayrıca c-kit c.1523A > T mutasyonunun neden olduğu konstitütif olarak aktive olmuş KIT’in inhibisyonu yoluyla bir köpek MHT vakasında klinik yanıt vermiştir [31]. IM ayrıca c-kit ekson 11 mutasyonlarına sahip köpek neoplastik mast hücrelerinde kaspaz bağımlı apoptozu indüklemiş [37] ve ekson 11’de c-kit mutasyonları taşıyan iki köpekte yanıtın etkili olduğunu göstermiştir [32]. IM, kit mutasyonu olan gastrointestinal c- stromal tümörlü bir köpeğin tedavisinde başarıyla kullanılmıştır [38].
Çalışmamızda, mast hücreli tümörlerin çoğunun DNA’sı çıkarılmış ve ekzon 10 ve 11 için PCR ile çoğaltılmıştır; dört hastada (ikisi IM ve ikisi VP grubundan), ekzon 11’in 3J splice bölgesi yakınında, kodon 576’daki 1759 pozisyonunda baz sübstitüsyonları ile karakterize mutasyonlar bulunmuştur (veriler sunulmamıştır). Bu çalışmada aktive edici internal tandem duplikasyon mutasyonlarına rastlanmamıştır. Mutasyonlar tedaviye yanıt ile bağlantılı görülmemiştir. Bu, IM [13] veya toceranib [39] ile ilgili yapılan daha önceki çalışmalarla paralellik göstermektedir.
MHT verilen köpeklerin iki grubundaki yan etkiler skorlanmış ve kaydedilmiştir. Her iki gruptaki köpeklerin çoğunda VCOG-CTCAE’ye [24] göre grade 1 yan etki görülmüş ve VP grubundan sadece bir hayvanda grade 2 yan etki görülmüştür. Her iki grupta grade 1 yan etki gösteren köpeklerin yüzdesi karşılaştırıldığında, VP grubundaki köpeklerin yüzdesinin önemli ölçüde daha yüksek olduğu görülmüştür. Bu çalışmada kullanılan dozlarda VP’nin yan etkileri hafif ve kabul edilebilir olarak değerlendirilmiş ve başka yerlerde de rapor edildiği gibi esas olarak hematolojik ve gastrointestinal toksisiteyi yansıtmıştır [27-29]. Bu çalışmada IM ile tedavi edilen köpeklerde çeşitli derecelerde gastrointestinal toksisite ve hafif şiddette hematolojik toksisite görülmüştür. Bu yan etkiler VP kemoterapisinin neden olduğu yan etkilerden daha düşüktü. Genel olarak, IM hafif (grade 1) ila orta (grade 2) şiddette, geçici ve tıbbi olarak yönetilebilirdir [31], bu da köpek MHT’sine göre daha güvenli bir seçenek olduğunu düşündürmektedir. VP tedavisi genellikle iyi tolere edilmektedir, ancak istenmeyen toksisiteden kaçınmak için doz yoğunluğu köpek MHT tedavisinde dikkatle ayarlanmalıdır [26]. Beklenildiği gibi, IM ile hedefe yönelik uygulanan tedavide ciddi sayılabilecek yan etkiler daha az görülmüştür.
Çalışmaya dahil edilen köpek sayısının nispeten düşük olması çalışmayı kısıtlayıcı bir faktör olarak değerlendirilebilir. Bununla birlikte, ırklar, cinsiyetler, yaşlar, DSÖ evrelemesi veya grade’lemesi ve KIT paternleri arasında herhangi bir istatistiksel fark bulunmayan IM veya VP ile tedavi edilen homojen köpek grupları, bu kısıtlamayı en aza indirebilir ve tedaviler ile yan etkiler arasındaki istatistiksel farklılıklar konusunda bize güven verebilir.
Diğer bir kısıtlama da IM ve VP gruplarındaki tedavi süresiyle ilgilidir. Köpekler 8 hafta boyunca IM ile tedavi edilmesine rağmen, VP protokolü 12 hafta süreyle uygulanmıştır. Tedavi süresindeki bu farklılıklara rağmen, IM tedavisi sonuç açısından 8 hafta içinde 12 hafta süren VP’den daha başarılı olmuştur ve IM grubundaki hayvanların ORR’si daha iyi çıkmıştır. Bu, IM kullanımının getirdiği bir diğer avantajı teşkil ediyor olabilir.
Çalışmaların çoğunda gerçekleştirilmiş olmasına rağmen, MHT’lerin KIT sekanslamasını bu rapora dahil etmedik. Willmann ve arkadaşları tarafından belirtildiği gibi, 2021 [40], köpek MHT’lerinde bir dizi KIT mutasyonu tespit edilmiş olmasına rağmen, KIT sekanslama yöntemi veteriner onkoloji rutininde henüz benimsenmemiştir ve yakın zamanda KIT mutasyonlarının tirozin kinaz inhibitörlerine verilen yanıtla ilişkili olmadığını ve hatta vahşi tip KIT MHT’si olan köpeklere kıyasla daha kötü sonuçlar doğurabileceğini gösteren tartışmalı veriler sunulmuştur. Çalışmamızda yalnızca 10. ve 11. ekzonların sekanslama sonuçları mevcut olduğundan (veriler sunulmamıştır), bu, köpek MHT’lerini konu alan ilerideki çalışmalarda kuşkusuz kaçınılması gereken bir sınırlamadır.
5. Sonuç
Sonuç olarak, bu çalışmanın amacı mast hücreli tümör vakalarında standart VP polikemoterapi ve IM ile hedefe yönelik tedaviyi karşılaştırmak ve tedaviye alınan yanıt ile histolojik grade ve KIT paterni gibi MHT progresyonunu etkilediği bilinen faktörler arasındaki ilişkiyi araştırmaktır. MHT’yi tedavi etmek için toceranib (Palladia®) ve masitinib (Masivet®) dahil olmak üzere diğer tirozin-kinaz inhibitörleri mevcut olsa da, IM tümörü olan insanlarda kullanılan ve MHT’li köpekleri tedavi etmek için de kullanılabilecek güncel bir tedavidir. Veteriner onkoloji alanındaki herhangi bir klinik çalışmanın amacı, mevcut hastalıkların tedavisi için etki ve güvenilirliğe odaklanan yeni tedaviler bulmaktır. Çalışmamız, IM’nin geleneksel kemoterapiye kıyasla bazı avantajlar sunduğunu ve düşük gradeli MHT’li köpeklerin faydası ve konforu için kullanılabileceğini göstermiştir.
Katkıda bulunan yazarlar: Orijinal projenin araştırma ve yazım hazırlıkları, T.R.M.; metodoloji, T.R.M., T.A.C.C., P.A.A., P.E.B., H.F., S.R.M., M.L.Z.D. ve A.C.B.C.F.P., J.M.M.; inceleme ve düzenleme,
G.F.d.Q., M.L.Z.D., J.M.M.; görsellik, denetim ve finansmanın sağlanması, J.M.M. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir.
Finansman: Bu çalışma, FAPESP-Fundação de Amparo a Pesquisa do Estado de São Paulo (hibe numarası 2010/15093-6) tarafından desteklenmiştir ve yazarlar teşekkürlerini sunmaktadır.
Etik Kurul Onay Beyanı: Bu çalışma Sao Paulo Üniversitesi, FMVZ-USP Veterinerlik ve Hayvan Bilimleri Fakültesi Etik Kurulu (CEUA) tarafından onaylanmıştır (işlem numarası 2092/2010).
Bilgilendirilmiş Onam Beyanı: Bu çalışmaya dahil edilen köpeklerin tüm sahipleri bilgilendirilmiş onam formlarını imzalamıştır.
Veri Erişim Beyanı: Veriler talep üzerine temin edilebilir.
Beyan: Bu çalışma Thais Rodrigues Macedo tarafından Julia Maria Matera’nın danışmanlığında Sao Paulo, SP, Brezilya’da bulunan São Paulo Üniversitesi Veterinerlik ve Hayvan Bilimleri Fakültesi Veteriner Cerrahi Kliniği Yüksek Lisans Programı’na sunulan doktora tezinin bir parçasıdır.
Çıkar Çatışması Beyanı: Yazarlar herhangi bir çıkar çatışması beyan etmemiştir.
- Macy, D.W. Canine mast cell tumors. Vet. Clin. N. Am. Small Anim. Pract. 1985, 15, 783–803. [CrossRef]
- Kiupel, M.; Camus, M. Diagnosis and prognosis of canine cutaneous mast cell tumors. Vet. Clin. N. Am. Small Anim. Pract. 2019,49, 819–836. [CrossRef] [PubMed]
- Willmann, M.; Hadzijusufovic, E.; Hermine, O.; Dacasto, M.; Marconato, L.; Bauer, K.; Peter, B.; Gamperl, S.; Eisenwort, G.; Jensen-Jarolim,E.; et al. Comparative oncology: The paradigmatic example of canine and human mast cell neoplasms. Vet. Comp. Oncol. 2019, 17, 1–10.
[CrossRef] [PubMed]
- Preziosi, R.; Morini, M.; Sarli, G. Expression of the KIT protein (CD117) in primary cutaneous mast cell tumors of the dog. J. Vet. Diagn.Investig. 2004, 16, 554–561. [CrossRef]
- Zemke, D.; Yamini, B.; Yuzbasiyan-Gurkan, V. Mutations in the juxtamembrane domain of c-KIT are associated with higher grade mast celltumors in dogs. Vet. Pathol. 2002, 39, 529–535. [CrossRef]
- Blackwood, L.; Murphy, S.; Buracco, P.; De Vos, J.P.; De Fornel-Thibaud, P.; Hirschberger, J.; Kessler, M.; Pastor, J.; Ponce, F.; Savary-Bataille, K.; et al. European consensus document on mast cell tumours in dogs and cats. Vet. Comp. Oncol. 2012, 10, e1–e29. [CrossRef]
- Patnaik, A.K.; Ehler, W.J.; MacEwen, E.G. Canine cutaneous mast cell tumor: Morphologic grading and survival time in 83 dogs. Vet. Pathol. 1984, 21, 469–474. [CrossRef]
- Kiupel, M.; Webster, J.D.; Bailey, K.L.; Best, S.; DeLay, J.; Detrisac, C.J.; Fitzgerald, S.D.; Gamble, D.; Ginn, P.E.; Goldschmidt, M.H.; et al. Proposal of a 2-tier histologic grading system for canine cutaneous mast cell tumors to more accurately predict biological behavior. Vet. Pathol. 2011, 48, 147–155. [CrossRef]
- Sledge, D.G.; Webster, J.; Kiupel, M. Canine cutaneous mast cell tumors: A combined clinical and pathologic approach to diagnosis, prognosis, and treatment selection. Vet. J. 2016, 215, 43–54. [CrossRef]
- Webster, J.D.; Yuzbasiyan-Gurkan, V.; Kaneene, J.B.; Miller, R.; Resau, J.H.; Kiupel, M. The role of c-KIT in tumorigenesis: Evaluation in canine cutaneous mast cell tumors. Neoplasia 2006, 8, 104–111. [CrossRef]
- London, C.C.; Thamm, D.H. Mast Cell Tumors. In Small Animal Clinical Oncology, 5th ed.; Withrow, S.J., Vail, D.M., Page, R.L., Eds.; Elsevier: St. Louis, MO, USA, 2013; p. 342.
- Dubreuil, P.; Letard, S.; Ciufolini, M.; Gros, L.; Martine, H.; Casteran, N.; Borge, L.; Hajem, B.; Lermet, A.; Sippl, W.; et al. Masitinib (AB1010), a potent and selective tyrosine kinase inhibitor targeting KIT. PLoS ONE 2009, 4, e7258. [CrossRef] [PubMed]
- Isotani, M.; Ishida, N.; Tominaga, M.; Tamura, K.; Yagihara, H.; Ochi, S.; Kato, R.; Kobayashi, T.; Fujita, M.; Fujino, Y.; et al. Effect of tyrosine kinase inhibition by imatinib mesylate on mast cell tumors in dogs. J. Vet. Intern. Med. 2008, 22, 985–988. [CrossRef] [PubMed]
- Séguin, B.; Besancon, M.F.; Mccallan, J.L.; Dewe, L.L.; Tenwolde, M.C.; Wong, E.K.; Kent, M.S. Recurrence rate, clinical outcome, and cellular proliferation indices as prognostic indicators after incomplete surgical excision of cutaneous grade II mast cell tumors: 28 dogs (1994–2002). J. Vet. Intern. Med. 2006, 20, 933–940. [PubMed]
- Misdorp, W. Mast cell and canine mast cell tumours: A review. Vet. Q. 2004, 26, 156–169. [CrossRef] [PubMed]
- Grant, I.A.; Rodriguez, C.O.; Kent, M.S.; Sfilgoi, G.; Gordon, I.; Davis, G.; Lord, L.; London, C.A. A phase II clinical trial of vinorelbine in dogswith cutaneous mast cell tumors. J. Vet. Intern. Med. 2008, 22, 388–393. [CrossRef]
- Thamm, D.H.; Turek, M.M.; Vail, D.M. Outcome and prognostic factors following adjuvant prednisone/vinblastine chemotherapy for high-riskcanine mast cell tumour: 61 cases. J. Vet. Med. Sci. 2006, 68, 581–587. [CrossRef]
- Gschwind, A.; Fischer, O.M.; Ullrich, A. The discovery of receptor tyrosine kinases: Targets for cancer therapy. Nat. Rev. Cancer2004, 4, 361–370. [CrossRef]
- London, C.A. Tyrosine kinase inhibitors in veterinary medicine. Top Companion Anim. Med. 2009, 24, 106–112. [CrossRef]
- Thompson, J.J.; Morrison, J.A.; Pearl, D.L.; Boston, S.E.; Wood, G.A.; Foster, R.A.; Coomber, B.L. Receptor tyrosine kinase expressionprofiles in canine cutaneous and subcutaneous mast cell tumors. Vet. Pathol. 2016, 53, 545–558. [CrossRef]
- Costa Casagrande, T.A.; de Oliveira Barros, L.M.; Fukumasu, H.; Cogliati, B.; Chaible, L.M.; Dagli, M.L.; Matera, J.M. The value of molecular expression of KIT and KIT ligand analysed using real-time polymerase chain reaction and immunohistochemistry as a prognostic indicator forcanine cutaneous mast cell tumours. Vet. Comp. Oncol. 2015, 13, 1–10. [CrossRef]
- Kiupel, M.; Webster, J.D.; Kaneene, J.B.; Miller, R.; Yuzbasiyan-Gurkan, V. The use of KIT and tryptase expression patterns as prognostictools for canine cutaneous mast cell tumors. Vet. Pathol. 2004, 41, 371–377. [CrossRef] [PubMed]
- Nguyen, S.M.; Thamm, D.H.; Vail, D.M.; London, C.A. Response evaluation criteria for solid tumours in dogs (v1.0): A Veterinary CooperativeOncology Group (VCOG) consensus document. Vet. Comp. Oncol. 2015, 13, 176–183. [CrossRef] [PubMed]
- Veterinarycooperativeoncologygroup-commonterminologycriteriaforadverseevents(VCOG-CTCAE)followingchemotherapy or biologicalantineoplastic therapy in dogs and cats v1.1. Vet. Comp. Oncol. 2016, 14, 417–446. [CrossRef]
- Owen,L.N.;WorldHealthOrganization;VeterinaryPublicHealthUnit&WHOCollaboratingCenterforComparativeOncology.TNM Classification of Tumours in Domestic Animals; Owen, L.N., Ed.; World Health Organization: Geneva, Switzerland, 1980.
- Serra Varela, J.C.; Pecceu, E.; Handel, I.; Lawrence, J. Tolerability of a rapid-escalation vinblastine-prednisolone protocol in dogs with mastcell tumours. Vet. Med. Sci. 2016, 2, 266–280. [CrossRef] [PubMed]
- Rassnick, K.M.; Bailey, D.B.; Flory, A.B.; Balkman, C.E.; Kiselow, M.A.; Intile, J.L.; Autio, K. Efficacy of vinblastine for treatment of canine mastcell tumors. J. Vet. Intern. Med. 2008, 22, 1390–1396. [CrossRef]
- Davies, D.R.; Wyatt, K.M.; Jardine, J.E.; Robertson, I.D.; Irwin, P.J. Vinblastine and prednisolone as adjunctive therapy for canine cutaneousmast cell tumors. J. Am. Anim. Hosp. Assoc. 2004, 40, 124–130. [CrossRef]
- Thamm, D.H.; Mauldin, E.A.; Vail, D.M. Prednisone and vinblastine chemotherapy for canine mast cell tumor-41 cases (1992–1997).J. Vet. Intern. Med. 1999, 13, 491–497.
- Webster, J.D.; Yuzbasiyan-Gurkan, V.; Kaneene, J.B.; Miller, R.; Resau, J.H.; Kiupel, M. Evaluation of prognostic markers for canine mast celltumors treated with vinblastine and prednisone. BMC Vet. Res. 2008, 4, 32. [CrossRef]
- Yamada, O.; Kobayashi, M.; Sugisaki, O.; Ishii, N.; Ito, K.; Kuroki, S.; Sasaki, Y.; Isotani, M.; Ono, K.; Washizu, T.; et al. Imatinib elicited afavorable response in a dog with a mast cell tumor carrying a c-kit c.1523A>T mutation via suppression of constitutive KIT activation. Vet.
Immunol. Immunopathol. 2011, 142, 101–106. [CrossRef]
- Nakano, Y.; Kobayashi, T.; Oshima, F.; Fukazawa, E.; Yamagami, T.; Shiraishi, Y.; Takanosu, M. Imatinib responsiveness in canine mast celltumors carrying novel mutations of c-KIT exon 11. J. Vet. Med. Sci. 2014, 76, 545–548. [CrossRef]
- Radford, I.R. Imatinib. Novartis. Curr. Opin. Investig. Drugs 2002, 3, 492–499. [PubMed]
34. 35.
36. 37. 38. 39.
40.
Downing, S.; Chien, M.B.; Kass, P.H.; Moore, P.E.; London, C.A. Prevalence and importance of internal tandem duplications in exons 11
and 12 of c-kit in mast cell tumors of dogs. Am. J. Vet. Res. 2002, 63, 1718–1723. [CrossRef] [PubMed]
Isotani, M.; Tamura, K.; Yagihara, H.; Hikosaka, M.; Ono, K.; Washizu, T.; Bonkobara, M. Identification of a c-kit exon 8 internal tandemduplication in a feline mast cell tumor case and its favorable response to the tyrosine kinase inhibitor imatinib mesylate. Vet. Immunol. Immunopathol. 2006, 114, 168–172. [CrossRef] [PubMed]
Kobie, K.; Kawabata, M.; Hioki, K.; Tanaka, A.; Matsuda, H.; Mori, T.; Maruo, K. The tyrosine kinase inhibitor imatinib [STI571] induces regression of xenografted canine mast cell tumors in SCID mice. Res. Vet. Sci. 2007, 82, 239–241. [CrossRef] [PubMed]Rossi, G.; Bertani, C.; Mari, S.; Marini, C.; Renzoni, G.; Ogilvie, G.; Magi, G.E. Ex vivo evaluation of imatinib mesylate for induction of cell death on canine neoplastic mast cells with mutations in c-Kit exon 11 via apoptosis. Vet. Res. Commun. 2013, 37, 101–108. [CrossRef]
Irie, M.; Takeuchi, Y.; Ohtake, Y.; Suzuki, H.; Nagata, N.; Miyoshi, T.; Kagawa, Y.; Yamagami, T. Imatinib mesylate treatment in a dog with gastrointestinal stromal tumors with a c-kit mutation. J. Vet. Med. Sci. 2015, 77, 1535–1539. [CrossRef]Weishaar, K.M.; Ehrhart, E.J.; Avery, A.C.; Charles, J.B.; Elmslie, R.E.; Vail, D.M.; London, C.A.; Clifford, C.A.; Eickhoff, J.C.; Thamm, D.H. c-Kit Mutation and Localization Status as Response Predictors in Mast Cell Tumors in Dogs Treated with Prednisone and Toceranib or Vinblastine. J. Vet. Intern. Med. 2018, 32, 394–405. [CrossRef]
Willmann, M.; Yuzbasiyan-Gurkan, V.; Marconato, L.; Dacasto, M.; Hadzijusufovic, E.; Hermine, O.; Sadovnik, I.; Gamperl, S.; Schneeweiss- Gleixner, M.; Gleixner, K.V.; et al. Proposed Diagnostic Criteria and Classification of Canine Mast Cell Neoplasms: A Consensus Proposal. Front. Vet. Sci. 2021, 10, 755258. [CrossRef]