Anahtar kelimeler: Köpek; lenfoma; T-hücresi; kemoterapi; lomustin; köpek
Kısaltmalar BCL, B hücreli lenfoma; CBC, Tam kan sayımı; CHOP, Siklofosfamid, doksorubisin, vinkristin, prednizolon; HGL, Yüksek gradeli lenfoma; HGTCL, Yüksek gradeli T hücreli lenfoma; TCL, T hücreli lenfoma; TZL, T zonlu lenfoma
Aust Vet J 2019 doi: 10.1111/avj.12847
GirişKöpek lenfoması, prognostik değeri olan ve çeşitli alt tipleri bulunan heterojen bir hastalıktır1. Büyük çoğunluğu ya B- hücreli (BCL) ya da T-hücreli lenfomalardan oluşur (TCL). Bu geniş kapsamlı kategoriler içinde bile farklı presentasyon, klinik progresyon ve prognozlara sahip bir hastalık spektrumu söz konusudur1.
Köpek TCL’sinin prognozunun BCL1-4’e göre daha kötü olduğu düşünülmektedir, ancak TCL oldukça değişken bir yapıya sahiptir. T zon lenfoma (TZL) gibi “indolent” veya yüksek gradeli T hücreli lenfoma (HGTCL) gibi agresif olarak kabul edilebilir.5,6 TZL’nin prognozu çok daha iyidir ve indolent nodal bir lenfoma türüdür.5-9 Bununla karşılaştırıldığında, köpek HGTCL oldukça agresif bir lenfoma spektrumunu temsil etmektedir.2,3,8,10-13 Valli ve arkadaşları5,6 multisentrik TCL’nin en yaygın alt tiplerinin periferik T hücreli lenfoma – başka türlü tanımlanmamış,
lenfoblastik lenfoma ve T bölgesi lenfoması/lösemisi olduğunu tespit etmiştir. Bazı TCL alt tipleri spesifik immünotipler ve prognozlar ile ilişkilendirilmiştir. Boxer gibi bazı ırkların TCL’ye yatkın olduğu bilinmektedir, bu da daha fazla karmaşıklığa sebep olabilir, çünkü TCL’nin tedavi sonucunu etkileyebilecek ırka özgü fenotipleri de söz konusu olabilir.11,12,14,15
Dolayısıyla pratikte TCL genel olarak ya indolent ya da HGTCL olarak kabul edilir. İndolent lenfoma bazen tedavi olmaksızın bilfiil kontrol edilir veya kortikosteroidlerle birlikte klorambusil gibi kronik, oral bazlı alkilleyici ajanlarla tedavi edilir. Ancak HGTCL, agresif doğası nedeniyle tipik olarak çok ajanlı kemoterapi ile tedavi edilmektedir ve bu nedenle indolent ve HGTCL’nin klinik anlamda ayırt edilmesi oldukça önemlidir.2,3,14,16-20 Köpek HGTCL’si için standart kemoterapi henüz belirlenmemiştir. Tarihsel süreçte, protokoller immünofenotipe bakılmaksızın seçilmiş ve çoğunlukla siklofosfamid, doksorubisin, vinkristin ve prednizolondan (CHOP) ibaret olmuştur. CHOP ile tedavi edilen HGTCL’li köpeklerde sonuçların BCL’ye kıyasla daha kötü olduğu göz önüne alınarak, bazı çalışmalarda alternatif tedavi stratejileri değerlendirilmiştir. Bu genellikle standart çoklu ilaç protokollerine alkilleyici ajanların eklenmesiyle yapılmıştır.14,16,17,19 Bu yöntemin altında yatan mantık genelde neoplastik hücrelerin bu ajanlara karşı direnç kazanmasının daha zor olması ve alkilleyiciler arasında kendiliğinden oluşan çapraz direncin daha az olmasıdır.
Bu çalışmanın amacı, köpek HGTCL için ilk basamak tedavi olarak siklofosfamid veya lomustin içeren çok ajanlı kemoterapi alan hastalarda progresyonsuz sağkalım (PFS) ve genel sağkalım süresini (OS) retrospektif olarak değerlendirmek ve prospektif bir çalışma için herhangi bir gereklilik olup olmadığını belirlemektir. İkinci amaç, iki tedavi grubu arasında toksisite açısından herhangi bir farklılık olup olmadığını tespit etmektir.
Materyal ve Metod
*İlgili yazar.
Willows Veteriner Tedavi Merkezi, Highlands Road, Solihull, B90 4NH,
İngiltere; jameselliott44@hotmail.com
Güncel adres: J Elliott’ın güncel adresi: Kuzey Carolina Eyalet Üniversitesi, Radyasyon Onkolojisi Bölümü, William Moore Drive, Raleigh, Kuzey Carolina, 27606, ABD
Willows Veteriner Tedavi Merkezinin tıbbi kayıtları, elektronik veri tabanı taraması ve elektronik olarak tutulan vaka kayıtları aracılığıyla 2011-2017 yılları arasında HGTCL teşhisi konan köpekler
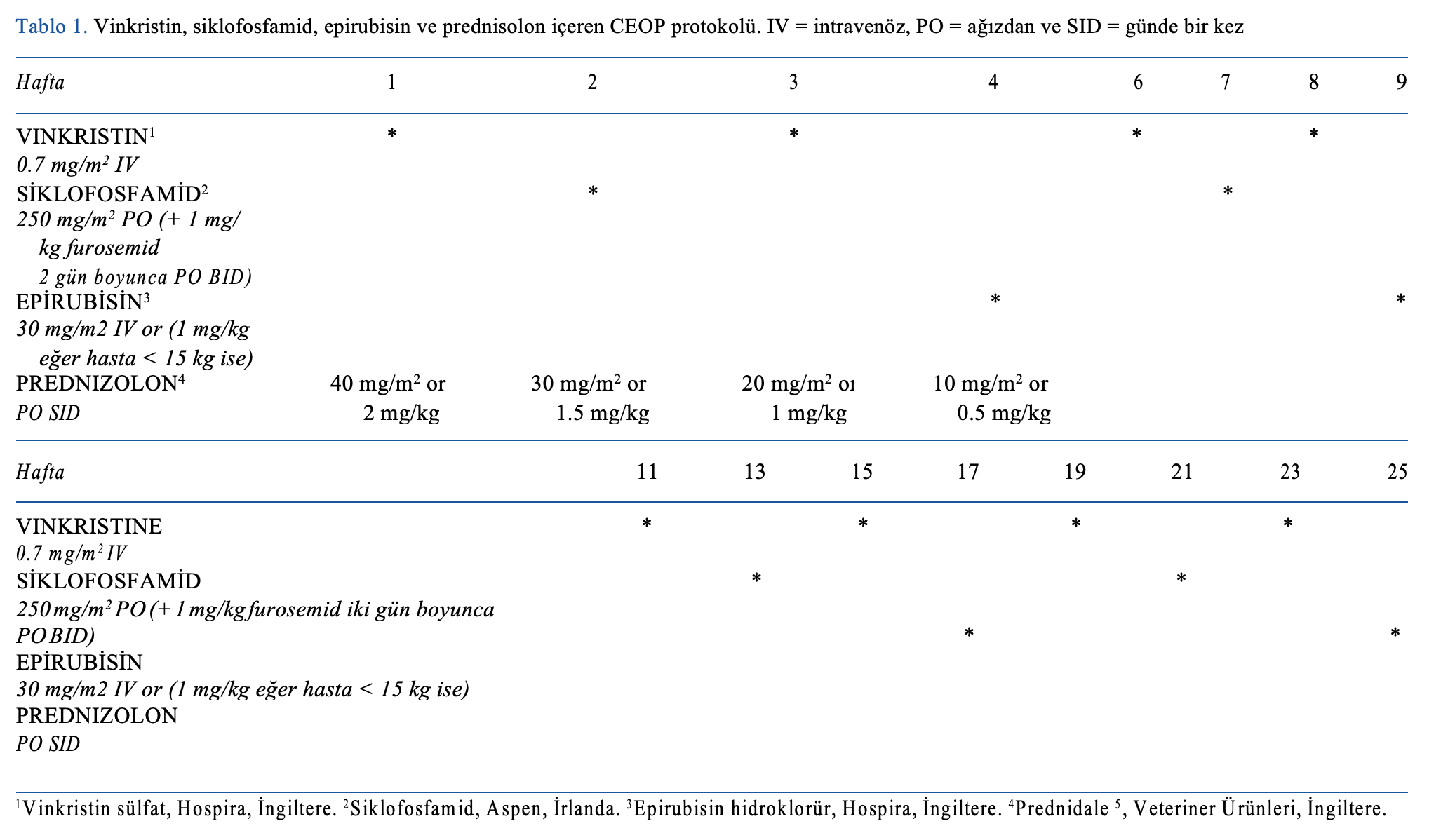 araştırılmıştır. Belirtiler, lenfoma teşhisi ve kan tahlili, evreleme bilgileri, kemoterapi protokolü, tedaviye alınan yanıt, uygulanan kurtarma protokolleri, yanıt alma süresi ve sağkalım bilgileri gibi çeşitli veriler toplanmış ve analiz edilmiştir. İlk basamak tedavi olarak kullanılan protokol 25 haftalık, çok ajanlı kemoterapi protokolü (“CEOP”: Tablo 1) veya LEOP’ta siklofosfamid yerine
araştırılmıştır. Belirtiler, lenfoma teşhisi ve kan tahlili, evreleme bilgileri, kemoterapi protokolü, tedaviye alınan yanıt, uygulanan kurtarma protokolleri, yanıt alma süresi ve sağkalım bilgileri gibi çeşitli veriler toplanmış ve analiz edilmiştir. İlk basamak tedavi olarak kullanılan protokol 25 haftalık, çok ajanlı kemoterapi protokolü (“CEOP”: Tablo 1) veya LEOP’ta siklofosfamid yerine
lomustin kullanılması dışında ilaçlar, dozlar ve kemoterapi tedavi sayısı açısından aynı olan 27 haftalık bir protokol (“LEOP”: Tablo 2) olmalıdır. Her lomustin tedavisinden sonra iki haftalık bir ara verilmiş ve bu da protokolün biraz daha uzamasına neden olmuştur. Her iki protokolde de herhangi bir bakım aşaması yoktu. CEOP, 2014’ten önce kullanılan standart protokoldü ancak daha sonra LEOP olarak kurumsal düzeyde değişiklik yapıldı. CEOP veya LEOP tamamlandıktan sonra nükseden hastalara aynı protokole yeniden başlamaları tavsiye edilmiştir. Daha sonra bu ilaçlara direnç gösteren hastalar, tedavi eden veteriner hekimin öngördüğü şekilde kurtarma kemoterapisi protokolleri alabilmiştir.
Vakalar, immünohistokimya veya akış sitometrisine göre T-hücresi fenotipinin doğrulanmasıyla birlikte, kurul sertifikalı veteriner patolog tarafından gerçekleştirilen histolojik veya sitolojik olarak yüksek gradeli lenfoma tanısı almışlarsa çalışmaya uygun kabul edilmiştir. HGTCL’nin belirli alt tiplerine (Enteropati ilişkili T-hücreli lenfoma, kutanöz epitelyotropik T-hücreli lenfoma, primer hepatik lenfoma ve hepatosplenik lenfoma) ve indolent TCL’ye sahip köpekler özellikle hariç tutulmuştur. Ölçülebilir hastalığı olmayan vakalar değerlendirmeye alınmamıştır.
Lenfoma nüksü tanısı klinik muayene, görüntüleme bulguları ve mümkünse sitoloji/histopatolojiye dayanılarak konuldu
Gerekli durumlarda, evreleme toraks radyografisi (dorsoventral [DV] ve her iki lateral görünüm veya sağ lateral ve DV görünümler) ve batın ultrasonu veya torako-abdominal bilgisayarlı tomografi (BT) taraması ile yapıldı. Kemik iliği aspirasyonu veya biyopsisi düzenli aralıklarla yapılmamıştır. Alt evre (a veya b) yalnızca tıbbi kayıtlardan tespit edilmiştir. Köpek lenfoması için klinik evreleme Dünya Sağlık Örgütü (DSÖ) kriterlerine göre yapıldı.6 Klinik evrelemenin yapılmamış olması çalışmaya dahil etmeme nedeni değildi.
Tedaviye alınan yanıtın değerlendirilmesi temel olarak fizik muayene, klinik bulgular, hematoloji, biyokimya ve uygunsa elle muayene edilebilen tümör volümü ile yapılmıştır. Görüntüleme verileri mevcutsa veya gerekli görüldüğünde dahil edilmiştir. Alınan yanıtlar, lenfoma için VCOG tarafından belirlenen mutabakata göre tam yanıt (CR), kısmi yanıt (PR) veya stabil hastalık (SD) şeklinde sınıflandırılmıştır.29
CEOP veya LEOP’a başlamadan önce tam kan sayımı (CBC) ve serum biyokimya analizi yapılmıştır. Hiperkalsemi iyonize kalsiyum analiziyle doğrulanmıştır. İdrar yolu veya böbrek hastalığına dair herhangi bir kanıt varsa ilk muayenede idrar tahlili yapılmış, aksi takdirde klinisyenin takdirine bırakılmıştır. Her kemoterapi tedavisinden hemen önce CBC yapılmış ve her lomustin tedavisinden önce tam kapsamlı biyokimya tetkiki yapılması önerilmiştir, ancak bazı vakalarda sadece ALT ve ALP değerlendirilmiştir.
Lomustin ve siklofosfamid tüm hastalara oral yoldan verilmiştir. Hedeflenen doza mümkün olduğunca yaklaşmak için gerektiğinde farmasötik olarak yeniden formüle edilmiş lomustin veya siklofosfamid kapsülleri kullanılmıştır (Nova Laboratories, Leicestershire, İngiltere). Hedeflenen doz tablet veya kapsül ebatlarında ise, doz yukarı veya aşağı yönlü yuvarlanarak hem siklofosfamid hem de lomustin için en yakın 5 mg’a ayarlanmıştır.
Siklofosfamid verildiğinde, eşzamanlı olarak 1 mg/kg ağızdan (PO), 2 ardışık gün boyunca, günde iki kez, siklofosfamid ile aynı zamanda başlamak üzere furosemid verilmiştir.
Bunun amacı siklofosfamide bağlı sistit riskini düşürmekti.
LEOP alan hastalar için her lomustin tedavisinde her hastaya önerilen dozda Denamarin® (Protexin, İngiltere) verilmiştir. Bunun amacı lomustine bağlı hepatotoksisiteyi önlemekti. Denamarin® tedavisine lomustin ile aynı anda başlanmış ve 7 gün boyunca devam edilmiştir. LEOP grubundaki hastalar için ilk lomustin uygulamasından 7 gün sonra, nötrofil sayısının en düşük olduğu varsayılan tarihte CBC yapılması önerilmiştir. Doz ayarlaması gerekiyorsa, “yeni” en düşük nötrofil değerini belirlemek için daha düşük doz uygulamasından 7 gün sonra ilave CBC yapılmıştır.
Hastayı tedavi eden veteriner hekim tarafından klinik olarak gerekli görülmesi halinde eş zamanlı anti-emetik tedavi (Maropitant; Cerenia®, Zoetis, İngiltere) önerilmiştir. Bu ilaç, kemoterapi sırasında IV veya PO olarak ve gerektiğinde takip eden 4 gün boyunca PO olarak verilmiştir.
Yan etkiler tıbbi kayıtlar ve kan tahlilleri değerlendirilerek VCOG kriterlerine göre derecelendirilmiştir.30 Vakaların çoğunda bu derecelendirme veri analizi sırasında retrospektif olarak yapılmıştır. Nötropeni veya gastrointestinal toksisite gibi toksisiteler için hastayı tedavi eden klinisyene ve hasta sahibi ile ilgili faktörlere göre doz azaltımı yapılmıştır. Bu, durumun ciddiyetine bağlı olarak %10-20 oranında olmuştur. Nötropeni nedeniyle meydana gelen doz gecikmeleri planlanan ilaç tedavisine, hasta ve hasta sahibine bağlı faktörlere ve mutlak nötrofil sayısına bağlıydı. Bu süre, durumun ciddiyetine bağlı olarak 3 ila 7 gün arasındaydı.
Kemoterapinin devam edip edemeyeceğini belirlemek için kullanılan kemoterapi öncesi mutlak nötrofil sayısı (ANC) ≥2 x 109/l’dir, ancak bu değer hekim, hasta ve hasta sahibi faktörlerine ve uygulanan ilaca bağlı olarak biraz değişiklik göstermektedir.
Progresyonsuz sağkalım (PFS) kemoterapi başlangıcından lenfoma progresyonunun belgelerle kanıtlanmasına kadar geçen süre olarak hesaplanmıştır. Genel sağkalım (OS), lenfoma için ilk basamak tedaviye başlanmasından lenfoma nedeniyle ölüm tarihine kadar geçen süre şeklinde hesaplanmıştır.
İstatistikler Prism Version 6 (Windows için), GraphPad Software Inc., La Jolla, California, ABD kullanılarak hesaplanmıştır. Kritik olasılık p < 0.05 olarak tanımlanmıştır. Veri analizi sırasında ilk remisyonda olan hastalar PFS analizinde sansürlenmiştir. Veri analizi sırasında hala hayatta olan veya lenfoma dışındaki nedenlerden dolayı öldüğü kesinleşen hastalar sansürlenmiştir. Temel sağkalım dağılımları Kaplan-Meier yöntemi ile incelenmiş ve karşılaştırmalar log-rank (Mantel-Cox) ve Gehan-Breslow- Wilcoxon testleri ile değerlendirilmiştir. Hastanın tanı anındaki kilosu, mediastinal kitle olup olmaması, hiperkalsemi olup olmaması, evre, alt evre ve boxer cinsi olup olmaması gibi çeşitli parametrelerin sağkalımla ilişkisi değerlendirilmiştir.
Sonuçlar
Hastalara dair bilgiler
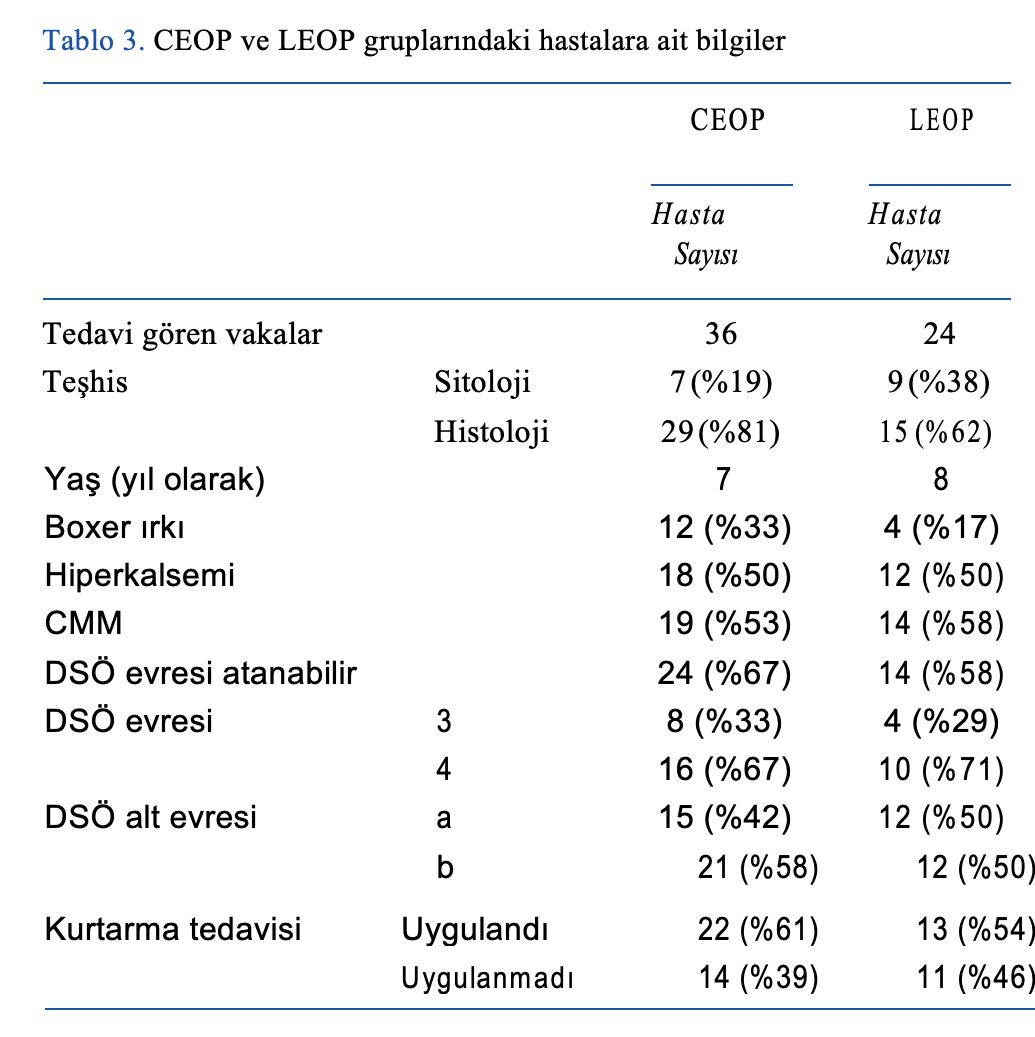
Altmış HGTCL hastası çalışmaya dahil edilmiştir. 36 hastaya CEOP ve 24 hastaya LEOP uygulanmıştır. Tüm CEOP ve LEOP hastaları sırasıyla protokolün en az ilk 4 veya 5 haftasını tamamlamıştır.
| Tüm hastaların ortalama yaşı 7 idi. Otuz kısırlaştırılmış erkek, üç kısırlaştırılmamış erkek, yirmi altı kısırlaştırılmış dişi ve bir kısırlaştırılmamış dişi vardı. Diğer hasta bilgileri Tablo 3’te verilmiştir. Kontenjans tablo analizi, CEOP ve LEOP grupları arasında şu değişkenler açısından herhangi bir fark olmadığını ortaya koymuştur: hiperkalsemi (p = 0.994), kraniyal mediastinal kitle (p = 0.793), 3. evre (p = 0.728), 4. evre (p = 0.437), alt evre ‘b’ (p = 0.295) ve boxer ırkı (p = 0.092). CEOP ve LEOP grupları arasında tanı anındaki vücut ağırlığı açısından herhangi bir fark bulunmamıştır (CEOP için ortalama 30 kg ve LEOP için 27,5 kg; p = 0,909).
|
Boxer (n = 16), Melez (n = 14), Cocker Spaniel (n = 6), Labrador (n = 5), Bernese Dağ Köpeği (n = 3), Golden Retriever (n = 3) , Weimeraner (n = 2), Fransız Mastifi (n = 2) ve Border Collie, Bulldog, Alman Çoban Köpeği, Dev Schnauzer, Gordon Setter, Tazı, Jack Russell Terrier, Lurcher ve Rhodesian Ridgeback (hepsi n = 1) gibi çeşitli ırklar yer almıştır.
Tanı sırasında görüntüleme yapılan hastalar Tablo 4’te verilmiştir.
DSÖ klinik evresi tayin edilebilen otuz sekiz hastanın %68’i (n = 26) 4. evre, geri kalanı ise 3. evre idi. On altı CEOP vakasının 10’unda (%63) ve 10 LEOP vakasının 7’sinde (%70) bu durum sitolojik olarak (karaciğer veya dalak aspirasyonu yoluyla) doğrulanmıştır. Geri kalanlarda, 4. evre görüntüleme sonuçlarına göre karaciğer ve/veya dalakta lenfoma tutulumu olasılığına göre belirlenmiştir. CEOP grubunun n = 21’inde (%58) ve LEOP grubunun n = 12’sinde (%50) ‘b’ alt evresi tespit edilmiştir.
Verilen ortalama siklofosfamid dozu 250 mg/m2 (doz aralığı: 248-260 mg/m2) idi. Verilen ortalama lomustin dozu 70 mg/m2 (doz aralığı: 66-71 mg/m2) idi.
Tablo 4. CEOP ve LEOP protokollerini alan yüksek gradeli, T-hücreli lenfomalı hastalarda tanı sırasında yapılan görüntüleme
Nüks sırasında CEOP grubunda 22 hastaya (%61) ve LEOP grubunda 13 hastaya (%54) çeşitli kurtarma kemoterapileri uygulanmıştır (Tablo 5).
Kemoterapi toksisitesi
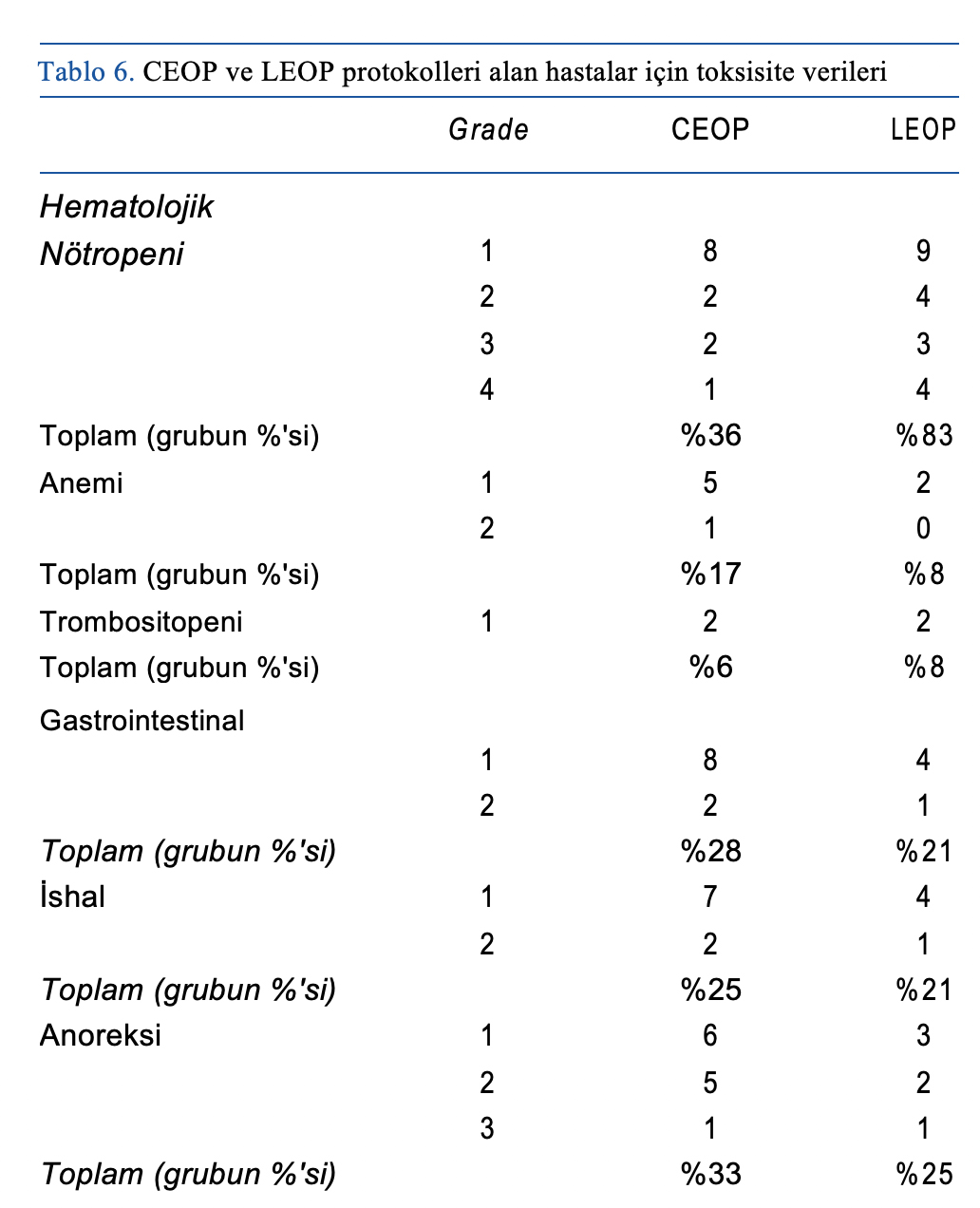
Gastrointestinal ve hematolojik toksisite Tablo 6’da verilmiştir.
Hem CEOP hem de LEOP gruplarında siklofosfamid (n = 2), vinkristin (n = 4) ve epirubisin (n = 8) sonrasında kusma görülmüştür. Siklofosfamid (n = 1), vinkristin (n = 3) ve epirubisin (n = 10) sonrası ishal görülmüştür. Siklofosfamid (n = 2), vinkristin (n = 4) ve epirubisin (n = 6) sonrasında anoreksi görülmüştür. Sadece 1 gastrointestinal toksisite vakası kaydedilmiştir; söz konusu vaka lomustini takip eden gün başlayan grade 1 kusmadır.
CEOP alan 13 köpekte (%36) nötropeni görülmüştür. Bunlar grade 1 (n = 8), grade 2 (n = 2), grade 3 (n = 2) ve grade 4 (n = 1) nötropeni olarak sınıflandırılmıştır. LEOP alan 20 köpekte (%83) nötropeni saptanmıştır. Bunlar grade 1 (n = 9), grade 2 (n = 4), grade 3 (n = 3) ve grade 4 (n = 4) nötropeni şeklinde sınıflandırılmıştır.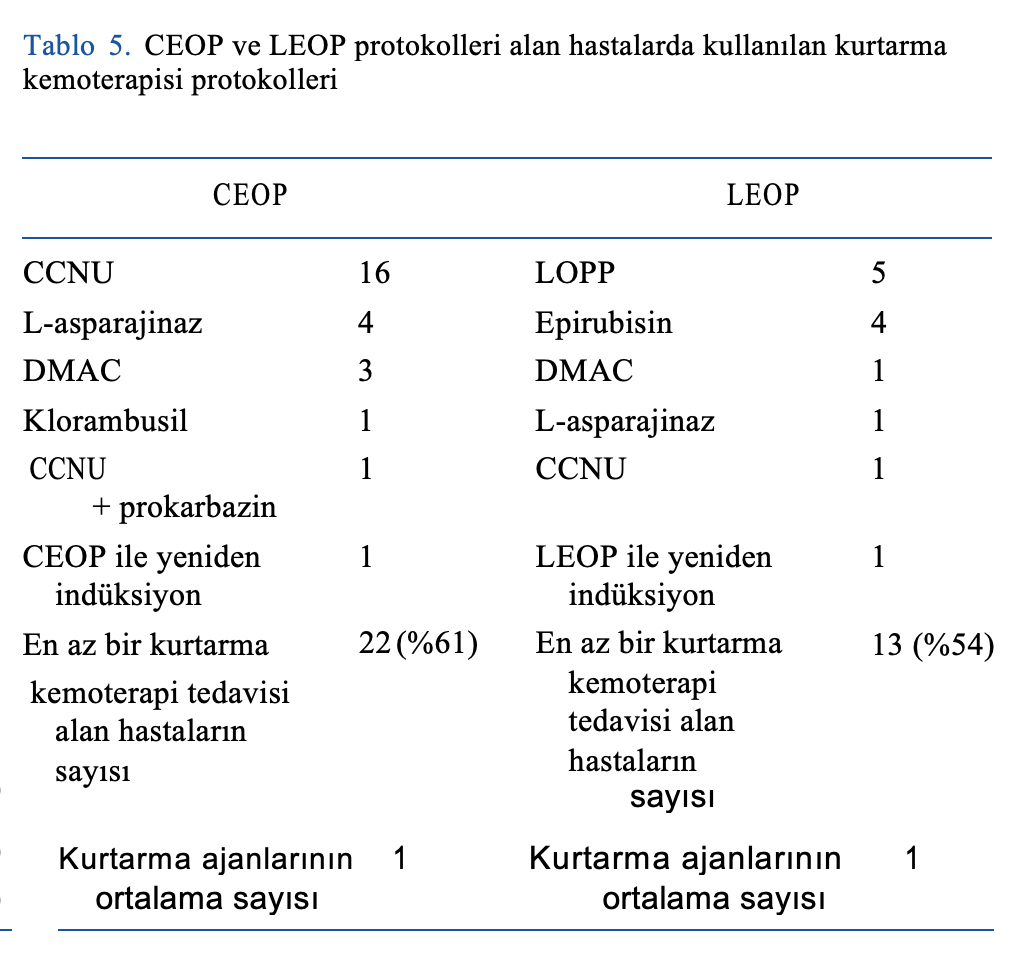
Grade 2 ataklardan ikisi ve grade 3 ve 4 atakların tamamı lomustin nötrofil seviyesinin en düşük olduğu zamandaydı. Klinik belirtiler nedeniyle hastaneye getirilen bir hasta epirubisinden 8 gün sonra anoreksi ve letarji şikayetiyle başvurmuş ve hematolojide grade 2 nötropeni tespit edilmiştir. Diğer vaka da benzer şekilde gelmiş ve lomustinden 5 gün sonra grade 4 nötropeni nedeniyle pireksi ile birlikte febril olduğu tespit edilmiştir.
CEOP grubundaki 6 köpekte (%17) çoğunlukla gastrointestinal (GI) toksisite nedeniyle doz düşürülmesi gerekmiştir. Bu durum siklofosfamid (n = 1), vinkristin (n = 2) ve epirubisin (n = 2) tedavisiyle ilgiliydi ve tüm vakalarda kusmaya bağlıydı. Bir vakada hastaneye yatış ve antibiyotik tedavisi gerektiren grade 4 febril nötropeni nedeniyle epirubisin dozu %20 azaltılmıştır. CEOP grubunda vinkristin (n = 2) ve siklofosfamid (n = 2) nedeniyle 4 köpekte (%11) doz ertelemesi gerekmiştir. LEOP grubunda toplam 7 köpekte (%29) doz düşürülmesi gerekmiştir. 2 köpekte (%8), vinkristin (n = 1) ve epirubisine (n = 1) bağlı gastrointestinal (GI) toksisite nedeniyle; her ikisinde de kusma nedeniyle. LEOP grubundaki 5 köpekte (%21) şiddetli nötropeni nedeniyle doz düşürülmesi önerilmiştir. Tüm vakalarda, ilk lomustin tedavisinden sonra tespit edilen grade 3 (n= 1) veya grade 4 (n = 4) nötropeni nedeniyle bu tavsiye edilmiştir. LEOP grubundaki 3 köpekte (%13) vinkristin sonrası doz ertelemesi gerekmiştir.
Her iki tedavi grubundaki tüm anemi ve trombositopeni vakaları herhangi bir spesifik tedavi uygulanmadan düzelmiştir.
CEOP grubundaki 1 köpekte siklofosfamide bağlı sistit teşhis edilmiştir. Köpek daha sonra siklofosfamid yerine 20 mg/m2 oral bolus olarak klorambusil almıştır.
- veya bir sonraki lomustin tedavisini almadan önce yüksek ALT görülen 6 hasta vardı. Bu durum 5 hastada grade 1 toksisite ve 1 hastada grade 2 toksisite şeklindeydi. Grade 2 toksisitesi olan hastada, LEOP ile devam edilmesine rağmen, ALT hem 3. hem de 4. lomustin tedavisinden önce grade 1 seviyesine düşmüştür. Hiçbir hastada hepatotoksisite nedeniyle lomustin tedavisi kesilmemiştir.
Her grupta bir köpek toksisite nedeniyle hastaneye yatırılmıştır. Her iki vakada da bu durum epirubisin sonrası febril nötropeniden kaynaklanmıştır.
Tedaviye alınan yanıt, sağkalım ve prognostik faktörler
Tüm hastalarda CEOP veya LEOP’a yanıt (CR veya PR) alınmıştır (%100 yanıt oranı) ve kırk sekiz hastada (%97) CR elde edilmiştir.
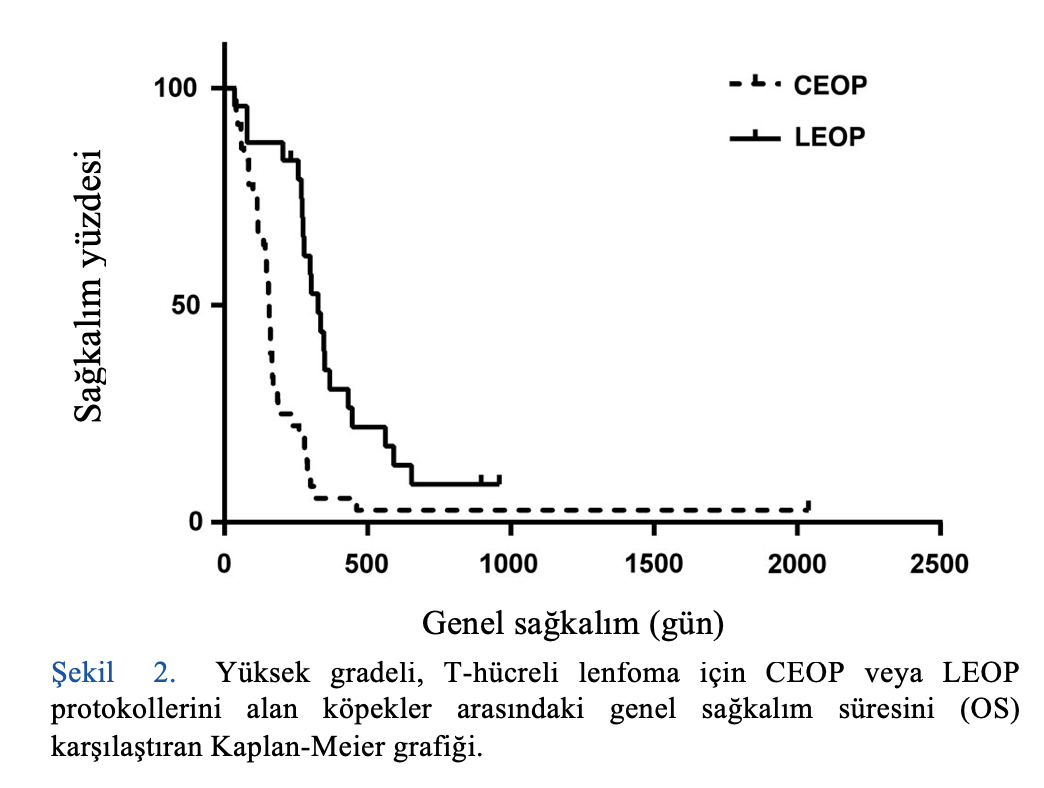
PFS ve OS, CEOP ile karşılaştırıldığında LEOP alan hastalarda istatistiksel olarak anlamlı derecede daha yüksekti. CEOP alan hastalarda PFS ve OS 100 ve 155 gün (p < 0.0001) iken LEOP alan hastalarda 269 ve 327 gün (p < 0.0001) idi (bkz. Tablo 7, Şekil 1 ve Şekil 2).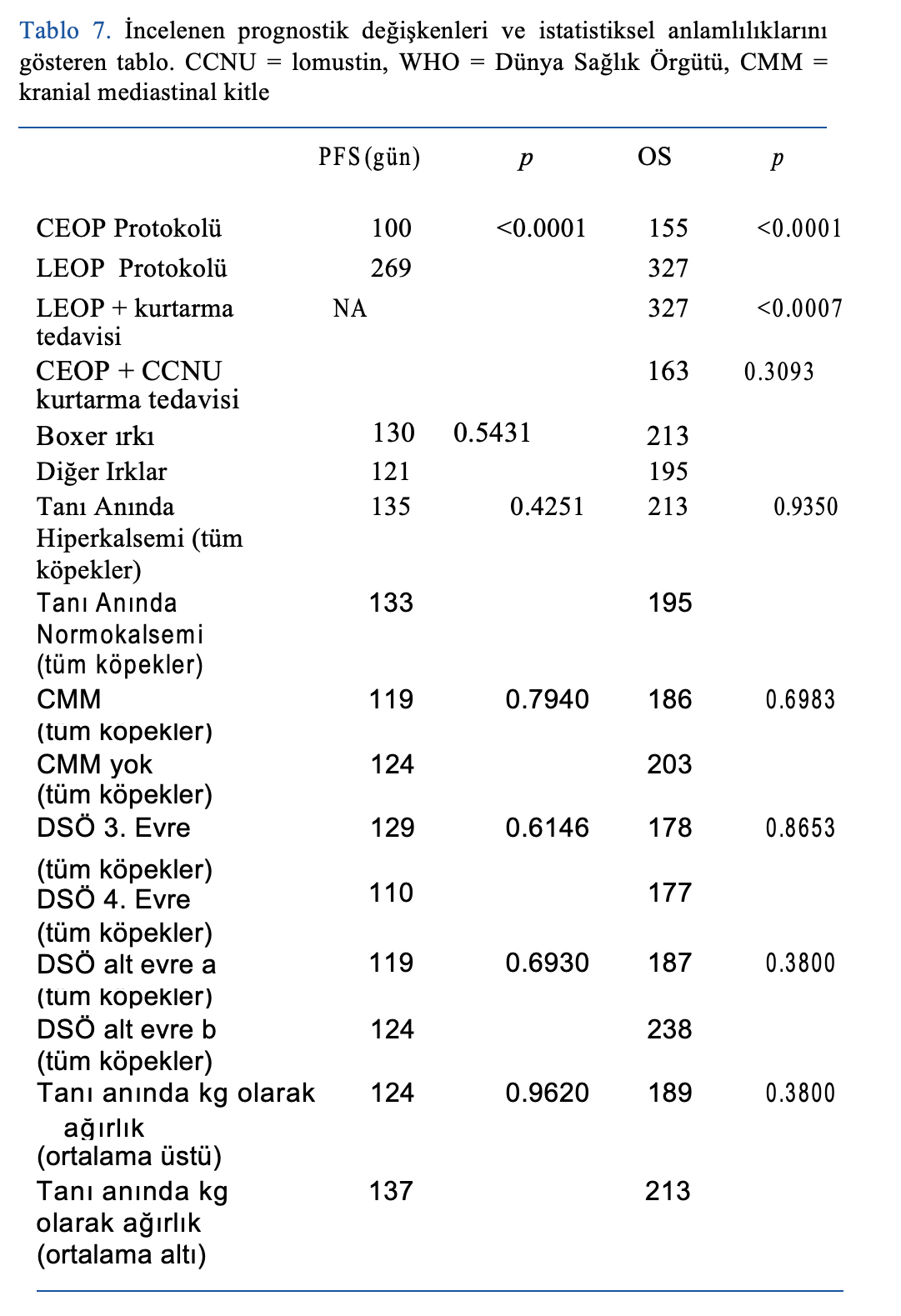
 Hastanın tanı anındaki kilosuna göre analiz edildiğinde PFS veya OS açısından genel olarak veya her bir grup dahilinde herhangi bir fark bulunmamıştır (bkz. Tablo 7).
Hastanın tanı anındaki kilosuna göre analiz edildiğinde PFS veya OS açısından genel olarak veya her bir grup dahilinde herhangi bir fark bulunmamıştır (bkz. Tablo 7).
6 aylık, 1 yıllık ve 2 yıllık sağkalım oranları CEOP ve LEOP için sırasıyla %31, %6, %3 ve %88, %33 ve %8’dir.
CEOP grubundaki bir hasta 2039 günde, LEOP grubundaki üç hasta ise 231, 897 ve 961. günlerde, hastayı sevk eden veteriner hekim ve hayvan sahibiyle yapılan görüşmeye göre lenfoma kanıtı olmamasına rağmen hayatta oldukları için sansürlenmiştir (PFS ve OS).
Genel olarak veya her grup içinde, boxer ırkı (diğer tüm ırklarla karşılaştırıldığında), mediastinal kitle bulunması, DSÖ 3. evreye kıyasla 4. evre, alt evre veya hiperkalsemi bulunması dikkate alındığında PFS veya OS açısından istatistiksel olarak anlamlı bir fark bulunmamıştır (bkz. Tablo 7).
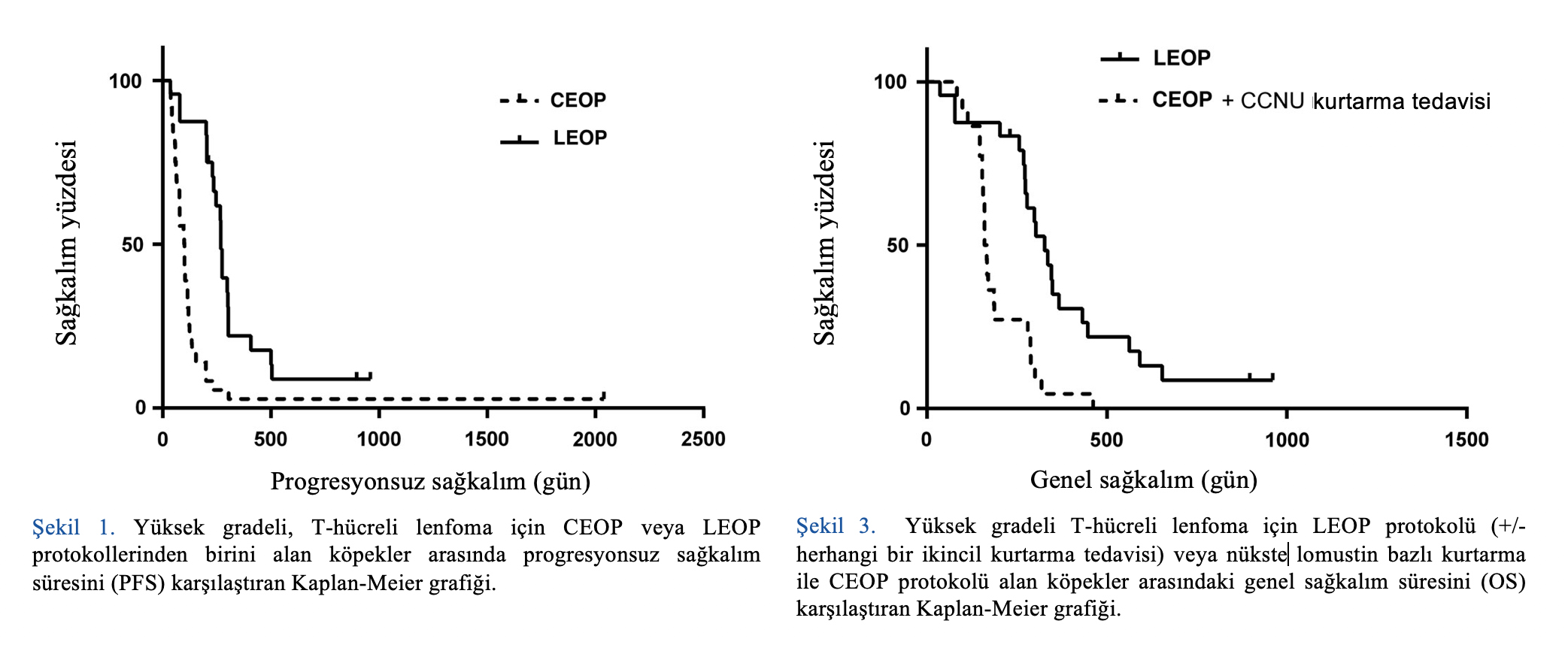
OS, her iki protokolle tedavi edilen hastalardan kurtarma kemoterapisi alanlarda, ilk nüksetme zamanından sonra kurtarma kemoterapisi almayanlara kıyasla istatistiksel olarak anlamlı derecede daha uzun olmuştur (241 güne karşılık 127 gün; p < 0,02). Bu durum her iki grup için de geçerlidir: CEOP (160 güne karşı 81,5 gün; p = 0,024) ve LEOP (346 güne karşı 229 gün; p = 0,039).
LEOP +/- kurtarma kemoterapisi ile tedavi edilen hastalarda OS, CEOP artı lomustin bazlı kurtarma kemoterapisi ile tedavi edilenlere kıyasla istatistiksel olarak anlamlı derecede daha uzun sürmüştür (327 güne karşı 163 gün; p < 0,0007) (Şekil 3).
Tartışma
Bu çalışmanın amacı, çok ajanlı CEOP (CEOP) uygulanan HGTCL’li köpeklerin sonuçlarını, siklofosfamid yerine lomustin (LEOP) ile tedavi edilen köpeklerle karşılaştırmaktır. Epirubisin, yazarların kurumunda kullandığı standart antrasiklindir. Veteriner hekimlikte doksorubisin ile karşılaştırıldığında nadiren rapor edilmiş olsa da, önceki çalışmalar CHOP ile karşılaştırıldığında CEOP ile tedavi edilen lenfoma hastaları için benzer sonuçlar ortaya koymuştur.18
Randomizasyon eksikliği seçim yanlılığına yol açabilirken, yazarların kurumunda HGTCL hastaları için CEOP yerine LEOP kullanılmasına yönelik kurumsal bir değişiklik yapılmış ve bu da vaka seçimi yapılmamasına neden olmuştur. Bununla birlikte, bu hastalar birkaç yıl boyunca çeşitli klinisyenler tarafından tedavi edilmiştir, bu da yanlılığa yol açabilir ve bu küçük retrospektif çalışmanın sonuçları yorumlanırken dikkate alınmalıdır.
LEOP protokolünde siklofosfamidin lomustin ile değiştirilmesinin mantığı, daha iyi PFS ve OS oranları elde etmek amacıyla HGTCL için bilinen, orta derecede etkili olan mevcut protokolü değiştirmekti. Siklofosfamid lomustin ile değiştirildi ve böylece LEOP protokolünde yine alkilleyici bir ajan kullanılmış oldu. Siklofosfamid, CHOP protokollerinde temel bir ilaç olsa da, tek bir ajan olarak performansı oldukça düşük görünmektedir.27,28 Son zamanlarda yapılan bazı çalışmalar, CHOP’un HGTCL de dahil olmak üzere yüksek gradeli lenfomalı köpekler için standart protokol olması gerektiği fikrine karşı çıkmaktadır.14,16,17,19
Tedavi edilen köpeklerin büyük bir kısmı Boxer cinsiydi (%27). T-hücreli lenfomaya yatkın oldukları bilinen bu ırk için şaşırtıcı olmayan bir durumdur.11,12,14,15 Yakın zamanda yapılan bir çalışmada, Boxer’lar için durumun daha kötü olabileceği öne sürülmüştür14 ve bu görüş, gruptaki Boxer sayısının daha yüksek olması (LEOP grubundaki %17’ye kıyasla %33) göz önüne alındığında, CEOP grubundaki daha kötü sonuçları açıklayabilir. Bununla birlikte, mevcut çalışmada, Boxer’lar ne genel olarak ne de tedavi grupları içinde analiz edildiğinde sonuç açısından diğer tüm ırklara kıyasla istatistiksel olarak anlamlı derecede kötü sonuç vermemiştir. Bu nedenle, bu durumun CEOP ve LEOP arasındaki PFS ve OS’deki bu istatistiksel farkı tek başına açıklayamayacağı düşünülmektedir.
CEOP ve LEOP arasındaki gastrointestinal toksisite benzerdi, ancak siklofosfamid ile karşılaştırıldığında lomustin sonrasında kusma ve anoreksi daha az görülmüştür. Bir hasta lomustin sonrası 5. günde febril grade 4 nötropeni ile kliniğe gelmiştir, bu da köpeklerde nötrofil en düşük değerinin değişiklik gösterebileceğini ve veteriner hekimlerin lomustin uygulamasından sonraki ilk hafta evcil hayvanlarını dikkatle gözlemlemeleri konusunda hayvan sahiplerini uyarması gerekliliğini ortaya koymaktadır. Nötropeni tipik olarak lomustin için doz sınırlayıcı toksisitedir ve yüksek nötropeni insidansları oldukça iyi rapor edilmiştir.21,31-33 Bu çalışma, klinik vakalarda lomustin ilacı kullanılırken yüksek gradeli hematolojik toksisiteler için dikkatli bir şekilde gözlem yapılması gerektiğini göstermiş ve ilk tedaviden 7 gün sonra hematoloji yapılması önerisini doğrulamıştır.
Doz ertelemesine ihtiyaç duyan hasta sayısı gruplar içinde benzer olup CEOP ve LEOP gruplarındaki hastaların sırasıyla %11 ve %13’ünü oluşturmaktadır. Lomustine bağlı yüksek nötropeni insidansı göz önüne alındığında, LEOP grubunda daha fazla doz ertelemesi yapılmaması oldukça ilginçtir. Bunun nedeni muhtemelen lomustin tedavisini takiben nörofilin iyileşmesine olanak tanıyan iki haftalık bir boşluk olmasıdır. Bu da büyük olasılıkla LEOP grubundaki hastalarda doz erteleme ihtiyacını azaltmıştır.
Yazarların kliniğinde kemoterapi öncesi ANC değeri, planlanan kemoterapinin devam etmesi için çoğunlukla 2 x 109/l olarak belirlenmiştir. Bu değerin 1,5 x109/l’ye yakın ya da daha düşük olmasının34 daha uygun olabileceği ve tedavideki gecikmeleri ve doz düşüşlerini en aza indirmeye yardımcı olacağı öne sürülmüştür. Bu, artan doz yoğunluğu nedeniyle tümör yanıtının olumlu yönde değişmesini sağlayabilir ve gelecekteki prospektif köpek lenfoması çalışmalarında göz önünde bulundurulması gerekir.
LEOP hastalarının %25’inde lomustine bağlı olduğu düşünülen yüksek ALT saptanmıştır.35 Hastaların çoğunda bu durum düşük şiddette ( grade 1) olmuş ve hiçbir vakada lomustine kesilmemiştir. Grade 2 toksisite görülen bir vakada, ilaca devam edilmesine rağmen ALT düşmüştür ve bu nedenle toksisite muhtemelen lomustin kaynaklı değildi. Hepatotoksisite, bu ilacı alan köpeklerde yaygın olarak görülen bir toksisitedir ve bu çalışmada yüksek ALT insidansının ve şiddetinin düşük olması, koruyucu olduğu öne sürülen Denamarin®’in profilaktik olarak uygulanmasından dolayı olabilir.35 Bu çalışmada, Denamarin® daha önce bildirildiği gibi sürekli olarak değil, her lomustin tedavisinden sonra yalnızca bir hafta süreyle verilmiştir.35 Bunun sebebi masrafları düşürmektir ve bunun için lomustin dozunun monoterapi olarak 3 haftada bir verilmesine kıyasla LEOP protokolünde daha az sıklıkta verilmesi gerektiği savunulmaktadır. Denamarin® tedavisinin azalan süresinin bu çalışmadaki hasta popülasyonunu olumsuz etkilememiş ancak daha kısa süreli verilen Denamarin®’in günlük verilen doz kadar koruyucu olup olmadığını tespit etmek için daha fazla araştırma yapılması gerekmektedir.
Bu çalışmada tedavi edilen tüm hastalarda olduğu gibi, bu işlem özel ilaç formülasyonu hazırlayan eczane tarafından yapıldığında bile, yeniden formüle edilmiş lomustin36,37 ve siklofosfamidin38 etkisinde büyük farklılıklar olabileceği gösterilmiştir. Bu durum çalışmada hem sonuç hem de toksisite sonuçlarını etkilemiş olabilir.
İlginç bir şekilde, LEOP +/- sonradan kurtarma tedavisi alan hastalar, sonradan lomustin bazlı kurtarma tedavisi ile CEOP alan köpeklere kıyasla daha iyi OS’ye sahip olmuştur. Bu durum, lomustinin ilk basamak tedavinin bir parçası olarak erken dönemde uygulanmasının avantajlı olabileceğini göstermektedir. Bunun nedeni, bu ilacın neo plastik hücrelerin en kemosensitif olduğu düşünülen ilk basamak tedavinin bir parçası olarak erken dönemde kullanıldığında daha etkili olması olabilir.
Bu çalışmayı kısıtlayan unsurlar arasında tedavi gruplarının nispeten küçük olması ve çalışmanın retrospektif niteliği yer almaktadır. Geriye dönük olarak elde edilen veriler kemoterapi toksisitesinin hem sıklığını hem de şiddetini olduğundan az gösterebilir. Başka bir kısıtlama da HGTCL olarak sınıflandırılanlar da dahil olmak üzere TCL’nin heterojen doğasıdır. Farklı histolojik, immünofenotipik ve moleküler alt tipler farklı sonuçlara sahip olabilir8,39 ve bu da bu çalışmanın sonuçlarını kısmen saptırmış olabilir. Ayrıca, bazı ırkların TCL’ye yatkın olması, TCL oluşumu için en azından kısmen altta yatan genetik nedenin altını çizmektedir ve bu da daha küçük çalışma popülasyonlarında sonuçları saptırabilir. Bununla birlikte, indolent, primer hepatik, primer gastrointestinal ve hepatosplenik TCL’li vakalar spesifik olarak çalışma dışı bırakılarak daha homojen bir hasta popülasyonu oluşturulmuştur. Köpek HGTCL tedavi olanakları üzerine gelecekte yapılacak çalışmalarda, klinik olarak mümkünse, hastaların kesin hastalık alt tipine göre sınıflandırılması ideal olacaktır. Tam başlangıç evrelemesi çoğu zaman yapılmamıştır ve hepatik/splenik lezyonlarda lenfomanın sitolojik olarak doğrulanmaması, 4. evre hastalığı olan hastaların fazla tahmin edilmesi ile birlikte sonuçları etkilemiş olabilir. Standart hale getirilmiş, tekrarlanan klinik evreleme bazı veteriner hastalar için masraflı olabilir ve bu çalışma popülasyonunda rutin aralıklarla her zaman yapılmamıştır. Bu durum PFS’nin olduğundan fazla tahmin edilmesine yol açabilir ve çalışma sonuçları yorumlanırken göz önünde bulundurulmalıdır. Ayrıca, kullanılan kurtarma protokollerinin standart hale getirilmemiş olması OS verilerini etkilemiş ve ortalama sağkalım sürelerinin olduğundan az veya fazla tahmin edilmesine yol açmış olabilir. Köpek lenfoma hastalarında kemoterapi protokolleri karşılaştırılırken, OS kemoterapi maliyeti, ek kurtarma tedavisi ve hasta sahiplerinin yaşam kalitesi ve ötenazi yapma zamanı konusundaki şahsi duyguları gibi faktörlerden etkilenebilir. Bu nedenle PFS, farklı protokollerin etkinliğinin değerlendirilmesinde ve karşılaştırılmasında daha uygun bir sonlanım noktasıdır ve bu çalışmada LEOP grubunda üstün olmaya devam etmiştir. LEOP grubunda (%50) CEOP grubuna (%61) kıyasla daha az sayıda hastanın kurtarma tedavisi almış olması dikkate değerdir ve bu nedenle LEOP grubunda görülen yüksek OS’yi açıklamada yetersiz kalmıştır.
Bu çalışmada, PFS ve OS, LEOP alan hastalarda CEOP’a kıyasla istatistiksel olarak anlamlı derecede daha yüksek çıkmıştır. Köpek HGTCL hastalarında ilk basamak çok ilaçlı kemoterapi için siklofosfamidin lomustin ile değiştirilmesi, prospektif çalışmalarla değerlendirilmeye uygundur.
Çıkar Çatışması Beyanı
Yazarlar herhangi bir çıkar çatışması beyan etmemiştir
Teşekkürler
Yazarlar, klinik vakaların yönetimindeki yardımları için iç hastalıkları ve onkoloji ekiplerine teşekkürini sunmaktadır.
Kaynakça
- Sayag D, Fournel-Fleury C and Ponce F. Prognostic significance of mor- photypes in canine lymphomas: A systematic review of literature. Vet Comp 2017.
- Fournel-Fleury C, Ponce F, Felman P, Blavier A, Bonnefont C, Chabanne L, Marchal T, Cadore JL, Goy-Thollot I, Ledieu D, Ghernati I and Magnol Canine T-cell lymphomas: a morphological, immunological, and clinical study of 46 new cases. Vet Pathol. 2002; 39(1): 92-109.
- Ponce F, Magnol JP, Ledieu D, Marchal T, Turinelli V, Chalvet-Monfray K and Fournel-Fleury C. Prognostic significance of morphological subtypes in canine malignant lymphomas during Vet J. 2004; 167(2): 158-66.
- Baskin CR, Couto CG and Wittum Factors influencing first remission and survival in 145 dogs with lymphoma: a retrospective study. J Am Anim Hosp Assoc. 2000; 36(5): 404-9.
- Valli VE, Kass PH, San Myint M and Scott Canine lymphomas: association of classification type, disease stage, tumor subtype, mitotic rate, and treatment with survival. Vet Pathol. 2013;50(5): 738-48.
- Valli VE, San Myint M, Barthel A, Bienzle D, Caswell J, Colbatzky F, Durham A, Ehrhart EJ, Johnson Y, Jones C, Kiupel M, Labelle P, Lester S, Miller M, Moore P, Moroff S, Roccabianca P, Ramos-Vara J, Ross A, Scase T, Tvedten H and Vernau W. Classification of canine malignant lymphomas according to the World Health Organization Vet Pathol. 2011; 48(1): 198-211.
- Flood-Knapik KE, Durham AC, Gregor TP, Sanchez MD, Durney ME and Sorenmo KU. Clinical, histopathological and immunohistochemical characteri- zation of canine indolent Vet Comp Oncol. 2013; 11(4): 272-86.
- Frantz AM, Sarver AL, Ito D, Phang TL, Karimpour-Fard A, Scott MC, Valli VE, Lindblad-Toh K, Burgess KE, Husbands BD, Henson MS, Borgatti A, Kisseberth WC, Hunter LE, Breen M,O’Brien TD and Modiano Molecular pro- filing reveals prognostically significant subtypes of canine lymphoma. Vet Pathol. 2013; 50(4): 693-703.
- Seelig DM, Avery P, Webb T, Yoshimoto J, Bromberek J, Ehrhart EJ and Avery Canine T-zone lymphoma: unique immunophenotypic features, out- come, and population characteristics. JVet Intern Med. 2014; 28(3): 878-86.
- Keller SM, Vernau W, Hodges J, Kass PH, Vilches-Moure JG, McElliot V and Moore Hepatosplenic and hepatocytotropic T-cell lymphoma: two distinct types of T-cell lymphoma in dogs.Vet Pathol. 2013; 50(2): 281-90.
- Lurie DM, Lucroy MD, Griffey SM, Simonson E and Madewell T-cell- derived malignant lymphoma in the boxer breed. Vet Comp Oncol. 2004; 2(3): 171-5.
- Lurie DM, Milner RJ, Suter SE and Vernau W. Immunophenotypic and cytomorphologic subclassification of T-cell lymphoma in the boxer Vet Immunol Immunopathol. 2008; 125(1-2): 102-10.
- Mastovich S, Ratech H, Ware RE, Moore JO and Borowitz Hepatosplenic T-cell lymphoma: an unusual case of a gamma delta T-cell lymphoma with a blast-like terminal transformation.Hum Pathol. 1994; 25(1): 102-8.
- Goodman IH, Moore AS and Frimberger AE. Treatment of canine non- indolent T cell lymphoma using the VELCAP-TSC protocol: A retrospective eval- uation of 70 dogs (2003-2013).Vet 2016; 211: 39-44.
- Fahey CE, Milner RJ, Barabas K, Lurie D, Kow K, Parfitt S, Lyles S and Clemente Evaluation of the University of Florida lomustine, vincristine, pro- carbazine, and prednisone chemotherapy protocol for the treatment of relapsed lymphoma in dogs: 33 cases (2003-2009). J Am Vet Med Assoc. 2011; 239(2): 209-15.
- Brodsky EM, Maudlin GN, Lachowicz JL and Post Asparaginase and MOPP treatment of dogs with lymphoma. J Vet Intern Med. 2009; 23(3): 578-84.
- Brown PM, Tzannes S, Nguyen S, White J and Langova LOPP chemother- apy as a first-line treatment for dogs with T-cell lymphoma. Vet Comp Oncol. 2017.
- Elliott JW, Cripps P, Marrington AM, Grant IA and Blackwood Epirubicin as part of a multi-agent chemotherapy protocol for canine lymphoma. Vet Comp Oncol. 2013; 11(3): 185-98.
- Moore AS. Treatment of T cell lymphoma in dogs. Vet Rec. 2016; 179 (11):
- Rebhun RB, Kent MS, Borrofka SA, Frazier S, Skorupski K and Rodriguez CHOP chemotherapy for the treatment of canine multicentric T-cell lymphoma. Vet Comp Oncol. 2011; 9(1):38-44.
- Saba CF, Hafeman SD, Vail DM and Thamm Combination chemother- apy with continuous L-asparaginase, lomustine, and prednisone for relapsed canine lymphoma. J Vet Intern Med.2009; 23(5): 1058-63.
- Saba CF, Thamm DH and Vail DM. Combination chemotherapy with L-asparaginase, lomustine, and prednisone for relapsed or refractory canine J Vet Intern Med. 2007;21(1): 127-32.
- Laprais A and Olivry Is CCNU (lomustine) valuable for treatment of cuta- neous epitheliotropic lymphoma in dogs? A critically appraised topic. BMC Vet Res. 2017; 13(1): 61.
- Rassnick KM, Bailey DB, Malone EK, Flory AB, Kiselow MA and Intile Toler- ability of lomustine in combination with cyclophosphamide in dogs with lym- phoma. J Am Anim HospAssoc. 2014; 50(3): 167-73.
- Sauerbrey ML, Mullins MN, Bannink EO, Van Dorp TE, Kaneene JB and Obradovich JE. Lomustine and prednisone as a first-line treatment for dogs with multicentric lymphoma: 17cases (2004-2005). J Am Vet Med 2007; 230(12): 1866-9.
- Moore AS, London CA, Wood CA, Williams LE, Cotter SM, L’Heureux DA and Frimberger Lomustine (CCNU) for the treatment of resistant lymphoma in dogs. J Vet Intern Med. 1999;13(5): 395-8.
- Sato M, Yamazaki J, Goto-Koshino Y, Takahashi M, Fujino Y, Ohno K and Tsujimoto Evaluation of cytoreductive efficacy of vincristine, cyclophospha- mide, and Doxorubicin in dogs with lymphoma by measuring the number of neoplastic lymphoid cells with real-time polymerase chain reaction. J Vet Intern Med. 2011; 25(2): 285-91.
- Wang SL, Lee JJ and Liao Assessment of temporal association of relapse of canine multicentric lymphoma with components of the CHOP protocol: Is cyclophosphamide the weakestlink? Vet J. 2016; 213: 87-9.
- Vail DM, Michels GM, Khanna C, Selting KA, London CA and Veterinary Cooperative Oncology Response evaluation criteria for peripheral nodal lym- phoma in dogs (v1.0)–a Veterinary Cooperative Oncology Group (VCOG) con- sensus document. Vet Comp Oncol. 2010; 8(1): 28-37.
- Veterinary cooperative oncology group – common terminology criteria for adverse events (VCOG-CTCAE) following chemotherapy or biological antineo- plastic therapy in dogs and cats1. Vet Comp Oncol. 2016; 14(4): 417-46.
- Rassnick KM, Moore AS, Williams LE, London CA, Kintzer PP, Engler SJ and Cotter Treatment of canine mast cell tumors with CCNU (lomustine). J Vet Intern Med. 1999; 13(6): 601-5.
- Risbon RE, de Lorimier LP, Skorupski K, Burgess KE, Bergman PJ, Carreras J, Hahn K, Leblanc A, Turek M, Impellizeri J, Fred R, 3rd, Wojcieszyn JW, Drobatz K and Clifford Responseof canine cutaneous epitheliotropic lymphoma to lomustine (CCNU): a retrospective study of 46 cases (1999-2004). J Vet Intern Med. 2006; 20(6): 1389-97.
- Skorupski KA, Clifford CA, Paoloni MC, Lara-Garcia A, Barber L, Kent MS, LeBlanc AK, Sabhlok A, Mauldin EA, Shofer FS, Couto CG and Sorenmo CCNU for the treatment of dogs with histiocytic sarcoma. J Vet Intern Med. 2007; 21(1): 121-6.
- Fournier Q, Serra JC, Handel I and Lawrence Impact of Pretreatment Neu- trophil Count on Chemotherapy Administration and Toxicity in Dogs with Lym- phoma Treated with CHOP Chemotherapy. J Vet Intern Med. 2018; 32(1): 384-93.
- Skorupski KA, Hammond GM, Irish AM, Kent MS, Guerrero TA, Rodriguez CO and Griffin Prospective randomized clinical trial assessing the efficacy of Denamarin for prevention of CCNU-induced hepatopathy in tumor-bearing dogs. J Vet Intern Med. 2011; 25(4): 838-45.
- KuKanich B, Warner M and Hahn Analysis of lomustine drug content in FDA-approved and compounded lomustine capsules. J Am Vet Med Assoc. 2017; 250(3): 322-6.
- Burton JH, Stanley SD, Knych HK, Rodriguez CO, Skorupski KA and Rebhun Frequency and Severity of Neutropenia Associated with Food and Drug Administration Approved andCompounded Formulations of Lomustine in Dogs with Cancer. J Vet Intern Med. 2016; 30(1): 242-6.
- Burton JH, Knych HK, Stanley SD and Rebhun Potency and stability of compounded formulations of chlorambucil, melphalan and cyclophosphamide. Vet Comp Oncol. 2017; 15(4):1558-63.
- Deravi N, Berke O, Woods JP and Bienzle Specific immunotypes of canine T cell lymphoma are associated with different outcomes. Vet Immunol Immuno- pathol. 2017; 191: 5-13.
(Yayın için kabul edilme tarihi: