| Translat Regulat Sci. 2(3): 68–71, 2020; doi: 10.33611/trs.2020-013 |
1 Laboratory 1 Veteriner Cerrahi Laboratuvarı, Veteriner Tıbbi Bilimler Bölümü, Zirai ve Beşeri Bilimler Enstitüsü, Tokyo Üniversitesi, 1-1-1 Yayoi, Bunkyo-ku, Tokyo 113-8657, Japonya
2 Fonksiyonel Genomik Laboratuvarı, Hesaplamalı Biyoloji ve Tıbbi Bilimler Bölümü, Öncü Bilimler Enstitüsü, Tokyo Üniversitesi, 4-6-1 Shirokanedai, Minato-ku, Tokyo 108-8639, Japonya
3 Rehber Köpekler ve Görme Engelli Kişiler için Bilimler Laboratuvarı, Öncü Bilimler Enstitüsü, Tokyo Üniversitesi, Komaba II Kampüsü T binası 4-6-1 Komaba, Meguro-ku, Tokyo 153-8505, Japonya
Özet. Lapatinib, epidermal büyüme faktörü reseptörü (EGFR) ve insan epidermal büyüme faktörü reseptörü 2’yi (HER2) hedefleyen molekül ağırlığı düşük bir ajandır. İnsanda ileri evre meme kanserine karşı kullanılan antitümör ajanlardan biridir. Biz bunu köpek meme bezi tümörlerine (cMGTs) karşı uygulamayı amaçladık. Bu doğrultuda, sağlıklı köpeklerde tolere edilebilir dozajı ve lapatinibin yan etkilerini değerlendirdik. Bu çalışmada, maksimum tolere edilebilir dozu belirlemek için 30 mg/kg’dan başlamak üzere doz-eskalasyon toksisite testi yaptık. Kilo kaybı olarak görülen Grade 3 toksisite 40 mg/kg/gün dozda gözlenmiştir. Daha sonra uzun süreli bir uygulama testi gerçekleştirdik ve 35 mg/kg/gün dozunun 7 hafta içinde iyi tolere edildiğini ancak sekizinci haftada grade 3 hepatik toksisiteye neden olduğunu tespit ettik. Sonuç olarak, bulgularımız 8 haftayı geçmeyecek şekilde uygulanan 35 mg/kg/gün dozunun sağlıklı köpeklerde kullanım için oldukça güvenli olduğunu ortaya koymaktadır. Bu doz, insanlar için önerilen dozdan daha yüksektir; bu nedenle, köpek tümörlerine karşı etkili dozu değerlendiren daha ayrıntılı çalışmalara ihtiyaç vardır.
| Önemli Noktalar |
Anahtar kelimeler: köpek, insan epidermal büyüme faktörü reseptörü 2, lapatinib, meme bezi tümörü, güvenlik testi
- İnsan tıbbındakine benzer şekilde, HER2 köpek malign tümörleri için umut verici tedavi yöntemidir.
- Lapatinib tosilat hidrat, HER2’yi de içeren HER ailesine karşı moleküler hedefli bir ilaçtır; insanlarda kullanımı güvenli ve anti-tümör etkisi kanıtlanmıştır.
- Veteriner hekimlikte lapatinibin MTD’sini ve güvenli olup olmadığını belirlemek için altı sağlıklı köpekte lapatinibin doz-eskalasyon çalışması ve uzun süreli uygulama testi yapılmıştır.
- Yemeklerle birlikte 35 mg/kg/gün lapatinibin oral kullanımı cMGT’lerin tedavisinde güvenli bulunmuştur.
- Lapatinibin doz sınırlayıcı toksisiteleri kilo kaybı ve ALP yüksekliğiydi.
İnsan epidermal büyüme faktörü reseptörü 2 (HER2) bir tirozin kinaz reseptörüdür ve insan epidermal büyüme faktörü reseptörü (HER/EGFR/ERBB) ailesinin bir üyesidir. Aşırı ekspresyonunun, proliferasyon, metastaz ve ilaç direnci gibi insan meme kanserinin malignitesini etkileyen faktörlerle bağlantılı olduğu rapor edilmiştir [1, 2]. İnsan meme kanseri klinik olarak hormon reseptörlerinin ve HER2’nin ekspresyon durumuna ve proliferasyon indeksine göre intrinsik alt tiplere ayrılmıştır [3, 4]. İnsan meme kanseri tedavisi alt tipe göre seçilmektedir ve HER2-pozitif kanserli hastalara HER2-hedefli tedavi uygulanmaktadır. Bu hastalar için ilk basamak kemoterapi, insan HER2’sini hedef alan hümanize monoklonal bir antikor olan trastuzumabdır (Herceptin®; Chugai Pharmaceutical Co., Ltd., Tokyo, Japonya). Kanser ileri bir evreye ulaştığında veya trastuzumab tedavisine yanıt vermediğinde, insan meme kanserinde kapesitabin ve lapatinib ile kombinasyon tedavisi göz önünde bulundurulur. Lapatinib, epidermal büyüme faktörü reseptörü (EGFR) ve HER2’yi hedef alan molekül ağırlığı düşük bir bileşiktir [2] ve ilerlemiş HER2-pozitif meme kanserine karşı etkili olduğu bildirilmiştir [5]. Veteriner hekimlikte, köpek meme bezi tümörleri (cMGT’ler) dişi köpeklerde en sık görülen tümörler arasındadır ve bu tümörlerin erken klinik evrede ilk tedavi seçeneği cerrahi eksizyondur [6]. Uzak metastazı olan hayvanlar için, karboplatin ve doksorubisin gibi geleneksel sitosidal antikanser ajanları yaygın olarak uygulanmaktadır. Bu ajanlar köpeklerdeki neoplazmlar için yaygın olarak kullanılmaktadır ve ilerlemiş cMGT vakalarında cerrahi operasyondan sonra ortalama sağkalım süresini uzatmaktadır (adjuvan kemoterapi ile birlikte cerrahi uygulanan vakalarda 228 gün ve sadece cerrahi uygulanan vakalarda 194 gün) [7]. Bununla birlikte, bu ajanların miyelosupresyon ve kardiyotoksisite gibi yan etkileri vardır, bu da bazen kullanımlarını sınırlayarak cMGT’ler için yeni bir tedavi geliştirilmesini zorunlu kılar.
*İlgili yazar: Nakagawa, T.: anakaga@mail.ecc.u-tokyo.ac.jp (Ek materyal: Bkz. J-STAGE https://www.jstage.jst. go.jp/browse/trs/-char/en)
Sunum: 19 Temmuz 2020; Kabul: 12 Ağustos 2020
©2020 Catalyst Unit
Bu, Creative Commons Attribution Non-Commercial No Derivatives (by-nc-nd) Lisansı koşulları altında dağıtılan açık erişimli bir makaledir.
(CC-BY-NC-ND 4.0: https://creativecommons.org/licenses/by-nc-nd/4.0/)
cMGT’lerin %18-46’sında aşırı HER2 ekspresyonu rapor edilmiştir [8]. Bu nedenle, HER2 hedefleyici ajan lapatinib, cMGT’lere karşı yeni aday ajan olabilir. Lapatinibin veri sayfasına göre, köpeklerde iki seri güvenlik testi yapılmıştır: tek ve çoklu doz toksisite testleri. Tek doz toksisite testinde, sağlıklı köpeklerde 10, 60 ve 360 mg/kg dozları kullanılmış ve yan etki olarak sadece hafif ishal bildirilmiştir. Öte yandan, çoklu doz toksisite testinde, 10, 40 ve 160 mg/kg/gün dozları 13 hafta ve 39 hafta boyunca kullanılmış ve 40 mg/kg/gün’den daha yüksek dozlarda deri iltihabı ve hepatotoksisite gibi bazı yan etkiler gözlenmiş ve her iki zaman diliminde de NOAEL 10 mg/kg/gün olarak belirlenmiştir [9]. Ön çalışmamızda, 20 mg/kg dozda herhangi bir olumsuz etki gözlenmemiştir (henüz yayınlanmamış veriler). Bu bulgulara dayanarak, köpeklerde lapatinibin maksimum tolere edilebilir dozunu (MTD) belirlemek için 30 mg/kg dozdan başlayarak doz-eskalasyon toksisite testi yaptık.
Sağlıklı Beagle köpekleri Oriental Yeast Co., Ltd. ‘den (Tokyo, Japonya) satın alınmıştır. Üç erkek ve üç dişi köpek bu çalışmaya dahil edilmiştir. Tüm köpekler 18 aylıktı ve ortalama vücut ağırlıkları 9.2 ± 0.74 kg (aralık: 7.9-10.1 kg) idi. Köpekler, miktarı hayvanların vücut ağırlıklarına göre belirlenen Urban Life Junior kuru mama (Royal Canin, Dubai, Birleşik Arap Emirlikleri) ile beslendi ve ad libitum taze suya erişimleri vardı. Oda sıcaklığı 25°C civarında tutuldu ve nem oranı yaklaşık %60 idi. Tüm hayvan deneyleri Tokyo Üniversitesi Ziraat Fakültesi Etik Kurulu tarafından onaylanmış ve Tokyo Üniversitesi’nin hayvanların bakımı ve kullanımına ilişkin yönergelerine uyulmuştur (onay numarası: P18-048).
Lapatinib tosilat hidrat (Tykerb®) Novartis’ten (Basel, İsviçre) satın alınmıştır. Lapatinib her doz için kapsüller (Matsuya, Osaka, Japonya) içine yerleştirilmiştir. Kapsüller günde bir kez gıda ile birlikte per os olarak uygulanmıştır. Hayvanların genel fiziksel durumu, gıda alım miktarı ve kusma ile ishal durumu da dahil olmak üzere günde iki kez kontrol edilmiştir. Köpekler haftada bir kez kalp ve solunum hızı ölçümü ve oskültasyon, 2 haftada bir vücut ağırlığı ölçümü ve kan muayenesi ve muayene öncesi ve sonrasında toraks röntgeni dahil olmak üzere fiziksel muayenelerden geçirildi. Kan muayenesi tam kan sayımı, pıhtılaşma testi ve albümin, alkalin fosfat (ALP), alanin aminotransferaz (ALT), aspartat aminotransferaz (AST), gama-glutamiltrans- feraz (GGT), total bilirubin (T-BIL), kan üre nitrojeni (BUN), kreatinin, glukoz ve elektrolit seviyelerinin belirlenmesi dahil olmak üzere biyokimyayı içeriyordu (DRI- CHEM 7000V, Fujifilm Corp., Tokyo, Japonya). Yan etkiler Veteriner Onkoloji Grubu – Yan Etkiler için Ortak Terminoloji Kriterleri (VCOG-CTCAE) ver. 1.1’e göre değerlendirilmiş ve bazı örnek yan etkiler Ek Tablo 1’de gösterilmiştir [10].
İki çalışma yapılması planlanmıştır: bir doz-eskalasyon çalışması ve uzun süreli uygulama testi. Doz-eskalasyon çalışmasında, 30 mg/kg/gün başlangıç dozundan başlayarak, VCOG-CTCAE grade 3’ten daha şiddetli bir yan etki ortaya çıkana kadar doz her 2 haftada bir 5 mg/kg/gün artırılmıştır. Grade 3 yan etkiye yol açmayan maksimum doz MTD olarak kabul edildi ve bir sonraki incelemeye geçildi. Uzun süreli uygulama testinde, bir önceki çalışmadan 8 hafta aradan sonra MTD’yi 8 hafta boyunca uyguladık. Geleneksel antitümör ilaçlarla yapılan birçok protokole benzer şekilde, 8 haftalık uygulama bir dönem olarak kabul edildi. Yan etki yukarıda açıklandığı gibi belirlenmiştir ve grade 3 yan etkilerin ortaya çıkması çalışmanın son noktası olarak belirlenmiştir. Her iki çalışmanın başlangıcında tüm köpeklerin klinik anormallik göstermediği ve tüm muayenelerde normal değerlere sahip olduğu teyit edilmiştir.
Doz-eskalasyon çalışması, köpekler için doğru lapatinib dozunu belirlemek amacıyla gerçekleştirilmiştir. Tablo 1, 30-40 mg/kg/gün lapatinib uygulamasında görülen yan etkileri göstermektedir. Lapatinib 40 mg/kg/gün dozunda uygulandığında bir köpekte grade 3 toksisite gelişmiştir. Doz sınırlayıcı toksisite, >%15 kilo kaybı olarak tanımlanan grade 3 yan etkiydi. Bu köpekte ağırlık yüzdesi %84,4’e kadar düşmüştür. 30 ve 35 mg/kg/gün dozlarında grade 3’ten daha yüksek şiddette hiçbir yan etki gözlenmemiştir.
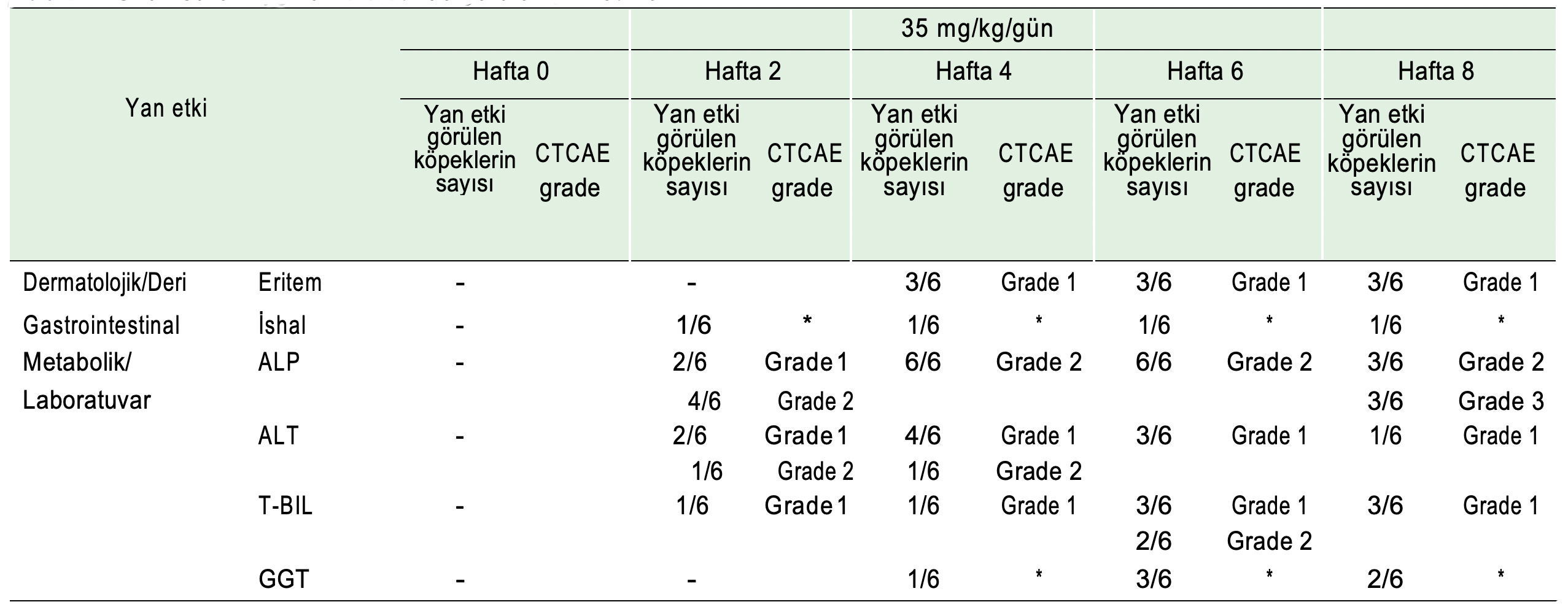
Doz-eskalasyon çalışmasının sonuçlarına göre, uzun süreli uygulama testi 35 mg/kg/gün dozunda yapılmıştır. Uzun süreli uygulama testi sırasında görülen yan etkiler Tablo 2’de gösterilmiştir. Köpeklerde ALP referans aralığı 20 ila 156 IU/l olduğundan, bu çalışmada ALP seviyesi açısından grade 3 yan etkinin büyüklüğü hesaplanmış ve 780 ila 3120 IU/l olarak belirlenmiştir (Ek Tablo 1). Lapatinib 8 hafta boyunca uygulandıktan sonra, altı köpekten üçünde belirlenen aralığın alt sınırının üzerinde olan yüksek ALP seviyeleri (814, 967 ve 1316 IU/l) görülmüştür. Diğer parametrelerin hiçbiri grade 3’ün ötesinde toksisite seviyesini aşmamıştır.
Meme bezi tümörleri de dahil olmak üzere bazı köpek tümörlerinde HER2 ekspresyonu bildirildiği için, lapatinib faydalı bir tedavi seçeneği olarak düşünülebilir [8, 11-13]. Ayrıca, HER2 inhibisyonunun köpek meme hücre hatlarında etkili olduğu bildirilmiştir [14]. Bununla birlikte, köpeklerde belirli dozlarda [9] birkaç güvenlik çalışması gerçekleştirilmiş olsa da, herhangi bir pratik protokol oluşturulmamıştır.
Bu çalışmada, lapatinibin köpekler için MTD’si 8 hafta içinde 35 mg/kg/gün olarak bulunmuştur. İnsanlarda lapatinib, kapesitabin ile birlikte 50 kg ağırlığındaki bir kişi için 25 mg/kg’a eşit olan 1.250 mg/baş/gün dozunda uygulanmaktadır. Bu çalışmada tanımlanan MTD, köpeklerde klinik olarak uygulanabilir doz olup, insan tıbbında uygulanan ekstrapole dozdan daha yüksektir. Bu çalışmayı sınırlandıran unsurlardan biri, köpek tümörleri üzerindeki etkisinin değil, yalnızca lapatinib kullanımının güvenliğinin incelenmiş olmasıdır. İlaç için klinik olarak faydalı olacak bir protokol belirlemek için daha fazla çalışma yapılması gerekmektedir.
Bu çalışmada, kilo kaybı ve yüksek ALP seviyesi doz sınırlayıcı toksisite olarak belirlenmiştir. İnsanlarda olduğu gibi lapatinib de hepatobiliyer toksisiteye neden olabilir, ancak bu durumdan etkilendiği bildirilen değerler köpekler ve insanlar arasında farklılık göstermektedir: ALT, AST ve T-BIL seviyelerinin insanlarda arttığı rapor edilmiştir, ancak bu çalışmada en çok etkilenen parametre ALP olmuştur. Bu çalışmada kilo kaybının nedeni açık değildir. Çalışma sırasında iştah ve diyet değişmediğinden, nedensel faktör bağırsak sistemi bozukluğu olabilir. Lapatinibin farmakodinamiğinin ve köpeklerdeki yan etki mekanizmalarının ayrıntılı olarak belirlenmesi için daha fazla araştırma yapılması gerekmektedir.
Antitümör ajanlar arasında sıklıkla kullanılan birçok ilaç kemik iliği supresyonuna neden olmaktadır. Aynı zamanda, molekül hedefli ajanlar, muhtemelen sınırlı bilgi ve maliyet nedeniyle veteriner kliniklerinde yaygın olarak kullanılmamaktadır. Ancak bu çalışmanın sonuçları, lapatinibin köpeklerde bile herhangi bir olumsuz miyelosupresif etki olmaksızın nispeten güvenli bir şekilde kullanılabileceğini göstermektedir. İlacın geleneksel antitümör ilaçlarla birlikte kullanılıp kullanılamayacağını belirlemek için daha fazla güvenlik çalışmasına ihtiyaç vardır.
İlaç farmakokinetiğinin insanlarda yağ alımına bağlı olarak değiştiği bildirilmiştir; yüksek yağ alımı, yüksek konsantrasyon-zaman eğrisi altında kalan alan (EAA) ve maksimum kan konsantrasyonuyla bağlantılıdır [5]. İnsan tıbbında, farmakokinetik değişikliklerden kaçınmak için lapatinibin öğünler arasında uygulanması önerilmektedir. Bununla birlikte, veteriner hekimlikte, köpeklere oral ilaçların evde, özellikle de herhangi bir ödül olmadan uygulanması genellikle zordur. İlaçla ilgili uygun bir protokol oluşturmak için ilacı yemeklerle birlikte uygulamaya karar verdik. Aynı zamanda,
Tablo 1. Doz-eskalasyon çalışmasında görülen yan etkiler
*: “İshal” ve “GGT” yan etkiler için Ortak Terminoloji Kriterlerine (CTCAE) dahil edilmedikleri için derecelendirilmemiştir. -: herhangi bir anormallik veya yan etki görülmemiştir. ALP, alkalin fosfataz; ALT, alanin aminotransferaz; T-BIL, total bilirubin; GGT, γ-glutamil transpeptidaz.
Tablo 2. Uzun süreli uygulama testinde görülen yan etkiler
*: “İshal” ve “GGT” yan etkiler için Ortak Terminoloji Kriterlerine (CTCAE) dahil edilmedikleri için derecelendirilmemiştir. -: herhangi bir anormallik veya yan etki görülmemiştir. ALP, alkalin fosfataz; ALT, alanin aminotransferaz; T-BIL, total bilirubin; GGT, γ-glutamil transpeptidaz.
köpeklere evde çeşitli diyet programları uygulandığını varsayarak, bu çalışmada köpeklere kapsamlı bir beslenme modeli sunduk ve seçilen diyette yağ oranı oldukça yüksekti (toplam yağın %16’sından az). İlaç öğünler arasında veya düşük yağlı öğünlerle birlikte uygulanırsa, MTD daha yüksek çıkabilir. Sonuç olarak, lapatinibin 8 hafta içinde yemeklerle birlikte 35 mg/kg/gün dozunda oral olarak uygulanmasının köpekler için güvenli olduğu tespit edilmiştir. Bu bulgu, tümör taşıyan köpeklerde antitümör etkisinin ve yan etkilerinin klinik değerlendirmesi için yararlı olabilir.
Çıkar çatışması beyanı
Yazarların bu makale ile ilgili beyan edecekleri herhangi bir çıkar çatışması bulunmamaktadır.
Teşekkürler
Bu çalışma JSPS KAKENHI tarafından 18H02339 numaralı hibe ile desteklenmiştir.
Kaynakça
- Meric, , Hung, M. C., Hortobagyi, G. N. and Hunt, K.
- 2002. HER2/neu in the management of invasive breast cancer. J. Am. Coll. Surg. 194: 488–501. [Medline] [CrossRef]
- Korkaya, H., Paulson, A., Iovino, F. and Wicha, S. 2008. HER2 regulates the mammary stem/progenitor cell population driving tumorigenesis and invasion. Oncogene 27: 6120–6130. [Medline] [CrossRef]
- Mitri, Z., Constantine, and O’Regan, R. 2012. The HER2 receptor in breast cancer: pathophysiology, clinical Use, and new advances in therapy. Chemother. Res. Pract.2012: 743193. [Medline]
- Dai, X., Li, T., Bai, Z., Yang, Y., Liu, X., Zhan, J. and Shi, B. 2015. Breast cancer intrinsic subtype classification, clinical use and future trends. J. Cancer Res. 5: 2929–2943. [Medline]
- Koch, K. M., Reddy, N. J., Cohen, R. B., Lewis, N. L., Whitehead, , Mackay, K., Stead, A., Beelen, A. P. and Lewis,
- D. 2009. Effects of food on the relative bioavailability of lapatinib in cancer patients. J. Clin. Oncol. 27: 1191–1196. [Medline] [CrossRef]
- Sorenmo, U., Worley, D. R. and Goldschmidt, M. H. 2013. Tumors of the mammary gland. pp. 538–556. In: Withrow and MacEwen’s Small Animal Clinical Oncology, 5th ed. (Withrow, S.J., Vail, D.M. and Page, R.L. eds.), Elsevier
Saunders, St. Louis.
- Tran, M., Moore, A. S. and Frimberger, A. E. 2016. Surgical treatment of mammary carcinomas in dogs with or without postoperative chemotherapy. Vet. Comp. Oncol. 14: 252–262. [Medline] [CrossRef]
- Peña, L., Gama, A., Goldschmidt, M. H., Abadie, J., Benazzi, C., Castagnaro, M., Díez, L., Gärtner, F., Hellmén, E., Kiupel, M., Millán, , Miller, M. A., Nguyen, F., Poli, A., Sarli, G., Zappulli, V. and de las Mulas, J. M. 2014. Canine mammary tumors: a review and consensus of standard guidelines on epithelial and myoepithelial phenotype markers, HER2, and hormone receptor assessment using immunohistochemistry. Vet. Pathol. 51: 127–145. [Medline] [CrossRef]
- Novartis Pharma Tykerb interview form. http://image. jp/pdf.php?mode=1&yjcode=4291022F1026 [accessed April 27, 2020] (in Japanese).
- Veterinary Cooperative Oncology Group. 2016. Veterinary cooperative oncology group−common terminology criteria for adverse events (VCOG-CTCAE) followingchemotherapy or biological antineoplastic therapy in dogs and cats v1.1. Comp. Oncol. 14: 417–446. [Medline] [CrossRef]
- Yoshimoto, S., Kato, D., Kamoto, S., Yamamoto, K., Tsuboi, M., Shinada, M., Ikeda, N., Tanaka, , Yoshitake, R., Eto, S., Saeki, K., Chambers, J., Kinoshita, R., Uchida, K., Nishimura,
- and Nakagawa, T. 2019. Immunohistochemical evaluation of HER2 expression in canine thyroid carcinoma. Heliyon 5: e02004. [Medline] [CrossRef]
- Yoshimoto, S., Kato, D., Kamoto, S., Yamamoto, K., Tsuboi, M., Shinada, M., Ikeda, N., Tanaka, , Yoshitake, R., Eto, S., Saeki, K., Chambers, J. K., Kinoshita, R., Uchida, K., Nishimura, R. and Nakagawa, T. 2019. Detection of human epidermal growth factor receptor 2 overexpression in canine anal sac gland carcinoma. J. Vet. Med. Sci. 81: 1034–1039. [Medline] [CrossRef]
- Yoshimoto, S., Kato, D., Kamoto, S., Yamamoto, K., Tsuboi, M., Shinada, M., Ikeda, N., Tanaka, , Yoshitake, R., Eto, S., Saeki, K., Chambers, J., Hashimoto, Y., Uchida, K., Nishimura, R. and Nakagawa, T. 2020. Overexpression of human epidermal growth factor receptor 2 in canine primary lung cancer. J. Vet. Med. Sci. 82: 804–808. [Medline] [CrossRef]
- Singer, , Weichselbaumer, M., Stockner, T., Mechtcheriakova, D., Sobanov, Y., Bajna, E., Wrba, F., Horvat, R., Thalhammer,
- G., Willmann, M. and Jensen-Jarolim, E. 2012. Comparative oncology: ErbB-1 and ErbB-2 homologues in canine cancer are susceptible to cetuximab and trastuzumab targeting. Mol. Immunol. 50: 200–209. [Medline] [CrossRef]