Ping Zhang 1, Ting Han 2, Hui Xia 3, Lijie Dong 2*, Liuqing Chen 1* ve Li Lei 1
1 Wuhan 1 No’lu Hastane, Dermatoloji Bölümü, Tongji Tıp Fakültesi, Huazhong Bilim ve Teknoloji Üniversitesi, Wuhan, Çin, 2 Malzeme Bilimi ve Mühendisliği Fakültesi, Wuhan Teknoloji Üniversitesi, Wuhan, Çin, 3 Wuhan 1 No’lu Hastane, Hepatobiliyer Cerrahi Bölümü, Tongji Tıp Fakültesi, Huazhong Bilim ve Teknoloji Üniversitesi, Wuhan, Çin
Geniş kapsamlı kanser tedavileri üzerinde yoğun bir şekilde çalışılmaktadır. Geleneksel tedavi yöntemleri (örn. radyoterapi, kemoterapi) tümörleri yok etmesine rağmen kaçınılmaz biçimde normal hücrelere de zarar vermekte ve ciddi komplikasyonlara neden olmaktadır. Fotodinamik terapi (FDT), travma oranının düşük olması, hedefi hassasiyetle belirlemesi, sinerjizmi ve tekrar edilebilirliği ile tümör tedavisinde büyük avantajlar sunmaktadır. Son yıllarda, nanoteknoloji tabanlı PDT kanser tedavisi için yeni bir model olarak karşımıza çıkmaktadır. FS’lerin nanoteknoloji ile doğrudan modifikasyonu veya FS’lerin nanotaşıyıcılar yoluyla iletilmesi, tümörleri hedef almayı, özgüllüğü ve PDT’nin verimliliğini artırabilir. Bu makalede, okuyucuya PDT’de kullanılan fotosensitizerlerin ve nanomateryallerin türleri, özellikleri ve araştırma sürecinin çeşitli yönleri hakkında kapsamlı ve genel bir bakış sağlamaya çalıştık. Ayrıca melanom olmayan deri kanseri ve melanomda nanoteknolojik PDT’nin uygulanma süreci ve buna bağlı kısıtlamalar da ele alınmıştır.
Anahtar Kelimeler: fotodinamik terapi, fotosensitizer, nanoteknoloji, nanopartikül, melanom olmayan deri kanseri, metastatik melanom
GİRİŞ
Fotodinamik tedavi (FDT), güvenilirliği ve etkinliği kanıtlanmış, non-invaziv veya minimal invaziv bir tedavidir. FDT, 2011 yılında ABD’de Amerikan Ulusal Gelişmiş Kanser Ağı (NCCN) tarafından erken özofagus kanseri tedavisinde birincil yöntemlerden biri olarak kabul edilmiştir. FDT stratejisinin denendiği diğer tümörler arasında mide kanseri, kolanjiyokarsinom, baş ve boyunda skuamöz hücreli karsinom, erken servikal kanser veya prekanseroz ve ürolojik maligniteler vb. yer almaktadır (1). Günümüzde FDT, deri kanseri ve prekanseröz lezyonlarda gözle görülür kozmetik etki ile birlikte yaygın ve gelişmiş bir şekilde kullanılmaktadır.
FDT, patolojik dokularda yoğun bir şekilde biriken fotosensitizerlerin (PS’ler), belirli bir dalga boyundaki ışık kaynakları aracılığıyla ışınlanması ile sitotoksik maddeler üretmesi prensibine dayanır ve patolojik hücreleri öldürmek, mikrovasküler hasarı indüklemek ve immün yanıtları harekete geçirmek için hedef dokular üzerinde etkisini gösterir. FDT’nin iki çeşit foto-oksidatif mekanizması vardır: PS’ler, radyan enerjiyi absorbe ettikten sonra singlet temel halinden uyarılmış singlet hale dönüşür ve daha sonra kısmi enerji PS’lerini uyarılmış triplet hale dönüştürür. Bir taraftan, PS’ler enerjiyi çevreleyen biyomoleküllere aktarabilir, böylece reaktif oksijen türleri (ROS) daha fazla üretilir ve tümör hücreleri bu fotodinamik reaksiyonlar aşamasında yok edilir (Tip I); diğer taraftan, PS’ler enerjiyi doğrudan temel haldeki oksijen moleküllerine aktararak singlet oksijen (1O2, Tip II) oluşumunu sağlar. Tip II reaksiyon en önemli süreç olmakla birlikte, mevcut oksijen miktarı azaldıkça Tip I mekanizması da önemli rol oynar (2). FDT temel olarak; tümör hedefli FDT, vasküler hedefli FDT (VTP) ve anti-mikrobiyal FDT şeklinde sınıflandırılmıştır. Çoğu FDT hücresel hedefli fotokemoterapiye dayanmaktadır. VTP diğer iki yöntemden daha farklıdır ve vaskülatürde, özellikle endotel hücrelerinde oksidatif hasara neden olur ve selektif olarak vasküler fonksiyonu bozar. Ayrıca, VTP-PS’ler çoğunlukla dolaşım içerisinde kalır (3). Mikroorganizmalar, enfeksiyonlarla ilişkili ve oldukça iyi organize olmuş biyofilm ekosistemlerinde çoğalır. FDT, hücre zarında hasar, DNA hasarı ve protein/enzim inaktivasyonu gibi birden fazla hedef bölgeye aynı anda etki ederek biyofilm üreten patojenlerin etkisini ortadan kaldırır. Ayrıca, gram-negatif ve pozitif bakteriler, mantarlar, virüsler ve parazitlere karşı da kullanılmaktadır (4). Bu makalede, FDT’de kullanılan fotosensitizerlerin ve nanomateryallerin türleri, özellikleri ve bunların araştırma süreci incelenmiş ve ayrıca, melanom olmayan deri kanseri ve melanomda nanoteknolojik FDT’nin uygulanmasına ilişkin sonuçlar özetlenmiştir.
PS’LERİN ARAŞTIRILMA SÜRECİ
1980’lerden bu yana, FDT sistematik olarak incelenmiş, bir dizi PS ve ışık kaynağı geliştirilmiştir. PS, fotonları emebilen ve enerjiyi moleküllere aktarabilen, böylece kimyasal reaksiyonlara dahil olmadan onları hızlandıran bir bileşiktir (5).
Genel olarak, PS’ler üç nesle ayrılır. Birinci nesil PS’ler (PS1) ağırlıklı olarak porfirin bileşiklerini içermektedir. Bu bileşiklerin kimyasal saflığı düşük, doku penetrasyonu ve selektivitesi zayıf, vücutta kalma süresi uzun olduğundan kullanımları da sınırlıdır.
İkinci nesil PS’lerin (PS2) yapıları PS1’inkilere kıyasla daha nettir ve PS2’nin fotosensitize edici etkisi, absorpsiyon spektrumları ve derin yerleşimli dokulara penetrasyonu belirgin ölçüde daha iyi hale getirilmiştir (2, 6). PS2, porfirin türevlerini (örn. 5-Aminolevulinik asit, 5-ALA), klorini (örn. Temoporfrin/m-THPC, bakteriyoklorin türevi) ve metalik ftalosiyaninleri (PC’ler) içerir. 5-ALA, protoporfirin IX’un (PpIX, ışığa duyarlı yüksek aktiviteye sahip) öncü maddesidir, bu nedenle 5-ALA; port-wine lekesi, şiddetli akne, siğiller, cSCC ve prekanseröz lezyonlarda sıklıkla kullanılmaktadır (7).
Porfirinlerle karşılaştırıldığında, klorinler daha düşük fototoksisiteye, yüksek molar absorpsiyon katsayısına, yüksek 1O2 formasyonu verimliliğine ve 650-800 nm’de maksimum absorpsiyon dalga boyuna sahiptir, bu da doku penetrasyon derinliğini 1 cm’ye kadar çıkarmaktadır. Araştırmacılar, klorofil türevlerinin alkleter analoglarını, 2-[1- Hexyloxyethyl]-2-devinyl pyropheophorbide-a (HPPH) tek kimyasal yapısıyla, yüksek uyarımlı dalga boyuyla ve yüksek fotostabilitesiyle sentezlemişlerdir. Chen ve ark. HPPH için bir sıçan PBPK modeli geliştirmiş ve sindirim kanseri ile deri kanserinin tedavisi için ışığa maruz kalmanın uygun zaman aralığının sırasıyla 24-48 saat ve 48-96 saat olduğunu kanıtlamıştır (8). Dört N atomu ile bağlanmış dört pirol biriminden oluşan büyük konjuge sistemler olan Pc’ler, çeşitli malzemelerle fonksiyonel hale getirilebilir. Pc’ler ile geçiş metalleri olmayan metallerin (Zn, Al, Si) oluşturduğu karmaşık yapılar, tümöre karşı fotobiyolojik etki gösterir. Bazı PC’ler 750-900 nm’de güçlü absorpsiyon sergiler, melanomun ışık geçirgenlik oranı bahsedilen aralıkta belirgin bir şekilde yüksektir ve absorpsiyon 630nm dalga boyunun neredeyse iki katı kadar artmaktadır. Daha önce belirtildiği gibi, PC’ler daha güçlü reaktif oksijen türleri (ROS) oluşturmaları ve daha iyi spektroskopik özellikleri nedeniyle porfirinlere kıyasla melanomaya karşı FDT’de tümör hücresi fotokillingi ve karanlığa bağlı toksisitenin azaltılması açısından daha etkili olmuştur (9, 10). PS’ler güçlü hidrofobikliğe ve agregatlaşma eğilimine sahiptir, böylece FDT’nin etkinliğini azaltır, ancak PS2 bu dezavantajların üstesinden gelmek için çekirdek veya periferik modifikasyon ile yeniden fonksiyonel hale getirilebilir. Bilim insanları şekere bağlı çinko Pc (ZnPcs) sentezlemiş ve çözeltideki C-glikozit-modifiye Pc’lerin agregasyonunun büyük ölçüde azaltılabileceğini ve böylece PS’lerin stabilitesinin artırılabileceğini tespit etmiştir.
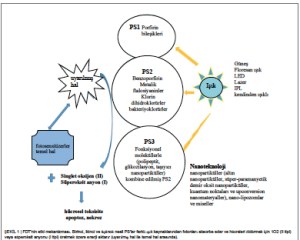
PS3, biyouyumluluğu ve hedef belirlemeyi iyileştirmek için taşıyıcı olarak polipeptitler, glikosile bileşikler ve nanopartiküller (NP’ler) dahil olmak üzere fonksiyonel moleküllerle kombine edilmiş PS2 bileşiklerdir (11). Kanser hücrelerinin hızlı çoğalması için çok sayıda karbonhidrat bileşiği gerekir ve bu nedenle glikosile PS’ler doğal olarak kanser hücrelerini daha iyi hedefler ve suda daha iyi çözünür. İnaktive edici PS’ler, kanser hücreleri üzerindeki spesifikliğini artırmak amacıyla PS’leri aktive etmek için bir söndürücü madde veya pH sensörü gibi yardımcı bir ilaç ile konjüge edilir. Muttaqien ve arkadaşları, FDT için pH’a duyarlı faz geçişi sağlayan daha düşük çözelti sıcaklığına sahip polimerler geliştirmiştir. PS-polimer konjügat önemli derecede yüksek hücresel tutulum göstermiş ve FDT’nin etkinliğini tümör pH’ına göre selektif bir şekilde artırmıştır (12, 13). PS’lerin etki mekanizması Şekil 1’de gösterilmiştir.
NANOTEKNOLOJİ
Polimerize PS’ler-NP’ler en çok çalışılan PS3’lerdir ve genellikle PS’ler ile polilaktik asit, poli-D-lizin, polikaprolakton ve jelatin gibi polimerler arasındaki hidrofobik veya elektrostatik etkileşimler yoluyla üretilirler (14). Tümörlü anjiyogenez, normal kan damarlarından yapı ve morfoloji olarak farklıdır, endotel hücreler arasında daha büyük
boşluklar vardır; ve tümörlerde lenfatik olmaması, artmış geçirgenlik ve alıkonma etkisi (EPR) olarak da bilinen lenfatik reflüksü önler, sonuç olarak NP’ler veya diğer makromoleküler maddeler tercihen tümör bölgelerinde göreceli olarak uzun süre birikebilir, böylece FDT’nin verimliliğini artırır ve periferik normal dokudaki yan etkileri azaltır.
PS’ler nanoteknoloji ile doğrudan modifiye edilebilir veya NP’ler, nanolipozomlar (LP’ler) ve nanohidrojel partikülleri gibi nanotaşıyıcılar ile iletilebilir. NP’ler arasında altın NP’ler (GNP’ler), Süperparamanyetik demir oksit NP’ler (SPION’lar), kuantum noktaları (Qd’ler) ve upconverting nanomateryal vb. yer almaktadır (15).
NP’ler
NP’ler, yeni nano-PS’ler elde etmek için PS’lerle birleştirilebilir. Geleneksel PS’lerle karşılaştırıldığında, nano-PS’ler küçük boyut, geniş spesifik yüzey alanı, yüksek katalitik etki, daha fazla aktif merkez sayısı ve güçlü adsorpsiyon kapasitesi gibi birçok avantaja sahiptir (16).
İyi biyouyumluluk ve hipotoksisiteye sahip GNP’ler genellikle SPION’lar için pasifleştirici ajanlar ve PS’ler veya antikarsinojen için taşıyıcılar olarak kullanılır (17). Polietilen glikol (PEG) ile modifiye edilen GNP’ler, çözünürlüğü ve protein adsorpsiyonuna direnci artırma ve retiküloendotelyal sistem tarafından uzaklaştırılmayı önleme yeteneğine sahiptir, böylece ilaçların in vivo kalma süresini uzatır. GNP’ler, FDT’de tümör-fotosensitize edici bir rol oynayıp oynamadıklarına göre pasif ve aktif tiplere ayrılır. Esas olarak ilaç taşınması için kullanılan pasif GNP’lerin PS’lerin etkinliği üzerinde kayda değer bir etkisi yoktur. Buna karşılık, aktif GNP’ler PS uyarımını ve ROS üretimini artırmak için ışık enerjisini etkili bir şekilde absorbe edebilir. Temsili aktif GNP’ler, altın nanorodlar (AuNR’ler), kabuklar ve küpler gibi plazma aktif NP’lerdir (18). Bazı GNP’ler, yakın kızılötesi ışığı etkili bir şekilde absorbe edebilen ve fotonları ısı enerjisine dönüştürebilen güçlü plazmonik rezonans bantlarına sahiptir, böylece kanser hücrelerinde geri dönüşü olmayan yüksek sıcaklı ablasyona neden olur (19).
GNP’ler kimyasal inertlikleri ve minimal toksisiteleri dolayısıyla çeşitli biyolojik uygulamalar kapsamında incelenmiştir. Li ve arkadaşları (20), elektrostatik kuvvet yoluyla AuNR’ler-AlPc’ler oluşturmak için negatif yüklü sülfonlanmış alüminyum Pc’lere (AlPc’ler) bağlanan pozitif yüklü hekzadesil dimetilamonyum bromür kaplı AuNR’ler önermişlerdir. Bu yapılar 5 kat daha güçlü fluoresansa sahipti ve QGY karaciğer kanseri hücrelerinde normal ışık dozuna bağlı FDT aracılığıyla hasara neden oldu. Bu sinerjik reaksiyon aynı anda fotodinamik algılamayı ve tedavi verimliliğini de artırmıştır.
Qd’ler güçlü ve çok yönlü biyolojik görüntüleme problarıdır. Qd’ler geniş ışık absorpsiyon bantlarına, ikili foton absorpsiyon kesitlerine ve ışık direncine sahiptir. Biyolojik sistemdeki kromoforlar oldukça karmaşıktır. Farklı enerji yoğunluklarına sahip fotonlar, farklı elektron geçişleri ve fotolüminesans (PL) reaksiyonu üretmek için farklı kromoforlarla rezonansa girebilir, bu nedenle Qd’lerin değiştirilebilir PL spektrumu, çeşitli tümör dokularının gereksinimlerini karşılayabilir (21). Bununla birlikte, Qd’ler geleneksel PS’lerden daha düşük ROS verimine sahiptir ve bazıları toksik kadmiyum içerir, bu nedenle Qd’ler ve PS’ler birbirini tamamlayan modalitelerdir ve birlikte kullanıldıklarında avantajları artar. Samia ve arkadaşları (22) “FDT için Qd’ler-PS” fikrini önermişlerdir. Spesifik biçimde, enerji verici Qd’ler alıcı olarak geleneksel PS’lerle floresans rezonans enerji transferi (FRET) üretir. Kovalent olarak bağlı olmayan Qd’ler-Pc4 komplekslerinin ROS üretimini arttırdığı tespit edilmiştir.
Bugüne kadar, Qd’ler-porfirinler, Qd’ler-Pc’ler ve Qd’ler-organik veya inorganik boyalar gibi bir dizi Qd’ler-PS sistemi geliştirilmiştir. Yüksek kuantum verimine sahip Qd’ler genellikle suda düşük çözünürlüğe sahiptir ve bu nedenle çözünürlüklerini iyileştirmek için yüzey modifikasyonu gereklidir. Karabanovas ve arkadaşları (23) klorin e6 (Ce6) ile yüklenmiş ve fosfolipidlerle kaplanmış CdSe/ZnS Qd’ler hazırlamış ve bu bileşiklerin suda çözünürlüğü ve kolloidal stabilitesi büyük ölçüde artmıştır.
Suda çözünür Qd’lere konjüge edilen PS’ler, Qd’lerden PS’lere FRET ile sonuçlanır ve böylece FDT’nin etkisini artırır (24). Yueshu ve arkadaşları (25) CuInS2/ZnS (CIS/ZnS) Qd’leri 5-ALA ile koordine ederek kimyasal bağ yoluyla CIS/ZnS-5-ALA konjugatları oluşturmuştur. Yapılan analizler, konjugatların FRET etkinliğinin %58,49 olduğunu ve 800 ve 1300 nm femtosaniye uyarımından sonra in vitro hücrelerin canlılığının %40’tan az olduğunu ortaya koymuştur. Li ve arkadaşları (26) AlPcS’lerin elektrostatik bağlanma yoluyla amin-dihidrolipoik asit kaplı Qd’lerle konjugasyonunu bildirmiş ve serbest AlPcS’lerle karşılaştırıldığında, AlPcS-Qd bileşiklerinin insan nazofaringeal karsinom hücrelerinde (KB hücreleri) tutulum oranını büyük ölçüde artırdığını ve %84 oranında FRET elde ettiğini ortaya koymuştur.
SPION’lar, çekirdekleri demir oksit NP’leri (esas olarak Fe3O4 ve Fe2O3 içeren) olan manyetik parçacıklardır. SPION’ların boyutları mıknatıslanma yoğunluk indeksleri ile doğrusal olarak ilişkilidir (27). Yapılan çalışmalar, kristal çekirdek çapı <10 nm olan SPION’ların süperparamanyetik özellikler sergilediğini göstermiştir. Bununla birlikte, normal dokulardaki mikrodamarların minimum gözenek boyutu yaklaşık 10 nm’dir ve bu nedenle, partikül boyutunun aşırı küçük olması ilaç sızıntısına yol açabilir ve sedimantasyon hızını etkileyebilir. Bunun aksine, dokulardaki >200 nm partiküller fagositik sistem tarafından kolayca absorbe edilmektedir (28), bu nedenle SPION’ların uygulanmasında boyutun doğru seçilmesi gerekmektedir. En iyi stabiliteye ve manyetizmaya sahip olan 10-100 nm boyutundaki manyetik NP’ler ilaç taşımada etkili olabilir (29). FDT uygulanırken porfirinleri ve porfirin olmayan öncül ilaçları hedef noktalara ulaştırmak için başarıyla kullanılmışlar ve böylece çok işlevli SPION-PS konjugatlarının geliştirilmesini sağlamışlardır (30). Daha iyi özellikler elde etmek için, SPION’ların genellikle yüzeyi modifikasyona uğratılıp çeşitli fonksiyonel gruplarla daha da işlevsel hale getirilir (31); bunlar arasında esas olarak sentetik polimerler (örn. PEG), nötr polimerler (örn. dekstran, kitosan), inorganik metaller, inorganik oksitler (örn. silika) ve biyoaktif moleküller (örn. lipozomlar) yer alır. Leyong ve arkadaşları (32) 980 nm lazer ile ışınlama altında MCF-7 hücrelerinin %70’ini öldürebilen SPION’lar, upconverting NP’ler (UCNP’ler) ve AlPcS4’ten oluşan çok bileşenli nanokompleksler geliştirmiştir. He ve arkadaşları (33) kolorektal kanser modellerinde görüntüleme için bimodal kontrast ajanları olarak hemaglutinin bağlı Fe3O4@GNP’leri sentezlemiştir. Wei ve arkadaşları (34) güçlü aVb3 integrin reseptörü ile HepG2 hücrelerini görüntülemek için kimyasal yöntemlerle integrin reseptörü hedefli bir cRGDfK-SPION nanomoleküler prob oluşturmuş ve sonuçlar cRGDfK-SPION’un HepG2 hücrelerinde in vitro olarak belirgin şekilde akümülasyon sağladığını ortaya koymuştur.
Özel yapı-düzenli gözenek ağından yararlanan silika bazlı mezogözenekli malzemeler, PS’lerin veya ilaçların kontrollü bir şekilde yüklenmesini ve salınmasını sağlayabilir. Pc4-manyetik NP’ler ile konjuge edilmiş çok işlevli nanokompozitler, FDT uygulamasında potansiyel ilaçlar olarak kullanılmıştır. Gauta ve meslektaşları (35) ZnPc-AMNPs-FA konjugatları oluşturmak için folik asit ve amin fonksiyonlu manyetik NP’lere bağlı ZnPc bildirmiş ve bu yapılar hem harici bir manyetik alan yardımıyla tümör bölgelerinde lokalize olmuş hem de MRG ile birlikte hedeflenen FDT modlarının sağladığı avantajlardan faydalanmıştır. Refilwe ve arkadaşları (36) ZnTPPcQ-DNDs-BODIPY’yi (ZnPc, nanodiamond ve halojenli BODIPY ile konjuge edilmiş), zaman ilişkili tek foton sayma yöntemlerinden elde edilen fluoresans yaşam sürelerini test ederek su çözeltisinde daha yüksek 1O2 kuantum verimliliğine sahip PS’ler şeklinde geliştirmiştir, böylece üç bileşenli nano yapı serbest bireysel bileşenlerden daha iyi çalışmıştır.
UCNP’ler, güçlü doku penetrasyonuna sahip yakın kızılötesi ışığı (NIR) UV veya görünür ışığa (VIS) dönüştürebilir. Ayrıca, geleneksel FDT’deki sığ doku penetrasyon derinliği sorununu çözmesi planlanan NIR ile aktive edilen FDT için ışığı dönüştürebilir. Benzersiz bir ışık dönüştürme malzemesi olarak UCNP’ler düşük toksisite, düşük absorpsiyon bandı, uzun absorpsiyon ömrü, fotosoldurma direnci, arka planda otofloresan olmaması gibi güçlü özelliklere sahiptir. Ayrıca, biyolojik görüntüleme, biyoalgılama ve ilaç salınım kontrolünde önemli bir potansiyele sahiptir. Buna ek olarak, taşıyıcı yüklü PS’ler olarak UCNP’ler, hidrofobik PS’lerin kolay topaklanmasını önleyebilir. UCNP’ler, EPR etkisi ile tümör bölgelerinde etkili olabilir (37, 38).
SiO2 kaplama, kendi kendine birleştirme ve kovalent bağlama UCNP-PDT sistemi oluşturmak için kullanılan üç yaygın yöntemdir. Zhang ve arkadaşları (39) derin nüfuz eden yakın kızılötesi dalga boylarını görünür dalga boylarına dönüştürebilen mezogözenekli silika kaplı UCNP’ler inşa etmiştir. Bu çalışmada, iki tip PS (MC 540 ve ZnPc) ile yüklü kompozitler, 980 nm ışık kaynağı ile uyarılan UCNP’lerin polikromatik emisyonunu kullanarak ROS verimini artırmak ve PDT etkilerini geliştirmek için tasarlanmıştır. Chen ve arkadaşları (40) sığır serum albümini (BSA) ile kaplanmış kompleksler (UCNP@BSA-RB&IR825) oluşturmuş ve bu komplekslerin fizyolojik ortamda çözünürlüğünü ve stabilitesini geliştirmiştir.
BSA katmanına eş zamanlı olarak rose bengal (RB) ve IR825 yüklenmiştir. NIR altında, bu ikili boya yüklü UCNP’ler in vivo ikili model görüntüleme için kullanıldı; bu arada, fototermal terapi (FTT)/FDT sinerjik olarak kanser hücrelerini yok etti. UCNP-PDT sisteminde, UCNP’ler ve PS’ler sırasıyla enerji vericisi ve alıcısı olarak hareket eder. Ce6 ve UCNP-NaYF4:Yb, Er@CaF2 tümör pH’ına duyarlı kompozitlere monte edilmiş ve 980 nm uyarımdan sonra NaYF4:Yb, Er@CaF2 675 nm’de dönüşümlü floresan üretmiş, bu da Ce6’nın düşük pH mikroçevresinde derin tümör dokularını selektif bir şekilde öldürmek için ROS üretmesine yol açmıştır (41). UCNP’ler üzerindeki PS’lerin yakın yükü ve yoğun içeriği, UCNP-PDT’nin enerji aktarım etkinliğini artırmanın anahtarıdır.
LP’ler ve Miseller
LP’ler, sulu ortamda dağılan fosfolipitlerin kendiliğinden oluşturduğu tek veya çok lamelli nanosistemlerdir ve LP’ler EPR etkisi yoluyla tümör hücrelerinde pasif olarak birikir (42). Bazı LP’ler biyouyumlu ve biyolojik olarak parçalanabilirdir ve çeşitli hidrofilik ve hidrofobik ilaçlarla bağlanabilirler. Bu bileşenler arasında, PEG ile kaplanmış LP’ler kan dolaşımında daha uzun süre kalırlar ve bu nedenle ilacın taşınması için geniş çapta incelenmiştir (43).
Lipozomal preparat PS’lerin agregasyonunu etkili bir şekilde önleyebilir ve böylece fotoaktivitelerini artırabilir. NIR’ye yanıt olarak boyayı serbest bırakan ICG serisine yüklenmiş PS’ler, meme kanseri modelinde tümör büyümesini serbest boyaya göre daha fazla baskılama kabiliyeti göstermiştir (44). Bilim insanları, FDT aracılığıyla ROS üretimi ile DNA’da hasara yol açan ve üçlü-negatif meme kanseri hücre hatları (MDA-MB-468, HCC-1806) üzerinde güçlü inhibitör etki gösteren ICG kaplı fototermal-duyarlı LP’ler hazırlamışlardır (45). LP’lerin yüzeyine hedef belirleyici moleküllerin bağlanması, LP’lerin belirli dokulara veya hücre tiplerine seçici olarak bağlanmasını sağlamıştır. Kemoterapinin etkisi, anti-kanser ilaçlarının biyo-yararlı formda sınırlı emilimi ile kısıtlanmaktadır. LP’ler, birlikte dağıtım sistemleri oluşturmak için PS’leri ve ilaçları aynı anda entegre edebilir. Doksorubisin (Dox) yüklü porfirin-fosfolipid LP’lerin (Pop-LPs-Dox) dolaşımdaki yarı ömrünün ve depolama stabilitesinin uzun sürdüğü bildirilmiştir. Pop-LPs-Dox, yakın kızılötesi ışınlama altında fare subkutan pankreas ksenograftlarına (3-7 mg/kg Dox) enjekte edilmiş ve sonuçlar tümörlerde 7 kat daha fazla Dox birikimi olduğunu ortaya koymuştur (46). Hızlı tümör büyümesi ve artan oksijen tüketimi nedeniyle, hipoksi mikro ortamı FDT’nin etkinliğini büyük ölçüde kısıtlamaktadır. Shi ve arkadaşları (47), tümörlerde oksijenasyonu artıran ve intratümöral H2O2 katalizi yoluyla 1O2 üretimini hızlandıran kompleksler oluşturmak için katalaz, lizoz hedefli NIR-PS ve Dox’u LP’lerde kapsüllemiş, böylece tümör hücrelerinde apoptozu önemli ölçüde indüklediği tespit edilmiştir.
Micelles are self-assembled nanoscale colloidal particles with a hydrophobic core and hydrophilic shell. PS-loaded polymeric micelles are characterized by a long bleeding cycle time and high accumulation in diseased tissues. Many PSs can be used in combination with LPs or micelles for PDT (48). Wu et al. (49) confirmed that porphyrin- and galactosyl-conjugated polymer micelles had better targeting and PDT efficiency in HepG2 cells.
Elbayoumi ve arkadaşları (50) tetrafenilporfirin (TPP) yüklü PEG-PE misellerinin tek başına TPP’den daha fazla sitotoksisiteye ve MCF-7 hücrelerinde daha iyi hedeflemeye sahip olup olmadığını araştırmışlardır. Deng ve arkadaşları (51) PEGile iridyum bazlı nanomiseller (IP600-IP4000 NPs) oluşturmuş ve misel stabilitesinin PEG uzunluğu arttıkça yükseldiğini ve hücresel tutulumun PEG uzunluğu arttıkça düştüğünü tespit etmiştir. IP2000 ve IP4000 NP’ler mükemmel biyouyumluluğa sahipti ve yapılan detaylı analizler IP2000 NP’lerin FDT’de yüksek terapötik etkinlik gösterdiğini ortaya koydu.
PS’leri taşıyan miseller kan dolaşımı sırasında endotel hücrelerine ve komşu damar hücrelerine zarar vererek fototoksisiteye neden olabilir; bu nedenle hedeflenmeyen bölgedeki yan etkilerin azaltılması gerekmektedir (52). Li ve arkadaşları (53) PS olarak feoforbit A (PhA) ve basit fiziksel birleştirme yoluyla antioksidan b-karoten (CAR) içeren PEG-b-poli (kaprolakton) miselleri tasarlamıştır. CAR, kan dolaşımında PhA tarafından üretilen 1O2’yi ortadan kaldırmış ve fototoksisiteyi azaltmıştır. Miseller tümör hücreleri tarafından yutulduğunda, PhA ve CAR’ın uzaysal izolasyonu 1O2’nin yok edilmesini engelleyerek tümör hücresi ölümüne yol açmıştır. Bu strateji, kanser tedavisinde FDT’nin etkinliğini ve güvenliğini güçlendirmiştir.
Nanomalzemelerin avantajları ve dezavantajları bakımından, GNP’lerin hazırlanması kolaydır, ancak biyouyumlulukları zayıf olduğu için çıkarılmaları oldukça yavaştır. QD’ler kombine etiketleme, tespit ve tedaviye izin verebilir, ancak bazı QD’ler ağır toksik metaller içerir. UCNP’ler, ilaç yükünün zayıf olması ve düşük upconversion verimliliği nedeniyle in vitro kullanımla sınırlı kalmaktadır. Miseller, hidrofobik ilaçları iletmek için yaygın olarak kullanılmaktadır, ancak in vivo stabilitelerinin iyileştirilmesi gerekmektedir.
DERİ KANSERİNDE NANO-FDT UYGULAMASI
Patolojik bulgular baz alındığında, skuamöz hücreli karsinom (SCC), bazal hücreli karsinom (BCC) ve malign melanom (MM) en sık görülen deri kanserleri arasındadır. Paget hastalığı, sarkom ve kutanöz T/B-hücreli lenfoma gibi diğer deri kanserleri nispeten nadirdir. Hücrelerin kökenine göre, deri kanseri de iki türe ayrılabilir: MM ve melanom olmayan deri kanseri (NMSC). Epidemiyolojik analizler, 2018 yılında dünya genelinde her 100.000 kişide tahmini 300 deri kanseri vakası olduğunu ortaya koymuştur (54). Deri kanseri, çevre kirliliği ve diğer olumsuz faktörler nedeniyle Kafkas kökenli kişilerde yaygındır, ancak Çin’de deri kanseri insidansı da her yıl artmaktadır. Kutanöz SCC (cSCC) deri tümörlerinin yaklaşık %20’sini oluşturmaktadır (55). Primer cSCC cerrahi ile başarılı bir şekilde tedavi edilebilmesine rağmen, cSCC’li hastaların %5’inde tam rezeksiyondan sonra metastaz veya lokal nüks görülmektedir.
MM’nin görülme oranı hızla artmaktadır. Her yıl dünya çapında tahmini 280.000 yeni MM vakası ve 60.000’den fazla ölüm görülmektedir. Küresel olarak, MM’nin morbidite ve mortalitesinde önemli farklılıklar vardır ve bu farklılıklar esas olarak hastalığın teşhis ve tedavisinin ne zaman yapıldığıyla ilgilidir (56). MM için geleneksel tedaviler cerrahi, kemoterapi ve radyoterapiyi kapsamaktadır. Son yıllarda, hedefe yönelik tedavi ve immünoterapi, sağkalımı uzatma ve hastaların yaşam kalitesini iyileştirme konusunda önemli ilerlemeler kaydedilmiştir. Topikal tedavi, hastalıklı bölgelerdeki lokal ilaç konsantrasyonunu artırabilir, ayrıca sistemik ilaç tedavisine göre daha az toksisite riski taşır, bu da sistemik tedaviye yardımcı bir yöntemdir.
2010 yılında, Norveç Fotodinamik Terapi Grubu ve tıp uzmanları, NMSC’de topikal FDT’nin pratik kullanımı için kılavuzlar sunmuştur (57). PS’ler seçici olarak lezyonlarda toplanabilir ve spesifik biyolojik etkiler üretebilir. Bu önemli özellik, PDT’ye deri kanserinde hedefe yönelik tedavi için büyük umut vermektedir. PS’ler hastalara topikal, oral veya intravenöz olarak verilmektedir.
5-ALA ve metil aminolevulinat (MAL, ALA ile karşılaştırıldığında lipid çözünürlüğü artmıştır) FDA tarafından dermatolojik endikasyonlar için onaylanmıştır, ancak ön ilaçlar olarak, ışınlama üzerine hücre ölümünü indüklemek için tercihen endoplazmik retikulumda lokalize olan aktif PpIX’e dönüştürülmeleri gerekir. PpIX’in ana absorpsiyon piki 410-420 nm’de mavi ışık aralığında meydana gelir, ancak 5-ALA’yı aktive etmek için daha küçük absorpsiyon pikleri olan diğer dalga boyları da kullanılabilir. Mavi ışık kaynağı, potasyum titanil fosfat lazer, darbeli boya lazer ve yoğun darbeli ışığın FDT uygulamaları oldukça geniştir. Dalga boyu 630 nm olan kırmızı ışık (örn. helyum-neon lazer) da bazı araştırmalarda ışık kaynağı olarak kullanılmıştır (58). Genel olarak, ışığın cilde nüfuz etme derinliği dalga boyları uzadıkça artar ve bu nedenle kırmızı ışık ve NIR daha kalın lezyonlar için daha etkilidir.
FDT’nin optimizasyonu uygun ışık parametrelerine, oksijene, PS’lerin dokulardaki kinetik dağılımına ve konsantrasyonuna bağlıdır, ancak 5-ALA’nın düşük deri penetrasyonu FDT’nin etkinliğini sınırlamaktadır. Champeau ve arkadaşları (59) deri kanserinde PS’lerin/ilaçların penetrasyonunu ve PpIX metabolizmasını iyileştirmek için kimyasal (nanoteknoloji içeren) ve fiziksel stratejileri incelemiştir.
Deri Bariyerleri ve İlacın Nüfuz Etmesi
Topikal ilacın deriye nüfuz etmesini artırma yöntemleri arasında stratum corneum kalınlığının değiştirilmesi ve deri bariyerlerinin kimyasal emilimi de yer almaktadır ve bu stratejiler dahilinde ablatif fraksiyonel lazer (AFL), PS alımını kolaylaştırmak için deri yüzeyinde mikrokanallar oluşturabilir. Bilim insanları, AFL yoluyla ilaç iletimini artırmak amacıyla epidermiste dikey mikro gözenekler oluşturmak için üç grup uzak kızılötesi dalga boylu lazer (10.600 nm dalga boylu CO2 lazer, 2940 nm dalga boylu Er: YAG lazer ve 2790 nm dalga boylu Er: YSSG lazer) kullanmışlardır; aynı zamanda mikro gözeneklerin derinliği lazer enerji yoğunluğu ile kontrol edilebilmektedir. Anderson’ın grubu aktinik keratozlu (AK, şiddet derecesi I-III) 212 hastayı tedavi etmek için MAL krem ile birlikte AFXL (atım başına 10 mJ, 0,12 mm spot, %5 yoğunluk; UltraPulse-DeepFx, Lumenis Inc.) kullanarak randomize bir klinik çalışma yürütmüştür (60). 3 aylık takipten sonra, AFXL-PDT tüm AK dereceleri için FDT’den belirgin şekilde daha etkili olmuştur. Fraktoinal fototermoliz teorisine göre, AFL, konsantre noktaları düzinelerce ila yüzlerce küçük odak noktasına dağıtan bir görüntü jeneratörü ile donatılmıştır, hedef dokuları matris modunda buharlaştırabilir, böylece ısı hasarı olan bölgeler arasındaki deri dokuları etkilenmez, bununla birlikte derinin iyileşmesi kolaylaşır. AFL, PS’lerin geçirgenliğini artırsa da, sekonder deri enfeksiyonu, inflamatuar hiper/hipopigmentasyon ve skarlaşma gibi bazı dezavantajları da vardır (61).
Farklı materyallere ve şekillere sahip mikroiğneler (MN’ler) kutanöz iletimi artırabilir. Ayrıca, 900 mm’den kısa MN’ler derin kan damarlarına ve sinirlere zarar vermez, bu da riskin düşük ve ağrının az olmasını sağlar (62). Wu ve çalışma arkadaşları, lokalize nöropatik ağrıyı tedavi etmek amacıyla kalsitonin geniyle ilişkili peptid antagonistini transdermal olarak vermek için çözünebilir MN’ler içeren analjezik bir MN yaması oluşturmuştur. Yapılan çalışma, AMN yamalarının deri tahrişine veya sistemik yan etkilere sebebiyet vermediğini kanıtlamıştır (63). Randomize bir klinik çalışma, AK’nin in situ tedavisi için hızlandırılmış MN destekli FDT’nin inkübasyon süresini önemli ölçüde kısaltarak 20 dakikaya indirdiğini ve geleneksel 1 saatlik 5-ALA inkübasyonu için elde edilen bulgulara benzer şekilde %76 klirens sağladığını doğrulamıştır (64).
AFL ve MN’lere ek olarak, fiziksel yöntemler arasında mikrodermabrazyon, küretaj ve keratolitikler de stratum korneumun kalınlığını azaltarak PS’lerin/ilaçların deriye nüfuz etmesini artırabilir.
Son 20 yılda, AK ve cSCC’nin in situ tedavisinde 5-ALA PDT ve MAL PDT’nin 5-FU, imikuimod ve kriyoterapi gibi diğer topikal tedavi yöntemlerine göre üstünlüğünü araştırmak için farklı ışık kaynakları ile kapsamlı çalışmalar yapılmıştır (65). FDT’nin süperfizyel ve ince nodüler BCC’yi (kalınlık < 2 mm) tedavi etmesi gerekir ve süperfizyel debridman kombinasyonu FDT derinliğini uygun şekilde uzatabilir (66). Roozeboom ve arkadaşları (67) nBCC’de cerrahi eksizyona karşı önceden kısmi debulking ile fraksiyone %20 5-ALA PDT’nin uzun vadeli etkinliğini karşılaştırmıştır. Sonuç, 5-ALA PDT grubunda rekürrens oranının cerrahi gruba göre daha yüksek olduğunu ortaya koymuştur.
MAL, 5-ALA’ya göre seçiciliği daha iyidir ve daha derin deri penetrasyonunun yanı sıra lipotropik etkiler de göstermektedir. Klinik çalışmalar (68) şiddetli akne, yüz ve saçlı deride hiperkeratotik olmayan AK, Bowen hastalığı ve konvansiyonel cerrahi ile tedavi edilmesi uygun olmayan BCC gibi NMSC’lerin tedavisinde MAL FDT’nin (uyarıcı ışık olarak kırmızı ışık tercih edilmektedir) etkisini ortaya koymuştur. Rhodes ve arkadaşları (69) 3 ve 24 aylık takipler sonrasında MAL FDT’nin nBCC için cerrahiden daha üstün olmadığını teyit etmiştir. Szeimies ve arkadaşları (70) 3 aylık takipten sonra aynı sonuca ulaşmıştır, ancak nüks oranı 12 ayda MAL FDT grubunda cerrahi grubuna göre belirgin şekilde daha yüksektir.
Güçlendirici Özellikli İlaçlar
PpIX güçlü floresan ve fotosensitize edici aktiviteye sahiptir ve bazı tümörler yüksek 5-ALA aracılı PpIX seviyelerine sahiptir; bu nedenle, PpIX seviyelerinin artırılması FDT’nin tümörlere karşı etkisini artırabilir. Xue ve arkadaşları (71) 5-ALA tabanlı tümör tespiti ve FDT’yi geliştirmeye yönelik stratejileri açıklamıştır. Demir şelatörleri ferro demiri uzaklaştırabilir ve PpIX’in heme dönüşümünü önleyebilir, böylece PpIX birikimini artırabilir.
Metotreksat ve D vitamini gibi bazı diferansiyel ajanlar 5-ALA aracılı PpIX üretimini artırabilir ve CPOX’u yükselterek 5-ALA FDT etkilerini artırabilir. Anand ve arkadaşları (72), PpIX seviyelerini 3-4 kat artıran FDT öncesinde oral D3 vitamini kullanımının, normal dokularda istenmeyen fototoksisiteye neden olmadan cSCC’de FDT ile gerçekleşen hücre ölümünü 20 kat artırdığını bulmuştur. PpIX, ABCG2 taşıyıcısının endojen bir substratıdır. Sun ve arkadaşları (73), gefitinibin (güçlü bir ABCG2 inhibitörü) malign beyin tümörü hücrelerinden ABCG2 aracılı PpIX efluksunu inhibe edebileceğini, böylece Şekil 2’de sunulduğu gibi hücre içi PpIX seviyelerini ve FDT’nin etkisini artırabileceğini kanıtlamıştır.
Collier ve Rhodes (74), BCC’de topikal FDT’nin randomize kontrollü çalışmalarının analizine dayanan bilgilerin bir özetini sunmuş, topikal FDT’nin etki mekanizmasını tanıtmış, 5-ALA/MAL’in ön ilaç olarak kullanımını tanımlamış ve penetrasyonu artırmak ve PpIX birikimini optimize etmek için stratejilerin geliştirilmesini tartışmıştır (örn. epigallocatechin-3-gallate, demir şelatörleri). BCC alt tipleri ile FDT’nin etkisi arasındaki korelasyon (süperfisyal düşük riskli BCC’de, topikal FDT’ye diğer BCC alt tiplerinden daha yüksek oranda tam yanıt alınmıştır) ortaya konmuş ve topikal FDT’nin diğer topikal yöntemlerle (örn. cerrahi eksizyon, kriyocerrahi, topikal 5- FU, imiquimod) karşılaştırılması rapor edilmiştir.
NMSC Tedavisinde Kullanılan Nanoteknolojik FDT
5-ALA/MAL’in deride penetrasyonunun sınırlı olması ve lüminesans etkisinin düşük olması nedeniyle NP’ler, LP’ler ve miseller gibi mikroveziküller ve nanoilaç taşıyıcı sistemler geliştirilmiştir (Tablo 1).
Yapılan çalışmalar LP’lerin 5-ALA’nın serbest 5-ALA’ya göre deriye penetrasyonunu artırdığını ve ilacın sistemik dolaşıma emilimini sınırladığını, böylece tedavi sonrası sitotoksisite ve fototoksisiteyi azalttığını bildirmiştir (75). Araştırmacılar kedi cSCC’sinde PS’nin lipozomal formülasyonunun (m-THPC) olası toksisitelerini değerlendirmişlerdir. Tüm kediler tedaviye yanıt vermiştir (sefalik veya femoral vene 0,15 mg m-THPC/kg enjeksiyon) ve tedavinin 1 yıllık genel kontrol oranı %75’tir. Bu sonuç, lipozomal PS’nin güvenli ve etkili olduğunu göstermiştir (76). Bilim insanları (77), 652 nm diyot lazer ile ışınlama altında lipozomal fosforile mTHPC’nin intravenöz enjeksiyonunu takiben kedi cSCC’sinin uzun vadeli sonuçlarını ve prognostik faktörlerini araştırmış ve genel yanıt oranı %84 (tam remisyon, %61; kısmi remisyon, %22) ve ortalama progresyonsuz geçen süre 35 ay olmuştur. Woźniak ve arkadaşları (78) in vitro olarak MUG-Mel2 (melanom), SCC-25 (SCC) ve HaCaT (normal keratinositler) hücrelerinde etki gösteren kurkumin yüklü LP’lerin fotosensitize edici etkisini analiz etmiş ve lipozomal formülasyonun deri kanserlerinde kurkumin aracılı FDT’nin fotosensitize edici özelliklerini geliştirdiğini ve normal keratinositlerde toksisiteyi azalttığını ortaya koymuştur. Alyssa ve ark. (79) polimerik misellerle kaplanmış EGFR-hedefli Pc4 nanoformülasyonunun EGFR-aşırı eksprese eden H&N SCC-15 hücrelerinde daha hızlı ve daha geniş tutulma gösterdiğini bildirmiştir, farelerde deri altı SCC-15 ksenograftlarında Pc4 nanoformülasyonunun FDT yanıtını test etmişler ve daha yüksek Pc4 tümör içi alım seviyesinin hücre çalışmasına karşılık geldiğini, böylece in vitro ve in vivo FDT etkinliğini artırdığını bulmuşlardır.
FDT’nin numune boyutu ve tümör derinliği sınırlıdır. Örneğin, papiller dermisle sınırlı cSCC FDT ile tedavi edilebilir. Bu engellerin üstesinden gelmek için, AFL’ler veya MN’lerle yapılan ön işlem ve PS’lerin LP’ler veya diğer nanoplatformlar ile kapsüllenmesi kayda değer bir etki göstermiştir (80). Nanotaşıyıcılar EPR etkisi ile tümör bölgelerinde pasif olarak birikebildiğinden NP’ler de FDT güçlendiricileri olarak kullanılmıştır. Wang ve arkadaşları (81) 5-ALA yüklü polilaktik-ko-glikolik asit (PLGA) NP’lerini helyum-neon lazer ışınlamasıyla birlikte tümör yüzeylerine uygulanmak üzere krem formülasyonu olarak hazırlamış ve 5-ALA-PLGA NP’lerinin cSCC’de aynı konsantrasyonda serbest 5-ALA’dan daha etkili biçimde FDT’ye aracılık ettiğini tespit etmiştir. Kitosan/metoksi polietilen glikol-polilaktik asit (CPP) üzerine yüklenmiş ZnPcs, NP-(Z-CPP) oluşturmak için kullanılmış ve SCC’de topikal FDT’nin karanlığa bağlı toksisitesi ve etkinliği in vivo ve in vitro testler kullanılarak incelenmiştir. Sonuçlar, bileşiklerin karanlığa bağlı toksisite göstermediğini ve FDT’nin etkisinin Z-CPP kullanılarak serbest ZnPcs kullanımına göre belirgin şekilde daha iyi olduğunu göstermiştir (82).
PDT FDT, özellikle primer nodüler ve süperfisyal BCC dahil olmak üzere düşük riskli BCC için kabul görmüş bir tedavidir. Randomize bir faz III çalışma, BF-200 5-ALA’nın (5-ALA içeren nanoemülsiyon jel) sBCC veya nBCC’nin FDT ile tedavisinde MAL’a (MAL içeren krem) göre non-inferioritesini değerlendirmiştir. BF-200 ALA grubundaki tam yanıt oranı, MAL grubundaki %91,8’e kıyasla %93,4’tür ve BF-200 ALA-FDT’nin MAL-FDT’ye göre daha düşük olmadığı kanıtlanmıştır (83). Salmivuori ve arkadaşları (84) prospektif ve çift kör çalışma yürütmüş ve düşük konsantrasyonlu heksil aminolevulinat ve BF-200 5- ALA’nın agresif olmayan BCC için FDT’de MAL ile benzer etkinlik ve tolerabiliteye sahip olduğunu doğrulamıştır.
Melanom Tedavisinde Nanoteknolojiye Dayalı FDT
Melanoma Melanom, invaziv ve agresif bir deri kanseridir ve pigmentli veya pigmentsiz tip olarak sınıflandırılabilir. 2019 yılında, Avrupa Disiplinlerarası Melanom Kılavuzu, kutanöz melanom tanı ve tedavisine ilişkin önerilerde bulunmuş ve melanomun birincil tedavisinin cerrahi eksizyon olduğunu Zhang et al. Advances and Application in Photodynamic
Frontiers in Oncology | www.frontiersin.org 9 March 2022 | Volume 12 | Article 836397
onaylamıştır, adjuvan tedavide FDT’den bahsedilmemiştir (85). Bununla birlikte, yayınlanmış bazı literatürlerde FDT, süperfisyal ve lokalize kutanöz MM için etkili bir tedavi olarak kabul edilmektedir.
Tümör hücreleri bir dereceye kadar kendi savunma sistemlerini oluşturabilir ve FDT ile tetiklenen oksidatif stres altında antioksidan bir savunma sistemi oluşturabilir. Nano-PS’ler’in ROS veriminin yüksek olması, kolayca modifiye edilebilmeleri ve stabilitelerinin iyi olması gibi avantajları vardır ve FDT direncini aşabilirler. Tang ve arkadaşları NP’lerin MM’de oksidatif stres, DNA hasarı ve hücre zarı hasarı yoluyla tümör hücrelerini doğrudan öldürebildiğini gözlemlemiş ve kemoterapötik ilaçları veya nükleotid fragmanlarını elektrostatik kuvvet veya hidrofilik/hidrofobik etkileşimler yoluyla taşıyıcı olarak bağlayıp nano-ilaçların biyouyumluluğunu ve hedeflenebilirliğini artırdıklarını kanıtlamıştır (86). Tümör tedavisi için genlerin yüksek oranda susturulmasını sağlamak üzere küçük interferaz RNA (siRNA) gen ifadesini bloke edebilir, ancak siRNA’lar stabil değildir ve kanda kolayca bozulabilirler. Ragelle ve arkadaşları (87) siRNA’ları iletmek için PEGile kitosan bazlı NP’ler oluşturmuş ve bu kombine NP’lerin lusiferaz eksprese eden B16 melanom hücrelerinde yüksek gen susturma, düşük sitotoksisite ve yüksek stabilite sağladığını doğrulamıştır.
İn vitro tek katmanlı hücre kültürü modelleri, in vivo klinik çalışmaların etkinliğini yansıtmamaktadır ve aslında melanom hücreleri üç boyutlu (3D) bir alanda diğer hücrelerle etkileşim kurmaktadır. 3D kültür modelleri (melanom sferoidleri) hipoksik ortam gibi doğal gradyanları yeniden oluşturarak tümör heterojenitesini yeniden yaratır (88), ancak tümör yapısını taklit eden melanom sferoidleri üzerine FDT ile ilgili sadece birkaç çalışma vardır.
FDT, pigmentli melanoma karşı NMSC’ye göre daha az etkilidir çünkü melanositlerde sentezlenen melaninin ana işlevi UV kaynaklı hasara karşı koruma sağlamaktır ve bu da ışığın hedeflere etkili bir şekilde ulaşmasını engeller. Naidoo ve arkadaşları (89) verteporfin, halojenli porfirinler, 5-ALA, rutenyum porfirinler ve Pcs gibi PS’lerin MM’de FDT için uygulandığını bildirmiştir. Cai ve arkadaşları (90) 5-ALA PDT’nin MM-A375 ve A431 hücrelerinin sağkalımını konsantrasyona ve zamana bağlı bir şekilde önemli ölçüde inhibe edebildiğini ve etki mekanizmasının Bcl-2’nin downregülasyonu ve Bax ve cleaved-PARP’ın upregülasyonu ile bağlantılı olduğunu bulmuştur.
Antikorların veya hedefleyici moleküllerin NP’lere dahil edilmesi, hedef tümör hücrelerine pasif veya aktif PS iletimini artırmıştır. Fonksiyonel NP platformları, Şekil 3’te gösterildiği gibi PS ilaç iletimini arttırmak için faydalıdır.
Nanotaşıyıcılar pasif veya aktif olarak absorbe edilmelerine göre iki türe ayrılabilir. Pasif ilaç dağıtım sistemleri arasında miseller, LP’ler, dendrimerler, metal oksit, seramik ve silika yer almaktadır (91).
Melanomun pigmentasyonu FDT’nin etkinliğini azaltsa da, araştırmacılar (92) melanin sentezini inhibe etmek ve pigmentsiz melanom hücreleri elde etmek için feniltiyoüre (bir melanin sentezi inhibitörü) kullanmış ve bu hücreler daha sonra sodyum demir klorofilini (Fe-CHL) kapsülleyen LP’lerle birlikte inkübe edilmiştir. Transmisyon elektron mikroskopisi hücresel alımın arttığını ve bileşiklerin esas olarak mitokondri ve çekirdeklerde biriktiğini, böylece Fe-CHL aracılı FDT’nin etkisinin arttığını ortaya koymuştur. Lee ve arkadaşları (93) kitosan kaplı LP’lerin ICG’nin stabilitesini ve geçirgenliğini artırdığını, ajanın hücresel alımını artırdığını ve B16-F10 melanom hücrelerinde topikal FDT’nin etkisini artırdığını göstermiştir.
Polonyalı bilim insanları IR-768’i daunorubisin ile mPEG-b-PLGA miselleri aracılığıyla birleştiren bir ortak dağıtım sistemi tasarlamış ve çift ilaç yüklü dağıtım sistemi A375 hücrelerinde FDT sırasında 1O2 oluşumunu artırmıştır (94). Chen ve arkadaşları (95) paladyum porfirini (PdTCPP) katmanlı metal oksit NP’lerde (LDH) kapsülleyerek hidrofobik PS-PdTCPP’nin çözünürlüğünü geliştirmiş ve nanokompozitlerin biyouyumluluğunu ve stabilitesini artırmıştır. LDH daha yüksek yükleme kapasitesine sahip olduğundan, yüzey farklı fonksiyonel gruplarla modifiye edilebilmiştir. PdTCPP-LDH, B16F10 hücrelerinde FDT sırasında mükemmel anti-kanser etkinliği sağlamıştır.
NP’ler, tümör hücreleri üzerinde aşırı eksprese edilen reseptörlere selektif olarak bağlanabilen hedefleyici moleküllerle fonksiyonel hale getirilebilir ve bu da PS/ilaç iletimini artırır. Monoklonal antikorlar, peptitler, aptamerler, DNA/RNA ve diğer hedefleyici moleküller FDT’de aktif hedefleme için kullanılmıştır. Bu süreçte QD’ler, kendi kendini aydınlatan nanokristaller ve metal oksit bazlı veya upconverting maddeler gibi araçlar nanotaşıyıcı olarak kullanılmıştır (96).
Melanin pigmentinin pik absorpsiyonu 335 nm civarındadır ve 700 nm’den daha uzun dalga boylarında absorpsiyon neredeyse tamamen azalır. NIR, ayarlanabilir optikler ve fototermal özelliklerle ışınlanan GNP’ler, FDT’de PS’lerle sinerjik etkiler gösterebilir. Araştırmacılar, 635 nm’de ışınlama altında B16F10 melanotik hücreler ve B16G4F amelanotik hücrelerle in vitro olarak AuNR’lere bağlı ZnPc komplekslerini kullanarak FDT/PTT’nin ikili etkinliğini değerlendirmiştir. Sonuçlar, fotodinamik aktivite ve fototermal etkinin melanom hücrelerinin %90’ından fazlasını ortadan kaldırabildiğini göstermiştir (97). Campu ve arkadaşları (98) ICG ile yüklü altın nanobipiramitler (AuBP’ler) içeren yakın kızılötesi ışınlamaya duyarlı ikili PTT/PDT terapötik nanosistemi tasarlamıştır. Nanosistem NIR ile simüle edildiğinde, 1O2 verimi iki katına çıkmış ve PTT etkisi tek başına AuBP’ler için elde edilen bulgulara kıyasla güçlü bir şekilde artmıştır. Urszula ve arkadaşları (99) lantanit iyonları (Er3+ [%2] ve Yb3+ [%20]) ile birlikte katkılanmış yukarı dönüştürücü NaYF4 NP’leri ile birlikte kapsüllenmiş ksantin kaynaklı RB tasarlamış ve ardından bunları PLGA ve iyonik olmayan yüzey aktif maddeler (Span 80 ve Cremophor A25). Sonuç, hibrit fluoroforların birlikte dağıtımı için çift çekirdekli nanoplatformun insan melanom hücrelerinde (Me-45 ve MeWo) mükemmel seçicilik, biyouyumluluk ve FDT etkilerine sahip olduğunu göstermiştir.
ÖZET
Şimdiye kadar, yapılan sayısız çalışma PS’lerin FDT’de nanomateryallerle kombine edilebilirliğini araştırmıştır. Konvansiyonel PS’lerin in vivo hedeflenen taşıma etkinliği, karmaşık konjuge yapılar, suda çözünürlüğün düşük olması ve değişken biyolojik ortam (örn. pH, oksijen, besinler) nedeniyle engellenmiş olsa da, nano-PS stratejileri FDT’nin etkili olması için yeni imkanlar sunmaktadır. Bazı lokal ve süperfisyal deri kanserleri ve prekanseroz, nanoteknoloji destekli FDT için kesinlikle endikasyon teşkil etmektedir. Ayrıca, nanotaşıyıcılar ilaç salınımını daha iyi kontrol edebilir ve ROS üretme özelliğini önemli ölçüde artırabilir.
FDT klinik kullanım açısından hala birçok zorlukla karşı karşıyadır. PS’lerin eksitasyon dalga boyu esas olarak UV veya VIS’de yoğunlaşır, ancak biyolojik dokular dalga boyu aralığında ışık üzerinde güçlü absorpsiyon ve saçılma etkisine sahiptir, bu da derin tümörlerde veya büyük solid tümörlerde doğrudan uygulanamayan zayıf penetrasyon ile sonuçlanır. 700-1000 nm’de yüksek penetrasyon derinliğine sahip NIR, ideal bir FDT uyarma ışığıdır. Ne yazık ki, UV-VIS ile karşılaştırıldığında, PS’lerin NIR’deki absorpsiyon piki ile molar absorpsiyon katsayısı genellikle düşüktür, bu nedenle tek foton uyarımı (OPE) FDT etkisi, güvenli bir radyasyon dozu ile NIR uyarımı altında ideal değildir. İki foton uyarımlı (TPE) FDT gelişmiş uzamsal seçiciliğe sahiptir ve doğru hedef belirlemeye yardımcı olabilir, ancak TPE-PDT PS’ler çoğunlukla küçük iki foton emilim kesitine sahip odak bölgesinde meydana gelir, bu da TPE FDT’nin düşük verimliliğine neden olur, yüksek enerjili NIR tekniği kullanılsa bile FDT verimliliği çok fazla artırılamaz. TPE ile karşılaştırıldığında, upconversion işlemi yüksek güçlü bir lazere ihtiyaç duymaz (98) ve geleneksel sürekli lazerler UCNP’lerin kısa dalga boylu ışık yaymasını sağlayabilir, böylece yüksek güçlü ışık kaynaklarının neden olduğu doku hasarını azaltır (100), ancak UCNP’lerin foto kuantum verimi nispeten düşüktür. Çeşitli nanomalzemelerin artıları ve eksileri tartıldığında, yüksek derecede kimyasal saflık ve kararlılık, dokularda kolay çözünürlük, yüksek fotokimyasal reaktivite ve ışığa duyarlı etki gibi özelliklere sahip ideal PS bileşiklerinin oluşturulması çok önemlidir ve maksimum ışık emilimi 600 nm-800 nm dalga boylarında, mükemmel seçicilik ve minimum sitotoksisitede olmalıdır.
Oksijen tüketimi ve mikrovasküler hasar nedeniyle, FDT’nin anti-tümör etkisi tümörlü hipoksik durumla sınırlı kalmaktadır. Bilim insanları, tümör bölgelerinin kan oksijen içeriğini artırmak için doğrudan oksijen iletimi (hemoglobin veya perfluorokarbon NP’leri ile), katalitik oksijen üretim stratejileri (katalaz oksijen üreten nanodelivery sistemi) vb. dahil olmak üzere çeşitli nanodelivery sistemleri tasarlamıştır. Doğrudan oksijen dağıtım stratejisi ve enzim katalizli oksijen üretim stratejisi, dağıtım etkinliği ve substrat konsantrasyonundan etkilenir (101), oksijenle güçlendirilmiş FDT’nin etkinliğini daha da artırmak için araştırmacılar, hipoksik iç ortamı etkili bir şekilde artırabilen oksijen üretmek için in vivo su ile reaksiyona giren duyarlı malzemeler kullanmıştır. FDT, dermatolojide en önemli klinik tedavilerden biri haline gelmiştir. Nanotıp, biyoloji ve optiğin geliştirilmesi ve entegrasyonu ile giderek daha fazla dermatolojik hastanın FDT’den fayda göreceğine inanılmaktadır.
KAYNAKÇA
1. Donohoe C, Senge MO, Arnaut LG, Gomes-da-Silva LC. Cell Death in Photodynamic Therapy: From Oxidative Stress to Anti-Tumor Immunity. Biochim Biophys Acta Rev Cancer (2019) 1872:188308. doi: 10.1016/ j.bbcan.2019.07.003
2. Kwiatkowski S, Knap B, Przystupski D, Saczko J, Kedzierska E, Knap-Czop K, et al. Photodynamic Therapy – Mechanisms, Photosensitizers and Combinations. BioMed Pharmacother (2018) 106:1098–107. doi: 10.1016/ j.biopha.2018.07.049
3. Nogueira L, Tracey AT, Alvim R, Reisz P, Scherz A, Coleman JA, et al. Developments in Vascular-Targeted Photodynamic Therapy for Urologic Malignancies. Molecules (2020) 25. doi: 10.3390/molecules25225417
4. Warrier A, Mazumder N, Prabhu S, Satyamoorthy K, Murali TS. Photodynamic Therapy to Control Microbial Biofilms. Photodiagnosis Photodyn Ther (2021) 33:102090. doi: 10.1016/j.pdpdt.2020.102090
5. Wilson BC. Photodynamic Therapy for Cancer: Principles. Can J Gastroenterol (2002) 16:393–6. doi: 10.1155/2002/743109
6. Dobson J, de Queiroz GF, Golding JP. Photodynamic Therapy and Diagnosis: Principles and Comparative Aspects. Vet J (2018) 233:8–18. doi: 10.1016/j.tvjl.2017.11.012
7. Wen X, Li Y, Hamblin MR. Photodynamic Therapy in Dermatology Beyond non-Melanoma Cancer: An Update. Photodiagnosis Photodyn Ther (2017) 19:140–52. doi: 10.1016/j.pdpdt.2017.06.010
8. Chen L, Zhang X, Cao Q, Wu Y, Zhang T, Tong H, et al. Development and Application of a Physiologically Based Pharmacokinetic Model for HPPH in Rats and Extrapolate to Humans. Eur J Pharm Sci (2019) 129:68–78. doi: 10.1016/j.ejps.2018.12.014
9. Almeida EDP, Dipieri LV, Rossetti FC, Marchetti JM, Bentley M, Nunes RS, et al. Skin Permeation, Biocompatibility and Antitumor Effect of Chloroaluminum Phthalocyanine Associated to Oleic Acid in Lipid Nanoparticles. Photodiagnosis Photodyn Ther (2018) 24:262–73. doi: 10.1016/j.pdpdt.2018.10.002
10. Li K, Qiu L, Liu Q, Lv G, Zhao X, Wang S, et al. Conjugate of Biotin With Silicon(IV) Phthalocyanine for Tumor-Targeting Photodynamic Therapy. J Photochem Photobiol B (2017) 174 : 243 – 50 . doi: 10 . 1016/ j.jphotobiol.2017.08.003
11. Ma X, Qu Q, Zhao Y. Targeted Delivery of 5-Aminolevulinic Acid by Multifunctional Hollow Mesoporous Silica Nanoparticles for Photodynamic Skin Cancer Therapy. ACS Appl Mater Interfaces (2015) 7:10671–6. doi: 10.1021/acsami.5b03087
12. Muttaqien SE, Nomoto T, Dou X, Takemoto H, Matsui M, Nishiyama N. Photodynamic Therapy Using LCST Polymers Exerting Ph-Responsive Isothermal Phase Transition. J Control Release (2020) 328:608–16. doi: 10.1016/j.jconrel.2020.09.036
13. Zhao B, Wang M, Wang X, Yu P, Wang N, Li F. Synthesis and Characterization of Novel Porphyrin-Cinnamic Acid Conjugates. Spectrochim Acta A Mol Biomol Spectrosc (2019) 223:117314. doi: 10.1016/j.saa.2019.117314
14. Avci P, Erdem SS, Hamblin MR. Photodynamic Therapy: One Step Ahead With Self-Assembled Nanoparticles. J BioMed Nanotechnol (2014) 10:1937– 52. doi: 10.1166/jbn.2014.1953
15. Yang Z, Ma Y, Zhao H, Yuan Y, Kim BYS. Nanotechnology Platforms for Cancer Immunotherapy. Wiley Interdiscip Rev Nanomed Nanobiotechnol (2020) 12:e1590. doi: 10.1002/wnan.1590
16. Mishra S. Nanotechnology in Medicine. Indian Heart J (2016) 68:437–9. doi: 10.1016/j.ihj.2016.05.003
17. Fakayode OJ, Tsolekile N, Songca SP, Oluwafemi OS. Applications of Functionalized Nanomaterials in Photodynamic Therapy. Biophys Rev (2018) 10:49–67. doi: 10.1007/s12551-017-0383-2
18. Gamaleia NF, Shton IO. Gold Mining for PDT: Great Expectations From Tiny Nanoparticles. Photodiagnosis Photodyn Ther (2015) 12:221–31. doi: 10.1016/j.pdpdt.2015.03.002
19. Norouzi H, Khoshgard K, Akbarzadeh F. In Vitro Outlook of Gold Nanoparticles in Photo-Thermal Therapy: A Literature Review. Lasers Med Sci (2018) 33:917–26. doi: 10.1007/s10103-018-2467-z
20. Li L, Chen JY, Wu X, Wang PN, Peng Q. Plasmonic Gold Nanorods can Carry Sulfonated Aluminum Phthalocyanine to Improve Photodynamic
Detection and Therapy of Cancers. J Phys Chem B (2010) 114:17194–200. doi: 10.1021/jp109363n
21. Skripka A, Dapkute D, Valanciunaite J, Karabanovas V, Rotomskis R. Impact of Quantum Dot Surface on Complex Formation With Chlorin E
(6) and Photodynamic Therapy. Nanomaterials (Basel) (2018) 9. doi: 10.3390/nano9010009
22. Samia AC, Chen X, Burda C. Semiconductor Quantum Dots for Photodynamic Therapy. J Am Chem Soc (2003) 125:15736–7. doi: 10.1021/ja0386905
23. Karabanovas V, Skripka A, Valanciunaite J, Kubiliute R, Poderys V, Rotomskis R. Formation of Self-Assembled Quantum Dot–Chlorin E6 Complex: Influence of Nanoparticles Phospholipid Coating. J Nanoparticle Res (2014) 16. doi: 10.1007/s11051-014-2508-x
24. Yaghini E, Giuntini F, Eggleston IM, Suhling K, Seifalian AM, MacRobert AJ. Fluorescence Lifetime Imaging and FRET-Induced Intracellular Redistribution of Tat-Conjugated Quantum Dot Nanoparticles Through Interaction With a Phthalocyanine Photosensitiser. Small (2014) 10:782–92. doi: 10.1002/smll.201301459
25. Feng Y, Liu L, Hu S, Liu Y, Ren Y, Zhang X. Förster Resonance Energy Transfer Properties of a New Type of Near-Infrared Excitation PDT Photosensitizer: Cuins2/Zns Quantum Dots-5-Aminolevulinic Acid Conjugates. RSC Adv (2016) 6:55568–76. doi: 10.1039/C6RA06937A
26. Li L, Zhao JF, Won N, Jin H, Kim S, Chen JY. Quantum Dot-Aluminum Phthalocyanine Conjugates Perform Photodynamic Reactions to Kill Cancer Cells via Fluorescence Resonance Energy Transfer. Nanoscale Res Lett (2012) 7:386. doi: 10.1186/1556-276X-7-386
27. Mok H, Zhang M. Superparamagnetic Iron Oxide Nanoparticle-Based Delivery Systems for Biotherapeutics. Expert Opin Drug Deliv (2013) 10:73–87. doi: 10.1517/17425247.2013.747507
28. Hayashi K, Nakamura M, Sakamoto W, Yogo T, Miki H, Ozaki S, et al. Superparamagnetic Nanoparticle Clusters for Cancer Theranostics Combining Magnetic Resonance Imaging and Hyperthermia Treatment. Theranostics (2013) 3:366–76. doi: 10.7150/thno.5860
29. Gupta AK, Gupta M. Synthesis and Surface Engineering of Iron Oxide Nanoparticles for Biomedical Applications. Biomaterials (2005) 26:3995– 4021. doi: 10.1016/j.biomaterials.2004.10.012
30. Yan L, Amirshaghaghi A, Huang D, Miller J, Stein JM, Busch TM, et al. Protoporphyrin Ix (Ppix)-Coated Superparamagnetic Iron Oxide Nanoparticle (Spion) Nanoclusters for Magnetic Resonance Imaging and Photodynamic Therapy. Adv Funct Mater (2018) 28:16. doi: 10.1002/adfm.201707030
31. Xu JK, Zhang FF, Sun JJ, Sheng J, Wang F, Sun M. Bio and Nanomaterials Based on Fe3O4. Molecules (2014) 19:21506–28. doi: 10.3390/molecules191221506
32. Zeng L, Xiang L, Ren W, Zheng J, Li T, Chen B, et al. Multifunctional Photosensitizer- Conjugated Core– Shell Fe3 O4@ Nayf4: Yb/Er Nanocomplexes and Their Applications in T2-Weighted Magnetic Resonance/Upconversion Luminescence Imaging and Photodynamic Therapy of Cancer Cells. RSC Adv (2013) 3. doi: 10.1039/c3ra41916a
33. He X, Liu F, Liu L, Duan T, Zhang H, Wang Z. Lectin-Conjugated Fe2O3@ Au Core@Shell Nanoparticles as Dual Mode Contrast Agents for In Vivo Detection of Tumor. Mol Pharm (2014) 11:738–45. doi: 10.1021/mp400456j
34. Xinqing J. Integrin Receptor Targeted Crgd-Conjugated Magnetic Nanoparticles for Vitro Imaging Experimental Hepatic Cancer Cells. Chin J Clinicians (Electronic Edition) 05:783–7. doi: 10.3877/cma.j.issn.1674- 0785.2015.05.019.
35. Matlou GG, Oluwole DO, Prinsloo E, Nyokong T. Photodynamic Therapy Activity of Zinc Phthalocyanine Linked to Folic Acid and Magnetic Nanoparticles. J Photochem Photobiol B (2018) 186:216–24. doi: 10.1016/ j.jphotobiol.2018.07.025
36. Matshitse R, Ngoy BP, Managa M, Mack J, Nyokong T. Photophysical Properties and Photodynamic Therapy Activities of Detonated Nanodiamonds-BODIPY-Phthalocyanines Nanoassemblies. Photodiagnosis Photodyn Ther (2019) 26:101–10. doi: 10.1016/j.pdpdt.2019.03.007
37. Wang F, Han Y, Lim CS, Lu Y, Wang J, Xu J, et al. Simultaneous Phase and Size Control of Upconversion Nanocrystals Through Lanthanide Doping. Nature (2010) 463:1061–5. doi: 10.1038/nature08777
38. Su Q, Feng W, Yang D, Li F. Resonance Energy Transfer in Upconversion Nanoplatforms for Selective Biodetection. Acc Chem Res (2017) 50:32–40. doi: 10.1021/acs.accounts.6b00382




