Marília Carneiro Machado 1, Priscila Akemi Yamamoto 2,3 , Leandro Francisco Pippa 2 , Natália Valadares de Moraes 2 , Fabiane Maria Fernandes Neves 4, Ricardo Dias Portela 5 , Stella Maria Barrouin-Melo 1 , Anna Hielm-Björkman 6 , Ana Leonor Pardo Campos Godoy 4 ve Alessandra Estrela-Lima 1,6,7,*
1 Veteriner Anatomi, Patoloji ve Klinik Bölümü, Veteriner Hekimliği ve Zootekni Fakültesi, UFBA, Salvador 40170-110, BA, Brezilya
2 Eczacılık Bölümü, Eczacılık Fakültesi, Florida Üniversitesi, Orlando, FL 32827, ABD
3 Ribeirão Preto Farmasötik Bilimler Fakültesi, São Paulo Üniversitesi, Ribeirão Preto 14040-903, SP, Brezilya
4 Farmakokinetik Laboratuvarı, Eczacılık Fakültesi, Bahia Federal Üniversitesi, Salvador 40170-115, BA, Brezilya
5 İmmünoloji ve Moleküler Biyoloji Laboratuvarı, Sağlık Bilimleri Enstitüsü, Bahia Federal Üniversitesi, Salvador 40231-300, BA, Brezilya
6 At ve Küçük Hayvan Hekimliği Bölümü, Veteriner Fakültesi, Helsinki Üniversitesi, P.O. Box 57, 00014 Helsinki, Finlandiya
7 Meme Onkolojisi Araştırma Merkezi NPqOM/HOSPMEV, Bahia Federal Üniversitesi, Salvador 40170-110, BA, Brezilya
* İlgili yazar: aestrela@ufba.br; Tel.: +55-71-3283-6739
Kısa özet: Bu çalışma, meme karsinomlu dişi köpeklerde metronomik siklofosfamidin, karboplatinin tolere edilebilirliği, etkinliği ve farmakokinetiği üzerindeki etkisini değerlendirmek amacıyla yapılmıştır. Meme karsinomlu 16 dişi köpek 300 mg/m2 intravenöz (i.v.) karboplatin tedavisi (sayı = 8) veya 12,5 mg/m2/gün oral siklofosfamid (sayı = 8) ile birlikte 300 mg/m2 i.v. karboplatin ile tedavi edildi. İkinci ve dördüncü kemoterapi döngülerinde karboplatinin PK parametrelerini hesaplamak için kompartmental olmayan bir analiz uygulanmıştır. Karboplatin farmakokinetiği, sadece karboplatin alan hayvanlarda plazma konsantrasyon-zaman eğrisi (EAA) altındaki alanda 10 kat değişkenlik ile bireyler arası yüksek değişkenlik göstermiştir. Karboplatine sistemik plazma maruziyeti (EAA ve Cmax) her iki tedavide de (tek başına karboplatin ve karboplatin + siklofosfamid) eşdeğerdi. Karboplatin + metronomik siklofosfamid tüm hayvanlar tarafından iyi tolere edilmiştir. Elde ettiğimiz sonuçlar, karboplatin tedavisine düşük günlük siklofosfamid dozlarının eklenmesiyle meme kanserli dişi köpeklerde sağkalım oranının arttığını göstermiştir.
Özet: Bu prospektif çalışmada, meme karsinomlu köpeklerde metronomik siklofosfamidin karboplatinin tolerabilitesi, etkinliği ve farmakokinetiği üzerindeki etkisinin değerlendirilmesi amaçlanmıştır. Meme karsinomlu 16 dişi köpek şu şekilde gruplara ayrılmıştır: 300 mg/m2 intravenöz (i.v.) karboplatin tedavisi (G1 = 8) veya metronomik tedaviyle 12,5 mg/m2 oral siklofosfamid ile birlikte 300 mg/m2 i.v. karboplatin (G2 = 8). İncelenen hayvanlara klinik değerlendirme, mastektomi, karboplatin kemoterapisi ve farmakokinetik analiz için seri kan örneği alma gibi işlemler uygulanmıştır. Yan etkiler ve sağkalım oranları takip edilmiştir. Karboplatinin 2. ve 4. kemoterapi döngülerindeki farmakokinetik parametrelerini hesaplamak için kompartmental olmayan bir analiz uygulanmıştır. Karboplatin PK, G1’de plazma konsantrasyon-zaman eğrisi (EAA) altındaki alanda 10 kat değişkenlik ile bireyler arası yüksek değişkenlik göstermiştir. Karboplatine sistemik plazma maruziyeti, EAA ve maksimum plazma konsantrasyonu (Cmax) değerleri dikkate alındığında her iki tedavide de eşdeğerdi. G2’de kırmızı kan hücreleri (p < 0.0001), trombositler (p = 0.0005), toplam lökositler (p = 0.0002) ve parçalanmış nötrofiller (p = 0.0007) azalmasına rağmen, G1 ile karşılaştırıldığında sağkalım oranı artmıştır (p = 0.0044). Sonuç olarak, karboplatin tedavisine günlük olarak düşük dozlarda siklofosfamid eklenmesiyle meme tümörü olan dişi köpeklerde umut verici sonuçlar elde edilmiştir.
1. Giriş
Veteriner Cerrahi Onkoloji Derneği’ne (VSSO) göre meme tümörleri, dişi köpeklerde teşhis edilen tüm tümörlerin %42’sini ve üreme sistemindeki tümörlerin %82’sini oluşturmaktadır [1]. Malign veya metastatik meme tümörlerinde etkili adjuvan kemoterapi protokollerinin olmaması nedeniyle, antineoplastik ajanlar mümkün olduğunca çok sayıda neoplastik hücreye saldırması için kombine şekilde kullanılabilir [2,3]. Doksorubisin, siklofosfamid, 5-florourasil, sisplatin ve karboplatin, mikrometastazı ve solid tümör nükslerini önlemek için maksimum tolere edilebilir dozda yaygın olarak kullanılmaktadır [4]. Kemoterapi ilaçlarının çoğu hücre bölünmesini düzenleyerek veya DNA’ya verdikleri hasar ile etki gösterirler. Normal hücreler kemoterapi ile malign hücrelerden ayırt edilemez. Bu nedenle, başta kemik iliği ve gastrointestinal epitel hücreleri olmak üzere hızlı bölünen hücrelerin bulunduğu dokular kemoterapiye özellikle duyarlıdır [2]. Maksimum tolere edilebilir dozda kemoterapi ile yapılan hiçbir çalışmada, bu tedavinin karsinomlu köpeklerde ortalama sağkalım süresi üzerinde etkili olup olmadığı kanıtlanamadığından, toksisitesi azaltılmış ve etkinliği daha iyi olan yeni terapötik stratejilerin geliştirilmesi kanser tedavisinde önemli bir sorundur.
Geleneksel kemoterapide, yüksek doza bağlı ilaç toksisitesinde, normal dokuların artan hücre çoğalma oranlarıyla iyileşmesi için belli bir dinlenme süresi gerekir [5]. Buna karşılık, sitotoksik ilaçların metronomik olarak uygulanması, çok daha düşük dozda sürekli veya daha sık aralıklarla verilmesiyle yapılır ve böylece ilacın yan etki gösterme riski azalır [6]. Metronomik kemoterapi, yan etkilerin daha az görülmesi ve stres seviyelerinin daha düşük olması sayesinde umut verici bir alternatif olarak karşımıza çıkmaktadır [6]. Bununla birlikte, bu yöntemin veteriner hekimlikte, özellikle dişi köpeklerdeki meme tümörleri söz konusu olduğunda, tek başına ya da konvansiyonel kemoterapi ile birlikte uygulanıp uygulanmadığına ilişkin az sayıda çalışma bulunmaktadır [7-10]. Bununla birlikte, düşük doz kemoterapi ile yeni tedavi kombinasyonlarının klinik olarak uygulanması için, her tümör tipi ve popülasyonu için etkili tedavi kombinasyonları bulmak amacıyla çalışmalar yapılmalıdır [8,11-13].
Karboplatin, insan tıbbı için geliştirilmiş ve alkil antikanser bir ilaçtır. Dişi köpeklerde meme neoplazmının adjuvan tedavisi için kullanılan ilaçlardan biridir ve özellikle düşük dozlarda naltrekson veya siklooksijenaz inhibitörleri ile birlikte kullanıldığında sağkalım oranlarında ve yaşam kalitesinde önemli bir artış sağlar [7,14]. Karboplatin, sisplatine göre daha az nefrotoksiktir ve karboplatin tedavisi sırasında kusma ve ishal daha az görülür ve yoğundur [15]. Bu çalışmada, köpek meme kanserinde metronomik siklofosfamidin, konvansiyonel karboplatin tedavisinin etkinliği ve tolere edilebilirliği üzerindeki etkisini araştırmayı amaçladık. Meme karsinomlu dişi köpekler 300 mg/m2 intravenöz (i.v.) karboplatin veya günlük 12,5 mg/m2 oral siklofosfamid ile kombine edilen i.v. karboplatin tedavisi uygulanmıştır. Kombine tedavi karboplatin PK plazma, hastalık progresyonu, sağkalım oranı ve yan etki açısından değerlendirilmiştir.
2. Materyal ve Metod
2.1. Çalışmaya dahil edilen hayvanlar
Meme karsinomu olan dişi köpekler şu kriterlere göre çalışmaya dahil edilmiştir: (a) üç santimetreden büyük bir tümörün varlığı; (b) IV. klinik evrede veya histopatolojik derecesi II veya III olan meme karsinomu; (c) değerlendirme sırasında eşlik eden başka bir hastalığın olmaması. Etik Kurul bu araştırma protokolünü onaylamış ve tüm prosedürler Brezilya Hayvan Deneyleri Kurulu’na (COBEA) göre yürütülmüştür. Tüm hayvan sahiplerinden bilgilendirilmiş onam formu alınmıştır. Hayvanlar prospektif olarak kontrollü, randomize şekilde klinik çalışmaya dahil edilmiş ve tümör boyutu, klinik evre, tanı ve histolojik dereceler dikkate alınarak: geleneksel i.v. karboplatin
kemoterapisi (300 mg/m2) grubu (G1) ve oral 12,5 mg/m2/gün siklofosfamid uygulaması ile kombine edilen karboplatin kemoterapisi grubu (G2) şeklinde gruplara ayrılmıştır.
2.2. Klinik Değerlendirme ve Mastektomi
Tüm hayvanlar kanser araştırması, üç açılı toraks radyografisi, metastazı değerlendirmek için tüm batın ultrasonu ve tam kan sayımı, serum üre, kreatinin, alkalin fosfataz, alanin aminotransferaz, iyonize kalsiyum ve glukoz konsantrasyonlarını içeren kan testlerini de kapsayacak şekilde klinik değerlendirmeye tabi tutulmuştur. Malign tümörler, tümör boyutu (T), bölgesel lenf nodlarının tutulumu (N) ve uzak metastazın varlığı veya yokluğu (M) dahil olmak üzere TNM evreleme sistemine göre sınıflandırılmıştır [16]. Tüm hayvanlara inguinal lenf düğümünü çıkarmak için komple tek taraflı mastektomi uygulandı. Tümör örnekleri Cassali ve arkadaşları [4] tarafından tanımlandığı gibi Dünya Sağlık Örgütü (DSÖ) kriterlerine göre sınıflandırılmıştır.
2.3. Kemoterapi
Ameliyattan yirmi gün sonra, karboplatin kemoterapisi seanslar arasında yirmi bir gün olacak şekilde altı seans halinde başlatıldı. Köpeklere sefalik ven yoluyla intravenöz 5 dakikalık karboplatin (300 mg/m2) infüzyonu uygulandı. Sadece G2’deki hayvanlara karboplatin kemoterapisine başladıktan sonra sekiz ay boyunca 12,5 mg/m2/gün siklofosfamid oral olarak verilmiştir. Siklofosfamid tableti ilk karboplatin seansından yaklaşık iki saat sonra ve sekiz ay boyunca her gün sabahları uygulanmıştır. Kan örnekleri 2. ve 4. kemoterapi döngülerinde karboplatin dozlamasından önce ve 5, 15, 30, 45, 60, 120 ve 240 dakika sonra karboplatin PK’sını değerlendirmek için toplanmıştır. Kan örnekleri 3000x g’de 5 dakika santrifüj edilmiştir. Plazma örnekleri alikotlar halinde ayrılmış ve analize kadar −80 ◦C’de kriyotüplerde saklanmıştır.
Karboplatin uygulamasından on dört gün sonra (en düşük nokta) ve her seanstan yaklaşık 48 saat önce idrar tahlili, tam kan sayımı ve serum biyokimya analizi için biyolojik örnekler toplanmıştır. Laboratuvar testleri, hayvanların kemoterapötik karboplatin bazlı prosedürü uygulamaya uygun durumda olduğunu kanıtlamıştır. Ondansetron (0,2 mg/kg), ranitidin (2 mg/kg) ve prometazin (0,1 mg/kg) deri altından verilmiştir. Bu protokol çerçevesinde gruplardaki tüm hayvanlara bu ilaçlar verilmiştir. Bu ilaçlar, tek doz olarak verilen prometazin hariç, kemoterapiden sonraki üç gün boyunca ağızdan verilmiştir.
2.4. Kemoterapinin Yan Etkileri
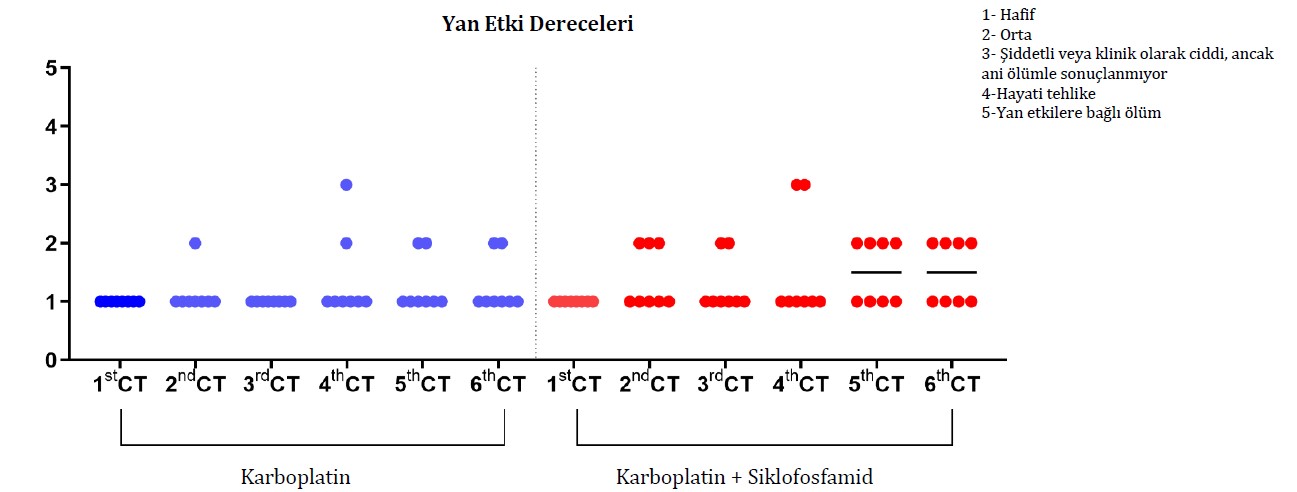
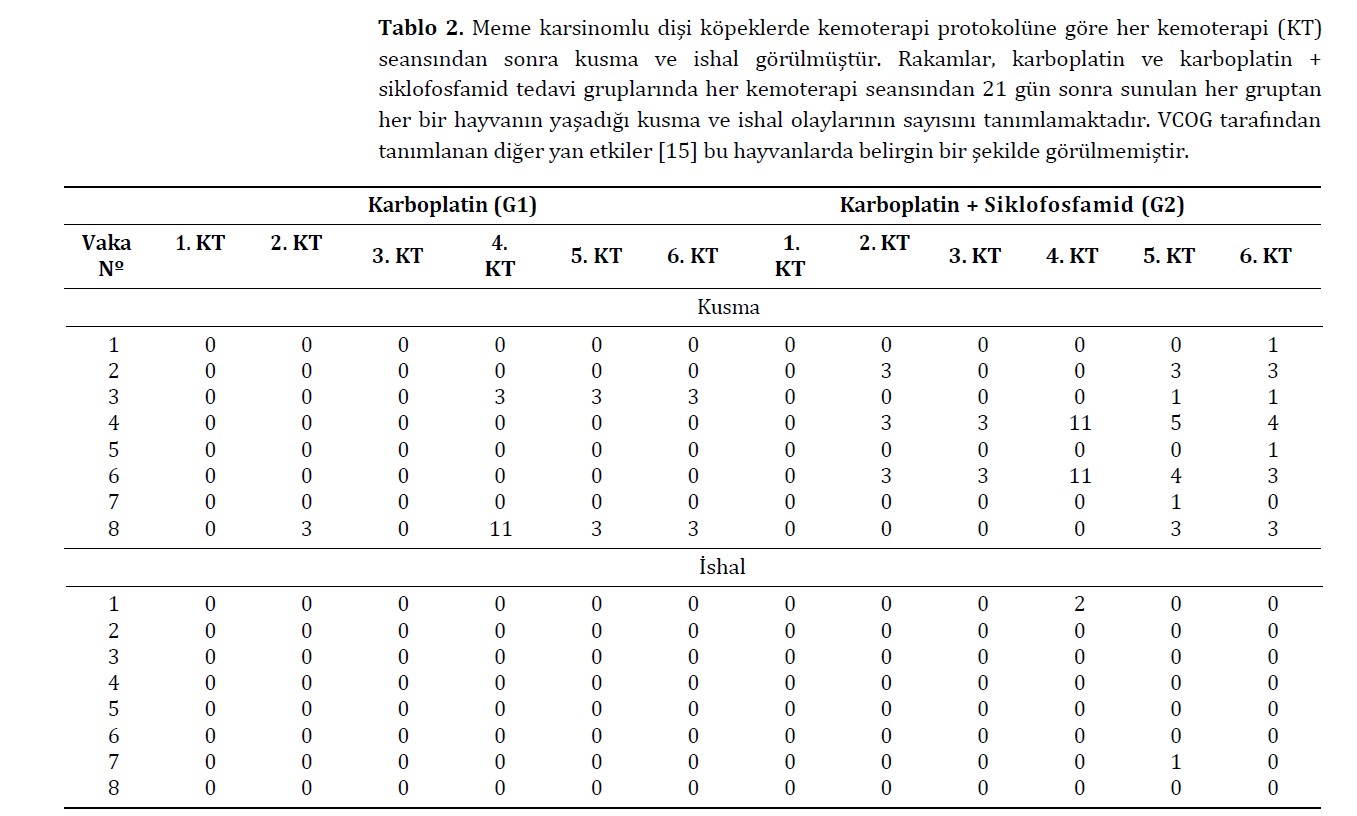
Tüm hayvanlar kemoterapi süresince haftalık telefon görüşmeleri ile kontrol edildi ve her on beş günde olası yan etkiler için klinik muayene ile değerlendirildi. Kemoterapi protokolünün neden olduğu yan etkilerin değerlendirilmesi için Veteriner Kooperatif Onkoloji Grubu-Yan Etkiler için Ortak Terminoloji Kriterleri (VCOG-CTCAE) tarafından belirlenen kriterler dikkate alınmıştır [17]. Bu konsensüs, köpek ve kedilerde kemoterapinin (kusma ve ishal) neden olduğu yan etkilerin şiddetini belirlemek için aşağıdaki sınıflandırmaya göre belli bir derecelendirme ölçeği (1’den 5’e kadar) kullanılmasını önermektedir: grade 1 (hafif): asemptomatik veya hafif semptomlar, sadece diagnostik gözlemler, terapötik müdahale endikasyonu yok; grade 2 (orta): günlük aktivitelerde orta derecede azalma, minimal veya noninvaziv ayakta tedavi müdahalesi gerektiriyor; grade 3 (şiddetli veya klinik olarak ciddi, ancak ani ölümle sonuçlanmıyor): günlük aktivitelerde önemli ölçüde azalma, hastaneye yatış endikasyonu var; grade 4 (hayati tehlike): acil terapötik müdahale gerektiriyor; grade 5: yan etkiye bağlı ölüm [17]. Köpek sahipleri gerekli bilgileri telefonla vermiş ve olası yan etkileri belirten haftalık raporları doldurmuşlardır. Meme karsinomlu dişi köpeklerin kemoterapi protokolüne göre her kemoterapi seansında gruplar arasında çiftler halinde yan etki skorlarını karşılaştırmak için Wilcoxon işaretli sıralar testi yapıldı.
2.5. Köpek Plazmasında Karboplatin Analizi
Plazmadaki karboplatin konsantrasyonları 229 nm’de UV ile ölçülerek yüksek performanslı sıvı kromatografisi (HPLC) ile tamamen doğrulanmıştır. Kromatografik analiz C18 ters fazlı kolon (250 x 4,6 mm) kullanılarak gerçekleştirilmiştir. Mobil faz 0,1 M potasyum dihidrojen fosfat ve 1 mM dipotasyum edetat pH 3 (A) ve asetonitril (B) karışımından oluşmuştur. Mobil faz bileşimi 2 dakika boyunca %100 A, 2 ila 10 dakika arasında %95 A ve %5 B ve 10 ila 11 dakika arasında %100 A ile başlamıştır.
Plazma örnekleri (150 µL) 200 µL asetonitril kullanılarak protein çökeltme yoluyla hazırlanmıştır. Örnekler 15 dakika boyunca çalkalanmış ve 15.000 x g’de 15 dakika boyunca santrifüjlenmiştir. Süpernatantlar kuruyana kadar buharlaştırıldıktan sonra, kalıntı 100 µL su içinde sulandırılmıştır. HPLC sistemine 20 µL’lik bir alikot enjekte edilmiştir. Yöntem 1-75 µg/mL plazma aralığında doğrusaldı ve alt miktar belirleme limiti (LLOQ) 1 µg/mL idi. Beş örnek kopyası için bağıl standart sapma (RSD) olarak değerlendirilen çalışma içi hassasiyet, LLOQ ve düşük (3 µg/mL), orta (40 µg/mL) ve yüksek (60 µg/mL) kalite kontrol seviyeleri için %10,75 dahilindeydi. Çalışmalar arası hassasiyet için, tüm kalite kontrol seviyeleri %13,84’e varan RSD değeri göstermiştir. Beş kopya için bağıl hata (RE) olarak değerlendirilen çalışma içi ve çalışma arası doğruluk, ±%20’ye kadar RE’ye sahip olan LLOQ hariç, ±%15 dahilindeydi. Karboplatin, köpek plazma örneklerinde kısa vadeli stabilite (24 ◦C’de 4 saat), uzun vadeli stabilite (-70 ◦C’de 70 gün) ve işlem sonrası (18 ◦C’de 42 saat) ve 3 dondurma/çözme döngüsüne kadar (oda sıcaklığı/ -70 ◦C (Ek Bilgiler, Tablo S1) gibi çeşitli stabilite testleri için stabil kalmıştır.
2.6. Plazmada Karboplatin PK Analizi
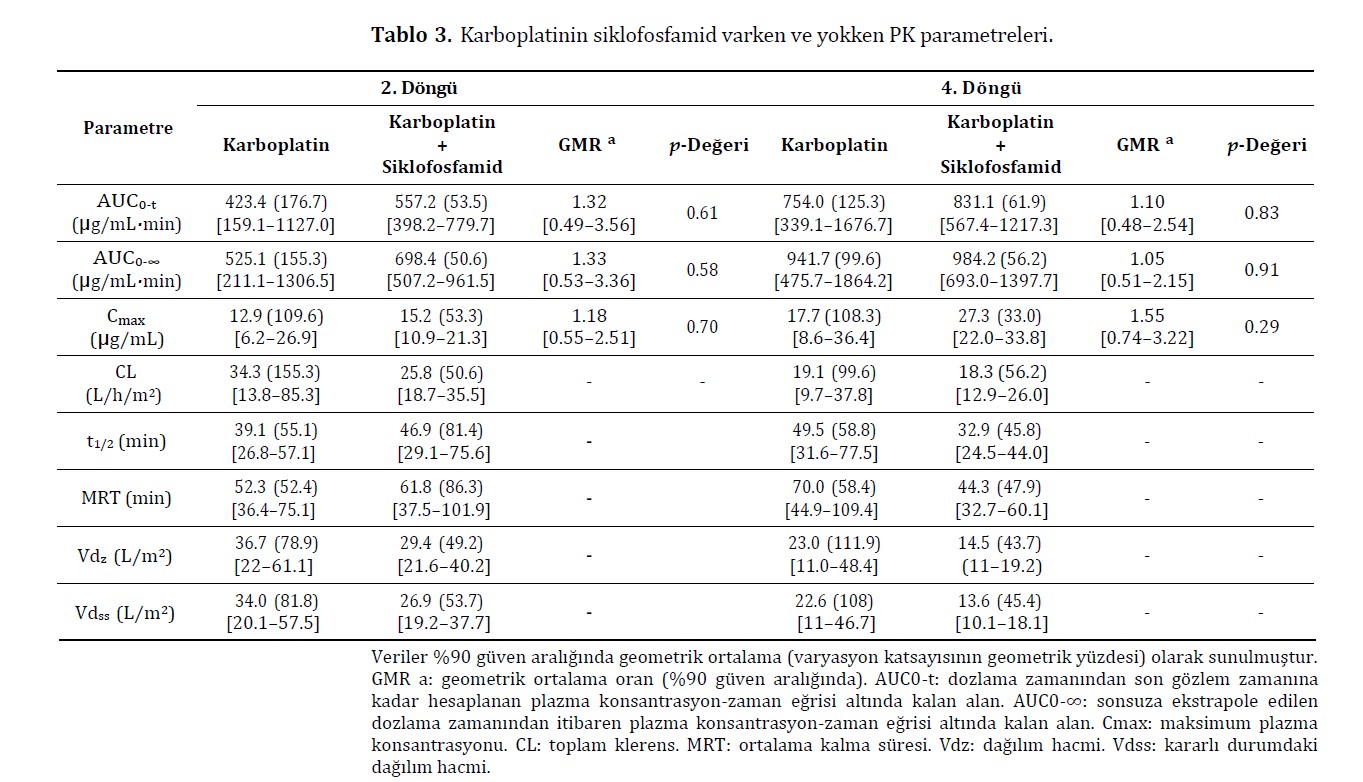
Kompartmental olmayan analiz (NCA) Phoenix 64 WinNon- lin yazılımı v.8.3.4.295 (Certara, Princeton, NJ, ABD) kullanılarak gerçekleştirilmiştir. Eliminasyon yarı ömrünü (λz) elde etmek için plazma konsantrasyon-zaman profilinin terminal eğimi seçilmiştir. Plazma konsantrasyon-zaman eğrisi altında kalan alan, dozlama zamanından son gözlem zamanına kadar (AUC0-t) lineer/log trapezoidal yöntem kullanılarak hesaplanmıştır. AUC0-∞, ölçülen son konsantrasyon (Clast)/λz oranına AUC0-t eklenerek hesaplanmıştır. PK parametrelerinin ortalama kalma süresi (MRT), yarılanma ömrü (t1/2), toplam klerens (CL) ve dağılım hacmi standart NCA denklemlerine göre tahmin edilmiştir. EAA-ekstrapole edilen alanın yüzdesi %20’den büyükse, toplam EAA0-∞’un güvenilmez olduğu kabul edilmiştir. Shapiro-Wilk testi kullanılarak normallik değerlendirildikten sonra, sırasıyla fazlar ve gruplar arasındaki farmakokinetik parametreleri karşılaştırmak için log-dönüşümlü verilerin bağımlı ve bağımsız t-testleri kullanılmıştır. 0,05’ten düşük p değerleri istatistiksel olarak anlamlı kabul edilmiştir. Her gruptaki PK parametreleri için tanımlayıcı istatistikler geometrik ortalamalar ve geometrik varyasyon katsayıları olarak gösterilmiştir. Geometrik ortalama oranının 0,8-1,25 aralığında %90 güven aralığına (%90 CI) sahip olması durumunda, tedavilerin eşdeğer olduğu kabul edilmiştir [18]. İstatistiksel analiz R yazılımı v.4.3.1 [19] kullanılarak gerçekleştirilmiş ve grafikler ggplot2 paketi v.3.3.6 [20] kullanılarak oluşturulmuştur.
2.7. Takip Amaçlı Muayene ve Sağkalım Oranı
Klinik ve laboratuvar testleri 15 günde bir yapıldı. Torasik radyolojik incelemeler ve tüm batın ultrasonları aylık olarak yapıldı. Karboplatin ile konvansiyonel kemoterapi döngüsünün (altı seans) tamamlanmasından bir ay sonra ve siklofosfamid ile metronomik kemoterapinin (sekiz ay) sonunda, hayvanlar klinik olarak laboratuvar testleriyle değerlendirildi ve nötrofil, trombosit ve kırmızı hücre parametrelerinin normal aralıkta olduğu görüldü. Bu kontroller deneyin sonuna ya da hayvanın ölümüne kadar devam ettirilmiştir. Genel sağkalım süresi, primer tümörün cerrahi eksizyonu ile hastalık nedeniyle ölüm tarihi veya çalışmanın tamamlanma tarihi arasındaki süre (gün olarak) olarak tanımlanmıştır. Hayvanların genel sağkalımları deneyin sonunda hasta sahipleri ile yapılan telefon görüşmeleri neticesinde teyit edilmiştir.
Tüm hayvanlar kemoterapi sırasında haftalık olarak ve kemoterapi bitiminden sonra çalışmanın sonuna kadar aylık olarak kontrol edilmiştir. Tıbbi personel tarafından ötenazi gerekip gerekmediği değerlendirilmiş ve hayvan sahiplerinin onayı ile ötenazi yapılmıştır [21]. Takip süresi boyunca ölen hastaların ölüm nedenini belirlemek ve olası metastazları veya kemoterapiye bağlı lezyonları tanımlamak için hastalara nekropsi yapılmıştır. Sağkalım ve hastalıksız geçen süre eğrileri Kaplan-Meier yöntemiyle tahmin edilmiş ve sırasıyla tek değişkenli veya çok değişkenli analizde Log-rank (Mantel-Cox) veya Cox testiyle karşılaştırılmıştır. Analizler Prism yazılımı v5.0 (GraphPad, San Diego, CA, ABD) kullanılarak yapılmıştır. Tüm değerlendirmeler için istatistiksel anlamlılık oranı %5 (p < 0,05) olarak belirlenmiştir.
3. Sonuç
3.1. Klinik ve Patolojik Özellikler
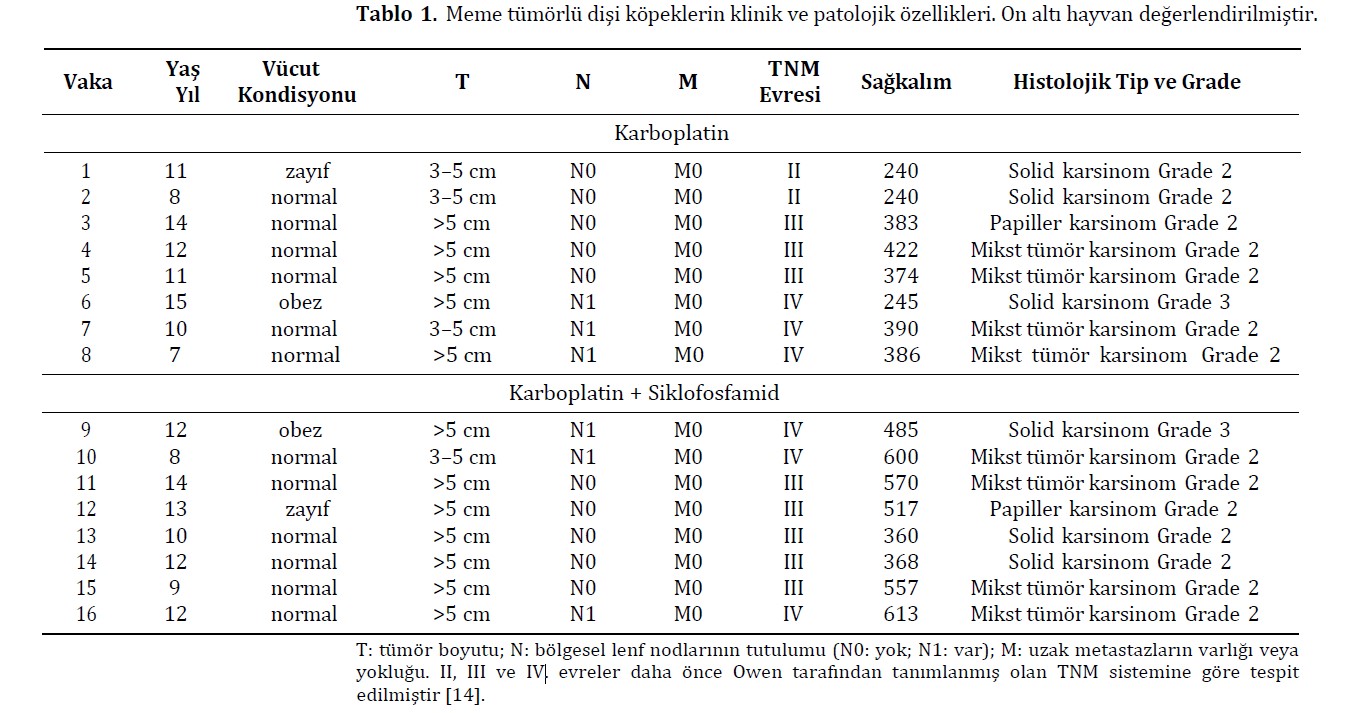
Meme tümörü olan ve kriterlere uygun 50 hayvan arasından, karışık ırklardan 16 dişi köpek mevcut araştırmaya dahil edilmiştir. Diğer tümör tiplerinin varlığı, meme karsinomunun in situ olması, değerlendirme sırasında eşlik eden hastalıklar ve kemoterapi prosedürünün uygulanacağı gün köpeklerin hazır bulunmaması gibi durumlar çalışma dışı bırakma kriteri olarak kabul edilmiştir. Çalışmaya dahil edilen dişi köpeklerin yaşları yedi ila on beş arasında ve ağırlıkları 7 ila 15 kg arasındaydı. Meme tümörlerinin farklı histolojik tiplerine rağmen, gruplar arasında homojen bir dağılım olduğu gözlendi (Tablo 1). Tümörlerin histopatolojik derecelendirmesi için invaziv alanlar kullanıldı; on dört tümör grade II ve iki tümör grade III olarak sınıflandırıldı. Klinik evreleme değerlendirmesine göre, köpekler II, III veya IV. evre olarak sınıflandırılmıştır. Ölen dişi köpeklerde nekropsi sonrasında metastatik odakların varlığı doğrulanmış ve organların histopatolojik değerlendirmesi bölgesel metastazdan bağımsız olmak üzere daha kötü prognoz nedeniyle V. evre olarak yeniden sınıflandırılmıştır.
3.2. Yan Etkiler
Kemoterapi süreci göz önüne alındığında, dişi köpeklerin %81,25’i (13/16), belirlenen protokolde planlandığı gibi, 21 gün arayla altı seansı tamamlamıştır.
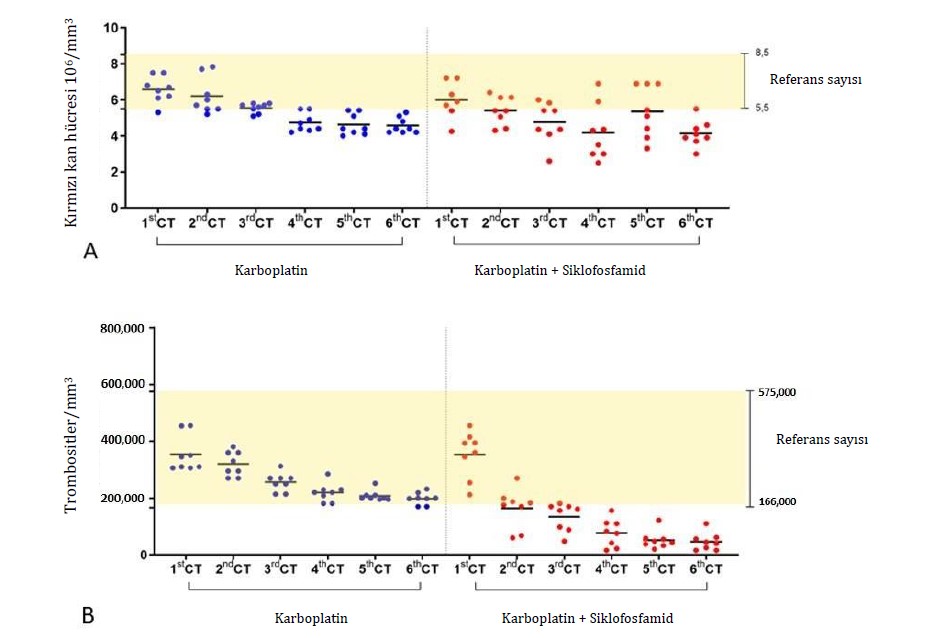
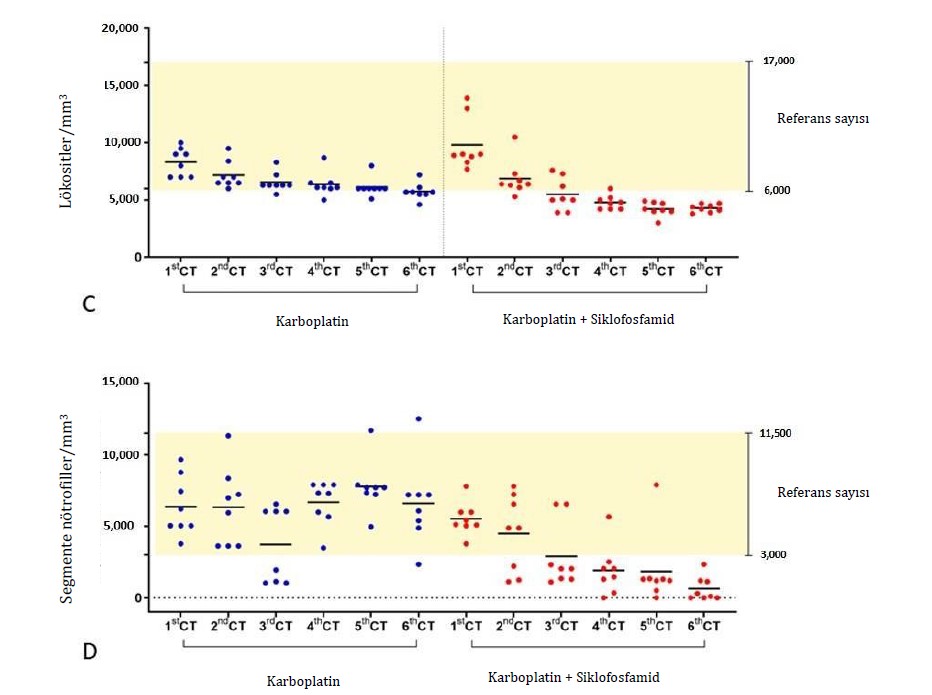
Tedavi edilen gruptan bağımsız olarak, hematolojik parametrelerin iyileşmesi için ortalama toplam beş gün gözlem yapılmıştır. Bununla birlikte, tedavi sırasında daha önemli hematolojik değişiklikler gösteren hayvanlar için, hematolojik iyileşme için gereken süre, karboplatin grubu için ortalama yedi gün ve karboplatin + siklofosfamid grubu için on gün olmuştur. Bu durumlarda, metronomik gruptaki iki hayvan ve karboplatin tedavi grubundaki bir hayvan için, tam anlamıyla klinik iyileşmeye ulaşmak amacıyla seanslar arasındaki süreyi 28 güne çıkarmamız gerekti. Tedavinin yan etkileri arasında, dişi köpeklerin %18,75’inde (3/16) kemoterapi seansından iki gün sonrasına kadar ve ilacın en az verildiği dönemde kusma ve %12,5’inde (2/16) çoğunlukla G2’de ishal görülmüştür. Kemoterapi seansı ve tedavi grubu dağılımına bakılmaksızın, değerlendirilen köpeklerin çoğu yan etki göstermemiş veya herhangi bir müdahale endikasyonu olmaksızın hafif reaksiyonlar göstermiştir. Gruplar arasında yan etkilerin derecesi açısından herhangi bir fark yoktu (Şekil 1; Tablo 2). Başlıca hematolojik yan etkiler arasında anemi, trombositopeni ve nötropeni yer almıştır. Trombositopeni her iki grup için de en kritik bulgu olmuştur. G1 ile karşılaştırıldığında G2’de kırmızı kan hücrelerinde (p < 0.0001) ve trombositlerde (p = 0.0005) belirgin bir azalma görülmüştür (Şekil 2 A,B). Nötropeni her iki grupta da gözlenmiş, G2’de daha sık olmak üzere toplam lökosit (p = 0.0002) ve parçalı nötrofil (p = 0.0007) sayılarında azalma görülmüştür (Şekil 2 C,D). Deney grupları arasında klinik biyokimya ve idrar tahlili parametrelerinde belirgin bir farklılık gözlenmemiştir. Siklofosfamid tedavisi gören hiçbir hayvanda sistit görülmemiştir.
Şekil 1. Meme karsinomlu dişi köpeklerde kemoterapi protokolüne göre her kemoterapi (KT) seansındaki yan etki derecelerinin karşılaştırılması. Buradaki sınıflandırma, VCOG tarafından belirlenen sınıflandırmaya göre yapılmıştır [15]. Wilcoxon işaretli sıralar testi çiftler halinde uygulanmış ve tüm kemoterapi seanslarında gruplar arasında istatistiksel olarak anlamlı bir fark olmadığı (p < 0.05) görülmüştür.
3.3. Karboplatinin Farmakokinetik Analizi
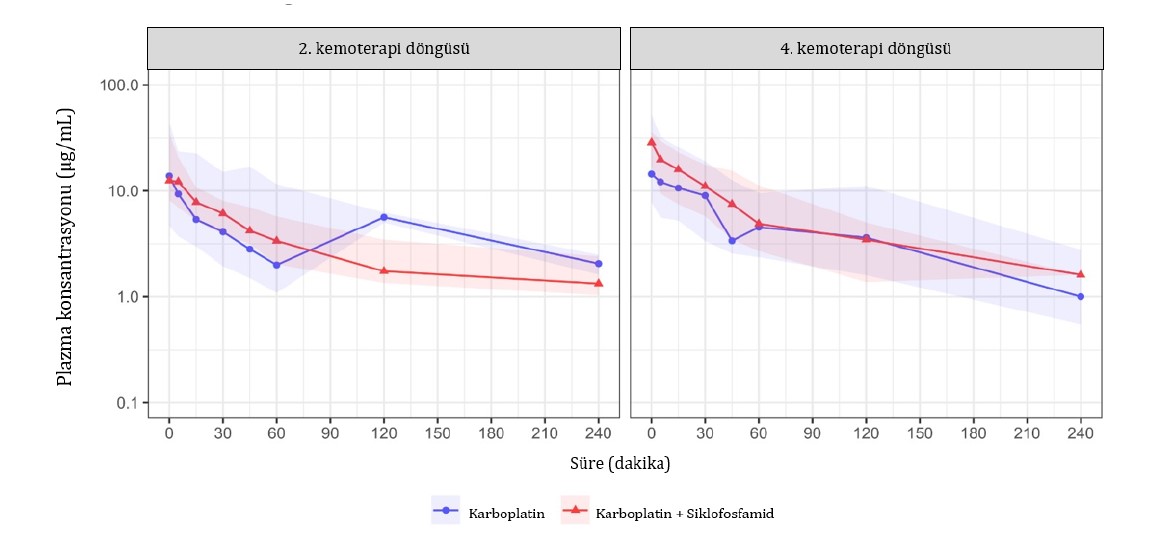
HPLC ile köpek plazmasında karboplatin analizi için kullanılmak üzere uygun bir yöntem geliştirilmiş ve geçerliliği doğrulanmıştır. Yöntem yeterli miktarda doğrusallık, kesinlik, doğruluk, stabilite ve güven sınırları göstermiş ve köpeklerde karboplatinin plazma konsantrasyonlarını belirlemek için başarılı bir şekilde kullanılmıştır (Tablo S1). G1’den iki hayvan, ekstrapole edilen AUC alanının %20’den düşük olması kriterini karşılamadığı için istatistiksel analizden çıkarılmıştır. Verilerin log-dönüşümünden sonra normal dağılım gösterdiği kabul edilmiş (Ek Tablo S2) ve boxplots olarak sunulmuştur (Şekil S1). Karboplatin PK bireyler arası yüksek değişkenlik göstermiştir. Sadece karboplatin ile tedavi edilen hayvanlarda EAA’da 10 katlık bir varyasyon gözlenmiştir. Geometrik ortalama EAA0-∞ 2. ve 4. döngülerde sırasıyla 525,1 ve 941,7 μg dk/mL (Tablo 3, Şekil 3). CL değerleri sadece karboplatin alan hayvanlarda 2. ve 4. döngülerde sırasıyla 34,3 ve 19,1 L/h/m2 olmuştur. Karboplatin ve siklofosfamid alan hayvanlarda CL 2. döngüde 25,8 ve 4. döngüde 18,3 L/h/m2 olmuştur (Tablo 3). Diğer PK parametrelerinde herhangi bir farklılık gözlenmemiştir. Karboplatine sistemik plazma maruziyetinin her iki tedavide de eşdeğer olduğu düşünülmüştür. Kombine tedavi ile tedavi edilen köpekler 2. ve 4. dozlarda sırasıyla 698,4 ve 984,2 μg dk/mL karboplatin EAA0-∞ değerleri göstermiştir (Tablo 3). Karboplatin + siklofosfamid protokolü alan hayvanlarda, 2. kür ile 4. kür karşılaştırıldığında, karboplatinin Cmaks değeri sadece 4. kürde artmıştır. AUC0-t ve AUC0-∞, her iki grup için de 2. ve 4. döngülerde benzerdi (Ek Bilgiler, Tablo S3).
Şekil 2. Karboplatin (G1) veya karboplatin + siklofosfamid tedavileri (G2) ile kemoterapideki (KT) terapötik toksisitenin hematolojik biyobelirteçlerinin karşılaştırılması. (A) Toplam eritrositler, (B) trombositler, (C) toplam lökositler ve (D) nötrofil granülositler. Kemoterapinin başlamasından yaklaşık 48 saat önce idrar analizi, tam kan sayımı ve serum biyokimya analizi için biyolojik örnekler alınmıştır. 1. KT’de bu değerler tüm analizler için başlangıç değeri olarak kabul edilmiştir. Wilcoxon işaretli sıralar testi çiftler halinde uygulanmış ve tüm hematolojik biyobelirteçler için gruplar arasında p < 0.05 düzeyinde istatistiksel olarak anlamlı farklılıklar göstermiştir.
Şekil 3. Meme karsinomlu dişi köpeklerde ikinci ve dördüncü kemoterapi döngülerinde karboplatin farmakokinetik (PK) profilleri. Dişi köpekler, metronomik bir rejimde 12,5 mg/m2/gün oral siklofosfamid eşliğinde (mavi) ve (kırmızı) olmadan seanslar arasında yirmi bir günlük aralıklarla altı kemoterapi seansında 300 mg/m2 karboplatinin 5 dakika intravenöz (i.v.) infüzyonu ile tedavi edilmiştir. PK profilleri ortalama değerler için düz çizgiler ve 5.-95. persantiller için gölgeli alanlar şeklinde gösterilmiştir.
3.4. Sağkalım süresi
Gözlenen minimum sağkalım süresi sadece karboplatin alan ve akciğer metastazı nedeniyle öldüğü histopatolojik değerlendirme ile teyit edilen dişi bir köpekte 240 gün olmuştur. Maksimum sağkalım süresi mastektomiden sonra 613 gün olup, bu süre karboplatin + siklofosfamid alan ve halen gözlem altında tutulan gruptan bir köpeğe ait olmuştur.
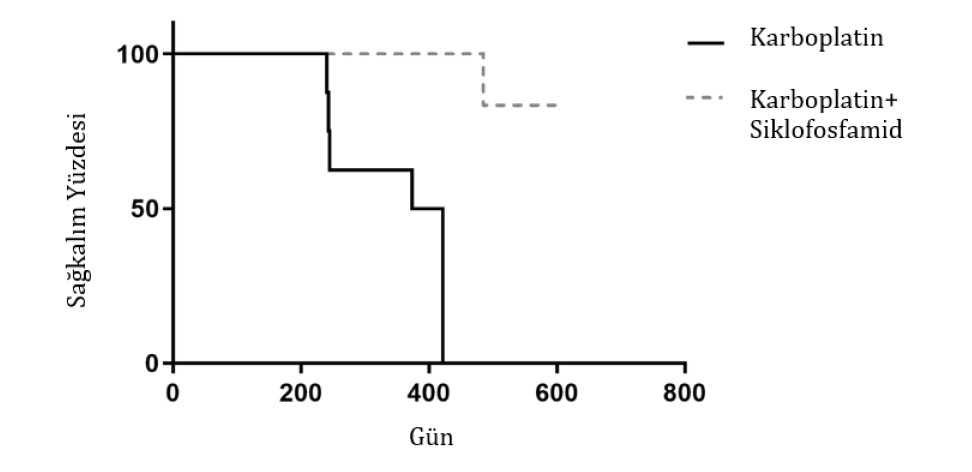
Karboplatin ile tedavi edilen gruptaki (G1) ortalama sağkalım oranı 398 gün iken, karboplatin + siklofosfamid grubundaki (G2) ortalama değere ulaşmamıştır (Şekil 4). Karboplatin + siklofosfamid grubu (G2) sağkalım eğrileri ile karboplatin grubu (G1) arasında istatistiksel olarak anlamlı farklar vardı. G1’de kanserin ilerlemesi (metastaz) nedeniyle ölümlerin daha fazla olduğu görülmüştür (n = 5/8; %62,5, p = 0,0117, HR 10,06 ve IC %95 1,839-54,99) (Şekil 4). Nekropsi sonrasında, en çok uzak metastaz görülen bölgeler akciğerler, deri ve karaciğerdi ve başlıca ölüm nedeni akut solunum yetmezliğiydi. G2’de, kemoterapi ile ilgisi olmayan ileri kalp yetmezliği nedeniyle sadece bir ölüm tespit edilmiştir. Çalışma süresi boyunca tüm hayvanları takip edebildiğimiz için hiçbir hayvan sansürlenmemiştir.
Şekil 4. Karboplatin ile ilişkili (kesikli çizgi) veya metronomik siklofosfamid ile ilişkili olmayan (düz çizgi) tedaviden sonra dişi köpeklerin sağkalım eğrisi.
4. Tartışma
Dişi köpeklerde görülen yüksek insidans nedeniyle, meme karsinomlarının tedavisinde güvenli ve etkili multimodal farmakolojik stratejilere ihtiyaç duyulmaktadır. Elde ettiğimiz veriler, karboplatin tedavisine düşük dozlarda oral siklofosfamid eklenmesinin hematolojik parametrelerin değerlerini ciddi oranda düşürdüğünü göstermektedir. Ancak, bu etkiler klinik sonuçları tetiklemek veya köpeklerin yaşam kalitesini etkilemek için yeterli olmamıştır. Metronomik siklofosfamid ile tedavi edilen osteosarkomlu köpeklerde de benzer sonuçlar gözlenmiş, ilişkili herhangi bir klinik bulgu olmaksızın laboratuvarlarda hafif değişiklikler görülmüştür [13].
Karboplatinin yan etkileri arasında böbrek rahatsızlıkları, gastrointestinal etkiler (anoreksi, kusma ve kabızlık gibi) ve karaciğer toksisitesi yer almaktadır [7]. Her iki gruptaki dişi köpeklerin böbrek ve karaciğer fonksiyonları çalışma süresi boyunca kemoterapiden etkilenmemiştir. Doksorubisin ve siklofosfamid alan meme tümörlü dişi köpeklerde serum biyokimya parametrelerinde (kreatinin, üre ve alanin aminotransferaz) herhangi bir değişiklik bildirilmemiştir [7]. Temel olarak nötropeni ve trombositopeni ile karakterize olan miyelosupresyon, karboplatin tedavisinden yaklaşık 14 ila 21 gün sonra bildirilmiştir [22]. Coffee ve arkadaşları [23] kilo kaybı ile kemoterapiye bağlı miyelosupresyon riski arasında bir ilişki olduğunu belirtmiştir. Mevcut araştırmada, hematolojik parametreler dişi köpeklerin vücut ağırlığına göre değişmediğinden dolayı bahsedilen ilişki gözlemlenmemiştir.
Karboplatin + siklofosfamid ile tedavi edilen köpeklerde metastazın varlığına veya yokluğuna bakılmaksızın sağkalımda artış gözlenmiştir. Benzer şekilde, karboplatin + metronomik talidomid ve siklofosfamid ile tedavi edilen dişi köpekler, karboplatin + siklofosfamid grubundakilerle karşılaştırıldıklarında sağkalım süresi daha uzun olmuştur [24]. Sadece karboplatin ile tedavi edilen beş dişi köpek hastalığın ilerlemesi nedeniyle öldü (5/16). Bu hayvanlara nekropsi yapıldı ve akciğer, deri ve karaciğerde uzak metastazlar gözlendi. Ölüm nedeni olarak akut solunum yetmezliği tespit edilmiştir.
Ölüm nedeni ve geç metastazların varlığı göz önüne alındığında, benzer sonuçlar Costa-Santos ve arkadaşları tarafından da tanımlanmıştır [25]. Bu çalışmada, etkilenen organların histolojik analizleri metastazların varlığını doğrulamıştır.
Bu çalışma, metronomik siklofosfamidin köpeklerde karboplatinin kinetik dağılımı üzerindeki etkisini ilk kez ortaya koymaktadır. Daha önce yapılan bir çalışmada, osteosarkomlu köpeklerde kombine metronomik tedavi ve maksimum tolere edilebilir doz kemoterapisinde ilaç toksisitesi araştırılmış, ancak yazarlar karboplatin PK verilerini rapor etmemişlerdir [8]. Ekstremite amputasyonu ve karboplatin kemoterapisini takiben apendiküler osteosarkomlu köpeklerde adjuvan meloksikam ile metronomik siklofosfamidin etkinliğini araştıran başka bir çalışmada da karboplatin PK verileri rapor edilmemiştir [13]. Metronomik kemoterapinin metastaz indeksini düşürdüğü ve yan etkileri azalttığı, böylece köpeklerin yaşam kalitesini ve refahını artırdığı belirtilmiştir [26,27].
Yapılan önceki çalışmalarda 30-580 mg/m2 doz aralığında tedavi edilen köpeklerde karboplatin PK’sı rapor edilmiştir [15,22,28,29]. Karboplatin, köpeklere terapötik dozlarda uygulandığında PK doğrusaldır [28]. Fare, köpek veya insan plazma proteinlerine anında ve geri dönüşümlü olarak bağlanmaz [30]. Sisplatinin aksine, karboplatin plazma proteinlerine yavaş bağlanır (%24-50) [28,31]. Renal ekskresyon, insanlarda (%57-82) ve köpeklerde (%46-70) karboplatin eliminasyonunun birincil yoludur [32-34]. İnsanlarda karboplatin klerensi yüksek oranda glomerüler filtrasyon hızı ile ilişkilidir [32]. Elde ettiğimiz sonuçlar, meme karsinomlu dişi köpeklerde karboplatin PK’sinin düşük doz siklofosfamidin birlikte uygulanmasından etkilenmediğini göstermektedir. Karboplatin + siklofosfamid ile tedavi edilen hayvanlar, 2. ve 4. kemoterapi döngülerinde plazma Cmax ve AUC değerleri ile değerlendirildiğinde eşdeğer sistemik maruziyet sonuçları göstermiştir. Karboplatine toplam sistemik maruziyet (EAA) 2. ve 4. döngülerde benzerdi (Tablo S3). Karboplatin Cmaks değeri 4. döngüde yalnızca karboplatin + siklofosfamid alan hayvanlarda artmıştır. Siklofosfamid PK parametreleri araştırılmamış olsa da, artan karboplatin Cmaks değerinin zaman içinde kan sayımı parametreleri üzerindeki kümülatif etkiyle ilişkili olabileceğini söyleyebiliriz.
Kombine kemoterapi tedavileri, farklı etki mekanizmalarına sahip oldukları ve daha fazla sayıda neoplastik hücreye ulaştıkları için tümörlü hayvanların sağkalımını uzatarak tedavinin etkinliğini artırmaktadır. Karboplatinin etki mekanizması DNA zincirleri içinde ve arasında bağlantı kurulması yoluyla meydana gelir ve non-spesifik hücre döngüsü fazında protein sentezini inhibe eder [35]. Karboplatin, nükleofilik gruplara bağlanan platin kompleksleri ile reaksiyona girmek için hücre içinde aktive olur, bu da DNA’da inter ve intra pilgrimler üretir ve bunların replikasyonunu, RNA transkripsiyonunu ve protein sentezini inhibe eder. Bu da apoptoz ve neoplastik hücrelerin büyümesinin engellenmesiyle sonuçlanır [36].
Siklofosfamid güçlü bir antianjiyojenik ve immünomodülatör kapasiteye sahiptir ve kademeli olarak tümörlerin kontrol altına alınmasına katkıda bulunur [12]. Siklofosfamide maruz kaldıklarında, tümör vaskülatüründeki endotel hücreleri sitotoksik ilaçlardan [37-39] seçici bir apoptoz indüksiyonu ve seçici proliferasyon ve migrasyon inhibisyonu ile doğrudan etkilenir [40-42]. Bu hücreler aynı zamanda anjiyojenik faktörlerin modülasyonundan da dolaylı olarak etkilenmektedir – anti-anjiyojenik faktörlerin (örn. en- dostatin ve trombospondin-1 [TSP-1]) upregülasyonu ve pro-anjiyojenik faktörlerin downregülasyonu (örn, vasküler endotelyal büyüme faktörü [VEGF], bazik fibroblast büyüme faktörü [bFGF], hipoksi ile indüklenebilir faktör-1α [HIF-1α] ve anjiyopoeitin grubu) [2,39]. Siklofosfamidin immünomodülatör işlevleri arasında interferon gammanın uyarılması, doğal öldürücü T lenfositlerin artması, dendritik hücrelerin olgunlaşması ve hafıza T hücrelerinin yaşam süresinin artması sayılabilir. Bu ilaç ayrıca TGF-b, IL-10 ve IL-2 gibi immünosupresif sitokinlerin konsantrasyonunu azaltarak ve düzenleyici T lenfositlerinin sayısını azaltarak da etki gösterir [26]. Dolayısıyla, siklofosfamid ile ilişkili karboplatin mekanizmasının kombinasyonu, sitotoksik, antianjiyojenik ve immünomodülatörler gibi farklı mekanizmalarla antineoplastik bir etki yaratarak neoplastik büyüme progresyonunun kontrol altına alınmasını ve hastanın daha uzun süre hayatta kalmasını sağlar.
Karboplatin + siklofosfamid ile tedavi edilen köpeklerde klinik biyokimya ve kan sayımları ile yan etkiler veya diğer klinik sonuçlar arasında herhangi bir ilişki bulunmamıştır. Bu nedenle, bölgesel lenf nodu metastazı veya orta/yüksek gradeli meme karsinomu olan dişi köpeklerde karboplatin + metronomik siklofosfamid tedavisi sadece karboplatin ile yapılan tedaviden daha üstündür. Bununla birlikte, metronomik rejimde tek başına siklofosfamidin meme karsinomlu köpeklerin sağkalımı üzerindeki etkisini değerlendiren çalışmalar yapılmasına ihtiyaç vardır.
5. Sonuç
Elde ettiğimiz sonuçlar, karboplatine sistemik plazma maruziyetinin her iki kemoterapi rejimindeki hayvanlarda eşdeğer olduğunu göstermiştir. Artan sağkalım oranı göz önüne alındığında, karboplatin + metronomik siklofosfamid, yüksek gradeli veya metastatik meme karsinomlu dişi köpekler için tamamlayıcı nitelikte tedavi edici bir alternatiftir. Bu umut verici kombinasyon tedavisini değerlendirmek için daha fazla prospektif, randomize, daha büyük ölçekli klinik çalışmalar yapılması gerekmektedir.
Ek Bilgiler: Aşağıdaki ek bilgiler şu adresten indirilebilir: https://www.mdpi.com/article/10.3390/ani12223109/s1, Tablo S1: Köpek plazmasında karboplatin analizi için HPLC-UV yönteminin validasyonu; Tablo S2: Ham ve log-transformasyonlu değerler için Shapiro-Wilk testleri; Tablo S3: Karboplatinin 2. ve 4. kemoterapi döngülerindeki PK parametreleri; Şekil S1: Siklofosfamid eşliğinde ve olmaksızın karboplatinin PK parametrelerinin boxplots grafikleri.
Katkıda bulunan yazarlar: Kavramsallaştırma, A.E.-L., A.L.P.C.G., M.C.M. ve N.V.d.M.; Veri yönetimi, M.C.M., A.E.-L., A.L.P.C.G. ve N.V.d.M.; Formal analiz, M.C.M., A.E.-L., P.A.Y., N.V.d.M, A.L.P.C.G. ve L.F.P.; Fon bulma, A.E.-L.; Araştırma, M.C.M., P.A.Y. ve F.M.F.N.; Metodoloji, A.E.-L., A.L.P.C.G., M.C.M. ve N.V.d.M.; Proje yönetimi, A.E.- L. ve A.L.P.C.G.; Danışmanlık, A.E.-L. ve A.L.P.C.G.; Onaylama, M.C.M., A.E.-L., P.A.Y., N.V.d.M. ve A.L.P.C.G.; Görselleştirme, M.C.M., A.E.-L., A.L.P.C.G., N.V.d.M., P.A.Y., L.F.P., F.M.F.N., R.D.P., S.M.B.-M. ve A.H.-B.; Yazım-orijinal taslak hazırlama, M.C.M., A.E.-L., A.L.P.C.G. ve N.V.d.M.; Yazım- gözden geçirme ve düzenleme, M.C.M., A.E.-L., A.L.P.C.G., N.V.d.M., P.A.Y., L.F.P., F.M.F.N., R.D.P., S.M.B.-M. ve A.H.-B. Tüm yazarlar makalenin yayınlanan versiyonunu okumuş ve kabul etmiştir.
Fon desteği: Bu çalışma Bahia Eyaleti Araştırma Destek Vakfı (FAPESB), n◦ 023/2014 PROINTER ve Coordenação de Aperfeiçoamento de Pessoal de Nível Superior-Brasil (CAPES)-Finance Code 001 tarafından finanse edilmiştir. AEL (Proc. 310248/2021-3), SMBM (Proc. 312022/2021-2) ve RDP (Proc. 313350/2019-1), Ulusal Bilimsel ve Teknolojik Gelişim Konseyi (CNPq) tarafından araştırma ve teknolojik gelişim bursları ile desteklenmektedir.
Etik Kurul Beyanı: Burada sunulan araştırma prosedürleri, Bahia Federal Üniversitesi Veterinerlik Fakültesi Etik Kurulu tarafından onaylanmıştır (protokol no. 90/2017). Bu çalışmada listelenen tüm prosedürler, Brezilya Deneylerde Hayvan Kullanımı Kurulu (COBEA) tarafından belirlenen kılavuzlara göre yürütülmüştür. Tüm hayvanlar evcilleştirilmiş ve köpek bakıcıları serbest ve bilgilendirilmiş onam formu imzalayarak araştırma projesinin detayları hakkında bilgilendirilmiştir.
Bilgilendirilmiş Onam Beyanı: Mevcut değil.
Veri Erişim Beyanı: Bu çalışmanın bulgularını destekleyen veriler, talep edilmesi halinde ilgili yazar tarafından temin edilebilir.
Çıkar Çatışması Beyanı: Yazarlar, araştırmanın çıkar çatışmasına sebep olabiliecek herhangi bir ticari veya finansal ilişki olmaksızın yürütüldüğünü beyan etmişlerdir.
Kaynakça
1.Veterinary Society of Surgical Mammary Tumors—Canine. 2019. Available online: https://vsso.org/mammary-tumors- canine/ (accessed on 8 October 2022).
2.Biller, Metronomic Chemotherapy in Veterinary Patients with Cancer. Vet. Clin. N. Am. Small Anim. Pract. 2014, 44, 817–829.[CrossRef] [PubMed]
3.Fares, J.E.; El Tomb, P.; Khalil, L.E.; Atwani, R.W.; Moukadem, H.A.; Awada, A.; El Saghir, N.S. Metronomic chemotherapy for patients with metastatic breast cancer: Review of effectiveness and potential use during pandemics. Cancer Treat. Rev. 2020, 89, [CrossRef] [PubMed]
4. Cassali, G.D.; Jark, P.C.; Gamba, C.; Damasceno, K.; Estrela-Lima, A.; Nardi, A.; Ferreira, E.; Horta, R.; Firmo, B.; Sueiro, F.; et al. Consensus Regarding the Diagnosis, Prognosis and Treatment of Canine and Feline Mammary Tumors–2019. Braz. J. Vet. Pathol. 2020, 13, 555–574. [CrossRef]
5. Klahn, S. Chemotherapy Safety in Clinical Veterinary Oncology. Vet. Clin. N. Am. Small Anim. Pract. 2014, 44, 941–963. [CrossRef]
[PubMed]
6. Kareva, I.; Waxman, D.J.; Klement, G.L. Metronomic chemotherapy: An attractive alternative to maximum tolerated dose therapy that can activate anti-tumor immunity and minimize therapeutic resistance. Cancer Lett. 2014, 358, 100–106. [CrossRef] [PubMed]
7. Lavalle, G.E.; De Campos, C.B.; Bertagnolli, A.C.; Cassali, G.D. Canine malignant mammary gland neoplasms with advanced clinical staging treated with carboplatin and cyclooxygenase inhibitors. In Vivo 2012, 26, 375–379. [PubMed]
8. Bracha, S.; Walshaw, R.; Danton, T.; Holland, S.; Ruaux, C.; Obradovich, J. Evaluation of toxicities from combined metronomic and maximal-tolerated dose chemotherapy in dogs with osteosarcoma. J. Small Anim. Pract. 2014, 55, 369–374. [CrossRef]
9. Rossi, F.; Sabattini, S.; Vascellari, M.; Marconato, L. The impact of toceranib, piroxicam and thalidomide with or without hypofractionated radiation therapy on clinical outcome in dogs with inflammatory mammary carcinoma. Vet. Comp. Oncol. 2018, 16, 497–504. [CrossRef]
10. Alonso-Miguel, D.; Valdivia, G.; José, P.G.S.; Alonso-Diez, A.; Clares, I.; Portero, M.; Peña, L.; Pérez-Alenza, M.D. Clinical outcome
of dogs diagnosed with canine inflammatory mammary cancer treated with metronomic cyclophosphamide, a cyclooxygenase-2 inhibitor and toceranib phosphate. Vet. Comp. Oncol. 2022, 20, 179–188. [CrossRef]
11. Banys-Paluchowski, M.; Schütz, F.; Ruckhäberle, E.; Krawczyk, N.; Fehm, T. Metronomic Chemotherapy for Metastatic Breast Cancer—A Systematic Review of the Literature. Geburtshilfe Frauenheilkd. 2016, 76, 525–534. [CrossRef]
12. Gaspar, T.B.; Henriques, J.; Marconato, L.; Queiroga, F.L. The use of low-dose metronomic chemotherapy in dogs-insight into a modern cancer field. Vet. Comp. Oncol. 2018, 16, 2–11. [CrossRef] [PubMed]
13. Matsuyama, A.; Schott, C.R.; Wood, G.A.; Richardson, D.; Woods, J.P.; Mutsaers, A.J. Evaluation of metronomic cyclophosphamide chemotherapy as maintenance treatment for dogs with appendicular osteosarcoma following limb amputation and carboplatin chemotherapy. J. Am. Vet. Med. Assoc. 2018, 252, 1377–1383. [CrossRef] [PubMed]
14. Machado, M.C.; Da Costa-Neto, J.M.; Portela, R.; D’Assis, M.J.M.H.; Martins-Filho, O.A.; Barrouin-Melo, S.M.; Borges, N.F.; Silva, F.L.; Estrela-Lima, A. The effect of naltrexone as a carboplatin chemotherapy-associated drug on the immune response, quality of life and survival of dogs with mammary carcinoma. PLoS ONE 2018, 13, e0204830. [CrossRef] [PubMed]
15. Villarino, N.; Cox, S.; Yarbrough, J.; Martiãn-Jimãnez, T. Determination of carboplatin in canine plasma by high-performance
liquid chromatography. Biomed. Chromatogr. 2009, 24, 908–913. [CrossRef] [PubMed]
16. Owen, L.N.; World Health Organization. Veterinary Public Health Unit & WHO Collaborating Center for Comparative Oncology; Owen, L.N., Ed.; TNM Classification of Tumours in Domestic Animals; World Health Organization: Geneva, Switzerland, 1980. Available online: https://apps.who.int/iris/handle/10665/68618 (accessed on 14 July 2022).
17. Veterinary Cooperative Oncology Group. Common terminology criteria for adverse events (VCOG-CTCAE) following chemother- apy or biological antineoplastic therapy in dogs and cats v1.1. Vet. Comp. Oncol. 2016, 14, 417–446. [CrossRef]
18. Clinical Pharmacology; Therapeutics Editorial Team. Statistical Guide for Clinical Pharmacology & Therapeutics. Clin. Pharmacol. Ther. 2010, 88, 150–152. [CrossRef]
19. R Core Team. R: A Language and Environment for Statistical Computing. 2020. Available online: https://www.r-project.org/ (accessed on 8 October 2022).
20. Wickham, H. Ggplot2: Elegant Graphics for Data Analysis; Springer: New York, NY, USA, 2016. Available online: https://ggplot2
.tidyverse.org/ (accessed on 8 October 2022).
21. Underwood, W.; Anthony, R. AVMA Guidelines for the Euthanasia of Animals: 2020 Edition. Retrieved on 30 March 2001–2020. 2013. Available online: https://www.avma.org/sites/default/files/2020-01/2020-Euthanasia-Final-1-17-20.pdf (accessed on 8 October 2022).
22. Page, R.L.; McEntee, M.C.; George, S.L.; Williams, P.L.; Heidner, G.L.; Novotney, C.A.; Riviere, J.E.; Dewhirst, M.W.; Thrall, D.E. Pharmacokinetic and Phase I Evaluation of Carboplatin in Dogs. J. Vet. Intern. Med. 1993, 7, 235–240. [CrossRef]
23. Coffee, C.; Roush, J.K.; Higginbotham, M.L. Carboplatin-induced myelosuppression as related to body weight in dogs. Vet. Comp. Oncol. 2020, 18, 804–810. [CrossRef]
24. DE Campos, C.B.; Lavalle, G.E.; Monteiro, L.N.; Pêgas, G.R.A.; Fialho, S.; Balabram, D.; Cassali, G.D. Adjuvant Thalidomide and Metronomic Chemotherapy for the Treatment of Canine Malignant Mammary Gland Neoplasms. In Vivo 2018, 32, 1659–1666. [CrossRef]
25. Costa-Santos, K.; Damasceno, K.; Portela, R.D.; Santos, F.L.; Araújo, G.C.; Martins-Filho, E.F.; Silva, L.P.; Barral, T.D.; Santos, S.A.; Estrela-Lima, A. Lipid and metabolic profiles in female dogs with mammary carcinoma receiving dietary fish oil supplementation. BMC Vet. Res. 2019, 15, 401. [CrossRef]
26. Penel, N.; Adenis, A.; Bocci, G. Cyclophosphamide-based metronomic chemotherapy: After 10 years of experience, where do we stand and where are we going? Crit. Rev. Oncol. Hermatol. 2012, 82, 40–50. [CrossRef] [PubMed]
27. Janssens, T.; Brouwers, E.E.M.; De Vos, J.P.; De Vries, N.; Schellens, J.H.M.; Beijnen, J.H. Inductively coupled plasma mass- spectrometric determination of platinum in excretion products of client-owned pet dogs. Vet. Comp. Oncol. 2015, 13, 124–132. [CrossRef] [PubMed]
28. Gaver, ; George, A.; Deeb, G. In vitro stability, plasma protein binding and blood cell partitioning of 14C-carboplatin. Cancer Chemother. Pharmacol. 1987, 20, 271–276. [CrossRef] [PubMed]
29. Chen, ; Wang, W.; Zhou, H.; Huang, J.; Liu, P.; Song, T.; Sun, M. Pharmacokinetic Comparison between Systemic and Local Chemotherapy by Carboplatin in Dogs. Reprod. Sci. 2009, 16, 1097–1102. [CrossRef] [PubMed]
30.Browder, ; Butterfield, C.E.; Kräling, B.M.; Shi, B.; Marshall, B.; O’Reilly, M.S.; Folkman, J. Antiangiogenic scheduling of chemotherapy improves efficacy against experimental drug-resistant cancer. Cancer Res. 2000, 60, 1878–1886. [PubMed]
31. Oguri, ; Sakakibara, T.; Mase, H.; Shimizu, T.; Ishikawa, K.; Kimuram, K.; Smyth, R.D. Clinical pharmacokinetics of carboplatin. Clin. Pharmacol. 1988, 28, 208–215. [CrossRef]
32. O’Dwyer, J.; Stevenson, J.P.; Johnson, S.W. Clinical Pharmacokinetics and Administration of Established Platinum Drugs. Drugs 2000, 59, 19–27. [CrossRef]
33. Samimi, G.; Safaei, R.; Katano, K.; Holzer, A.K.; Rochdi, M.; Tomioka, M.; Goodman, M.; Howell, S.B. Increased Expression of the Copper Efflux Transporter ATP7A Mediates Resistance to Cisplatin, Carboplatin, and Oxaliplatin in Ovarian Cancer Cells. Cancer Res. 2004, 10, 4661–4669. [CrossRef]
34. Holzer, K.; Manorek, G.H.; Howell, S.B. Contribution of the Major Copper Influx Transporter CTR1 to the Cellular Accumulation of Cisplatin, Carboplatin, and Oxaliplatin. Mol. Pharmacol. 2006, 70, 1390–1394. [CrossRef]
35. Larson, A.; Blair, B.G.; Safaei, R.; Howell, S.B. The role of the mammalian copper transporter 1 in the cellular accumulation of platinum-based drugs. Mol. Pharmacol. 2009, 75, 324–330. [CrossRef]
36. Dilruba, ; Kalayda, G.V. Platinum-based drugs: Past, present and future. Cancer Chemother. Pharmacol. 2016, 77, 1103–1124. [CrossRef] [PubMed]
37. Mutsaers, J. Metronomic chemotherapy. Top. Companion Anim. Med. 2009, 24, 137–143. [CrossRef] [PubMed]
38. Mross, ; Steinbild, S. Metronomic anti-cancer therapy—An ongoing treatment option for advanced cancer patients. J. Cancer Ther. Res. 2012, 1, 1–32. [CrossRef]
39. Loven, ; Hasnis, E.; Bertolini, F.; Shaked, Y. Low-dose metronomic chemotherapy: From past experience to new paradigms in the treatment of cancer. Drug Discov. Today 2013, 18, 193–201. [CrossRef]
40. Bocci, ; Nicolaou, K.C.; Kerbel, R.S. Protracted low-dose effects on human endothelial cell proliferation and survival in vitro reveal a selective antiangiogenic window for various chemotherapeutic drugs. Cancer Res. 2002, 62, 6938–6943.
41. Blansfield, J.A.; Caragacianu, D.; Alexander, H.R., III; Tangrea, M.A.; Morita, S.Y.; Lorang, D.; Schafer, P.; Muller, G.; Stirling, D.; Royal, E.; et al. Combining agents that target the tumor microenvironment improves the efficacy of anticancer therapy. Clin. Cancer Res. 2008, 14, 270–280. [CrossRef]
42. Pasquier, ; Kavallaris, M.; André, N. Metronomic chemotherapy: New rationale for new directions. Nat. Ver. Clin. Oncol. 2010, 7, 455–465. [CrossRef]