Laura Marconato1 | Carmit Chalfon2 | Riccardo Finotello3 | Gerry Polton4 | Maria E. Vasconi5 | Maurizio Annoni6 | Damiano Stefanello7 | Paola Mesto8 | Ombretta Capitani2 | Chiara Agnoli2 | Maria Amati9 | Silvia Sabattini2
1Centro Oncologico Veterinario, Bologna, İtalya
2Veteriner Tıp Bilimleri Bölümü, Bologna Üniversitesi, Bologna, İtalya
3Küçük Hayvan Klinik Bilimi Bölümü, Veteriner Bilimleri Enstitüsü, Liverpool Üniversitesi, Neston, İngiltere
4North Downs Specialist Referrals, Bletchingley, İngiltere
5Centro Veterinario Torinese, Torino, İtalya
6Clinica Veterinaria Tibaldi, Milan, İtalya
7Veteriner Hekimliği Bölümü, Milano Üniversitesi, Milano, İtalya
8Centro Medico Veterinario BMVet, Bari, İtalya
9Ospedale Veterinario Città di Pavia, Pavia, İtalya
Özet
Metastatik (III. evre) splenik hemanjiosarkomlu köpekler için tedavi seçenekleri oldukça kısıtlıdır. Genellikle doksorubisin bazlı kemoterapi uygulanmaktadır; ancak bu uygulamayı destekleyecek herhangi bir yayınlanmış veri bulunmamaktadır. Bu çalışmanın amacı splenektomi uygulanan III. evre splenik hemanjiosarkomlu köpeklerde maksimum tolere edilebilir doz kemoterapi (MTD), metronomik kemoterapi (MC) ve hiçbir adjuvan tedavi uygulanmamasının sonuçlar üzerindeki etkisini araştırmaktır. Splenektomiyi takiben MTD kemoterapi, MC veya adjuvan tedavi uygulanmayan III. evre splenik hemanjiosarkomlu köpeklerin tıbbi kayıtları derlendi. Progresyona kadar geçen süre (TTP), sağkalım süresi (ST) ve toksisite incelendi. Çalışmaya yüz üç köpek dahil edilmiştir: 23’ü adjuvan MTD, 38’i MC almış ve 42’si ilaçsız tedavi edilmiştir. Genel ortalama TTP ve ST sırasıyla 50 (%95 güven aralığı [CI], 39-61) ve 55 gün (%95 CI, 43-66) idi. Adjuvan MTD ile tedavi edilen köpeklerde, MC alan köpeklere kıyasla belirgin şekilde daha uzun TTP ve ST görülmüştür (sırasıyla ortalama TTP, 134 vs 52 gün, P = .025; ortalama ST, 140 vs 58 gün, P = .023). En kısa ortalama TTP (28 gün) ve ST (40 gün) sadece splenektomi ile tedavi edilen köpeklerde görülmüştür. Ayrıca, tedaviye bağlı yan etkiler (AE’ler) MTD grubunda bariz şekilde daha fazlaydı (P = .017). Metastatik dalak hemanjiosarkomu olan köpeklerin sonuçları kötüydü. MTD, MC’ye kıyasla daha etkili olsa da, bu grupta toksisite daha yüksekti. İleri evre hemanjiosarkomlu köpeklere adjuvan MTD önerilirken tedaviye bağlı AE’ler ile bu orta dereceli sağkalım süresinin uzunluğu arasında dikkatli bir denge kurulmalıdır.
1 | GİRİŞ
Köpek viseral hemanjiosarkomu, vasküler endotelyal hücrelerin veya kemik iliği kaynaklı endotelyal progenitörlerin meydana getirdiği oldukça malign bir neoplazmdır.1,2 En yaygın primer bölge dalaktır, ancak hemanjiosarkom vasküler sisteme sahip herhangi bir bölgede de gelişebilir.1,3-7
Splenik hemanjiosarkom hızlı büyüme ve erken uzak metastaz ile karakterizedir; çoğunlukla karaciğer, akciğer, periton ve merkezi sinir sistemi bölgelerinde tutulum görülür.1,3,8 Tedavinin merkezinde cerrahi ve devamında adjuvan kemoterapi yer alır.
• Yapılan önceki çalışmalar, tanı anında (III. evre) gross metastatik hastalığı olan köpeklerin sağkalım süresinin (ST) I. veya II. evre hastalığı olan köpeklere kıyasla daha kısa olduğunu göstermiştir.9-12 III. evre splenik hemanjiosarkomlu köpeklerde bildirilen ortalama ST, sadece splenektomiyi takiben 27 ila 65 gün arasında değişmektedir.7,9,10 Tek ajan olarak bir antrasiklin,10,12,13 siklofosfamid veya dakarbazin ile kombinasyon halinde doksorubisin,14 veya vinkristin ve siklofosfamid ile kombinasyon halinde doksorubisin içeren adjuvan maksimum tolere edilebilir doz kemoterapisinin (MTD) eklenmesi,15,16 ortalama 62 ila 195 günlük ST elde edilmiştir. Genel olarak, sağkalım hayal kırıklığı yaratmaya devam etmiştir ve çoğu köpek ilerleyici hastalığa yenik düşmüştür.
Sitotoksik ajanların MTD’leri ile tedavi ederek mümkün olduğunca çok sayıda tümör hücresini ötenazi etmek üzere tasarlanmış ilaç rejimlerinin kullanımı yerine, son zamanlarda metronomik kemoterapi (MC) kullanımı gündeme gelmiştir.17-23 “Metronomik” terimi, ilaçsız uzun aralıklar olmaksızın kronik, eşit aralıklı ve genellikle düşük dozlarda tekli veya kombine kemoterapötik ilaçlardan oluşan tedavi programını ifade eder. MC’nin II. evre dalak hemanjiosarkomu olan köpeklerin sağkalım süresini uzatabileceğine dair çeşitli kanıtlar mevcuttur.24
Şu anda sadece bir çalışmada III. evre splenik hemanjiosarkomlu köpekler incelenmiştir. Bu çalışmada, hem tek başına splenektomi hem de adjuvan MTD veya MC ile birlikte splenektomi sonrası sonuçlar değerlendirilmiştir.9 Adjuvan tıbbi tedavi olmaksızın bildirilen ortalama ST süresi 0,9 ay olmuştur. Yapılan çalışmada adjuvan tedavinin avantajı net bir şekilde ortaya konamamıştır.9 Bu bilgiler bizi, III. evre splenik hemanjiosarkom nedeniyle splenektomi yapılan ve MTD ya da MC’ye karşılık herhangi bir ek tedavi uygulanmayan köpeklerin sonuçlarını ve tedaviye bağlı toksisite profillerini araştırmak amacıyla retrospektif olarak bu çalışmayı yapmaya sevk etmiştir. İlerlemiş hemanjiosarkomu olan bu hasta popülasyonunda kemoterapi kullanımının hiçbir ek tedaviye üstün olmayacağı ve MC’nin MTD’ye benzer şekilde etkili olacağı ancak daha iyi tolere edileceği varsayılmıştır.
2 | MATERYAL VE METOD
Çok kurumlu, retrospektif bir çalışma gerçekleştirilmiştir. İtalyan Veteriner Onkoloji Derneği (SIONCOV) üyelerinden, splenektomi yapılan ve tıbbi bilgileri metastatik hastalığın yerini, tedaviyi, tedaviye yanıtı ve sonucu değerlendirmek için yeterli olan III. evre splenik hemanjiosarkomlu köpekleri belirlemek için 2011-2018 yılları arasındaki kayıtları araştırmaları istenmiştir. Çalışmaya yalnızca dikişler alındığı sırada hayatta olan köpekler dahil edilmiştir.
Dahil edilme kriterleri, köpeklerin histolojik olarak doğrulanmış, cerrahi olarak çıkarılmış dalak hemanjiosarkomları ile sunulması ve ameliyattan sonraki 48 saat içinde fizik muayene, hematoloji, serum biyokimyası, 3 görünümlü torasik radyografiler ve abdominal ultrason veya tüm vücut bilgisayarlı tomografisi (TBCT) dahil olmak üzere temel evrelemeye tabi tutulmasıydı. Çalışmaya yalnızca III. evre (ölçülebilir metastazlar) hastalığı olan köpekler dahil edilmiştir. Viseral metastatik hastalığın sitolojik veya histolojik olarak doğrulanması gerekiyordu. Pulmoner nodülleri olan köpeklerin yalnızca görüntüleme sonuçlarına bakılarak akciğer metastazı olduğu varsayılmıştır.
Torasik radyografi ve abdominal ultrason ile takip amaçlı muayene, klinisyenin takdirine ve hasta sahibinin tercihine bağlı olarak gerçekleştirilmiştir. Takip amaçlı görüntüleme yapılmaması çalışmadan çıkarılma kriteri olarak kabul edilmemiştir çünkü görüntülemenin düzenli bir şekilde yapılması, hasta sahiplerinin tercihi, maddi kısıtlamalar ve hastaların klinik durumundan doğrudan etkilenebilmektedir.
MTD kemoterapi, MC veya ek onkolojik tedavi uygulanmayan köpeklerden elde edilen sonuçlar değerlendirilmiştir. Maksimum tolere edilebilir doz kemoterapisi, kemoterapi ajanlarının, ilacın kesildiği zaman aralığını uzun tutarak, önerilen maksimum dozda uygulanması şeklinde tanımlanmıştır. Metronomik kemoterapi, kemoterapi ajanlarının günde bir kez veya iki günde bir düşük dozda (MTD’nin altında) sürekli uygulanması şeklinde tanımlanmıştır. Tedavi süresi çalışmadan çıkarılma kriteri olarak kabul edilmemiştir. Hastalar her muayene edildiğinde tedaviye bağlı yan etkiler (AE’ler) Veteriner Kooperatif Onkoloji Grubu (VCOG) kılavuzlarına göre kaydedilmiştir.25 Tedaviye alınan yanıt değerlendirilirken cRECIST kriterlerine göre tanım yapılmıştır.26 Alınan ek bilgiler arasında hastaların klinik özellikleri, semptomların süresi ve türü, görüntüleme yöntemi, kan nakline ihtiyaç olup olmadığı, metastaz bölgesi, splenektomiden tıbbi tedavinin başlamasına kadar geçen süre ve tedavi toksisitesi, takip amaçlı yapılan evreleme sonuçları (varsa), progresyona kadar geçen süre (TTP), ST ve ölüm nedeni yer almıştır.
2.1 | İstatistiksel analiz
Sürekli veriler D’Agostino ve Pearson normallik testi ile normallik açısından test edilmiştir. Değişkenler normal dağılım durumunda ortalama ± SD olarak, normal olmayan dağılım durumunda ise ortalama ve aralık şeklinde ifade edilmiştir.
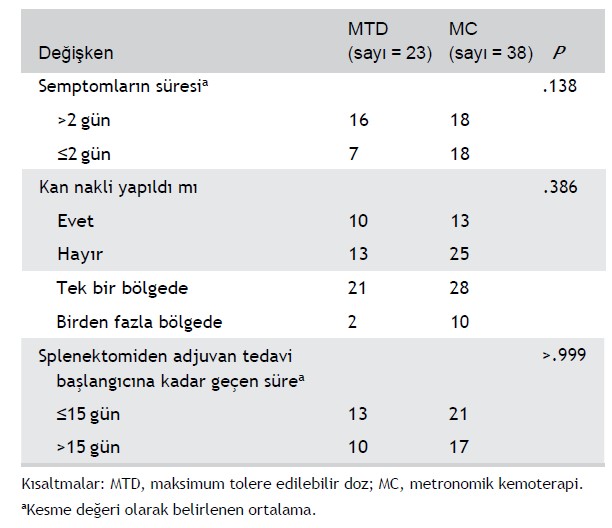
Üç tedavi grubunun özelliklerinin hastaların kabulü sırasında farklılık gösterip göstermediğini değerlendirmek için, semptom süresi (kesme noktası isteğe bağlı olarak ortalama değer olarak belirlenmiştir), kan nakli (evet/hayır) ve metastatik bölge sayısı (tekli veya çoklu) gibi olası sonuç değişkenlerinin gruplar arasındaki dağılımı Fisher’in kesin testi/χ2 testi ile karşılaştırılmıştır. Splenektomiden adjuvan tedaviye başlanmasına kadar geçen süre MTD ve MC grupları arasında Mann-Whitney U testi ile karşılaştırılmıştır. Fisher’in kesin testi/χ2 testi ayrıca tedaviye bağlı yan etki görülen köpeklerin oranını ve 6 aylık sağkalım oranlarını tedavi grupları arasında karşılaştırmak için kullanılmıştır.
TTP, splenektomi ile kaydedilen ilk progresyon tarihi arasındaki MARCONATO ET AL. 3 aralık esas alınarak hesaplanmıştır; veri analizinin kapanışında progresif hastalığı (PD) olmayan veya ölen köpekler sansürlenmiştir. PD, bir veya daha fazla yeni lezyonun ortaya çıkması, hedef lezyonların çaplarının toplamında en az %20 artış ve/veya görüntüleme yöntemleri ile belirlenen mevcut hedef dışı lezyonlarda belirgin ilerleme ve/veya fizik muayenede tespit edilen klinik bulguların (örn. hemoperitoneum) ortaya çıkması şeklinde tanımlanmıştır. Stabil hastalık (SD), hedef lezyonların çaplarının toplamında %30’dan az küçülme veya %20’den az artış ya da görüntüleme yöntemleri ile dokümante edilen bir veya daha fazla hedef dışı lezyonun en az 4 hafta boyunca küçülmesi veya stabil kalması şeklinde tanımlanmıştır.26 ST, splenektomi ile tümöre bağlı ölüm arasındaki süre olarak hesaplanmıştır. Tümörle ilişkili olmayan nedenlerle ölen veya veri analizinin kapanışında hayatta olan köpekler sansürlenmiştir. Sağkalım grafikleri Kaplan-Meier çarpım-limit yöntemine göre hazırlanmış ve log-rank testi ile karşılaştırılmıştır. Sağkalım tahminleri, karşılık gelen %95 güven aralığıyla (CI) birlikte ortalama olarak ifade edilmiştir. Semptom süresi, kan nakli, metastatik bölge sayısı ve tedavi gibi potansiyel prognostik değişkenlerin tümör progresyonu ve tümöre bağlı ölüm üzerindeki etkisi tek değişkenli Cox regresyon analizi ile değerlendirilmiştir. Tek değişkenli analizde P değeri <.1 olan faktörler çok değişkenli Cox orantılı tehlike modeli ile bağımsızlık açısından test edilmiştir.
Analizler ticari amaçlı yazılım programı (SPSS Statistics v19, IBM, Armonk, New York) kullanılarak yapılmıştır; anlamlılık düzeyi 0,05 olarak belirlenmiştir.
3 | SONUÇLAR
3.1 | Köpekler ve tümörlerin özellikleri
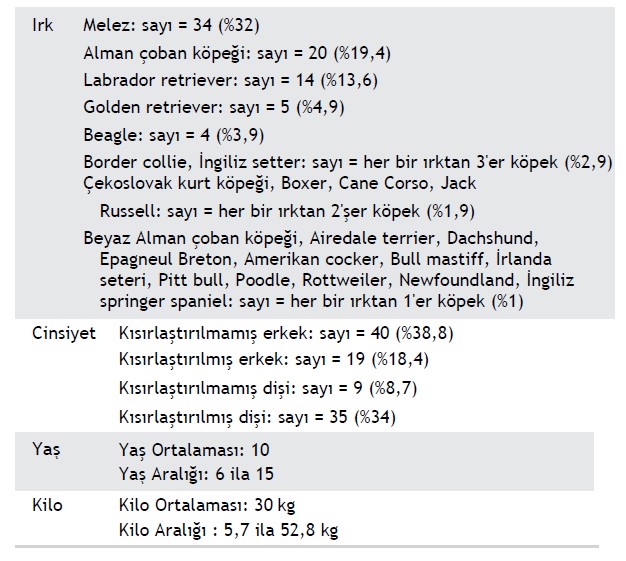
Yüz üç köpek çalışmaya dahil edilmiştir. Bu köpeklerin özellikleri Tablo 1’de özetlenmiştir. Hasta kabulde tüm köpekler semptomatikti. Bildirilen klinik belirti ve semptomlar arasında
TABLO 1 Metastatik dalak hemanjiosarkomu nedeniyle getirilen 103 köpeğin klinik özellikleri
letarji/halsizlik (sayı = 74; %71,8), abdominal distansiyon (sayı = 33; %32), iştah kaybı (sayı = 20; %19,4), kollaps (sayı = 16; %15. 3), mukoz membranlarda solukluk (sayı = 8; %7,8), kusma (sayı = 4; %3,9), polidipsi ve poliüri (sayı = 2; %1,9), ve şunlardan her biri (%0,9): kilo kaybı, hipotermi ve topallık görülmüştür. Splenektomi öncesi klinik belirtilerin ortalama süresi 2 gündü (zaman aralığı: 1-60 gün).
Görüntüleme yöntemleri ile yapılan değerlendirmede, splenektomi sırasında 73 (%70,9) köpeğe toraks radyografisi ve abdominal ultrasonografi çekilmiş, 29 (%28,2) köpeğe TBCT taraması yapılmış ve 1 (%0,9) köpeğe eksploratif laparotomi öncesinde sadece üç görünümlü toraks radyografisi çekilmiştir.
Doksan yedi (%94,2) köpekte ilk kabul esnasında hemoperitoneum vardı ve 35 (%33,9) köpeğe splenektomi sırasında veya sonrasında kan nakli yapıldı.
Elli dört (%52,4) köpeğe biyopsi ve 44 (%42,7) köpeğe şüpheli metastatik lezyonlar için ince iğne aspirasyon sitolojisi uygulanmıştır. Bu tanısal testler neticesinde vakaların tümünde metastatik hastalık olduğu doğrulanmıştır. Pulmoner metastazı olan beş (%4,9) köpekten sitolojik veya histolojik inceleme için örnek alınmamıştır. Köpeklerin tümünde splenektomi sonrasında gros metastatik hastalık kalmıştır.
Genel olarak, 80 (%77,7) köpekte; hepatik (sayı = 59; %73,7), omental (sayı = 13; %16,2), pulmoner (sayı = 5; %6,2), kas (sayı = 1; %1,2), mesane (sayı = 1; %1,2) ve uzak nodal (sayı = 1; %1,2) olmak üzere tek yerleşimli metastaz vardı.
Yirmi üç (%22,3) köpekte; karaciğer ve omentum (sayı = 9; %39,1); karaciğer ve akciğerler (sayı = 3; %13); karaciğer, böbrek, kalp ve akciğerler (sayı = 1; %4,3); karaciğer, akciğerler ve kaslar (sayı = 2; %8,7); karaciğer, akciğerler ve omentum (sayı = 1; %4. 3); karaciğer, omentum ve diyafram (sayı = 1; %4,3); karaciğer ve deri (sayı = 1; %4,3); karaciğer ve adrenal bez (sayı = 1; %4,3); karaciğer ve kalp (sayı = 1; %4,3); karaciğer ve böbrek (sayı = 1; %4,3); akciğerler ve sternal lenf nodu (sayı = 1; %4,3); omentum ve karın duvarı (sayı = 1; %4,3) olmak üzere birden fazla bölgede metastaz vardı.
3.2 | Adjuvan tedaviler
Yirmi üç (%22,3) köpek MTD, 38 (%36,9) köpek MC almış ve 42 (%40,8) köpek ilaçsız tedavi edilmiştir. Tedavi grupları semptom süresi, kan nakli yapılıp yapılmadığı, metastatik bölge sayısı ve splenektomiden adjuvan tedavinin başlamasına kadar geçen süre gibi olası prognostik değişkenler bakımından oldukça dengeliydi (Tablo 2).
MTD alan vakaların 17’si (%73,9) tek ajan olarak doksorubisin, 2’si (%8,7) doksorubisin ve siklofosfamid, 1’i (%4,3) doksorubisin ve dakarbazin ve 3’ü (%13,1) tek ajan olarak epirubisin ile tedavi edilmiştir. Doksorubisin alan köpeklerden 16’sı her 3 haftada bir 30 mg/m2, biri ise 25 mg/m2 dozunda tedavi edilmiştir. Epirubisin her 3 haftada bir 30 mg/m2 dozunda uygulanmıştır. Dakarbazin, doksorubisin uygulamasının yapıldığı gün başlamak üzere 5 gün boyunca günde bir kez 200 mg/m2 dozunda uygulandı. Siklofosfamid, doksorubisin uygulamasının yapıldığı gün başlamak üzere 4 gün boyunca 200 mg/m2 dozunda uygulanmıştır.
TABLO 2 Splenektomi yanı sıra maksimum tolere edilebilir doz kemoterapi veya metronomik kemoterapi ile tedavi edilen metastatik splenik hemanjiosarkomlu 61 köpeğin temel özellikleri.
Splenektomiden MTD başlangıcına kadar geçen ortalama süre 15 gün (zaman aralığı: 5 ila 30 gün) ve uygulanan ortalama tedavi sayısı 4 (değer aralığı: 1 ila 8) idi. Ortalama MTD süresi 88 gündü (zaman aralığı: 21 ila 168 gün). Ayrıca, bu grupta toplamda dört köpek olmak üzere (%17,4) antrasiklin bazlı protokolün sonunda üç köpek talidomid, siklofosfamid ve piroksikam ve bir köpek de siklofosfamidden oluşan MC almıştır. Tedavi sırasında 23 köpeğin 14’üne takip amaçlı görüntüleme yapılmıştır: 12’sinde SD ve 2’sinde PD vardı.
MC uygulanan vakaların 33’ü (%86,8) talidomid, siklofosfamid ve piroksikam ile, 2’si (%5,3) talidomid ve piroksikam ile, 2’si (%5,3) siklofosfamid ve meloksikam ile ve 1’i (%2,6) siklofosfamid ve piroksikam ile tedavi edilmiştir. Siklofosfamid günde bir kez veya iki günde bir 10-15 mg/m2, talidomid günde 2-4 mg/kg, meloksikam ve piroksikam ise standart dozda günlük olarak uygulanmıştır. Splenektomiden MC’ye başlanmasına kadar geçen ortalama süre 15 gündü (zaman aralığı: 1 ila 45 gün). Ortalama MC süresi 35 gündü (zaman aralığı: 5 ila 421 gün). 38 köpekten 12’sine (%31,6) tedavi sırasında bazı takip amaçlı görüntülemeler yapılmıştır: 6’sında SD ve 6’sında PD vardı.
3.3 | Toksisite
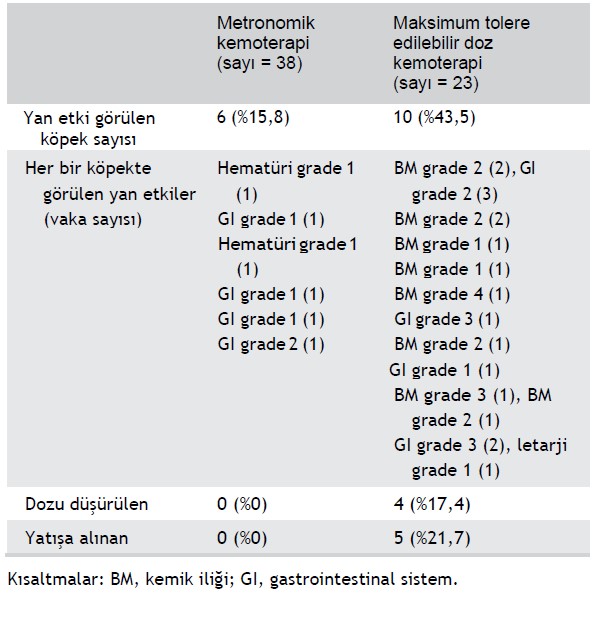
MTD alan köpekler arasında 10’unda (%43,5) yan etki (AE) görülmüştür. Her köpek için kaydedilen AE’lerin tam listesi ve vaka sayısı Tablo 3’te listelenmiştir. Dört köpeğin dozu düşürülmüş ve bu da doz gecikmesine neden olmuştur. Beş köpekte görülen (febril nötropeni ile sayı = 2 ve şiddetli gastrointestinal semptomlarla sayı = 3) AE’lerin semptomatik tedavisi için intravenöz sıvılar, antibiyotikler, anti-emetik ve mide koruyucu ilaçlar verilmiş ve köpekler yatışa alınmıştır.
MC alan köpeklerin 6’sında (%15,8) AE görülmüştür (Tablo 3). Hiçbirinde hastaneye yatış, dozu düşürmek veya tedaviyi kesmek gerekmemiştir.
TABLO 3 Splenektomi yanı sıra metronomik kemoterapi veya maksimum tolere edilebilir doz kemoterapi ile tedavi edilen metastatik splenik hemanjiosarkomlu 61 köpekte görülen yan etkiler
Tedaviye bağlı AE görülen köpek sayısı MTD grubunda istatistiksel olarak anlamlı şekilde daha yüksekti (P = .017). Sadece yatışa almayı gerektiren AE’ler değerlendirildiğinde de fark istatistiksel olarak yine anlamlıydı (P = .005).
3.4 | Bulgular ve prognostik değişkenlerin analizi
Çalışmanın sonunda 101 (%98,1) köpek ölmüştür (100’ü kansere bağlı nedenlerden, 1’i kansere bağlı olmayan nedenlerden) ve 2 (%1,9) köpek 26 ve 81 gün sonra hala hayattaydı. Genel olarak, ortalama TTP ve ST sırasıyla 50 gün (%95 CI, 39-61) ve 55 gün (%95 CI, 43-66) idi.
Adjuvan tıbbi tedavi alan köpeklerin sonuçları, sadece splenektomi ile tedavi edilen köpeklere kıyasla belirgin şekilde daha iyi çıkmıştır (ortalama TTP, 68’e karşılık 28 gün; P < .001; ortalama ST, 80’e karşılık 40 gün; P < .001).
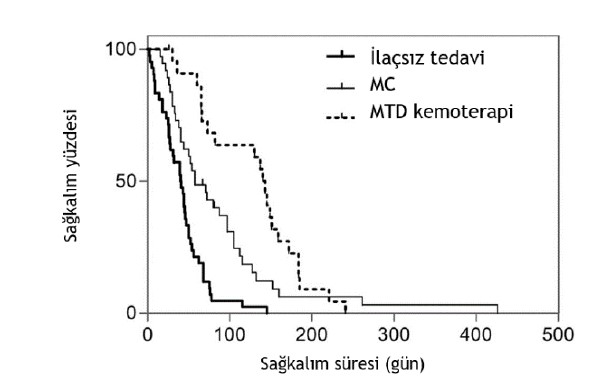
Bireysel tedavi grupları değerlendirildiğinde, MTD ile tedavi edilen köpekler için TTP 134 gün (%95 CI, 73-194) ve MC ile tedavi edilen köpekler için 52 gün (%95 CI, 32-72) sürmüştür. Sağkalım süresi MTD ile tedavi edilen köpekler için 140 gün (%95 CI, 123-157) ve MC ile tedavi edilen köpekler için 58 gün (%95 CI, 33-83) şeklindeydi. MTD ile tedavi edilen köpekler MC ile tedavi edilen köpeklere kıyasla istatistiksel olarak anlamlı derecede daha iyi TTP ve ST’ye sahipti (TTP P = .025; ST P = .023; Şekil 1).
Sadece splenektomi yapılan grupta 6 aylık sağkalım oranı %0 iken adjuvan kemoterapi alan köpeklerde bu oran %12 olmuştur (P = .039). 6 aylık sağkalım oranı MTD (%23) veya MC (%6; P = .09) ile tedavi edilen köpekler arasında anlamlı bir farklılık göstermemiştir.
ŞEKİL 1 Yalnızca splenektomi (kalın çizgi, sayı = 42), splenektomi yanı sıra metronomik kemoterapi (MC, ince çizgi, sayı = 38) ve splenektomi yanı sıra maksimum tolere edilebilir doz kemoterapi (MTD kemoterapi, noktalar; sayı = 23) ile tedavi edilen III. evre hemanjiosarkomlu köpekler için Kaplan-Meier sağkalım grafiği. Sağkalım süresi MTD ile tedavi edilen köpeklerde MC (P = .023) veya yalnızca splenektomi (P < .001) ile tedavi edilen köpeklere kıyasla belirgin şekilde daha uzundu.
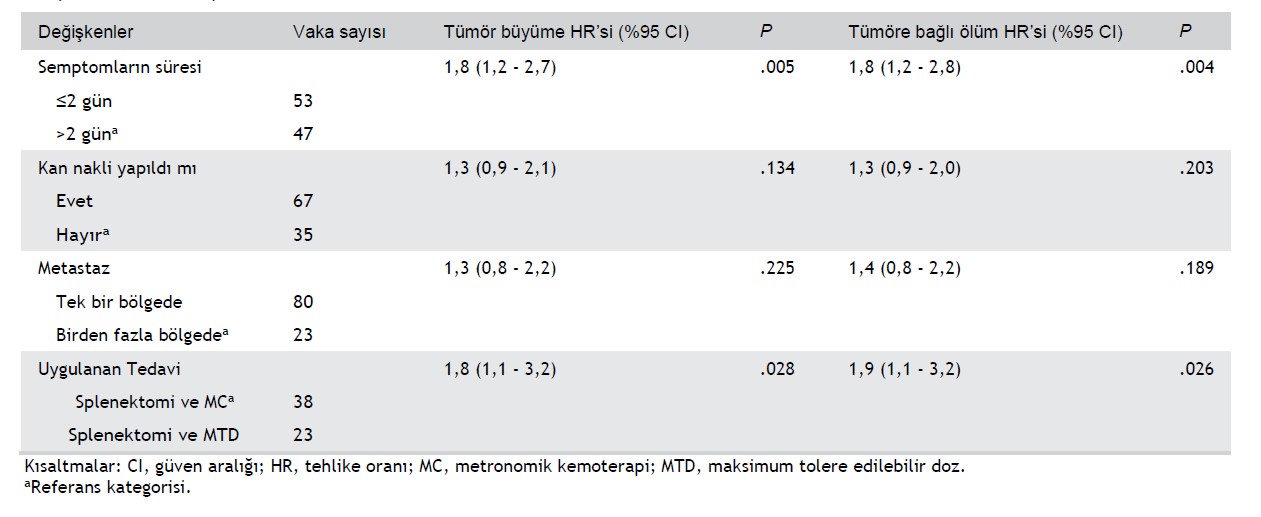
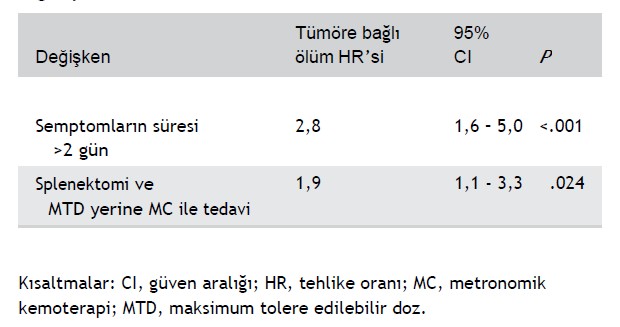
Tedavinin yanı sıra, hem tek değişkenli hem de çok değişkenli sağkalım analizinde tümör progresyonu ve tümöre bağlı ölüm riskinin daha yüksek çıkmasıyla belirgin şekilde bağlantılı olan bir diğer değişken de semptom süresiydi (Tablo 4-6). Taşıdığı tümöre işaret eden ve 2 günden uzun süren klinik belirtileri olan hastalarda ölüm riski istatistiksel olarak anlamlı derecede yüksekti (tehlike oranı [HR] = 1.8; %95 CI = 1.2-2.8; P = .004; Tablo 4).
4 | TARTIŞMA
Geçtiğimiz on yıl boyunca, köpek dalak hemanjiosarkomunun ölümcüllüğünün üstesinden gelmek için büyük çaba sarf edilmiştir.10-16,27-29 Ancak, doksorubisin bazlı protokollerin etkinliği artık durma noktasına gelmiş gibi görünmektedir; hemanjiosarkom teşhisi konulan köpeklerin %10’undan birkaçı teşhisten 1 yıl sonra
hayatta kalmaktadır.1 Klinik araştırmaları daha da kötüleştiren şey, hemanjiosarkom başka bölgelere yayıldıktan sonra tedavi edilemez olarak görülmesi ve adjuvan tedavilerin etkisinin belirsiz olmasıdır.7,9-16 Bu nedenle, adjuvan kemoterapiden fayda görebilecek köpek popülasyonunu belirlemek oldukça zordur.
Bu çalışmada elde edilen sonuçlara göre, MTD, MC’ye kıyasla daha fazla etkili olmuştur. MTD ile tedavi edilen köpeklerde, MC ile tedavi edilenlere (58 gün) kıyasla ortalama ST 140 gün olmuştur. Bu çalışmada elde edilen veriler, MTD’den sonra ortalama ST’nin 62 ila 195 gün arasında değiştiği bildirilen ve daha önce yayınlanan verilerle uyumludur. 9-16
Bununla birlikte, 6. ayda hayatta olan köpeklerin oranı göz önüne alındığında, vaka sayısının az olması bu analizi etkilemiş olsa da, MTD ve MC grupları arasında önemli bir fark yoktu.
MC’nin II. evre hemanjiosarkomlu (HSA) köpekler için alternatif bir tedavi olabileceği ve geleneksel MTD ile karşılaştırılabilir sonuçlar verebileceği önceki çalışmalarda ortaya konmuştur24 ve böylece “ne kadar yüksek, o kadar iyi” paradigmasına “ne kadar sık, o kadar iyi” paradigmasıyla meydan okunmuştur. MC aslında ilaçların, zaman içerisinde, asgari olarak ve aynı miktarda, hatta genellikle daha fazla miktarda verilmesi için tasarlanmıştır.30,31 Mevcut çalışmada MC tedavisi sağkalım bakımından fayda sağlamamıştır. Bunun nedeni, III. evre hemanjiosarkomun son derece ölümcül olması ve genellikle ilaçların etkili olabilmesi için yeterli zaman tanımaması olabilir.9,29 III. evre hemanjiosarkom vakalarında, tümör büyüme hızı nedeniyle antitümör tepkinin yeterli şekilde belgelenemeyeceği düşünülebilir. Bu olasılık doğru ise, MC’nin dalak hemanjiosarkomunun tüm evrelerinde fayda sağlamadığı söylenebilir.
MTD uzun süreli sağkalım ile ilişkilendirilmiştir. Ancak bu artan uzun süreli sağkalım oranı ve prognoz hala hayal kırıklığı yaratmaya devam etmektedir. MTD’nin genellikle ileri derece solid kanserli köpeklerde, muhtemelen çok hızlı şekilde gelişen direnç nedeniyle,
TABLO 4 Metastatik dalak hemanjiosarkomlu 103 köpekte tümör büyümesi ve tümöre bağlı ölüm riskinde artış ile bağlantılı olabilecek değişkenlerin tek değişkenli Cox regresyon analizi
TABLO 5 Maksimum tolere edilebilir doz kemoterapisi veya metronomik kemoterapi ile tedavi edilen metastatik dalak hemanjiosarkomlu 61 köpekte tümör büyümesi riskinde artış ile bağlantılı olabilecek değişkenlerin çok değişkenli Cox regresyon analizi
TABLO 6 Maksimum tolere edilebilir doz kemoterapi veya metronomik kemoterapi ile tedavi edilen metastatik dalak hemanjiosarkomlu 61 köpekte tümöre bağlı ölüm riskinde artış ve bununla bağlantılı olabilecek değişkenlerin çok değişkenli Cox regresyon analizi
sadece palyasyon sağlaması beklenir32, ancak bu çalışmada MTD sağkalım süresini önemli ölçüde uzatmıştır ve bu önemli bir veridir.
MTD ile tedavi edilen köpeklerin genel sağkalımında artış görülse de MC ile karşılaştırıldığında tedaviye bağlı toksisite insidansı belirgin şekilde yüksek çıkmıştır. Bu nedenle köpekler genellikle yatışa alınmış ve tedavide bazı değişiklikler yapılması da dahil olmak üzere destek amaçlı ek tedavi gerektirmiştir.
Mevcut köpek grubunda, MTD ve MC alan hastalar arasındaki sonuç farkı neredeyse 3 aya ulaşmıştır. Belirlenen hasta popülasyonlarında sağkalımın iyileştirilmesine büyük ilgi duyan onkologlar olarak, bu durum kayda değer bir iyileşmeye işaret ediyor gibi durmaktadır. Fakat bu retrospektif çalışmada yaşam kalitesine ilişkin doğrulanmış ölçütlerin bulunmadığını kabul eden yazarlar, okuyucuları bu fazladan 82 günün değerini düşünmeye davet etmektedir. Gruplar arasındaki yan etki insidansı belirgin şekilde farklıydı. Sağkalım olasılığındaki bu artışın, artan yan etki riskinin olumsuz etkisini yeterli ölçüde aşıp aşmadığına klinisyen ve hasta sahibi karar verecektir. Bu makalede sunulan veriler ışığında bu kararın en azından daha iyi kanıtlara dayanarak alınabileceği umulmaktadır.
Cox’un orantılı tehlikeler modeli, MC’ye kıyasla MTD kullanımı ve altta yatan hastalığa işaret eden klinik bulguların varlığı olmak üzere prognostik olarak anlamlı görünen iki ortak değişken tespit etmiştir. Splenektomi öncesinde klinik bulguların daha uzun süre görülmesi prognostik açıdan olumlu bulunmuştur. Bu durum beklentilerin aksine gerçekleşmiştir. Bu bağlamda, sonucun en önemli belirleyicisinin kanamanın şiddeti olacağı düşünülmüştü. Şiddetli kanamanın perakut öyküsü olur. Daha hafif seri kanamaların ise daha kronik bir öyküsü vardır. Bu gözlem ışığında yazarlar, sonuç üzerindeki en önemli biyolojik belirleyicinin uzun süredir devam eden hastalığa eşlik eden patofizyolojik değişim olduğunu öne sürmektedir. Çalışma kohortu bağlamında, bu kronikleşme süreci beraberinde ilerlemiş metastazı da getirmektedir.
Kanser literatüründe klasik olarak hastalık derecesi, basit bir klinik evre ifadesiyle kaydedilmektedir ve bu ifade metastaz derecesi için herhangi bir açıklama barındırmamaktadır, ancak kayda değer varyasyonların mevcut olduğu bilinmektedir. Metastatik ve metastatik olmayan kanserler bağlamında bu farklılık önemsiz görünebilir, ancak yalnızca 3. evre dalak hemanjiosarkomu vakaları bağlamında bu değişken daha büyük önem kazanabilir. III. evre hemanjiosarkom vakalarının prospektif analiziyle metastatik yükteki ölçülebilir farklılıklar daha doğru bir şekilde kaydedilebilir. Böyle bir vaka serisinin incelenmesi, farklı metastatik hastalık yüküne sahip hastaların MTD ve MC için uygunluğundaki gerçek farklılıkları ortaya çıkarabilir.
Bu çalışmanın, özellikle retrospektif yapısı nedeniyle bazı kısıtlamaları bulunmaktadır. Yaşam kalitesine ilişkin bilgiler tıbbi kayıtlardan doğru bir şekilde toplanamamıştır, bu nedenle sadece belirgin yan etkiler rapor edilmiştir.
Ayrıca, her iki grupta da tıbbi tedavi protokollerine ilişkin bazı heterojenlikler söz konusudur. MC grubundaki köpeklerin çoğunluğu piroksikam, talidomid ve siklofosfamid kombinasyonu almış olsa da, 5 (%13,2) köpek sadece iki ilaç almıştır. Benzer şekilde, MTD grubundaki köpeklerin çoğunluğu tek ajan olarak doksorubisin alırken, küçük bir grup alkilleyici ajan veya epirubisin ile kombine doksorubisin almıştır. Bu gruptaki dört köpek de yüksek doz protokolü tamamlandıktan sonra MC almıştır.
Son olarak, takip amaçlı yapılan görüntülemeler düzenli şekilde yapılmamış, bu da TTP’nin değerlendirilmesini zorlaştırmıştır. MTD kemoterapisi alan köpeklerin daha uzun süre hayatta kalmaları ve muhtemelen sahiplerinin tedaviye uyum göstermesi nedeniyle takip görüntülemesi yaptırma olasılığı daha yüksekti. Bunun aksine, ilaçla tedavi edilmeyen köpekler ve MC alanların yaklaşık üçte ikisi düzenli takip görüntülemesi yaptırmamıştır; MC’nin asgari düzeyde takip imkanı sağlayarak tedavinin uygulanmasını kolaylaştırdığını, böylece hastane ziyareti ihtiyacını ve sonuç olarak takip amaçlı görüntüleme yapma şansını azalttığını göz önünde bulundurduğumuzda bu durum şaşırtıcı gelmemektedir.
Hastaların hiçbirinde post mortem inceleme yapılmadığından ölüm nedeni sadece tahmini olarak belirlenebilmiştir; ancak yazarlar, ileri klinik evre ve metastatik HSA vakalarında sıklıkla görülen hızlı klinik progresyon göz önüne alındığında, bu vakalarda ölümün büyük olasılıkla tümör progresyonu/tümörle ilişkili nedenlerden kaynaklandığına inanmaktadır.
Bunlara ek olarak, örneklem büyüklüğünün nispeten küçük olması tip II hataya yol açmış olabilir.
Bununla birlikte, yapılan çalışmanın yeni sayılabilecek özelliği, bu köpek popülasyonuna uygulanan adjuvant tedaviye duyulan mevcut kuşkuları gidermeye çalışmasıdır. Mevcut çalışmanın bulgularının klinik karar verme sürecine önemli değerler katacağına inanıyoruz.
Sonuç olarak, MTD’nin faydaları sınırlı olmakla birlikte görülen yan etkiler de dikkate alındığında, bu tedavinin tavsiye edilip edilemeyeceği sorusu gündeme gelmektedir. Yazarların görüşüne göre, ileri evre kanserli köpekler için etkili olabilecek tedaviler artık mümkün olmadığında, tedavinin odak noktası yaşam süresini uzatmaktan, gereksiz toksik etkilerden kaçınarak yaşam kalitesini korumaya geçmelidir.
TEŞEKKÜRLER
Vakaların toplanmasına katkıda bulunan tüm klinisyenlere ve vakaları yönlendiren veteriner hekimlere teşekkür ederiz.
ÇIKAR ÇATIŞMASI BEYANI
Bu makalenin yazarlarından hiçbiri, makalenin içeriğini uygunsuz bir şekilde etkileyecek veya önyargılı davranabilecek diğer kişi veya kuruluşlarla maddi veya kişisel anlamda herhangi bir ilişkisi bulunmamaktadır.
ORCID
Laura Marconato https://orcid.org/0000-0002-7843-615X Damiano Stefanello https://orcid.org/0000-0003-2726-0366 Silvia Sabattini https://orcid.org/0000-0001-7005-2736
KAYNAKÇA
- Thamm DH. Hemangiosarcoma. In: Withrow SJ, Vali DM, eds. With- row & MacEwen’s Small Animal Clinical Oncology. 5th St Louis, MO: Saunders Elsevier; 2013:679-688.
- Lamerato-Kozicki AR, Helm KM, Jubala CM, Cutter GC, Modiano Canine hemangiosarcoma originates from hematopoietic precursors with potential for endothelial differentiation. Exp Hematol. 2006;34: 870-878.
- Brown NO, Patnaik AK, MacEwen Canine hemangiosarcoma: ret- rospective analysis of 104 cases. J Am Vet Med Assoc. 1985;186: 56-58.
- Hammond TN, Pesillo-Crosby Prevalence of hemangiosarcoma in anemic dogs with a splenic mass and hemoperitoneum requiring a transfusion: 71 cases (2003-2005). J Am Vet Med Assoc. 2008;232: 553-558.
- Schultheiss A retrospective study of visceral and nonvisceral hem- angiosarcoma and hemangiomas in domestic animals. J Vet Diagn Invest. 2004;16:522-526.
- Pintar J, Breitschwerdt EB, Hardie EM, Spaulding KA. Acute nontraumatic hemoabdomen in the dog: a retrospective analysis of 39 cases (1987-2001). J Am Anim Hosp Assoc. 2003;39: 518-522.
- Johnson KA, Powers BE, Withrow SJ, Sheetz MJ, Curtis CR, Wrigley Splenectomy in dogs. Predictors of neoplasia and survival after splenectomy. J Vet Intern Med. 1989;3:160-166.
- Waters DJ, Hayden DW, Walter PA. Intracranial lesions in dogs with hemangiosarcoma. J Vet Intern Med. 1989;3:222-230.
- Wendelburg KM, Price LL, Burgess KE, Lyons JA, Lew FH, Berg Sur- vival time of dogs with splenic hemangiosarcoma treated by splenec- tomy with or without adjuvant chemotherapy: 208 cases (2001-2012). J Am Vet Med Assoc. 2015;247:393-403.
- Kim SE, Liptac JM, Gall TT, Monteith GJ, Woods Epirubicin in the adjuvant treatment of splenic hemangiosarcoma in dogs: 59 cases (1997-2004). J Am Vet Med Assoc. 2007;231:1550-1557.
- Sorenmo KU, Baez JL, Clifford CA, et al. Efficacy and toxicity of a dose-intensified doxorubicin protocol in canine hemangiosarcoma. J Vet Intern Med. 2004;18:209-223.
- Matsuyama A, Poirier VJ, Mantovani F, Foster RA, Mutsaers Adju- vant doxorubicin with or without metronomic cyclophosphamide for canine splenic Hemangiosarcoma. J Am Anim Hosp Assoc. 2017;53: 304-312.
- Sorenmo K, Samluk M, Clifford C, et Clinical and pharmacokinetic characteristics of intracavitary administration of pegylated liposomal encapsulated doxorubicin in dogs with splenic hemangiosarcoma. J Vet Intern Med. 2007;21:1347-1354.
- Finotello R, Stefanello D, Zini E, Marconato Comparison of doxoru- bicin with doxorubicin-dacarbazine for the adjuvant treatment of canine hemangiosarcoma. Vet Comp Oncol. 2017;15:25-35.
- Hammer AS, Couto CG, Filppi J, Getzy D, Shank Efficacy and toxic- ity of VAC chemotherapy (vincristine, doxorubicine, and cyclophos- phamide) in dogs with hemangiosarcoma. J Vet Intern Med. 1991;5: 160-166.
- Alvarez FJ, Hosoya K, Lara-Garcia A, Kisseberth W, Couto G. VAC protocol for treatment of dogs with stage III J Am Anim Hosp Assoc. 2013;49:370-377.
- Leach TN, Childress MO, Greene SN, et Prospective trial of metro- nomic chlorambucil chemotherapy in dogs with naturally occurring cancer. Vet Comp Oncol. 2011;10:102-112.
- Schrempp DR, Childress MO, Stewart JC, et Metronomic adminis- tration of chlorambucil for treatment of digs with urinary bladder transitional call carcinoma. J Am Vet Med Assoc. 2013;242:1534- 1538.
- Elmslie RE, Glawe P, Dow SW. Metronomic therapy with cyclophos- phamide and Piroxicam effectively delays tumor recurrence in dogs with incompletely resected soft tissue sarcomas. J Vet Intern Med. 2008;22:1373-1379.
- Tripp CD, Fidel J, Anderson CL, et al. Tolerability of metronomic administration of Lomustine in dogs with cancer. J Vet Intern Med. 2011;25:278-284.
- Maiti Metronomic chemotherapy. J Pharmacol Pharmacother. 2014; 5:186-192.
- Madondo M, Quinn M, Plebanski M. Low dose cyclophospha- mide: mechanisms of T cell Cancer Treat Rev. 2017; 42:3-9.
- Gaspar TB, Henriques J, Marconato L, Queiroga FL. The use of low- dose metronomic chemotherapy in dogs-insight into a modern cancer Vet Comp Oncol. 2018;16:2-11.
- Lana S, U’ren L, Plaza S, et Continuous low-dose oral chemother- apy for adjuvant therapy of splenic hemangiosarcoma in dogs. J Vet Intern Med. 2007;21:764-769.
- Veterinary Co-operative Oncology Group. Veterinary co-operative oncology group-common terminology criteria for adverse events (VCOG-CTCAE) following chemotherapy for biological antineoplastic therapy in dogs and Vet Comp Oncol. 2004;2:195-231.
- Nguyen SM, Thamm DH, Vail DM, London CA. Response evaluation criteria for solid tumours in dogs (v1.0): a Veterinary Cooperative Oncology Group (VCOG) consensus document. Vet Comp Oncol. 2013;13:176-183.
- Finotello R, Henriques J, Sabattini S, et A retrospective analysis of chemotherapy switch suggests improved outcome in surgically removed, biologically aggressive canine hemangiosarcoma. Vet Comp Oncol. 2017;15:493-503.
- Alexander CK, Cronin KL, Silver M, Gardner HL, London C. The addition of metronomic chemotherapy does not improve outcome for canine splenic hemangiosarcoma. J Small Anim Pract. 2018;60: 32-37.
- Bray JP, Orbell G, Cave N, Munday JS. Does thalidomide prolong sur- vival in dogs with splenic haemangiosarcoma? J Small Anim Pract. 2018;59:85-91.
- Piccart-Gebhart MJ. Mathematics and oncology: a match for life?
J Clin Oncol. 2003;21:1425-1428. - Kerbek RS, Kamen BA. The anti-angiogenic basis of metronomic che- motherapy. Nat Rev Cancer. 2004;4:426-436.
- Bertolini F, Paul S, Mancuso P, et al. Maximum tolerable dose and
low-dose metronomic chemotherapy have opposite effects on the mobilization and viability of circulating endothelial progenitor cells. Cancer Res. 2003;63:4342-4346.